LAPORAN MINGGUAN
PRAKTIKUM KIMIA DASAR
TERMOKIMIA
Oleh :
Nama : Kezia Christianty Charismata
NRP : 123020158
Kelompok : F
Meja : 07 (Tujuh)
Tanggal Percobaan : 27 Desember 2012
Asisten : Happinessa Brilliant Husni
LABORATORIUM KIMIA DASAR JURUSAN TEKNOLOGI PANGAN
FAKULTAS TEKNIK UNIVERSITAS PASUNDAN
TERMOKIMIA
Kezia Christianty Charismata 123020158
Assisten : Happinessa Brilliant Husni
Tujuan percobaan: Untuk mempelajari bahwa
1. Setiap reaksi kimia selalu disertai dengan perubahan kimia
2. Perubahan kalor dapat diukur atau dipelajari dengan percobaan yang sederhana
3. Reaksi kimia dapat berlangsung secara eksoterm dan endoterm
Prinsip percobaan: Hukum Black yang berbunyi “kalor yang diserap akan sama dengan kalor yang dilepas”
Hukum Lavoiser yang berbunyi “setiap reaksi massa zat sebelum dan sesudah reaksi adalah sama”
Metode percobaan :
1. Metode Penentuan Penetralan HCl dengan NaOH
2. Metode Penentuan Penetapan Kalorimeter
Ukur suhu selama 4 menit selang waktu ½ menit.
Ukur suhu selama 4 menit selang waktu ½ menit.
Ukur suhu selama 5 menit selang waktu ½ menit.
3. Metode Penentuan Kalor Zn + CuSO4
Timbang serbuk Zn sebanyak 2 gr
4. Metode Penentuan Kalor Etanol dalam air
Catat suhu dengan (Td) suhu dingin.
Ukur
suhunya (Tc) selama 10 menit selang 1 menit. Ukur
suhunya dengan suhu (Tp). 20 ml
Hasil Pengamatan :
1. Penetapan Kalorimeter Masukkan CuSO4, ukur suhunya (Td) suhu awal selama 2 menit selang ½ menit.
Campurkan Zn lalu ukur suhunya selama 2 menit selang ½ menit.
Masukkan 18 ml aquades , catat suhunya dengan (Taq).
Masukkan 29 ml etanol dan ukur suhu dengan (Tetanol).
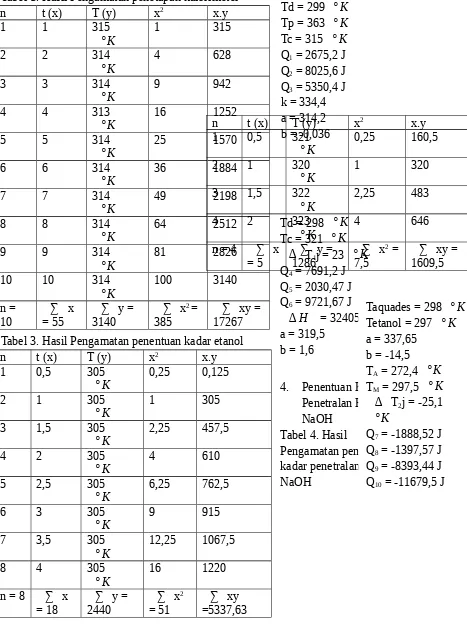
Tabel 1. Hasil Pengamatan penetapan kalorimeter
2. Penentuan Kalor Zn + CuSO4
Tabel 2. Hasil
Pengamatan penentuan kalor Zn + CuSO4
3. Penentuan Kalor Etanol dalam air Tabel 3. Hasil Pengamatan penentuan kadar etanol
4. Penentuan Kadar Penetralan HCl + NaOH
Tabel 4. Hasil
Pembahasan :
Pada praktikum termokimia pada penetapan kalorimter didapatkan Td= 299 penafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan dan pembentukan larutan (Keenan, 1986).
dihasilkan dari posisi atau komposisi materi). Energi kinetik berhubungan dengan gerak molekul acak yang kadang disebut energi termal (Petrucci, 2011).
energi kinetik=1
2x m(kg)x[u
(
ms
)
] 2m s (¿¿−2) m(kg)x a¿x d(m) kerja=gaya x jarak=¿
Kalor adalah energi yang ditransfer antara sistem dan sekelilingnya sebagai akibat perbedaan suhu antara keduanya. Dalam beberapa kasus, kalor dapat ditransfer pada suhu konstan, seperti pada perubahan wujud materi dalam suatu sistem. Kuantitas kalor adalah hasil kali kapasitas kalor sistem dan perubahan suhu. Selanjutnya kapasitas kalor adalah hasil kali massa dan kalor spesifik, yaitu banyaknya kalor yang diperlukan untuk mengubah suhu satu gram zat sebanyak satu derajat celcius. Menurut sejarah , satuan untuk mengukur kalor adalah kalori (kal), tetapi satuan SI untuk kalor adalah joule, sama seperti bentuk energi lain. Transfer energi antara sistem dan sekelilingnya harus sesuai dengan hukum kekekalan energi yang berarti bahwa semua kalor yang hilang dari suatu sistem diambil oleh sekelilingnya (Petrucci dkk, 2011).
1kal=4,184J 4,18
g℃=4,18J g
−1℃−1
Qsistem+Qsekeliling=0 Qsistem=−Qsekeliling
Pada reaksi kimia, perubahan energi kimia yang berkait dengan reaktan dan produknya dapat muncul sebagai kalor. Kalor reaksi adalah kuantitas kalor yang dipertukarkan antara sistem dan sekelilingnya, jika reaksi terjadi pada suhu konstan. Pada reaksi eksotermik, kalor dibebaskan oleh sistem, pada reaksi endotermik sistem menyerap kalor. Kalor reaksi ditemukan dalam kalorimeter, yaitu alat untuk mengukur kuantitas kalor (Petrucci dkk, 2011).
suatu unsur atau senyawaan dibakar, biasanya dalam oksigen, dan energi atau kalor yang dibebaskan dalam reaksi itu diukur. Kalometri reaksi merujuk pada penentuan kalor reaksi apa saja selain rekasi pembakaran. Metode terakhir ini lebih umum dingunakan dengan senyawaan anorganik dan larutan-larutannya. Seperti diterapkan untuk senyawaan organik, kalorimetri pembakaran mencakup pemutusan lengkap kerangka karbon, bila senyawaan itu terbakar dalam oksigen. Metode pembakaran mempunyai penerapan yang meluas dengan senyawaan organik yang kurang reaktif terhadap reagensia selain oksigen, atau yang menghasilkan lebih dari satu produk organik dengan reagensia lain. Kalorimetri reaksi dapat dingunakan dengan senyawaan yang mudah bereaksi dengan cukup cepat pada temperatur sedang tanpa pembentukan produk samping yang tak diinginkan (Keenan, 1986).
Bila perubahan panas yang dikaitkan dengan suatu reaksi kimia dinyatakan dengan suatu reaksi, pernyataan lengkapnya dirujuk sebagai, persamaan termokimia. Perubahan kalor dalam suatu reaksi kimia disebut perubahan entalpi, ∆ H . Secara lebih cermat, istilah perubahan entalpi merujuk ke perubahan kalor selama suatu proses yang dilakukan pada suatu tekanan konstan. Jika energi itu harus dikhususkan secara cermat, kondisi awal dan akhir dari tekanan dan temperatur haruslah diketahui (Keenan,1986).
Kesimpulan :
Dari percobaan termokimia pada penetapan kalorimter didapatkan Td= 299 ° K , Tp = 363 ° K , Tc = 315 ° K , Q1 = 2675,2 J , Q2 = 8025,6 J , Q3 = 5350,4 J, k= 334,4 , a = 314,2 , b = -0,036. Pada penentuan kalor Zn + CuSO4 didapatkan Td = 298 ° K , Tc = 321 ° K , ∆ Tij = 23 ° K , Q4 = 7691,2 J , Q5 = 2030,47 J,Q6 = 9721,67 J , ∆ H = 324055,6 J , a = 319,5 , b = 1,6. Pada penentuan kadar etanol dalam air didapatkan Taquades = 298 ° K , Tetanol = 297 ° K , TA = 272,4 ° K TM = 297,5 ° K , a = 337,65 , b = -14,5 , ∆ T2j = -25,1 J, Q7 = -1888,52 J, Q8 = -1397,57 J, Q9 = -8393,44 J, Q10 = -11679,5 J, ∆ H = -18538,89 J . Pada penentuan kadar penetralan HCl + NaOH didapatkan THCl = 298 ° K , TNaOH = 297 ° K , TA= 260,32 ° K , TM = 297,5 ° K , a = 75,35 , b = 33,63 , ∆ T3j = -37,18 ° K , Q11 = -5889,31 J, Q12 = -12432,99 J, Q13 = -18322,3 J , ∆ H = -53889,11 J.
Harwood, Herring, Madura, Petrucci, 2011, Kimia Dasar Prinsip – Prinsip dan Aplikasi Modern, Jakarta, Erlangga.
Keenan, Kleinfelter, Wood, 1986, Kimia Untuk Universitas, Jakarta, Erlangga.
LAMPIRAN
Penetapan Kalorimeter
Tabel 1. Hasil Pengamatan penetapan kalorimeter
Y6 = a + bx6
Penentuan Kalor Zn + CuSO4
Tabel 2. Hasil Pengamatan penentuan kalor Zn + CuSO4
Penentuan Kalor Etanol dalam air
Tabel 3. Hasil Pengamatan penentuan kadar etanol
Y1-8 = a + bx1
Penentuan Kadar Penetralan HCl + NaOH
1 2 3 4 5 6 7 8 9 10 300
305 310 315 320
T (y)
1 2 3 4 5 6 7 8
200 220 240 260 280 300 320
T (suhu) Column1
1 2 3 4
320 321 322 323 324 325 326
1 2 3 4 5 6 7 8 9 10 300
310 320 330 340 350