LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. INFAR ARISPHARMA
MEDAN
Disusun Oleh:
Dewi Susanti, S.Farm
093202014
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. INFAR ARISPHARMA
MEDAN
Laporan ini disusun untuk melengkapi salah syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun Oleh:
Dewi Susanti, S.Farm 093202014
PT. Infar Arispharma Medan
Pembimbing,
Sakro Mega Maruhawa, S.Si, Apt QC Manager
Fakultas Farmasi
Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kami panjatkan atas kehadirat Allah SWT yang telah
melimpahkan rahmat dan karunia-Nya, sehingga dapat menyelesaikan Praktek
Kerja Profesi Apoteker di PT. Infar Arispharma Medan dalam penyusunan
laporan ini.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada :
1. Bapak H. Azwir Aziz selaku Direktur Utama PT. Infar Arispharma Medan
yang teleh berkenan memberikan fasilitas dan kesempatan kepada kami
dalam melaksakan Praktek Kerja Profesi (PKP)
2. Ibu Dra. Hj. Nihaya Anum, Apt., selaku Manager Produksi PT. Infar
Arispharma yang telah memberikan fasilitas, dan memberi pengarahan
selama melaksanakan Praktek Kerja Profesi (PKP)
3. Ibu Sakro Mega Maruhawa, S.Si, Apt., selaku Manager Quality Control
(QC)
yang telah memberikan fasilitas, membimbing dan memberi pengarahan
selama melaksanakan Praktek Kerja Profesi (PKP)
4. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara
5. Bapak Drs. Wiryanto, M.S.,Apt., selaku Koordinator Program Studi
Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara
6. Seluruh karyawan dan karyawati PT. Infar Arispharma Medan yang telah
7. Kedua orang tua dan keluarga saya yang selalu memotivasi dan
mendoakan saya agar dapat menyelesaikan Praktek Kerja Profesi beserta
laporannya dengan baik.
8. Rekan-rekan mahasiswa apoteker angkatan 2009 dan semua pihak yang
telah memberikan dukungan dalam menyelesaikan laporan Praktek Kerja
Profesi (PKP) ini.
Semoga laporan Praktek Kerja Profesi (PKP) ini bermanfaat bagi
perkembangan ilmu pengetahuan khususnya d.i bidang farmasi.
Medan, Juli 2010
Penulis
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
RINGKASAN ... xi
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Tujuan ... 2
1.3Manfaat ... 2
1.4Tempat dan Waktu ... 2
BAB II TINJAUAN UMUM INDUSTRI FARMASI ... 3
2.1 Perusahaan PT. Infar Arispharma ... 3
2.1.1 Sejarah ... 3
2.1.3 Letak dan Lokasi Bangunan Pabrik ... 4
2.1.4 Struktur Organisasi ... 5
2.1.5 Personalia ... 6
2.1.6 Bidang Usaha ... 6
2.1.7 Jenis Produk ... 6
Halaman 2.2 CPOB ... 7
2.2.1 Dasar Hukum ... 7
2.2.2.Tujuan CPOB ... 8
2.2.3 Landasan Umum ... 8
2.3 Aspek-Aspek yang Harus Diperhatikan dalam CPOB ... 8
2.3.1 Personalia ... 8
2.3.2 Bangunan ... 10
2.3.3 Peralatan ... 12
2.3.4. Sanitasi dan Higiene ... 13
2.3.4.1 Personalia ... 13
2.3.4.2 Bangunan ... 13
2.3.5. Produksi ... 15
2.3.5.1 Bahan Awal ... 15
2.3.5.2 Validasi Proses ... 16
2.3.5.3 Pencemaran ... 16
2.3.5.4 Sistem Penomoran Bets dan Lot ... 16
2.3.5.5 Penimbangan dan Penyerahan ... 17
2.3.5.6 Pengolahan ... 17
2.3.5.7 Pengawasan Selama Proses ... 19
2.3.5.8 Pengemasan ... 20
2.3.5.9 Penyimpanan Bahan Awal, Produk Antara, Produk Ruahan, dan Obat Jadi ... 21
Halaman 2.3.6. Pengawasan Mutu ... 22
2.3.7 Pemastian Mutu ... 24
2.3.8 Inspeksi Diri ... 25
2.3.9 Penangganan Keluhan, Penarikan Obat dan Obat Kembalian ... 26
2.3.11 Kualifikasi dan Validasi ... 29
2.3.12 Analisis Kontrak ... 33
BAB III KEGIATAN DI INDUSTRI FARMASI ... 34
3.1 Keterlibatan Dalam Produksi ... 34
3.2 Tinjauan ke Bagian-bagian Lain ... 34
3.2.1 Sistem Pengolahan Udara ... 34
3.2.2 Sistem Pengolahan Air ... 34
3.2.3 Produksi ... 35
3.2.4 Alur Proses Bahan Awal Sampai Bahan Jadi ... 38
3.2.5 Pengolahan Limbah ... 49
BAB IV PEMBAHASAN ... 51
BAB V KESIMPULAN DAN SARAN ... 55
5.1 Kesimpulan ... 55
5.2 Saran ... 55
DAFTAR PUSTAKA ... 55
DAFTAR GAMBAR
Halaman
Gambar 1. Alur Karyawan Masuk ke Ruang Produksi ... 37
Gambar 2. Alur Proses Bahan Awal Sampai Dengan Obat Jadi ... 38
Gambar 3. Alur Proses Pengolahan Sediaan Cairan Obat Dalam ... 41
Gambar 4. Alur Proses Pengolahan Salep ... 43
DAFTAR TABEL
Halaman
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Struktur Organisasi PT. Infar Arispharma Medan ... 57
Lampiran 2. Denah Alur Air Produksi PT. Infar Arispharma ... 58
Lampiran 3. Label Bahan Baku PT. Infar Arispharma ... 59
Lampiran 4. Label Produk PT. Infar Arispharma …... 60
Lampiran 5. Kartu Persediaan Bahan Baku PT. Infar Arispharma ... 61
Lampiran 6. Prosedur Tetap IPC ... 62
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Infar
Arispharma Medan yang merupakan salah satu program dalam pendidikan profesi
apoteker, bertujuan agar mahasiswa atau mahasiswi mengetahui dan memahami
tugas dan fungsi apoteker dalam industri farmasi, sehingga diharapkan dapat
menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa
juga diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas,
memahami penerapan CPOB di PT. Infar Arispharma Medan, serta mengetahui
gambaran tentang situasi dan kondisi kerja di PT. Infar Arispharma Medan.
Praktek Kerja Profesi di Industri Farmasi PT. Infar Arispharma Medan
dilaksanakan pada tanggal 18-29 Mei 2010. Kegiatan yang dilakukan selama
Praktek Kerja Profesi (PKP) di Industri Farmasi antara lain membuat catatan
kegiatan harian yang berisi absensi dan materi kegiatan yang ditandatangani oleh
pembimbing, melihat kegiatan diruang produksi, laboratorium Quality Control
(QC), gudang bahan baku, gudang bahan pengemas, gudang obat jadi, sistem
pengaturan udara dan sistem pengolahan limbah.
Industri Farmasi PT. Infar Arispharma Medan memproduksi sadiaan
cairan obat dalam non antibiotik, sediaan cairan obat luar non antibiotic dan
sediaan salep yang telah mendapat sertifikat CPOB. Namun yang lebih dominan
diproduksi adalah sediaan cairan obat dalam non antibiotik (sediaan sirup).
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Infar
Arispharma Medan yang merupakan salah satu program dalam pendidikan profesi
apoteker, bertujuan agar mahasiswa atau mahasiswi mengetahui dan memahami
tugas dan fungsi apoteker dalam industri farmasi, sehingga diharapkan dapat
menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa
juga diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas,
memahami penerapan CPOB di PT. Infar Arispharma Medan, serta mengetahui
gambaran tentang situasi dan kondisi kerja di PT. Infar Arispharma Medan.
Praktek Kerja Profesi di Industri Farmasi PT. Infar Arispharma Medan
dilaksanakan pada tanggal 18-29 Mei 2010. Kegiatan yang dilakukan selama
Praktek Kerja Profesi (PKP) di Industri Farmasi antara lain membuat catatan
kegiatan harian yang berisi absensi dan materi kegiatan yang ditandatangani oleh
pembimbing, melihat kegiatan diruang produksi, laboratorium Quality Control
(QC), gudang bahan baku, gudang bahan pengemas, gudang obat jadi, sistem
pengaturan udara dan sistem pengolahan limbah.
Industri Farmasi PT. Infar Arispharma Medan memproduksi sadiaan
cairan obat dalam non antibiotik, sediaan cairan obat luar non antibiotic dan
sediaan salep yang telah mendapat sertifikat CPOB. Namun yang lebih dominan
diproduksi adalah sediaan cairan obat dalam non antibiotik (sediaan sirup).
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pembangunan kesehatan merupakan salah satu bagian dari pembangunan
nasional. Industri farmasi yang ada di Indonesia juga memiliki peranan yang
cukup penting dalam pembangunan kesehatan, terutama dalam hal penyediaan
obat-obatan. Industri farmasi merupakan salah satu tempat dimana apoteker
melakukan pekerjaan kefarmasian. Kemampuan seorang apoteker dalam
mengelola industri farmasi merupakan faktor yang sangat penting untuk
keberhasilan industi.
Kedudukan apoteker diatur oleh peraturan pemerintah yang dituangkan dalam
Pedoman Cara Pembuatan Obat yang Baik (CPOB), yaitu apoteker berperan
sebagai penanggung jawab produksi dan pengendali mutu. Untuk menghasilkan
sediaan obat jadi yang tetap memenuhi persyaratan yang telah ditetapkan sesuai
dengan tujuan penggunaannya, maka setiap industri farmasi wajib menerapkan
CPOB dalam seluruh aspek dan rangkaian kegiatan produksi.
Praktek Kerja Profesi di industri farmasi merupakan salah satu bagian dari
Praktek Kerja Profesi pada Program Pendidikan Profesi Apoteker Fakultas
Farmasi USU. Dalam pelaksanaan Praktek Kerja Profesi di industri, Fakultas
Farmasi bekerja sama dengan PT. Infar Arispharma Medan Jln. Tojai No.1
Kawasan Industri Mabar Sejahtera sebagai salah satu indutri farmasi di Indonesia.
Melalui Praktek Kerja Profesi di industri farmasi ini diharapkan calon
penelitian dan pengembangan, pengawasan mutu dan bagian produksi serta
penerapan CPOB sehingga setelah mengikuti Praktek Kerja Profesi ini para calon
apoteker mampu mengelola industri farmasi sesuai dengan pedoman CPOB.
1.2 Tujuan
Adapun tujuan Praktek Kerja Profesi Apoteker Fakultas Farmasi USU di
Industri Farmasi adalah:
1. Mengetahui dan memahami tugas dan tanggung jawab apoteker di industri
Farmasi
2. Memperoleh wawasan pengetahuan yang lebih luas serta memahami
penerapan CPOB di Industri Farmasi
1.3 Manfaat
Praktek Kerja Profesi di industri farmasi ini diharapkan dapat memberikan
pengetahuan praktis kepada mahasiswa calon apoteker tentang pekerjaan
kefarmasian di industri melalui penerapan CPOB.
1.4 Tempat dan Waktu
Praktek Kerja Profesi di industri farmasi dilaksanakan di PT. Infar Arispharma
Jln. Tojai No.1 Kawasan Industri Mabar Sejahtera pada tanggal 18 Mei 2010
BAB II
TINJAUAN UMUM INDUSTRI FARMASI
2.1 Perusahaan PT. Infar Arispharma Medan
2.1.1 Sejarah Perusahaan
PT. Infar Arispharma merupakan salah satu industri farmasi swasta yang
terletak di Medan. Berdiri pada tahun 1950 dan didirikan oleh Bapak H. Sutan
Azis. Pada saat berdiri belum berbentuk suatu industri, melainkan masih
berbentuk home industry. Pada saat itu beralamat di Jln. Puri No. 301/173 Medan.
Sejak berdirinya hingga saat ini PT. Infar Arispharma telah mengalami beberapa
perubahan yaitu :
1. Pada tahu 1970 Home Industry Arispharma berkembang menjadi bentuk
industri atas anjuran Kepala Kanwil Kesehatan Wilayah Sumatera Utara dan
pada saat itu hanya memproduksi sediaan serbuk obat dalam.
2. Pada tahun 1988, terjadi pergantian kerpemimpinan perusahaan dari Bapak H.
Sutan Azis Kepada Bapak H. Azwir Aziz.
3. Pada tahun 1988, PT. Infar Arispharma mengajukan permohonan sertifikat
CPOB kepada Balai POM untuk:
- Sediaan serbuk obat dalam
- sediaan cairan obat dalam non antibiotik,
- sediaan cairan obat luar non antibiotik,
4. Pada tahun 2001, PT. Infar Arispharma mendapat sertifikat CPOB untuk
keempat sediaan tersebut.
5. Sejak tahun 2007, PT. Infar Arispharma sudah tidak lagi memproduksi
sediaan serbuk obat dalam.
6. Pada tahun 2002, PT. Infar Arispharma pindah lokasi ke Jln. Tojai No. 1
Kawasan Industri Mabar Sejahtera, Kelurahan Mabar, Kecamatan Medan
Deli, Kodya Medan Sumatera Utara.
7. Pada tahun 2003 sampai dengan sekarang PT. Infar Arispharma melayani
obat-obat tender untuk PKD
2.1.2 Visi dan Misi Perusahaan
2.1.2.1 Visi Perusahaan
Sebagai organisasi bisnis yang berlandaskan pada pengabdian dengan
jaringan kerja sama dan kedisiplinan untuk menjadi perusahaan farmasi yang
memenuhi persyaratan dan dapat bersaing di pasar global.
2.1.2.2 Misi Perusahaan
1. Menyediakan dan mengadakan serta menyalurkan sediaan farmasi yang
berkualitas dan bernilai dengan jangkauan harga yang dapat memenuhi
kebutuhan masyarakat luas.
2. Mengembangkan sumber daya manusia untuk meningkatkan kompetisi dan
komitmen perkembangan perusahaan serta berperan aktif dalam
pengembangan industri farmasi nasional.
PT. Infar Arispharma Medan terletak di Jln. Tojai No.1 Kawasan Industri
Mabar Sejahtera dengan luas 800 m2 yang terdiri dari :
o Ruang Perkantoran
o Ruang laboratorium Pengawasan Mutu
o Ruang Produksi
o Ruang Penimbangan
o Gudang Bahan Baku
o Gudang Bahan Kemas
o Gudang Obat Jadi
o Bangunan penunjang seperti tempat pencucian alat, dapur, kantin (ruang
makan), kamar mandi dan musholla.
Sumber arus listrik berasal dari Perusahaan Listrik Negara (PLN). Sumber
air berasal dari Perusahaan Air Minum (PAM) dan untuk keperluan produksi
digunakan Air PAM yang telah diolah menjadi air murni melalui sistem Reverse
Osmosis.
Kontruksi bangunan PT. Infar Arispharma Medan telah dibuat sesuai dengan
persyaratan CPOB dimana dinding dibuat dari epoksi dan langit-langit dibuat dari
gipsum yang memiliki permukaan licin dan tidak terdapat persambungan. Lantai
di dalam ruang produksi dilapisi dengan epoksi, ruang produksi untuk
masing-masing bentuk sediaan letaknya terpisah. Sistem pengatur udara pada ruangan
produksi menggunakan tekanan udara yang lebih besar dari pada tekanan udara di
luar ruang produksi.
Struktur organisasi PT. Infar Arispharma merupakan struktur organisasi
yang memperlihatkan wewenang dan tanggung jawab vertikal, yang berarti bahwa
tiap-tiap orang dalam organisasi mempunyai beberapa orang bawahan dapat
dilihat pada lampiran 1 hal 57.
Kekuasaan tertinggi berada pada rapat umum pemegang saham yang
pelaksanaannya harus dipertanggung jawabkan oleh Direktur. Direktur
membawahi 4 bagian yang masing-masing bagian di pimpin oleh manager yang
langsung bertanggung jawab penuh kepada Direktur.
2.1.5 Personalia
Untuk mendukung kegiatan operasionalnya, PT. Infar Arispharma
memerlukan personalia yang cakap, terampil, terlatih dan saat ini berjumlah ±75
orang.
Dalam rangka memenuhi persyaratan CPOB, langkah-langkah yang diambil
PT. Infar Arispharma dibidang personalia adalah dengan cara mengirim pimpinan
atau staf untuk mengikuti penataran dan pelatihan mengenai CPOB. Selanjutnya
diharapkan pimpinan dan staf tersebut dapat memberikan bimbingan dan pelatihan
tentang CPOB pada karyawan sehingga kegiatan perusahaan akan memenuhi
ketentuan CPOB.
2.1.6 Bidang Usaha
Unit-unit usaha yang ada dan dilaksanakan pada perusahaan ini adalah :
o Unit Produksi Obat Jadi (formulasi) dan manufacture.
2.1.7 Jenis Produk
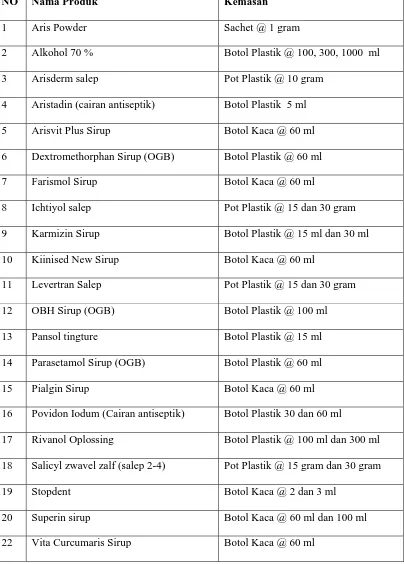
Tabel 1. Nama-Nama Produk di PT. Infar Arispharma
NO Nama Produk Kemasan
1 Aris Powder Sachet @ 1 gram
2 Alkohol 70 % Botol Plastik @ 100, 300, 1000 ml
3 Arisderm salep Pot Plastik @ 10 gram
4 Aristadin (cairan antiseptik) Botol Plastik 5 ml
5 Arisvit Plus Sirup Botol Kaca @ 60 ml
6 Dextromethorphan Sirup (OGB) Botol Plastik @ 60 ml
7 Farismol Sirup Botol Kaca @ 60 ml
8 Ichtiyol salep Pot Plastik @ 15 dan 30 gram
9 Karmizin Sirup Botol Plastik @ 15 ml dan 30 ml
10 Kiinised New Sirup Botol Kaca @ 60 ml
11 Levertran Salep Pot Plastik @ 15 dan 30 gram
12 OBH Sirup (OGB) Botol Plastik @ 100 ml
13 Pansol tingture Botol Plastik @ 15 ml
14 Parasetamol Sirup (OGB) Botol Plastik @ 60 ml
15 Pialgin Sirup Botol Kaca @ 60 ml
16 Povidon Iodum (Cairan antiseptik) Botol Plastik 30 dan 60 ml
17 Rivanol Oplossing Botol Plastik @ 100 ml dan 300 ml
18 Salicyl zwavel zalf (salep 2-4) Pot Plastik @ 15 gram dan 30 gram
19 Stopdent Botol Kaca @ 2 dan 3 ml
20 Superin sirup Botol Kaca @ 60 ml dan 100 ml
2.2 CPOB
2.2.1 Dasar Hukum
Berdasarkan keputusan Menteri Kesehatan RI Nomor
43/MENKES/SK/II/1988 pada tanggal 2 Februari 1988 ditetapkan Pedoman Cara
Pembuatan Obat yang Baik yang menjadi pedoman wajib bagi industri farmasi
dalam penerapan Cara Pembuatan Obat yang Baik (CPOB).
2.2.2 Tujuan CPOB
Penerapan CPOB dimaksudkan untuk:
1. Menjamin obat jadi yang dihasilkan memenuhi persyaratan mutu yang
ditentukan sesuai dengan tujuan penggunaannya.
2. Sebagai pedoman yang jelas bagi semua pihak yang terlibat dalam pembuatan
obat.
3. Menjamin konsistensi mutu obat dalam setiap pembuatannya.
2.2.3 Landasan Umum
CPOB dibuat dengan berlandaskan:
1. Pada pembuatan obat pengawasan menyeluruh sangat penting untuk
menjamin bahwa konsumen menerima obat yang bermutu tinggi.
2. Mutu obat harus dibentuk di dalam produk tersebut tidak cukup hanya lulus
dari pemeriksaan mutu.
3. semua obat di buat dalam kondisis yang dikendalikan dan dipantau secara
4. CPOB merupakan pedoman dengan tujuan agar obat yang dihasilkan sesuai
dengan spesifikasi yang dikendaki.
2.3 Aspek-Aspek yang Harus Diperhatikan dalam CPOB
2.3.1 Personalia
Struktur organisasi perusahaan hendaklah sedemikian rupa sehingga bagian
produksi, pengawasan mutu dan pemastian mutu dipimpin oleh apoteker yang
berlainan dan tidak saling bertanggung jawab satu dengan yang lainnya. Manajer
produksi, manajer pengawasan mutu dan manajer pemastian mutu membawahi
beberapa supervisor yang terlatih dan memiliki keterampilan teknis serta
pengalaman dalam bidang yang berkaitan dengan tugasnya.
Manajer produksi, pengawasan mutu dan pemastian mutu haruslah seorang
apoteker yang cakap, terlatih, memiliki pengalaman praktis yang memadai untuk
melaksanakan tugasnya secara profesional. Manajer produksi, manajer
pengawasan mutu dan manajer pemastian mutu memiliki wewenang dan tanggung
jawab penuh dalam mutu obat yang dihasilkan.
Manajer produksi memiliki wewenang dan tanggung jawab penuh untuk
mengelola produksi obat. Manajer pengawasan mutu memiliki wewenang dan
tanggung jawab dalam seluruh tugas pengawasan mutu. Manajer pemastian mutu
memiliki wewenang dan tanggung jawab dalam seluruh tugas pemastian mutu.
Manajer produksi, pengawasan mutu dan pemastian mutu bersama-sama
bertanggung jawab dalam penyusunan dan pengesahan prosedur-prosedur tertulis,
pemantauan kebersihan lingkungan pabrik, validasi proses produksi, pemberian
persetujuan pada pemasok bahan, pengamanan bahan dan produk terhadap
bahwa tugas dan tanggung jawab yang diberikan kepada seluruh karyawan jelas
dan dapat dipahami dengan baik.
Setiap karyawan yang langsung ikut serta dalam kegiatan pembuatan obat
dan yang karena tugasnya harus memasuki daerah pembuatan obat, hendaklah
diberikan pelatihan yang sesuai dengan tugasnya maupun pelatihan CPOB.
Pelatihan hendaknya dilaksanakan secara berkesinambungan dengan program
tertulis yang disetujui oleh manajer produksi dan manajer pengawasan mutu.
Pelatihan khusus diberikan kepada karyawan yang bekerja di daerah steril, di
daerah bersih, atau bagi mereka yang bekerja menggunakan bahan yang beresiko
tinggi, toksis atau yang menimbulkan sensitisasi atau alergi. Pelatihan hendaknya
diberikan oleh orang yang cakap. Dokumen pelatihan harus disimpan dengan baik
dan efektivitas program pelatihan hendaknya dinilai secara berkala.
2.3.2 Bangunan
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan
konstruksi serta letak yang memadai agar memudahkan dalam pelaksanaan kerja,
pembersihan dan pemeliharaan yang baik. Tiap sarana kerja hendaklah memadai,
sehingga setiap resiko terjadinya kekeliruan, pencemaran silang dan berbagai
kesalahan lain yang dapat menurunkan mutu obat, dapat dihindarkan.
Lokasi bangunan hendaklah sedemikian rupa untuk mencegah terjadinya
pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah
dan air maupun dari kegiatan di dekatnya. Apabila bangunan itu terletak pada
tempat yang tidak sesuai, tindakan yang efektif hendaklah diambil untuk
Dalam menentukan rancang bangun dan penataan gedung hendaklah
dipertimbangkan hal-hal berikut:
1. Kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam sarana yang
sama atau dalam sarana yang berdampingan.
2. Luasnya ruang kerja, yang memungkinkan penempatan peralatan dan
bahan-bahan secara teratur dan logis serta untuk memungkikan terlaksananya
kegiatan, kelancaran arus kerja, komunikasi dan pengawasan yang efektif
maupun untuk mencegah kesesakan dan ketidakteraturan.
3. Pencegahan terjadinya penggunaan kawasan produksi sebagai lalu lintas
umum bagi karyawan atau bahan-bahan ataupun sebagai tempat penyimpanan
kecuali untuk bahan-bahan yang sedang dalam proses.
Rancang bangun dan penataan gedung hendaklah memenuhi
persyarata-persyaratan berikut:
a. Dicegah resiko tercampur baurnya obat atau komponen obat yang berbeda,
kemungkinan terjadinya pencemaran silang oleh obat atau bahan-bahan lain
serta resiko terlewatnya salah satu langkah dalam proses produksi.
b. Kegiataan pengolahan bahan bagi produk bukan obat dipisahkan dari ruang
produksi obat.
c. Disediakan ruang terpisah untuk membersihkan alat yang da[pat
dipindah-pindahkan dan ruangan untuk menyimpan alat pembersih.
d. Kamar ganti-simpan pakaian berhubungan langsung dengan daerah
pengolahan tetapi letaknya terpisah.
e. Toilet tidak terbuka langsung ke daerah produksi dan dilengkapi dengan
Untuk kegiatan-kegiatan berikut diperlukan daerah tertentu yaitu:
a. Penerimaan bahan
b. Karantina barang masuk
c. Penyimpanan bahan awal
d. Penimbangan dan penyerahan
e. Pengolahan
f. Penyimpanan produk ruahan
g. Pengemasan
h. Karantina obat jadi selama menunggu pelulusan akhir
i. Penyimpanan obat jadi
j. Pengiriman barang
k. Laboratorium
l.Pencucian peralatan
Bangunan hendaklah mendapatkan penerangan yang efektif dan mempunyai
ventilasi dengan fasilitas pengendali udara (termasuk suhu, kelembaban dan
penyaring) yang sesuai untuk kegiatan dalam bangunan maupun dengan
lingkungan sekitarnya.
2.3.3 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki
rancang bangun dan konstruksi yang tepat. Permukaan peralatan yang bersentuhan
langsung dengan bahan atau produk tidak boleh bereaksi karena dapat merubah
identitas, mutu dan kemurnian produk yang dihasilkan, tidak boleh mencemari
produk, harus mudah dibersihkan baik bagian dalam maupun bagian luar
menguji harus diperiksa ketelitiannya secara teratur menurut program dan
prosedur yang tepat.
Pemasangan dan penempatan alat harus dapat mencegah terjadinya
kontaminasi silang dan cukup renggang untuk memberikan keleluasaan kerja.
Saluran air, uap, udara bertekanan atau hampa udara harus dipasang dengan baik
sehingga mudah dicapai selama kegiatan berlangsung.
Peralatan hendaknya dirawat menurut jadwal agar tetap berfungsi dengan
baik dan mencegah pencemaran terhadap produk. Catatan mengenai pelaksanaan,
pemeliharaan dan pemakaian suatu peralatan utama hendaklah dicakup dalam
buku catatatn harian yang menunjukkan tanggal, waktu, kekuatan dan nomor bets
atau lot produk yang diolah dengan peralatan tersebut serta pelaksana
pembersihan.
2.3.4 Sanitasi dan Higiene
2.3.4.1 Personalia
a. Semua karyawan hendaklah menjalani pemeriksaan kesehatan, baik pada
waktu diterima bekerja maupun selama bekerja.
b. Setiap karyawan hendaklah menetapkan higiene pribadi yang baik.
c. Karyawan yang menderita suatu penyakit atau mempunyai luka terbuka,
yang dapat merugikan kualitas produk, hendaklah dilarang untuk
menangani bahan dan produk sampai dia sembuh kembali.
d. Semua karyawan hendaklah didorong untuk melaporkan keadaan
kesehatannya yang dapat merugikan kualitas produk kepada atasannya.
e. Dihindarkan persentuhan langsung antara tangan dengan bahan baku,
f. Karyawan hendaklah mengenakan pakaian pelindung badan yang bersih
termasuk penutup rambut, hidung, dan mulut sesuai dengan tempat kerja
karyawan tersebut utnuk mencegah kontak langsung antara badan dengan
produk.
g. Karyawan harus mencuci tangan terlebih dahulu sebelum memasuki
ruangan produksi.
h. Merokok, makan, minum, mengunyah, meletakkan tanaman, menyimpan
makanan dan minuman hanya diperbolehkan di tempat-tempat tertentu
saja.
i. Peraturan higiene perorangan hendaklah diberlakukan bagi setiap orang
yang memasuki daerah produksi.
2.3.4.2 Bangunan
a. Rancang bangun gedung harus memudahkan untuk pelaksanaan
sanitasinya.
b. Tersedianya toilet dalam jumlah yang cukup dengan ventilasi yang baik.
c. Tersedia tempat penyimpanan barang milik pribadi yang memadai.
d. Fasilitas penyiapan makanan dibatasi daerah khusus, harus terpelihara dan
bersih.
e. Harus tersedia tempat sampah yang cukup yang terletak di luar bangunan
produksi, jangan biarkan sampah menumpuk dimana-mana.
f. Rodentisida, insektisida, bahan fumigasi dan bahan pembersih lain yang
digunakan pada sanitasi tidak boleh mencemari peralatan, bahan baku,
g. Harus mempunyai prosedur tetap sanitasi, meliputi cara-cara sanitasi,
jadwal pelaksanaan sanitasi dan penanggung jawab pelaksanaan sanitasi.
2.3.4.3 Peralatan
a. Setelah peralatan digunakan harus segera dibersihkan baik bagian dalam
maupun luarnya sesuai prosedur yang telah ditetapkan.
b. Hindari penggunaan sikat dan udara bertekanan, gunakan vakum atau cara
basah.
c. Pembersihan peralatan yang dapat dipindah-pindahkan hendaklah
dilakukan di ruang terpisah dari ruang produksi.
d. Prosedur tetap cara pembersihan alat harus ditaati.
2.3.5 Produksi
Produksi obat hendaklah dilaksanakan mengikuti prosedur yang telah
ditetapkan agar senantiasa diperoleh obat jadi yang memenuhi spesifikasi yang
ditentukan. Prosedur produksi hendaklah dibuat oleh penanggung jawab produksi
bersama-sama dengan penanggung jawab pengawasan mutu. Setiap
penyimpangan terhadap prosedur yang telah ditetapkan hendaknya dicatat pada
catatan bets dan bila perlu proses produksi setiap bets sebelumnya dievaluasi
kembali.
2.3.5.1 Bahan Awal
1. Setiap pemasukan, pengeluaran dan sisa bahan harus dilakukan pencatatan
2. Pada saat diterima harus diperiksa keutuhan kemasan dan kebenaran label
3. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaklah
memenuhi spesifikasi bahan awal yang sudah ditetapkan dan diberi label
dengan nama yang dinyatakan dalam spesifikasi.
4. Bahan awal yang mengalami kerusakan oleh suhu harus disimpan di
tempat yang suhu udaranya diatur.
5. Bahan awal yang mudah terurai atau menurun potensinya harus dinyatakan
batas waktu penggunaannya.
6. Persediaan bahan awal diperiksa dalam selang waktu tertentu untuk
meyakinkan bahwa wadahnya tertutup rapat, bertanda yang benar dan
dalam kondisi yang baik. Pemeriksaan laboratorium kembali dilakukan
sesuai prosedur yang telah ditentukan.
7. Semua bahan awal yang tidak memenuhi syarat ditandai dengan jelas,
ditempatkan terpisah dan secepatnya dikembalikan ke pemasok atau
dimusnahkan.
2.3.5.2 Validasi Proses
Semua prosedur produksi hendaklah divalidasi dengan tepat. Validasi
dilaksanakan menurut prosedur yang telah ditentukan dan catatan hasilnya harus
disimpan. Program dan dokumentasi validasi hendaklah membuktikan kecocokan
bahan yang dipakai, keandalan peralatan dan sistem serta kemapuan petugas
pelaksana.
Perubahan penting dalam proses, peralatan atau bahan hendaklah disertai
dengan validasi ulang, untuk menjamin bahwa perubahan tersebut akan tetap
menghasilkan produk yang memenuhi spesifikasi yang telah ditentukan.
Pencemaran kimiawi atau mikroba terhadap suatu obat yang dapat
merugikan kesehatan atau mengurangi daya terapeutik atau mempengaruhi
kualitas suatu produk, tidak dapat diterima. Perhatian khusus hendaklah diberikan
pada masalah pencemaran silang, karena sekalipun sifat dan tingkatannya tidak
berpengaruh langsung kepada kesehatan, hal ini menunjukkan pelaksanaan
pembuatan obat yang tidak sesuai dengan CPOB.
2.3.5.4 Sistem Penomoran Bets dan Lot
Penomoran bets dan lot diperlukan secara rinci untuk memastikan bahwa
produk antara, produk ruahan, dan produk jadi dapat dikenali dengan nomor bets
atau lot tertentu. Sistem penomoran ini hendaknya menjamin bahwa nomor bets
dan lot yang sama tidak digunakan secara berulang.
2.3.5.5 Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, produk antara, produk ruahan
dan produk jadi harus dilakukan dan didokumentasi sesuai dengan prosedur yang
telah ditetapkan. Sebelum dilakukan penimbangan harus dilakukan pemeriksaan
kebenaran penandaan termasuk hasil pemeriksaan laboratorium. Untuk
menghindari terjadinya kontaminasi silang, dan hilangnya identitas maka bahan
awal, produk antara, dan produk ruahan yang ada di daerah penyerahan hanya
boleh untuk satu bets saja.
2.3.5.6 Pengolahan
Semua bahan yang digunakan dalam pengolahan harus diperiksa terlebih
dahulu. Kondisi daerah pengolahan harus dipantau dan dikendalikan sesuai
persyaratan yang telah ditetapkan. Peralatan harus dinyatakan bersih secara
dan tiap penyimpangan harus segera dilaporkan kepada supervisor dan
didokumentasikan di dalam catatan pengolahan bets.
Pengolahan Sediaan Cairan Dan Salep
Produk berupa cairan dan salep hendaklah dibuat sedemikian rupa agar
produk terlindung dari pencemaran mikroba dan pencemaran lain. Sistem
pembuatan dan pemindahan secara tertutup sangat dianjurkan. Daerah produksi
dimana produk dan juga wadah-wadah bersih tanpa tutup terpapar ke lingkungan
hendaklah diventilasi secara efektif dengan udara yang disaring.
Peralatan tanki, wadah, pipa dan pompa yang digunakan hendaklah
dirancang dan dipasang sedemikian rupa sehingga memudahkan pembersihan dan
sanitasi bila perlu. Dalam merancang peralatan hendaklah diperhatikan agar tidak
terdapat lekukan atau sambungan mati (dead-legs) atau bagian-bagian dimana
kotoran dapat terkumpul dan menumbuhkan mikroba.
Peralatan gelas sedapat mungkin dihindarkan penggunaannya. Baja tahan
karat berkualitas tinggi adalah bahan pilihan untuk bagian peralatan yang
bersentuhan dengan produk yang sedang diproses. Kualitas kimiawi dan
mikrobiologi air yang digunakan hendaklah ditetapkan dan selalu dipantau. Air
hendaklah memiliki bilangan kuman dalam batas ambang yang dapat diterima.
Sistem pengadaan air proses yang disanitasi dengan bahan kimia hendaklah
divalidasi untuk memastikan bahan sanitasinya telah dibersihkan secara efektif.
Proses pencampuran dan pengisian hendaklah divalidasi. Perhatian
khusus hendaklah diberikan pada awal, sesudah penghentian dan pada akhir
proses pengisian untuk memastikan produk selalu dalam keadaan homogen.
Sirup adalah Sediaan cair berupa larutan yang mengandung sakarosa.
Kecuali dinyatakan lain, kadar sakarosa tidak kurang dari 64,0% dan tidak lebih
dari 66,0%.
Sirup dibagi menjadi 2 :
a. Non Medicated Syrup/Flavored vehicle Sirup
Contoh: Cherry Syrup, Cocoa Syrup, orange syrup.
b. Medicated syrup/ sirup obat
Contoh: Sirup Piperazina Sitrat, Sirup Isoniazid.
Komponen Sirup
a. Gula atau pengganti gula
b. Pengawet antimikroba
c. Pembau
d. Pewarna
e. Juga banyak sirup-sirup, terutama yang dibuat dalam perdagangan,
mengandung pelarut-pelarut khusus, pembantu kelarutan, pengental dan
stabilisator.
Pembuatan Sirup
a. Melarutkan bahan – bahan dengan bantuan pemanasan.
b. Melarutkan bahan – bahan dengan pengadukan tanpa pemanasan.
c. Penambahan sukrosa pada cairan obat yang dibuat atau pada cairan yang
2.3.5.7 Pengawasan Selama Proses
Prosedur pengawasan selama proses harus dipatuhi seperti pengambilan
contoh, frekuensi pengambilan contoh, dan jumlah yang diambil untuk
pemeriksaan. Hasil pengujian pengawasan selama proses harus dicatat dan
didokumentasikan.
Menurut Lachman (1989), Pengawasan mutu selama proses produksi
(IPC) untuk:
1. Sediaan padat meliputi: pemeriksaan kadar zat aktif, pemeriksaan
keseragaman bobot untuk tablet dan kapsul, dilakukan beberapa kali selama
proses produksi, pemeriksaan waktu larut, waktu hancur, kekerasan tablet
(kadar air), sampel diambil pada waktu permulaan, pertengahan, dan akhir
pencetakan tablet.
2. Sediaan setengah padat meliputi: keseragaman dan homogenitas obat,
pemeriksaan ukuran partikel, pemeriksaan penampilan, viskositas, berat
jenis, pemeriksaan bobot, pemeriksaan kebocoran tube (wadah).
3. Sediaan Cair meliputi: pemerian, kadar, berat jenis, pH, kebocoran, volume
terpindahkan, viskositas.
2.3.5.8 Pengemasan
Kegiatan pengemasan berfungsi membagi-bagi dan mengemas produk
ruahan menjadi produk jadi. Proses pengemasan hendaklah dilaksanakan di bawah
pengawasan ketat untuk menjaga identitas, keutuhan, dan kualitas barang yang
sudah dikemas. Sebelum kegiatan pengemasan dimulai hendaklah dilakukan
bersih dan bebas dari produk dan sisa produk lain atau dokumen yang tidak
diperlukan untuk kegiatan yang dilakukan.
Sebelum menempatkan bahan pengemas pada jalur pengemasan
hendaklah diadakan pemeriksaan kesiapan jalur pengemasan yang bersangkutan
oleh petugas yang ditunjuk sesuai derngan prosedur tertulis yang ditentukan.
Pada penyelesaian proses pengemasan produk yang sudah dikemas
hendaklah diperiksa dengan teliti untuk memastikan bahwa produk obat tersebut
sesuai dengan persyaratan dalam prosedur pengemasan induk. Hanya obat jadi
yang berasal dari satu bets pengemasan saja yang boleh ditempatkan pada satu
plat. Bila ada karton yang tidak penuh maka jumlah yang ada di dalamnya
hendaklah dituliskan pada karton tersebut.
Pelulusan obat jadi oleh bagian pengawasan mutu harus didahului dengan
penyelesaian yang memuaskan dari hal-hal seperti:
a. Produk jadi memenuhi persyaratan pengawasan mutu dalam semua spesifikasi
pengolahan dan pengawasan.
b. Bagian pengawasan mutu menyimpan obat jadi dalam jumlah yang cukup
sebagai contoh pertinggal yang akan digunakan untuk pengujian di masa
mendatang.
c. Kemasan akhir atau penandaan memenuhi persyaratan sesuai hasil
pemeriksaan bagian pengawasan mutu.
d. Rekonsiliasi bahan pengemas cetak cocok.
e. Obat jadi yang diterima di daerah karantina sesuai dengan jumlah yang tertera
2.3.5.9 Penyimpanan Bahan Awal, Produk Antara, Produk Ruahan, dan
Obat Jadi
Semua bahan hendaklah disimpan secara rapi dan teratur untuk mencegah
resiko tercampur-baur atau pencemaran serta memudahkan pemeriksaan dan
pemeliharaan. Semua bahan ini disimpan dengan jarak yang cukup terhadap bahan
lainnya maupun terhadap dinding, tidak diletakkan di lantai, dan dalam kondisi
lingkungan yang sesuai. Penyimpanan di luar gedung diperbolehkan bagi bahan
yang dikemas dalam wadah kedap yang mutunya tidak terpengaruh oleh suhu,
kelembabab dan faktor lainnya.
Setiap bahan awal, produk antara, produk ruahan, dan obat jadi yang
disimpan hendaklah mempunyai kartu persediaan yang senantiasa direkonsiliasi
dan jika terdapat penyimpangan hendaklah dicatat disertai penjelasan.
2.3.6 Pengawasan Mutu (QC)
Pengawasan mutu adalah bagian yang penting dari cara pembuatan obat
yang baik agar tiap obat yang dibuat memenuhi persyaratan mutu yang sesuai
dengan tujuan penggunaannya. Rasa keterikatan dan tanggung jawab semua unsur
dalam semua rangkaian pembuatan adalah mutlak untuk menghasilkan obat yang
bermutu mulai dari saat obat dibuat sampai pada distribusi obat jadi. Untuk
keperluan tersebut harus ada suatu bagian pengawasan mutu yang berdiri sendiri.
Sistem pengawasan mutu hendaklah dirancang dengan tepat untuk
menjamin bahwa tiap obat mengandung bahan dengan mutu yang benar dan
jumlah yang ditetapkan dan dibuat pada kondisi yang tepat dan mengikuti
prosedur standar sehingga obat tersebut senantiasa memenuhi spesifikasi yang
Pengawasan mutu meliputi semua fungsi analisa yang dilakukan
laboratorium termasuk pengambilan contoh, pemeriksaan dan pengujian bahan
awal, produk antara, produk ruahan, dan obat jadi. Pengawasan mutu juga
meliputi program uji stabilitas, pemantauan lingkungan kerja, validasi,
dokumentasi suatu bets, program penyimpanan contoh dan penyusunan serta
penyimpanan spesifikasi yang berlaku dari tiap bahan dan produk termasuk
metode pengujiannya.
Bagian pengawasan mutu melaksanakan tugas pokok sebagai berikut:
1. Menyusun dan merevisi prosedur pengawasan dan spesifikasi.
2. Menyiapkan instruksi tertulis yang rinci untuk tiap pemeriksaan dan
pengujian.
3. Menyusun rencana dan prosedur tertulis mengenai pengambilan contoh untuk
pemeriksaan.
4. Menyimpan contoh pertinggal untuk rujukan di masa mendatang.
5. Meluluskan atau menolak tiap bets bahan awal, produk antara, produk ruahan,
dan obat jadi serta hal-hal lain yang telah ditentukan.
6. Meneliti catatan yang berhubungan dengan pengolahan, pengemasan, dan
pengujian obat jadi bets yang bersangkutan sebelum meluluskannya untuk
didistribusikan.
7. Mengevaluasi stabilitas semua obat jadi secara berlanjut, bahan awal jika
diperlukan, dan menyiapkan instruksi mengenai cara penyimpanan bahan awal
dan obat jadi di pabrik berdasarkan data stabilitas yang ada.
8. Menetapkan tanggal kadaluarsa dan batas waktu penggunaan bahan awal dan
9. Mengevaluasi dan menyetujui prosedur pengolahan ulang suatu produk
10.Menyetujui penunjukan pemasok bahan baku dan bahan pengemas yang
diketahui dapat dipercayai mampu atau dapat diandalkan untuk memasok
bahan awal yang memenuhi spesifikasi mutu yang telah ditetapkan.
11.Mengambil bagian atau memberikan bantuan dalam pelaksanaan program
validasi.
12.Mengevaluasi semua keluhan yang diterima atau kekurangan yang ditemukan
mengenai suatu bets, dan bila perlu bekerjasama dengan bagian lain untuk
mengambil tindakan perbaikan yang diperlukan.
13.Menyediakan baku pembanding sekunder sesuai spesifikasi yang terdapat
pada prosedur pengujian yang berlaku dan menyimpan baku pembanding ini
pada kondisi yang tepat.
14.Menyimpan catatan pemeriksaan dan pengujian semua contoh yang diambil.
15.Mengevaluasi obat yang dikembalikan dan menetapkan apakah obat tersebut
dapat digunakan langsung atau diproses ulang atau harus dimusnahkan.
16.Ikut serta dalam program inspeksi diri bersama bagian lain dalam perusahaan.
17.Memberikan rekomendasi untuk pembuatan obat oleh pihak lain atas dasar
kontrak setelah diadakan evaluasi terhadap kontraktor yang bersangkutan
dinilai mampu membuat obat yang memenuhi standard mutu yang ditetapkan.
2.3.7 Pemastian Mutu (QA)
Kepala pemastian mutu hendaklah seorang Apoteker atau Magister Sains
atau Doktor Sains dan memiliki pengalaman paling sedikit 5 tahun sebagai
apoteker dalam suatu perusahaan farmasi, pengalaman praktek dalam analisis
laboratorium modern, kemampuan untuk menguraikan metode analisis serta fasih
berbahasa Inggris, kesanggupan dalam manajemen dan memotivasi personalia
serta memiliki pengetahuan yang baik dalam proses pembuatan obat dan CPOB
baik nasional maupun internasional.
Bagian pemastian mutu melaksanakan tugas pokok sebagai berikut:
1. Memantau kinerja sistem mutu dan prosedur serta nilai efektifitasnya.
2. Menyiapkan prosedur dalam penerapan CPOB dalam pembuatan obat,
pengemasan, penyimpanan dan pengawasan mutu.
3. Memastikan pemenuhan peraturan pemerintah dan standard perusahaan.
4. Melaksanakan inspeksi diri dan menyelenggarakan pelatihan CPOB.
5. Menyetujui protap dan mengelola sistem protap.
6. Melakukan penilaian terhadap keluhan teknik farmasi dan mengambil
keputusan serta tindakan atas hasil penilaian bila perlu bekerjasama dengan
bagian lain.
7. Memastikan penyelenggaraan validasi proses pembuatan dan sistem
pelayanan.
8. Memantau penyimpanan bets.
9. Mengawasi sistem pengendalian perubahan dan menyetujui perubahan.
10.Menyetujui prosedur pengolahan induk dan prosedur pengemasan induk.
11.Menyetujui atau menolak pasokan bahan baku.
12.Bertanggung jawab dalam pelulusan atau penolakan obat jadi sesuai protap
terkait.
Tujuan inspeksi diri adalah untuk melakukan penilaian apakah seluruh
aspek produksi dan pengendalian mutu senantiasa memenuhi persyaratan CPOB.
Program inspeksi diri hendaklah dirancang untuk mencari kelemahan dalam
pelaksanaan CPOB dan untuk menetapkan tindakan perbaikannya. Inspeksi diri
ini hendaklah dilaksanakan secara teratur. Tindakan perbaikan yang disarankan
hendaklah dilaksanakan. Untuk pelaksanaan inspeksi diri ditunjuk tim inspeksi
yang mampu menilai secara objektif pelaksanaan CPOB. Prosedur dan catatan
mengenai inspeksi diri hendaklah dibuat.
Untuk mendapatkan standard inspeksi diri yang minimal dan seragam maka
disusun daftar pemeriksaan selengkap mungkin. Daftar pemeriksaan hendaklah
meliputi pertanyaan mengenai hal-hal berikut:
1. Karyawan
2. Bangunan termasuk fasilitas untuk karyawan
3. Penyimpanan bahan awal dan bahan jadi
4. Peralatan
5. Produksi
6. Pengawasan mutu
7. Dokumentasi
8. Pemeliharaan gedung dan peralatan.
Tim inspeksi diri ditunjuk oleh pimpinan perusahaan terdiri dari
sekurang-kurangnya tiga orang yang ahli dibidang yang berlainan dan paham mengenai
CPOB. Anggota tim dapat berasal dari lingkungan perusahaan atau dari luar
lingkungan perusahaan. Tiap anggota tim hendaklah bebas dalam memberikan
2.3.9 Penangganan Keluhan, Penarikan Obat dan Obat Kembalian
1. Prosedur dan Catatan Penanganan Keluhan
Hendaklah dibuat prosedur penanganan keluhan dan laporan mengenai reaksi
yang merugikan dari obat jadi, yang mencakup defenisi tentang keluhan dan
reaksi merugikan, jenis keluhan dan laporan, cara penanganan keluhan dan
laporan mengenai reaksi yang merugikan dari obat jadi. Juga dibuat catatan untuk
tiap keluhan dan laporan yang memuat nama produk dan nomor bets, jenis
keluhan dan laporan, tempat asal keluhan dan laporan, contoh produk yang
bersangkutan, ringkasan tentang keluhan atau laporan, hasil penyelidikan,
evaluasi, tanggapan dan tindak lanjut terhadap keluhan atau laporan.
2. Prosedur dan Catatan Penanganan Obat Kembalian
Hendaklah dibuat prosedur penanganan obat yang dikembalikan yang
mencakup pedoman mengenai obat jadi yang dapat diselamatkan, diolah kembali
dan dimusnahkan. Hasil penanganan obat kembalian haruslah dicatat.
3. Prosedur dan Catatan Penarikan Kembali Obat Jadi
Hendaklah dibuat prosedur penarikan kembali obat jadi suatu bets atau lot atau
seluruh obat jadi dari peredaran dan juga dibuat catatan tindakan penarikan
kembali yang mencakup nama produk, nomor bets dan ukuran bets, tanggal
dimulai dan selesainya penarikan, alasan penarikan kembali, jumlah sisa dan
jumlah yang telah didistribusikan, jumlah produk yang dikembalikan, tempat asal
produk dikembalikan, evaluasi, tindak lanjut, dan laporan penanganan penarikan
4. Prosedur dan Catatan Pemusnahan Bahan dan Produk yang Ditolak
Dibuat prosedur pemusnahan bahan atau produk yang ditolak yang
mencakup tindakan pencegahan pencemaran lingkungan dan kemungkinan
jatuhnya produk tersebut ke tangan orang yang tidak berwenang. Juga harus
dibuat catatan pemusnahan bahan atau produk yang ditolak yang berisi antara lain
nama bahan, nomor bets dan jumlah, asal bahan atau produk, cara pemusnahan,
nama petugas yang melaksanakan, dan tanggal pemusnahan.
2.3.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi
manajemen yang meliputi spesifikasi, prosedur, metode dan instruksi, catatan dan
laporan serta jenis dokumentasi lain yang diperlukan dalam perencanaan,
pelaksanaan, pengendalian, serta evaluasi seluruh rangkaian kegiatan pembuatan
obat. Sistem dokumentasi hendaklah menggambarkan riwayat lengkap dari setiap
bets atau lot suatu produk sehingga memungkinkan penyelidikan serta
penelusuran terhadap bets atau lot produk yang bersangkutan. Sistem dokumentasi
diperlukan pula dalam pemantauan dan pengendalian, misalnya kondisi
lingkungan, perlengkapan dan personalia.
Dokumen dalam pembuatan obat:
a. Dokumen dalam produksi
1. Dokumen produksi induk yang merupakan pedoman dasar produksi untuk
tiap jenis obat jadi dengan bentuk sediaan dan dosis tertentu tanpa
memperhatiakn besarnya bets.
2. Prosedur produksi induk yang terdiri dari prosedur pengolahan induk dan
prosedur pengemasan induk.
3. Catatan produksi bets yang terdiri dari catatan pengolahan bets dan catatan
pengemasan bets yang pada dasarnya merupakan turunan dari prosedur
produksi induk yang sudah berisi data atau informasi mengenai
pelaksanaan produksi, pengolahan dan pengemasan.
b. Dokumen dalam pengawasan mutu
Dokumen dalam pengawasan mutu terdiri dari:
1. Prosedur dalam pengawasan mutu dan metode pengujian. Disamping itu,
prosedur dalam pengawasan yang terpenting adalah prosedur pengambilan
contoh untuk pengujian.
2. Catatan dan laporan hasil pengujian. Catatan tentang hasil uji stabilitas
biasanya diadakan tersendiri. Laporan hasil pengujian dapat berupa
sertifikat analisa.
c. Dokumen penyimpanan dan distribusi
Hendaklah diadakan catatan mengenai dokumen penyimpanan dan distribusi.
d. Dokumen dalam pemeliharaan, pembersihan, pengendalian ruangan dan
peralatan.
Dokumen pemeliharaan, pembersihan, pengendalian ruangan dan peralatan
yang terpenting adalah prosedur dan catatan pemeliharaan dan pembersihan
untuk peralatan, ruangan dan pembasmian hama serta catatan pemantauan
partikel dan jasad renik.
e. Dokumen dalam Penanganan Obat yang ditarik kembali akibat adanya
keluhan masyarakat, Obat Kembalian, dan pemusnahan Bahan dan Obat.
2.3.11 Kualifikasi dan Validasi
Validasi adalah tindakan pembuktian dengan cara-cara yang sesuai bahwa
tiap bahan, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang
digunakan dalam produksi dan pengawasan mutu akan senantiasa mencapai hasil
yang diinginkan (CPOB 2006). Langkah-langkah pelaksanaan validasi adalah
sebagai berikut:
• Membentuk komite validasi yang bertanggung jawab terhadap pelaksanaan
validasi di industri yang bersangkutan.
• Menyusun rencana induk validasi (RIV), yaitu dokumen yang menguraikan
secara garis besar pedoman pelaksanaan validasi.
• Membuat dokumen validasi, yaitu prosedur tetap, serta laporan validasi
• Pelaksanaan validasi
(Manajemen Industri Farmasi, 2007)
Validasi untuk mesin, peralatan produksi dan sarana penunjang disebut
kualifikasi. Kualifikasi tersebut adalah langkah pertama dalam melaksanakan
validasi di industri farmasi. Kualifikasi terdiri dari empat tingkatan yaitu:
a. Kualifikasi Desain/Design Qualification (DQ)
Merupakan unsur utama dalam melakukan validasi terhadap vasilitas, sistem
atau peralatan baru.
Kualifikasi dilakukan terhadap fasilitas, sistem dan peralatan baru atau yang
dimodifikasi, mencakup:
• Instalasi peralatan, pipa dan saran penunjang hendaklah sesuai dengan
spesifikasi dan gambar teknik yang di desain.
• Pengumpulan dan penyusunan dokumen pengoperasian dan perawatan
peralatan dari pemasok
• Ketentuan dan persyaratan kalibrasi
• Verifikasi bahan konstruksi
c. Kualifikasi Operasional/Operational Qualification (OQ)
Dilakukan setelah kualifikasi instalasi selesai dilaksanakan, dikaji dan disetujui.
Kualifikasi operasional mencakup:
• Kalibrasi
• Pelatihan operator dan ketentuan perawatan preventif
d. Kualifikasi Kinerja/Performance Qualification (PQ)
Dilakukan untuk menjamin dan mendokumentasikan bahwa system atau
peralatan yang telah diinstalasi beroperasi sesuai dengan spesifikasi yang
diinginkan (CPOB, 2006).
1. Validasi Prosedur Analitik
Validasi prosedur analitik merupakan proses yang dilakukan melalui
penelitian laboratorium untuk membuktikan bahwa karakteristik kinerja prosedur
itu memenuhi persyaratan aplikasi analitik yang dimaksudkan. Jenis prosedur
analitik yang harus divalidasi pada umumnya adalah uji identifikasi, uji kuantitatif
komponen terpilih lainnya dalam suatu produk obat, uji kuantitatif kandungan
cemaran, dan uji batas untuk mengendalikan jumlah cemaran.
Karakteristik kinerja atau parameter yang harus diukur dalam suatu penelitian
validasi prosedur analitik mencakup:
1. Akurasi, merupakan kedekatan antara nilai nyata yang diterima sebagai nilai
benar yang konvensional atau nilai standar yang dapat diterima dengan nilai
hasil pengukuran dari komponen yang sama.
2. Presisi, merupakan kedekatan antara hasil pengujian individu dalam
serangkaian pengukuran terhadap suatu contoh homogen yang dilakukan
pengambilan contoh secara berganda menurut prosedur yang telah ditetapkan.
3. Ketegaran, merupakan kapasitas suatu prosedur analitik untuk tidak
4. Linieritas, merupakan kemampuan suatu penetapan kadar untuk memperoleh
hasil uji yang sebanding dengan konsentrasi analit dalam contoh.
5. Rentang, merupakan interval di antara konsentrasi analit tertinggi dan
terendah adalah contoh yang dapat ditetapkan dengan akukrasi, presisi, dan
linieritas yang dapat diterima menggunakan metode analisis tersebut.
6. Selektifitas, merupakan kemapuan yang pasti untuk menetapkan suatu analit
yang terdapat bersama komponen lainnya dalam contoh. Komponen lain itu
dapat berupa cemaran atau hasil urai seperti komponen tablet, komponen
sediaan cair dan lainnya.
Bagian pengawasan mutu melakukan validasi terhadap hal-hal berikut:
a. Metode Analisis Penetapan Kadar
Metode ini meliputi kualifikasi peralatan yang dipakai, spesifikasi bahan
pereakasi, kondisi pengujian seperti waktu, suhu, keasaman larutan dan
kondisi lain yang ditetapkan dalam prosedur pengujian serta tindakan
pengamanan yang perlu.
b. Kalibrasi Instrumen
Penerapan instrument yang dipakai dalam pengujian hendaklah dilakukan
secara berkala untuk menjamin bahwa instrument tersebut senantiasa
memberikan hasil pengukuran dan penimbangan yang tepat.
2. Validasi Berkala
Bagian pengawasan mutu hendaklah memberikan bantuan yang diperlukan
khususnya bagian produksi untuk menjamin bahwa setiap produk yang dihasilkan
senantiasa memenuhi spesifikasi yang telah ditetapkan.
2.3.12 Analisis Kontrak
Pembuatan dan analisis kontrak harus dibuat secara benar, disetujui dan
dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan
produk atau pekerjaan dengan mutu yang tidak memuaskan, termasuk :
mengembalikan kontrak dan tidak dikontrol dan pemastian mutu pemberi kontrak
BAB III
KEGIATAN DI INDUSTRI FARMASI
3.1 Keterlibatan Dalam Produksi
Pelatihan Praktek Kerja Profesi Apoteker (PKPA) di PT. Infar Arispharma
Medan, dilaksanakan selama 2 minggu dari tanggal 18-29 Mei 2010.
Kegiatan yang dilakukan berupa:
1. Tutorial yang diadakan oleh bidang Pengendalian Mutu dan Produksi.
2. Tinjauan ke lapangan.
3. Melakukan ujian tertulis
3.2 Tinjauan ke Bagian-bagian Lain
3.2.1 Sistem Pengolahan Udara
Sistem pengolahan udara PT. Infar Arispharma menggunakan dust collector,
ducting dan AC central.
3.2.2. Sistem Pengolahan air
Untuk memenuhi suplai air murni (Purified water), dalam kasus ini dibagi
dalam 2 tahapan:
1. Tahap I : Pre Treatment System
Sumber air : Air PAM
Tahap pre treatment :
- Sand Filter
- Iron dan Manganese Filter
- Activated Carbon Filter
2. Tahap II: Sistem utama pengolahan air
- Mixed bed (Cation and Anion Exchanger)
- Reverse Osmosis
Tipe air yang digunakan dalam industri farmasi PT. Infar Arispharma: Sistem RO
(Lampiran 2 hal 58)
3.2.3 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari penerimaan bahan
awal, pengolahan sampai dengan menghasilkan obat jadi. Kegiatan produksi ini
dilakukan diarea tertutup dan tidak berhubungan langsung dengan bagian gudang,
laboratorium ataupun perkantoran.
Tugas dari bagian produksi PT Infar Arispharma Medan:
1. Melaksanakan pembuatan obat sesuai dengan Surat Perintah Produksi (SPP)
dari bagian PPIC, mulai dari permintaan bahan baku ke gudang, penimbangan,
pengolahan, pengemasan, sampai pengiriman obat jadi ke gudang obat jadi
sesuai dengan prosedur tertulis yang telah ditetapkan (Protap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama
proses pengolahan dan pengemasan dengan berpedoman pada protap.
Sebelum dimulainya kegiatan produksi, petugas yang terlibat dalam kegiatan
masker, penutup kepala, dan mendesinfeksi tangan dengan desinfektan yang
tersedia sebelum memakai sarung tangan .
Hal-hal yang harus diperhatikan sebelum memulai kegiatan produksi:
1. Ruang produksi harus tetap terjaga kebersihan, dimana kegitan pembersihan
dilakukan setiap pagi sebelum dimulai kegiatan produksi dan sore hari
sesudah selesai kegiatan produksi.
2. Temperatur dan kelembaban tiap ruangan produksi diatur sedemikan rupa
menggunakan sistem AC sentral.
3. Peralatan yang digunakan harus dipastikan selalu dalam keadaan bersih
sebelum dan sesudah dilakukan kegiatan produksi.
4. Ruangan Produksi harus mendapat penerangan dan pertukaran udara yang
cukup agar kegiatan produksi berjalan lancar.
Produksi dilaksanakan setelah adanya SPP dari bagian PPIC ke bagian
produksi, dan dilakukan produksi sesuai dengan protap yang telah ditetapkan serta
mendokumentasi setiap tindakan yang dilakukan selama produksi.
3.2.3.1 Jalur Proses Produksi
Setelah adanya perintah produksi dari PPIC, bagian produksi meminta
bahan baku ke bagian gudang bahan baku dan bahan pengemas dengan surat
perintah pengeluaran bahan baku dan bahan pengemas, petugas gudang
melakukan penimbangan atau penyerahan bahan sesuai dengan yang ditulis pada
SPP tersebut. Selama produksi berlangsung, dibuat laporan proses produksi mulai
dari penimbangan bahan, pencampuran, pengisian dan pengemasan primer sampai
Sehingga bila terjadi kekeliruan ataupun kesalahan pada proses produksi, dapat
segera ditelusuri pada proses dimana keselahan tersebut terjadi dan diambil
tindakan untuk mengatasi permasalahan tersebut.
Surat Perintah Produksi (SPP) terdiri dari: produksi sediaan, no bets, besar
bets, tahapan proses, operator, tanggal, jam, hasil, pengawasan yang berguna
untuk mengetahui berapa lama waktu yang dibutuhkan untuk menghasilkan suatu
bets sediaan. Proses produksi ini diisi oleh petugas yang melakukan suatu tahapan
proses produksi dan diketahui oleh supervisor produksi.
Selama proses produksi berlangsung dilakukan pengawasan dalam proses
(In Process Control/IPC) oleh bagian Pengawasan Mutu, yaitu: setiap 15 menit
sekali dilakukan pemeriksaan keseragaman bobot, keseragaman volume, pH dan
kadar zat berkhasiat.
Produk setengah jadi selanjutnya diserahkan kebagian pengemasan
sekunder melalui pass box untuk dilakukan pengemasan sampai dihasilkan obat
jadi. Obat jadi yang telah selesai dikemas dan dicatat dimasukkan ke ruang
karantina selanjutnya dibuat permohonan periksa kebagian pengawasan mutu
untuk dilakukan finished pack analysis. Obat jadi yang lulus pemeriksaan
selanjutnya diserahkan ke gudang penyimpanan obat jadi.
3.2.3.2 Alur karyawan
Pintu Masuk/Keluar
Loker Wanita Loker Pria
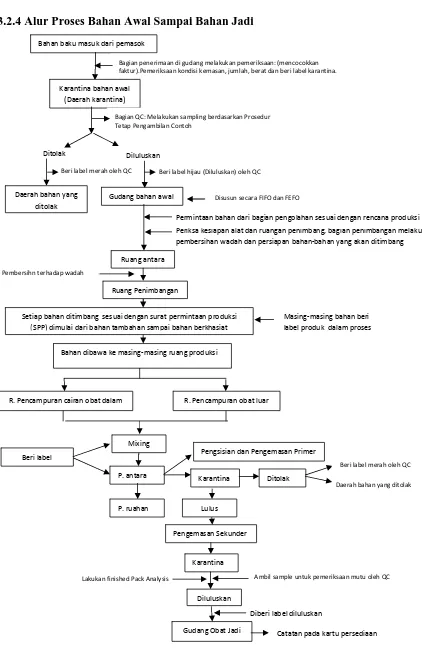
3.2.4 Alur Proses Bahan Awal Sampai Bahan Jadi
Bahan baku masuk dari pemasok
Bagian penerimaan di gudang melakukan pemeriksaan: (mencocokkan faktur).Pemeriksaan kondisi kemasan, jumlah, berat dan beri label karantina.
Karantina bahan awal (Daerah karantina)
Bagian QC: Melakukan sampling berdasarkan Prosedur
Tetap Pengambilan Contoh
Ditolak Diluluskan
Beri label merah oleh QC Beri label hijau (Diluluskan) oleh QC
Daerah bahan yang ditolak
Gudang bahan awal Disusun secara FIFO dan FEFO
Periksa kesiapan alat dan ruangan penimbang, bagian penimbangan melakukan pembersihan wadah dan persiapan bahan‐bahan yang akan ditimbang Permintaan bahan dari bagian pengolahan sesuai dengan rencana produksi
Ruang antara
Setiap bahan ditimbang sesuai dengan surat permintaan produksi (SPP) dimulai dari bahan tambahan sampai bahan berkhasiat
Masing‐masing bahan beri
Lakukan finished Pack Analysis Pembersihn terhadap wadah
Ruang Penimbangan
Bahan dibawa ke masing‐masing ruang produksi
R. Pencampuran cairan obat dalam R. Pencampuran obat luar
Diberi label diluluskan
Catatan pada kartu persediaan Pengsisian dan Pengemasan Primer
Mixing
Bagian Produksi pada PT Infar Arispharma Medan terdiri dari:
1. Jalur Proses Produksi Sediaan Cairan Obat Dalam
Jalur produksi sirup terpisah dari jalur produksi yang lain dimana pada jalur
produksi ini terdiri dari beberapa ruangan yang telah diatur suhu, kelembaban dan
tekanan. Adapun ruangan pada jalur produksi sirup terdiri dari:
A. Ruangan penimbangan
Pada ruangan ini dilengkapi dengan beberapa alat timbangan digital (elektrik),
dust collector, ducting. Bahan-bahan yang telah ditimbang akan ditempatkan pada
staging area untuk kemudian diambil oleh petugas produksi lain untuk dilakukan
proses produksi selanjutnya. Ruangan penimbangan dipakai untuk menimbang
bahan sediaan salep, cairan obat dalam, cairan obat luar, tetapi tidak pada waktu
yang bersamaan.
B. Ruangan pencampuran
Dilengkapi dengan alat mixer untuk mencampur bahan berkhasiat dan bahan
tambahan sampai homogen sehingga diperoleh produk ruahan dilakukan IPC oleh
bagian pengawasan mutu. Alat tersebut dibersihkan setiap pagi hari sebelum
digunakan dan sore hari sesudah selesai digunakan. Bila tidak ada kegiatan
produksi maka pembersihan dilakukan seminggu sekali. Setelah produk ruahan
diproleh dilakukan IPC oleh bagian pengawasan mutu.
C. Ruangan pengisian
Ruangan untuk melakukan pengisian sediaan sirup dilengkapi dengan mesin
pengisi sirup semi automatic dengan kapasitas 1000 botol/jam dan mesin capping.
pass box, dibawa oleh petugas produksi keruang pengisi dan disusun kemesin
pengisi yang telah dimasukkan massa sirup kemudian dilakukan pengisian.
Keseragaman bobot diperiksa pada awal pengisian oleh bagian pengawasan mutu
dan operator produksi kemudian setiap 15 menit sekali dilakukan pemeriksaan
sampai akhir pengisian selesai oleh bagian pengawasan mutu.
D. Ruangan karantina
Ruangan yang digunakan untuk menyimpan produk ruahan dan produk obat
jadi yang menunggu hasil pemeriksaan laboratorium pengawasan mutu. Di PT.
Infar Arispharma ruang karantina terdiri dari beberapa ruangan yaitu ruang
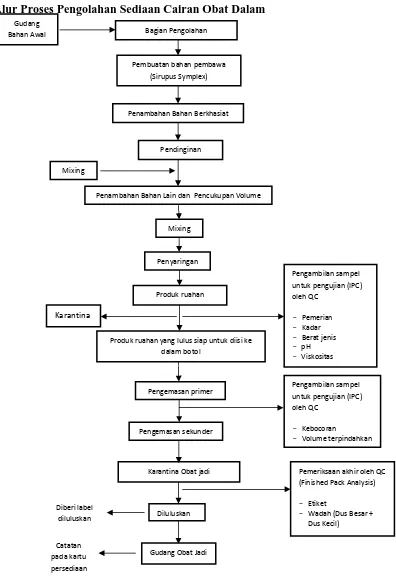
Alur Proses Pengolahan Sediaan Cairan Obat Dalam
Gudang
Bahan Awal Bagian Pengolahan
Pembuatan bahan pembawa (Sirupus Symplex)
Penambahan Bahan Berkhasiat
Pendinginan
Mixing
Penambahan Bahan Lain dan Pencukupan Volume
Mixing
Gambar 3. Alur Proses Pengolahan Sediaan Cairan Obat Dalam
Produk ruahan
Produk ruahan yang lulus siap untuk diisi ke dalam botol
Pengemasan primer
Pengemasan sekunder
Karantina Obat jadi
Pengambilan sampel (Finished Pack Analysis)
2. Jalur Produksi Salep
Jalur produksi salep terpisah dari jalur produksi yang lain dimana pada jalur
produksi ini terdiri dari beberapa ruangan yang telah diatur suhu. Adapun ruangan
pada jalur produksi salep terdiri dari:
A. Ruangan penimbangan
Pada ruangan ini dilengkapi dengan beberapa alat timbangan digital (elektrik),
dust collector. Bahan-bahan yang telah ditimbang akan ditempatkan pada staging
area untuk kemudian diambil oleh petugas produksi lain untuk dilakukan proses
produksi selanjutnya. Ruangan penimbangan dipakai untuk menimbang bahan
awal untuk sediaan salep, sirup, sediaan cairan obat luar.
B. Ruangan pencampuran
Pada ruangan ini dilengkapi dengan alat mixer untuk mencampur bahan aktif
dengan bahan dasar salep, campuran diaduk sampai homogen sehingga diperoleh
produk ruahan. Selama proses produksi dilakukan IPC oleh bagian pengawasan
mutu yang meliputi: pemerian, homogenitas, kadar, viskositas. Alat tersebut
dibersihkan setiap pagi hari sebelum digunakan dan sore hari sesudah selesai
digunakan. Bila tidak ada kegiatan produksi maka pembersihan dilakukan
seminggu sekali.
C. Ruangan pengisian
Ruangan dilengkapi dengan mesin pengisi salep Elemech dengan kapasitas
500 pot/jam dan neraca analitik.Sebelum pengisian salep , pot kosong yang telah
dibersihkan ditimbang untuk mengetahui berat rata-ratanya kemudian dimasukkan
kemesin pengisi yang telah dimasukkan massa salep kemudian dilakukan proses
pengisian. Keseragaman bobot diperiksa pada awal pengisian oleh bagian
pengawasan mutu dan operator produksi kemudian setiap 15 menit sekali
dilakukan pemeriksaan sampai akhir pengisian selesai oleh bagian pengawasan
mutu.
D. Ruangan karantina
Ruangan yang digunakan untuk menyimpan produk ruahan dan produk obat
jadi yang menunggu hasil pemeriksaan laboratorium pengawasan mutu. Di PT.
Infar Arispharma ruang karantina terdiri dari beberapa ruangan yaitu ruang
karantina produk ruahan dan ruang karantina produk jadi.
Alur Proses Pengolahan Salep
Gudang
Bahan Awal Bagian Pengolahan
Bahan
Karantina Obat jadi
Pengambilan sampel untuk pengujian oleh QC
- Pemerian - Kadar - Homogenitas Pengambilan sampel
untuk pengujian(IPC) oleh QC Pengisian dan Pengemasan Primer
Gambar 4. Alur Proses Pengolahan Salep
3. Jalur Produksi Sediaan Cairan Obat Luar
Jalur produksi cairan terpisah dari jalur produksi yang lain dimana pada jalur
produksi yang lain dimana pada jalur produksi ini terdiri dari beberapa ruangan
yang telah diatur suhu. Adapun ruangan pada jalur produksi salep terdiri dari:
A. Ruangan penimbangan
Pada ruangan ini dilengkapi dengan beberapa alat timbangan digital (elektrik),
dust collector. Bahan-bahan yang telah ditimbang akan ditempatkan pada staging
area untuk kemudian diambil oleh petugas produksi lain untuk dilakukan proses
produksi selanjutnya. Ruangan penimbangan dipakai untuk menimbang bahan
sediaan salep, sirup, sediaan cairan.
B. Ruangan pencampuran
Pada ruangan ini dilengkapi dengan alat mixer untuk mencampur bahan aktif
dengan bahan pembawa, campuran diaduk sampai homogen sehingga diperoleh
produk ruahan. Selama proses produksi dilakuakn IPC oleh bagian pengawasan
mutu. Alat tersebut dibersihkan setiap pagi hari sebelum digunakan dan sore hari
sesudah selesai digunakan. Bila tidak ada kegiatan produksi maka pembersihan
dilakukan seminggu sekali.
C. Ruangan pengisian
Ruangan untuk melakukan pengisian sediaan cairan dilengkapi dengan mesin
pengisi dengan kapasitas 1000 botol/jam dan neraca analitik.Sebelum dilakukan
kemesin pengisi yang telah dimasukkan salep kemudian dilakukan pengisian.
Keseragaman bobot diperiksa pada awal pengisian oleh bagian pengawasan mutu
dan operator produksi kemudian setiap 15 menit sekali dilakukan pemeriksaan
sampai akhir pengisian selesai oleh bagian pengawasan mutu.
D. Ruangan karantina
Ruangan yang digunakan untuk menyimpan produk ruahan dan produk obat
jadi yang menunggu hasil pemeriksaan laboratorium pengawasan mutu. Di PT.
Infar Arispharma ruang karantina terdiri dari beberapa ruangan yaitu ruang
karantina produk ruahan dan ruang karantina produk jadi.
Alur Proses Pengolahan Cairan Obat Luar
Diluluskan Diberi label diluluskan
Gudang Bahan Awal
Gambar 5. Alur Proses Pengolahan Cairan Obat Luar
A. Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pengemas datang dari pemasok kebagian gudang,
kemudian petugas laboratorium melakukan sampling dan pemeriksaan terhadap:
1. Bahan baku dan bahan tambahan
a) Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa
b) Pemeriksaan Kimia, meliputi pemeriksaan kualitatif, kuantitatif dan pH.
c) Pemeriksaan Fisika, meliputi titik lebur, kelarutan dan berat jenis.
2. Bahan pengemas
a) Pemeriksaan kemasan (dus kecil dan dus besar), meliputi ukuran dan
kebocoran wadah.
b) Pemeriksaan etiket, meliputi ukuran, desain (art work) dan warna
B. Pengawasan Selama Proses (In Process Control/IPC)
Tujuan dilakukan pengawasan selama berlangsungnya proses pengolahan
yaitu untuk mencegah terlanjur diproduksinya obat yang tidak memenuhi
spesifikasi. Laboratorium pengujian IPC terletak diarea produksi. Pengawasan ini
dilakukan dengan cara mengambil contoh dan mengadakan pemeriksaan dan
pengujian terhadap produk yang dihasilkan pada tahap-tahap tertentu dari proses
pengolahan.