BAB II
TINJAUAN UMUM
PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN
2.1 Sejarah dan Perkembangan Perusahaan
P.T. Kimia Farma (Persero) Tbk. merupakan pioner dalam industri farmasi Indonesia. Cikal bakal perusahaan dapat dirunut balik ke tahun 1917, ketika Naamloze Vennootschap (N.V.) Chemicalien Handle Rathkamp & Co., perusahaan farmasi yang didirikan pertama kali di Hindia Timur. P.T. Kimia Farma (Persero) Tbk. sebagai Badan Usaha Milik Negara (BUMN) dibentuk
sebagai Perusahaan Perseroan Terbatas (P.T.) pada tanggal 16 Agustus 1971.
Sejak berdirinya hingga sekarang ini P.T. Kimia Farma (Persero) Tbk. telah
mengalami beberapa perubahan, yaitu: 1. Periode I (1957-1959)
Periode ini adalah periode dimana pemerintah melaksanakan nasionalisasi perusahaan farmasi milik bangsa Belanda yang ada di Indonesia. Program nasionalisasi ini dikoordinasi oleh Badan Pengambil Alihan Perusahaan Farmasi (BAPPHAR). Adapun perusahaan farmasi milik Belanda tersebut yaitu:
a. Naamloze Vennootschap (N.V.) Rathkamp dan Naamloze Vennootschap (N.V.) Bavosta di Jakarta
b. Naamloze Vennootschap (N.V.) Bandoengsche Kinine Febriek di Bandung
d. Naamloze Vennootschap (N.V.) Industri Tella di Surabaya e. Commanditaire Vennootschap (C.V.) Apotek Malang di Malang f. Drogistry Van Belem dan Naamloze Vennootschap (N.V.) Sari Delle
di Yogyakarta 2. Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara Farmasi (PNF) dan perusahaan-perusahaan farmasi milik Belanda yang telah dinasionalisasikan sebelumnya. Perusahaan Negara Farmasi (PNF) ini berdasarkan Peraturan Pemerintah Nomor 60 tahun 1961 dibawah koordinasi Badan Pimpinan Umum Farmasi Negara sebagai peleburan Badan Pengambil Alihan Perusahaan Farmasi (BAPPHAR) yang bernaung dibawah Departemen Kesehatan.
Perusahaan-perusahaan yang didirikan adalah :
a. Perusahaan Negara Farmasi (PNF) Radja Farma (yang dahulunya Naamloze Vennootschap (N.V.) Rathkamp) di Jakarta
b. Perusahaan Negara Farmasi (PNF) Nurani Farma (yang dahulunya Naamloze Vennootschap (N.V.) Van Gorkom) di Jakarta
c. Perusahaan Negara Farmasi (PNF) Nakula Farma (yang dahulunya Naamloze Vennootschap (N.V.) Bavosta) di Jakarta
d. Perusahaan Negara Farmasi (PNF) Bhinneka Kimia Farma di Bandung
f. Perusahaan Negara Farmasi (PNF) Kasa Husada (yang dahulunya Naamloze Vennootschap (N.V.) Varbanstaffen)
g. Perusahaan Negara Farmasi (PNF) Biofarma (yang dahulunya Naamloze Vennootschap (N.V.) Pasteur Institute) di Bandung
3. Periode III (1969-1970)
Untuk meningkatkan efisiensi setiap Badan Usaha Milik Negara (BUMN), dikeluarkan Intruksi Presiden Nomor 17 tahun 1967 sehingga Departemen Kesehatan melebur perusahaan-perusahaan milik negara tersebut ke dalam Perusahaan Negara Farmasi (PNF) dan Alat-Alat Kesehatan Bhinneka Kimia Farma serta Perusahaan Negara Farmasi (PNF) Kasa Husada di Surabaya dirubah menjadi Perusahaan Umum dan Perusahaan Daerah, kemudian Perusahaan Negara Farmasi (PNF) Sari Husada di Yogyakarta berdiri sendiri sebagai anak perusahaan.
4. Periode IV (1971-2001)
5. Periode V (2001-sekarang)
Pada periode ini tepatnya tanggal 28 Juni 2001 P.T. Kimia Farma (Persero) menjadi Perusahaan Terbuka (Tbk.) dengan nama P.T. Kimia Farma (Persero) Tbk. dimana untuk privatisasi tahap I saham yang lepas adalah sebanyak 9% dengan rincian 3% untuk program Kepemilikan Saham Karyawan dan Manajemen (KSKM) P.T. Kimia Farma (Persero) Tbk., dan sebanyak 6% untuk masyarakat umum.
Pada tanggal 4 Januari 2003 P.T. Kimia Farma membentuk 2 anak perusahaan yaitu:
a. P.T. Kimia Farma Health & Care
b. P.T. Kimia Farma Trading & Distribution
Sedangkan pabrik sebagai P.T. Kimia Farma Holding Company.
Sejak tanggal 4 Juli 2001 pula P.T. Kimia Farma (Persero) Tbk. tercatat sebagai perusahaan publik di Bursa Efek Jakarta dan Bursa Efek Surabaya. Berbekal tradisi industri yang panjang selama lebih dari 187 tahun dan nama yang identik dengan mutu, hari ini P.T. Kimia Farma (Persero) Tbk. telah berkembang menjadi sebuah perusahaan pelayanan kesehatan utama di Indonesia yang kian memainkan peranan penting dalam pengembangan dan pembangunan bangsa dan masyarakat.
Plant Jakarta memproduksi sediaan tablet, tablet salut, kapsul, sirup kering, suspensi, sirup, tetes mata, krim, antibiotika dan injeksi. Unit ini merupakan satu-satunya pabrik obat di Indonesia yang mendapat tugas dari pemerintah untuk memproduksi obat golongan narkotika. Industri formulasi ini telah memperoleh sertifikat, yaitu: Cara Pembuatan Obat yang Baik (CPOB) dan ISO (International Organization for Standardization) 9001:2008.
Plant Bandung memproduksi bahan baku kina dan turunan-turunannya, rifampisin, obat asli indonesia dan Alat Kontrasepsi Dalam Rahim (AKDR). Selain itu, Plant Bandung juga memproduksi tablet, sirup, serbuk, dan produk kontrasepsi Pil Keluarga Berencana (Pil KB). Unit produksi ini telah menerima sertifikat Cara Pembuatan Obat yang Baik (CPOB) dan ISO (International Organization for Standardization) 9002.
Plant Semarang mengkhususkan diri pada minyak jarak, minyak nabati, serta bedak. Untuk menjamin kualitas produksi, unit ini secara konsisten menerapkan Sistem Manajemen Mutu (SMM) ISO (International Organization for Standardization) 9001:2008 serta telah memperoleh sertifikat Cara Pembuatan
Obat yang Baik (CPOB).
Plant Watudakon di Jawa Timur merupakan satu-satunya pabrik yang mengolah tambang yodium di Indonesia. Unit ini memproduksi yodium dan garam-garamnya, bahan baku ferro sulfat sebagai bahan utama pembuatan tablet besi untuk obat tambah darah, dan kapsul lunak ”Yodiol” yang merupakan obat
(CPOB), ISO (International Organization for Standardization) 9002 dan ISO (International Organization for Standardization) 14001.
Plant Medan di Tanjung Morawa, Sumatera Utara, dikhususkan untuk memasok kebutuhan obat di wilayah Sumatera. Produk yang dihasilkan oleh pabrik yang telah memperoleh sertifikat Cara Pembuatan Obat yang Baik (CPOB) untuk tablet, krim dan kapsul serta ISO (International Organization for Standardization) 9001:2008.
2.2 Visi dan Misi
Visi P.T. Kimia Farma (Persero) Tbk. adalah: Komitmen pada peningkatan kualitas kehidupan kesehatan dan lingkungan. Untuk mewujudkan visi tersebut, P.T. Kimia Farma (Persero) Tbk. memiliki misi, diantaranya:
1. Mengembangkan industri kimia dan farmasi dengan melakukan penelitian dan pengembangan produk yang inovatif.
2. Mengembangkan bisnis Pelayanan Kesehatan Terpadu (Health Care Provider) yang berbasis jaringan distribusi dan jaringan apotek.
3. Meningkatkan kualitas sumber daya manusia dan mengembangkan sistem informasi perusahaan.
Misi ini diwujudkan melalui strategi perusahaan, yakni:
1. Meningkatkan sinergi antar unit usaha dengan menggunakan salah satu unit usaha yang kuat untuk mengembangkan unit usaha lain.
2. Meningkatkan efektifitas pemasaran dengan penyusunan program pemasaran yang lebih fokus dan perluasan cakupan daerah pemasaran yang ada.
3. Memperkuat struktur bisnis distribusi dengan melakukan intensifikasi dan ekstensifikasi kegiatan distribusi.
4. Melakukan diversifikasi dan pengembangan produk, baik yang berasal dari pengembangan sendiri maupun kerja sama dengan pihak luar.
6. Mengembangkan sumber daya manusia untuk memperoleh sumber daya manusia yang mempunyai komitmen-komitmen tinggi, melalui pelatihan dan pendidikan yang terencana dan berkesinambungan.
Mengembangkan sistem dan prosedur operasi ditunjang dengan sistem ilmu teknologi yang memadai untuk peningkatan efisiensi dan menuju Operasional yang Baik (Excellence Operational).
2.3 Lokasi dan Sarana Produksi
P.T. Kimia Farma (Persero) Tbk. Plant Medan berada pada Jalan Sisingamangaraja Kilometer 9 dengan luas 20.269 meter persegi, Kotamadya Medan, Provinsi Sumatera Utara, Indonesia. Perusahaan ini berdiri di atas lahan dengan luas 20.269 meter persegi yang terdiri dari:
1. Ruang perkantoran.
2. Ruang laboratorium pengelolaan mutu (ruang asisten manager QA, ruang mikrobiologi, ruang pengawasan mutu, ruang instrumen, ruang contoh pertinggal) dan pengawasan selama proses (In Process Control/IPC).
3. Ruang produksi tablet/kapsul. 4. Ruang produksi krim/salep. 5. Ruang penimbangan sentral. 6. Gudang bahan baku.
7. Gudang bahan kemas. 8. Gudang etiket.
10. Bangunan penunjang seperti tempat pencucian, dapur, mushola, dan tempat olahraga.
Konstruksi bangunan P.T. Kimia Farma (Persero) Tbk. Plant Medan telah dibuat sesuai dengan persyaratan Cara Pembuatan Obat yang Baik (CPOB) dimana dinding dan langit-langit memilki permukaaan licin dan tidak terdapat sambungan. Lantai dan dinding di dalam ruangan produksi dilapisi dengan epoksi, ruang produksi untuk masing-masing bentuk sediaan terletak terpisah. Sistem pengaturan udara pada ruang produksi menggunakan Unit Pengatur Udara (Air Handling Unit/AHU) dengan Penyejuk Udara (Air Conditioner/AC) sentral,
dimana rangkaian AHU terbagi atas dua rangkaian unit yaitu unit pertama berhubungan dengan sistem tata udara yang mencakup ruang produksi tablet dan kapsul, sedangkan unit kedua berhubungan dengan ruang produksi salep dan krim.
2.3.1 Struktur Organisasi P.T. Kimia Farma (Persero) Tbk. Plant Medan Dalam melaksanakan kegiatannya P.T. Kimia Farma (Persero) Tbk. Plant Medan menggunakan struktur organisasi yang disusun sedemikian rupa sehingga jelas terlihat batas-batas tugas, wewenang dan tanggung jawab dari setiap personil dalam organisasi. Struktur organisasinya dapat dilihat pada Lampiran 1, dimana di dalamnya mencakup tingkat manager sampai pada tingkat asisten manager dan tingkat supervisor, sedangkan untuk level karyawan tidak digambarkan.
2.3.2 Sediaan-Sediaan Obat yang Diproduksi P.T. Kimia Farma (Persero) Tbk. Plant Medan
3. Betason® krim.
4. Dexocort® 0,25% krim tube 5 gram.
5. Fungoral® krim tube 5 gram dan 10 gram. 6. Virules® krim tube 5 gram.
7. Hidrokortison 2,5% krim.
8. Kloramfenikol 250 miligram kapsul (1000 kapsul per botol dan 250 kapsul per botol).
9. Kalsium Laktat 500 miligram tablet (1000 tablet per botol).
10. Parasetamol 500 miligram tablet (kemasan 10 tablet per strip dalam 10 strip per kotak dan 1000 tablet per botol).
11. Gliseril Guaiakolat 200 miligram (1000 tablet per botol). 12. Gentamisin salep kulit.
13. Antalgin 500 mg tablet (kemasan 10 tablet per strip dalam 10 strip per kotak dan 1000 tablet per botol).
14. Vitamin B kompleks tablet (1000 tablet per botol).
2.3.3 Perencanaan Produksi dan Pengendalian Inventaris (PPPI)
Tugas dan fungsi dari Perencanaan Produksi dan Pengendalian Inventaris (PPPI) (Plan Production And Inventory Control/PPIC) yaitu:
1. Merencanakan kebutuhan bahan produksi. 2. Mengontrol jalannya pembuatan obat. 3. Merencanakan pengiriman obat jadi.
Dasar perencanaan adalah pemesanan pemasaran yang berasal dari direktorat pemasaran di Jakarta setiap triwulan. Dari jumlah pesanan tersebut di konversikan per Bets (Batch) karena tiap produk memiliki ukuran Bets (Batch) yang berbeda.
Untuk pemesanan bahan, Perencanaan Produksi dan Pengendalian Inventaris (PPPI) memperhatikan stok bahan baku yang ada di gudang, stok produk ruahan atau setengah jadi dan stok produk jadi di gudang, sehingga dapat diketahui beberapa bahan yang akan dipesan.
Setelah semua jumlah bahan yang diperlukan untuk produksi dihitung, maka Perencanaan Produksi dan Pengendalian Inventaris (PPPI) mengeluarkan Surat Permintaan Pembelian Bahan (SPPB) ditujukan kepada bagian pembelian. Pembelian ada dua cara yaitu: secara terpusat di Jakarta dan secara lokal di Medan. Bagian pembelian ini akan memilih pemasok yang paling murah tetapi memenuhi spesifikasi bahan yang diminta, kemudian bagian pembelian menerbitkan Surat Pemesanan (SP) (Purchase Order/PO) dan ditandatangani Manager Plant. Dibuat tembusan satu lembar arsip pesanan ke bagian gudang agar disiapkan tempatnya.
(HPL). Jika tidak memenuhi syarat yang akan diberi label merah disertai Hasil Pemeriksaan Laboratorium (HPL) untuk nantinya akan dikembalikan ke pihak pemasok.
Setelah semua bahan yang dipesan lengkap, maka Perencanaan Produksi dan Pengendalian Inventaris (PPPI) membuat Surat Perintah Kerja (SPK) ke bagian produksi yang ditandatangani pimpinan. Pada Surat Perintah Kerja (SPK) tersebut ditulis Nomor Surat Perintah Kerja (Nomor SPK), Nama Sediaan, Nomor Bets (Batch), dan kapan obat tersebut diharapkan siap diproduksi. Surat Perintah Kerja (SPK) dari Perencanaan Produksi dan Pengendalian Inventaris (PPPI) yang dikirim ke bagian produksi dilampiri Catatan Pengolahan Bets (Batch), Catatan Pengemasan Bets (Batch), Surat Perintah Pengeluran Bahan Baku (SPPBB) dan Surat Perintah Pengeluran Bahan Kemas (SPPBK). Surat Perintah Kerja (SPK) dibuat rangkap 4 dengan distribusi ke bagian Produksi, bagian Gudang, bagian Laboratorium dan sebagai Arsip.
2.3.4 Produksi
Produksi adalah semua kegiatan pembuatan mulai dari penerimaan bahan awal, pengolahan sampai dengan menghasilkan obat jadi. Kegiatan produksi ini dilakukan di area tertutup dan tidak berhubungan langsung dengan bagian gudang ataupun perkantoran.
Tugas dari bagian produksi PT Kimia Farma (Persero) Tbk. Plant Medan: 1. Melaksanakan pembuatan obat sesuai dengan Surat Perintah Kerja (SPK)
dari bagian Perencanaan Produksi dan Pengendalian Inventaris (PPPI), mulai dari permintaan bahan baku ke gudang, penimbangan, pengolahan, pengemasan, sampai pengiriman obat jadi ke gudang obat jadi sesuai dengan prosedur tertulis yang telah ditetapkan pada Prosedur Tetap (ProTap).
2. Melaksanakan dokumentasi atas semua tindakan yang dilakukan selama proses pengolahan dan pengemasan dengan berpedoman pada Prosedur Tetap (ProTap). Sebelum dimulainya kegiatan produksi, petugas yang terlibat dalam kegiatan produksi ataupun yang memasuki area produksi harus memakai pakaian bersih, masker, penutup kepala, dan melakukan desinfeksi tangan dengan desinfektan yang tersedia sebelum memakai sarung tangan.
Hal-hal yang harus diperhatikan sebelum memulai kegiatan produksi: 1. Ruang produksi harus tetap terjaga kebersihan, dimana kegiatan
2. Temperatur dan kelembaban tiap ruangan produksi diatur sedemikan rupa menggunakan Unit Pengatur Udara (Air Handling Unit/AHU) yaitu Penyejuk Udara (Air Conditioner/AC) sentral.
3. Peralatan yang digunakan harus dipastikan selalu dalam keadaan bersih sebelum dan sesudah dilakukan kegiatan produksi.
4. Ruangan produksi harus mendapat penerangan dan pertukaran udara yang cukup agar kegiatan produksi berjalan lancar.
Produksi dilaksanakan setelah adanya Surat Perintah Kerja (SPK) dari bagian Perencanaan Produksi dan Pengendalian Inventaris (PPPI) ke bagian Produksi dan dilakukan Produksi sesuai dengan Prosedur Tetap (ProTap) yang telah ditetapkan serta mendokumentasi setiap tindakan yang dilakukan selama produksi. Laporan proses produksi memuat Sediaan, Nomor Bets (Batch), Besar Bets (Batch), Tahapan Proses, Operator, Tanggal, Jam, Hasil, Pengawasan yang berguna untuk mengetahui berapa lama waktu yang dibutuhkan untuk menghasilkan suatu Bets (Batch) sediaan dan kualitas sediaan yang dihasilkan. Laporan proses produksi ini diisi oleh petugas yang melakukan suatu tahapan proses produksi dan diketahui oleh supervisor produksi.
Selama proses produksi berlangsung dilakukan Pengawasan Selama Proses (In Process Control/IPC). Pengawasan Selama Proses (In Process Control/IPC) yang dilakukan ada 2 macam, yaitu:
1. Dilakukan oleh pihak produksi, yaitu setiap 15 menit sekali dilakukan pemeriksaan keseragaman bobot.
Obat yang telah selesai diproduksi akan dilakukan pengemasan primer di bagian produksi yang selanjutnya diserahkan ke bagian pengemasan melalui Kotak Hantar (Passing Box) untuk dilakukan pengemasan sekunder sampai dihasilkan obat jadi. Obat jadi yang telah selesai dikemas, ditimbang dan dicatat selanjutnya dibuat permohonan periksa ke Bagian Pemastian Mutu untuk dilakukan Analisis Kemasan Akhir (Finished Pack Analysis). Obat jadi yang lulus pemeriksaan selanjutnya diserahkan ke gudang penyimpanan obat jadi.
Bagian Produksi pada PT Kimia Farma (Persero) Tbk. Plant Medan terdiri dari beberapa jalur, diantaranya:
1. Jalur Produksi Krim dan Salep.
Jalur produksi krim terpisah dari jalur produksi yang lain dimana pada jalur produksi ini terdiri dari beberapa ruangan. Ruangan tersebut telah diatur suhu, kelembaban dan tekanan dengan Unit Pengatur Udara (Air Handling Unit/AHU). Adapun ruangan pada jalur produksi krim terdiri dari:
a. Ruangan penimbangan.
b. Ruangan pencampuran.
Pada ruangan ini dilengkapi dengan alat Double Jacket Tank untuk memanaskan air, alat Ultra Turrax untuk mencampur bahan aktif dengan bahan dasar krim, alat Pencampur (Mixer) untuk pengadukan sehingga diperoleh produk ruahan. Alat-alat tersebut dibersihkan setiap pagi hari sebelum digunakan dan sore hari sesudah selesai digunakan. Bila tidak ada kegiatan produksi maka pembersihan dilakukan seminggu sekali. Selama proses produksi Pengawasan Selama Proses (In Process Control/IPC) oleh Bagian Pengawasan Mutu.
c. Ruangan pengisian.
Ruangan untuk melakukan pengisian sediaan krim ada 3 yaitu: Ruangan pengisian I: dilengkapi dengan mesin pengisian krim
(Elemech) dengan kapasitas 2400 tube per jam dan dilengkapi juga dengan neraca analitik.
Ruang pengisian II: dilengkapi dengan mesin pengisian krim
(Pharmech) dengan kapasitas 900 tube per jam sampai 2000 tube per jam dan dilengkapi juga dengan neraca analitik.
Ruang pengisian III: dilengkapi dengan mesin pengisian krim
(Pharmech) dengan kapasitas 1600 tube per jam dan dilengkapi juga dengan neraca analitik.
mesin pengisian yang telah dimasukkan massa krim kemudian dilakukan pengisian. Setiap 15 menit dilakukan pemeriksaan bobot oleh operator dan pada awal dan akhir pengisian dilakukan pemeriksaan oleh Bagian Pengawasan Mutu.
d. Ruangan karantina.
Pada ruang ini disimpan produk ruahan untuk menunggu pemeriksaan laboratorium. Produk ruahan yang telah selesai diperiksa akan dikirim ke bagian pengemasan melalui Kotak Hantar (Passing Box) untuk dilakukan pengemasan sekunder. Bagan Alur proses
Produksi krim dan salep dapat dilihat pada Lampiran 2. 2. Jalur Produksi Tablet.
Jalur produksi tablet terletak terpisah dari jalur produksi krim untuk menghindari terjadinya pencemaran silang. Pada unit tablet juga terdapat beberapa jalur. Ruangan tersebut telah diatur suhu, kelembaban dan tekanan dengan Unit Pengatur Udara (Air Handling Unit/AHU). Juga dilengkapi dengan Pengumpul Debu (Dust Collector) sentral. Adapun ruangan pada produksi tablet terdiri dari:
a. Ruangan pencampuran.
b. Ruang pengeringan.
Granul basah yang dihasilkan dikeringkan di dalam oven dengan suhu 50oC sampai dengan 60oC selama 10 jam (tergantung pada bahan yang akan dikeringkan). Kapasitas oven tersebut 450 kg per hari. Setelah kering dilakukan pemeriksaan laboratorium dan selanjutnya dipindahkan ke ruangan granulasi untuk pengayakan.
c. Ruang granulasi.
Massa granul yang telah dikeringkan digranulasi dengan alat Communiting Fitz Mill, kemudian hasil granulasi dibawa ke ruang pencampuran akhir.
d. Ruang pencampuran akhir.
Massa yang telah digranulasi dimasukkan ke dalam alat V-Mixer dan ditambahkan dengan bahan pelicin dan bahan penghancur luar. Hasil yang diperoleh kemudian dilakukan pemeriksaan Pengawasan Selama Proses (In Process Control/IPC). Massa disimpan di ruang karantina.
e. Ruang pencetakan.
Ruang untuk pencetakan ada 5, masing-masing terdapat 1 alat cetak dan juga terdapat Pengumpul Debu (Dust Collector), neraca analitis, dan Unit Pengatur Udara (Air Handling Unit/AHU). Pencetakan dilakukan dengan menggunakan mesin cetak tablet merek Cadmach CU dengan kecepatan mesin 50000 tablet per jam. Setiap 15
atau pengujian terhadap produk ruahan yang meliputi: pemerian, friabilitas, waktu hancur, kekerasan tablet, disolusi dan keseragaman bobot.
f. Ruang sortir.
Tablet yang dihasilkan disortir oleh petugas, tablet disortir dari debu dan juga untuk disortir dari bentuk tablet yang tidak bagus atau pecah. Kemudian dipindahkan ke ruangan pengemasan.
g. Ruang pengemasan.
Tablet yang telah diluluskan oleh Bagian Pengawasan Mutu dibawa ke ruang pengemasan primer dan dikemas dalam kantong plastik atau diblister. Tiap kantong berisi 1000 tablet dengan menggunakan mesin penghitung dan diberi silika gel. Pada kemasan strip atau blister masing-masingnya berisi 10 tablet dan dikemas ke dalam kotak yang setiap kotak berisi 10 strip atau blister. Setelah selesai dilakukan pengemasan primer dipindahkan ke ruangan melalui Kotak Hantar (Passing Box) untuk dilakukan pengemasan sekunder. Bagan alur produksi tablet dapat dilihat pada Lampiran 3.
3. Jalur Produksi Kapsul.
Sediaan kapsul yang diproduksi oleh P.T. Kimia Farma (Persero) Tbk. Plant Medan adalah Kloramfenikol Kapsul. Seperti jalur produksi krim, salep dan tablet, jalur produksi Kapsul juga terletak terpisah untuk menghindari terjadinya pencampuran atau pencemaran silang (Mix Up atau Cross Contamination). Pada jalur produksi kapsul juga terdapat beberapa
tekanan dengan menggunakan Unit Pengatur Udara (Air Handling Unit/AHU), juga dilengkapi Pengumpul Debu (Dust Collector) sentral.
Adapun ruangan pada unit kapsul terdiri dari: a. Ruang pengeringan.
Bahan yang akan dipakai untuk pembuatan kapsul ditimbang di ruang penimbangan sesuai dengan Surat Perintah Kerja (SPK). Untuk bahan pengisi (Avicel) dikeringkan terlebih dahulu di dalam oven selama kurang lebih 12 jam pada suhu 85oC. Setelah itu semua bahan dipindahkan ke ruang pencampuran.
b. Ruang pencampuran.
Pada ruang ini dilakukan pencampuran bahan aktif, bahan pengisi dan bahan tambahan lainnya dengan menggunakan alat Pencampur-V (V-Mixer) selama kurang lebih 15 menit. Setelah homogen, dilakukan pemeriksaan massa oleh Bagian Pengawasan Mutu dan kemudian dipindahkan ke ruang pengisian kapsul.
c. Ruang pengisian kapsul.
d. Ruang sortir.
Kapsul yang dihasilkan disortir oleh petugas, Kapsul disortir dari debu dan juga untuk disortir dari bentuk kapsul yang tidak bagus. Kemudian dipindahkan ke ruangan pengemasan.
e. Ruang pengemasan.
Kapsul yang telah diluluskan oleh Bagian Pengawasan Mutu dibawa ke ruang pengemasan primer dan dikemas dalam kantong plastik. Tiap kantong berisi 250 kapsul dan 1000 kapsul dengan menggunakan mesin penghitung dan diberi silika gel. Setelah selesai dilakukan pengemasan primer dipindahkan ke ruangan pengemasan melalui Kotak Hantar (Passing Box) untuk dilakukan pengemasan sekunder. Bagan alur produksi kapsul dapat dilihat pada Lampiran 4.
2.3.5 Pengawasan Mutu dan Pemastian Mutu
Pengawasan mutu adalah semua pengawasan yang dilakukan selama pembuatan dan dirancang untuk menjamin agar produk obat yang dihasilkan senantiasa memenuhi spesifikasi, identifikasi, kekuatan, kemurnian dan karakteristik lain yang telah ditetapkan. Pengawasan mutu merupakan bagian yang paling penting dari Cara Pembuatan Obat yang Baik (CPOB) agar tiap obat yang dibuat memenuhi persyaratan mutu yang sesuai dengan tujuan penggunaannya.
1. Memastikan bahan awal memenuhi spesifikasi yang ditetapkan untuk identitas, kekuatan, kemurnian, kualitas, dan keamanan.
2. Memastikan tahapan produksi obat telah dilaksanakan sesuai prosedur yang ditetapkan dan telah divalidasi.
3. Memastikan semua Pengawasan Selama Proses (In Process Control/IPC) dan pemeriksaan selama proses dan pemeriksaan laboratorium terhadap suatu Bets (Batch) obat telah dilaksanakan dan Bets (Batch) tersebut memiliki spesifikasi yang ditetapkan sebelum didistribusi.
4. Memastikan suatu Bets (Batch) obat memenuhi persyaratan mutunya selama waktu peredaran yang ditetapkan. Setiap bahan baku yang dikarantina dilakukan pengujian oleh Bagian Pengawasan Mutu yang mencakup: spesifikasi identitas, kualitas, kekuatan/potensi dan persyaratan lain yang ditentukan.
2.3.6 Pemeriksaan Mutu Bahan Baku dan Bahan Pengemas
Bahan baku dan bahan pengemas datang dari pemasok ke bagian gudang, kemudian petugas laboratorium melakukan sampling dan pemeriksaan terhadap: 1. Bahan baku dan bahan tambahan.
Pemeriksaan terhadap bahan baku dan bahan tambahan meliputi pemeriksaan:
a. Pemeriksaan organoleptis, meliputi bentuk, warna, bau dan rasa. b. Pemeriksaan kimia, meliputi pemeriksaan kualitatif, kuantitatif dan
c. Pemeriksaan fisika, meliputi titik lebur, kelarutan dan berat jenis. 2. Bahan pengemas.
Pemeriksaan terhadap bahan pengemas meliputi pemeriksaan: a. Pemeriksaan ukuran dan kebocoran wadah.
b. Pemeriksaan etiket, meliputi ukuran, kebenaran tulisan dan lambang, desain dan warna.
2.3.7 Pengawasan Selama Proses (In Process Control/IPC)
Tujuan dilakukan pengawasan selama berlangsungnya proses pengolahan atau Pengawasan Selama Proses (In Process Control/IPC) yaitu untuk mencegah terlanjur diproduksinya obat yang tidak memenuhi spesifikasi. Laboratorium Pengujian Pengawasan Selama Proses (In Process Control/IPC) terletak di area produksi. Pengawasan ini dilakukan dengan cara mengambil contoh dan mengadakan pemeriksaan dan pengujian terhadap produk yang dihasilkan pada tahap-tahap tertentu dari proses pengolahan.
Pengawasan dalam proses pengolahan dilaksanakan oleh 2 pihak, yaitu: 1. Bagian Produksi, yang menjamin bahwa mesin dan peralatan produksi serta
proses yang digunakan akan menghasilkan produk yang memenuhi spesifikasi yang ditetapkan.
Pengawasan Selama Proses (In Process Control/IPC) hendaklah meliputi pengujian parameter kualitas, antara lain:
1. Tablet: pemerian, kadar air, bobot rata-rata, bobot satuan, kadar bahan aktif, kekerasan, friabilitas, waktu hancur dan disolusi.
2. Kapsul: pemerian, bobot rata-rata, bobot satuan, kadar bahan aktif, waktu hancur dan disolusi.
3. Krim dan Salep: pemerian, pH, bobot rata-rata, homogenitas dan kadar bahan aktif.
2.3.8 Pengawasan Selama Pengemasan
Pengawasan dalam proses pengemasan hendaklah meliputi pemeriksaan parameter kualitas, antara lain:
1. Kerapatan tutup wadah seperti tutup botol dan tutup tube. 2. Jumlah satuan produk dalam kemasan.
3. Kebenaran dan kebersihan bahan pengemas yang dipakai.
4. Kerapian pengemasan, penulisan Nomor Bets (Batch), tanggal kadaluarsa. 5. Kebocoran produk yang dikemas dalam strip.
2.3.9 Uji Stabilitas
Program pengujian stabilitas hendaklah dipatuhi dan mencakup jumlah contoh dan jadwal pengujian, kondisi penyimpanan, metode pengujian, dan pengujian dalam kemasan yang sama dengan kemasan obat yang dipasarkan.
Pengujian stabilitas produk obat hendaklah dilakukan dengan cara:
1. Pengujian jangka panjang mutu produk obat untuk suatu jangka waktu yang ditentukan, terbagi dalam beberapa interval: minimal setiap tiga bulan untuk tahun pertama, setiap enam bulan untuk tahun kedua, serta selanjutnya sekali setiap tahun dan dengan kondisi penyimpanan tertentu, misalnya suhu 30oC kurang lebih 2oC, kelembaban relatif 60% kurang lebih 5%. Khususnya bahan baku aktif/produk jadi yang peka terhadap panas hendaklah disimpan pada suhu yang lebih rendah, yang pada akhirnya akan ditetapkan menjadi suhu penyimpanan jangka panjang. Lama periode pengujian biasanya ditentukan oleh masa edar yang diperkirakan bagi produk tersebut.
2. Pengujian dipercepat mutu produk selama 3 sampai 6 bulan terbagi sedikitnya dalam empat interval waktu dengan kondisi yang diperberat, seperti temperatur dan kelembaban tinggi, pemaparan cahaya dan sebagainya. Dengan cara pengujian stabilitas dipercepat, laju penguraian obat dapat diperkirakan dan stabilitas produk dapat diramalkan untuk kondisi penyimpanan tertentu, yakni 10oC di atas suhu penyimpanan jangka
2.3.10 Pengolahan Limbah
Pengolahan limbah yang ada di Industri P.T. Kimia Farma (Persero) Tbk. Plant Medan diantaranya:
1. Pengolahan Limbah Cair
Sumber limbah cair berasal dari air cucian atau bilasan di ruang produksi dan air cucian atau bilasan alat-alat di laboratorium.
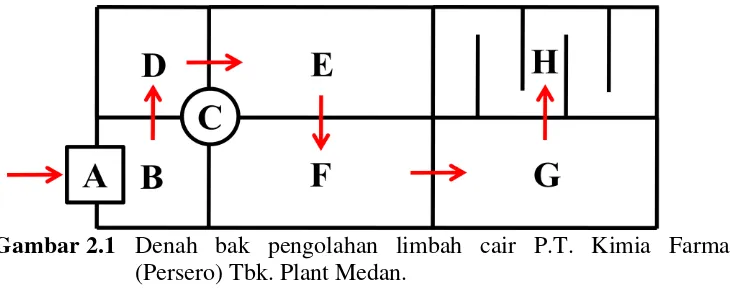
Gambar 2.1 Denah bak pengolahan limbah cair P.T. Kimia Farma (Persero) Tbk. Plant Medan.
Keterangan gambar: A = Saluran masuk B = Bak penampung C = Mesin pompa D = Bak Netralisasi E = Bak Aerasi I F = Bak Aerasi II G = Bak Sedimentasi H = Bak Biokontrol
Proses pengolahan limbah cair yaitu:
b. Selanjutnya dipompakan dengan Mesin Pompa (C) ke Bak Netralisasi (D).
c. Pada Bak Netralisasi (D) bila perlu, ditambahkan air kapur untuk menetralkan limbah cair yang dikeluarkan. Selanjutnya limbah cair yang telah netral dialirkan ke Bak Aerasi I (E)
d. Pada Bak Aerasi I (E) dilakukan aerasi dengan menggunakan aerator yang bertujuan untuk menginjeksikan udara ke dalam bak tersebut supaya bakteri aerob yang terdapat dalam bak tersebut dapat melakukan penguraian bahan-bahan organik yang terdapat dalam limbah cair tersebut. Selanjutnya juga dialirkan ke Bak Aerasi II (F). e. Pada Bak Aerasi II (F) juga mendapat perlakuan yang sama dimana
dilakukan aerasi dengan menggunakan aerator yang bertujuan untuk menginjeksikan udara ke dalam bak tersebut supaya bakteri aerob yang terdapat dalam bak tersebut dapat melakukan penguraian bahan-bahan organik yang terdapat dalam limbah cair tersebut. Lalu dialirkan ke Bak Sedimentasi (G).
f. Pada Bak Sedimentasi (G), limbah cair tersebut didiamkan atau diendapkan beberapa hari selanjutnya dialirkan ke Bak Biokontrol (H).
g. Pada Bak Biokontrol (H), dilakukan pengujian terhadap hasil pengolahan limbah cair tersebut berupa nilai BOD (Biological Oxygen Demand) dan COD (Chemical Oxygen Demand) bila telah memenuhi
Oxygen Demand) maka limbah cair yang telah diolah tersebut dapat
dibuang ke lingkungan. 2. Pengolahan Limbah Padat
Sumber limbah padat berasal dari:
a. Debu yang pada Pengumpul Debu (Dust Collector) di ruang produksi.
b. Debu yang berasal dari Pembersih Vakum (Vacuum Cleaner) yang digunakan untuk membersihkan ruangan produksi dan alat produksi.
c. Wadah dan etiket yang rusak dari bagian pengemasan. Untuk tube sebelum dimusnahkan harus digunting terlebih dahulu.
d. Bahan-bahan yang tidak memenuhi spesifikasi ataupun yang telah rusak yang berasal dari bagian gudang.
Semua limbah padat tersebut dibakar oleh petugas dan sisa pembakaran tersebut dibuang ke tempat pembuangan akhir.
2.4 Cara Pembuatan Obat yang Baik (CPOB) 2.4.1 Manajemen Mutu (Pemastian Mutu)
ini seperti desain dan pengembangan produk. Sistem pemastian mutu yang benar dan tepat bagi industri farmasi hendaklah memastikan bahwa:
1. Desain dan pengembangan obat dilakukan dengan memperhatikan persyaratan Cara Pembuatan Obat yang Baik (CPOB) dan semua langkah produksi dan pengendalian diuraikan secara jelas.
2. Tanggung jawab manajerial diuraikan dengan jelas dalam uraian jabatan. 3. Pengaturan disiapkan untuk pembuatan pasokan dan penggunaan bahan
awal dan pengemas yang benar.
4. Semua pengawasan terhadap produk antara dan Pengawasan Selama Proses (In Process Control/IPC) lainnya memenuhi persyaratan yang ditetapkan. 5. Pengkajian terhadap semua dokumen yang terkait dengan proses
pengemasan dan pengujian Bets (Batch) dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi. Penilaian hendaklah meliputi semua faktor yang relevan termasuk kondisi pembuatan, hasil dan Pengawasan Selama Proses (In Process Control/IPC), pengkajian dokumen produksi termasuk pengemasan, pengkajian penyimpangan dari prosedur yang telah ditetapkan, pemenuhan persyaratan dari spesifikasi produk jadi dan pemeriksaan produk dalam kemasan akhir.
7. Tersedia pengaturan yang memadai untuk memastikan bahwa sedapat mungkin produk disimpan, didistribusikan dan selanjutnya ditangani sedemikian rupa agar mutu tetap dijaga selama masa edar atau masa simpan obat.
8. Tersedia prosedur inspeksi diri dan audit mutu yang secara berkala mengevaluasi efektivitas dan penerapan sistem pemastian mutu.
9. Pemasok bahan awal dan bahan pengemas dievaluasi dan disetujui untuk memenuhi spesifikasi mutu yang telah ditentukan oleh perusahaan.
10. Penyimpangan dilaporkan, diselidiki dan dicatat.
11. Tersedia sistem persetujuan terhadap perubahan yang berdampak pada mutu produk.
12. Prosedur pengolahan ulang dievaluasi dan disetujui.
13. Evaluasi mutu produk berkala dilakukan untuk verifikasi konsistensi proses dan memastikan perbaikan proses yang berkesinambungan.
Cara Pembuatan Obat yang Baik (CPOB) adalah bagian dari Pemastian Mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk.
Persyaratan dasar dari Cara Pembuatan Obat yang Baik (CPOB) adalah: 1. Semua proses pembuatan obat dijabarkan dengan jelas, dikaji secara
2. Tahap proses yang kritis dalam pembuatan, pengawasan proses dan sarana penunjang serta perubahannya yang signifikan divalidasi.
3. Tersedia semua sarana yang diperlukan dalam Cara Pembuatan Obat yang Baik (CPOB) termasuk:
a. Personil yang terkualifikasi dan terlatih.
b. Bangunan dan sarana dengan luas yang memadai. c. Peralatan dan sarana penunjang yang sesuai. d. Bahan, wadah dan label yang benar.
4. Prosedur dan instruksi yang disetujui dan tempat penyimpanan serta sarana transportasi yang memadai.
5. Prosedur dan instruksi ditulis dalam bentuk instruksi dengan bahasa yang jelas, tidak bermakna ganda, dapat diterapkan secara spesifik pada sarana yang tersedia.
6. Operator memperoleh pelatihan untuk menjalankan prosedur secara benar. 7. Pencatatan dilakukan secara manual atau dengan alat pencatat selama
pembuatan yang menunjukkan bahwa semua langkah yang dipersyaratkan dalam prosedur dan instruksi yang ditetapkan benar-benar dilaksanakan dan jumlah serta mutu produk yang dihasilkan sesuai dengan yang diharapkan. 8. Tiap penyimpangan dicatat secara lengkap dan diinvestigasi.
9. Catatan pembuatan termasuk distribusi yang memungkinkan penelusuran riwayat Bets (Batch) secara lengkap, disimpan secara komprehensif dan dalam bentuk yang mudah diakses.
11. Tersedia sistem penarikan kembali Bets (Batch) obat manapun dari peredaran.
12. Keluhan terhadap produk yang beredar dikaji, penyebab cacat mutu diinvestigasi serta dilakukan tindakan perbaikan yang tepat dan pencegahan pangulangan kembali keluhan.
2.4.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip Cara Pembuatan Obat yang Baik (CPOB) dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan.
Personil Kunci mencakup Kepala Bagian Produksi, Kepala Bagian Pengawasan Mutu dan Kepala Bagian Manajemen Mutu (Pemastian Mutu). Posisi utama tersebut dijabat oleh personil purna waktu. Kepala Bagian Produksi dan Kepala Bagian Manajemen Mutu (Pemastian Mutu) serta Kepala Bagian Pengawasan Mutu harus independen satu terhadap yang lain.
Bagian Produksi hendaklah diberi kewenangan dan tanggung jawab penuh dalam produksi obat.
Kepala Bagian Pengawasan Mutu hendaklah seorang Apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga memungkinkan untuk melaksanakan tugas secara profesional. Kepala Bagian Pengawasan Mutu hendaklah diberi kewenangan dan tanggung jawab penuh untuk melaksanakan tugas yang berhubungan pengawasan mutu obat selama proses produksi.
Kepala Bagian Manajemen Mutu (Pemastian Mutu) hendaklah seorang Apoteker yang terdaftar dan terkualifikasi, memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan Manajerial sehingga memungkinkan untuk melaksanakan tugas secara profesional. Kepala Bagian Manajemen Mutu (Pemastian Mutu) hendaklah diberi kewenangan dan tanggung jawab penuh untuk melaksanakan tugas yang berhubungan dengan sistem mutu atau pemastian mutu.
tinggi, toksis atau yang menimbulkan alergi. Pelatihan hendaknya diberikan oleh orang yang cakap. Dokumen pelatihan harus disimpan dengan baik dan efektifitas program pelatihan hendaknya dinilai secara berkala.
2.4.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat.
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan kontruksi serta letak yang memadai agar memudahkan dalam melaksanakan kerja, pembersihan dan pemeliharaan yang baik. Tiap sarana kerja hendaklah memadai, sehingga setiap resiko terjadinya kekeliruan, pencemaran silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat, dapat dihindarkan.
Dalam menentukan rancang bangun dan penataan gedung hendaklah dipertimbangkan hal-hal berikut:
1. Kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam sarana yang sama atau dalam sarana yang berdampingan.
2. Luasnya ruang kerja, yang memungkinkan penempatan peralatan dan bahan-bahan secara teratur dan logis serta memungkinkan terlaksananya kegiatan, kelancaran arus kerja, komunikasi dan pengawasan yang efektif maupun untuk mencegah kesesakan dan ketidakteraturan.
3. Pencegahan terjadinya penggunaan kawasan produksi sebagai lalu lintas umum bagi karyawan atau bahan-bahan ataupun sebagai tempat penyimpanan kecuali untuk bahan-bahan yang sedang dalam proses.
Rancang bangun dan penataan gedung hendaklah memenuhi persyaratan-persyaratan berikut:
1. Mencegah resiko tercampur baurnya obat atau komponen obat yang berbeda, kemungkinan terjadinya pencemaran silang oleh obat atau bahan-bahan lain serta resiko terlewatnya salah satu langkah dalam proses produksi.
2. Kegiatan pengolahan bahan bagi produk bukan obat dipisahkan dari ruang produksi obat.
3. Disediakan ruang terpisah untuk membersihkan alat yang dapat dipindah-pindahkan dan ruangan untuk menyimpan alat pembersih.
5. Toilet tidak terbuka langsung ke daerah produksi dan dilengkapi dengan ventilasi yang baik.
Untuk kegiatan-kegiatan berikut diperlukan daerah tertentu yaitu: 1. Penerimaan bahan.
2. Karantina barang masuk. 3. Ruang sampling.
4. Penyimpanan bahan awal. 5. Penimbangan dan penyerahan. 6. Pengolahan.
7. Penyimpanan produk ruahan. 8. Pengemasan.
9. Karantina obat jadi selama menunggu pelulusan akhir. 10. Penyimpanan obat jadi.
11. Pengiriman barang. 12. Laboratorium. 13. Pencucian peralatan.
Bangunan hendaklah mendapatkan penerangan yang efektif dan mempunyai ventilasi dengan fasilitas Sistem Pengatur Udara (Air Handling Sistem/AHS) (termasuk suhu, kelembaban dan penyaring) yang sesuai untuk kegiatan dalam bangunan maupun dengan lingkungan sekitarnya.
2.4.4 Peralatan
tepat, agar mutu obat terjamin sesuai dengan desain serta seragam dari Bets (Batch) ke Bets (Batch) dan untuk memudahkan pembersihan serta perawatan.
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki rancang bangun dan kontruksi yang tepat. Permukaan peralatan yang bersentuhan langsung dengan bahan atau produk tidak boleh bereaksi karena dapat merubah identitas, mutu dan kemurnian produk yang dihasilkan, tidak boleh mencemari produk, harus mudah dibersihkan baik bagian dalam maupun bagian luar mesin atau alat tersebut. Peralatan yang digunakan untuk menimbang, mengukur, dan menguji harus diperiksa ketelitiannya secara teratur serta dikalibrasi menurut program dan prosedur yang tepat.
Pemasangan dan penempatan alat harus dapat mencegah terjadinya kontaminasi silang dan cukup renggang untuk memberikan keleluasaan kerja. Saluran air, uap dan udara bertekanan harus diatur dengan baik sehingga kualitas ruangan dan sediaan yang baik dicapai selama kegiatan berlangsung.
Peralatan hendaknya dirawat menurut jadwal agar tetap berfungsi dengan baik dan mencegah pencemaran terhadap produk. Catatan mengenai pelaksanaan, pemeliharaan dan pemakaian suatu peralatan utama hendaklah dicakup dalam buku catatan harian yang menunjukkan Tanggal, Waktu, Kekuatan, Nomor Bets (Batch) produk dan Jumlah Produk yang Dihasilkan yang diolah dengan peralatan tersebut serta pelaksana pembersihan.
2.4.5 Sanitasi dan Higiene
bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
2.4.5.1 Higiene Perorangan
1. Tiap personil yang masuk ke area pembuatan hendaklah mengenakan pakaian pelindung yang sesuai dengan kegiatan yang dilaksanakan.
2. Prosedur higiene perorangan termasuk persyaratan untuk mengenakan pakaian pelindung hendaklah diberlakukan bagi semua personil yang memasuki area produksi, baik karyawan purna waktu, paruh waktu atau bukan karyawan yang berada di area pabrik, misalnya karyawan kontraktor, pengunjung anggota manajemen senior dan inspektur.
3. Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan personil, hendaklah personil mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya termasuk penutup rambut. Pakaian kerja kotor (yang dapat dipakai ulang) hendaklah disimpan dalam wadah tertutup hingga saat pencucian.
pengawasan serta pengemasan. Program higiene hendaklah dipromosikan oleh manajemen dan dibahas secara luas selama sesi pelatihan.
5. Semua personil hendaklah menjalani pemeriksaan kesehatan pada saat direkrut. Industri harus bertanggung jawab agar tersedia instruksi yang memastikan bahwa keadaan kesehatan personil yang dapat mempengaruhi mutu produk diberitahukan kepada manajemen industri. Harus dilakukan pemeriksaan kesehatan personil secara berkala. Petugas pemeriksa visual hendaklah menjalani pemeriksaan mata secara berkala.
6. Semua personil hendaklah menerapkan higiene perorangan yang baik. Hendaklah mereka dilatih mengenai penerapan higiene perorangan. Semua personil yang berhubungan dengan proses pembuatan hendaklah memperhatikan tingkat higiene perorangan yang tinggi.
7. Tiap personil yang mengidap penyakit atau menderita luka terbuka yang dapat merugikan mutu produk hendaklah dilarang menangani bahan awal, bahan pengemas, bahan yang sedang diproses dan obat jadi sampai dia sembuh kembali.
8. Semua personil hendaklah diperintahkan dan didorong inisiatifnya untuk melaporkan kepada atasan langsung tiap keadaan (pabrik, peralatan atau personil) yang menurut penilaian mereka dapat merugikan produk.
10. Personil hendaklah diinstruksikan supaya menggunakan sarana mencuci tangan dan mencuci tangannya sebelum memasuki area produksi. Untuk tujuan itu perlu dipasang poster yang sesuai.
11. Merokok, makan, minum, mengunyah, memelihara tanaman, menyimpan makanan, minuman, bahan untuk merokok atau obat pribadi hanya diperbolehkan di area tertentu dan dilarang dalam area produksi, laboratorium, area gudang dan area lain yang mungkin berdampak terhadap mutu produk.
2.4.5.2 Sanitasi Bangunan dan Fasilitas
1. Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik.
2. Hendaklah tersedia dalam jumlah yang cukup sarana toilet dengan ventilasi yang baik dan tempat cuci bagi personil yang letaknya mudah diakses dari area pembuatan.
3. Hendaklah disediakan sarana yang memadai untuk penyimpanan pakaian personil dan milik pribadinya di tempat yang tepat.
4. Penyiapan, penyimpanan dan konsumsi makanan dan minuman hendaklah dibatasi di area khusus, misalnya kantin. Sarana ini hendaklah memenuhi standar sanitasi.
6. Rodentisida, insektisida, agen fumigasi dan bahan sanitasi tidak boleh mencemari peralatan, bahan awal, bahan pengemas, bahan yang sedang diproses dan/atau produk jadi.
7. Hendaklah ada prosedur tertulis untuk pemakaian rodentisida, insektisida, agen fumigasi, pembersih dan sanitasi yang tepat. Prosedur tertulis tersebut hendaklah disusun dan dipatuhi untuk mencegah pencemaran terhadap peralatan, bahan awal, wadah obat, tutup wadah, bahan pengemas dan label atau produk jadi. Rodentisida, insektisida dan fungisida hendaklah tidak digunakan kecuali yang sudah terdaftar dan digunakan sesuai peraturan terkait.
8. Hendaklah ada prosedur tertulis yang menunjukkan penanggung jawab untuk sanitasi serta menguraikan dengan cukup rinci mengenai jadwal, metode, peralatan dan bahan pembersih yang harus digunakan untuk pembersihan sarana dan bangunan. Prosedur tertulis terkait hendaklah dipatuhi.
9. Prosedur sanitasi hendaklah berlaku untuk pekerjaan yang dilaksanakan oleh kontraktor atau karyawan sementara maupun karyawan purna waktu selama pekerjaan operasional biasa.
10. Segala praktik tidak higiene di area pembuatan atau area lain yang dapat berdampak merugikan terhadap mutu produk, hendaklah dilarang.
2.4.5.3 Pembersihan dan Sanitasi Peralatan
dijaga dan disimpan dalam kondisi yang bersih. Tiap kali sebelum dipakai, kebersihannya diperiksa untuk memastikan bahwa semua produk atau bahan dari Bets (Batch) sebelumnya telah dihilangkan.
2. Metode pembersihan dengan cara vakum atau cara basah lebih dianjurkan. Udara bertekanan dan sikat hendaklah digunakan dengan hati-hati dan sedapat mungkin dihindari karena menambah risiko pencemaran produk. 3. Pembersihan dan penyimpanan peralatan yang dapat dipindah-pindahkan
dan penyimpanan bahan pembersih hendaklah dilaksanakan dalam ruangan yang terpisah dari ruangan pengolahan.
4. Prosedur tertulis yang cukup rinci untuk pembersihan dan sanitasi peralatan serta wadah yang digunakan dalam pembuatan obat hendaklah dibuat, divalidasi dan ditaati. Prosedur ini hendaklah dirancang agar pencemaran peralatan oleh agen pembersih atau sanitasi yang dicegah. Prosedur ini setidaknya meliputi penanggung jawab pembersihan, jadwal, metode, peralatan dan bahan yang dipakai dalam pembersihan serta metode pembongkaran dan perakitan kembali peralatan yang mungkin diperlukan untuk memastikan pembersihan yang benar terlaksana. Jika perlu, prosedur juga meliputi sterilisasi peralatan, penghilangan identitas Bets (Batch) sebelumnya serta perlindungan peralatan yang telah bersih terhadap pencemaran sebelum digunakan.
5. Catatan mengenai pelaksanaan pembersihan, sanitasi dan inspeksi sebelum penggunaan peralatan hendaklah disimpan secara benar.
sebelumnya telah dibersihkan dan hendaklah disimpan untuk jangka waktu tertentu kecuali bila disterilkan.
2.4.5.4 Validasi Prosedur Pembersihan dan Sanitasi
Prosedur pembersihan sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk memastikan efektivitas prosedur memenuhi persyaratan.
2.4.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan Cara Pembuatan Obat yang Baik (CPOB) yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Prosedur produksi hendaklah dibuat oleh penanggung jawab produksi bersama-sama penanggung jawab pengawasan mutu. Setiap penyimpangan prosedur yang telah ditetapkan hendaknya dicatat pada Catatan Bets (Batch) dan bila perlu proses produksi setiap Bets (Batch) sebelumnya dievaluasi kembali.
2.4.6.1 Bahan Awal
1. Setiap pemasukan, pengeluaran dan sisa bahan harus dilakukan pencatatan. 2. Pada saat diterima harus diperiksa keutuhan kemasan dan kebenaran label
3. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaklah memenuhi spesifikasi bahan awal yang sudah ditetapkan yang diberi label dengan nama yang dinyatakan dalam spesifikasi.
4. Bahan awal yang mengalami kerusakan oleh suhu disimpan di tempat yang suhu udaranya diatur.
5. Bahan awal yang mudah terurai atau menurun potensinya harus dinyatakan batas waktu penggunaannya.
6. Penyimpanan hendaklah dilakukan dalam ruangan atau tempat yang suhunya diatur dan disesuaikan dengan sifat fisik dan kimia bahan tersebut. 7. Persediaan bahan awal diperiksa dalam selang waktu tertentu untuk
menyakinkan bahwa wadahnya tertutup rapat, bertanda yang benar dan dalam kondisi yang baik pemeriksaan laboratorium kembali dilakukan sesuai prosedur yang ditentukan.
8. Semua bahan awal yang tidak memenuhi syarat ditandai dengan jelas, di tempatkan terpisah dan secepatnya dikembalikan ke pemasok atau dimusnahkan.
2.4.6.2 Validasi Prosedur
Perubahan penting dalam proses, peralatan atau bahan hendaklah disertai dengan validasi ulang, untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditentukan.
2.4.6.3 Pencemaran
Pencemaran kimiawi atau mikroba terhadap suatu obat yang dapat merugikan kesehatan atau mengurangi daya terapeutik atau mempengaruhi kualitas suatu produk, tidak dapat diterima. Perhatian khusus hendaklah diberikan pada masalah pencemaran silang, karena sekalipun sifat dan tingkatannya tidak berpengaruh langsung pada kesehatan, hal ini menunjukkan pelaksanaan pembuatan obat yang tidak sesuai dengan Cara Pembuatan Obat yang Baik (CPOB). Tindakan pencegahan terhadap pencemaran silang dan efektifitasnya hendaklah diperiksa secara berkala misalnya dengan pemeriksaan rutin pada saringan udara, pemeriksaan lingkungan, dan pemeriksaan perbedaan tekanan antar ruang terutama ruang penyangga.
2.4.6.4 Sistem Penomoran Bets (Batch)
2.4.6.5 Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, produk antara, produk ruahan dan produk jadi harus dilakukan dan didokumentasikan sesuai dengan prosedur yang telah ditetapkan. Sebelum dilakukan penimbangan harus dilakukan pemeriksaan kebenaraan penandaan termasuk hasil pemeriksaan laboratorium. Untuk menghindari terjadinya kontaminasi silang, dan hilangnya identitas maka bahan awal, produk antara, dan produk ruahan yang ada di daerah penyerahan hanya boleh untuk satu Bets (Batch) saja.
2.4.6.6 Pengolahan
Semua bahan yang digunakan dalam pengolahan harus diperiksa lebih dahulu. Hendaklah tidak memasukkan bahan lain selain bahan untuk Bets (Batch) yang sedang diolah tersebut. Pemantauan kondisi area pengolahan dan langkah yang harus dilakukan sebelum memulai proses pengolahan sebaiknya menggunakan suatu daftar periksa yang mencakup, antara lain: kondisi daerah pengolahan harus dipantau dan dikendalikan sesuai persyaratan yang telah ditetapkan dan peralatan harus dinyatakan bersih secara tertulis sebelum digunakan. Kegiatan pengolahan harus mengikuti Prosedur Tetap (ProTap), dan tiap penyimpangan harus segera dilaporkan kepada supervisor dan didokumentasikan di dalam catatan pengolahan Bets (Batch).
2.4.6.7 Pengawasan Selama Proses (In Process Control/IPC)
yang diambil untuk pemeriksaan. Hasil pengujian Pengawasan Selama Proses (In Process Control/IPC) harus dicatat dan didokumentasikan.
Pengawasan mutu selama proses produksi atau Pengawasan Selama Proses (In Process Control/IPC) dilakukan untuk:
1. Sediaan padat, meliputi: pemeriksaan kadar zat aktif, pemeriksaan keseragaman bobot untuk tablet dan kapsul, dilakukan beberapa kali selama proses produksi, pemeriksaan waktu hancur, kekerasan tablet (kadar air), sample diambil pada waktu permulaan, pertengahan, dan akhir pencetakan tablet.
2. Sediaan setengah padat, meliputi: keseragaman dan homogenitas obat, pemeriksaan ukuran partikel, pemeriksaan tampilan, viskositas, berat jenis, pemeriksaan berat, pemeriksaan kebocoran tube (wadah).
2.4.6.8 Pengemasan
Kegiatan pengemasan berfungsi mengemas produk ruahan menjadi produk jadi. Proses pengemasan hendaklah dilaksanakan dibawah pengawasan ketat untuk menjaga identitas, keutuhan, dan kualitas barang yang sudah dikemas. Sebelum kegiatan pengemasan dimulai hendaklah dilakukan pemeriksaan untuk memastikan bahwa peralatan dan ruang kerja dalam keadaan bersih dan bebas dari produk dan sisa produk lain atau dokumen yang tidak diperlukan untuk kegiatan yang dilakukan.
Pada penyelesaian proses pengemasan produk yang sudah dikemas hendaklah diperiksa dengan teliti untuk memastikan bahwa produk obat tersebut sesuai dengan persyaratan dalam prosedur pengemasan induk. Hanya obat jadi yang berasal dari satu Bets (Batch) pengemasan saja yang boleh di tempatkan pada satu area. Bila ada karton yang tidak penuh maka jumlah yang ada di dalamnya hendaklah dituliskan pada karton tersebut.
Produk dalam status karantina hendaklah diberi label “Karantina” dan
disimpan dalam rak khusus untuk karantina atau di tempat yang diberi tanda khusus sehingga mudah dibedakan dengan produk yang telah diluluskan.
2.4.6.9 Penyimpanan Bahan Awal, Produk Antara, Produk Ruahan, dan Obat Jadi
Semua bahan hendaklah disimpan secara rapi dan teratur untuk mencegah resiko tercampur atau beresiko terjadinya pencemaran serta memudahkan pemeriksaan dan pemeliharaan. Semua bahan ini disimpan dengan jarak yang cukup terhadap bahan lainnya maupun terhadap dinding, tidak diletakkan di lantai, dan dalam kondisi lingkungan yang sesuai. Penyimpanan di luar gudang diperbolehkan bagi bahan yang dikemas dalam wadah kedap yang mutunya tidak terpengaruh oleh suhu, kelembaban dan faktor lainnya. Bahan yang mudah terbakar hendaklah disimpan di gudang khusus yang letaknya terpisah sesuai dengan peraturan yang berlaku.
2.4.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang penting dari Cara Pembuatan Obat yang Baik (CPOB) agar tiap obat yang dibuat memenuhi persyaratan mutu yang sesuai dengan tujuan penggunaannya. Rasa keterikatan dan tanggung jawab semua unsur dalam semua rangkaian pembuatan adalah mutlak untuk menghasilkan obat yang bermutu mulai dari saat obat dibuat sampai pada distribusi obat jadi. Untuk keperluan tersebut harus ada suatu Bagian Pengawasan Mutu yang berdiri sendiri.
Sistem pengawasan mutu hendaklah dirancang dengan tepat untuk menjamin bahwa tiap obat mengandung bahan dengan mutu yang benar dan jumlah yang ditetapkan dan dibuat pada kondisi yang tepat dan mengikuti Prosedur Tetap (ProTap) sehingga obat tersebut senantiasa memenuhi spesifikasi yang telah ditetapkan mengenai identitas, kadar, kemurnian mutu, dan keamanannya.
Pengawasan mutu meliputi semua fungsi analisa yang dilakukan laboratorium termasuk pengambilan contoh, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan, dan obat jadi. Pengawasan mutu juga meliputi program uji stabilitas, pemantauan lingkungan kerja, validasi, dokumentasi suatu Bets (Batch), program penyimpanan contoh dan penyusunan serta penyimpanan spesifikasi yang berlaku dari tiap bahan dan produk termasuk metode pengujiannya.
2. Menyiapkan intruksi tertulis yang rinci untuk setiap pemeriksaan dan pengujian.
3. Menyusun rencana dan prosedur tertulis mengenai pengambilan contoh untuk pemeriksaan.
4. Menyimpan contoh pertinggal untuk rujukan dimasa mendatang.
5. Meluluskan atau menolak tiap Bets (Batch) bahan awal, produk antara, produk ruahan, dan obat jadi serta hal-hal lain yang telah ditentukan.
6. Meneliti catatan yang berhubungan dengan pengolahan, pengemasan, dan pengujian obat jadi Bets (Batch) yang bersangkutan sebelum meluluskannya untuk didistribusikan.
7. Mengevaluasi stabilitas semua obat jadi secara berlanjut, bahan awal jika diperlukan, dan menyiapkan intruksi mengenai cara penyimpanan bahan awal dan obat jadi dipabrik berdasarkan data stabilitas yang ada.
8. Menetapkan tanggal kadaluarsa dan batas waktu penggunaan bahan awal dan obat jadi berdasarkan data stabilitas dan kondisi penyimpanannya. 9. Mengevaluasi dan menyetujui prosedur pengolahan ulang suatu produk. 10. Menyetujui penunjukkan pemasok bahan baku dan bahan pengemas yang
diketahui dapat dipercayai mampu atau dapat diandalkan untuk memasok bahan awal yang memenuhi spesifikasi mutu yang telah ditetapkan.
11. Mengambil bagian atau memberikan bantuan dalam pelaksanaan program validasi.
13. Menyediakan baku pembanding sekunder sesuai spesifikasi yang terdapat pada prosedur pengujian yang berlaku dan menyimpan baku pembanding ini pada kondisi yang tepat.
14. Menyimpan catatan pemeriksaan dan pengujian semua contoh yang diambil. 15. Mengevaluasi obat yang dikembalikan dan menetapkan apakah obat
tersebut diproses ulang atau harus dimusnahkan.
16. Ikut dalam program inspeksi diri bersama bagian lain dalam perusahaan. 17. Memberikan rekomendasi untuk pembuatan obat oleh pihak lain atas dasar
kontrak setelah diadakan evaluasi terhadap kontraktor yang bersangkutan di nilai mampu membuat obat yang memenuhi standar mutu yang ditetapkan.
2.4.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk melakukan penilaian apakah seluruh aspek produksi dan pengendaliaan mutu senantiasa memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang untuk mencari kelemahan dalam pelaksanaan Cara Pembuatan Obat yang Baik (CPOB) dan untuk menetapkan tindakan perbaikannya. Inspeksi diri ini hendaklah dilaksanakan secara teratur. Tindakan perbaikan yang disarankan hendaklah dilaksanakan. Untuk pelaksanaan inspeksi diri ditunjuk tim inspeksi yang mampu menilai secara objektif pelaksanaan Cara Pembuatan Obat yang Baik (CPOB). Prosedur dan catatan mengenai inspeksi diri hendaklah dibuat.
1. Karyawan.
2. Bangunan termasuk fasilitas untuk karyawan. 3. Penyimpanan bahan awal dan bahan jadi. 4. Peralatan.
5. Produksi.
6. Pengawasan mutu. 7. Dokumentasi.
8. Pemeliharaan gedung dan peralatan.
Tim inspeksi diri ditunjuk oleh pimpinan perusahaan terdiri dari sekurang-kurangnya tiga orang yang ahli dibidang yang berlainan dan paham mengenai Cara Pembuatan Obat yang Baik (CPOB). Anggota tim dapat berasal dari lingkungan perusahaan atau dari luar lingkungan perusahaan. Tiap anggota tim hendaklah bebas dalam memberikan penilaian atas hasil inspeksi.
2.4.9 Penanganan Keluhan Terhadap produk, Penarikan Kembali Produk dan Produk Kembalian
Keluhan dan laporan dapat menyangkut kualitas, efek samping yang merugikan atau masalah medis lainnya. Semua keluhan dan laporan hendaklah diselidiki dan dievaluasi serta diambil tindak lanjut yang sesuai.
seluruh obat jadi tertentu dapat merupakan tindak lanjut penghentian pembuatan satu jenis obat jadi yang bersangkutan.
2.4.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi manajemen, yang meliputi: spesifikasi, prosedur, metode dan instruksi, catatan dan laporan serta jenis dokumentasi lain yang diperlukan dalam perencanaan, pelaksanaan, pengendalian, serta evaluasi seluruh rangkaian kegiatan pembuatan obat. Sistem dokumentasi hendaklah menggambarkan riwayat lengkap dari setiap Bets (Batch) produk sehingga memungkinkan penyelidikan serta penelusuran terhadap Bets (Batch) produk yang bersangkutan. Sistem dokumentasi diperlukan pula dalam pemantauan dan pengendalian, misalnya kondisi lingkungan, perlengkapan dan personalia.
2.4.11 Pembuatan dan Analisis Berdasarkan Kontrak 2.4.11.1 Umum
1. Hendaklah dibuat kontrak tertulis yang meliputi pembuatan dan atau analisis obat yang dikontrakkan dan semua pengaturan teknis terkait.
2. Semua pengaturan untuk pembuatan dan analisis berdasarkan kontrak termasuk usul perubahan dalam pengaturan teknis atau pengaturan lain hendaklah sesuai dengan izin edar untuk produk yang bersangkutan.
2.4.11.2 Pemberi Kontrak
1. Pemberi kontrak bertanggung jawab untuk menilai kompetensi penerima kontrak dalam melaksanakan pekerjaan atau pengujian yang diperlukan dan memastikan bahwa prinsip dan pedoman Cara Pembuatan Obat yang Baik (CPOB) diikuti.
2. Pemberi kontrak hendaklah menyediakan semua informasi yang diperlukan kepada penerima kontrak untuk melaksanakan pekerjaan kontrak secara benar sesuai izin edar dan persyaratan legal lain.
2.4.11.3 Penerima Kontrak
1. Penerima kontrak harus mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman dan personil yang kompeten untuk melakukan pekerjaan yang diberikan oleh pemberi kontrak dengan memuaskan. Pembuatan obat berdasarkan kontrak hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat Cara Pembuatan Obat yang Baik (CPOB) yang diterbitkan oleh Otoritas Pengawasan Obat (OPO).
2. Penerima kontrak hendaklah memastikan bahwa semua produk dan bahan yang diterima sesuai dengan tujuan penggunaannya.
2.4.11.4 Kontrak
2.4.12 Kualifikasi dan Validasi 2.4.12.1 Kualifikasi
Validasi untuk mesin, peralatan produksi dan sarana penunjang disebut dengan kualifikasi. Jadi, kualifikasi adalah istilah yang digunakan untuk validasi mesin, peralatan produksi maupun sarana penunjang. Kualifikasi mesin, peralatan produksi maupun sarana penunjang merupakan langkah pertama (first step) dalam pelaksanakan validasi di industri farmasi.
Kualifikasi adalah “Kegiatan Pembuktian” bahwa perlengkapan fasilitas
atau sistem yang digunakan dalam suatu proses atau sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten. Kualifikasi peralatan merupakan identitas sifat suatu peralatan yang berkaitan dengan kinerja dan fungsinya serta pemberian batasan nilai tertentu terhadap identitas atau sifat tersebut.
Validasi atau kualifikasi mesin, peralatan produksi dan sarana penunjang terdiri dari 4 tingkatan, yaitu:
1. Kualifikasi Desain.
2. Kualifikasi Instalasi.
Tujuan Kualifikasi Instalasi adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang diinstalasi atau dipasang sesuai dengan spesifikasi yang tertera pada dokumen pembelian, buku manual alat yang bersangkutan dan pemasangannya dilakukan memenuhi spesifikasi yang telah ditetapkan. Jadi Kualifikasi Instalasi dilaksanakan pada saat pemasangan atau instalasi peralatan produksi atau sarana penunjang.
3. Kualifikasi Operasional.
Tujuan dari Kualifikasi Operasional adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan spesifikasi yang diinginkan. Jadi Kualifikasi Operasional dilaksanakan setelah pemasangan atau instalasi mesin atau peralatan produksi atau sarana penunjang dan digunakan sebagai mesin atau peralatan percobaan.
4. Kualifikasi Kinerja.
Tujuan dari Kualifikasi Kinerja adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan spesifikasi yang diinginkan dengan cara menjalankan sistem sesuai dengan tujuan penggunaan.
2.4.12.2 Validasi
Validasi adalah tindakan pembuktian yang didokumentasi dengan cara-cara yang sesuai bahwa tiap bahan, prosedur, kegiatan, sistem, dan perlengkapan yang digunakan dalam produksi dan pengawasan mutu akan senantiasa mencapai hasil yang diinginkan.
Cara-cara pelaksanaan validasi terbagi empat yaitu: 1. Validasi Prospektif (Prospective Validation).
Validasi Prospektif adalah validasi berdasarkan pada perolehan data pertama sesuai protokol validasi yang direncanakan. Validasi ini berlaku untuk produk yang belum beredar.
2. Validasi Konkuren (Concurrent Validation).
Validasi Konkuren adalah validasi yang berdasarkan data otentik yang diperoleh dan dikumpulkan dari proses yang sedang dilaksanakan. Validasi ini berlaku pada produk yang sedang beredar.
3. Validasi Retrospektif (Retrospective Validation).
Validasi Retrospektif adalah validasi yang berdasarkan data otentik yang diperoleh dan dikumpulkan dari proses yang sudah dilaksanakan dan dinilai menurut prinsip statistik. Validasi ini berlaku pada produk yang sudah beredar.
4. Validasi Ulang (Revalidation).
2.4.12.3 Validasi Prosedur Analitik
Validasi Prosedur Analitik merupakan proses yang dilakukan melalui penelitian laboratorium untuk membuktikan bahwa karakteristik kinerja prosedur itu memenuhi persyaratan aplikasi analitik yang dimaksudkan. Jenis prosedur analitik yang harus divalidasi pada umumnya adalah uji identifikasi, uji kuantitatif komponen terpilih lainnya dalam suatu produk obat, uji kuantitatif kandungan cemaran, dan uji batas untuk mengendalikan jumlah cemaran.
2.4.12.4 Validasi Berkala
Bagian Pengawasan Mutu hendaklah memberikan bantuan yang diperlukan atau mengambil bagian dalam pelaksanaan validasi berkala oleh bagian lain, khususnya bagian produksi untuk menjamin bahwa setiap produk yang dihasilkan senantiasa memenuhi spesifikasi yang telah ditetapkan.
2.4.12.5 Langkah-Langkah Pelaksanaan Validasi
Begitu luasnya cakupan validasi, terkadang membingungkan kalangan praktisi di industri farmasi untuk melaksanakannya. Administrasi Makanan dan Obat (Food and Drug Administration/FDA) dalam Pedoman Prinsip Umum Validasi Proses (Guideline on General Principles of Process Validation) memberikan langkah-langkah dalam pelaksanaan validasi, yang tertuang dalam Siklus Hidup Validasi (Validation Life Cycle) berikut ini, yaitu: