PENGARUH PENAMBAHAN RAGI ROTI DAN LAMA WAKTU
FERMENTASI TERHADAP GLUKOSA HASIL HIDROLISIS
SELULOSA AMPAS TEBU (Saccharum officanarum)
DENGAN HCl 30% DALAM PEMBUATAN
BIOETANOL
SKRIPSI
FERI SUSANTO
080802063
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH PENAMBAHAN RAGI ROTI DAN LAMA WAKTU
FERMENTASI TERHADAP GLUKOSA HASIL HIDROLISIS
SELULOSA AMPAS TEBU (Saccharum officanarum)
DENGAN HCl 30% DALAM PEMBUATAN
BIOETANOL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
FERI SUSANTO
080802063
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH PENAMBAHAN RAGI ROTI DAN
LAMA WAKTU FERMENTASI TERHADAP GLUKOSA HASIL HIDROLISIS SELULOSA AMPAS TEBU (Saccharum Officanarum) DENGAN HCl 30% DALAM PEMBUATAN BIOETANOL
Kategori : SKRIPSI
Nama : FERI SUSANTO
Nomor Induk Mahasiswa : 080802063
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2012
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Yuniarti Yusak,MS DR. Rumondang Bulan, MS NIP. 194901271980022001 NIP.195408301985032001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH PENAMBAHAN RAGI ROTI DAN LAMA WAKTU
FERMENTASI TERHADAP GLUKOSA HASIL HIDROLISIS
SELULOSA AMPAS TEBU (Saccharum officanarum)
DENGAN HCl 30% DALAM PEMBUATAN
BIOETANOL
SKRIPSI
Saya mengakui bahwa karya skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2012
PENGHARGAAN
Alhamdulillahirabbil’alamin... Inilah kalimat indah untuk-Mu Ya Allah, kalimat yang menandakan rasa syukur ku sebagai hamba-Mu atas nikmat dan karunia yang tak henti-hentinya Engkau berikan. Sholawat dan salam untuk junjungan Nabi Muhammad SAW. Penulis mengakui setulus-tulusnya bahwa banyak pihak yang telah memberikan dorongan, bimbingan, semangat dan saran dalam penyelesaian penulisan skripsi ini yang berjudul “Pengaruh Penambahan Ragi Roti dan Lama Waktu Fermentasi Terhadap Glukosa Hasil Hidrolisis Selulosa Ampas Tebu
(Saccharum Officanarum) Dengan HCl 30% Dalam Pembuatan Bioetanol” dalam rangka memenuhi persyaratan untuk memperoleh gelar sarjana pada program studi Kimia FMIPA USU. Oleh karena itu penulis menyampaikan penghargaan dan ucapan terima kasih sebesar-besarnya kepada : Ayahanda tercinta Sudirman dan Ibunda Zahara atas doa yang tiada henti, kesabaran dan kasih sayang yang tulus serta dukungan moril dan materil sehingga Ananda dapat mempersembahkan sebuah karya sebagai penyejuk hati. Kepada abang, kakak, dan keponakanku yang selalu memberikan tawa saat bersama dalam keluarga.
Penulis mengucapkan ribuan terima kasih atas segala kebesaran dan ketulusan hati yang telah memberikan saran, membimbing dan mengarahkan penulis dalam penyelesaian skripsi ini serta untuk ilmu yang penulis dapatkan selama perkuliahan kepada : ibu Dr. Rumondang Bulan, MS, selaku Ketua Jurusan dan sebagai dosen pembimbing I dan ibu Dr. Yuniarti Yusak, MS, sebagai dosen pembimbing II, Bapak Drs. Albert Pasaribu, M.Sc selaku Sekretaris Jurusan Kimia, Bapak Drs. Firman Sebayang, MS, selaku kepala Laboratorium Biokimia/Kimia Bahan Makanan, Bapak Dr. Ribu Surbakti, MS dan Ibu Dra. Emma Zaidar, M.Si, sebagai dosen biokimia, Bapak Prof. Basuki Wirjosentono,Ph.D, sebagai dosen wali serta bapak ibu dosen berserta semua staf Departemen Kimia FMIPA USU.
Dan tak lupa juga penulis mengucapkan terima kasih kepada keluarga Biokimia (Tiwi, Icha, Yhaya, Arau, Ari, Tika, Putri, Echa dan Saiful) serta Kak Pia dan Kak Vika yang telah banyak membantu dan memberikan semangat kepada penulis dalam penyelesaian skripsi ini. Sahabat-sahabat terbaikku (Jaka, Zefry, Jandri, Yohannes, Siti, Juju, Feby, Bethsy, Erin, Reni, Ria). Kawan-kawan seperjuangan stambuk 2008 yang banyak membantu Arif, Andreas, Enka, Bayu, Firman, Elisa, Tya. Dan untuk Nurul atas dukungan dan semangat kepada penulis. Kakak, Abang dan adik-adik satu almamater yang telah menjalin kerja sama, saling bertukar pikiran selama kuliah untuk menuju puncak keberhasilan bersama.
ABSTRAK
THE INFLUENCE ADDED BAKER YEAST AND PERIODS OF FERMENTATION TOWARD GLUCOSE YIELD
HYDROLYSIS CELLULOSE SUGARCANE BAGASSE WITH HCl 30% TO MAKE
BIOETHANOL
ABSTRACT
DAFTAR ISI
1.2 Perumusan Masalah 3
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 4
1.6 Lokasi Penelitian 4
1.7 Metodologi Penelitian 4
Bab II Tinjauan Pustaka 6
2.1 Tanaman Tebu 6
2.3 Analisa Kualitatif dan Kuantitatif Gula Pereduksi 15
2.3.1 Analisa Kualitatif Gula Pereduksi 15
2.3.1.1 Uji Molisch 15
2.3.1.2 Uji Seliwanof 15
2.3.1.3 Uji Anthrone 16
2.3.2.1 Metode Luff-Schroll 17
2.3.2.2 Metode Munson Walker 18
2.3.2.3 Metode Lane-Eynon 19
2.4 Glikolisis 19
2.5 Fermentasi 21
2.6 Ragi 22
2.6.1 Faktor-faktor yang Mempengaruhi Kehidupan Ragi 22
2.7 Bioetanol 23
Bab III Metoda Penelitian 25
3.1 Alat dan Bahan 25
3.1.1 Alat-alat 25
3.1.2 Bahan-bahan 26
3.2 Prosedur Penelitian 27
3.2.1 Pengambilan Sampel 27
3.2.2 Pembuatan Larutan 27
1. Larutan K2Cr2O7 0689 N 27
2. Larutan Fe(NH4)2(SO4)2.6H2O 0,393 N 28
3. Indikator Ferroin 28
4. Pereaksi Benedict 28
5. Larutan HCl 30% 28
12. Larutan Pereaksi Nelson 29
13. Larutan Arsenomolibdat 30
3.2.3 Cara Kerja 30
3.2.3.1 Isolasi Selulosa dan Uji Kualitatif Selulosa 30 3.2.3.2 Hidrolisis Selulosa Ampas Tebu dan 31
Uji Kualitatif Glukosa
3.2.3.3 Pengukuran Panjang Gelombang Maksimum 31 Larutan Glukosa Standar
3.2.3.4 Penyiapan Kurva Standar Glukosa 31 3.2.3.5 Analisa Kadar Glukosa dari Hidrolisis 32
Selulosa Ampas Tebu
3.2.3.6 Fermentasi Glukosa Hasil Hidrolisis Selulosa 32 Ampas Tebu Menjadi Bioetanol
3.2.3.7 Destilasi Larutan Fermentasi Glukosa Hasil 32 Hidrolisis Selulosa Ampas Tebu
3.2.3.8 Penentuan Kurva Kalibrasi Etanol Standar 33 3.2.3.9 Analisa Kadar Bioetanol Dengan Metode 33
Oksidasi Kalium Dikromat
3.3 Bagan Penelitian 34
3.3.2 Hidrolisis Selulosa Ampas Tebu dan Uji Kualitatif 35 Glukosa
3.3.3 Pembuatan Larutan Fermentasi 36
3.3.4 Destilasi Larutan Hasil Fermentasi dan Uji 37 Kuantitatif Bioetanol
Bab IV Hasil dan Pembahasan 38
4.1 Hasil Penelitian 38
4.2 Perhitungan 39
4.2.1 Perhitungan Kadar Selulosa Dalam Ampas Tebu 39 4.2.2 Perhitungan Kadar Glukosa Hasil Hidrolisis 39
Selulosa Ampas Tebu
4.2.3 Perhitungan Kadar Bioetanol 42
4.3 Pembahasan 44
4.3.1 Variasi Lama Fermentasi Terhadapa Kadar 44 Bioetanol
4.3.2 Variasi Penambahan Ragi Roti Terhadap 45 Kadar Bioetanol
4.3.3 Reaksi Kalium Dikromat Dengan Bioetanol 47
Bab V Kesimpulan dan Saran 48
5.1 Kesimpulan 48
5.2 Saran 48
DAFTAR PUSTAKA 49
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil Analisis Kadar Glukosa Hasil Hidrolisis Selulosa 38 Ampas Tebu
Tabel 4.2 Data Penentuan Larutan Glukosa Standar (mg/mL) Pada 40 Berbagai Konsentrasi
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Selulosa 12
Gambar 2.2 Reaksi Hidrolisis Selulosa Dengan Asam 14
Gambar 2.3 Resorcinol (1,3 dihidroksi benzen) 15
Gambar 2.4 Reaksi Gula Pereduksi Dengan Pereaksi benedict 17
DAFTAR LAMPIRAN
Halaman
Lampiran A Data Penentuan λ Maksimum dari Larutan Glukosa 52 0,05 mg/mL
Lampiran B Data Larutan Glukosa Standar Pada λ 760 nm 52 Lampiran C Data Volume Titrasi Fe(NH4)2(SO4)2 0,393 N dan Kadar 53
Bioetanol Dari Fermentasi Glukosa Hasil Hidrolisis Selulosa Ampas Tebu
Lampiran D Data Penentuan Ybaru 53
Lampiran E Kurva Penentuan λ Maksimum dari Larutan Glukosa 54 0,05 mg/mL
Lampiran F Kurva Larutan Glukosa Standar Pada λ 760 nm 54 Lampiran G Kurva Larutan Etanol Standar Dengan Berbagai Konsentrasi 55 Lampiran H Kurva Kadar Bioetanol Dengan Variasi Penambahan 55
ABSTRAK
THE INFLUENCE ADDED BAKER YEAST AND PERIODS OF FERMENTATION TOWARD GLUCOSE YIELD
HYDROLYSIS CELLULOSE SUGARCANE BAGASSE WITH HCl 30% TO MAKE
BIOETHANOL
ABSTRACT
BAB I
PENDAHULUAN
I.1.Latar Belakang
Tanaman tebu di Indonesia banyak ditanam oleh para petani kecil baik atas usaha
sendiri maupun atas usaha kerjasama dengan pabrik gula atau pabrik gula yang
menyewa lahan pertanian penduduk dan sekaligus mengupah tenaganya dalam usaha
mengembangkan tanaman tebu bagi keperluan memenuhi bahan baku bagi pabriknya
(Kartasapoetra, 1988).
Produk utama dari pabrik gula adalah gula putih. Namun ada produk yang
merupakan produk samping dari pengolahan tebu menjadi gula. Hasil samping
tersebut berupa tetes (molase), pucuk daun tebu, blotong, ampas tebu yang merupakan
limbah pabrik. Hasil samping berupa limbah pabrik sering menimbulkan banyak
permasalahan sebab menjadi sumber pencemaran lingkungan.
Ampas tebu adalah hasil samping dari proses ekstraksi (pemerahan) cairan
tebu. Dari satu pabrik dapat dihasilkan ampas tebu sekitar 35 – 40% dari berat tebu
yang digiling. Mengingat begitu banyak jumlahnya, maka ampas tebu akan
memberikan nilai tambah untuk pabrik jika diberi perlakuan lebih lanjut (Tim Penulis
PS, 1992).
Ampas tebu sebagai limbah pabrik gula merupakan salah satu bahan
lignoselulosa yang potensial untuk dikembangkan menjadi sumber energi seperti
bioetanol. Konversi bahan lignoselulosa menjadi bioetanol mendapat perhatian
sebagai bahan bakar terus dikembangkan . Menurut Licht (2009), pada tahun 1999
produksi bahan bakar etanol mencapai 4.972 juta galon (setara dengan 18.819 juta
liter) dan pada tahun 2008 meningkat menjadi 17.524 juta galon (setara dengan 66.328
juta liter). (Hermiati, 2009).
Manfaat umum yang dapat diperoleh dari bahan bakar bioetanol antara lain,
digunakan untuk bahan baku industri turunan alkohol, campuran minuman keras,
industri farmasi, sampai pada bahan baku campuran kendaraan. Tentu saja,
pemanfaatan etanol ini harus disesuaikan dengan jenis kebutuhannya. Misalnya, untuk
kebutuhan industri diperlukan etanol dengan grade antara 90-96,5%, sedangkan untuk
minuman keras dibutuhkan etanol berkadar 99,5-100%, atau etanol yang harus
betul-betul kering dan anhydrous supaya tidak korosif (Abidin, 2009).
Pemanfaatan ampas tebu untuk dikonversikan menjadi bioetanol telah banyak
dikembangkan dari dulu hingga saat ini, diantaranya yang pernah memanfaatkan
ampas tebu menjadi bioetanol yaitu M.Samsuri dkk (2007) “Pemanfaatan Selulosa
Bagas Untuk Produksi Etanol Melalui Sakarifikasi Dan Fermentasi Serentak Dengan
Enzim Xylanase”; M.Samsuri dkk (2007) “Sakarifikasi Dan Fermentasi Bagas
Menjadi Etanol Menggunakan Enzim Selulase dan Enzim Selobiase”; dan Euis
Hermiati dkk (2009) “Pemanfaatan Biomassa Lignoselulosa Ampas Tebu Untuk
Produksi Bioetanol”.
Penelitian ini dilatarbelakangi berdasarkan penelitian Pembuatan Bioetanol
Dari Biji Durian Sebagai Sumber Energi Alternatif oleh Fifi Nurfiana (2009) dan
Pembuatan Bioetanol Dari Singkong Secara Fermentasi Menggunakan Ragi Tape oleh
Heppy Rikana dan Risky Adam (2000). Dimana pada penelitian ini, ragi tape dapat
dengan langsung digunakan untuk proses fermentasi tanpa mengisolasi mikroba yang
ada dalam ragi tape terlebih dahulu.
Berdasarkan uraian diatas maka penulis tertarik untuk melakukan penelitian
mengenai pemanfaatan ampas tebu dalam pembuatan bioetanol secara fermentasi
dengan menggunakan ragi roti tanpa mengisolasi Saccharomyces cereviceae terlebih
1.2 Perumusan Masalah
1. Apakah ragi roti dapat digunakan secara langsung tanpa mengisolasi
Saccharomyces cereviceae terlebih dahulu dalam pembuatan bioetanol dari
fermentasi glukosa hasil hidrolisis selulosa ampas tebu dengan HCl 30% ?
2. Bagaimana pengaruh variasi penambahan ragi roti dan lama waktu fermentasi
terhadap kadar bioetanol yang dihasilkan?
1.3 Pembatasan Masalah
Karena luasnya permasalahan dalam pemanfaatan ampas tebu, maka penelitian ini
dibatasi sebagai berikut:
1. Ampas tebu diperoleh dari Pabrik Gula Sei Semayang Jalan Medan-Binjai Km 12.
2. Hidrolisis ampas tebu menggunakan HCl 30%.
3. Ragi roti yang digunakan untuk fermentasi adalah ragi roti dalam bentuk kemasan
dengan merk saf instant.
4. Kadar bioetanol ditentukan secara volumetrik dengan metode oksidasi kalium
dikromat.
5. Kadar glukosa ditentukan dengan metode Nelson Somogyi.
6. Variasi ragi roti yang digunakan yaitu 1, 2, dan 3 gram.
7. Variasi lama fermentasi yaitu 2, 4, 6, dan 8 hari.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mengetahui apakah ragi roti dapat memfermentasi glukosa hasil hidrolisis
selulosa dari ampas tebu menjadi bioetanol tanpa melalui isolasi Saccharomyces
cereviceae terlebih dahulu.
2. Untuk mengetahui pengaruh variasi berat ragi roti yang ditambahkan dan lama
1.5 Manfaat Penelitian
Dari hasil penelitian ini diharapkan:
1. Pemanfaatan ampas tebu sebagai bahan baku penghasil bioetanol diharapkan dapat
meningkatkan nilai ekonomis bagi para petani tebu.
2. Dapat memanfaatkan limbah pabrik gula sebagai bahan baku pembuatan bioetanol
untuk bahan bakar alternatif.
3. Dapat memberikan informasi kadar bioetanol yang dihasilkan untuk penelitian
lebih lanjut.
4. Dapat memberikan informasi ilmiah dalam pemanfaatan limbah pabrik gula untuk
pembuatan bioetanol dengan menggunakan ragi roti.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia/Kimia Bahan Makanan
FMIPA-USU Medan, Laboratorium Ilmu Dasar FMIPA-USU dan Pusat Penelitian FMIPA-USU.
1.7 Metodologi Penelitian
Penelitian ini adalah bersifat eksperimental laboratorium dengan menggunakan ampas
tebu dimana metode penelitian dilakukan dengan cara sebagai berikut:
Penelitian dilakukan dengan 4 tahapan yaitu:
1. Penyediaan selulosa ampas tebu.
• Bahan baku adalah ampas tebu yang diperoleh dari Pabrik Gula Sei Semayang
Jalan Medan- Binjai Km 12.
• Proses isolasi selulosa dengan cara delignifikasi ampas tebu.
• Uji kualitatif selulosa dilakukan dengan penambahan larutan Iodin.
2. Penyediaan glukosa dari hidrolisis selulosa ampas tebu.
• Bahan baku adalah selulosa yang diisolasi dari ampas tebu.
• Proses perubahan selulosa ampas tebu menjadi glukosa adalah hidrolisis
• Uji kualitatif glukosa dengan menggunakan pereaksi Benedict.
• Kadar glukosa dianalisa dengan menggunakan metode Nelson Somogyi.
3. Fermentasi glukosa hasil hidrolisis selulosa ampas tebu untuk menghasilkan
bioetanol
• Substrat yang digunakan pada fermentasi adalah glukosa hasil hidrolisis
selulosa dari ampas tebu.
• Mikroba yang digunakan berasal dari ragi roti.
4. Pemurnian bioetanol hasil fermentasi.
• Bioetanol dipisahkan dari sisa glukosa dengan menggunakan alat destilasi.
• Kadar bioetanol hasil pemisahan dianalisa dengan menggunakan metode titrasi
oksidasi kalium dikromat.
Adapun variabel–variabel dalam penelitian adalah :
1. Variabel bebas adalah variabel yang mempunyai pengaruh terhadap kadar
bioetanol yaitu:
• Pengaruh konsentrasi glukosa terhadap fermentasi hasil hidrolisis selulosa
ampas tebu.
• Pengaruh penambahan ragi terhadap glukosa 1, 2, dan 3 gram
2. Variabel terikat adalah variabel yang terukur terhadap perubahan perlakuan.
Dalam penelitian ini yang menjadi variabel terikat yaitu :
• Kadar bioetanol.
3. Variabel tetap adalah variabel yang dibuat tetap sehingga tidak menyebabkan
terjadinya perubahan variabel terikat. Dalam penelitian ini variabel tetap adalah:
• Berat sampel
• Berat ragi
• pH fermentasi yaitu pH= 4 - 5
• Temperatur fermentasi pada suhu kamar
• Kadar gula tetap
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Tebu
Tanaman tebu tidak asing lagi bagi kita, karena telah lama ada di negeri ini. Asal mula
tebu tidak diketahui dengan pasti. Ada yang mengatakan tebu berasal dari India,
karena tebu ditemukan pertama kali di India. Akan tetapi, di India tidak ditemukan
tanaman tebu yang hidup liar, sehingga India diragukan sebagai tempat asal mula
tebu. Beberapa tahun kemudian orang menemukan tebu di hutan-hutan Irian. Setelah
diamati, kemungkinan besar tebu berasal dari daerah ini (Tim Penulis PS, 1992).
Tebu adalah tanaman yang ditanam untuk bahan baku gula dan vetsin.
Tanaman ini hanya dapat tumbuh didaerah beriklim tropis. Tanaman ini termasuk
jenis rumput – rumputan. Di Indonesia tebu banyak dibudidayakan di pulau Jawa dan
Sumatera (Wikipedia.com).
Tanaman tebu merupakan tanaman perkebunan semusim yang mempunyai
sifat tersendiri sebab didalam batangnya terdapat zat gula. Mulai dari pangkal sampai
ujung batangnya mengandung air gula dengan kadar mencapai 20%. Air gula inilah
yang kelak dibuat menjadi kristal-kristal gula atau gula pasir (Tim Penulis PS, 1992).
2.1.1 Klasifikasi Tebu
Kerajaan : Plantae
Divisi : Magnoliophyta
Ordo : Poales
Famili : Poaceae
Genus : Saccharum
(www.wikipedia.com)
Jenis-jenis tebu yang sering ditanam yaitu POY 3016, PS 30, PS 41, PS 38, PS
36, PS 8, BZ 132, BZ 62 dan lain-lain. Adapun nama lokal tebu yaitu Sugar cane
(Inggris), Tebu (Indonesia), Tebu,Rosan (Jawa), Tiwu (Sunda), Tebhu (Madura),
Tebu,Isepan (Bali), Teubee (Aceh), Tewu (Nias,Flores), Atihu (Ambon), Tebu
(Lampung), Tepu (Timor) (www.iptek.net.id).
Diperkirakan kandungan polisakarida pada tebu mencapai lebih dari 70% yang
terbagi atas selulosa 50-55% dan hemiselulosa 15-20%. Kandungan lignin
diperkirakan hanya sekitar 20-30%. Pada biomassa lignoselulosa hanya selulosa dan
hemiselulosa yang biasanya diolah menjadi monosakarida untuk pembuatan etanol
(Samsuri, 2007).
Dibandingkan dengan bahan lignoselulosa lain yang banyak tersedia sebagai
hasil samping industri perrtanian dan perkebunan, misalnya jerami padi dan tandan
kosong kelapa sawit, ampas tebu memiliki kelebihan terutama dalam bentuk dan
ukuran bahan. Ampas tebu dari pabrik gula sudah merupakan partikel kecil yang tidak
lagi memerlukan proses perlakuan pendahuluan secara fisika berupa pencacahan atau
penggilingan untuk memperkecil ukuran bahan. Ampas tebu dapat langsung diberi
perlakuan pendahuluan lanjutan untuk mendegradasi lignin dalam bahan
(Hermiati, 2009).
2.2 Karbohidrat
Karbohidrat adalah polihidroksi aldehida atau polihidroksi keton yang mempunyai
rumus molekul umum (CH2O)n. Yang lebih dikenal sebagai golongan aldosa dan yang
kedua sebagai ketosa. Dari rumus umum dapat diketahui karbohidrat adalah suatu
monomer yang menyusun polimer itu, maka karbohidrat digolongkan menjadi
monosakarida, disakarida, trisakarida dan seterusnya sampai polisakarida. Bilamana
jumlah monomer yang menyusunnya berturut-turut adalah satu, dua, tiga dan banyak.
Untuk memudahkan biasanya dibagi menjadi tiga golongan yaitu monosakarida,
oligosakarida dan polisakarida.
Karbohidrat atau sakarida mempunyai dua fungsi yaitu sebagai bahan bakar
dan sebagai bahan penyusun struktur sel. Contoh karbohidrat yang tergolong dalam
kelompok pertama adalah glukosa, pati dan glikogen, dan yang termasuk kelompok
kedua adalah selulosa, kitin dan pektin (Martoharsono, 1998).
Molekul karbohidrat terdiri atas atom-atom karbon, hidrogen dan oksigen.
Jumlah atom hidrogen dan oksigen merupakan perbandingan 2:1 seperti molekul air.
Sebagai contoh molekul glukosa mempunyai rumus kimia C6H12O6. Pada glukosa
tampak bahwa jumlah atom hidrogen berbanding jumlah atom oksigen ialah 12:6 atau
2:1, sedangkan pada sukrosa 22:11 atau 2:1. Dengan demikian dahulu orang
berkesimpulan adanya air dalam karbohidrat, yang berasal dari “karbon” yang berarti
mengandung unsur karbon dan “hidrat” yang berarti air (Poedjiadi, 2007).
Bersama-sama dengan lemak dan protein, karbohidrat memegang peranan
penting bagi kehidupan dibumi ini. Bukan saja sebagai sumber energi utama bagi
makhluk hidup, tetapi juga sebagai senyawa yang menyimpan energi kimia. Pada
hewan atau manusia energi disimpan dalam bentuk glikogen dan pada tanaman
sebagai pati. Disamping kedua senyawa tersebut, ada pula karbohidrat pembentuk
struktur, misalnya selulosa yang berperanan sebagai komponen utama di dinding sel
bakteri. Selain terdapat pada dinding sel bakteri dan tumbuhan, polisakarida juga
2.2.1 Klasifikasi Karbohidrat
Pada umumnya karbohidrat dapat dikelompokkan menjadi monosakarida,
oligosakarida dan polisakarida. Monosakrida merupakan suatu molekul yang dapat
terdiri dari lima atau enam atom C, sedangkan oligosakarida merupakan polimer dari
2-10 monosakrida dan pada umumnya polisakarida merupakan polimer yang terdiri
lebih dari 10 monomer monosakarida.
2.2.1.1 Monosakarida
Monosakarida yang mengandung satu gugus aldehida disebut aldosa, sedangkan
ketosa mempunyai satu gugus keton. Monosakarida dengan enam atom C disebut
heksosa, misalnya glukosa (dekstrosa atau gula anggur), fruktosa (levulosa atau gula
buah), dan galaktosa. Sedangkan yang mempunyai lima atom C disebut pentosa,
misalnya : xilosa, arabinosa dan ribosa.
Beberapa monosakarida seperti D-glukosa, D-galaktosa dan D-fruktosa dengan
cepat dan mudah terserap melalui dinding usus kecil manusia, sedangkan
monosakarida lain yang mempunyai BM sama atau lebih kecil seperti D-mannosa,
L-arabinosa dan L-sorbosa hanya sebagian kecil saja yang terserap.
Meskipun ada bentuk D dan L, tetapi monosakarida-monosakarida yang
terdapat di alam pada umumnya berbentuk D, dan jarang sekali dalam bentuk L,
kecuali L-fruktosa yang terdapat dalam mukopolisakarida dan mukoprotein.
2.2.1.2 Oligosakarida
Oligosakarida adalah polimer dengan derajat polimerisasi 2 sampai 10 dan biasanya
bersifat larut dalam air. Oligosakarida yang terdiri dari dua molekul monosakarida
disebut disakarida, dan bila tiga molekul disebut triosa, bila sukrosa (sakarosa atau
gula tebu) terdiri dari molekul glukosa dan fruktosa, laktosa terdiri dari molekul
Ikatan antara dua molekul monosakarida disebut ikatan glikosidik. Ikatan ini
terbentuk antara gugus hidroksil dari atom C nomor 1 yang juga disebut karbon
anomerik dengan gugus hidroksil dan atom C pada molekul gula yang lain. Ikatan
glikosidik biasanya terjadi antara atom C nomor 1 dengan atom C nomor 4 atau
dengan melepaskan 1 mol air. Ikatan-ikatan glikosodik jarang terjadi antara karbon
anomerik dengan karbon yang ganjil misalnya 1, 3, 1,5, 1,7, tetapi biasanya dengan
ikatan karbon genap yaitu 2, 4, dan 6.
Ada tidaknya sifat pereduksi dari suatu molekul gula ditentukan oleh ada
tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada
glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan
pada fruktosa (ketosa) hidroksil reaktifnya terletak pada karbon nomor dua.
Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya
sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor 1
pada gugus glukosanya. Karean itu, laktosa bersifat pereduksi sedangkan sukrosa
bersifat nonpereduksi.
2.2.1.3 Polisakarida
Polisakarida dalam bahan makanan berfungsi sebagai penguat tekstur (selulosa,
hemiselulosa, pektin, lignin) dan sebagai sumber energi (pati, dekstrin, glikogen,
fruktan). Polisakarida penguat tekstur ini tidak dapat dicerna oleh tubuh, tetapi
merupakan serat-serat yang dapat menstimulasi enzim-enzim pencernaan.
Polisakarida merupakan polimer molekul-molekul monosakarida yang dapat
berantai lurus atau bercabang dan dapat dihidrolisis dengan enzim-enzim yang
spesifik kerjanya. Hasil hidrolisis sebagian akan menghasilkan oligosakarida dan
dapat dipakai untuk menentukan struktur molekul polisakarida.
Menurut jenis monosakaridanya dikenal pentosan dengan unit-unit pentosa dan
heksosan dengan monomer heksosa. Beberapa polisakarida mempunyai nama trivial
2.2.2 Lignin
Lignin merupakan komponen kimia dan morfologi yang karakteristik dari jaringan
tumbuhan tinggi seperti Pteridofita dan Spermatofita (gimnosperm dan angiosperm),
dimana lignin terdapat dalam jaringan vaskuler yang khusus untuk pengangkutan
cairan dan kekuatan mekanik. Tumbuhan primitif seperti jamur, lumut dan ganggang
tidak mengandung lignin, sementara masih dapat dipertanyakan apakah lumut
mengandung lignin yang sebenarnya atau hanya senyawa fenolat yang juga
menghasilkan sisa yang tidak dapat dihidrolisis selama perlakuan dengan asam.
Penelitian-penelitian yang lebih mutakhir terhadap sejumlah lumut (misalnya
Sphagnum maggellanicum) menunjukkan bahwa lumut tidak mengandung lignin dan
terdapat lignin terbatas pada tumbuhan vaskuler.
Jumlah lignin yang terdapat dalam tumbuhan yang berbeda sangat bervariasi.
Meskipun dalam spesies kayu kandungan lignin berkisar antara 20 hingga 40%,
angiosperm akuatik dan herba maupun banyak monokotil (misal spesies ekor kuda)
kurang mengandung lignin.
Di samping itu distribusi lignin di dalam dinding sel dan kandungan lignin
bagian pohon yang berbeda tidak sama. Sebagai contoh kandungan lignin yang tinggi
adalah khas untuk bagian batang yang paling rendah, paling tinggi dan paling dalam,
untuk cabang kayu lunak, kulit dan kayu tekan. Kandungan lignin dalam daun jarum
dan daun lebar dikatakan tidak tentu, terkadang tinggi atau rendah, kemungkinan
tergantung pada keadaan perkembangannya.
Dalam kebanyakan penggunaan kayu lignin digunakan sebagai bagian integral
kayu. Hanya dalam hal pembuatan pulp dan pengelantangan lignin dilepaskan dari
kayu dalam bentuk terdegradasi dan berubah, dan merupakan sumber karbon lebih
dari 35 juta ton tiap tahun di seluruh dunia yang sangat potensial untuk keperluan
2.2.3 Selulosa
Selulosa adalah suatu senyawa polimer yang tersusun atas residu dari D-glukopiranosa yang dihubungkan melalui ikatan β-(1,4) glikosida. Selulosa termasuk struktural polisakarida yang paling penting dalam tumbuhan. Karena jumlah selulosa yang
terdapat dalam tumbuhan kira-kira sepertiga dari biomassa, sehingga selulosa
termasuk kedalam bahan organik yang banyak dibumi ini. Diperkirakan sekitar 100
juta kg selulosa dihasilkan setiap tahun (McKee, 1996).
Adapun struktur selulosa yaitu dapat digambarkan sebagai berikut :
CH2OH CH2OH
Gambar 2.1 : Struktur selulosa. Dimana “n” mencapai ribuan unit
Struktur utama selulosa dapat dipecah dengan metode analisis metilasi. Selulosa yang
termasuk kedalam polimer linear mengandung residu glukosa hingga 15.000 yang
dihubungkan dengan ikatan glikosida (Voet, 1990).
Pada hidrolisis yang tidak lengkap terbentuk disakarida selobiosa, sedangkan pada hidrolisis lengkap terbentuk β-glukosa. Satuan β-glukosa ini berhubungan dengan ikatan 1-4. Selulosa tidak larut dalam air, berat molekulnya antara 50.000
sampai 400.000 dan ini sesuai dengan 300-2500 molekul glukosa. Dengan iodium,
selulosa tidak memberi warna. Enzim-enzim pencernaan tidak dapat memecah
selulosa sehingga selulosa penting sebagai sumber ‘bulk’ dalam makanan
(Iswari, 2006).
oleh enzim glikosidase yang terdapat dalam saluran pencernaan manusia atau hewan,
tetapi ular menghasilkan enzim selobiosa yang dapat menghidrolisis polimer ini
(Girindra, 1990).
Proses hidrolisis selulosa secara asam dibagi menjadi lima tahap yaitu
pencampuran selulosa dan asam, hidrolisis, netralisasi, pemucatan, penyaringan dan
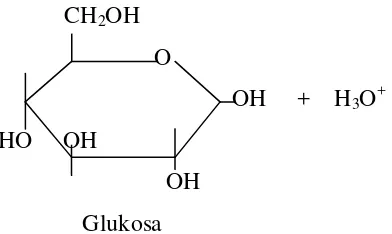
pemekatan. Adapun mekanisme hidrolisis selulosa sebagai berikut :
CH2OH
O
OH + H3O+
HO OH
OH
Glukosa
Gambar 2.2 : Reaksi Hidrolisis Selulosa Dengan Asam
(Humprey, 1979).
2.2.4 Glukosa
Glukosa juga dinamakan dekstrosa atau gula anggur, terdapat luas dialam dalam
jumlah sedikit yaitu didalam sayur, buah, sirup jagung, sari pohon dan bersamaan
dengan fruktosa dalam madu. Tubuh hanya dapat menggunakan glukosa dalam bentuk
D-glukosa. Glukosa murni yang ada dipasar biasanya diperoleh dari hasil olahan pati.
Glukosa memegang peranan penting dalam ilmu gizi. Glukosa merupakan hasil akhir
pencernaan pati, sukrosa, maltosa dan laktosa pada hewan dan manusia.
Dalam proses metabolisme, glukosa merupakan bentuk karbohidrat yang
beredar di dalam tubuh dan di dalam sel merupakan sumber energi. Dalam keadaan
normal sistem saraf pusat hanya dapat menggunakan glukosa sebagai sumber energi.
Glukosa dalam bentuk bebas hanya terdapat dalam jumlah terbatas dalam bahan
makanan. Glukosa dapat dimanfaatkan untuk diet tinggi energi. Tingkat kemanisan
glukosa hanya separuh dari sukrosa sehingga dapat digunakan lebih banyak untuk
2.3. Analisa Kualitatif dan Kuantitatif Gula Pereduksi 2.3.1. Analisa Kualitatif Gula Pereduksi
2.3.1.1 Uji Molisch
Karbohidrat oleh asam sulfat pekat akan dihidrolisa menjadi monosakarida dan
selanjutnya monosakarida mengalami dehidrasi oleh asam sulfat menjadi furfural atau hidroksi metil furfural. Furfural atau hidroksil metil furfural dengan α-naftol akan berkondensasi membentuk senyawa kompleks yang berwarna ungu. Apabila pemberian asam sulfat pada larutan karbohidrat yang telah diberi α-naftol melalui dinding gelas dan secara hati-hati maka warna ungu yang terbentuk berupa cincin
pada batas antara larutan karbohidrat dengan asam sulfat pekat. Dehidrasi pentosa
oleh asam akan dihasilkan furfural, dehidrasi heksosa menghasilkan hidroksi metil
furfural dan dehidrasi ramnosa menghasilkan metil furfural.
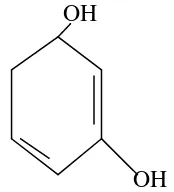
2.3.1.2 Uji Seliwanoff
Peristiwa dehidrasi monosakarida ketosa menjadi furfural lebih cepat jika
dibandingkan dengan dehidrasi monosakarida aldosa. Hal ini dikarenakan aldosa
sebelum mengalami dehidrasi lebih dahulu mengalami transformasi menjadi ketosa.
Dengan demikian aldosa akan bereaksi negatif pada uji Seliwanoff. Pada pengujian ini
furfural yang terbentuk dari dehidrasi tersebut dapat bereaksi dengan resorcinol
membentuk senyawa kompleks berwarna merah.
OH
OH
Gambar 2.3 : Resorcinol (1,3 dihidroksi benzen)
Sebagai zat untuk dehidrator dapat digunakan asam klorida 12% atau asam asetat atau
2.3.1.3 Uji Anthrone
Karbohidrat oleh asam sulfat akan dihidrolisa menjadi monosakarida dan selanjutnya
mengalami dehidrasi oleh asam menjadi furfural atau hidroksi metil furfural.
Selanjutnya senyawaan furfural ini dengan anthrone (9,10-dihidro-9-oxoanthracene)
membentuk senyawa kompleks yang berwarna biru kehijauan.
2.3.1.4 Uji Barfoed
Larutan Barfoed (campuran kupri asetat dan asam asetat) akan bereaksi dengan gula
reduksi sehingga dihasilkan endapan kuprooksida. Dalam suasana asam ini gula
reduksi yang termasuk dalam golongan disakarida memberikan reaksi yang sangat
lambat dengan larutan Barfoed sehingga tidak memberikan endapan merah kecuali
pada waktu percobaan yang diperlama. Uji ini untuk menunjukkan gula reduksi
monosakarida.
2.3.1.5 Uji Iodin
Karbohidrat golongan polisakarida akan memberikan reaksi dengan larutan iodin dan
memberikan warna spesifik bergantung pada jenis karbohidratnya. Amilosa dengan
iodin akan berwarna biru, amilopektin dengan iodin akan berwarna merah violet,
glikogen maupun dekstrin dengan iodin akan berwarna merah coklat.
2.3.1.6 Uji Osazon
Aldosa ataupun ketosa dengan fenilhidrazin dan dipanaskan akan membentuk
hidrason atau osazon. Senyawa ini terjadi karena gugus aldehid ataupun ketonik dari
karbohidrat berikatan dengan fenilhidrazin. Reaksi antar senyawaan tersebut
merupakan reaksi oksido-reduksi atom C yang mengalami reaksi adalah atom C
nomor satu dan dua dari aldosa atau ketosa. Fruktosa dan glukosa menunjukkan
2.3.1.6 Uji Fehling
Larutan fehling yang terdiri dari campuran kupri sulfat, Na-K-tartrat dan NaOH
dengan gula reduksi dan dipanaskan akan terbentuk endapan yang berwarna hijau,
kuning-orange atau merah bergantung dari macam gula reduksinya (Sudarmaji, 1984).
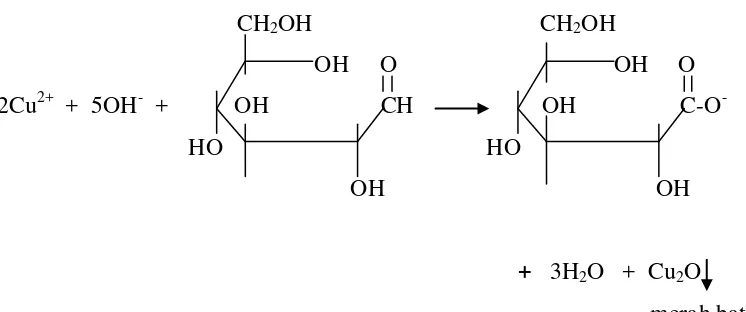
2.3.1.7 Uji Benedict
Pereaksi Benedict terdiri dari tembaga sulfat dalam larutan natrium karbonat dan
natrium sitrat yang dapat mereduksi glukosa. Dimana glukosa terlebih dahulu
dioksidasi dalam bentuk garam asam glukoronat. Reaksi ini juga akan membentuk
endapan merah bata Cu2O dan produk oksidasi lainnya. Adapun reaksinya sebagai
berikut :
CH2OH CH2OH
OH O OH O
2Cu2+ + 5OH- + OH CH OH C-O-
HO HO
OH OH
+ 3H2O + Cu2O merah bata
Gambar 2.4 : Reaksi Gula Pereduksi Dengan Pereaksi Benedict
(McKee, 1996)
2.3.2. Analisa Kuantitatif Gula Pereduksi
2.3.2.1 Metode Luff-Schrool
Pada penentuan gula cara Luff-Schrool yang ditentukan bukannya kuprooksida yang
mengendap tetapi dengan menentukan kuprioksida dalam larutan sebelum direaksikan
reduksi (titrasi sampel). Penentuannya dengan titrasi menggunakan Natrium tiosulfat.
Selisih titrasi blanko dengan titrasi blanko dengan titrasi sampel ekuivalen dengan
kuprooksida yang terbentuk dan juga ekuivalen dengan jumlah gula reduksi yang ada
dalam bahan atau larutan. Reaksi yang terjadi selama penentuan karbohidrat cara ini
mula-mula kuprioksida yang ada dalam reagen akan membebaskan iod dari garam
kalium iodida. Banyaknya iod yang dibebaskan ekuivalen dengan banyaknya
kuprioksida. Banyaknya iod dapat diketahui dengan titrasi menggunakan natrium
tiosulfat. Untuk mengetahui bahwa titrasi sudah cukup maka diperlukan indikator
amilum. Apabila larutan berubah warnanya dari biru menjadi putih berarti titrasi
sudah selesai. Agar perubahan warna biru menjadi putih dapat tepat maka
penambahan amilum diberikan pada saat titrasi hampir selesai. Setelah diketahui
selisih banyaknya titrasi blanko dan titrasi sampel kemudian dikonsultasikan dengan
tabel yang sudah tersedia yang menggambarkan hubungan antara banyaknya natrium
tiosulfat dengan banyaknya gula reduksi. Reaksi yang terjadi dalam penentuan gula
cara Luff-Schrool dapat dituliskan sebagai berikut:
R-COH + CuO Cu2O + R-COOH
Penentuan gula dengan cara ini adalah dengan menentukan banyaknya kuprooksida
yang terbentuk dengan cara penimbangan atau dengan melarutkan kembali dengan
asam nitrat kemudian menitrasi dengan tiosulfat. Jumlah kuprooksida yang terbentuk
ekuivalen dengan banyaknya gula reduksi yang ada dalam larutan dan telah
disediakan dalam bentuk tabel Hammond hubungan antara banyaknya kuprooksida
dengan gula reduksi. Tiap 1mL Na-tiosulfat (39 gram Na2S2O3) sesuai dengan 11,259
2.3.2.3 Metode Lane-Eynon
Penentuan gula cara ini adalah dengan cara menitrasi reagen Soxhlet (larutan CuSO4,
K-Na-tartrat) dengan larutan gula yang ditentukan. Banyaknya larutan contoh yang
dibutuhkan untuk menitrasi reagen soxhlet dapat diketahui banyaknya gula yang ada
dengan melihat pada tabel Lane-Eynon. Agar diperoleh penentuan yang tepat maka
raegen soxhlet perlu distandarisasi dengan larutan gula standar. Standarisasi ini
dikerjakan untuk menentukan besarnya faktor koreksi dalam menggunakan tabel
Lane-Eynon. Pada titrasi reagen soxhlet dengan larutan gula akan berakhir apabila
warna larutan berubah dari biru menjadi tak berwarna. Indikator yang digunakan cara
ini adalah bromtimol blue (Sudarmadji, 1984).
2.4 Glikolisis
Pada dasarnya metabolisme glukosa dapat dibagi dalam dua bagian yaitu yang tidak
menggunakan oksigen atau anaerob dan yang menggunakan oksigen atau aerob.
Reaksi anaerob terdiri atas serangkaian reaksi yang mengubah glukosa menjadi asam
laktat. Proses ini disebut glikolisis anaerob.
Proses glikolisis anaerob dimulai dengan molekul glukosa dan diakhiri dengan
terbentuknya asam laktat. Sedangkan glikolisis aerob dimulai dari molekul glukosa
dengan terbentunya piruvat yang akan masuk ke siklus krebs. Serangkaian
reaksi-reaksi dalam proses glikolisis tersebut juga dinamakan jalur Emden-Meyerhof.
Reaksi-reaksi yang berlangsung pada proses glikolisis dapat dibagi dalam dua
fase. Pada fase pertama, glukosa diubah menjadi triosafosfat dengan proses fosforilasi.
Fase kedua dimulai dari reaksi oksidasi triosafosfat hingga terbentuk asam laktat.
Perbedaan antara kedua fase ini terletak pada aspek energi yang berkaitan dengan
reaksi-reaksi dalam kedua fase tersebut.
Dalam proses glikolisis satu mol glukosa diubah menjadi dua mol asam laktat.
ADP. Jadi fase pertama ini menggunakan energi yang tersimpan dalam bentuk
molekul ATP. Fase kedua mengubah dua mol triosa yang terbentuk pada fase pertama
menjadi dua mol asam laktat dan dapat menghasilkan 4 mol ATP (Girindra, 2007).
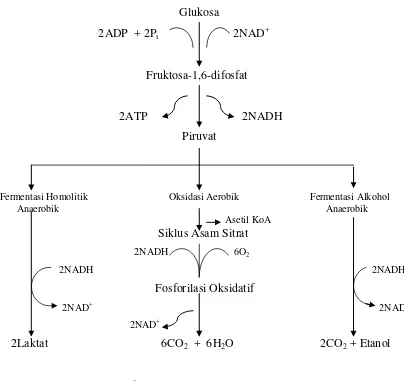
Fermentasi glukosa menjadi etanol dan karbondioksida oleh ragi telah lama
digunakan. Pembuatan bir dan roti merupakan awal pengembangan dari proses
fermentasi glukosa. Kemudian para ilmuwan mencoba meneliti lebih lanjut mengenai
mekanisme glikolisis yang dimulai sekitar pertengahan abad ke 19.
Gambar dibawah ini menjelaskan mengenai jalur glikolisis dalam pengubahan
glukosa menjadi piruvat yang menggunakan 2 ATP. Pada kondisi anaerobik,
fermentasi alkohol dari piruvat terjadi dengan adanya ragi, dimana fermentasi
homolitik terjadi dalam otot. Sedangkan kondisi aerob, piruvat dioksidasi menjadi
2.5 Fermentasi
Fermentasi merupakan kegiatan mikrobia pada bahan pangan sehingga dihasilkan
produk yang dikehendaki. Mikrobia yang umumnya terlibat dalam fermentasi adalah
bakteri, khamir dan kapang. Contoh bakteri yang digunakan dalam fermentasi adalah
Acetobacter xylinum pada pembuatan nata de coco, Acetobacter aceti pada pembuatan
asam asetat. Contoh khamir dalam fermentasi adalah Saccharomyces cereviseae
dalam pembuatan alkohol, sedangkan contoh kapang adalah rhizopus sp pada
pembuatan tempe, Monascus purpureus pada pembuatan angkak dan sebagainya
(Hidayat, 2009).
Fermentasi mulai dikenal pada tahun 1857 ketika Louis Pasteur menemukan bahwa
fermentasi merupakan sebuah hasil dari sebuah aksi mikroorganisme yang spesifik.
Fermentasi sebagai industri dimulai awal 1990, dengan produksi dari enzim mikroba,
asam organik, dan yeast.
Fermentasi alkoholik, dimana suatu molekul glukosa diubah menjadi dua
molekul etanol dan dua karbon dioksida, merupakan proses katabolik anaerobik yang
sama seperti glikolisis kecuali untuk stadium akhirnya yang menghasilkan produk
akhir yang berbeda. Pada glikolisis, perantara metabolik terakhir, piruvat direduksi
menjadi laktat. Dalam fermentasi alkoholik, ini dirubah menjadi etanol dan CO2
(Maulany, 1995).
Pada prinsipnya reaksi dalam proses pembuatan alkohol dengan fermentasi
adalah sebagai berikut:
C6H12O6 2 C2H2O5 + CO2
Jika digunakan disakarida seperti sakarosa, reaksinya adalah sebagai berikut:Reaksi
hidrolisis reaksi fermentasi sama seperti penggunaan monosakarida.
Khamir tidak dapat langsung memfermentasikan pati. Oleh karena itu tahap
yang penting adalah proses sakarifikasi, yaitu perubahan pati menjadi maltosa atau
glukosa dengan menggunakan enzim atau asam (Hidayat, 2009).
2.6 Ragi Roti
Penemu Yeast ( ragi roti ) pertama kali adalah Louis Pasteaur pada tahun 1872. Bibit
yeast yang terbagus terdapat dalam buah anggur dan apel serta pada akar pohon
tersebut.
Jenis – jenis ragi roti :
a. Fresh Yeast, merupakan jenis ragi yang pertama kali ditemukan, berbentuk
cair sehingga dalam penyimpanan memerlukan pembekuan sering disebut
compressed yeast.
b. Dry Yeast, merupakan jenis ragi yang kering berbentuk butiran – bituran sering
disebut dehydrated yeast.
c. Instan Yeast, merupakan ragi yang dibentuk dalam bentuk tepung/powder
Cara pemakaian dari ragi – ragi tersebut berbeda – beda yaitu:
a. Fresh Yeast sebelum dicampurkan dengan bahan – bahan lain harus dicairkan
terlebih dahulu
b. Dry Yeast sebelum dicampurkan dengan bahan – bahn lainnya harus dilarutkan
dulu dengan air dan difermentasikan. Instan yeast biasanya dicampurkan
langsung dengan bahan – bahan lain sehingga menjadi suatu adonan
( Subagjo, 2007 ).
2.6.1 Faktor –Faktor Yang Mempengaruhi Kehidupan Ragi
1. Nutrisi (Zat gizi)
Dalam kegiatannya khamir memerlukan penambahan nutrisi untuk
pertumbuhan dan perkembangbiakan, yaitu :
b. Unsur N, dengan penambahan pupuk yang mengandung nitrogen, misal
urea, dan amonia.
c. Unsur P, dengan penambahan pupuk fosfat, misal NPK.
d. Mineral-mineral.
e. Vitamin-vitamin.
2. Keasaman (pH)
Untuk fermentasi alkohol, khamir memerlukan media dengan suasana asam,
yaitu antara pH 4,8 – 5,0. Pengaturan pH dapat dilakukan dengan penambahan
asam sulfat jika substratnya alkalis atau dengan natrium bikarbonat jika
substratnya asam.
3. Suhu
Suhu optimum untuk pertumbuhan dan perkembangbiakan adalah 280C –
300C. pada waktu fermentasi terjadi kenaikkan panas, karena reaksinya
eksoterm. Untuk mencegah agar suhu fermentasi tidak naik, perlu pendinginan
agar dipertahankan tetap 260C -300C
4. Udara
Fermentasi alkohol berlangsung secara anaerobik (tanpa udara). Namun
demikian udara diperlukan pada proses pembibitan sebelum fermentasi untuk
perkembangbiakan khamir tersebut (Hidayat, 2009).
2.7 Bioetanol
Bioetanol adalah etanol yang dibuat dari biomassa yang mengandung komponen pati
atau selulosa, seperti singkong dan tetes tebu. Dalam dunia industri, etanol umumnya
digunakan sebagai bahan baku industri turunan alkohol, campuran untuk minuman
keras (seperti sake atau gin), serta bahan baku farmasi dan kosmetika. Berdasarkan
kadar alkoholnya, etanol terbagi menjadi tiga grade sebagai berikut :
• Grade industri dengan kadar alkohol 90-94%.
• Netral dengan kadar alkohol 96-99,5%, umumnya digunakan untuk minuman
keras atau bahan baku farmasi.
Adapun bahan baku yang dapat digunakan untuk menghasilkan bioetanol yaitu:
- Bahan berpati, berupa singkong atau ubi kayu, ubi jalar, tepung sagu, biji
jagung, biji sorgum, gandum, kentang, ganyong, garut, umbi dahlia dan
alain-lain.
- Bahan bergula, berupa molases (tetes tebu), nira tebu, nira kelapa, nira batang
sorgum manis, nira aren (enau), nira nipah, gewang, nira lontar dan lain-lain.
- Bahan berselulosa, berupa limbang logging, limbah pertanian seperti jerami
padi, ampas tebu, tongkol jagung, onggok (limbah tapioka), batang pisang,
serbuk gergaji dan lain-lain.
Dari bahan-bahan yang disebutkan diatas, bahan baku yang memiliki efisiensi
tertinggi adalah jagung, tetes tebu dan ubi kayu, sedangkan tebu memiliki efisiensi
paling rendah.
Pemerintah Indonesia melalui Dewan Standarisasi Indonesia (DSI) telah
menetapkan Standar Nasional Indonesia (SNI) untuk bioetanol. Yaitu
SNI-06-3565-1994 untuk alkohol teknis yang terbagi atas alkohol prima super, alkohol prima I, dan
alkohol prima II. Syarat mutu dalam SNI ini mencantumkan kadar etanol (pada 15oC)
untuk prima super sebesar maksimal 96,8% dan minimal 96,3%, sedangkan prima I
BAB III
METODA PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-alat
− Alat Autoklaf Fiesher Scientific
− Buret Pyrex
− Hot plate stirer Cimarec
− Labu ukur Pyrex
− Neraca analitik Sartorius
− pH universal p.a. Merck
− Pipet Volume Pyrex
− Termometer Fischer
− Oven Griffin
− Bunsen
− Bola karet
− Botol Akuades
− Corong
− Kertas saring Whatman
− Penangas air
− Pipet tetes
− Statif dan klem
− Spatula
− Stirer Magnetik
− Gelas Erlenmeyer Pyrex
− Desikator
− Spektrofotometer Genensys 20
− Glukosa monohidrat p.a. Merck
− NaNO3 p.a. Merck
− Aluminium Foil
− Indikator Ferroin
− Na-sitrat p.a. Merck
− Na-Hipoklorit p.a. Merck
− K-Na-Tartrat p.a. Merck
− Na2HAsO4.7H2O p.a. Merck
− (NH4)6Mo7O24.4H2O p.a. Merck
− Na2SO4 p.a. Merck
− NaHCO3 p.a. Merck
− C6H12O6 p.a. Merck
− 1,10-O-phenantrolin.H2O p.a. Merck
3.2. Prosedur Penelitian
3.2.1 Pengambilan Sampel
Sampel berupa ampas tebu diperoleh dari satu lokasi yaitu Pabrik Gula Sei Semayang
Jalan Medan-Binjai Km 12.
3.2.2 Pembuatan Larutan 1. Larutan K2Cr2O7 0,689 N
Sebanyak 162,5 mL larutan H2SO4(p) ditambahkan kedalam 200 mL akuades pada
labu ukur 500 mL. Campuran diaduk dan didinginkan pada suhu 80-90oC.
Ditambahkan 16,88 g K2Cr2O7 (standar primer), dilarutkan dan didinginkan.
2. Larutan Fe(NH4)2(SO4)2.6H2O 0,393 N
Dilarutkan 77 g Fe(NH4)2(SO4)2.6H2O dalam 250 mL akuades pada labu ukur 500
mL, ditambahkan 15 mL H2SO4(p) dan diencerkan dengan akuades hingga garis tanda
lalu dihomogenkan.
3. Indikator Feroin
Sebanyak 0,695 g FeSO4.7H2O dilarutkan dalam 50 mL akuades, kemudian
ditambahkan 1,485 g 1,10-O-phenantrolin.H2O dan diencerkan pada labu ukur 100 ml
sampai garis tanda lalu dihomogenkan.
4. Pereaksi Benedict
Sebanyak 17,3 g Na-Sitrat dilarutkan dengan akuades. Dimasukkan kedalam labu ukur
100 mL (Larutan 1). Sebanyak 1,73 g CuSO4.H2O dilarutkan dengan akuades (Larutan
2). Perlahan – lahan larutan 2 ditambahkan kedalam larutan 1. Kemudian di encerkan
dengan akuades dalam labu ukur 100 mL sampai garis tanda lalu dihomogenkan.
5. Larutan HCl 30%
Sebanyak 81,08 mL HCl 37% diencerkan dengan akuades dalam labu ukur 100 mL
hingga garis tanda lalu dihomogenkan.
6. Larutan NaOH 10 %
Sebanyak 10 g NaOH pelet dilarutkan dengan akuades dalam labu ukur 100 mL
hingga garis tanda lalu dihomogenkan.
7. Larutan HNO3 3,5 %
Sebanyak 54,6 mL HNO3 64% di tambahkan 10 mg NaNO3 lalu diencerkan dengan
8. Larutan Na2SO3 2%
Sebanyak 10 g Na2SO3 dilarutkan dengan akuades dalam labu ukur 500 mL hingga
garis tanda lalu dihomogenkan.
9. Larutan NaOH 2%
Sebanyak 10 g NaOH pelet dilarutkan dengan akuades dalam labu ukur 500 mL
hingga garis tanda lalu dihomogenkan.
10. Larutan NaOH 17,5 %
Sebanyak 87,5 g NaOH pellet dilarutkan dengan akuades dalam labu ukur 500 mL
hingga garis tanda lalu dihomogenkan.
11. Larutan Na-Hipoklorit 1,75%
Sebanyak 72,9 mL Na-Hipoklorit 12% diencerkan dengan akuades dalam labu ukur
500 mL hingga garis tanda lalu dihomogenkan.
12. Larutan pereaksi Nelson
Nelson A :
Dilarutkan12,5 g Natrium karbonat anhidrat, 12,5 g garam Rochelle (K-Na-Tartrat),
10 g Natrium Bikarbonat, dan 100 g Natrium Sulfat anhidrat dalam 300 ml akuades
dan diencerkan sampai 500 mL.
Nelson B :
Dilarutkan 7,5 g CuSO4.5H2O dalam 50 mL akuades dan ditambahkan 1 tetes asam
sulfat pekat.
Pereaksi Nelson dibuat dengan cara mencampur 25 bagian larutan Nelson A
13. Larutan Arsenomolibdat
Dilarutkan 25 g ammonium molibdat dalam 450 mL akuades dan ditambahkan 25 mL
H2SO4(p). Pada tempat yang lain, dilarutkan 3 g Na2HAsO4.7H2O dalam 25 mL
akuades, kemudian dituangkan larutan ini ke dalam larutan pertama.
Disimpan dalam botol berwarna coklat dan diinkubasi pada suhu 37oC selama
24 jam. Larutan pereaksi ini dapat digunakan setelah masa inkubasi dan berwarna
kuning.
3.2.3. Cara Kerja
3.2.3.1. Isolasi Selulosa dari Ampas Tebu dan Uji Kualitatif Selulosa
75 g ampas tebu yang telah halus dimasukkan ke dalam gelas. Ditambahkan 1000 mL
HNO3 3,5 % dan 10 mg NaNO2. Dipanaskan dengan menggunakan termostat selama 2
jam pada suhu 80o C. Disaring dan dicuci residu dengan akuades hingga pH = 7.
Ditambahkan 375 mL NaOH 2% dan 375 mL Na2SO3 2%. Dipanaskan dengan
menggunakan termostat selama 1 jam pada suhu 50o C.Disaring dan dicuci residu
dengan akuades hingga pH = 7. Ditambahkan 500 mL Na-Hipoklorit 1,75 %.
Dipanaskan dengan menggunakan termostat selama 30 menit pada suhu 100oC.
Disaring dan dicuci residu dengan akuades hingga pH = 7. Ditambahkan 500 mL
NaOH 17,5 %. Dipanaskan dengan menggunakan termostat selama 30 menit pada
suhu 80o C. Disaring dan dicuci residu dengan akuades hingga pH = 7. Ditambahkan
500 mL Na-Hipoklorit 1,75 %. Dipanaskan selama 5 menit pada suhu 100o C.
Disaring dan dicuci residu dengan akuades hingga pH = 7. Dikeringkan residu
didalam oven pada suhu 60o C. Dimasukkan kedalam desikator. Dimasukkan selulosa
secukupnya kedalam plat tetes. Diteteskan dengan larutan iodin 0,1 N. Jika tidak
3.2.3.2. Hidrolisis Selulosa Ampas Tebu Menjadi Glukosa Serta Uji Kualitatif Glukosa
Dimasukkan 0,5 g selulosa ampas tebu kedalam gelas erlenmeyer. Ditambahkan
dengan 8 mL HCl 30%. Ditutup dengan kapas dan aluminium foil. Dipanaskan
dengan menggunakan termostat pada suhu 80oC selama 30 menit.Didinginkan hingga
suhu kamar. Ditambahkan NaOH 10% hingga pH = 4 - 5. Disaring. Dipipet 1 mL
filtrat ke dalam tabung reaksi.Ditambahkan larutan Benedict secukupnya.Dipanaskan
dengan menggunakan termostat hingga terbentuk endapan merah bata.
3.2.3.3. Pengukuran Panjang Gelombang Maksimum Larutan Glukosa Standar
Ditimbang 500 mg glukosa anhidrat dan dilarutkan dengan aquades sampai volume
500 ml ( larutan glukosa anhidrat 1 mg/mL). Dipipet 5 mL larutan induk glukosa l
mg/mL dan dimasukkan kedalam labu takar 100 mL (0,05 mg/mL). Diencerkan
dengan aquades hingga garis batas. Dipipet 1 ml larutan glukosa 0,05 mg/mL kedalam
tabung reaksi,lalu ditambahkan 1 ml pereaksi Nelson lalu ditutup dengan kapas. .
Dipanaskan hingga mendidih selama 20 menit lalu didinginkan. Ditambahkan 1 ml
larutan arsenomolibdat lalu dikocok hingga semua endapan larut. Ditambahkan 7 ml
akuades lalu dikocok hingga homogen. Diukur serapan panjang gelombang pada 600
– 800 nm. (diperoleh panjang gelombang maksimum).
3.2.3.4. Penyiapan Kurva Standar Glukosa
Disiapkan larutan glukosa standar dalam beberapa tabung reaksi dengan konsentrasi
bertingkat dari 0,02 – 0,1 mg/mL. Ditambahkan 1 mL larutan Nelson kemudian
dipanaskan hingga mendidih selama 20 menit dan didinginkan. Ditambahkan 1 mL
larutan arsenomolibdat lalu dikocok hingga semua endapan larut. Ditambahkan 7 mL
akuades lalu dikocok hingga homogen. Diukur serapannya pada panjang gelombang
760 nm. Dibuat kurva standar yang menunjukkan hubungan antara konsentrasi gula
3.2.3.5. Analisa Kadar Glukosa Dari Hidrolisis Selulosa Ampas Tebu
Dipipet 1 ml filtrat hasil hidrolisa selulosa ampas tebu lalu diencerkan dalam labu
ukur 50 ml dan diambil 1 ml untuk dianalisa. Ditambahkan 1 ml larutan Nelson
kemudian dipanaskan hingga mendidih selama 20 menit dan didinginkan.
Ditambahkan 1 ml larutan arsenomolibdat lalu dikocok hingga semua endapan larut.
Ditambahkan 7 ml akuades lalu dikocok hingga homogen. Diukur serapannya pada
panjang gelombang 760 nm sehingga dapat dihitung kadar gula reduksinya
3.2.3.6. Fermentasi Glukosa Hasil Hidrolisis Selulosa Ampas Tebu Menjadi Bioetanol
Dimasukkan 100 mL larutan glukosa hasil hidrolisis ampas tebu kedalam gelas
Erlenmeyer 250 mL. Ditambahkan 0,1 g MgSO4.7H2O , 0,1 g KH2PO4 dan 0,1 g
(NH4)2SO4. Disterilisasi dengan menggunakan alat autoklaf pada suhu 121oC selama 1
jam lalu didinginkan. Ditambahkan ragi roti sebanyak 1 gram. Difermentasi selama 2,
4, 6, dan 8 hari. Dilakukan perlakuan yang sama untuk variasi berat ragi roti 2 dan 3
gram.
3.2.3.7. Destilasi Larutan Fermentasi Glukosa Hasil Hidrolisis Selulosa Ampas Tebu
Dimasukkan larutan fermentasi glukosa hasil hidrolisis selulosa ampas tebu ke dalam
labu leher dua. Dirangkai alat destilasi. Didestilasi pada suhu 78 – 80o C dengan
termostat. Ditampung destilat pada erlenmeyer yang ditutup dengan plastik dan diikat
karet. Ditambahkan 1 gram CaO kedalam destilat. Diaduk dan didiamkan selama 30
3.2.3.8. Penentuan Kurva Kalibrasi Etanol Standar
Disiapkan larutan standar etanol dengan konsentrasi 0,2 ; 0,4 ; 0,6 ; 0,8 ; 1,0 ; 1,2 ;
1,4 ; 1,6 ; 1, 8 dan 2,0 %. Dipipet sebanyak 5 mL dari masing-masing larutan etanol
yang telah disiapkan lalu diencerkan kedalam labu takar 100 mL. Dipipet 1 mL
larutan etanol hasil pengenceran kemudian dimasukkan kedalam gelas Erlenmeyer.
Ditambahkan 5 mL K2Cr2O7 0,689N. Ditambahkan 3 tetes indikator ferroin. Dititrasi
dengan Fe(NH4)2(SO4)2.6H2O 0,393N hingga larutan berwarna coklat kemerahan.
3.2.3.9. Analisa Kadar Bioetanol Dengan Metode Oksidasi Kalium Dikromat
Dimasukkan 1 mL destilat kedalam gelas Erlenmeyer. Ditambahkan 5 mL K2Cr2O7
0,689N.Ditambahkan 3 tetes indikator ferroin.Dititrasi dengan Fe(NH4)2(SO4)2. 6H2O
3.3 Bagan Penelitian
3.3.1 Isolasi Selulosa dari Ampas Tebu dan Uji Kualitatif Selulosa
Dicuci dengan aquades hingga pH = 7 dan disaring
Ditambahkan 375 mL NaOH 2% dan 375 mL Na2SO3 2% Dipanaskan menggunakan termostat selama 1 jam pada suhu 50oC Disaring
Dicuci dengan akuades hingga pH = 7 Ditambahkan 500 mL Na-Hipoklorit 1,75%
Dipanaskan dengan menggunakan termostat selama 30 menit pada suhu 100oC Disaring
Dicuci dengan akuades hingga pH = 7 Ditambahkan 500 mL NaOH 17,5%
Dipanaskan dengan menggunakan termostat selama 30 menit pada suhu 80oC Disaring
Dicuci dengan akuades hingga pH = 7 Ditambahkan 500 mL Na-Hipoklorit 1,75%
Dipanaskan dengan menggunakan termostat selama 5 menit pada suhu 100oC Disaring
Dicuci dengan akuades hingga pH = 7
Dikeringkan didalam oven pada suhu 60oC Ditimbang massanya
Dimasukkan selulosa secukupnya kedalam plat tetes Diteteskan dengan larutan Iodin 0,1N
Jika tidak terjadi perubahan warna berarti menunjukkan positif selulosa 75 gram ampas tebu halus
3.3.2. Hidrolisis Selulosa Ampas Tebu dan Uji Kuantitatif Glukosa
Dimasukkan kedalam gelas erlenmeyer
Ditambahkan 8 mL HCL 30%
Ditutup dengan menggunakan kapas dan
aluminium foil
Dipanaskan dengan menggunakan termostat pada
suhu 80oC selama 30 menit
Didinginkan
Ditambahkan NaOH 10% hingga pH = 4 – 5
Disaring
Dipipet 1 mL Diuji kadar glukosa dengan
Dimasukkan kedalam tabung reaksi metode Nelson Somogyi
Ditambahkan larutan Benedict
secukupnya
Dipanaskan dengan termostat hingga terbentuk
endapan merah bata
0,5 g selulosa ampas tebu
Larutan glukosa Residu
Hasil
3.3.3. Pembuatan Larutan Fermentasi
Dipipet 100 mL dan dimasukkan kedalalm
erlenmeyer
Ditambahkan 0,1g MgSO4.7H2O, 0,1g KH2PO4,
dan 0,1g (NH4)2SO4
Disterilisasi dengan autoklaf pada suhu 121oC
selama 1 jam lalu didinginkan
Ditambahkan ragi roti sebanyak 1 gram
Difermentasi selama 2, 4, 6, dan 8 hari
Dilakukan perlakuan yang sama untuk variasi ragi roti 2 dan 3 gram Larutan glukosa
3.3.4. Destilasi Larutan Hasil Fermentasi dan Uji Kuantitatif Bioetanol
Dimasukkan kedalam labu leher dua
Didestilasi pada suhu 78o-80oC dengan
termostat
Ditampung destilat pada erlenmeyer yang
ditutup dengan plastik dan diikat dengan karet
Ditambahkan 1 g CaO
Diaduk dan didiamkan selama 30 menit Disaring
Dipipet 1mL
Dimasukkan kedalam erlenmeyer
Ditambahkan 5mL K2Cr2O7 0,689N
Ditambahkan 3 tetes indikator ferroin
Dititrasi dengan Fe(NH4)2(SO4)2.6H2O 0,393 N hingga terbentuk larutan
berwarna merah kecoklatan
Dicatat volume yang terpakai
Dihitung kadar bioetanol yang diperoleh Larutan Hasil Fermentasi
Destilat
Hasil
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dalam pembuatan bioetanol dari fermentasi glukosa hasil hidrolisis selulosa ampas
tebu terlebih dahulu dilakukan isolasi selulosa dari ampas tebu, dimana pada
penelitian ini berat selulosa yang diperoleh sebesar 24,56 g dari 75 g ampas tebu
dengan kadar 29,81 %.
Selulosa hasil isolasi ampas tebu kemudian dihidrolisis menggunakan HCl
30%. Hasil hidrolisis dianalisa secara kuantitatif dengan metode Nelson-Somogyi
menggunakan spektrofotometer visible untuk mengetahui kadar glukosa hasil
hidrolisis.
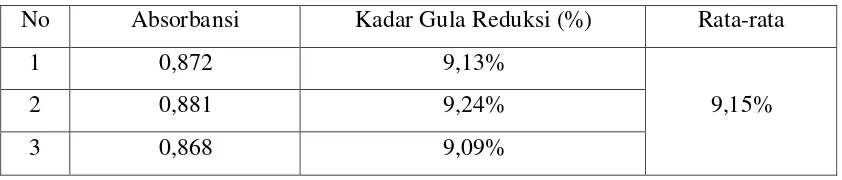
Tabel 4.1 Hasil Analisis Kadar Glukosa Hasil Hidrolisis Selulosa Ampas Tebu
No Absorbansi Kadar Gula Reduksi (%) Rata-rata
1 0,872 9,13%
9,15%
2 0,881 9,24%
3 0,868 9,09%
Glukosa yang diperoleh dari hasil hidrolisis selulosa ampas tebu kemudian
difermentasikan dengan variasi lama fermentasi yaitu 2, 4, 6, dan 8 hari. Sedangkan
variasi berat ragi roti yang digunakan yaitu 1, 2, dan 3 g. Setelah itu dilakukan tahap
destilasi sehingga diperoleh bioetanol yang kadarnya dianalisa dengan menggunakan
metode oksidasi kalium dikromat. Dimana kadar tertinggi bioetanol yang diperoleh
Untuk lebih jelasnya, kadar bioetanol untuk setiap variasi lama fermentasi dan
variasi penambahan ragi roti dapat dilihat pada Lampiran C.
4.2 Perhitungan
4.2.1 Perhitungan Kadar Selulosa Dalam Ampas Tebu
Kadar selulosa dapat dihitung dengan rumus sebagai berikut :
B−S
����������� x 100%
Dimana :
B = berat cawan + berat sampel setelah pengeringan 110oC
S = berat cawan + berat sampel setelah pengeringan 550oC
Jika diketahui B = 53,32 g dan S = 48,77 g, untuk berat sampel yang digunakan
15,26 g
Maka kadar selulosanya adalah :
B−S
�����������
x 100%
= 53,32−48,77
15,26 x 100%
= 29,81 %
4.2.2. Perhitungan Kadar Glukosa Hasil Hidrolisis Selulosa Ampas Tebu
Untuk menghitung kadar gula reduksi hasil hidrolisis selulosa ampas tebu dengan
kurva kalibrasi larutan glukosa standar dengan berbagai konsentrasi dan absorbansi
sebagai berikut:
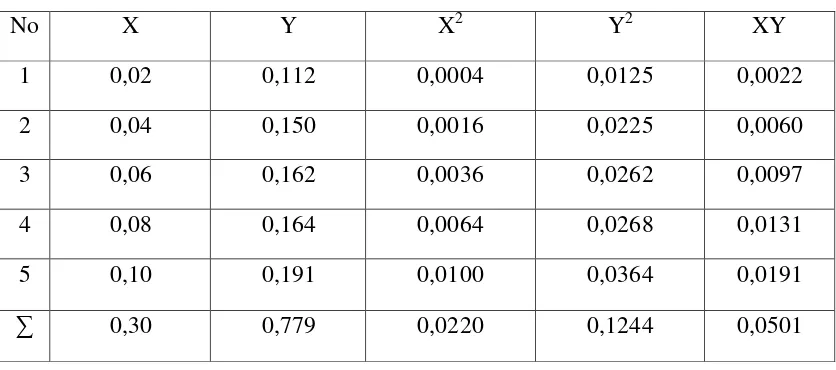
Tabel 4.2 Data Penentuan Larutan Glukosa Standar (mg/mL) Pada Berbagai
Konsentrasi
Maka persamaan garis regresinya adalah
Untuk memperoleh Ybaru maka persamaan di atas disubsitusikan sehingga memperoleh
data baru yang baru.
Contoh :
Absorbansi dari pengukuran glukosa dengan konsentrasi 0,02 mg/mL adalah 0,112
dengan slope (a) = 0,84 dan intersep (b) = 0,105, maka :
Y1 = aX + b
Y1baru = 0,84 (0,02) + 0,105 = 0,1218
Dengan cara yang sama, maka Ybaru dapat dihasilkan yang dapat dilihat pada
Lampiran D.
Untuk mendapatkan kadar glukosa hasil hidrolisis selulosa ampas tebu, terlebih
dahulu dicari harga X dengan persamaan garis regresi yang setelah diperoleh
kemudian disubsitusikan ke dalam rumus :
Kadar gula reduksi =
X
.
Fp
S
�
100%
Dimana :
X = konsentrasi glukosa dari perhitungan regresi
Fp = faktor pengenceran (mL)
S = berat sampel kering (mg)
Contoh :
Absorbansi suatu pengukuran adalah 0,872 dengan faktor pengenceran 50 mL dan
berat sampel kering 0,5 g, maka :
0,872 = 0,84X + 0,105
Kadar gula reduksi = 0,913�50
500
�
100%
= 9,13%
Data selengkapnya pengukuran kadar gula reduksi pada Tabel 4.1
4.2.3. Perhitungan Kadar Bioetanol
Untuk menghitung kadar bioetanol dari fermentasi glukosa hasil hidrolisis selulosa
ampas tebu yaitu dengan menggunakan metode oksidasi kalium dikromat. Dengan
menggunakan persamaan garis regresi dari kurva kalibrasi larutan etanol standar
dengan berbagai konsentrasi sebagai berikut :
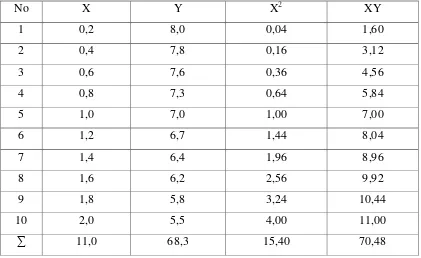
Tabel 4.3 Data Penentuan Kadar Etanol Standar Pada Berbagai Konsentrasi
b =
(∑�2) (��)−∑�(∑��)�(∑�2)−(∑�)2
=
(15,40)(68,3)−(11,0)(70,48)
10(15,40)−(11)2
= 10,5157
Maka persamaan garis regresinya adalah
Y = aX + b
Y = -1,4090X + 10,5157
Dimana :
X = kadar etanol (%)
Y = volume pentiter Fe(NH4)2(SO4)2 0,393 N (mL)
a = slope
b = intersept
Dengan menggunakan persamaan garis regresi diatas maka konsentrasi bioetanol
dapat ditentukan sebagai berikut :
Contoh :
Volume pentiter untuk lama fermentasi 2 hari dengan penambahan 1 gram ragi roti
yaitu 8,5 mL, maka kadar bioetanolnya adalah :
Y = aX + b
X = 8,5−10,5157 −1,4090
= 1,43%
Dengan cara yang sama, maka kadar bioetanol selengkapnya dapat dilihat pada
4.3. Pembahasan
Pembahasan dari hasil penelitian ini terletak pada pengaruh lama fermentasi yang
divariasikan yaitu 2 hari, 4 hari, 6 hari, dan 8 hari. Sedangkan untuk variasi
penambahan ragi roti yaitu 1 gram, 2 gram dan 3 gram.
4.3.1. Variasi Lama Fermentasi Terhadap Kadar Bioetanol
Ketika waktu fermentasi semakin lama maka akan memberikan kesempatan lebih
lama juga kepada mikroba untuk menguraikan glukosa menjadi bioetanol sehingga
memungkinkan untuk diperoleh kadar bioetanol yang tinggi. Hal ini tentunya juga
berhubungan dengan penurunan jumlah glukosa dimana glukosa berfungsi sebagai
nutrisi bagi mikroba selama proses fermentasi berlangsung.
Dari hasil penelitian yang dilakukan dapat dilihat bahwa dengan bertambahnya
waktu fermentasi maka kadar bioetanol yang dihasilkan juga semakin bertambah.
Dimana kadar bioetanol paling kecil terjadi pada lama fermentasi 2 hari dengan
penambahan 1 gram ragi roti yaitu 1,43%. Hal ini dikarenakan mikroba berada pada
fase adaptasi dan aktivitas mikroba juga belum optimal untuk menguraikan glukosa
menjadi bioetanol. Sedangkan fermentasi 6 hari dengan penambahan 2 gram ragi roti
dihasilkan kadar bioetanol paling tinggi yaitu 5,12%. Pada hari ke enam inilah
mikroba berada pada fase eksponensial dan waktu paling optimum bagi mikroba
untuk dapat menguraikan glukosa menjadi bioetanol. Pada fermentasi 8 hari dengan
penambahan 3 gram ragi roti dihasilkan kadar bioetanol yaitu 3,41%. Pada hari ke
delapan ini mikroba telah memasuki fase kematian yang dapat dilihat adanya serbuk
putih diatas larutan fermentasi. Fase kematian ini disebabkan karena penurunan
jumlah nutrisi sehingga mikroba tidak mampu mengubah substrat glukosa menjadi
4.3.2. Variasi Penambahan Ragi Roti Terhadap Kadar Bioetanol
Jumlah mikroba yang terdapat di dalam media fermentasi sangat berpengaruh
terhadap kadar bioetanol yang dihasilkan. Dimana semakin banyak mikroba yang
ditambahkan maka kadar bioetanol yang dihasilkan juga akan semakin bertambah. Hal
ini disebabkan karena mikroba yang menguraikan glukosa menjadi bioetanol semakin
bertambah. Pada dasarnya penambahan ragi yang berbeda pada proses fermentasi
untuk setiap bahan juga akan berpengaruh besar terhadap kadar bioetanol yang
dihasilkan.
Dari hasil penelitian yang dilakukan dapat dilihat bahwa semakin banyak
jumlah ragi roti yang ditambahkan maka kadar bioetanol yang dihasilkan semakin
tinggi. Dimana kadar bioetanol tertinggi diperoleh pada penambahan ragi roti 2 gram
dengan lama fermentasi 6 hari yaitu 5,12%. Hal ini dikarenakan adanya aktivitas
mikroba yang optimal dalam mengubah glukosa menjadi bioetanol. Sedangkan kadar
bioetanol terendah diperoleh pada penambahan ragi roti 1 gram dengan lama
fermentasi 2 hari yaitu 1,43%. Hal ini dikarenakan jumlah mikroba yang mengubah
glukosa menjadi bioetanol terlalu sedikit dan mikroba masih berada pada fase adaptasi
serta mikroba belum mampu untuk memecah glukosa secara optimal sehingga kadar
bioetanol yang dihasilkan masih terlalu rendah. Pada penambahan ragi roti 3 gram
dengan lama fermentasi 6 hari kadar bioetanol yang diperoleh menurun yaitu 3,98%
dibandingkan dengan penambahan ragi roti 3 gram dengan lama fermentasi 4 hari. Hal
ini disebabkan jumlah nutrisi selama fermentasi tidak sebanding dengan jumlah
mikroba yang ada sehingga mikroba lebih cepat memasuki fase kematian sebelum
secara optimal dapat mengubah glukosa menjadi bioetanol akibatnya kadar bioetanol
yang dihasilkan menurun.
Berikut ini adalah kurva pertumbuahn mikroorganisme yang sesuai dengan
fase stationer
fase pertumbuhan fase kematian
fase hidup
fase adaptasi
Waktu pertumbuhan
Keterangan kurva pertumbuhan mikroorganisme sebagai berikut :
1. Fase Adaptasi
Pada fase ini mikroorganisme masih menyesuaikan diri dengan lingkungan
baru, dimana bermacam-macam enzim dan zat perantara dibentuk sehingga
memungkinkan pertumbuhan lebih lanjut. Sel-selnya mulai membesar tetapi
belum membelah diri.
2. Fase Pertumbuhan
Pada fase ini mikroorganisme mulai membelah diri, tetapi dimana pada fase ini
metabolisme paling pesat sehingga bahan sel sangat cepat dan konstan.
Keadaan ini berlangsung terus sampai salah satu atau beberapa nutrien habis
atau telah terjadi penimbunan atas hasil metabolisme yang bersifat racun yang
menyebabkan terhambatnya pertumbuhan.
3. Fase Stationer
Pada fase ini jumlah mikroorganisme yang dihasilkan sama dengan jumlah
mikroorganisme yang mati sehingga jumlah sel mikroorganisme yang hidup
konstan.
4. Fase Kematian
Pada fase ini kecepatan kematian terus meningkat sedangkan kecepatan
pembelahannya menjadi nol. Setelah sampai ke fase kematian, logaritma
kecepatan kematian mencapai maksimal dan jumlah sel menurun. Hal ini
biasanya disebabkan karena jumlah nutrisi yang sudah habis.