Lampiran 1: Data perhitungan kadar glukosa
Rumus Perhitungan:
A = (VB – VS) x N Na2S2O3 0.1
Gula Reduksi (%) = A x Fp x100% W x 103
Keterangan: Vs = Volume Titrasi Sampel (mL)
Vb = Volume Titrasi Blanko (mL)
Fp = Faktor Pengenceran
N = Normalitas Na2S2O3 (N)
W = Berat Sampel (g)
A = Angka Tabel
Waktu Hidrolisis
(menit)
Massa Sampel
(g)
Blangko (mL)
Volume Sampel (mL)
Kadar Glukosa
(%)
90 2.0003 24.6 18.7 7.37
120 2.0004 24.6 17.4 9.2
Lampiran 2 : Angka tabel Penetapan Kadar Glukosa Menurut Luff-Schoorl
Na2S2O3
(mL) Glukosa Galaktosa Laktosa Maltose
1 2,4 2,7 3,6 3,9
2 4,8 5,5 7,3 7,8
3 7,2 8,3 11,0 11,7
4 9,7 11,2 14,7 15,6
5 12,2 14,1 18,4 19,6
6 14,7 17,0 22,1 23,5
7 17,2 20,0 25,8 27,5
8 19,8 23,0 29,5 31,5
9 22,4 26,0 33,2 35,5
10 25,0 29,0 37,0 39,5
11 27,6 32,0 40,8 43,5
12 30.0 35,0 44,6 47,5
13 33,0 38,1 48,4 51,6
14 35,7 41,2 52,2 55,7
15 38,5 44,4 56,0 59,8
16 41,3 47,6 59,9 63,9
17 44,2 50,8 63,8 68,0
18 47,1 54,0 67,7 72,2
19 50,0 57,3 71,7 76,5
20 52,1 60,7 75,7 80,9
21 56,1 64,2 79,8 85,4
22 59,1 67,7 83,9 90,0
Lampiran 4 : Perhitungan Konversi Glukosa Menjadi Etanol
C6H12O6 2C2H5OH + 2CO2
C6H12O6 = % C6H12O6 x Vol. Fermentasi
= 9,2 % x 150 mL
= 13,8 mL
W C6H12O6 = ρ C6H12O6 x Vol. C6H12O6
= 1,54 g/mL x 13,8 mL
= 21,252 g
Neraca Massa Reaksi Fermentasi (jika α = 100%)
Jika α reaksi = 100%, maka etanol yang terbentuk = 10.86244 g Jika ρ C2H5OH = 0.789 g/mL, maka
Dilakukan perhitungan yang sama untuk kadar glukosa 6.64% dan 7.37%
Hasil dari perhitungannya adalah: 6.64% = 9.9357 mL dan 7.73% = 11.02 mL
Keterangan : ρ C6H12O6 = 1,54 g/mL
ρ C2H5OH = 0.789 g/mL
BM C6H12O6 = 180 g/mol
BM C2H5OH = 46 g/mol
BM CO2 = 44 g/mol
Komponen In Out
C6H12O6 21.252 g - C2H5OH - 10.86244 g
CO2 - 10.39016 g
Lampiran 5 : Gambar proses pembuatan selulosa
Gambar Tongkol Jagung Gambar Penambahan Larutan NaOCl 1.75%
Lampiran 6: Gambar Pengujian Glukosa
Gambar Proses Pentitrasian dengan Gambar Penambahan Indikator Larutan Na2SO3 0,1 N Kanji 0,5%
Lampiran 7 : Gambar proses fermentasi dan proses pemurnian bioetanol
Gambar Proses Fermentasi Gambar Proses Pemisahan Bioetanol
DAFTAR PUSTAKA
Abidin, R. 2009. Membuat Bensin dari Ubi. Jakarta : Bentara Cipta Prima
Almatsier, S. 2001. Prinsip Dasar Ilmu Gizi. Jakarta : Gramedia Pustaka Utama.
Diana hidayati. 2006. Bahan Tambahan Pangan. Yogyakarta: Kanisius.
Deguchi, S. 2006. Cooking Cellulose in Hot and Compressed Water. New Jersey: Prentice Hall
Fessenden, R.J. dan J.S Fessenden. 1986. Kimia Organik. Jilid 2. Edisi ketiga. Jakarta : Erlangga
Goldsworthy, P. R. and N. M. Fisher. 1984. The Physiology Of Tropical Field Crops. New York: John Wiley &Sons, Ltd
Hambali, E. 2007. Teknologi Bioenergi. Jakarta: Agromedia Pustaka
Hasyim, H. 2008. Diktat Pengantar Pemuliaan Tanaman. Medan: USU Press
Holtzapple, M. T. 2003. Hemicelluloses In Encyclopedia of Food Sciences and Nutrition. Washington DC : Academic Press
Iyabu, H. 2014. Biokonversi Limbah Tongkol Jagung Menjadi Bioetanol Sebagai Bahan Bakar Terbarukan. Skripsi. FMIPA. UNG.
Kartasapoetra, Ance Gunarsih. 1990. Klimatologi Pengaruh Iklim Terhadap Tanah dan Tanaman. Jakarta: Bumi Aksara
Komarayati, S dan Gusmailina. 2010. Prospek Bioetanol Pengganti Minyak Tanah. Bogor
Klemm D, Philipp B, Heinze T, Heinze U, dan Wagenknecht W. 1998. Comprehensive Cellulose Chemistry:Fundamentals and Analytical
Methods. Vol.1. Weiheim:Wiley-VCH Verlag GmBH
Lehninger, A.L. 1993. Dasar-dasar biokimia. Jilid 1, 2, 3. (Alih bahasa oleh; M. Thenawidjaja). Jakarta: Erlangga
Nuringtyas, Tri Rini. 2010. Karbohidrat. Yogyakarta: Gajah Mada University Press
Poedjiadi, A. 1994. Dasar-dasar Biokimia. Jakarta : UI-Press
Rukmana, H.R. 1997. Ubi Kayu Budidaya dan Pasca Panen. Yogyakarta: Kanisius
Shofiyanto, M. Edy. 2008. Hidrolisa Tongkol Jagung oleh Bakteri Selulolitik Untuk Produksi Bioetanol Dalam Kultur Campuran. Fakultas Teknologi Pertanian IPB. Bogor
Sjostrom, E. 1995. Kimia Kayu Dasar – Dasar dan Penggunaan. Edisi 2. Gadjah Mada University Press : Yogyakarta
Stenius, P. 2000. Forest Products Chemistry. Finlandia: Fapet OY
Subagio, A.2007. Manajemen Pengolahan Kue dan Roti. Edisi Pertama. Yogyakarta: Graha Ilmu
Sudarmadji, S. 1984. Analisa Bahan Makanan dan Pertanian. Yogyakarta: liberti
Taherzadeh, M. J., & Karimi, K. (2007). Enzyme-based hydrolysis processes for ethanol from lignocellulosic materials. New Jersey: Humana Press Inc
Torget, R.W. 2003. Applied Biochemistry and Biotechnology Heterogeneous Aspects of Acid Hydrolysis of α-celulose. Colorado: Humana Press
Waites, M.J., Morgan, N.L., Rockey, J.S., dan Higton, G., 2001, Industrial Microbiology : An Introduction, 23-25. Oxford: Blackwell Science Ltd
Walker, S. 2008. Biochemistry Demystified. New York: Mc. Graw Hill
Warisno. 1998. Budidaya Jagung Hibrida. Kanisius. Jakarta
BAB 3
BAHAN DAN METODE PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat-Alat
Alat-alat yang digunakan adalah:
- Alat Autoklaf Fiesher Scientific
- Buret Pyrex
- Hot Plate Stirer Cimarec
- Labu Ukur Pyrex
- Neraca Analitik Sartorius
- pH Universal p.a. Merck
- Pipet Volume Pyrex
- Termometer Fischer
- Oven Griffin
- Kondensor Pyrex
- Labu Leher Tiga Pyrex
- Bunsen
- Bola Karet
- Botol Akuades
- Corong
- Kertas Saring Whatman
- Penangas Air
- Pipet Tetes
- Statif dan Klem
- Spatula
- Stirer Magnetik
- Gelas Erlenmeyer Pyrex
- Desikator
- Gelas Ukur Pyrex
- Tungku Kaki Tiga
- Penjepit Tabung
- Tabung Reaksi
- Plastik dan Karet
- Kapas
3.1.2 Bahan-Bahan
Bahan-bahan yang digunakan adalah:
- Tongkol Jagung
- Ragi Roti Saff Instant
- CuSO4.5H2O p.a. Merck
- Etanol 99,9% p.a. Merck
- H2SO4(p) p.a. Merck
- KH2PO4 p.a. Merck
- K2Cr2O7 p.a. Merck
- MgSO4.7H2O p.a. Merck
- NaOH p.a. Merck
- Na2SO3 p.a. Merck
- HNO3(p) p.a. Merck
- HCl(p) p.a. Merck
- NaNO3 p.a. Merck
- Na-Hipoklorit p.a. Merck
- C6H12O6 p.a. Merck
3.2 Pembuatan Larutan Pereaksi
3.2.1 Larutan HCl 1%
Sebanyak 2.7 mL HCl 37% diencerkan dengan akuades dalam labu ukur
100 mL hingga garis tanda lalu dihomogenkan.
3.2.2 Larutan NaOH 0,6%
Sebanyak 0,6 g NaOH pellet dilarutkan dengan akuades dalam labu ukur
100 mL hingga garis tanda lalu dihomogenkan.
3.2.3 Larutan HNO3 3,5%
Sebanyak 54,6 mL HNO3 64% ditambahkan 10 mg NaNO3 lalu
diencerkan dengan akuades dalam labu ukur 1000 mL hingga garis tanda lalu
dihomogenkan.
3.2.4 Larutan NaSO3 2%
Sebany ak 10 g NaSO3 dilarutkan dengan akuades dalam labu ukur 500 mL
hingga garis tanda lalu dihomogenkan.
3.2.5 Larutan NaOH 2%
Sebanyak 10 g NaOH pellet dilarutkan dengan akuades dalam labu ukur
500 mL hingga garis tanda lalu dihomogenkan.
3.2.6 Larutan NaOH 17,5%
Sebanyak 87,5 g NaOH pellet dilarutkan dengan akuades dalam labu ukur 500 mL
hingga garis tanda lalu dihomogenkan.
3.2.7 Larutan Na-Hipoklorit 1,75%
Sebanyak 72,9 mL Na-Hipoklorit 12% diencerkan dengan akuades dalam labu
3.3 Prosedur Penelitian
3.3.1 Isolasi Selulosa dari Tongkol Jagung
- Sebanyak 75 g tongkol jagung yang telah halus dimasukkan kedalam gelas
beaker 2000 mL
- Ditambahkan 1000 mL HNO3 3,5% dan 0,01 g NaNO2
- Dipanaskan dalam waterbath selama 2 jam pada suhu 90oC
- Disaring dan dicuci residu dengan akuades hingga pH=7
- Ditambahkan 375 mL NaOH 2% dan 375 mL Na2SO3 2%
- Dipanaskan selama 1 jam pada suhu 50oC
- Disaring dan dicuci residu dengan akuades hingga pH=7
- Ditambahkan 500 mL Na-Hipoklorit 1,75%
- Dipanaskan selama 30 menit pada suhu 70oC
- Disaring dan dicuci residu dengan akuades hingga pH=7
- Ditambahkan 500 mL NaOH 17,5%
- Dipanaskan selama 30 menit pada suhu 80oC
- Disaring dan dicuci residu dengan akuades hingga pH=7
- Ditambahkan H2O2 10%
- Dipanaskan selama 15 menit pada suhu 600C
- Disaring dan dicuci residu dengan akuades hingga pH=7
- Dikeringkan residu didalam oven pada suhu 60oC
- Dimasukkan kedalam desikator
3.3.2 Hidrolisis Selulosa Tongkol Jagung menjadi Glukosa serta Uji
Kualitatif Glukosa
- Dimasukkan 0,5 g tongkol jagung kedalam gelas erlenmeyer
- Ditambahkan dengan 8 mL HCl 1%
- Ditutup dengan kapas dan aluminium foil
- Dipanaskan dalam termostat pada suhu 80oC selama 90 menit
- Didinginkan hingga suhu kamar
- Disaring
- Dipipet 1 mL filtrat kedalam tabung reaksi
- Ditambahkan 5 mL Benedict
- Dipanaskan di waterbath hingga terbentuk endapan merah bata
- Dilakukan perlakuan yang sama untuk variasi lama waktu hidrolisis 120
menit, dan 150 menit.
3.3.3. Analisa Kandungan Glukosa Sampel
- Ditimbang sampel sebanyak 2 gram
- Dimasukan sampel ke dalam labu takar 50 ml
- Diencerkan sampai tanda tera
- Diambil 10 ml larutan dengan pipet volume
- Dimasukan kedalam erlenmeyer
- Ditambahkan 25 ml larutan luff schoorl dan 15 ml air suling
- Dipanaskan campuran (diusahakan agar larutan dapat mendidih selama
waktu 3 menit) dan dibiarkan mendidih selama 10 menit
- Didinginkan sampel dengan air yang berisi es
- Setelah dingin ditambahkan 15 ml larutan KI 20% dan 25 ml H2SO4 25 %
secara perlahan-lahan
- Dititrasi dengan larutan Na2S2O3 0,1 N
- Ditambahkan indikator kanji 0,5%
- Dicatat volume Na2S2O3 0,1 N yang terpakai
- Dilakukan perlakuan yang sama untuk volume blanko
3.3.4. Fermentasi Glukosa Hasil Hidrolisis Selulosa Tongkol Jagung
Menjadi Bioetanol
- Dimasukkan 100 mL larutan glukosa hasil hidrolisis tongkol jagung
kedalam gelas erlenmeyer 250 mL
- Ditambahkan 0,1 g MgSO4.7H2O, 0,1 g KH2PO4 dan 0,1 g (NH4)2SO4
- Disterilisasi dengan menggunakan alat autoklaf pada suhu 121oC selama 1
- Ditambahkan ragi roti sebanyak 3, 5, dan 7g
- Difermentasi selama 2, 4, dan 6 hari
3.3.5. Pemisahan Bioetanol dari Hasil Fermentasi
- Dirangkai alat destilasi
- Ditambahkan CaO kedalam sampel dengan perbandingan 1:2 (g/mL)
- Di destilasi sampel pada suhu 78oC selama 2 jam
- Ditampung destilat pada erlenmeyer yang ditutup dengan plastik dan
diikat karet
- Diukur volume destilat yang dihasilkan
3.4. Bagan penelitian
3.4.1. Isolasi Selulosa Tongkol Jagung
Dimasukkan ke dalam beaker glass 2000mL
Ditambahkan 1000mL HNO3 3,5% dan 0,01g NaNO2 Dipanaskan dalam waterbath selama 2 jam pada suhu 90oC
Dicuci dengan aquadest hingga pH = 7 dan disaring
Ditambahkan 375 mL NaOH 2% dan 375 mL Na2SO3 2% Dipanaskan selama 1 jam pada suhu 50oC
Disaring
Dicuci dengan akuades hingga pH=7 Ditambahkan 500mL Na-Hipoklorit 1,75% Dipanaskan selama 30 menit pada suhu 70oC Disaring
Dicuci dengan akuades hingga pH=7 Ditambahkan 500mL NaOH 17,5%
Dipanaskan selama 30 menit pada suhu 80oC Disaring
Dicuci dengan akuades hingga pH=7 Ditambahkan 250mL H2O2 10%
Dipanaskan selama 15 menit pada suhu 60oC Disaring
Dicuci dengan akuades hingga pH=7 Dikeringkan didalam oven pada suhu 60oC Ditimbang massanya
75 g Tongkol Jagung
Residu I Filtrat I
Residu V Filtrat V
3.4.2. Hidrolisis Selulosa Tongkol Jagung dan Uji Kuantitatif Glukosa
Dimasukkan kedalam gelas erlenmeyer Ditambahkan 8mL HCl 1%
Ditutup dengan menggunakan kapas dan aluminium foil Dipanaskan dalam thermostat pada suhu 80oC selama 90 menit
Didinginkan
Ditambahkan NaOH 0,7% hingga pH = 4-4,5 Disaring
Dipipet 1 mL Diuji kadar glukosa
Dimasukkan kedalam tabung reaksi metode Luff-Schroll Ditambahkan 5 mL Benedict
Dipanaskan didalam waterbath hingga terbentuk endapan merah bata
Dilakukan perlakuan yang sama untuk variasi lama waktu hidrolisis 120 menit,
dan 150 menit.
0,5 gram selulosa
Filtrat larutan gula hasil hidrolisis Residu
Hasil
3.4.3. Pembuatan Larutan Fermentasi
Dipipet 150 mL dan dimasukkan kedalam Erlenmeyer
Ditambahkan 0,1 g MgSO4.7H2O, 0,1 g KH2PO4, dan 0,1 g (NH4)2SO4
Disterilisasi dengan autoklaff pada suhu 121oC selama 1 jam lalu didiginkan
Ditambahkan ragi roti sebanyak 3 gram
Difermentasi selama 2 hari
Dilakukan perlakuan yang sama untuk variasi berat ragi roti 5 dan 7 g, dan variasi
lama fermentasi 4, dan 6 hari. Larutan Glukosa
3.4.4. Pemisahan Bioetanol dari Hasil Fermentasi dan Uji Kuantitatif
Bioetanol
Dirangkai alat destilasi
Ditambahkan CaO kedalam larutan
fermentasi dengan perbandingan 1:2 (V/B)
Di destilasi sampel pada suhu 78oC selama 1
jam
Diukur volume destilat
Dipipet 1 mL kedalam tabung reaksi Dianalisa kemurnian
Ditambahkan 2mL K2Cr2O7 bioetanol dengan
Ditambahkan 5 tetes H2SO4 menggunakan
Digoyang tabung reaksi hingga terjadi kromatografi gas
Perubahan warna
Larutan hasil fermentasi
Destilat
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Dalam pembuatan bioetanol dari fermentasi glukosa hasil hidrolisis selulosa
tongkol jagung terlebih dahulu dilakukan isolasi selulosa dari tongkol jagung,
diperoleh data sebagai berikut (tabel 4.1) :
Tabel 4.1 Hasil Isolasi Selulosa Tongkol Jagung
No. Berat Sampel
Uji Kualitatif Selulosa
Kimia
Selulosa tongkol jagung kemudian di analisa dengan menggunakan FTIR untuk memberikan informasi tentang adanya perubahan gugus fungsi yang
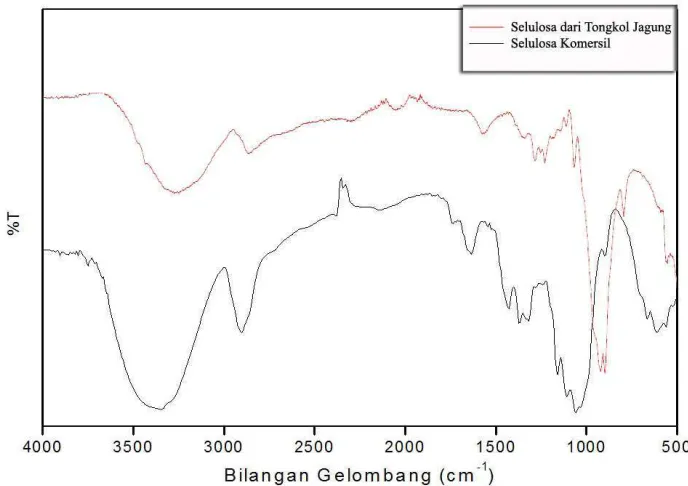
menandakan adanya interaksi secara kimia. Hasil FTIR dapat dilihat pada gambar 4.1 berikut ini:
Berdasarkan gambar 4.1 menunjukkan puncak khas pada spectrum FTIR dari selulosa tongkol jagung adalah (tabel 4.2) :
Tabel 4.2 Data FTIR Selulosa Tongkol Jagung
Panjang Gelombang (cm-1) Gugus Fungsi
α Selulosa Tongkol
Jagung
Selulosa tongkol jagung kemudian dihidrolisis menggunakan HCl 1%. Hasil
hidrolisis dianalisis secara kualitatif dan kuantitatif, pengujian kualitatif glukosa
dilakukan dengan menggunakan pereaksi Benedict sedangkan uji kuantitatif
glukosa dilakukan dengan metode Luff-Schroll (tabel 4.3 dan tabel 4.4), maka
diperoleh data sebagai berikut :
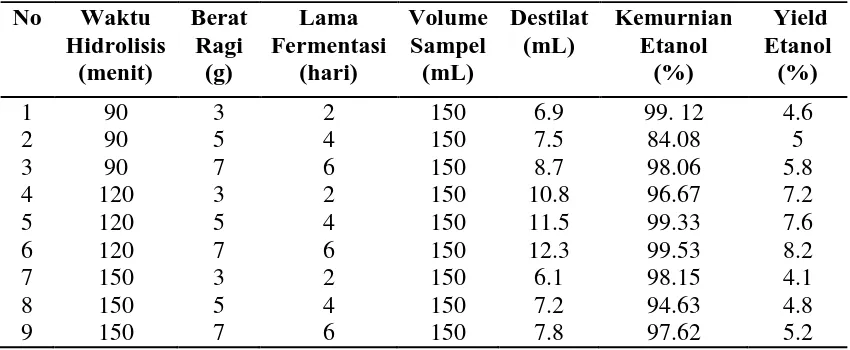
Tabel 4.3 Hasil Analisis Kualitatif Kadar Glukosa dari Hasil Hidrolisis
No. Sampel Penambahan Pereaksi Benedict
I Hidrolisis 90 menit Endapan merah bata II Hidrolisis 120 menit Endapan merah bata III Hidrolisis 150 menit Endapan merah bata
Tabel 4.4 Hasil Analisis Kuantitatif Kadar Glukosa dari Hasil Hidrolisis
Glukosa yang diperoleh dari hasil hidrolisis tongkol jagung kemudian
difermentasikan dengan variasi lama fermentasi yaitu 2, 4, dan 6 hari sedangkan
variasi berat ragi roti yang digunakan adalah 3, 5, dan 7 gram. Setelah itu
dilakukan tahap destilasi dengan menambahkan CaO untuk mengikat air dengan
kualitatif dengan pereaksi H2SO4 (p) + K2Cr2O7 yang akan menghasilkan larutan
biru. Setelah itu dilakukan pengujian kuantitatif dengan menggunakan
kromatografi gas. Berikut adalah data bioetanol yang diperoleh dengan variasi
waktu hidrolisis, berat ragi roti dan lama fermentasi (tabel 4.5 dan tabel 4.6):
Tabel 4.5 Hasil Analisis Kualitatif Bioetanol
No
Tabel 4.6 Hasil Analisis Kuantitatif Bioetanol
4.2. Pembahasan
4.2.1. Isolasi Selulosa Tongkol Jagung
Pada penelitian ini diperoleh berat selulosa 18.31, 20.36, 18,81, dan 19,73 gram,
kemudian selulosa hasil isolasi tongkol jagung diuji kualitatif yaitu secara fisika
dengan menambahkan air ke dalam tabung reaksi yang berisi hasil isolasi
kemudian digojog, dimana serbuk tersebut tidak larut dalam air yang menunjukan
sifat dari selulosa. Kemudian diuji secara kimia dengan penambahan iodin, tidak
terjadi perubahan warna.
4.2.2. Hidrolisis Selulosa Tongkol Jagung
Dalam penelitian ini, hidrolisis dilakukan dengan penggunaan asam, yaitu HCl
1%. Penggunaan konsentrasi asam klorida yang rendah dapat menghasilkan gula
yang tinggi dari selulosa tongkol jagung, sedangkan waktu hidrolisis yang
digunakan adalah 90, 120, dan 150 menit. Menurut Idral (2012) dalam Hendri
Iyabu (2014) waktu hidrolisis yang baik adalah 120 menit, karena jika waktu
hidrolisis terlalu lama maka glukosa akan terdegradasi dan bereaksi lebih lanjut
membentuk asam format, sehingga menyebabkan kadar glukosa menurun.
Terbukti bahwa pada penelitian ini kadar glukosa tertinggi diperoleh dari waktu
hidrolisis 120 menit yaitu 9.2%, dan mengalami penurunan menjadi 6.64% pada
waktu hidrolisis 150 menit.
4.2.3. Analisis Kadar Gula Reduksi
Sebelum difermentasi larutan hidrolisis diuji kualitatif dan kuantitatif untuk
mengetahui ada tidak nya gula reduksi dan untuk mengetahui jumlah gula reduksi
4.2.3.1. Analisis Kualitatif Gula Reduksi
Pengujian kualitatif gula reduksi dilakukan dengan menggunakan pereaksi
benedict, hasil yang terbentuk adalah endapan merah bata. Dalam penelitian ini
semua sampel positif mengandung glukosa, hal ini ditunjukan oleh adanya
endapan merah bata pada saat pengujian.
4.2.3.2. Analisis Kuantitatif Gula Reduksi
Pengukuran kadar glukosa dilakukan dengan menggunakan metode Luff Schoorl.
Pada penelitian ini diperoleh kadar gula reduksi berturut-turut 7.37%, 9.2%, dan
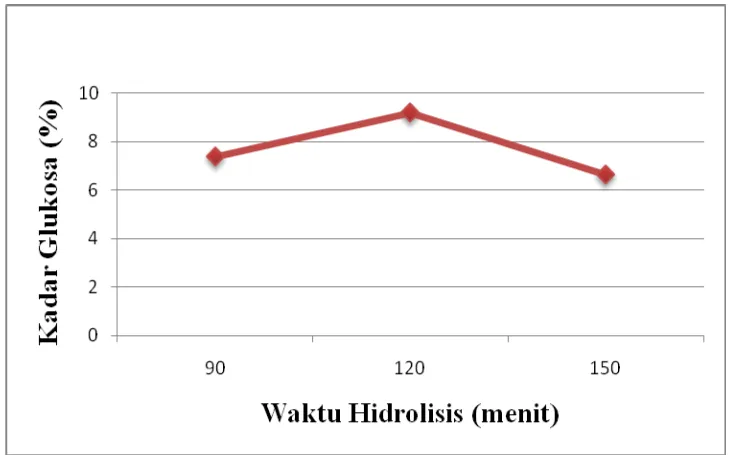
6.64%. Grafik hasil analisis kuantitatif kadar glukosa dari hasil hidrolisis
ditunjukkan pada gambar 4.2 :
Gambar 4.2 Hasil Analisa Kuantitatif Kadar Glukosa dari Hasil Hidrolisis
Hasil tersebut menunjukkan bahwa kadar gula reduksi tertinggi diperoleh pada
waktu hidrolisis 120 menit yaitu 9,2%, dan mengalami penurunan menjadi 6.64%
pada waktu hidrolisis 150 menit hal ini disebabkan karena gula reduksi yang di
4.2.4. Analisis Kadar Bioetanol
Bioetanol yang masih bercampur dengan media fermentasi ditambahkan dengan
CaO dengan perbandingan 1:2 (g/mL), lalu dipisahkan dengan menggunakan
destilasi. Fungsi CaO disini adalah untuk mengikat air sehingga yang didapatkan
adalah bioetanol murni. Destilat selanjutnya dianalisis secara kualitatif dan
kuantitatif untuk mengetahui kadar bioetanol yang dihasilkan.
4.2.4.1. Analisis Kualitatif Bioetanol
Dari pengujian secara kualitatif yang menggunakan pereaksi H2SO4 (p) + K2Cr2O7
diperoleh keseluruhan destilat dari tiap fermentasi memberikan uji positif
terhadap pereaksi ini, hal ini ditunjukkan oleh perubahan warna oleh adanya
perubahan warna pereaksi dari kuning menjadi biru.
4.2.4.2. Analisis Kuantitatif Bioetanol
Dari destilasi yang dilakukan diperoleh bahwa destilat yang dihasilkan pada
proses hidrolisis 90 dan 120 menit jumlah destilat semakin meningkat, sedangkan
pada proses hidrolisis 150 menit jumlah destilat menurun. Hal ini disebabkan oleh
berkurangnya kadar glukosa pada proses hidrolisis tersebut, yang mana glukosa
berperan sebagai nutrisi untuk mikroba. Semakin banyak glukosa yang dihasilkan
maka akan semakin banyak bioetanol yang diperoleh. Dari destilat yang diperoleh
maka yield bioetanol dapat dihitung dengan rumus yang tertera pada lampiran 2.
yield bioetanol tertinggi terdapat pada proses hidrolisis 120 menit dengan
penambahan ragi roti 7 gram dan lama fermentasi 6 hari yaitu 8.2%. Sedangkan
yield bioetanol terendah terdapat pada proses hidrolisis 150 menit dengan
penambahan ragi roti 3 gram dan lama fermentasi 2 hari yaitu 4.1%. Untuk
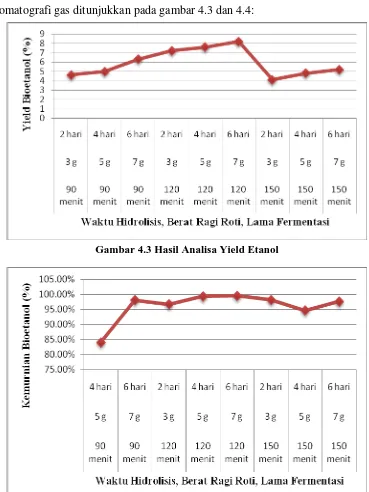
pengujian kemurnian bioetanol dilakukan dengan menggunakan kromatografi gas.
yaitu 84.08%. Grafik hasil analisis yield etanol dan kemurnian etanol dengan
kromatografi gas ditunjukkan pada gambar 4.3 dan 4.4:
Gambar 4.3 Hasil Analisa Yield Etanol
Gambar 4.4 Hasil Analisa Kemurnian Etanol
Penurunan kadar glukosa juga berpengaruh pada kadar bioetanol yang akan
diperoleh, semakin banyak glukosa yang ada pada suatu larutan maka bioetanol
yang dihasilkan akan semakin banyak dikarenakan glukosa tersebut sebagai
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Kadar glukosa yang diperoleh dari hasil hidrolisis selulosa adalah 7.37%,
9.2%, dan 6.64%. Penentuan kadar glukosa ini menggunakan metode
Luff-Schoorll
2. Kemurnian bioetanol tertinggi yang diperoleh adalah 99.53%
5.2. Saran
Kepada peneliti selanjutnya disarankan agar lebih meningkatkan
kemurnian bioetanol yang diperoleh, hal ini dikarenakan bioetanol yang
bisa digunakan sebagai bahan bakar kendaraan adalah dengan tingkat
BAB 2
TINJAUAN PUSTAKA
2.1. Jagung (Zea mays)
Jagung (Zea mays) merupakan tanaman C4 dan mampu beradaptasi dengan baik
pada faktor pembatas pertumbuhan dan produksi. Salah satu sifat tanaman jagung
sebagai tanaman C4, antara lain daun mempunyai laju fotosintesis lebih tinggi
dibandingkan tanaman C3, fotorespirasi dan transpirasi rendah, efisien dalam
penggunaan air. Tanaman jagung berakar serabut terdiri dari akar seminal, akar
adventif dan akar udara (Goldsworthy dan Fisher, 1980),
Tanaman jagung sangat bermanfaat bagi kehidupan manusia dan hewan.
Di Indonesia, jagung merupakan komoditi tanaman pangan kedua terpenting
setelah padi. Berdasarkan urutan bahan makanan pokok di dunia, jagung
menduduki urutan ke-3 setelah gandum dan padi. Akhir-akhir ini tanaman jagung
semakin meningkat penggunaannya. Tanaman jagung banyak sekali gunanya,
sebab hampir seluruh bagian tanaman dapat dimanfaatkan untuk berbagai macam
keperluan antara lain:
a. Batang dan daun muda sebagai pakan ternak
b. Batang dan daun tua sebagai kompos
c. Batang dan daun kering sebagai kayu bakar
d. Batang jagung sebagai pulp
e. Buah jagung sebagai bahan makanan (warisno,1998).
Linnaeus (1737), seorang ahli botani, memberikan nama Zea mays untuk
tanaman jagung. Zea berasal dari bahasa Yunani yang digunakan untuk
mengklasifikasikan jenis padi-padian. Adapun mays berasal dari bahasa Indian,
yaitu Mahiz atau Marisi yang kemudian digunakan untuk sebutan spesies. Sampai
Tanaman jagung merupakan tumbuhan semusim (annual). Susunan
tubuhnya (morfologi) terdiri dari akar, batang, daun bunga dan buah. Perakaran
tanaman jagung terdiri dari akar utama, akar cabang, akar lateral, dan akar rambut.
Sistem perakaran serabut yang berfungsi sebagai alat untuk menghisap air serta
garam-garam yang terdapat dalam tanah, berupa mineral-mineral senyawa kimia
yang mengeluarkan zat organik dari tanah dan alat pernafasan. Batang jagung
beruas-ruas (berbuku-buku) dengan jumlah ruas bervariasi antara 10-40 ruas.
Tanaman jagung tidak bercabang. Panjang batang jagung berkisar antara 60-300
cm (Rukmana, 1997).
Daun jagung tumbuh melekat pada buku-buku batang, struktur daun terdiri
atas tiga bagian yaitu kelopak daun, lidah daun (ligula) dan helaian daun. Jumlah
helaian daun bervariasi antar 8-48 helaian. Bunga jantan matang terlebih dahulu
1-2 hari dari pada bunga betina. Buah jagung terdiri atas tongkol, biji dan daun
pembungkus. B iji jagung mempunyai bentuk , warna dan kandungan endosperm
yang bervariasi tergantung jenisnya. (Hasyim, 2007).
Buah jagung terdiri atas tongkol, biji, dan daun pembungkus. Biji jagung
mempunyai bentuk, warna dan kandungan endosperm yang bervariasi, tergantung
pada jenisnya. Pada umumnya, biji jagung tersusun dalam barisan yang melekat
secara lurus atau berkelok-kelok dan berjumlah antara 8 – 20 baris biji. Biji
jagung terdiri atas tiga bagian utama, yaitu kulit biji (seedcoat), endosperm dan
embrio (Rukmana, 1997).
Faktor-faktor yang dapat mempengaruhi produksi tanaman jagung dapat
dari berbagai hal, salah satu contohnya yaitu faktor iklim. Iklim merupakan
keadaan dimana yang sangat menentukan sehingga tidak semua tanaman dapat
tumbuh pada setiap iklim. Selain iklim dapat menentukan produktivitas tanaman
jagung tetapi dapat juga menentukan dalam hal kandungan gizi yang dihasilkan
tanaman tetapi masyarakat tidak mementingkan gizi yang terkandung dalam
iklim tropis yang hanya memiliki 2 musim yaitu musim hujan dan kemarau.
i2.1.1. Taksonomi Jagung
Menurut Rukamana (1997) kedudukan jagung (Zea mays L.) diklasifikasikan
sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Class : Monocotyledoneae
Ordo : Poales
Famili : Poacea (Graminae)
Genus : Zea
Spesies : Zea mays L.
Rukmana (1997)
2.1.2. Tongkol Jagung
Tongkol jagung merupakan limbah tanaman yang setelah diambil bijinya tongkol
jagung tersebut umumnya dibuang begitu saja, sehingga hanya akan
meningkatkan jumlah sampah. Tongkol jagung dan biji jagung merupakan sumber
karbohidrat potensial untuk dijadikan bahan pangan, sayuran, dan bahan baku
sebagai industri makanan. Kandungan kimia jagung terdiri atas air 13,5%, protein
10%, lemak 4%, karbohidrat 61%, gula 1,4%, pentosan 6%, serat kasar 2,3%, abu
1,45%, dan zat-zat lain 0,4% (Rukmana,1997).
Tongkol jagung adalah tempat pembentukan lembaga dan gudang
penyimpanan makanan untuk pertumbuhan biji. Jagung mengandung kurang lebih
30% tongkol jagung sedangkan sisanya adalah kulit dan biji. Tongkol jagung
mengandung xylan 31,1%, selulosa 34,3%, lignin 17,7%, dan abu 16,9%
(Horiuchi, 2013). Komposisi kimia tersebut membuat tongkol jagung dapat
digunakan sebagai sumber energy, bahan pakan ternak, dan sebagai sumber
2.2. Karbohidrat
Karbohidrat merupakan bahan yang banyak terdapat dalam makanan, dan didalam
tubuh mengalami perubahan atau metabolisme. Hasil metabolisme karbohidrat
antara lain glukosa yang terdapat dalam darah, sedangkan glikogen adalah
karbohidrat yang disintesis dalam hati dan digunakan oleh sel-sel pada jaringan
otot sebagai sumber energy. Jadi ada bermacam-macam senyawa yang termasuk
dalam golongan karbohidrat ini. Dari contoh-contoh tadi kita mengetahui bahwa
amilum atau pati, selulosa, glikogen, gula, atau sukrosa dan glukosa merupakan
beberapa senyawa karborhidrat yang terpenting dalam kehidupan.
Molekul karbohidrat terdiri atas atom-atom karbon, hydrogen dan oksigen.
Jumlah atom hydrogen dan oksigen merupakan perbandingan 2:1 seperti molekul
air. Sebagai contoh molekul glukosa mempunyai rumus kimia C12H22O11. Pada
glukosa tampak bahwa jumlah atom hidrogen berbanding jumlah atom oksigen
ialah 12:6 atau 2:1, sedangkan pada sukrosa 22:11 atau 2:1. Dengan demikian
dahulu orang berkesimpulan adanya air dalam karbohidrat, yang berasal dari
“karbon” yang berarti mengandung unsur karbon dan “hidrat” yang berarti air.
(Poedjiadi, A. 1994)
Beberapa turunan molekul karbohidrat yang ada dan dapat dibentuk dari
pengurangan. Sebagai contoh, jika ada molekul yang mempunyai oksigen yang
jumlahnya lebih sedikit lalu kita katakana ini sebagai deoksi karbohidrat, dan
yang paling banyak dikenal adalah deoksiribosa yang komponen utamanya yaitu
deoksiribonukleat (DNA). Gula berbeda dari D-ribosa yang didalamnya terdapat
golongan hidroksil yang diganti oleh atom hydrogen (penghilangan satu oksigen).
Gula alkohol dibentuk ketika golongan karbonil direduksi menjadi
golongan hidroksil. Gula alkohol biasanya digunakan sebagai pengganti makanan.
Untuk alasan ini banyak produk seperti permen karet yang manis mengandung
gula alkohol. Yang paling penting kegunaan dari alkohol adalah dalam pembuatan
menghasilkan perubahan kecil pada tingkat gula darah. Selain itu, gula alkohol
diserap lalu diekskresikan ke urin dari pada untuk metabolisme (Walker, S. 2008).
2.2.1. Selulosa
Selulosa adalah polimer glukosa yang berbentuk rantai linier dan dihubungkan oleh ikatan β-1,4 glikosidik. Struktur yang linier menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah didegradasi secara kimia
maupun mekanis. Di alam, biasanya selulosa berasosiasi dengan polisakarida lain
seperti hemiselulosa atau lignin membentuk kerangka utama dinding sel
tumbuhan (Holtzapple, M.T.2003).
Unit penyusun (building block) selulosa adalah selobiosa karena unit
keterulangan dalam molekul selulosa adalah 2 unit gula (D-glukosa). Selulosa
adalah senyawa yang tidak larut di dalam air dan ditemukan pada dinding sel
tumbuhan terutama pada tangkai, batang, dahan, dan semua bagian berkayu dari
jaringan tumbuhan. Selulosa merupakan polisakarida struktural yang berfungsi
untuk memberikan perlindungan, bentuk, dan penyangga terhadap sel, dan
jaringan (Lehninger, A.L.1993).
Selulosa memiliki struktur yang unik karena kecenderungannya
membentuk ikatan hidrogen yang kuat. Ikatan hidrogen intramolekular terbentuk
antara: (1) gugus hidroksil C3 pada unit glukosa dan atom O cincin piranosa yang
terdapat pada unit glukosa terdekat, (2) gugus hidroksil pada C2 dan atom O pada
C6 unit glukosa tetangganya. Ikatan hidrogen antarmolekul terbentuk antara
gugus hidroksil C6 dan atom O pada C3 di sepanjang sumbu b (Gambar 4).
Dengan adanya ikatan hidrogen serta gaya van der Waals yang terbentuk, maka
struktur selulosa dapat tersusun secara teratur dan membentuk daerah kristalin. Di
samping itu, juga terbentuk rangkaian struktur yang tidak tersusun secara teratur
yang akan membentuk daerah nonkristalin atau amorf. Semakin tinggi packing
density-nya maka selulosa akan berbentuk kristal, sedangkan semakin rendah
dipengaruhi oleh sumber dan perlakuan yang diberikan. Rantai-rantai selulosa
akan bergabung menjadi satu kesatuan membentuk mikrofibril, bagian kristalin
akan bergabung dengan bagian nonkristalin. Mikrofibril-mikrofibril akan
bergabung membentuk fibril, selanjutnya gabungan fibril akan membentuk serat
(Klemm, D. 1998).
Gambar 2.1. Struktur Selulosa
Berdasarkan derajat polimerisasi dan kelarutan dalam senyawa natrium
hidroksida (NaOH) 17,5%, selulosa dapat dibedakan atas tiga jenis yaitu :
1. Selulosa α (Alpha Cellulose) adalah selulosa berantai panjang, tidak larut
dalam larutan NaOH 17,5% atau larutan basa kuat dengan derajat
polimerisasi 600 - 1500. Selulosa α dipakai sebagai penduga dan atau
penentu tingkat kemurnian selulosa. Selulosa α merupakan kualitas selulosa yang paling tinggi (murni). Selulosa α > 92% memenuhi syarat untuk digunakan sebagai bahan baku utama pembuatan propelan dan atau bahan
peledak, sedangkan selulosa kualitas dibawahnya digunakan sebagai bahan
baku pada industri kertas dan industri sandang/kain. Semakin tinggi kadar
alfa selulosa, maka semakin baik mutu bahannya (Nuringtyas, T.R.2010)
2. Selulosa β (Betha Cellulose) adalah selulosa berantai pendek, larut dalam
larutan NaOH 17,5% atau basa kuat dengan derajat polimerisasi 15 - 90,
dapat mengendap bila dinetralkan
3. Selulosa γ (Gamma cellulose) adalah sama dengan selulosa β, tetapi derajat polimerisasinya kurang dari 15. Bervariasinya struktur kimia selulosa (α, β, γ) mempunyai pengaruh yang besar pada reaktivitasnya. Gugus-gugus hidroksil yang terdapat dalam daerahdaerah amorf sangat mudah dicapai dan
daerah-daerah kristalin dengan berkas yang rapat dan ikatan antar rantai
yang kuat mungkin tidak dapat dicapai sama sekali. Pembengkakan awal
selulosa diperlukan baik dalam eterifikasi (alkali) maupun dalam esterfikasi
(asam) (Sjostrom. E, 1995).
2.2.2. Sifat-Sifat Selulosa
Selulosa tidak memiliki rasa, tidak berbau, tidak larut dalam air dan sebagian
pelarut organik. Selulosa dapat dipecah menjadi unit-unit kimia glukosa dengan
mereaksikannya dengan asam pekat pada suhu tinggi. Dibandingkan dengan
pati, selulosa jauh lebih bersifat Kristal. Dimana pati mengalami transisi Kristal
menjadi amorf ketika dipanaskan dalam air pada suhu mencapai 60-70oC.
sedangkan selulosa membutuhkan suhu 320oC dan tekanan 25 MPa untuk
menjadi amorf dalam air (Deguchi,S. 2006).
Kebanyakan sifat selulosa tergantung pada panjang rantai atau derajat
polimerisasi unit glukosa. Selulosa dari pulp kayu memiliki panjang rantai yang
khas antara 300-1700 unit. Kapas dan serat tanaman lainnya sama seperti
selulosa bakteri memiliki panjang rantai berkisar antara 800-10.000 unit
(Klemm,D. 1998).
Selulosa yang diturunkan dari tanaman biasanya ditemukan dalam suatu
campuran dengan hemiselulosa, lignin, pektin, dan zat-zat lain. Sementara
selulosa mikroba cukup murni, memiliki kadar air cukup tinggi dan terdiri dari
rantai panjang. Selulosa larut dalam kuprietilendiamin (CED),
kadmiumetilendiamin (cadoxen), N-metilmorfolina N-oksida, dan litium klorida
atau dimetil formamida. Pelarut-pelarut ini digunakan dalam produki selulosa
2.2.3. Hidrolisis Selulosa
Hidrolisis adalah salah satu tahapan pembuatan bioetanol berbahan baku
lignoselulosa. Hidrolisis bertujuan untuk memecah selulosa dan hemiselulosa
menjadi monosakarida (glukosa dan Xylosa) yang selanjutnya akan difermentasi
menjadi bioetanol. Secara umum teknik hidrolisis dibagi menjadi dua, yaitu:
hidrolisis berbasis asam dan hidrolisis dengan enzim.
Didalam metode hidrolisis asam, biomassa lignoselulosa dipaparkan
dengan asam pada suhu dan tekanan tertentu selama waktu tertentu, dan
menghasilkan monomer gula dari polimer selulosa dan hemiselulosa. Beberapa
asam yang umum digunakan untuk hidrolisis asam antara lain adalah asam sulfat
(H2SO4), asam perklorat, dan HCl. Asam sulfat merupakan asam yang paling
banyak diteliti dan dimanfaatkan untuk hidrolisis asam pekat dan hidrolisis asam
encer (Taherzadeh, M.J. 2007).
Hidrolisis selulosa lengkap dengan HCl 30%, hanya menghasilkan
D-glukosa. Disakarida yang terisolasi dari selulosa yang terhidrolisis sebagian
adalah selobiosa, yang dapat dihidrolisis lebih lanjut menjadi D-glukosa dengan
suatu katalis asam atau dengan emulsion enzim. Selulosa sendiri tidak mempunyai
karbon hemiasetal-selulosa sehingga tidak dapat mengalami mutarotasi atau
dioksidasi oleh reagensia seperti Tollens (Fessenden, R.J. 1986).
Selulosa Selobiosa Glukosa
Hidrolisis dalam suasana asam, yang menghasilkan pemecahan ikatan
glikosidik berlangsung dalam tiga tahap. Tahap pertama, proton yang bertindak
sebagai katalisator asam berinteraksi cepat dengan oksigen glikosida yang
menghubungkan dua unit gula (I), membentuk asam konjugat (II). Langkah ini
diikuti dengan pemecahan yang lambat dari ikatan C-O, yang menghasilkan zat
antara kation karbonium siklik (III). Protonisasi dapat juga terjadi pada oksigen
cincin (II), menghasilkan pembukaan cincin dan kation karbonium nonsiklik (III).
Tidak ada kepastian ion karbonium mana yang paling mungkin terbesar pada
cepat, membentuk hasil akhir yang stabil dan melepaskan proton (Torget, R.W.
2003).
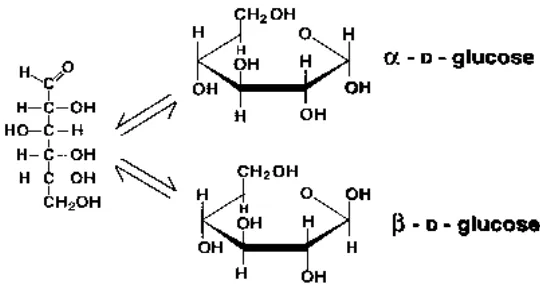
2.2.4. Glukosa
Dalam alam glukosa dihasilkan dari reaksi antara karbondioksida dan air dengan
bantuan sinar matahari dan klorofil dalam daun. Proses ini disebut fotosintesis
dan glukosa yang terbentuk terus digunakan untuk pembentukan amilum atau
selulosa
6CO2 + 6H2O Sinar matahari C6H12O6 + 6O2 Klorofil
Sebagian besar monosakarida dikenal sebagai heksosa, karena terdiri atas
6-rantai atau cincin karbon. Atom-atom hydrogen dan oksigen terikat pada rantai
atau cincin ini secara terpisah atau sebagai gugus hidroksil (OH). Ada tiga jenis
heksosa yang penting dalam ilmu gizi, yaitu glukosa, fruktosa, dan galaktosa.
Ketiga macam monosakarida ini mengandung jenis dan jumlah yang sama, yaitu
6 atom karbon, 12 atom hydrogen, dan 6 atom oksigen. Perbedaannya hanya
terletak pada cara penyusunan atom hydrogen dan oksigen disekitar
atom-atom karbon. Perbedaan dalam susunan atom-atom inilah yang menyebabkan
perbedaan dalam tingkat kemanisan, daya larut, dan sifat lain ketiga
monosakarida tersebut. Monosakarida yang terdapat di alam pada umumnya
terdapat dalam bentuk isomer dekstro (D). Gugus hidroksil ada karbon nomor 2
terletak disebelah kanan. Struktur kimianya dapat berupa struktur terbuka atau
struktur cincin (Poedjiadi, A.1994).
2.3. Analisa Kualitatif dan Kuantitatif Gula Pereduksi
2.3.1. Analisa Kualitatif Gula pereduksi
Beberapa cara untuk mengetahui adanya gula pereduksi dalam suatu bahan antara
lain:
a. Uji Molisch
Karbohidrat oleh asam sulfat pekat akan dihidrolisis menjadi monosakarida dan
selanjutnya monosakarida mengalami dehidrasi oleh asam sulfat menjadi furfural
atau hidroksi metal furfural. Senyawa-senyawa ini dengan alfa naftol akan
berkondensasi membentuk senyawa kompleks yang berwarna ungu.
b. Uji Iodin
Karbohidrat golongan polisakarida akan memberikan reaksi dengan larutan iodin
dan memberikan warna spesifik bergantung pada jenis karbohidratnya. Amilosa
dengan iodin akan berwarna biru, amilopektin dengan iodin akan berwarna merah
violet, glikogen maupun dextrin dengan iodin akan berwarna merah coklat.
c. Uji Pembentukan Osazon
Aldosa ataupun ketosa dengan fenilhidrasin dan dipanaskan akan membentuk
hidrason atau osazon. Reaksi antara senyawaan tersebut merupakan reaksi
oksido-reduksi, atom C yang mengalami reaksi adalah atom C nomor satu dan dua dari
aldosa atau ketosa. Fruktosa dan glukosa menunjukkan osason yang sama.
d. Uji Fehling
Larutan fehling yang terdiri dari campuran kupri sulfat, Na-K-tartrat dan natrium
hidroksida dengan gula reduksi dan dipanaskan akan terbentuk endapan berwarna
hijau, kuning orange atau merah tergantung dari macam gula reduksinya
e. Uji Benedict
Gula Reduksi dengan larutan Benedict (campuran garam kuprisulfat, Natrium
sitrat, dan Natrium Karbonat) akan terjadi reaksi reduksi oksidasi dan dihasilkan
endapan berwarna merah dari kuprooksida
O O
R C H + CuO Cu2O + R C OH
2.3.2. Analisa Kuantitatif Gula pereduksi
Penentuan karbohidrat yang termasuk polisakarida maupun oligosakarida
memerlukan perlakuan pendahuluan yaitu hidrolisis terlebih dahulu sehingga
diperoleh monosakarida. Untuk keperluan ini bahan dihidrolisis dengan asam atau
enzim pada suatu keadaan tertentu. Beberapa cara analisis kuantitatif
monosakarida antara lain:
a. Metode Luff Schoorl
Pada penentuan gula secara Luff Schoorl, yang ditentukan adalah kuprioksida
dalam larutan sebelum direaksikan dengan gula reduksi (titrasi Blanko) dan
sesudah direaksikan dengan sampel gula reduksi (titrasi sampel). Penentuannya
dengan titrasi menggunakan Na-tiosulfat. Selisih titrasi blanko dengan titrasi
sampel equivalent dengan kuprooksida yang terbentuk dan juga equivalent dengan
jumlah gula reduksi yang ada dalam bahan atau larutan.
b. Metode Munson-Walker
Penentuan gula cara ini adalah dengan menentukan banyaknya kuprooksida yang
terbentuk dengan cara penimbangan atau dengan melarutkan kembali dengan
asam nitrat kemudian menitrasi dengan tiosulfat. Jumlah kuprooksida yang
terbentuk equivalent dengan banyaknya gula reduksi yang ada dalam larutan dan
telah disediakan dalam bentuk tabel hammon, yakni hubungan antara banyaknya
kuprooksida dengan gula reduksi.
c. Metode Lane-Eynon
Penentuan gula cara ini dengan menitrasi reagen soxhlet (larutan CuSO4,
K-N-tartrat) dengan larutan gula yang diselidiki. Banyaknya larutan sampel yang
dibutuhkan untuk menitrasi reagen soxhlet dapat diketahui banyaknya gula yang
d. Metode Nelson-Somogyi
Metode ini dapat digunakan untuk mengukur kadar gula reduksi dengan
menggunakan reaksi tembaga arsenomolibdat. Kupri mula-mula direduksi
menjadi bentuk kupro dengan pemanasan larutan gula. Kupro yang terbentuk
berupa endapan selanjutnya dilarutkan dengan arsenomolibdat menjadi
molybdenum berwarna biru yang menunjukan konsentrasi gula. Dengan
membandingkan terhadap larutan standart, konsentrasi gula dalam sampel dapat
ditentukan. Reaksi warna yang terbentuk dapat menentukan konsentrasi gula
dalam sampel dengan mengukur absorbansinya (Sudarmadji,S.1987).
2.4. Fermentasi
Fermentasi merupakan suatu cara untuk mengubah substrat menjadi produk
tertentu yang dikehendaki dengan mengutamakan bantuan mikroba.
Produk-produk tersebut biasanya dimanfaatkan sebagai minuman atau makanan.
Fermentasi merupakan suatu cara yang telah dikenal dan digunakan sejak zaman
kuno. Sebagai suatu proses fermentasi memerlukan:
1. Mikroba inokulum
2. Tempat (wadah) yang menjamin proses fermentasi berlangsung
dengan optimal.
3. Substrat sebagai tempat tumbuh (medium) dan sumber nutrisi bagi
mikroba (Waites,M.J.2001).
Pada dasarnya fermentasi dapat langsung menggunakan enzim tetapi
sampai saat ini, industri fermentasi yang besar-besar masih memanfaatkan
mikroorganisme, antara lain karena cara ini jauh lebih murah dan mudah. Mikroba
yang banyak digunakan dalam proses fermentasi diantaranya adalah khamir,
kapang dan bakteri. Kegiatan demikian akan erat hubungannya dengan teknologi
microbial karena selain diperlukan galur-galur yang unggul alami dapat pula
dilakukan mutasi-mutasi induk sampai kepada rekayasa genetik. Istilah yang
banyak dipakai adalah “Bioteknologi Mikrobial” yang pada dasarnya dapat dibagi
1. Teknologi mikrobial tradisional yaitu teknologi yang menggunakan
metode-metode yang telah berkembang lama yaitu seleksi alami serta
modifikasi proses untuk memperoleh hasil maksimal.
2. Teknologi microbial dengan rekayasa organisme, antara lain dengan
menggunakan gen-gen asing yang disisipkan pada gen mikroba. Disini
umumnya disebut rekayasa genetik. Upaya tersebut selain bertujuan
untuk mendapatkan strain atau mutan atau galur yang unggul tetapi
dapat pula dikultivasi secara besar-besaran.
Semua mikroorganisme membutuhkan air, sumber energi, karbon, nitrogen,
elemen-elemen mineral, vitamin dan O2 (jika aerobic). Medium untuk skala besar
harus menggunakan sumber-sumber nutrien untuk menciptakan sebuah medium
yang memenuhi kriteria sebagai berikut :
1. Menghasilkan yield maksimum dari produk atau biomass pergram
substrat yang digunakan.
2. Menghasilkan konsentrasi maksimum dari produk atau biomassa.
3. Mengijinkan laju maksimum dari pembentukan produk
4. Yield minimum dari produk yang tidak diinginkan
5. Murah, kualitas yang konsisten dan tersedia sepanjang tahun
6. Menimbulkan masalah-masalah yang minimal terutama pada aerasi,
agitasi, ekstraksi, purifikasi, dan pengolahan limbah (Riadi, L.2007)
2.5. Ragi Roti
Penemu Yeast (ragi roti) pertama kali adalah Louis Pasteaur pada tahun 1872.
Bibit yeast yang terbagus dalam buah anggur dan apel serta pada akar pohon
tersebut.
Jenis-jenis ragi roti :
a. Fresh Yeast, merupakan jenis ragi yang pertama kali ditemukan, berbentuk
cair sehingga dalam penyimpanan memerlukan pembekuan sering disebut
b. Dry Yeast, merupakan jenis ragi yang kering berbentuk butiran-butiran sering
disebut dehydrated yeast.
c. Instant Yeast, merupakan ragi yang dibentuk dalam bentuk tepung/powder.
Cara pemakaian dari ragi tersebut berbeda-beda yaitu :
a. Fresh Yeast sebelum dicampurkan dengan bahan-bahan lain harus
dicairkan terlebih dahulu
b. Dry Yeast sebelum dicampurkan dengan bahan-bahan lain harus dilarutkan
dulu dengan air dan difermentasikan. Instant yeast bisa dicampurkan
langsung dengan bahan-bahan lain sehingga menjadi suatu adonan.
(Subagio,A.2007)
2.6. Bioetanol
Bioetanol adalah bioetanol yang dibuat dari biomassa yang mengandung
komponen pati atau selulosa, seperti singkong dan tetes tebu. Dalam dunia
industri, bioetanol umumnya digunakan sebagai bahan baku industri, bioetanol
umumnya digunakan sebagai bahan baku industri turunan alcohol, campuran
untuk minuman keras
(seperti sake atau gin), serta baku farmasi dan kosmetika. Berdasarkan kadar
alkoholnya, bioetanol menjadi tiga bagian sebagai berikut:
• Bagian industri dengan kadar alkohol 90-94%
• Netral dengan 96-99.5%, umumnya digunakan untuk minuman keras atau
bahan baku farmasi.
• Bagian bahan bakar dengan kadar alkohol diatas 99.5%.
Ketika harga BBM merangkak semakin tinggi, bioetanol diharapkan dapat
dimanfaatkan sebaagai bahan bakar pensubstitusi BBM untuk motor bensin.
Sebagai bahan pensubstitusi bensin, bioetanol dapat diaplikasikan dalam bentuk
bauran dengan minyak bensin (EXX), misalnya 10% bioetanol dicampur dengan
90% bensin (gasohol E10) atau digunakan 100% (E100) sebagai bahan bakar.
Brasil merupakan salah satu Negara yang telah sukses mengembangkan bioetanol
sebagai bahan bakar alternative pensubstitusi bensin.
Bioetanol diperoleh dari hasil yang mengandung gula. Tahap inti produksi
bioetanol adalah fermentasi gula, baik yang berupa glukosa, sukrosa, maupun
fruktosa oleh ragi terutama Saccharomyces sp atau bakteri Zymomonas mobilis.
Pada proses ini, gula akan dikonversi menjadi bioetanol dan gas karbondioksida
C6H12O6 2C2H5OH + 2CO2
Gula Bioetanol Karbondioksida (gas)
Bahan baku bioetanol bisa diperoleh dari berbagai tanaman yang
menghasilkan gula (seperti tebu dan molase) dan tepung (seperti jagung,
singkong, dan sagu). Pada tahap persiapan, bahan baku berupa padatan harus
dikonversi terlebih dahulu menjadi larutan gula sebelum akhirnya difermentasi
untuk menghasilkan bioetanol, sedangkan bahan-bahan yang sudah dalam bentuk
larutan gula (seperti molase) dapat langsung difermentasi. Bahan padatan dikenai
perlakuan pengecilan ukuran dan tahap pemasakan. Proses pengecilan ukuran
dapat dilakukan dengan menggiling bahan (singkong, sagu, jagung)
BAB I
PENDAHULUAN
1.1. Latar Belakang
Tongkol jagung merupakan limbah tanaman yang setelah diambil bijinya tongkol
jagung tersebut umumnya dibuang begitu saja, sehingga hanya akan
meningkatkan jumlah sampah (Hidayati,D.2006). Tongkol jagung dan biji jagung
merupakan sumber karbohidrat potensial untuk dijadikan bahan pangan, sayuran,
dan bahan baku sebagai industri makanan. Tongkol jagung mengandung xylan
31.1%, selulosa 34.3%, lignin 17.7%, dan abu 16.9%. Komposisi kimia tersebut
membuat tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan
ternak, dan sebagai sumber karbon bagi pertumbuhan mikro organisme
(Shofiyanto, 2008).
Selulosa merupakan serat-serat panjang yang bersama-sama hemiselulosa,
pektin dan protein membentuk struktur jaringan yang memperkuat dinding sel
tanaman. Pada proses pematangan, penyimpanan atau pengolahan, komponen
selulosa dan hemiselulosa mengalami perubahan sehingga terjadi perubahan
struktur (Winarno,F.G.1992).
Selulosa membentuk komponen serat dari dinding sel tumbuhan.
Ketegaran selulosa disebabkan oleh struktur keseluruhannya. Molekul selulosa
merupakan rantai-rantai dari D-glukosa sampai 14.000 satuan yang terdapat
sebagai berkas-berkas terpuntir mirip tali yang terikat satu sama lain oleh ikatan
hydrogen. Suatu molekul tunggal selulosa merupakan polimer lurus dari 1,4-β
-D-glukosa. Hidrolisis lengkap HCl dalam air, hanya menghasilkan D--D-glukosa.
Disakarida yang terisolasi dari selulosa yang terhidrolisis sebagian adalah
selobiosa, yang dapat dihidrolisis lebih lanjut menjadi D-glukosa dengan suatu
Glukosa juga dinamakan dekstrosa atau gula anggur, terdapat luas dialam
dalam jumlah sedikit yaitu didalam sayur, buah, sirup jagung, sari pohn dan
bersamaan dengan fruktosa dalam madu. Tubuh hanya dapat menggunakan
glukosa dalam bentuk D-glukosa. Glukosa murni yang ada dipasar biasanya
diperoleh dari hasil olahan pati. Glukosa memegang peranan penting dalam ilmu
gizi. Glukosa merupakan hasil akhir pencernaan pati, sukrosa, maltose, dan
laktosa pada hewan dan manusia. Glukosa difermentasi akan menghasilkan
alkohol, fermentasi glukosa adalah proses biologi dimana glukosa diubah menjadi
energi seluler dan juga menghasilkan bioetanol dan karbon dioksida sebagai
produk sampingan. Karena proses ini tidak membutuhkan oksigen melainkan
khamir yang melakukannya, maka fermentasi glukosa ini digolongkan respirasi
anaerob (Almatsier, 2001).
Bioetanol (C2H5OH) merupakan salah satu bahan bakar nabati yang saat
ini menjadi primadona untuk menggantikan minyak bumi. Minyak bumi saat ini
harganya semakin meningkat, selain kurang ramah lingkungan juga termasuk
sumber daya yang tidak dapat diperbaharui. Bioetanol mempunyai kelebihan
selain ramah lingkungan, penggunaannya sebagai campuran BBM terbukti dapat
mengurangi emisi karbon monoksida dan asap lainnya dari kendaraan. Bioetanol
dapat diproduksi dari berbagai bahan baku yang banyak terdapat di Indonesia,
sehingga sangat potensial untuk diolah dan dikembangkan karena bahan bakunya
sangat dikenal masyarakat. Tumbuhan yang potensial untuk menghasilkan
bioetanol antara lain tanaman yang memiliki kadar karbohidrat tinggi, seperti
tebu, nira, aren, sorgum, ubi kayu, jambu mete (limbah jambu mete), batang
pisang, ubi jalar, jagung, bonggol jagung, jerami, dan bagas (ampas tebu)
(Komarayati, S. dan Gusmailina, 2010).
Manfaat umum yang dapat diperoleh dari bahan bakar bioetanol, antara
lain digunakan untuk bahan baku industri turunan alkohol, campuran minuman
keras, industry farmasi, sampai pada bahan baku campuran kendaraan. Tentu saja,
Misalnya, untuk kebutuhan industry diperlukan bioetanol berkadar 99,5-100%,
atau bioetanol yang harus betul-betul kering dan anhydrous supaya tidak korosif
(Abidin, R. 2009)
Pada penelitian sebelumnya telah dilakukan pembuatan bioetanol dari
hasil hidrolisis selulosa ampas tebu secara fermentasi dengan variasi penambahan
ragi roti dan lama waktu fermentasi oleh Feri Susanto (2008), dimana kadar
bioetanol tertinggi yaitu sebesar 5.12% pada penambahan ragi roti 2 gram dengan
lama waktu 6 hari. Selain itu, Lisma Sari (2010) juga melakukan penelitian
tentang pembuatan bioetanol dari hasil hidrolisis selulosa jerami padi secara
fermentasi dengan variasi penambahan ragi roti dan lama waktu fermentasi,
dimana kadar bioetanol tertinggi sebesar 7.43% pada penambahan ragi roti 6 gram
dan lama waktu fermentasi 6 hari. Pada penelitian lainnya Annisa Suri (2008)
melakukan penelitian tentang pembuatan bioetanol dari hasil hidrolisis selulosa
tandan kosong kelapa sawit secara fermentasi dengan variasi penambahan ragi roti
dan lama waktu fermentasi, dimana kadar bioetanol tertinggi sebesar 7.59% pada
penambahan ragi roti 6 gram dan lama waktu fermentasi 6 hari. Pada penelitian
tersebut hanya dibahas mengenai variasi penambahan ragi roti dan lama waktu
fermentasi, tanpa membahas pengaruh lama waktu hidrolisis selulosa untuk
menghasilkan larutan gula hasil hidrolisis.
Berdasarkan uraian diatas maka penulis tertarik untuk melakukan
penelitian tentang pengaruh lama hidrolisis terhadap glukosa hasil hidrolisis
selulosa tongkol jagung dengan menggunakan HCl 1%, dimana akan dilihat kadar
1.2. Permasalahan
Permasalahan dalam penelitian ini adalah
1. Berapakah kadar glukosa yang diperoleh berdasarkan variasi waktu
hidrolisis selulosa tongkol jagung?
2. Berapakah kemurnian bioetanol yang diperoleh?
1.3. Pembatasan Masalah
Dalam penelitian ini masalah dibatasi pada :
1. Bahan baku fermentasi adalah glukosa hasil hidrolisis selulosa dari
tongkol jagung
2. Mikroba yang digunakan berasal dari ragi roti dalam bentuk kemasan saf
instan
3. Variasi lama waktu hidrolisis adalah 90, 120 dan 150 menit
4. Berat ragi roti yang digunakan dalam fermentasi adalah 3, 5, dan 7 gram
5. Lama fermentasi adalah 2, 4, dan 6 hari
6. Kadar glukosa ditentukan dengan metode Luff-Schroll
7. Pengukuran kemurnian bioetanol menggunakan Kromatografi gas.
1.4. Tujuan Penelitian
1. Untuk mengetahui kadar glukosa yang diperoleh berdasarkan variasi
waktu hidrolisis selulosa tongkol jagung
1.5. Manfaat Penelitian
Hasil penelitian ini dapat dimanfaatkan sebagai sumber informasi yang berguna
dalam upaya pemanfaatan limbah jagung, sehingga masyarakat setempat dapat
memanfaatkannya, serta turut berpartisipasi dalam upaya mengurangi limbah
jagung.
1.6. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia/ Kimia Bahan Makanan
FMIPA-USU, dan Laboratorium Kimia Dasar FMIPA-USU.
1.7. Metodologi Penelitian
Penelitian ini adalah eksperimental laboratorium dengan menggunakan tongkol
jagung dimana metode penelitian dilakukan dengan cara sebagai berikut:
Penelitian dilakukan dengan 4 tahapan yaitu:
1. Penyediaan selulosa tongkol jagung
• Bahan baku adalah tongkol jagung
• Proses isolasi selulosa dengan cara delignifikasi tongkol jagung
2. Peyediaan glukosa dari hidrolisis selulosa tongkol jagung
• Bahan baku adalah selulosa yang diisolasi dari tongkol jagung
• Proses konversi selulosa tongkol jagung menjadi glukosa adalah hidrolisis
dengan menggunakan HCl 1%
• Kadar glukosa dianalisa dengan menggunakan metode Luff-Schroll
3. Fermentasi glukosa dari hidrolisis selulosa tongkol jagung untuk menghasilkan
bioetanol
• Substrat yang digunakan pada fermentasi adalah glukosa hasil hidrolisis
selulosa dari tongkol jagung
• Yield bioetanol yang dihasilkan dianalisa dengan menggunakan metode
kromatografi gas.
4. Pemurnian bioetanol hasil fermentasi
• bioetanol dipisahkan dari sisa glukosa dengan menggunakan alat destilasi • Yield bioetanol hasil pemisahan dianalisa dengan menggunakan metode
kromatografi gas
Adapun variable-variabel dalam penelitian adalah:
1. Variabel bebas adalah variabel yang mempunyai pengaruh terhadap kadar
bioetanol, yaitu:
• Pengaruh variasi lama hidrolisis yaitu 90, 120 dan 150 menit terhadap
kadar glukosa dan kadar bioetanol
• Pengaruh variasi lama fermentasi yaitu 2, 4, dan 6 hari terhadap kadar kadar bioetanol
• Pengaruh variasi berat ragi roti yaitu 3,5, dan 7 gram terhadap kadar kadar
bioetanol
2. Variabel terikat adalah variabel yang terukur terhadap perubahan perlakuan.
Dalam penelitian ini yang menjadi variabel terikat, yaitu:
• Kadar Bioetanol
3. Variabel tetap adalah variabel yang dibuat tetap sehingga tidak menyebabkan
terjadinya perubahan variabel terikat. Dalam penelitian ini variabel tetap
adalah:
• Berat Sampel
ABSTRAK
Telah dilakukan penelitian tentang pengaruh lama hidrolisis terhadap kadar bioetanol dari glukosa hasil hidrolisis selulosa tongkol jagung dengan HCl 1%. Isolasi selulosa dari tongkol jagung dengan berat yang diperoleh 18,31 g. Selulosa yang diperoleh dihidrolisis dengan HCl 1% dengan variasi lama hidrolisis 90, 120, dan 150 menit untuk menghasilkan glukosa yang dianalisa dengan metode Luff-Schoorl. Kadar glukosa yang diperoleh 7.37%, 9.2% dan 6.64%. Dari hasil penelitian didapatkan bahwa yield bioetanol tertinggi diperoleh pada hidrolisis 120 menit dengan berat ragi roti 7 g dan lama fermentasi 6 hari sebesar 8,2%. Analisis kemurnian bioetanol menggunakan kromatografi gas dengan hasil kemurnian 99,53%.
Kata kunci: tongkol jagung, selulosa, hidrolisis, glukosa, dan bioetanol
THE EFFECT OF TIME CELLULOSE CORN COB (Zea mays)
HYDROLYSIS WITH HCl 1% ON GLUCOSE LEVELS
TO MAKE BIOETHANOL
ABSTRACT
Have been done research about influence of hydrolysis time on bioethanol of hydrolysis glucose from cellulose corn cobs by HCl 1%. Cellulose insulation on baby corn cob with weight obtained 18.21 g. The cellulose obtained is hydrolyzed by HCl 1% with a variation of hydrolysis time 90, 120, and 150 minutes to produced glucose was analyzed by the Luff-Schoorl method. Glucose levels were obtained 7.37%, 9.2% and 6.64%. The result showed that the highest of bioethanol yield at hydrolysis time of 120 minutes with a weight of 7 g of baker's yeast and fermentation time 6 days is 8.2%. The results of analysis bioethanol using gas chromatography with a purity of bioethanol 99.5%.
PENGARUH LAMA HIDROLISIS SELULOSA TONGKOL JAGUNG (Zea mays) DENGAN HCl 1% TERHADAP
KADAR GLUKOSA UNTUK PEMBUATAN BIOETANOL
SKRIPSI
ADYTIA ANGGARA PUTRA 140822025
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH LAMA HIDROLISIS SELULOSA TONGKOL JAGUNG (Zea mays) DENGAN HCl 1% TERHADAP
KADAR GLUKOSA UNTUK PEMBUATAN BIOETANOL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ADYTIA ANGGARA PUTRA 112401082
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2016
PERSETUJUAN
Judul : PENGARUH LAMA HIDROLISIS SELULOSA
TONGKOL JAGUNG (Zea mays) DENGAN HCl 1% TERHADAP KADAR GLUKOSA UNTUK PEMBUATAN BIOETANOL
Nama : ADYTIA ANGGARA PUTRA
Nomor Induk Mahasiswa : 140822025
Program Studi : SARJANA (S1) KIMIA
Departement : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Juni 2016
Komisi Pembimbing Pembimbing 2
Dra. Emma Zaidar, M.Si NIP : 195509181987012001
Pembimbing 1
Dr. Rumondang Bulan, MS NIP : 195408301985032001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH LAMA HIDROLISIS SELULOSA TONGKOL
JAGUNG (Zea mays) DENGAN HCl 1% TERHADAP
KADAR GLUKOSA UNTUK PEMBUATAN
BIOETANOL
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2016
PENGHARGAAN
Bismillahirrohmaanirrohim..
Alhamdulillah, segala Puji dan Syukur Penulis ucapkan atas kehadirat Allah SWT yang telah memberikan Rahmat dan karunia-Nya sehingga Penulis dapat menyelesaikan skripsi ini.
Dalam hal ini penulis ucapkan terima kasih dan penghargaan kepada kedua orangtua tercinta, ayahanda Junaedi dan Ibunda Heru Sunarni yang dengan doa, semangat dan dukungannya yang sangat besar serta selalu mendampingi penulis demi terselesaikannya skripsi ini. Terima kasih kepada kakak saya tercinta Siska Anggraeni dan adek tercinta Muhammad Rafif akmal yang telah memberikan semangat serta membantu penulis dalam menyelesaikan skripsi ini.
Terima kasih kepada ibu Dr. Rumondang Bulan, MS selaku dosen pembimbing I dan Ketua Departemen Kimia dan Ibu Dra. Emma Zaidar, M.Si selaku Dosen pembimbing II, yang telah dengan sabar membantu, mengarahkan dan membimbing Penulis dalam mengerjakan penelitian dan menyelesaikan skripsi ini. Terima kasih kepada Bapak Dr. Darwin Yunus Nasution, M.S selaku koordinator kimia ekstensi, dan seluruh staf Dosen pengajar Jurusan Kimia FMIPA USU yang telah banyak memberikan ilmu yang bermanfaat bagi penulis.
Terima kasih kepada sahabat-sahabat penulis jurusan ekstensi kimia FMIPA USU angkatan 2014 atas bantuan dan motivasi yang diberikan dan atas kebersamaannya selama ini. Terima kasih kepada rekan-rekan di Laboratorium Biokimia FMIPA USU yang banyak membantu dan juga terima kasih kepada semua pihak yang tak bisa disebutkan satu-persatu disini yang telah banyak membantu, mendoakan dan menyemangati penulis dalam menyelesaikan skripsi ini.
Akhirnya Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu Penulis mengharapkan saran dan masukan yang bersifat membangun dari semua pihak demi terciptanya kesempurnaan dari skripsi ini, dan semoga Allah SWT membalas semua kebaikan kita dan memberikan kebahagian bagi kita semua. Amin.
Medan, Juni 2016
ABSTRAK
Telah dilakukan penelitian tentang pengaruh lama hidrolisis terhadap kadar bioetanol dari glukosa hasil hidrolisis selulosa tongkol jagung dengan HCl 1%. Isolasi selulosa dari tongkol jagung dengan berat yang diperoleh 18,31 g. Selulosa yang diperoleh dihidrolisis dengan HCl 1% dengan variasi lama hidrolisis 90, 120, dan 150 menit untuk menghasilkan glukosa yang dianalisa dengan metode Luff-Schoorl. Kadar glukosa yang diperoleh 7.37%, 9.2% dan 6.64%. Dari hasil penelitian didapatkan bahwa yield bioetanol tertinggi diperoleh pada hidrolisis 120 menit dengan berat ragi roti 7 g dan lama fermentasi 6 hari sebesar 8,2%. Analisis kemurnian bioetanol menggunakan kromatografi gas dengan hasil kemurnian 99,53%.
Kata kunci: tongkol jagung, selulosa, hidrolisis, glukosa, dan bioetanol
THE EFFECT OF TIME CELLULOSE CORN COB (Zea mays)
HYDROLYSIS WITH HCl 1% ON GLUCOSE LEVELS
TO MAKE BIOETHANOL
ABSTRACT
Have been done research about influence of hydrolysis time on bioethanol of hydrolysis glucose from cellulose corn cobs by HCl 1%. Cellulose insulation on baby corn cob with weight obtained 18.21 g. The cellulose obtained is hydrolyzed by HCl 1% with a variation of hydrolysis time 90, 120, and 150 minutes to produced glucose was analyzed by the Luff-Schoorl method. Glucose levels were obtained 7.37%, 9.2% and 6.64%. The result showed that the highest of bioethanol yield at hydrolysis time of 120 minutes with a weight of 7 g of baker's yeast and fermentation time 6 days is 8.2%. The results of analysis bioethanol using gas chromatography with a purity of bioethanol 99.5%.
DAFTAR ISI
1.4. Tujuan Penelitian 1.5. Manfaat Penelitian 1.6. Lokasi Penelitian 1.7. Metodologi Penelitian1 2.2. Karbohidrat
2.2.1. Selulosa
2.2.2. Sifat-sifat Selulosa 2.2.3. Hidrolisis Selulosa 2.2.4. Glukosa
2.3. Analisa Kualitatif dan Kuantitatif Gula Pereduksi 2.3.1. Analisa Kualitatif Gula Pereduksi
2.3.2. Analisa Kuantitatif Gula Pereduksi 2.4. Fermentasi
Bab III Metodologi Penelitian 22
3.1. Alat dan Bahan 3.1.1. Alat-alat 3.1.2. Bahan-bahan
3.2.2. Larutan NaOH 0,4% 3.3. Prosedur Penelitian
3.3.1. Isolasi Selulosa dari Tongkol Jagung Muda
3.3.2. Hidrolisis Selulosa Menjadi Glukosa dan Uji Kualitatif Glukosa
3.3.3. Analisa Kandungan Glukosa
3.3.4. Fermentasi Glukosa Menjadi Etanol
3.3.5. Pemisahan Bioetanol dari Hasil Fermentasi 3.4. Bagan Penelitian
3.4.1. Isolasi Selulosa Tongkol Jagung Muda
3.4.2. Hidrolisis Selulosa Menjadi Glukosa dan Uji Kualitatif Glukosa
3.4.3. Pembuatan Larutan Fermentasi
3.4.4. Pemisahan Bioetanol dari Hasil Fermentasi dan Uji Kuantitatif Bioetanol
Bab IV Hasil dan Pembahasan
4.1. Hasil Penelitian 4.2. Pembahasan
4.2.1. Isolasi Selulosa Tongkol Jagung Muda 4.2.2. Hidrolisis Selulosa Tongkol Jagung Muda 4.2.3. Analisis Kadar Gula Reduksi
Bab V Kesimpulan dan Saran
DAFTAR TABEL
Tabel 4.1.
Tabel 4.2.
Tabel 4.3.
Tabel 4.4.
Tabel 4.5.
Tabel 4.6.
Hasil Isolasi Selulosa Tongkol Jagung
Data FTIR Selulosa Tongkol Jagung
Hasil Analisis Kualitatif Kadar Glukosa dari Hasil Hidrolisis
Hasil Analisis Kuantitatif Kadar Glukosa dari Hasil Hidrolisis
Hasil Analisis Kualitatif Etanol
Hasil Analisis Kuantitatif Etanol dengan Kromatografi Gas
32
33
33
33
34
DAFTAR GAMBAR
Gambar 4.1.
Gambar 4.2.
Gambar 4.3.
Gambar 4.4.
Spektrum FTIR Selulosa Tongkol Jagung
Kurva Hasil Analisa Kuantitatif Kadar Glukosa dari Hasil Hidrolisis
Kurva Hasil Analisa Rendemen Etanol
Kurva Hasil Analisa Kadar Etanol
32
36
38
DAFTAR LAMPIRAN
Lampiran 1.
Lampiran 2.
Lampiran 3.
Lampiran 4.
Lampiran 5.
Lampiran 6.
Lampiran 7.
Data perhitungan kadar glukosa
Angka tabel Penetapan Kadar Glukosa Menurut Luff-Schoorl
Data perhitungan yield bioetanol
Perhitungan Konversi Glukosa Menjadi Etanol
Gambar proses pembuatan selulosa
Gambar Pengujian Glukosa
Gambar proses fermentasi dan proses pemurnian bioetanol 43
44
45
46
48
49