A.
LATAR BELAKANGUsaha peternakan sapi perah di Indonesia yang terkonsentrasi di PuIau Jawa. merupakan salah satu usaha yang berperanan sangat penting dalam menghasilkan protein hewani. Produksi susu segar di Jawa Barat sebesar 149.5 ribu ton pada tahun 1994.
yang
rneningkat menjadi 152.9 ribu ton pada tahun berikutnya, sedang-kan produksi total Indonesia pada tahun 1995 mencapai 434.8 ribu ton; 70% dari total produksi tersebut dikonsumsi oleh 7 buah Industri Pengolahan Susu
(IPS)
terbe- sar di Indonesia, yaitu PT. Nestle Indonesia.PT.
Indomilk. PT. Frieshe Vlag Indo- nesia. PT. Foremost Indonesia.PT
Ultra Jaya,PT.
Dafa danPT.
Sari Husada, yang mencapai 313.2 ribu ton pada tahun yang sama, yaitu hanya merupakan 30% dari kebutuhan IPS. Namun demikian, produksi ini belum dapat memenuhi kebutuhan IPS baik dari segi kuantitas, maupun kualitas (Business Consultancy Indonesia. 1996).Mengingat usaha petemakan sapi perah pada umunmya masib bersifat mi- onal atau peternakan rakyat
(>
90%). maka kualitas susu segar yang dihasilkan belum &pat memenuhi persyaratan minimal secara keseluruhan seperti yang tercan- tum dalam Surat Keputusan Direktur Jenderal Peternakan No: 17IKptsJDJPI Deptanl83, misabya berat jenis sekurang-kurangnya 1.028 pada suhu 27.S°C, ataujumlah rnikroba yang dapat d i b i i tiap ml susu segar setinggi-tingginya 3 juta.
Hasil penelitian D i k t o r a t Kaehatan Hewan, Direktorat Jenderal Peternakan (1982)
menunjukkan bahwa sebanyak 54.56 persen dari jumlah sampel yang diperiksa tidak
memenuhi persyaratan berat jenis tersebut di atas. Hasil pengamatan selama trim-
Bogor (1997) dengan total produksi 1,291 ton, ternyata mum susu segar menunjuk-
kan
rata-rata berat jenisI
.0255. kadar bahan kering 11 -82%. dengan kadar lernak3.89 % ; y ang pada tahun I996 rata-rata produksi mencapai 4.984.7 ton/tahun dengan
berat jenis 1.0261, kadar bahan kering 1 1.89 96, dan kadar lemak 3.89%. Produksi total susu segar di Koperasi Peternakan Bandung Selatan {KPBS) pada tahun 1996
mencapai rata-rata 13 1.3 tonihari dengan berat jenis rata-rata 1.02, kadar bahan kering 10.4% dan kadar temak 3.2
1,
sedangkan di Koperasi Peternakan Sapi Bandung Utara/KPSBU berat jenis rata-rata 1.026, dengan kadar bahan kering11 -4 % dan kadar lemak 3.8 %
.
Berdasarkan Laporan Analisa Rasio Persusuan diJawa Barat, ternyata bahwa raw-rata berat jenis tertinggi yaitu 1.027 dicapai oleh KUD/Koperasi Mitraya (MI 32 buah KUD/Koperasi di Jawa Barat), sedangkan paling rendah yaitu 1.02 (KPBS) dan 1
.M1
(Td
Mukti).Di lain pihak dalam menjamin kebutuhan bahan baku yang cukup besar untuk
memproduksi berbagai produk susu yang mencapai 762,461 ton pada tahun 1995
serta mempertahankan mutu produk IPS, maka instansi terkait dalam bidang persu-
suan yang pada tahun 1995 telah menempuh kebijakan impor bahan balcu dalam bentuk semi-finished milk products yang terdiri dari susu skim bubuk sebanyak
50.015 ton. tepung butter milk 9.498 ton. susu bubuk penuh ~ l l c r e a m milkpow-
&r)
986 ton, d m anhydrous milkfa
sebanyak 7,758 ton (BCZ, 1996). Produk terse- but terutama berasal dari Selandia Baru (24%). Australia (20%), Jerman(7%)
dandengan syarat-syarat tertentu telah ditetapkan dan dievaluasi setiap lima tahun.
misalnya sejak awal tahun 1996. IPS/P.T. Indomilk menerima susu segar dari
KUDlKOP dengan minimal kadar lemak 3.3 %. kadar bahan kering tanpa lemak
7.7% dan total bahan kering 11.096, d i i i i hasil negatif dengan uji alkohol75%,
dan jumlah total mikroba (totalplate count/TPC) lebih kecil dari 30 juta per m1
susu segar.
Sehubungan dengan ha1 tersebut di atas pemerintah melalui KUD/KOP atau
Milk
Treatment telah mengambii kebijakan untuk menerima susu segar dari petemak-an rakyat atau perusahaan peternalum sapi perah dengan persyaratan minimal berat
jenis 1.026 (Milk Treatment. Ujung Berung. Bandung, 1994) atau mungkin lebih
rendah, misalnya pa& KPS Bogor 1.0250 untuk produksi susu pagi hari dan 1.0240
untuk produksi sore hari yang diikuti pengujian alkohol75 5% (KPS. Bogor, 1997).
Selain uji berat jenis, dilakukan pula uji aIkohol75 persen yang bila menunjukkan
hasil positif,
maka
susu dinyatakan ~ S a k dm ditolak oleh KUD, meskipun beratjenisnya memenuhi persyaratan. Demikian pula bila ada penyirnpangan dalam uji
organoleptik, seperti misalnya menjadi agak manis, asin atau pahit, maka sum dito-
lak. Dengan demikian susu segv yang ditolak karena tidak memenuhi persyaratan
.
.
rmnunaI
KUD/Milk Trearment atau IPS tidak &pat dipasarkan, dan disebut sebagaisusu
substandar.Hutasoit (1988) mengemdakau W w a kerusakan komoditas
susu
di Indone-sia masih tinggi yaitu sebesar 5
-
12.5 persen. Berdasarkan data dariMilk
T m -m m t , Ujung Berung, Gabungan Koperasi Susu Indonesia (GKSI) Wilayah Jawa Barat (1993).
diketahui
bahwa j d a h susu yang ditolak selama bulan l a d sampaidengan September memxtpai rata-rata 3000 liter
per
hari. Dengan semakin intensif-nya peranan
GKSI
dalam membina peternak tradisional (205 koperasi/KUD se1995 Milk Treatment Ujung Berung, Bandung, hanya membeli susu segar untuk kebutuhan produksi susu pasteurisasi Aiam Murni, yogurt, dan lain-lain sedangkan koperasi/KUD di wilayah Jawa Barat iainnya m e n g u i susu segar langsung ke IPS.
Data dari GKSI Pusat Jakarta (1993) menunjukkan bahwa total susu segar yang tidak dapat dipasarkan, yang rneliputi 3 Milk Treatment di Jawa (Ujung Berung. Boyolali dan Pandaan) selama tahun 1992 yaitu sebesar kira-kira 1660 ton. Dari KPBS (1996) di Pangalengan dengan produksi susu segar ram-rata 13 1 - 3 ton per hari tahun 1996 dan 142.9 todhari tahun 1995 diketahui pula bahwa jumlah susu segar yang tidak dapat dipasarkan ke Industri Pengolahan Susu/IPS mencapai rata-rata 1.0% dari total produksi per hari, sedangkan dari KPSBU. Ltmbang. Bandung (1996) diperoleh laporan bahwa jumlah susu segar y m g ditolak IPS menca- pai 1.2 % dari rata-rata produksi per hari sebesar 66.9 ton.
Dari KPS Bogor (1997) diperoleh data bahwa jumlah susu segar yang tidak dapat dipasarkan ke IPS rata-rata 13.460 ton pada tahun 1995, 12.271 ton pada
tahun 1996, dan pada triwulao pertama tahun 1997 mencapai 3.6 ton, dan pada tahun
1995 susu segar yang ditolak di tingkat petemak sebesar rata-rata 2.5 tonlbulan (KPS Bogor melakukan penjemputan susu segac pada anggota-anggotanya).
Untuk mengatasi permasalahan tersebut di atas, perln diupayakan altematif lain dalam bentuk suatu proses yang dapat mendayagunakan susu sapi substandar. sehingga memberikan nilai tarnbah pada produk tcrsebut.
Susu tecmasuk salah satu baban pangan yang mudah cuak mengingat bahwa
sebagai bahan makanan cair yang berkualitas tinggi maka susu mengandung hampir
semua
zat gizi yang diperlukan clan mudah dicemauntuk
Wvitas dan perkembang-semua vitamin yang berfungsi sebagai faktor p e n d u n g proses biokimia yang terja-
di pada tubuh (Adnan, 1976).
Susu sapi normal mengandung 13 persen bahan kering termasuk protein.
lemak, laktosa dan garam-garam organik maupun anorganik.
Dalam
100 ml susunormal terdapat 3.0
-
3.5 gram total protein yang terdiri atas dua bagian besar yaitukasein sebesar SO%, dan sisanya merupakan protein serum atau protein whey (Dal-
gleish. 1982).
Berbagai macam produk protein susu dapat dihasilkan, antara lain berupa
kasein asam. kasein Iaktat, kasein renet, kaseinat, konsentrat protein whey, kopresi- pitat atau protein susu total, clan hidrolisat protein susu. Produk-produk protein susu
mengandung asam-asam amino esensial yang dapat digunakan sebagai suplemen a t
gizi sekaligus menunjukkan sifat-sifat fungsional yang dikehendaki daIam sistem
pangan, misalnya dalam formulasi makanan bayi, sari buah yang diperkaya protein
atau minuman olahraga (Giese. 1994). Penggunaan isolat protein susu, khususnya
kasein dan kaseinat meningkat dengan cepat sejak tahun 1960 (total produksi dunia
rata-rata mencapai 150 000 ton) untuk kebutuhan industri pangan modern atau
formulasi pangan, yang pada tahun 1991 mencapai rata-rata 250 000 ton, dengan
negara pengguna terbesar yaitu Jepang. Amerika Serikat dart Inggris (Mulvihill,
1991).
Saat ini
sebesar 70-80% produk-produk protein susu digunalcan untuk kepen-tingan Mustri pangan, yang umumnya diproduksi di Selandia baru. Australia, USA.
Belanda dan Kanada, dengan menggunakan susu sapi kualitas se-kunder, dan 20-
30%
untuk
kebutuhan industri lain, seperti perekat, plastik, serat kasein dan pelapiskertas (Morr. 1982; Muller. 1982).
Sifat fungsional protein me~p&aXI sifat-sifat yang berpengaruh terhadap
proses pengolahan atau formulasi suatu produk, sebagai wntoh, untuk bahan substi-
membuih dan sifat penyerapan l e d (Modler. 1985). Suatu cara untuk meningkat-
kan sifat fungsional tertentu pada protein dapat
diIakukan
dengan modifikasi proteinsecara kimia atau enzimatis, yang bertujuan mmpengaruhi sifat-sifat fiiko kimia-
nya, sehingga jumlah penggunaannya dalam suatu sistem pangan tertentu dapat
dikurangi.
Hasil penelitian Matheis clan W t a k e r (1984) melaporkan bahwa fosforilasi
kasein secara kimia ternyata meniagkaUEan sifat pembenNkaa gel. Fosforifasi dapat
meningkatkan kelarutan protein pada pH netral dan juga kapasitas pengikatan air,
khususnya pada 0-laktoglobulin. Matheis et al.. (1983) dan Medina era[.. (1992)
juga melaporkan bahwa fosforilasi meningkatkan viskositas kasein maupun kelaru-
tannya pada titik isoelektrik.
Modifikasi enzirnatis secara terbatas pada kasein. misalnya menggunakan
enzirn pankreatin ternyata dapat meningkatkan sifat daya buih kasein (Modler,
1985). dan juga kelarutan pada titik isoeiektrik (Chobert er d., 1988) clan penggu- naannya antara lain dalam pembuatan kembang gula, produk pangan cair maupun
minuman. Hasil penelitian Phiilips dan Beuchat (1981) menunjukkan terjadinya
pe- kelarutan protein kasein d m juga protein kedelai pada
kisaran
pH 4-5.Mahmoud (1994) melaporkan bahwa mocWilcasi enzimatis dengan derajat hidrolisis
teaentu akan meningkaran aktivitas ernulsi pada protein whey yang tennodifikasi
oleh enzim tripsin, namun demikian bila hidroiisis tidak terkcndali maka stabilitas emulsi awxnuun sangat nyata.
Swaisgood (1985) menjelaskan bahwsf protein
utama
susu. yaitu kasein.mempunyai kelarutan dan stabilitas
yang
tinggi pada kondisi tertentu, hat ini menye-babkan produk-produk kasein, misalnya
Icaseinat.
baik yang dibuat dengan netral%asioleh natrium atau kalium merupakan pengcmdsi yang baik. Dengan demikian
formulasi produk-produk asal daging, produk-produk protein nabati terteksturisasi
(TVP = texturized vegetable protein), margarin, bahan pensubstitusi krim, bahan
pemutih kopi d m sebagai bahan pemantap buih. Sedangkan produk kopresipitat atau
total protein susu diperoleh dengan pemanasan susu skim, sehingga protein whey
mengalami denaturasi dan selanjutnya membentuk kompleks dengan kasein melalui
ikatan disulfida. Produk kopresipitat mempunyai sifat aktif permukaan yang baik,
sehingga dapat diaplikasikan sebagai bahan pengemulsi. pembuih dan pengembang
(whipping).
Berdasarkan uraian di atas, banyak hal-ha! yang masih perlu digali dan
dikaji dalam penelitian ini, misalnya mempelajari sifat sifat fungsional isolat protein
susu dari susu sapi substandar, sekaligus melalcukan modifikasi protein susu baik
secara kimia atau enzimatik dalam rangka meningkatkan sifat fungsional tertentu
agar memenuhi persyaratan bahan balcu suahr produk pangan. dengan demikian dapat
meningkatkaa pemanfaatan susu sapi substandar dan memperoleh nilai tambah
produk tersebut.
1. Meiakukan isolasi protein susu dari susu sapi substandar, karakterisasi sifat-
sifat fungsional, dan pola asam-asam amino produk isolat protein susu. yaitu
kasein laktat, natrium kaseinat dan kopresipitat.
2. Mempelajari pengaruh modifikasi kimia d m enzimatik terhadap karakteristik
fungsional, pola gel elektroforesis, clan daya
cema
in virro produk isolat protein susu.3. Mempelajari stabilitas fungsional berbagai produk isolat protein
susu
dan produk4.
Mempelajari aplikasi produk isolat protein susu dan produk protein termodifikasi-
nya untuk pensubstitusi bahan penstabil, yaitu pada es krim atau meningkatkan
mutu produk pangan tertentu, yaitu pada bahan
dasar
minuman ringan.
/
Modifikasi kimia dan enzimatik terhadap struktur kimia protein susu sapi
memberikan pengaruh yang berbeda pada karakteristik fungsional produk isolat
protein susu sehingga produk isolat protein susu
dan
atau produk termodifikasinya
11.
TINJAUAN PUSTAKA
A. KUALITAS SUSU
DI
INDONESIA
1.
Persyaratan Susu
/Berdasarkan Surat Keputusan Direktur Jenderal Peternakan (1983) tglah
ditetapkan tentang syarat-syarat,
tatacara pengawasan dan pemeriksaan kualitas susu
produksi dalam negeri. Beberapa ketentuan yang penting antara lain mengenai pe-
ristilahan misalnya, yang dirnaksud dengan
:a) susu adalah susu sapi meliputi susu
segar, susu murni, susu pasteurisasi
dan
susu sterilisasi, b) susu murni adalah cairan
yang berasal dari ambing sapi sehat, yang diperoleh dengan cara pemerahan yang
benar tanpa mengurangi atau menambah sesuatu komponen, c) susu segar adalah
susu murni yang tidak mengalami proses pemanasan, d) susu pasteurisasi adalah susu
mumi yang telah mengalami proses pasteurisasi secara sempurna, e) susu sterilisasi
adalah susu murni yang telah mengalami proses sterilisasi secara sempurna.
Dalam ha1 ini telah ditetapkan pula persyaratan kualitas susu murni yang
beredar, yaitu antara
lain :a) tidak ada perubahan pada warna, bau, rasa
dan
keken-
talan,
b) berat jenis
@adasuhu
27.5"C)
sekurang-kurangnya 1.028, c) kadar lemak
sekurang-kurangnya
2.8
persen, d) kadar bahan kering tanpa lemak sekurang-
kurangnya 8 persen, e)
kadar
protein sekurang-kurangnya
2.7
persen,
f)negatif pada
uji &oh01
70
persen,
g)jumlah kuman
yang dapat
d i b i i
tiap
ml
setinggi-tinggi-
nya adalah 3 juta. Demikian pula persyaratan yang spesifk untuk susu pasteurisasi
maupun susu sterilisasi telah ditetapkan.
Mengenai pengawasan dan pengujian kualitas susu, maka ditetapkan tata
caranya yaitu dilakukan terhadap susu pada
peternakan
sapi perah, penampung susu
laboratorium saja, sedangkan pengujian di penampung susu (misalnya, KUD) atau
pengumpul susu hanya dilakukan terhadap keadaan susu, yang meliputi antara lain:
pemeriksaan organoleptik, uji kebersihan, uji keasaman dengan alkohol 70 persen
(pada kenyataannya konsentrasi alkohol lebih tinggi, misatnya 75% di KPS, Bogor
dan di IPS Indomilk, 1997). sedangkan pengujian terhadap susunan susu hanya
>
dilakukan terhadap berat jenis saja.
2.
Susu Substandar
Susu substandar didefinisikan sebagai susu murni yang tidak memenuhi
persyaratan minimal yang ditetapkan oleh Pemerintah, dalam hal
ini
KUD atau Milk
Treatment.
Pada kenyataannya sampai saat ini masih sulit bagi peternak untuk
memenuhi semua persyaratan susu murni tersebut di atas, sehingga pemerintah
mengambil kebijakan melalui KUDlKOP atau penampung susu dalam penyerapan
susu dari peternak. Misalnya, di
Milk
Ttreatment
di Ujung Berung, Bandung mash
menerima susu segar dengan berat jenis
1.026(GKSI
Wilayah Jawa Barat, 1997).
ha1 yang sama juga diterapkan di KPBS Pangalengan (1993) akan tetapi bila ada
petemak anggota koperasi menghasilkan susu segar dengan berat jenis lebii rendah
dari standar
KPBS
tetapi mash
B1.024,
maka
susu tersebut masih diterima dengan
persyaratan khusus. Di KPS, Bogor (1997) susu segar
masih
diterima bila memiliki
berat jenis minimal 1.0250 (produksi pagi hari),
dan
1.0240 pada produksi sore hari.
Hal ini dilakukan dalam rangka terus mengupayakan para peternak memproduksi
susu dengan kualitas yang sesuai dengan standar yang diwpkan.
Perkembangan produksi susu di dalam negeri sejak beberapa tahun terakhir
ini menunjukkan peningkatan yang menggembirakan, yaitu usaha produksi yang
dikelola oleh para peternak sapi
perah
berskala keluarga yang dibina oleh Koperasi
Pengolahan Susu (IPS). Data dari
Ti
K o o r d i i i Persusuan (Dit. Jen. Perdagangan
Dalam Negeri. 1993) menunjukkan bahwa penyerapan susu segar dalam negeri
(SSDN) oleh IPS cenderung meningkat dari 652 ton per hari pada tahun 1991,
menjadi 825 ton per hari pada tahun 1993.
1Mengingat usaha peternakan rakyat
masih
dalam kondisi keterbatasan dalam
banyak
hal,
misalnya permodalan, jumlah pemilikan sapi, luas lahan, pengetahdan
maupun keterampilan, maka tingkat produktivitas maupun kualitas susu belum
mencapai persyaratan yang ditetapkan pemerintah secara keseluruhan, sehingga
masih ditemui susu segar yang tidak dapat dipasarkan karena kualitasnya masih di
bawah standar. Sebagai contoh, dari data Gabungan Koperasi Susu Indonesia Pusat
(1993). diketahui bahwa pada tahun 1991 sebanyak kira-kira 2600 ton susu segar
tidak dapat dipasarkan ke IPS, sedangkan pada tahun 1992 terdapat sebanyak kira-
kira 1660 ton (yang meliputi 3 Milk Treatment di Jawa (Ujung Berung, Boyolali
danPandaan).
Dengan semakin intensifnya peranan GKSI dalam membina peternak
tradisional(205 KUDIKOP se Indonesia,
dan
sejumlah 30 koperasi1KUD di wilayah
Jawa Barat), maka sejak tahun 1995
Milk
Treatment
Ujung Berung, Bandung, hanya
membeli susu segar untuk kebutuhan produksi susu pasteurisasi
Alum
Murni
dan
yogurt, sedangkan koperasilKUD di wilayah Jawa Barat lainnya mengirim susu
segar
langsung ke IPS.
Data dari Koperasi Peternak Bandung SelatanIKPBS (1996) di Pangalengan
dengan produksi susu segar rata-rata 131.3 ton per hari tahun 1996 dan 142.9
tonthari tahun 1995 diietahui pula bahwa jumlah
susu
segar yang tidak dapat dipa-
sarkan ke Industri Pengolahan SusuIIPS mencapai rata-rata satu persen dari total
produksi per hari, sedangkan
dari KPSBU. Lembang. Bandung (1996) diperoleh
laporan bahwa jumlah susu
segar
yang ditolak IPS mencapai 1.2% dari rata-rata
jumlah susu segar yang tidak dapat dipasarkan ke IPS rata-rata 13.460 ton pada
tahun 1995, 12.271 ton pada tahun 1996, dan pada triwulan pertama tahun 1997
mencapai 3.6 ton, dan pada
tahun
1995 susu segar yang ditolak pada tingkat peter-
nak
sebesar rata-rata 2.4 ton/bulan (KPS Bogor melakukan penjemputan susu
segar
pada anggota-anggotanya). Pada tahun 19% produksi susu segar dari KUDIKOP di
Jawa Barat (yang meliputi 11 kabupaten dengan 32 KUDIKOP) sebeiar
103,942,593.2 liter, yang memasok 47.7% produksi Nasional.
B. SIFAT FISIKO-KIMIA SUSU
Susu sapi bukan saja merupakan suatu lamtan kimia yang komplek, tetapi
juga sifat-sifat fisisnya secara alamiah sangat unik. Keadaan fisis yang memegang
peranan penting antara
lain
warna,
bau, rasa dan sifat penggumpalannya.
Susu berwarna putih kebii-biruan sampai dengan kuning kekecoklat-coklak-
tan. Warna putih pada susu serta penampakannya disebabkan penyebaran dispersi
koloid lemak, kalsium kaseinat dan kalsium fosfat, sedangkan warna kekuning-
kuningan ditentukan oleh kadar karoten
dan
riboflavin.
Rasa asli susu agak manis dan menyenangkan
@leasanr)
Adanya
rasa manis
berasal dari laktosa dan rasa asin berasal dari khlorida, sitrat dan garam-garam
mineral lainnya. Rasa susu ini mudah sekali menjadi abnormal karena beberapa
penyebab antara lain
:sari makanan ternak yang terbawa oleh susu, enzim susu.
oksidasi lemak, aktivitas mikroba
dan
peralatan susu.
Penggumpalan atau pengentalan merupakan salah satu sifat susu yang dapat
disebabkan oleh kegiatan enzim atau
penambahan
asam
(Fleet. 1978).
Enzim
renin
yang diproduksi dari lambung anak sapi atau enzim proteolitik lainnya, termasuk
isoelektrik kasein, yaitu sekitar
4.6,
maka kasein
akan
menggumpal karena garam-
garam kalsium dan fosfor yang semula berikatan dengan protein terlepas secara
berangsur-angsur.
Berat jenis susu segar bervariasi dari
1.0260
hiigga
1.0320
pada suhu
20%.
yang
dalam
praktek sehari-hari dibaca 26 atau.32. Variasi tersebut sangat bergantung
I
pada kadar lemak dan bahan kering tanpa lemak, bila kadar lemak tinggi maka berat
jenis akan rendah, karena berat jenis lemak lebih rendah dibandingkan dengan
komponen-komponen lainnya.
Susu segar memilii pH dengan kisaran
6.6
-
6.7
atau sediit
asam
dan
bila
terbenhlk cukup banyak asam yang berasal aktivitas mikroba, maka
pH
menurun
secara nyata. Susu yang baru perah bereaksi amfoter, karena terdapat senyawa-
senyawa bufer, yaitu fosfat, sitrat
dan
protein yang secara nonnal terdapat di dalarn
susu. Bila susu menunjukkan pH di atas
6.6
-
6.8
maka ha1 ini mempakan indikasi
sapi tersebut menderita penyakit mastitis (Fleet.
1978).
1.
Komposisi
Kimia
Lampert
(1965)
menerangkan bahwa susu memiliki komposisi gizi yang
sangat komplek, beberapa komponen susu seperti laktosa, kasein dan lemak susu
tidak dapat ditemukan pa& bahan makanan lain. Komposisi kimia susu berdasarkan
Tahel 1. Komposisi
Kimii
Susu Sapi
No. Sumber Bahan Laktosa protein* ~ e m a k * ~ b u *
Kering
- -- -
...
%.../...
1. Ressang & Nasution (1962) 12.10 4.60 3.20 3.45 0.85
2. Lampert (1965) 12.71 4.92 3.42 3.66 0.71
3. Brunner (1977) 13.00' 4.80 3.50 4.00 0.30
4. Fleet, (1978) 12.90 4.80 3.40 3.90 0.72
5. Belitz & Grosch (1987) 13.00 3.70 3.60 5.00 0.70
Keterangan
: *) =berdasarkan berat basah
Dari Tabel
1
dapat dijelaskan bahwa kandungan bahan kering susu pada
setiap hasil penelitian berheda-beda,
dan
umumnya kandungan komponen lemak susu
lebih tinggi dibandingkan dari komponen susu lainnya, rnisalnya protein atau abu.
Protein
Kandungan protein susu umumnya dengan kisaran antara 3.20 hingga 3.60
persen (berat basah), yang terbagi atas dua bagian besar, yaitu 80 persen adalah
kasein sedangkan 20 persen sisanya mempakan protein whey (whey protein).
Kasein disebut juga kalsium fosfoprotein yaitu protein yang mengandung
.
kalsium
clan
fosfor (Dalgleish, 1982). Kedua gmp protein
susu
tersebut berbeda baik
secara kirnia maupun fisik, yang pada kenyataannya di dalam susu masing-masing
terdapat dalam
fase
yang berbeda pula.
Kasein
merupakan agregat koloid, sedangkan
protein whey terdapat dalam larutan bebas. Dalam ha1 ini kasein lebih komplek
karena mampu mengikat ion logam yang pada gilirannya mudah mengalami presipit-
asi yang komplek. Dilain
fiiak,
protein whey yang merupakan protein globular
Pengasaman susu oleh bakteri dapat mengendapkan kasein. Bila kadar asam
cukup untuk menumnkan pH susu menjadi
5.2
-
5.3
maka kasein dapat mengendap
disertai dengan melarutnyaa garam-garan kalsium dan fosfor yang semula terikat
pada protein. Pada pH isoelektrik yaitu sekitar
4.6
-
4.7,
kasein diendapkan &an
terbebas dari semua garam-garam anorganik.
>
Lemak
Kandungan lemak bervariasi antara 3
-
6
persen (berat basah) yang dalam
susu berbentuk globula lemak yang bergaris tengah antara I
-
20
mikron, biasanya
dalam setiap militer susu mengandung kira-kira 3
x
lo9
butiran lemak. Sekitar
98
-
99
persen lemak susu berbentuk trigliserida, yaitu tiga rnolekul
asam
lemak yang
diesterifi-kasii terhadap gliserol, sedangkan lemak yang berbentuk digliserida dan
monogliserida masing-masing terdapat sekitar
0.5
dan 0.04 persen (Fleet.
1978).
Lebih lanjut dijelaskan bahwa lemak terdapat dalam tiga tempat, yaitu di dalam
globula, pada membran material dan di dalam serum.
Secara
kuantitatif lemak tersu-
sun oleh
98-99
persen trigliserida yang terdapat dalam globula lemak,
0.2-1.0
persen
fosfolipida yang terdapat dalam membran material dan sebagian di dalam serum.
Sisanya adalah sterol, yang kandungannya berkisar antara
0.25-0.40
persen.
Butiran lemak cenderung memisah
dan
timbul pada permukaan yang merupa-
kan suatu lapisan. Bagian lemak ini disebut krim dan cairan susu yang terdapat di
bawahnya d i b u t
skim.
Bagian lemak tersebut dapat terpisah dengan mudah karena
berat jenisnya kecil. Karena mempunyai luas permukaan yang sangat besat. maka
reaksi-reaksi kirnia mudah sekali terjadi di permukaan perbatasan lemak dengan
mediumnya
(Adnan,
1976).
k m a k
merupakan komponen susu yang penting karena beberapa
hal,
antara
bahan baku dalam pembuatan mentega. Usaha-usaha seleksi sapi perah kadang-
kadang ditujukan untuk menghasilkan jenis sapi yang menghasilkan air susu dengan
kadar lemak yang tinggi,
(2)
lemak bernilai gizi tinggi, atas
dasar
jumlah kalori yang
d i i d u n g n y a . Selain itu lemak juga mengandung nutrien lain, yaitu fosfolipid,
sterol, tokopherol (vitamin
E),
karotenoid, vitamin
A
dan vitamin
D.
(3) lemak
memegang peranan penting dalam menentukan rasa, bau dan tekstur. ~ e s k i p t n
susu dipisahkan menjadi
k r i i
dan
skim, maka sebanyak 70 persen fosfolipid terdapat
di dalam krim, yang dengan cepat dapat teroksidasi dan menimbulkan
cardboard
off-.vor.
Sterol yang terdapat dalam susu berupa kolesterol sebanyak 0.015 persen,
(4) lemak merupakan konsituen yang dapat mempengaruhi kesehatan manusia.
Laktosa
Laktosa merupakan karbohidrat utama dalam susu, dalam bentuk disakarida
yang selama pencernaan mengalami perombakan oleh enzim laktase atau enzim
O-D-
galaktosidase menjadi glukosa
dan
galaktosa (Fox
danMulvihiil, 1982;
Fleet,
1978;
Lampert, 1965). Selain laktosa dengan kandungan antara 3.7 hingga 4.92 persen,
juga ditemukan sejumlah kecil glukosa dan galaktosa dengan kadar masing-masing
sebesar 0.007 dan 0.002 persen. Di dalam susu, laktosa terdapat dalam
fase
larutan
yang sesungguhnya sehingga mudah dicerna pada proses hidrolisii oleh enzim usus.
Setiap organisme yang dapat menghidrolisis laldosa, tentu mempunyai ernzim
tersebut. misalnya
Streptococcus laktis
,
Escherichia coli
dan ragi. Laktosa tidak
dapat diidrolisis dengan
asam
yang terdapat
dalam
kelenjar pencernaan
kita,
baik di
dalam perut maupun di kelenjar usus. Hidrolisis laktosa di dalam pencernaan kita
dilaksanakan oleh mihoorganisme dan oleh enzim B-D-galaktosidase yang d i i i l -
kan
oleh kelenjar
usus.
Hasil hidrolisis tersebut berupa
asam-asamorganik terutama
Keasaman ini dapat mengganggu pertumbuhan bakteri yang tidak kita kehendaki
terutama bakteri yang dapat menyebabkan diare
@utrefacrive bacteria).
Sebagian kecil laktosa mengalami hidrolisis di dalam sel-sel dinding usus
karena sel-sel mukosa yang terdapat dalam dinding usus mempunyai enzim
&D-
galaktosidase tersebut. Penyerapan laktosa dalam dinding usus ternyata menstimulir
mineral seperti kalsium, fosfor yang disebabkan karena kenaikan permiabilitas dari
dinding sel-sel tersebut. Apabila laktosa diinjeksikan langsung ke dalam aliran darah,
maka
zat tersebut tidak dapat diiidrolisis melainkan
akan
disekresikan melalui urin
(Adnan,
1966).
Vitamin
dan
Mineral
Susu merupakan sumber vitamin yang larut
dalam
air yaitu vitamin B dan
C
maupun vitamin yang larut dalam lemak yaitu vitamin A, D,
E
dan K. Sebagian
besar vitamin
C
dan
BIZ
ternyata rusak selama proses pasteurisasi. Bila air pada
susu dihilangkan dengan penguapan dan sisanya dibakar maka akan diperoleh sisa
abu putih yang mengandung bahan-bahan mineral (Fox dan Mulvihill, 1982). Dalam
hal
ini
dua macam mineral yang paling penting dalam susu yaitu kalsium dan fosfor.
Hanya 25 persen kalsium. 20 persen magnesium dan 44 persen fosfor terdapat dalam
bentuk tidak larut, sedangkan mineral-mineral lainnya semua
dalam
bentuk larut.
Kalsium dan magnesium dalam bentuk yang tidak larut terdapat secara
kiiiawi dan fisik bersenyawa dengan kaseinat, fosfat dan sitrat. Hal inilah yang
memungkinkan susu dapat mengandung kalsium dalam konsentrasi yang
besar
serta
pada saat yang sama dapat mempertahankan tekanan osmosa secara normal dalam
darah. Komposisi mineral utama yang terdapat dalam susu sapi disajikan pada
Tabel
2.
Kandungan Mineral dalam Susu
Unsur
%Berat Basah
-
Kalium
-
Kalsium
-
Klorida
-
Fosfor
-
Natrium
-
Ma
nesium
-
Su
9
fur
Sumber
:Fleet
(1982).
Di samping mineral-mineral utama terdapat pula mineral-mineral lainnya
dalam jumlah yang sangat kecil antara lain, yaitu alumunium, barium, bromin, dan
seng. Mineral-mineral tersebut sebagian berada
&lam
bentuk suspensi dan sebagian
lagi berada dalam bentuk larutan.
2.
Emulsi Susu
Winarno
(1984)
mengemukakan bahwa emulsi merupakan
sumdispersi atau
suspensi suatu cairan di dalam
cairan
yang lain, yang mana molekul-malekul kedua
cairan tersebut tidak saling berbaur, tetapi saling antagonistik.
Struktur
Pada suatu emulsi biasanya terdapat tiga bagian yang terdispersi yang terdiri
dari butir-butir yang biasanya merupakan lemak, bagian kedua disebut media pen-
dispersi yang biasanya terdiri dari air, dan bagian ketiga adalah bahan penstabil
(stabilizer atau
emulsifier
agent), yang berfungsi menjaga agar butir minyak atau
lemak tadi tetap tersuspensi di dalam air.
Pada emulsi susu
maka
s t r u b globula lemak di bagian dalamnya sebagian
dilapisi dengan suatu membran tipis yang dinarnakan
membran material,
yang ber-
fungsi untuk menstabilkan struktur emulsi tersebut, disamping mencegah tergabung-
nya globula lemak satu dengan yang lainnya dan membentuk butiran yang lebih
besar (Fox dan Mulvihill. 1982). Kasein mempakan protein dengan
kadar
60 pdrsen
dari
membran material
itu, sedangkan fosfo1,ipida kira-kina
35
persen.
I
Karakterisasi
Susu merupakan emulsi minyak dalam air karena dalam ha1 ini butiran-
butiran lemak dan senyawa-senyawa yang ada hubungamya dengan lemak, misalnya
gliserida-gliserida terdapat dalam bentuk globula-globula yang berupa dispersi kasar.
Dengan perkataan lain bahwa bahan penstabilnya lebih terikat pada air atau lebih
larut dalam air (polar), sehingga dapat lebih membantu terjadinya dispersi minyakf
lemak susu dalam air ( W i n a r o 1984). Butiran-butiran lemak ini dapat dilihat
dengan mikroskop, yang mempunyai bentuk bulat.
Di dalam satu ml susu, kiua-kira terdapat tiga bilyun (3
x10')
globula lemak.
Diameter lemak bervariasi antara 0.1 mikron sampai lebih dari 15 mikron, dengan
rata-rata berkisar antara 3
-
4
mikron dan hanya sedikit yang diameternya kurang
dari dua mikron, kira-kira 90 persen globula memiliki diameter dengan
kisaran
2
-
7
mikron. Lemak dalam susu terdapat pada tiga tempat yaitu di dalam globula, pada
membran dan di dalam serum.
Kestabilan emulsi susu sangat ditentukan oleh selapisfilm (membran) protein
yang mengelilingi setiap butiran lemak. Bila struktur membran protein ini ~ s a k
akibat kadar asam dalam susu terlalu tinggi atau terjadi hidrolisis oleh enzim proteo-
presipitasi atau menggumpal, yang keadaan ini disebut sebagai susu pecah (Eckles,
el a[., 195
1;
Jennes dan Panon, 1969).
Kestabilan emulsi dapat juga dirusak oleh akibat pertumbuhan dan aktivitas
bakteria, misalnya Bacillus cereus yang menghasilkan enzim pencerna fosfolipid
pada membran meterial yang menyebabkan terjadi sweet curdling, yaitu susu men-
$
galami koagulasi tanpa penurunan pH (Fleet, 1978).
C
PROTEIN
SUSU
Susu sapi m e ~ p a k a n
bahan
makanan bernilai gizi tinggi karena mengandung
30-35 g protein per liter susu. Pada prinsipnya protein susu terbagi atas dua bagian
besar, yaitu 80 persen adalah kasein dengan empat macam komponen, yaitu
ors,-kasein, a,-kasein, B-kasein, dan k-kasein, sedangkan sisanya mempakan protein
whey yang terdiri dari dua komponen utama, yaitu 6-laktoglobulin (8-lg) dan
or-laktalbumin (a-la).
Namun demikian terdapat beberapa protein lainnya, yaitu albumin serum
darah, imunoglobulin, laktoferin, proteosa-pepton, dan seruloplasmin dalam kon-
sentrasi sangat rendah (trace).
1.
Kasein
a.
Komponen Kasein
Modler (1985) mengemukakan bahwa empat macam komponen utama
kasein, yaitu
as,-,
a,-,
8-clan
k-kasein berturut-turut terdapat kira-kira
45,
12,
34
dan 10 persen, tergantung dari genetik varian yang terlibat. Pada Tabel 3 disajikan
Berdasarkan Tabel
3
dikemukakan bahwa terdapat perbedaan berat molekul
antar komponen-komponen kasein, yaitu paling tinggi adalah komponen a,-kasein,
lalu diikuti 0-kasein, a,,-kasein dan k-kasein. Masing-masing komponen kasein
mengandung residu fosfat dan prolin, akan tetapi gugus sulfhidril (-SH) tidak'ter-
dapat pada komponen a,,-kasein dan 8-kasein.
3
Pada as,-kasein, sebanyak tujuh grup fosfat dari delapan grup terletak
diantara residu asam amino ke
42
dan
80
yang menghasilkan total muatan bersih
yaitu
-21
pada pH
6.6,sedangkan sisa molekul tidak bermuatan. Dalam ha1 ini
terdapat tiga bagian hidrofobik utama pada % , - h e i n , yaitu pada
antara
residu asam
amino ke
1-44, 90-113
dan
132-199.
Komponen a,-kasein,
yang
memiliki residu fosforil pada asam amino
10-13
merupakan komponen kasein yang terhidrofilik. Segmen C terminal
(160-207)
merupakan hidrofobik terkuat, dan segmen antara residu
91
dan
120
merupakan
hidrofobik lemah (Fox
dan
Mulvihill,
1982).
Tabel
3.
Sifat Fisiko-Kimia Komponen Kasein
Protein E ka- Stmu EM T i t i k T i t i k NO R-pro Bag SH-
r e i n Skim iso- lso- R e s per2 hidro grup
Komponen 6-kasein bermuatan negatif kuat, dengan empat grup fosfat dari
lima grup terletak pada terminal N antara residu asam amino ke 13 dan
21.
Terminal C ujung pada E-kasein mempakan bagian hidrofobik
.
Komponen k-kasein hanya mempunyai satu residu fosfoseril, dengan demiki-
an tidak mengikat kuat gugus kalsium, yang menyebabkan daya larut relatif tinggi
dalam lamtan kalsium lemah, dibandingkan as-kasein dan 8-kasein. Disebabkan
tidak terdistribusi meratanya asam amino yang bersifat asam, grup fosfat-serin, dan
asam amino hidrofobik dalam rantai polipeptida, maka bagian hidrofilik yang
bermuatan negatif tinggi
akan
mengalami
interspresed
dengan bagian hidrofobik kuat
dalam rantai peptida yang sama. Dengan demikian kasein cendemng berasosiasi
h a t , karena kombinasi ikatan hidrofobik, hidrogen, elektrostatik dan ikatan disulfida
(k-kasein)
.Kasein
mengandung residu fosfoseril yang tinggi yang menstabilkan
micell.
Disamping itu kandungan prolin pada kasein juga tinggi yang tersebb merata pada
rantai polipeptida dengan struktur or-helix dan 8-sheet yang terbatas sehingga
membentuk struktur kasein yang sangat terbuka dibandingkan dengan protein
whey.
Struktur
terbuka berarti bahwa kasein lebih mudah diserang oleh enzim
clan
juga dengan mudah berdifusi pada
intelfaces.
Keberadaan dan letak fosfat pada
,
berbagai fraksi kasein berimplikasi penting dalam sifat fungsionalnya.
Fox dan Mulvihill (1982) mengemukakan bahwa kasein dapat mengalami
'
destabilisasi selama prosessing produk-produk susu ataupun karena penyimpanan.
Telah diketahui bahwa kasein tidak larut pada titik isoelektrisnya yaitu pH
4.6
dengan cara fermentasi sedangkan kasein asam khlorida maupun kasein asam sulfat dengan cara asidifikasi langsung (Modler. 1985).
Asidifikasi dan pencucian mempakan tahap yang terpenting mendapat per- hatian pada proses isolasi kasein-asam. Bila proses asidifrkasi tidak efisien maka ion kalsium banyak tertinggal, sehingga produk yang d i i l k a n mempunyai viskositas -
.
.
-
-
. *..
.
- 2 .- --- ---
kasein asam, fermentasi produk susu cair dan pada pembuatan beberapa varietas keju seperti keju Cottage dan keju Queso Blanco.
Proses foriifikasi dengan penambahan kalsium, misalnya 0
-
0.6 persen kalsium khlorida, mengakibatkan presipitasi kasein pada suhu 90°C, yang ha1 ini dimanfaatkan pada produksi kasein protein whey kopresipitat. Kasein misel rneng- alami koagulasi, bila mencampur susu segar dengan larutan etanol.Pada prinsipnya kasein misel tahan panas atau stabil hingga pemanasan pada suhu 140°C selama 10-20 menit sebelum terjadi koagulasi. Daya tahan panas kasein sangat tergantung dari pH susu, akan tetapi susu segar tahan terhadap pemanasan diatas pH 6.4.
Pelepasan kalsium dari susu secara keseluruhan menyebabkan 10 kali disa- gregasi lebih lanjut, dengan membentuk komplek submiselar kasein dengan berat molekul 2 million. Sedangkan penambahan agensia disosiasi yang kuat seperti urea, HC1 guanidin alkali atau natrium lauryl sulfat maka agregat kasein berdisosiasi membentuk unit-unit monomernya dengan kisaran berat molekuI dari 19 000 hingga 30 000.
Pada k-kasein yang memiliki sedikit residu fosfoseril maka tidak mengikat kuat ion kaIsium dan larut dalam kalsium k-kasein dapat berasosiasi dengan kom- ponen a-kasein maupun 0-kasein, yang dengan adanya ion kaIsium akan rnenstabi- lisasi ikatan tersebut sehingga mencegah timbulnya presipitasi, namun demikian k-kasein kurang stabil akibat modifikasi oleh enzim proteinase, misal renet, yang dengan adanya ion kalsium dapat terjadi koagulasi kasein rnisel. Hal ini sangat penting pada proses pembuatan bezmacam varietas keju dan Mirenet.
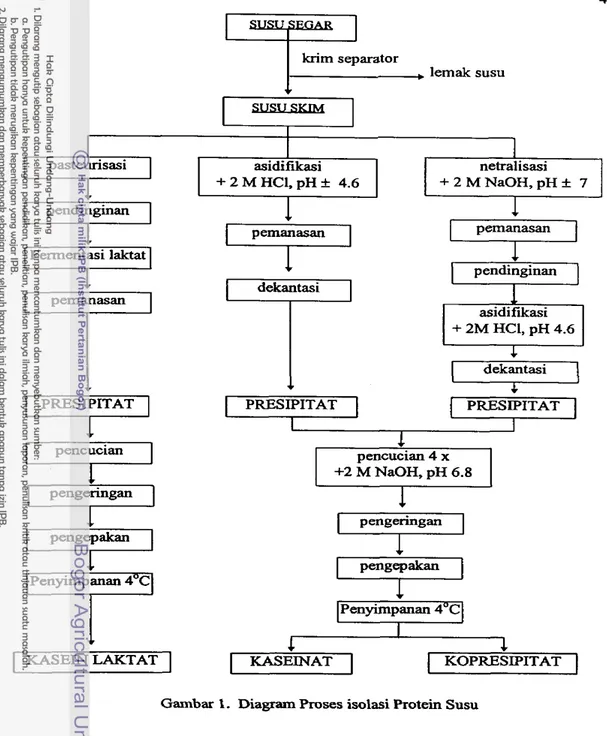
Kasein diisolasi dari susu skim melalui proses asidifikasi (presipitasi pada pH isoelektrii yaitu 4.6), dengan menggunakan asam lakcat, asam khiorida atau
dengan cara fermentasi sedangkan kasein asam khlorida maupun kasein asam
sulfat dengan cara asidifikasi langsung (Modler, 1985).
Asidifikasi dan pencucian merupakan tahap yang terpenting mendapat per-
hatian pada proses isolasi kasein-asam. Bila proses asidifikasi tidak efisien
maka'
ion
kalsium banyak tertinggal, sehingga produk, yang dihasilkan mempunyai viskositas
Jtinggi dan akan timbul kesulitan dalam produksi kaseinat berikutnya. Bila proses
pencucian tidak baik maka banyak laktosa yang tertinggal, sehingga produk akan
berubah warm selama penyimpanan.
Kasein renet diperoleh dengan cara hidrolisis komponen k-kasein oleh enzim
renin misalnya. Dalam ha1 ini Fox dan Mulvihill (1982) mengemukakan bahwa
untuk menginduksi proses koagulasi protein pada proses produksi kasein renet maka
85 persen k-kasein harus terhidrolisis. Selanjutnya presipitat kasein yang diperoleh
dipisahkan dari cairan wheynya,lalu dilakukan pencucian, penekanan, penggilingan,
pengeringan, penggilingan, pengayakan dan pengepakan.
Kasein renet tidak larut hingga dicapai pH 9 dengan adanya komplek ion
kalsium, karena tidak mengandung k-kasein amphifilik, yang diakibatkan terlepas-
nya makropeptida terminal-C hidrofilik, sedangkan kasein asam sangat tidak larut
pa& pH 4.6. Kadar abu kasein renet cukup tinggi (kalsium dan fosfat) karena dalam
clotted-micell mengandung koloid kalsium fosfat-sitrat, sedangkan kadar abu
kasein
asam rendah disebabkan kalsium fosfat terdapat di dalam
cairan
whey (Swaisgood,
1985). Kasein kopresipitat Iebih larut dari pada kasein asam maupun kasein renet,
tetapi k e l a ~ t a n
terbaik adalah kaseinat.
Kaseinat diproduksi dari kasein asam yang masih belum dikeringkan atau
dengan melakukan rekonstitusi q u n g kasein asam dengan natrium, kalium, amonia
(NH,)
atau kalsium dengan proses netralisasi dari pH 6.8 hingga 7.5. Produksi
cita rasa yang lebih baik dibandingkan bila diproduksi dari rekonstitusi kasein asam. Suatu ha1 yang sangat penting diperhatikan yaitu tetap mempertahanlcan pH dari
6.8 hingga 7.5 untuk mencegah terjadi pengikatan fosfolipid pada bagian hidrofobik dalam molekul kasein.
Produk kopresipitat dapat diperoleh dengan memanaskan susu s k i , sehingga protein whey mengalami denaturasi dan selanjutnya membentuk kompleks dengan kasein melalui ikatan disulfida. Proses asidifikasi pada pH 4.6 aiau dengan menam- bahkan kalsium khlorida akan menyebabkan presipitasi kompleks tersebut. Dalarn ha1 ini dapat digunakan penambahan 3 tingkat konsentrasi kalsium khlorida, yaitu kalsium tinggi (2.5
-
3.0 persen), kalsium sedang (1.0-
2.5 persen) dan kalsium rendah (0.5-
0.8 persen). Jumlah penambahan kalsium dapat dikontrol, suhu dipertahankan 900 C, sambil diiakukan penambahan asam.2. Protein Whey
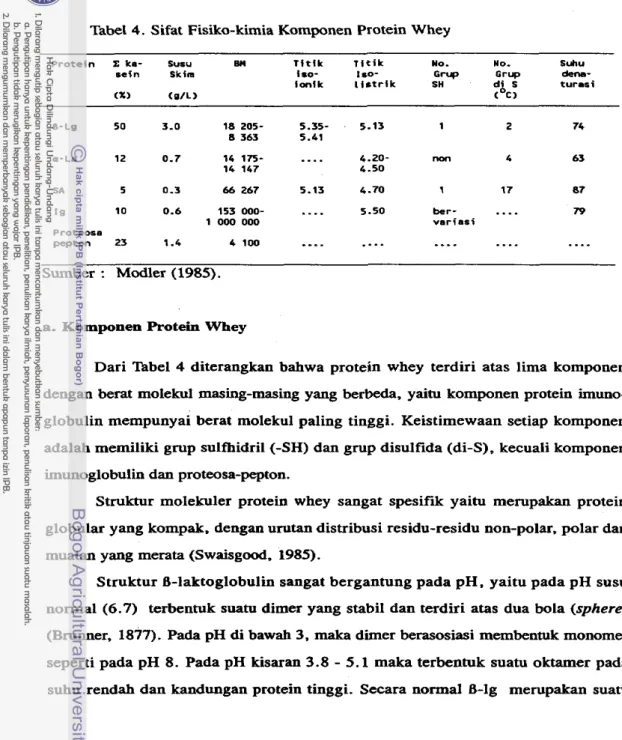
Protein whey merupakan protein globular, kompak dengan berat molekul antara 16 000-5 000 000 (nbel4). yang terdiri dari komponen utama yaitu B-lakto- globulin (B-lg) disarnping a-Iaktalbumin (a-la), serum albumin (SA), imunoglobuIin
(Ig) clan proteosa pepton (Modler. 1985).
Tab4 4. Sifat Fisiko-kihnia Komponen Protein Whey
P r o t e i n E lea- Sucu Bll T i t i k ~ i t i k Yo. No- Suhu
seln skim iso- I SO- Grup Grup den€,-
i o n i k I i a t r i k SH di 5 t u r a s i
C%> < I / L > ("c>
I g 10 0.6 153 000-
....
5.50 ber- .... 79 1 O W 000 v a r i a s iProteosa
pepton 23 1.4 4 100
.-..
....
---. ....
....
Sumber : Modler (1985).
a. Komponen Protein Whey
Dari 'Pabel 4 diterangkan bahwa protein whey terdiri atas lima komponen dengan berat molelcui masing-masing yang berbeda, yaihl komponen protein imuno- globulin mempunyai berat molekul paling tinggi. Keistimewaan setiap komponen adalah memiliki grup sulfhidril (-SH) dan grup disulfida (di-S), kecuali komponen imunoglobulin dan proteosa-pepton.
Struktur molekuler protein whey sangat spesifik yaitu merupakan protein globular yang kompak, dengan urutan distribusi residu-residu non-polar, polar dan muatan yang merata (Swaisgood, 1985).
dimer dengan dua buah sub-unit yang identik. Setiap monomer mengandung satu grup sulfiidril (SH) dan dua ikatan disulfida.
Pada kondisi pH susu normal (sekitar 6.6) atau diatasnya, maka a-lakto- globulin merupakan suatu monomer. Suatu hat yang menarik adalah struktur tiga diiensi a-lg sangat mirip dengan lisozim salah satu komponen protein albumen telur (Brunner. 1977).
Komponen or-laktalbumin berbeda dengan 8-lg, karena hanya merupakan suatu monomer, dengan empat ikatan &sulfida tanpa gugus SH-bebas. Dengan ada- nya gugus SH dan ikatan disulfida menyebabkan timbulnya disulfida interchange dan terbentuknya formasi komplek protein whey akibat perlakuan pemanasan ataupun terjadi interaksi dengan k-kasein yang juga mengandung dua grup-SH.
Komponen imunoglobulin di daIam air susu terdapat dalam bentuk monomer atau bentuk polimernya. Bentuk monomer imunoglobulm t e d i dari 4 rantai mole- kul yaitu 2 rantai pendek dengan berat molekul kira-kira 20 000 dan 2 rantai peptida yang panjang dengan berat molekul 50 000
-
70 000. Seperti diketahui imunoglobu- lm me~pztkan protein yang mempunyai daya sebagai antigen atau immunitas (anti-genic properties).
b. Sifat-sifat Protein Whey
Protein whey berbeda dengan kasein dalam beberapa aspek, antara lain kelarutan pada titik isoelektrik, sifat amphifilik yang terbatas, globular dan peka ierhadap denaturasi akibat panas.
yang sedikit maka kedua ha1 tersebut rnenyebabkan terbentuknya konformasi glo- bular dengan struktur helik yang nyata.
Protein whey sangat sensitif terhadap pemanasan di atas suhu 60°C, yaitu
akan mengalami denaturasi yang bergantung dari membukanya konformasi globular
yang kompak rnenjadi konformasi acak. Denaturasi protein whey ditandai dengan kehilangan daya Larut pada pH 4.6 hingga 5.4 (Morr. 1974).
Akibat pemanasan larutan whey berturut-turut mengalami presipitasi yaitu imunoglobulin (Ig). B-laktoglobulii, serum albumin (SA) dan or-laktaibumin, dengan masing-masing suhu denaturasi pada 79,74,87 dan 63OC. Kornponen B-laktoglobulin (B-lg) merupakan 50 persen protein whey yang mengalami presipitasi akibat pema- nasan, lalu cr-laktalbumin (a-la) sebesar 12 persen, berikutnya imunoglobulin (Ig)
sebanyak 10 persen clan serum-albumin (SA) 5 persen.
Penelitian menunjukkan bahwa presipitasi protein whey maksimum dicapai dengan memanaskan larutan whey pada pH 6 dengan suhu 120°C. Hal ini penting diperhatikan terutama pada proses deproteinize larutan whey.
Penambahan kasein atau kasein-misel pada pemanasan whey akan rnencegah terbentuknya partikel presipitat. Daya stabilisasi oieh kasein tersebut tidak melibat-
kan
mekanisme disuljide-interchange. melainkan oleh terbentuknya formasi komplek calrium-linkage antara kasein dengan agregasi protein whey.D.
-
S
T
=
FUNGSIONAL PROTEINSUSU
Sifat fungsional protein merupahn sifat-sifat yang rnenyangkut faktor-faktor yang berpengaruh pada protein sebelum dikonsumsi, termasuk faktor enzimatik, non-enzirnatik (organoleptik) dan industri, akan tetapi tidak termasuk faktor nilai
mempengaruhi perilaku protein selama proses pengolahan, terutama dalarn suatu siatem pangan. Sebagai contoh. untuk pensubstitusi produk susu dibutuhkan sifat fungsiond pembentuk get, sifat koagulasi, pembuihan dan fat holding capasity.
Modler (1985) mengemukakan bahwa terdapat 7 macam sifat fungsional
utama (lihat Tabel 5) yang hams dipenuhi suatu protein sebagai zat makanan (food protein ingredients).
Protein ingredient dapat digunakan dalam suatu sistem pangan dengan memenuhi salah satu sifat atau beberapa sifat seperti yang tercantum dalam Tabel 5.
Contoh, tepung susu skim (Skim Milk Powder-SMP) dapat ditambahkan dalarn yoghurt untuk mengurangi sineresis (akibat hidrasi) dan menghasilkan yohurt dengan tekstur yang dikehendaki f i r m body) juga penampakan yang lebii menarik.
Tabel 5. Sifat Fungsional Food Protein Ingredients.
Property Fungsional attributes
-
Organoleptik - Penampakan-
Hidrasi- Surfactant
-
Structural-
Textural-
Rheological-
Flavor, odor, tekstur, w a m a Kekeruhan, warna
Kelarutan, dispersi
,
swelling, viskositas, gel.Emulsif ikasi
,
foaming, whipping, - - - -baking.
E l a t i s i tas, cohesi, texturization,
agregasi
.
Viskositas, adhesi, agregasi,
texturiza tion, geld tion.
Agre asi, gelation, viskositas,
dougg-formation, extrudability.
Sumber : Mom (1981)
daIam
Modler (1985).pengeringan semprot, pengeringan dram atau pengeringan vakum kemungkinan terjadi kerusakan struktur yang tidak dapat balik (irreversible), menyebabkan kemampuan rehidrasi sangat menurun. Pengeringan beku mempertahankan struktur makro protein curd sehingga dapat mengalami proses hidrasi yang lebih lengkap. Pada umumnya protein tidak mengalami hidrasi lengkap hingga mencapai aktivitas air (aw) 0.92. Berdasarkan penelitian Ling (1972) seperti yang diemukakan Modler (1985). dalarn ha1 ini terjadi pengikatan 6 molekul air pada setiap sisi aktifnya.
Sifat aktif permukaan protein susu khususnya kasein penting diperhatikan pada aplikasi produk makanan. Protein merupakan emulsi yang stabil bila dapat mempertahankan keterpaduan fase kontinyus dengan fase dispersinya. Dalam ha1 ini protein pada permukaannya yang mengandung residu asam amino hidrofilik akan berorientasi dengan fase larut (aqueous), sedangkan segrnen hidrofobik protein akan
berikatan dengan gugus tidak polar atau fase lernak.
Sifat kelarutan sangat penting, khususnya berhubungan erat dengan fungsinya dalam daya buih dan pengemulsi. Perhatian perlu ditingkatkan pada saat proses pemanasan, agitasi dan penyesuaian pH untuk mencegah terjadi denaturasi, yang
akan mengurangi kelarutannya diatas kisaran pH 3 hingga 8, dan
hal
ini dapat dilihatKasein rennet dan kasein asam bersifat tidak larut dalam air, sehingga peng- gunaannya sebagai pengayaan nutrisi atau pengikat air dan lemak dalam makanan sangat terbatas. Namun demikian amonium (NIX,-), natrium (Na-) dan kalium kasei- nat mempunyai daya larut terbaik (Morr. 1979), sedangkan Msiurn kaseinat &pat membentuk suspensi koloid. Kaseinat tidak larut pada kisaran pH isoelektriknya (3.5-5.0) sehingga penggunaannya terbatas pada produk pangan yang cair dan bersi-
fat asam.
Protein merupakan emulsi yang stabil bila dapat mempertahankan keterpa- duan fase kontinyus dengan fase dispersinya. Dalam ha1 ini protein pada permu- kaannya yang mengandung residu asam amino hidrofilik akan berorientasi dengan fase larut (aqueous), sedangkan segmen hidrofobik protein akaa berikatan dengan gugus tidak polar atau fase lemak (Fox dan Mulvihill. 1982).
Faktor faktor yang mempengaruhi stabilitas emulsi meliputi : (a) faktor muatan dan ukuran fase diskontinyu fase dispersi. @) tegangan permukaan (interfa- cial tensions). (c) lrarakteriitik absorbed-film, (d) rasio berat antara kedua fase. dan (e) viskositas. Difusi protein, adsorpsi dan spreadlbiliry atau fleksibilitas molekul protein juga penting diperhatilcan dalam hal stabiiitas emulsi ataufoMl stu6iliry.
Kaseinat. yang mempakam bahan pengemulsi terbaik dibandmgkan dengan protein whey, akan membentuk emulsi yang stabil pada kisaran pH 5.4 hingga 10.5 dan kuat ion 0.05 hingga 0 . 3 . akan tetapi akan lebih efektif pada pH 10.4 dan
dan digliserida dan polyoxyethylene glycerol monostearat. disamping itu stabilitas emulsi kasein dipengaruhi oleh kalsium. fosfat dan sitrat.
3. Pembentukan Gel
Pembentukan gel dapat didefinisikan sebagai fenomena agregasi protein sebagai interaksi polirner-polimer dan polimer-pelarut serta daya tarik menarik dan tolak menolak yang seimbang sehingga membentuk jaringan tersier atau matrik (Schmidt, 1981). Mekanisme pembentukan gel dapat terjadi melalui induksi panas, induksi kalsium clan ikatan silang dalam struktur gel. Pembentukan gel akan optimal pada protein yang belum terdenaturasi dan akan menurun selama penyimpanan. Beberapa ha1 yang mempengaruhi pernbentukan gel adalah konsentrasi protein, pH, adanya agensia pereduksi serta perlakuan pemanasan.
Pada kondisi alamiah maka grup-SH akan aktif, sedangkan bila terjadi dena- turasi maka rantai polipeptida membuka yang pada gilirannya grup-SH terekspos dan akan berpartisipasi dalam disulfide-exchange, yang pada kondisi tertentu akan membentuk gel protein. Formasi gel protein akan melibatkan ikatan hidrogen, inter- aksi hidrofobik, ikatan kovalen dan jernbatan-kalsium atau calsium bridging.
Consentrated Calsium-caseinates (
>
15 persen bahan kering) terdispersi membentuk gel dengan pemanasan; suhu pembentukan gel meningkat pada kosentra- si 15-25 persen bahan kering dengan kisaran pH antara 5.9-7.6. Dengan pen- d i i i n a n terjadi pencairan gel secara perlahan, tetapi gel akan terbcntuk lagi dengan pemanasan. DaIam ha1 ini peranan komponen protein k-kasein pada pembentukan gel sangat penting. Natrium kaseinat (kandungan protein dengan kisaran 90-95 96)Cheftel et al.. (1985) rnengemukakan bahwa kekuatan buih meningkat dengan meningkatnya konsentrasi protein dalam larutan sampai dicapai nilai maksimum, sedangkan kemampuan beberapa protein dalam pembentukan buih dibandingkan dengan cara mengukur kekuatan buih dan konsentrasi protein.
Daya kembang (over-ncn) natriurn kaseinat adalah 720 persen, sedangkan untuk Whey protein Consentrare atau W P C dengan metode yang berbeda adalah antara 0-760 persen dan untuk putih telur sebesar 900 persen (Morr, 1974); penggu- naan kasein ternyata lebih baik dibandiigkan dengan protein whey untuk formulasi suatu whipped topping mix.
Faktor yang berperan terhadap viskositas antara lain konfonnasi protein, sifat hidrasi, adanya gugus hidrofobik dan distribusi muatan. Kesemua sifat tersebut akan
mempengaruhi interaksi intermolekuler yang akan mengakibatkan peningkatan visko- sitas. Dalam hal ini tejadi juga pengikatan air sehinga terjadi pengentalan clan sifat
ini bermanfaat dalam pembuatan sup dan sebagainya.
Viskositas larutan natrium kaseinat adalah tinggi, dan mencapai maksimal pada pH 7 yang secara logaritmik berhubungan dengan konsentrasi vs suhu absolut (seperti yang dikutip Fox dan Mulvihill, 1982, dari Hayes, et al., 1968). Roller- dried narriurn kaseinat dapat diperoleh dengan cara mencampur alkali dengan kasein tanpa pelarutan kembaIi yang ternyata efektif terbentuk pada konsentrasi
Selanjutnya diterangkan bahwa akan terjadi penurunan sangat cepat dengan meningkatnya suhu dan pH di atas 7.0; demikian pula amonium kaseinat mem- punyai viskositas lebih rendah dibandingkan dengan natrium kaseinat.
E.
MODIFTKASI PRODUK-PRODUK KASEINATModifikasi protein yaitu meliputi perlakuan-perlakuan fisik, kimia dan enzimatis yang mempengaruhi struktur dan konformasi baik primer maupun kuarterner sehubungan dengan sifat-sifat fisiko-kimia dan fungsional.
Tujuan modifikasi protein yaitu meningkatkan sifat-sifat fisik, sensori mau- pun nilai gizinya di samping jurnlah penggunaannya dalam sistem pangan dapat di- batasi dengan cara memblok reaksi yang bersifat dezeriortltive (Modler. 1985). Pada umumnya m o d i f h i sifat-sifat fungsional kasein dapat diakukan dengan 3 metode
dasar yaitu proses enzimatis, kimia dan fraksiki komponen-komponen kasein.
Kasein merupakan suatu sistem protein multikomponen yang &pat difraksi- nasi dengan menghasilkan crS-,J- dan k-kasein. Hasil penelitian Reimerdes dan Lorenzen (1983) seperti yang d i t i p oleh Molder (1985). menunjukkan bahwa sta- bilitas emulsi yang dibentuk olehJ-kasein adalah rendah dan bentuk k r i i a seperti gel, as-kasein lebih efektif sebagai stabilizer akan tetapi k-kasein adalah superior.
M o d i f h i kimia meliputi proses mbstitusi atau penambahan suatu grup atau komponen secara ikatan kovalen tetapi dapat juga menyanght grup hidrofobik atau muatan.
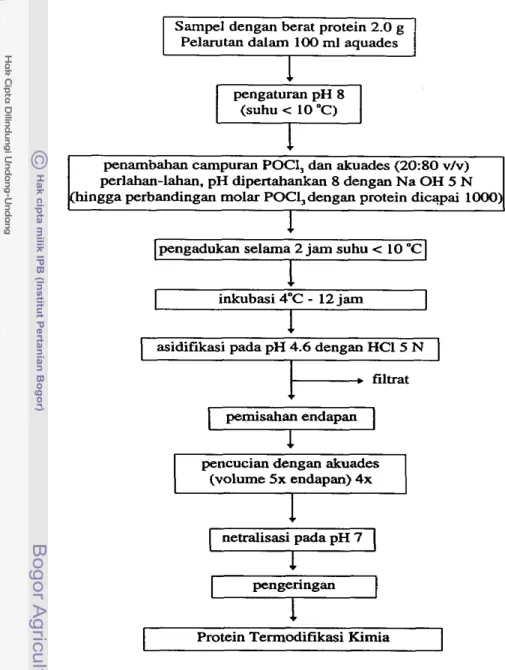
oksiiorida adalah bahan yang relatif murah dan aman dari aspek kesehatan. Namun demikian Matheis dan Whitaker (1984) mengemukakan bahwa sodium trimetafosfat juga dapat digunakan, terutarna untuk skala besar, selain asarn fosfat dan fosforus pentoksid. POCI, mempakan pereaksi yang sangat ref, dan bereaksi sangat cepat dengan H,O secara eksotermis membentuk asam fosfat dan asam Irhlorida. Penu- runan pH terjadi sangat cepat yang diiringi pembentukan panas, dapat meng- akibatkan protein terdenaturasi, sehimgga penambahan POCl, hams dilakukan berta- hap, dalam suhu rendah (3-25OC) diikuti kontrol pH (6-8.5) dengan penambahan NaOH.
Proses adisi grup fosfat dapat digunakan dalam modifikasi kasein, yaitu dengan cara mereaksikan kasein dengan fosfoms oksiklorida dan secara kovalen dilakukan penambahan 7.4 grup fosfat per rnolekul kasein. Kasein terfosforilasi menunjukkan viskositas yang nyata tinggi dibandingkan kasein kontrol, tetapi me- nunjukkan kapasitas emulsifikasi yang rendah (Matheis et al., 1983). Penelitian Matheis dan Whitaker (1984) mengungkapkan bahwa fosforilasi kasein oleh fosfoms oksiklorida ternyata meningkatkan sifat pembentukan gel, terutama dengan tersedia- nya ion kalsium. Peningkatan sifat kelarutan, viskositas atau kemarnpuan membentuk gel diduga akibat terbentuknya ikatan silang (cross linkage) antar molekul protein (Woo et al., 1982). Dalam ha1 ini terjadi pengikatan 10-20 molekul fosfat/rnolekul protein secara kovalen. Penelitian lain membuktikan bahwa pengikatan molekul fosfat dapat mencapai 50/rnolekul protein pa& albumin.
Hasil penelitian Medina et al.. (1992) menunjukkan bahwa penggunaan fosforus oksiiorida (POCl3 ternyata bermanfaat untuk mengubah sifat-sifat fisiko- kimia kasein, yaitu meningkatkan kelmtan pada pH isoelektrik, viskositas dan sifat hidrasi kasein. Hal ini bergantung pada tiga faktor, yaitu jumlah pengikatan fosfat
2. Secara Enzimatis
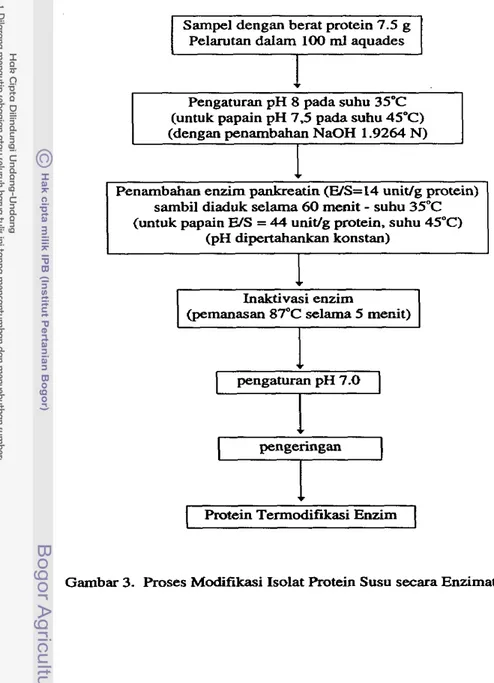
Secara enzimatis, kasein dapat dimodifikasi juga selain oleh renet, misalnya hidrolisis kasein dengan menggunakan enzim pankreatin ternyata dapat meningkat-
kan sifat daya buih kasein. Penggunaan enzim ini dapat membentuk a range tailor- wtude hydrolyzates, yaitu pembentukan viskositas dan karakteristik daya buih (foam- ing) (Modler. 1985). Lebih lanjut dikemukakan bahwa kasein dan protein whey dapat juga dihidrolisis dengan meng&unakan pankreatin yang ternyata dapat mening- katkan sifat emulsifikasi kasein. Pada umumnya hidrolisat kasein ini banyak d i n - fatkan pada pembuatan candy.
Modifikasi enzimatis merupakan suatu cara untuk meningkatkan sifat fungsio- nal protein, misalnya sifat kelarutan, emulsifikasi, gelasi, daya serap air, kapasitas pengikatan lemak, viskositas, heat coagulability, dan kapasitas buih. Proteolisis yang terkontrol dengan baik alcan mempengaruhi konformasi protein, ukuran berat mole- kul, kelarutan, dan kekuatan ikatan inter/intra rnolekuler pada molekul protein (Ponnampalam et al., 1987).
Sehubungan dengan pemilihan enzim yang digunakan untuk produksi protein hidrolisat, maka Lahl dan Braun (1994) mengemukakan bahwa penggunaan enzim dengan aktivitas yang luas adalah efektif dibamdingkan enzim yang hanya memi- liki aktivitas spesifik; misaInya sekaligus memiliki aktivitas ekso daan endo-enzim sehingga d i a p k a n dapat diperoleh komposisi asam amino, peptida atau tripeptida yang dibutuhkan untuk suatu sifat fungsional tertenm.
Salah satu enzim yang praktis dalam food protein hydrolysis dan banyak digunakan secara komersii adalah enzim pankreatin, yang mengandung campuran utama enzim tripsin dan khiiotripsin (Law dan
Braun.
1994). Adler-Nien (1986)(pig) yang menunjukkan spesifitas sangat luas (very broad specificity), karena terdiri dari campuran enzim tripsin, khimotripsin. elastase, karboksipeptidase A atau B, dengan kisaran aktivitas pada pH 7-9. Protease asal tanaman yang juga sering digu- nakan pada produksi protein terhidrolisis adalah papain (crude papain) yang meru- pakan campuran dari papain (BM 21 000). khimopapain (BM 36 000) dan lisozim
(BM 25 OOO), dengan spesifitas lebih rendah dibandingkan pankreatin; sedangkan pure papain merupakan tipe enzim cystine protease, dengan kisaran aktivitas
masing-masing pada pH 5-9 dan pH 5-7.
Di lain pihak proteolisis yang ekstensif dapat menimbulkan peptida yang rasanya pahit, misalnya penggunaan papain dan fisin pada hidrolisat kasein dan al- bumen telur menimbulkan flavor pahit (Mary-Clegg dan McMillan, 1974). Akan tetapi ha1 ini dapat dicegah dengan penggunaan enzim yang selektif, atau kombinasi dengan enzim lain atau mengontrol tingkat hidrolisis yang terjadi. Sebagai contoh. penggunaan gabungan enzim papain dengan aminopeptidase porcine kidney, dan beberapa enzim asal kapang dapat menghasiIkan kasein larut tanpa rasa pahit. Penghilangan peptida yang pahit dari hidrolisat kasein dapat dilakukan dengan proses pertukaran ion atau dengan teknik adsorpsi (seperti yang d i i t i p oleh Modler. 1985 dari Mom. 1982). Modifikasi albumen telur dengan enzim protwlitik, misal- nya bromelin, atau protease kapang ternyata meningkatkan sifat pembentukan buih
dan volume food angel cake akan -pi menimbulkan flavor yang tidak diiehembki. Hidrolisis terbatas terhadap protein whey oleh enzim pepsin ternyata me- ningkatkan sifat emulsifikasi dan kapasitas buih, akan tetapi bila menggunakan enzim Pronase (protease kapang Streptomyces grisu.9) maka te j a d i kern- pada karak-
teristik fungsional tersebut (Kuehler dan Stine. 1974).
isoelektrisnya yang pada gilirannya dapat mempengaruhi sifat emulsifikasi, pernben- tukan buih maupun pembentukan gel (Chobert et al.. 1988). Selanjutnya dikemuka- kan bahwa penggunaan protease bakteri Staphylococcus aureus
V8
pada kasein selama 48 jam hidrolisis ternyata meningkatkan kelarutannya hingga 50 persen pada sekitar pH 4.0-5.0, akan tetapi menurunkan aktivitas emulsifikasi.Frokjaer (1994) mengemukakan bahwa karakteristik terpenting protein terhi- drolisis antara lain sifat kelarutan yang tinggi pada kondisi asam dan palatabilitas yang baik, sehiigga sangat bermanfaat sebagai sumber protein, baik untuk kebutuh-
an pengobatan (misal, pada penyakit cysticjibrosis dan pancreutitis), maupun untuk konsumsi secara umum ( diets for the elderly. sports nutrition, dan food allergies/in-
fan8 formula). Miprodan dan Viby adalah contoh protein hidrolisat atau protein ter- modifikasi enzim bentuk komersil yang berasal dari kasein. Lacprodan dari protein whey dan Pro upm berasal dari protein kedelai yang sudah banyak digunakan dalam pengkayaan gizi ddam soft drink dan juice-based beverages.
Novo (1990) merekomendasikan bahwa komposisi kimia Pro up meliputi kandungan protein sebesar 84 % (berdasarkan berat kering), abu 6 5%. karbohidratlse-
rat 9% dan air 6%. Persyaratan mikrobilogi antara lain, negatif terhadap colilgram dan Salmonella/lO gram. Indeks kelarutannya yang tinggi pa& pH 4.2 (larutan pro- tein 5%) mencapai
>
99.9%. Penggunaan Pro up yang berbentuk tepung disarankan s