Pesatnya perkembangan ilmu pengetahuan dan teknologi serta berubahnya pola hidup masyarakat yang lebih mengarah kepada makanan siap saji yang berdampak pada munculnya berbagai penyakit degeneratif. Pola makan yang tidak tepat mengakibatkan terbentuknya radikal bebas dalam tubuh sehingga muncul beragam penyakit seperti kanker, diabetes melitus, aterosklerosis, katarak, dan penyakit jantung koroner (Napoli 2001). Namun, saat ini masyarakat mulai sadar dan mengubah pola hidupnya untuk kembali pada alam ( ), termasuk dalam hal memelihara dan menjaga kesehatan. Keberadaan radikal bebas yang bersifat tidak stabil dan reaktif di dalam tubuh dapat mengakibatkan kerusakan seluler, jaringan, dan genetik (mutasi DNA). Radikal bebas dapat dikurangi dengan mengkonsumsi antioksidan dalam jumlah yang cukup. Secara alami, tubuh mempunyai benteng yang dapat mencegah serangan berbagai penyakit yang disebut antioksidan. Antioksidan memiliki fungsi untuk menghentikan atau memutuskan reaksi berantai dari radikal bebas yang terdapat dalam tubuh sehingga dapat menyelamatkan sel3sel tubuh dari kerusakan akibat radikal bebas (Hernani & Rahardjo 2005).
Tubuh manusia menghasilkan senyawa antioksidan, tetapi tidak cukup kuat untuk berkompetisi dengan radikal bebas yang dihasilkan oleh tubuh sendiri setiap harinya (Hernani & Rahardjo 2005). Kekurangan antioksidan dalam tubuh dapat diatasi melalui asupan dari luar yang banyak mengandung antioksidan. Masyarakat tradisional umumnya telah memanfaatkan beberapa tanaman obat yang berpotensi sebagai antioksidan, salah satunya salam ( Wight.).
Tanaman salam biasa ditanam oleh petani untuk kebutuhan sebagai bumbu masak sehari3hari. Lingkungan agrobiofisik sekitar tanaman salam sangat berpengaruh terhadap pertumbuhan dan produksi daun salam. Iklim, ketersediaan unsur hara tanah, dan topografi daerah tempat tumbuh tanaman salam sangat menentukan kandungan bahan aktif daun salam yang berpotensi sebagai antioksidan. Dalam penelitian ini akan digunakan daun salam dari berbagai daerah dengan lingkungan agrobiofisik yang berbeda, yaitu Sukabumi, Bogor, dan Cianjur.
Masalah dari penelitian ini adalah belum adanya penelitian ilmiah secara yang membuktikan adanya pengaruh lingkungan
agrobiofisik terhadap khasiat antioksidasi dari ekstrak daun tanaman salam (
Wight.) belum dilakukan.
Penelitian ini bertujuan untuk membuktikan khasiat antioksidasi ekstrak daun salam ( Wight.) pada lingkungan agrobiofisik yang berbeda dengan mengukur konsentrasi malondialdehida menggunakan metode asam tiobarbiturat.
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai khasiat antioksidasi tanaman salam (
Wight.) secara in vitro sehingga dapat dijadikan dasar pengembangan tanaman
salam ( Wight.) menjadi
fitofarmaka.
% !"!#
Menurut Tjitrosoepomo (2005), salam yang merupakan salah satu jenis tanaman obat yang tergolong dalam Ordo: Myrtales, Famili: Myrtaceae, Genus: , dan Spesies: Wight. Tanaman ini juga memiliki nama latin lain yaitu
(Wight.) Walp. (Wijayakusuma 1996). Salam memiliki beberapa nama lain di Indonesia yaitu meselangan, ubar serai, gowok, manting, dan kastolam.
Salam dapat tumbuh liar di hutan dan pegunungan, atau ditanam di pekarangan rumah. Tanaman ini dapat ditemukan dari dataran rendah hingga daerah yang ketinggiannya mencapai 1800 meter di atas permukaan laut (Wijayakusuma 1996) bahkan hingga mencapai 2000 meter di atas permukaan laut (PSB 2006). Salam dapat dikembangbiakkan dengan cara stek batang, cangkok, dan biji (Dalimartha 2000).
Pesatnya perkembangan ilmu pengetahuan dan teknologi serta berubahnya pola hidup masyarakat yang lebih mengarah kepada makanan siap saji yang berdampak pada munculnya berbagai penyakit degeneratif. Pola makan yang tidak tepat mengakibatkan terbentuknya radikal bebas dalam tubuh sehingga muncul beragam penyakit seperti kanker, diabetes melitus, aterosklerosis, katarak, dan penyakit jantung koroner (Napoli 2001). Namun, saat ini masyarakat mulai sadar dan mengubah pola hidupnya untuk kembali pada alam ( ), termasuk dalam hal memelihara dan menjaga kesehatan. Keberadaan radikal bebas yang bersifat tidak stabil dan reaktif di dalam tubuh dapat mengakibatkan kerusakan seluler, jaringan, dan genetik (mutasi DNA). Radikal bebas dapat dikurangi dengan mengkonsumsi antioksidan dalam jumlah yang cukup. Secara alami, tubuh mempunyai benteng yang dapat mencegah serangan berbagai penyakit yang disebut antioksidan. Antioksidan memiliki fungsi untuk menghentikan atau memutuskan reaksi berantai dari radikal bebas yang terdapat dalam tubuh sehingga dapat menyelamatkan sel3sel tubuh dari kerusakan akibat radikal bebas (Hernani & Rahardjo 2005).
Tubuh manusia menghasilkan senyawa antioksidan, tetapi tidak cukup kuat untuk berkompetisi dengan radikal bebas yang dihasilkan oleh tubuh sendiri setiap harinya (Hernani & Rahardjo 2005). Kekurangan antioksidan dalam tubuh dapat diatasi melalui asupan dari luar yang banyak mengandung antioksidan. Masyarakat tradisional umumnya telah memanfaatkan beberapa tanaman obat yang berpotensi sebagai antioksidan, salah satunya salam ( Wight.).
Tanaman salam biasa ditanam oleh petani untuk kebutuhan sebagai bumbu masak sehari3hari. Lingkungan agrobiofisik sekitar tanaman salam sangat berpengaruh terhadap pertumbuhan dan produksi daun salam. Iklim, ketersediaan unsur hara tanah, dan topografi daerah tempat tumbuh tanaman salam sangat menentukan kandungan bahan aktif daun salam yang berpotensi sebagai antioksidan. Dalam penelitian ini akan digunakan daun salam dari berbagai daerah dengan lingkungan agrobiofisik yang berbeda, yaitu Sukabumi, Bogor, dan Cianjur.
Masalah dari penelitian ini adalah belum adanya penelitian ilmiah secara yang membuktikan adanya pengaruh lingkungan
agrobiofisik terhadap khasiat antioksidasi dari ekstrak daun tanaman salam (
Wight.) belum dilakukan.
Penelitian ini bertujuan untuk membuktikan khasiat antioksidasi ekstrak daun salam ( Wight.) pada lingkungan agrobiofisik yang berbeda dengan mengukur konsentrasi malondialdehida menggunakan metode asam tiobarbiturat.
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai khasiat antioksidasi tanaman salam (
Wight.) secara in vitro sehingga dapat dijadikan dasar pengembangan tanaman
salam ( Wight.) menjadi
fitofarmaka.
% !"!#
Menurut Tjitrosoepomo (2005), salam yang merupakan salah satu jenis tanaman obat yang tergolong dalam Ordo: Myrtales, Famili: Myrtaceae, Genus: , dan Spesies: Wight. Tanaman ini juga memiliki nama latin lain yaitu
(Wight.) Walp. (Wijayakusuma 1996). Salam memiliki beberapa nama lain di Indonesia yaitu meselangan, ubar serai, gowok, manting, dan kastolam.
Salam dapat tumbuh liar di hutan dan pegunungan, atau ditanam di pekarangan rumah. Tanaman ini dapat ditemukan dari dataran rendah hingga daerah yang ketinggiannya mencapai 1800 meter di atas permukaan laut (Wijayakusuma 1996) bahkan hingga mencapai 2000 meter di atas permukaan laut (PSB 2006). Salam dapat dikembangbiakkan dengan cara stek batang, cangkok, dan biji (Dalimartha 2000).
Bijinya berwarna cokelat dan berbentuk bulat dengan penampang sekitar 1 cm.
Pohon salam memiliki khasiat sebagai tanaman obat terutama daunnya, meskipun demikian kandungan senyawa kimia yang berkhasiat obat terdapat diseluruh bagian tanaman seperti kulit batang, akar dan buah. Salam mengandung zat3zat kimia, seperti minyak atsiri yang terdiri sitral dan eugenol, tanin, dan flavonoida (Wijayakusumah 1996). Selain untuk obat, pohon salam digunakan pula sebagai bahan pewarna barang anyaman terutama kulitnya, sedangkan kayunya dapat digunakan sebagai bahan bangunan (Heyne 1987).
Gambar 1 Salam ( Wight.).
&$ !'( ')* )+ , - &' !.!/ ! !$ - +
Tanaman salam (
Wight.) dapat tumbuh di daerah dataran rendah hingga dataran tinggi dengan curah hujan yang cukup basah. Suhu rata3rata tahunan yang dibutuhkan tanaman salam untuk tumbuh sekitar 18330 ºC dan ketersediaan air yang cukup tinggi yaitu bulan basah > 6 bulan dan bulan kering < 6 bulan. Tekstur tanah yang baik untuk pertumbuhan salam adalah tekstur lempung pasir (
) hingga liat ( ).
Produksi daun tanaman salam sangat tergantung iklim dan sering tidaknya dilakukan pemanenan. Semakin sering pemanenan daun salam maka pertumbuhan batang terhambat sehingga produksi daun salam semakin menurun. Produksi daun salam yang tinggi berada pada lingkungan dengan suhu rata3rata 22–25 ºC, bulan basah sekitar 6–8 bulan, dan bulan kering sekitar 3–4 bulan (PSB 2006). Sedangkan daerah topografinya berada pada ketinggian 800–1000 meter diatas permukaan laut, keberadaan lereng sekitar 15%, dan tekstur tanahnya lempung.
Produksi bahan aktif daun salam sangat tergantung dengan ketersediaan unsur hara tanah dan kondisi terain (lereng dan persentasi batuan permukaan) lokasi tumbuh. Semakin tinggi ketersediaan hara maka semakin tinggi produksi bahan aktif daun salam. Untuk kondisi terain, semakin rendah persentasi lereng dan batuan permukaan maka semakin tinggi produksi bahan aktif daun salam. Persentasi kondisi terain yang ideal untuk produksi bahan aktif daun salam sekitar < 20% untuk kondisi lereng dan < 7% untuk kondisi batuan permukaan.
Dalam penelitian ini digunakan daun salam berasal dari daerah Sukabumi, Bogor, dan Cianjur. Daerah ini dikenal dengan daerah yang dikelilingi oleh gunung di Jawa Barat dan memiliki daerah yang berbukit serta berlereng. Meskipun demikian daerah tersebut berpotensi sebagai tempat tumbuh tanaman salam.
Daerah Sukabumi memiliki tekstur permukaan bergelombang berupa dataran rendah di bagian selatan, sedangkan tekstur permukaan yang berbukit3bukit di bagian tengah dan utara. Sukabumi terletak pada daerah ketinggian antara 032960 meter di atas permukaan laut dengan kemiringan tanah antara 15334%. Jenis tanah yang dimiliki daerah Sukabumi bermacam3macam, antara lain aluvial, andosol, latosol, laterit, regosol, mediteran, podsolik merah kuning, litosol,
renzina, dan . Sukabumi
memiliki iklim basah dengan curah hujan antara 137833597 mm/tahun, suhu udara 183 30 ºC, dan kelembaban 80395%.
Daerah Bogor yang terkenal dengan julukan kota hujan terletak pada daerah ketinggian antara 5003700 meter di atas permukaan laut dengan kemiringan tanah 153 30%. Bogor memiliki berbagai macam jenis tanah, yaitu latosol, litosol, aluvial, dan podsolik merah kekuningan. Bogor termasuk dalam iklim basah dengan curah hujan tertinggi di Jawa Barat antara 291634500 mm/tahun, suhu udara 21.8326 ºC, dan kelembaban kurang lebih 70%.
Daerah Cianjur yang dijuluki sebagai kota beras terletak pada ketinggian antara 032962 meter di atas permukaan laut. Cianjur memiliki daerah yang sebagian besar berupa pegunungan serta berbukit3bukit dan sebagian kecil dataran rendah dengan kemiringan 03 >40%. Cianjur memiliki berbagai macam jenis tanah, yaitu aluvial, andosol,
tanah berglei. Cianjur memiliki iklim basah dengan curah hujan 107–2260 mm/tahun.
!. -!" &*!, &$0&*!* &$0!-& &$0!-&$&$0!-&'! +
Radikal bebas didefinisikan sebagai suatu senyawa kimia yang memiliki atom atau molekul dengan satu atau lebih elektron yang tidak berpasangan (Hernani & Rahardjo 2005). Adanya elektron yang berpasangan membuat molekul menjadi tidak stabil dan bersifat reaktif karena berusaha untuk mendapatkan pasangan elektron (Muhilal 1991).
Radikal bebas memiliki peran dalam berbagai terjadinya penyakit degeneratif. Hal ini disebabkan sifat senyawa radikal bebas yang sangat reaktif sehingga mampu bereaksi dengan makromolekul protein seperti halnya enzim, lipid, karbohidrat, atau DNA yang ada dalam tubuh (Musthafa 2000). Radikal bebas yang berlebihan dapat menimbulkan kerusakan seluler, jaringan, dan genetika (mutasi DNA). Kerusakan seluler dan jaringan tersebut dapat menimbulkan peradangan jaringan dan mendorong terjadinya keganasan (Lautan 1997). Hal tersebut disebabkan adanya efek mutagenik molekul radikal bebas superoksida (O23) yang terbentuk pada saat peradangan. Reaksi antara radikal bebas dengan molekul non radikal akan menghasilkan suatu radikal bebas yang baru dan selanjutnya menimbulkan reaksi berantai. Menurut Sofia (2005), senyawa radikal bebas terbentuk dari dua macam sumber yaitu endogenus dan eksogenus. Pembentukan radikal bebas secara endogenus dapat melalui reaksi autoksidasi, oksidasi enzimatik, fagositosis dalam respirasi, transpor elektron di mitokondria, dan oksidasi ion3ion logam transisi dalam tubuh. Sedangkan pembentukan radikal bebas secara eksogenus akibat bahan kimia yang bersifat karsinogenik, radiasi sinar UV, sinar X, dan sinar gamma.
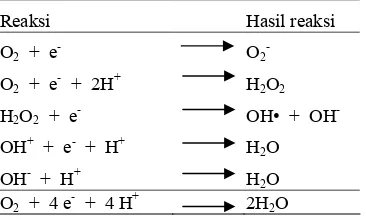
Radikal bebas yang terbentuk secara endogenus dapat berasal dari metabolisme normal tubuh. Salah satu contohnya proses reduksi molekul oksigen dalam rangkaian transport elektron pada rantai respirasi mitokondria. Oksigen dimetabolisme menjadi H2O dengan penambahan 4 elektron melalui beberapa tahapan reaksi (Siregar 1992). Reaksi molekul oksigen dengan elektron pertama akan membentuk anion radikal superoksida (O23), kemudian anion radikal superoksida direaksikan dengan elektron kedua dan dua atom hidrogen menghasilkan
hidrogen peroksida (H2O2). Penambahan elektron ketiga pada molekul hidrogen peroksida akan memicu pembentukan radikal hidroksil (OH•). Molekul H2O akan terbentuk melalui reaksi radikal hidroksil dengan elektron keempat dan sebuah atom hidrogen (Tabel 1).
Radikal bebas juga dapat dihasilkan dari berbagai proses kimia atau enzimatik dalam metabolisme tubuh yang melibatkan senyawa organik maupun inorganik seperti Fe. Radikal hidroksil (OH•) dapat terbentuk melalui reaksi nonenzimatik dari senyawa hidroperoksida (H2O2) yang dikatalisis oleh ion Fe2+, kemudian Fe2+ akan dioksidasi menjadi Fe3+ sehingga reaksi ini dikenal sebagai reaksi Fenton. Selain melalui reaksi Fenton, Radikal hidroksil (OH•) juga dapat terbentuk melalui reaksi Haber3Weiss dengan menggunakan radikal superoksida (O23) dan hidroperoksida (H2O2) sebagai substrat yang dikatalisis oleh besi, sesuai dengan reaksi sebagai berikut:
H2O2+ Fe2+ Fe3++ OH3+ OH• H2O2+ O23 O2+ OH3+ OH• Reaksi ini terjadi secara berantai dan terus menerus sampai ada molekul yang memberikan elektron yang dibutuhkan radikal bebas atau dapat berakhir bila dua buah gugus radikal bebas saling berinteraksi membentuk ikatan non radikal (Murray 2003).
Jenis radikal bebas yang berperan dalam berbagai reaksi3reaksi destruktif pada tubuh manusia adalah spesies oksigen reaktif. Senyawa yang termasuk dalam spesies oksigen reaktif yang dapat ditemukan dalam tubuh yaitu peroksida lipid (LOOH), Hidrogen peroksida (H2O2), singlet oksigen (IO2), ion hipoklorit (OCl3), radikal bebas superoksida (O23), radikal bebas hidroksil (OH+), radikal bebas alkoksi (RO•), dan radikal peroksil (ROO•) (Lautan 1997). Menurut peneliti lainnya ROS mempunyai peranan penting dalam patofisiologi manusia seperti kanker, kardiovaskuler, dan penyakit neurodegeneratif seperti dan
(Tuminah 2000).
Tabel 1 Reaksi pembentukan molekul H2O
Reaksi Hasil reaksi
O2 + e3 O23
O2 + e3 + 2H+ H2O2
H2O2 + e3 OH• + OH3
OH+ + e3 + H+ H2O
OH3 + H+ H2O
(ROS) terbentuk dari reaksi pembentukan energi yang tidak sempurna pada mitokondria. Molekul oksigen dan glukosa yang masuk dalam mitokondria diubah menjadi energi dan ROS. Reaktifitas ROS dapat distabilkan oleh enzim superoksida dismutase membentuk senyawa hidrogen peroksida, kemudian senyawa tersebut dinetralkan menjadi air dan oksigen oleh enzim katalase. Namun, konsentrasi ROS yang tinggi dalam tubuh akan menyerang sel lain seperti sel syaraf motorik (Gambar 2).
Gambar 2 Reaksi pembentukan (ROS).
! !/!$ &!-, &')-, .!, / . Peroksidasi lipid adalah reaksi yang terjadi antara radikal bebas dengan asam lemak tak
jenuh ganda ( ,
PUFA) pada membran sel yang sedikitnya mengandung tiga ikatan rangkap. Radikal bebas bersifat sangat reaktif jika bereaksi dengan PUFA sehingga akan menghasilkan radikal lipid bebas (R•). Apabila radikal lipid bebas bereaksi dengan O2 akan terbentuk radikal peroksi lipid (ROO•) yang dapat menghasilkan endoperoksida lipid atau lipid peroksida. Reaksi ini terjadi secara berantai dan terus menerus karena menghasilkan radikal lipid bebas (R•) lain yang menyebabkan peroksidasi lebih lanjut (Gambar 3). Peroksidasi lipid juga dikatalisis secara oleh senyawa heme dan enzim lipoksigenase yang ditemukan di dalam trombosit serta leukosit (Murray 2003).
Reaksi peroksidasi lipid dimulai dengan tahapan inisiasi yaitu pemisahan sebuah atom hidrogen oleh radikal bebas dari suatu grup metilena (3CH23) PUFA. Reaksi ini menghasilkan pembentukan suatu radikal karbon (3•CH3) pada PUFA. Radikal karbon distabilkan melalui suatu pengaturan ulang ikatan rangkap yang menghasilkan pembentukan diena terkonjugasi. Pada tahap propagasi, radikal peroksida lipid dapat juga menghilangkan sebuah atom hidrogen dari
molekul lipid lainnya yang berdekatan untuk membentuk hidroperoksida lipid dan juga membentuk radikal karbon lain sehingga reaksi peroksidasi lipid akan terjadi secara terus menerus. Tahap terminasi akan terjadi bila ada reaksi antara radikal bebas sendiri atau adanya senyawa antioksidan. Reaksi peroksidasi secara enzimatik dan nonenzimatik dikatalisis oleh ion logam transisi seperti Fe2+ (Cornwell & Morisaki 1984).
Peroksidasi lipid menghasilkan produk akhir malonaldehida (MDA). Konsentrasi MDA dapat diukur dengan metode asam tiobarbiturat (TBA) karena MDA akan bereaksi dengan asam tiobarbiturat membentuk produk berwarna merah yang diukur pada panjang gelombang 532 nm (Gambar 4). Kadar lipid peroksida dalam tubuh manusia tidak boleh lebih dari 4 nmol/ml. Kelebihan lipid peroksida dalam darah dan hati dapat mengakibatkan berbagai macam penyakit seperti kanker, jantung koroner, , katarak, autoimun, dan penuaan dini (Yagi 1994).
Gambar 3 Reaksi peroksidasi lipid.
&'!$!$ $ )-, .!$ . .!$ &,& ! !$ Kerusakan yang ditimbulkan oleh spesies oksigen reaktif dapat diatasi oleh tubuh sendiri melalui mekanisme pertahan preventif. Sistem pertahanan tubuh ini dilakukan oleh enzim3enzim pembersih ( ), diantaranya superoksida dismutase (SOD), katalase, dan glutation peroksidase (Tuminah 2000). Enzim SOD terdapat hampir semua jaringan terutama pada kompartemen sitosol dan mitokondria yang berfungsi mengubah radikal superoksida (O23•) menjadi H2O2dan O2dengan reaksi sebagai berikut:
Superoksida dismutase
O23 + O23 + 2 H+ H2O2 +
O2
Katalase terdapat pada peroksisom dan sitosol berfungsi untuk menetralkan H2O2menjadi O2 dan H2O. Sedangkan glutation peroksidase terdapat pada sitosol dan mitokondria akan mengkatalisis reaksi antara glutation (GSH) dan H2O2menjadi GSSG dan H2O. Gugus tiol (3SH) pada glutation peroksidase akan bereaksi dengan radikal superoksida sehingga dapat mencegah kerusakan komponen sel lainnya (Siregar 1992). Namun, dalam kondisi tertentu (sakit, stress, polusi, dan radiasi) produksi radikal bebas dapat melebihi kemampuan sistem pertahanan tubuh. Keterbatasan mekanisme tubuh untuk menetralkan reaksi oksidasi telah mendorong penggunaan antioksidan dari luar tubuh.
Antioksidan merupakan senyawa penting dalam menjaga kesehatan tubuh yang berfungsi sebagai penangkap radikal bebas dalam tubuh. Secara khusus, antioksidan diartikan sebagai zat yang dapat menunda atau mencegah terjadinya reaksi oksidasi radikal bebas dalam oksidasi lipid walaupun dengan konsentrasi lebih rendah dibandingkan substrat yang dapat dioksidasi (Trilaksani 2003).
Menurut Murray (2003), antioksidan berdasarkan fungsinya dibedakan menjadi dua macam, yaitu antioksidan pencegah dan antioksidan pemutus rantai. Antioksidan pencegah berfungsi mengurangi inisiasi rantai oksidasi seperti katalase dan peroksidase yang bereaksi dengan hidroperoksida lipid (ROOH), transferin dan feritin yang mencegah pembentukan Fe2+ bebas, serta seruplasmin dan albumin yang mencegah pembentukan Cu+ bebas. Antioksidan pemutus rantai bekerja dengan mempengaruhi
tahap propagasi pada pembentukan radikal bebas seperti vitamin E, fenol, dan amina aromatik yang berfungsi menangkap radikal peroksi (ROO•) dan radikal alkoksi (RO•). Contoh lainnya antara lain vitamin A dan vitamin C.
Berdasarkan mekanisme kerjanya, senyawa antioksidan terbagi menjadi tiga macam yaitu antioksidan primer yang bekerja untuk mengurangi pembentukan radikal bebas dengan memutuskan reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Senyawa yang termasuk antioksidan primer diantaranya superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan sekunder berperan mengikat senyawa radikal bebas dan mencegah amplifikasi radikal. Antioksidan sekunder terdiri atas vitamin A, vitamin C, vitamin B, vitamin E, β3karoten, dan senyawa3senyawa fitokimia. Sedangkan antioksidan tersier berperan sebagai mekanisme biomolekuler, seperti enzim perbaikan DNA dan metionin sulfoksida reduktase (Kartikawati 1999).
&$0!1! $ )-, .!$ "!# Senyawa antioksidan dapat diperoleh dalam berbagai tumbuh3tumbuhan. Beberapa antioksidan alami dapat dihasilkan dari rempah3rempah, tanaman herbal, sayuran dan buah. Namun, herbal tanaman obat mempunyai daya aktivitas antioksidan lebih tinggi dibandingkan dengan buah dan sayuran (Hernani & Rahardjo 2005). Telah banyak penelitian yang menyatakan bahwa perlawanan berbagai macam penyakit degeneratif seperti kanker dapat dilakukan dengan mengkonsumsi sayuran dan buah yang banyak mengandung senyawa antioksidan untuk mengurangi reaksi berantai radikal bebas. Senyawa kimia yang tergolong dalam kelompok antioksidan yang ditemukan pada tanaman, antara lain dari golongan polifenol, flavonoid, vitamin C, vitamin E, dan karotenoid.
Antioksidan dari golongan polifenol sangat mudah larut dalam air dan lemak. Pada umumnya senyawa antioksidan tersebut digunakan untuk mencegah kerusakan akibat reaksi oksidasi pada makanan, kosmetik, farmasi, dan plastik. Senyawa polifenol memiliki fungsi sebagai penangkap dan pengikat radikal bebas dari ion3ion logam yang mengalami kerusakan.
Flavonoid diperkirakan hampir 90 persen sebagai glikosida dan 10 persen sebagai aglikon. Senyawa flavonoid dapat dikelompokkan dalam dalam golongan flavon, flavonol, flavanon, antosianidin, katekin, dan isoflavon (Hernani & Rahardjo 2005). Kuersetin (3,43dihidroksiflavonol) adalah senyawa flavonoid dari golongan flavonol yang terdapat tanaman teh, tomat, apel, kakao, anggur, dan bawang. Keberadaan kuersetin juga telah dibuktikan secara ilmiah pada tanaman salam (PSB 2005). Aktivitas kuersetin dalam menghambat reaksi oksidasi
! (LDL) dapat
ditunjukkan secara in vitro (Sibuea 2004). Aktivitas antioksidan kuersetin dari anggur merah sebanding dengan α3tokoferol dalam menghambat peroksidasi lipid. Isoflavon merupakan sejenis senyawa oestrogen yang mempunyai aktivitas antioksidan yang cukup tinggi karena telah terbukti bahwa senyawa ini dapat mengurangi resiko terhadap penyakit kanker, jantung koroner, dan osteoporosis.
Vitamin C adalah suatu senyawa asam L3 askorbat (23ketoglukonolakton) yang memiliki multifungsi. Vitamin C dapat berfungsi sebagai antioksidan, proantioksidan, pengikat logam, pereduksi, dan penangkap oksigen. Vitamin E merupakan vitamin yang larut dalam lemak dan memiliki kemampuan sebagai antioksidan yang cukup kuat. Vitamin E berfungsi untuk memproteksi sel3sel membran serta LDL kolesterol dari reaksi oksidasi (Tuminah 1999), membantu memperlambat penuaan, dan melindungi tubuh dari kerusakan sel yang dapat menimbulkan penyakit kanker.
Karotenoid adalah molekul3molekul yang dapat memberikan warna3warna terang pada tanaman, buah3buahan, dan sayuran. Senyawa yang tergolong karotenoid antara lain α3 karoten, β3karoten, likopen, lutein, zeaksantin, dan β3kriptoksantin (Tuminah 1999). Senyawa karotenoid dapat mengurangi resiko terkena penyakit kanker. Zat antioksidan alami lainnya adalah saponin dari turunan glikosida yang berikatan dapat menurunkan kolesterol dalam darah dan menghambat penyakit kanker (Hernani & Rahardjo 2005).
&-$ - &$&$ (!$ ) &$, $ )-, .!$ Pengujian potensi antioksidan dapat dilakukan dengan beberapa cara, antara lain:
metode oksigen aktif ( ,
AOM), metode asam tiobarbiturat (23 , TBA), metode tiosianat,
metode bilangan ansidin, dan metode Kreis (Santoso 2002).
Metode oksigen aktif merupakan metode untuk mengukur nilai peroksida yang dihasilkan dari oksidasi asam lemak tak jenuh dalam kondisi jenuh udara pada suhu 98ºC. Metode TBA untuk mengukur produk oksidasi asam linoleat (malondialdehida) yang akan bereaksi dengan asam tiobarbiturat menghasilkan produk berwarna merah yang diukur pada λ 532 nm. Metode tiosianat untuk mengukur peroksida yang akan membentuk kompleks warna Fe[Fe(SCN)6]. Metode bilangan ansidin untuk mengukur senyawa aldehid hasil oksidasi yang bereaksi dengan p3 ansidin. Sedangkan metode Kreis untuk mengukur hasil oksidasi lemak yang akan bereaksi dengan fluoroglusinol.
Uji potensi antioksidan yang digunakan adalah metode TBA. Alasan penggunaan metode TBA dalam penelitian ini antara lain: metode TBA merupakan cara analisis antioksidan yang telah lama digunakan untuk mengukur peroksidasi asam lemak pada membran sel dan makanan, pereaksi TBA memiliki sifat sensitif terhadap peroksida lipid, serta reaksi yang ditimbulkan antara malondialdehida dengan asam tiobarbiturat menghasilkan produk yang sama dengan reaksi yang ditimbulkan antara lipid peroksida dengan asam tiobarbiturat (Yagi 1994).
Uji potensi antioksidan dilakukan setelah pengukuran hidroperoksida yang merupakan produk primer oksidasi asam linoleat dengan metode tiosianat. Pengukuran hidroperoksida bertujuan untuk menentukan waktu inkubasi asam linoleat. Menurut Kikuzaki dan Nobuji (1993), pengukuran potensi antioksidan dengan metode TBA lebih baik dilakukan setelah satu atau beberapa hari dari puncak absorbansi asam linoleat. Hal ini dilakukan karena hidroperoksida akan mengalami dekomposisi membentuk malondialdehida.
& ).& &$! &'-)$2( !,
Menurut Shahidi & Wanasundara (1997) metode diena terkonjugasi dapat digunakan sebagai indeks kestabilan lipid menggantikan bilangan peroksida karena lebih cepat daripada penentuan bilangan peroksida, jauh lebih sederhana, tidak tergantung dari reaksi kimia atau perubahan warna, dan membutuhkan sampel dalam ukuran yang lebih kecil (Tensiska 2001). Metode ini prinsipnya adalah mengukur hidroperoksida diena terkonjugasi yang terdapat dalam emulsi (o/w) 10%. Hasil analisis diena terkonjugasi dinyatakan dalam mmol hidroperoksida/kg minyak.
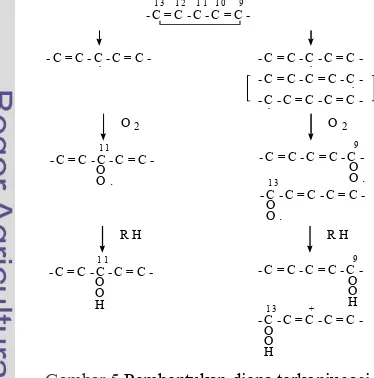
Kebanyakan metode diena terkonjugasi digunakan pada minyak yang benyak mengandung asam linoleat atau asam lemak tidak jenuh lainnya. Struktur 1,43pentadiena di dalam linoleat membuatnya menjadi sangat mudah mengalami oksidasi. Bahkan 20 kali lebih mudah teroksidasi daripada struktur propena pada oleat (Fennema 1996, dalam Krisnayunita 2002). Grup metil pada posisi 11 menjadi sangat reaktif karena diapit oleh dua ikatan rangkap dua (Gambar 5).
Perpindahan posisi atom hidrogen menghasilkan sebuah
, yang pada reaksi dengan molekul oksigen menghasilkan campuran yang seimbang dari 93 dan 133 diena hidroperoksida terkonjugasi. Bukti3bukti yang ada selama ini mengindikasikan bahwa 93 dan 133cis, trans3hidroperoksida mengalami interkonversi, dengan adanya isomerasi geometris, membentuk trans, trans3isomer. Walaupun demikian, masing3masing hidroperoksida (93 dan 133) ditemukan dalam bentuk cis3trans maupun dalam bentuk trans3 trans.
3 C = C 3 C 3 C = C 3
3 C = C 3 C 3 C = C 3 3 C = C 3 C 3 C = C 3 3 C = C 3 C = C 3 C 3 3 C 3 C = C 3 C = C 3
O2
O2
3 C = C 3 C = C 3 C 3 3 C = C 3 C 3 C = C 3
O 3 C 3 C = C 3 C = C 3
O
R H R H
3 C = C 3 C = C 3 C 3 3 C = C 3 C 3 C = C 3
O O
H H
3 C 3 C = C 3 C = C 3 O
O H 1 3 1 2 1 1 1 0 9
1 1 O . 9 O . 1 3 O .
1 1 9
1 3 + O
O O
Gambar 5Pembentukan diena terkonjugasi pada asam lemak linoleat.
! !$ .!$ "!
Bahan3bahan yang akan digunakan yaitu daun salam diperoleh dari Pusat Studi Biofarmaka–Institut Pertanian Bogor, akuades, etanol 70% (v/v), kloroform, amoniak, H2SO4 pekat, pereaksi Dragendorf, pereaksi Meyer, pereaksi Wagner, metanol 30%, NaOH 10% (b/v), eter, pereaksi Lieberman Burchard, etanol 75%, tetrametoksipropana (TMP), TBA 1% (b/v) dalam asam asetat 50%, asam trikloro asetat (TCA) 20%, asam linoleat 50 mM dalam etanol 99.8%, bufer fosfat 0.1 M pH 7, dan α3 tokoferol.
Peralatan yang diperlukan yaitu refluks, , oven, spektrofotometer UV, penangas air, dan sentrifus.
& ).& &$&" !$
Tahapan penelitian yang telah dilakukan antara lain ekstraksi senyawa aktif daun salam, analisis fitokimia, analisis hidroperoksida dari oksidasi asam linoleat menggunakan metode diena terkonjugasi, penentuan konsentrasi optimum potensi antioksidan menggunakan metode TBA, dan analisis konsentrasi MDA (Malondialdehida) dengan metode TBA.
-, '!-, !($ !"!#
Serbuk kering daun salam dari kota Bogor, Cianjur, dan Sukabumi diekstrak dengan pelarut organik etanol. Alkohol adalah pelarut serba guna yang baik untuk ekstraksi pendahuluan. Etanol 70% merupakan pelarut yang sering digunakan untuk ekstraksi karena mampu menghasilkan bahan aktif tanaman yang optimal dan jumlah pengotor yang ikut dalam larutan pengekstraksi sangat kecil (Harbone 1987).
Serbuk kering daun salam diekstraksi dengan metode refluks. Serbuk kering daun salam sebanyak 20 gram diekstraksi dengan 200 mL pelarut etanol 70% selama 2 jam pada suhu 70 ºC menggunakan refluks. Ekstrak yang diperoleh kemudian disaring dengan kertas saring. Ekstrak yang telah disaring diuapkan dengan
pada suhu 50 ºC dan dioven pada suhu 40 ºC maka diperoleh ekstrak kasar.
Menurut Shahidi & Wanasundara (1997) metode diena terkonjugasi dapat digunakan sebagai indeks kestabilan lipid menggantikan bilangan peroksida karena lebih cepat daripada penentuan bilangan peroksida, jauh lebih sederhana, tidak tergantung dari reaksi kimia atau perubahan warna, dan membutuhkan sampel dalam ukuran yang lebih kecil (Tensiska 2001). Metode ini prinsipnya adalah mengukur hidroperoksida diena terkonjugasi yang terdapat dalam emulsi (o/w) 10%. Hasil analisis diena terkonjugasi dinyatakan dalam mmol hidroperoksida/kg minyak.
Kebanyakan metode diena terkonjugasi digunakan pada minyak yang benyak mengandung asam linoleat atau asam lemak tidak jenuh lainnya. Struktur 1,43pentadiena di dalam linoleat membuatnya menjadi sangat mudah mengalami oksidasi. Bahkan 20 kali lebih mudah teroksidasi daripada struktur propena pada oleat (Fennema 1996, dalam Krisnayunita 2002). Grup metil pada posisi 11 menjadi sangat reaktif karena diapit oleh dua ikatan rangkap dua (Gambar 5).
Perpindahan posisi atom hidrogen menghasilkan sebuah
, yang pada reaksi dengan molekul oksigen menghasilkan campuran yang seimbang dari 93 dan 133 diena hidroperoksida terkonjugasi. Bukti3bukti yang ada selama ini mengindikasikan bahwa 93 dan 133cis, trans3hidroperoksida mengalami interkonversi, dengan adanya isomerasi geometris, membentuk trans, trans3isomer. Walaupun demikian, masing3masing hidroperoksida (93 dan 133) ditemukan dalam bentuk cis3trans maupun dalam bentuk trans3 trans.
3 C = C 3 C 3 C = C 3
3 C = C 3 C 3 C = C 3 3 C = C 3 C 3 C = C 3 3 C = C 3 C = C 3 C 3 3 C 3 C = C 3 C = C 3
O2
O2
3 C = C 3 C = C 3 C 3 3 C = C 3 C 3 C = C 3
O 3 C 3 C = C 3 C = C 3
O
R H R H
3 C = C 3 C = C 3 C 3 3 C = C 3 C 3 C = C 3
O O
H H
3 C 3 C = C 3 C = C 3 O
O H 1 3 1 2 1 1 1 0 9
1 1 O . 9 O . 1 3 O .
1 1 9
1 3 + O
O O
Gambar 5Pembentukan diena terkonjugasi pada asam lemak linoleat.
! !$ .!$ "!
Bahan3bahan yang akan digunakan yaitu daun salam diperoleh dari Pusat Studi Biofarmaka–Institut Pertanian Bogor, akuades, etanol 70% (v/v), kloroform, amoniak, H2SO4 pekat, pereaksi Dragendorf, pereaksi Meyer, pereaksi Wagner, metanol 30%, NaOH 10% (b/v), eter, pereaksi Lieberman Burchard, etanol 75%, tetrametoksipropana (TMP), TBA 1% (b/v) dalam asam asetat 50%, asam trikloro asetat (TCA) 20%, asam linoleat 50 mM dalam etanol 99.8%, bufer fosfat 0.1 M pH 7, dan α3 tokoferol.
Peralatan yang diperlukan yaitu refluks, , oven, spektrofotometer UV, penangas air, dan sentrifus.
& ).& &$&" !$
Tahapan penelitian yang telah dilakukan antara lain ekstraksi senyawa aktif daun salam, analisis fitokimia, analisis hidroperoksida dari oksidasi asam linoleat menggunakan metode diena terkonjugasi, penentuan konsentrasi optimum potensi antioksidan menggunakan metode TBA, dan analisis konsentrasi MDA (Malondialdehida) dengan metode TBA.
-, '!-, !($ !"!#
Serbuk kering daun salam dari kota Bogor, Cianjur, dan Sukabumi diekstrak dengan pelarut organik etanol. Alkohol adalah pelarut serba guna yang baik untuk ekstraksi pendahuluan. Etanol 70% merupakan pelarut yang sering digunakan untuk ekstraksi karena mampu menghasilkan bahan aktif tanaman yang optimal dan jumlah pengotor yang ikut dalam larutan pengekstraksi sangat kecil (Harbone 1987).
Serbuk kering daun salam diekstraksi dengan metode refluks. Serbuk kering daun salam sebanyak 20 gram diekstraksi dengan 200 mL pelarut etanol 70% selama 2 jam pada suhu 70 ºC menggunakan refluks. Ekstrak yang diperoleh kemudian disaring dengan kertas saring. Ekstrak yang telah disaring diuapkan dengan
pada suhu 50 ºC dan dioven pada suhu 40 ºC maka diperoleh ekstrak kasar.
diasamkan dengan 10 tetes H2SO42 M. Fraksi H2SO4 diambil, kemudian ditambahkan pereaksi Dragendorf, Meyer, dan Wagner. Keberadaan alkaloid ditandai dengan terbentuknya endapan putih pada pereaksi Meyer, endapan merah pada pereaksi Dragendorf, dan endapan coklat pada pereaksi Wagner. Sebagai pembanding digunakan daun tapak dara.
2 !/)$ $ 0.1 gram hasil ekstraksi ditambahkan 2 mL air dan dipanaskan selama lima menit. Larutan tersebut didinginkan kemudian dikocok hingga timbul busa sampai selang waktu 10 menit menunjukkan keberadaan saponin. Sebagai pembanding digunakan buah klerak.
2 "!6)$) . .!$ &$0!1! &$)" - 0.1 gram hasil ekstraksi ditambah 2 mL metanol 30% sampai terendam lalu dipanaskan. Filtratnya ditambah 1 tetes NaOH 10% (b/v) atau H2SO4pekat. Terbentuknya warna merah karena penambahan NaOH 10% (b/v) menunjukkan keberadaan senyawa fenolik hidrokuinon, sedangkan warna merah yang terbentuk karena penambahan H2SO4 pekat menunjukkan keberadaan senyawa flavonoid. Sebagai pembanding digunakan buah pinang.
2 ' &'/&$) . .!$ &') . 0.1 gram hasil ekstraksi ditambah 2 mL etanol 30% lalu dipanaskan dan disaring. Filtratnya diuapkan lalu ditambahkan eter. Lapisan eter ditambahakan pereaksi Lieberman Burchard (3 tetes asam asetat anhidrida dan 1 tetes H2SO4 pekat). Warna merah atau ungu menunjukkan kandungan triterpenoid, sedangkan warna hijau menunjukkan kandungan steroid. Sebagai pembanding steroid digunakan som jawa.
2 !$ $ 0.1 gram hasil ekstraksi ditambahkan 2 mL air kemudian dididihkan selama beberapa menit. Larutan tersebut disaring dan filtratnya ditambah FeCl3 1% (b/v). Warna biru tua atau hitam kehijauan menunjukkan keberadaan tanin. Sebagai pembanding digunakan teh.
!$7!$ !$ &$&" !$
Penelitian ini terdiri atas lima kelompok dengan ulangan masing3masing kelompok sebanyak tiga kali, yaitu kelompok I sebagai kontrol tanpa perlakuan ekstrak daun salam, kelompok II sebagai kontrol pembanding dengan, kelompok III sebagai sampel daun salam kota Sukabumi, kelompok IV sebagai sampel daun salam kota Bogor, kelompok V sebagai sampel daun salam kota Cianjur.
Kelompok I merupakan kontrol tanpa perlakuan ekstrak daun salam yang
menggunakan air bebas ion sebagai pengganti larutan uji. Kelompok II merupakan kontrol pembanding yang menggunakan vitamin E sebagai pengganti larutan uji. Kelompok III, IV, dan V merupakan sampel ekstrak etanol 70% daun salam dengan konsentrasi berdasarkan hasil penentuan konsentrasi optimum potensi antioksidan. Masing3masing kelompok diinkubasi dengan lama inkubasi berdasarkan hasil pengukuran hidroperoksida dari asam linoleat. Pengukuran potensi antioksidan ekstrak daun salam dilakukan dengan metode TBA lebih baik dilakukan setelah satu atau beberapa hari dari puncak absorbansi asam linoleat.
$!" , , .')/&')-, .! .!' -, .!, ,!# $)"&! & ).& &$! &'-)$2( !, , &'*!(&' 34548 . !7( .!"!# ! &'
9
Analisis hidroperoksida dilakukan dengan menggunakan 2 mL Bufer fosfat 0.1 M pH 7, 2 mL asam linoleat 50 mM dalam etanol 99.8%, dan 1 mL air bebas ion diletakkan ke dalam botol gelap yang berulir, kemudian campuran diinkubasi pada suhu 40 ºC. Lama inkubasi ditentukan setelah tercapainya absorbansi maksimum.
Campuran sampel tersebut diambil 50 VL ke dalam 6 mL etanol 75%, kemudian Absorbansidiena terkonjugasi sampel diukur langsung menggunakan spektrofotometer sinar UV pada panjang gelombang 234 nm.
Analisis hidroperoksida diukur setiap hari sampai tercapai absorbansi maksimum.
&$&$ (!$ )$,&$ '!, / #(# ) &$, $ )-, .!$ & ).&
Penentuan konsentrasi optimum dari ekstrak daun salam dilakukan dua tahap dengan menggunakan berbagai seri konsentrasi. Pada tahap pertama menggunakan kisaran konsentrasi 50, 100, 200, 500, dan 1000 ppm. Untuk tahap kedua menggunakan kisaran konsentrasi 500, 1000, 1500, dan 2000 ppm. Analisis konsentrasi ini dilakukan dengan metode TBA. Campuran sampel penemtuan konsentrasi optimum ini terdiri atas 2 mL bufer fosfat 0.1 M pH 7, 2 mL asam linoleat 50 mM dalam etanol 99.8%, dan 1 mL larutan uji dari masing3masing seri konsentrasi.
$!" , , )$,&$ '!, !")$. !".& .! .&$ !$ & ).& -(:!-3449
mL larutan uji. Campuran kontrol tanpa perlakuan dibuat sama seperti campuran sampel tetapi 1 mL larutan uji diganti dengan 1 mL air bebas ion. Campuran pembanding yang dibuat terdiri atas 2 mL bufer fosfat 0.1 M pH 7, 2 mL asam linoleat 50 mM dalam etanol 99.8% yang mengandung α3tokoferol (vitamin E 200 ppm), dan 1 mL air bebas ion.
Semua campuran tersebut diinkubasi dalam penangas air yang bersuhu 40ºC dengan lama inkubasi berdasarkan hasil pengukuran hidroperoksida dari asam linoleat. Campuran reaksi tersebut diuji potensi antioksidannya setelah satu atau beberapa hari dari puncak absorbansi asam linoleat. Masing3masing campuran reaksi diambil 1 mL lalu ditambahkan 2 mL TCA 20% dan 2 mL larutan TBA 1% (b/v) dalam asam asetat 50%. Kemudian campuran reaksi tersebut ditempatkan pada penangas air yang bersuhu 100 ºC selama 10 menit. Setelah itu didinginkan dan dilakukan sentrifugasi dengan kecepatan 3000 rpm selama 15 menit, selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 532 nm.
Sebagai kurva standar, larutan stok pereaksi 1,1,3,33tetrametoksipropana (TMP) konsentrasi 6 M dibuat menjadi 1.5, 3, 6, 9, 12, 15, dan 18 VM. Masing3masing konsentrasi dipipet sebanyak 1 mL lalu ditambahkan 2 mL TCA 20% dan 2 mL TBA 1%(b/v) dalam asam asetat 50% (v/v). Kemudian semua tabung diinkubasi pada suhu 100 ºC selama 10 menit dan didinginkan pada suhu kamar. Setelah dingin dilakukan sentrifugasi dengan kecepatan 3000 rpm selam 15 menit selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 532 nm.
!, " -, '!-,
Daun salam yang diekstraksi diperoleh dalam bentuk simplisia berupa serbuk yang berwarna coklat. Daun salam yang digunakan berasal dari kota Bogor, Sukabumi, dan Cianjur. Ekstraksi daun salam tersebut dilakukan pengulangan sebanyak dua kali. Daun salam yang berasal dari ketiga kota tersebut diekstraksi sebanyak tiga kali selama 6 jam menggunakan pelarut etanol teknis 70% dengan metode refluks. Penggunaan etanol sebagai pelarut untuk ekstraksi bertujuan untuk mengekstrak senyawa3senyawa bioaktif yang bersifat polar dan semi3polar.
Ekstrak yang diperoleh berwarna coklat tua dengan aroma khas salam. Rendemen yang diperoleh dari salam kota Bogor, Sukabumi, dan Cianjur berturut3turut sebesar 18.45%, 11.55%, dan 8.06%. Nilai rendemen yang diperoleh ini jauh lebih rendah dibandingkan dengan nilai rendemen ekstrak daun dewa yaitu 25.71% (Eridani 2006). Perbedaan ini dapat disebabkan hasil ekstrak daun salam berupa serbuk sehingga bobot yang diperoleh menjadi lebih ringan.
Berdasarkan hasil ekstraksi dapat diketahui bahwa rendemen daun salam kota Bogor lebih tinggi daripada salam kota Sukabumi dan Cianjur. Hal ini dikarenakan lingkungan agrobiofisik kota Bogor sesuai dengan persyaratan tumbuh tanaman salam. Persyaratan tersebut meliputi iklim dengan bulan basah antara 638 bulan, ketinggian tempat 032000 meter di atas ppermukaan laut, tekstur tanah yang lempung, keadaan lereng 15%, dan ketersediaan hara tinggi. Keadaan ini sesuai dengan laporan penelitian PSB (2006) yang menyatakan lahan kota bogor termasuk kategori sesuai untuk tanaman salam, sedangkan kota Sukabumi dan Cianjur termasuk dalam kategori agak sesuai untuk tanaman salam. Hal ini sesuai dengan hasil penelitian Hanan (1999) yang menyatakan bahwa aroma dari satu jenis tumbuhan yang sama bisa berbeda karena dipengaruhi iklim, keadaan tanah, sinar matahari dan cara pengolahan.
Perbedaan rendemen ekstraksi dapat menunjukkan kandungan senyawa3senyawa metabolit sekunder daun salam ketiga kota tersebut berbeda3beda. Hal ini sesuai dengan hasil penelitian sebelumnya bahwa daun salam kota Sukabumi memiliki kandungan kuersetin sebesar 0.3% dan kota Cianjur sebesar 0.725% (PSB 2006).
mL larutan uji. Campuran kontrol tanpa perlakuan dibuat sama seperti campuran sampel tetapi 1 mL larutan uji diganti dengan 1 mL air bebas ion. Campuran pembanding yang dibuat terdiri atas 2 mL bufer fosfat 0.1 M pH 7, 2 mL asam linoleat 50 mM dalam etanol 99.8% yang mengandung α3tokoferol (vitamin E 200 ppm), dan 1 mL air bebas ion.
Semua campuran tersebut diinkubasi dalam penangas air yang bersuhu 40ºC dengan lama inkubasi berdasarkan hasil pengukuran hidroperoksida dari asam linoleat. Campuran reaksi tersebut diuji potensi antioksidannya setelah satu atau beberapa hari dari puncak absorbansi asam linoleat. Masing3masing campuran reaksi diambil 1 mL lalu ditambahkan 2 mL TCA 20% dan 2 mL larutan TBA 1% (b/v) dalam asam asetat 50%. Kemudian campuran reaksi tersebut ditempatkan pada penangas air yang bersuhu 100 ºC selama 10 menit. Setelah itu didinginkan dan dilakukan sentrifugasi dengan kecepatan 3000 rpm selama 15 menit, selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 532 nm.
Sebagai kurva standar, larutan stok pereaksi 1,1,3,33tetrametoksipropana (TMP) konsentrasi 6 M dibuat menjadi 1.5, 3, 6, 9, 12, 15, dan 18 VM. Masing3masing konsentrasi dipipet sebanyak 1 mL lalu ditambahkan 2 mL TCA 20% dan 2 mL TBA 1%(b/v) dalam asam asetat 50% (v/v). Kemudian semua tabung diinkubasi pada suhu 100 ºC selama 10 menit dan didinginkan pada suhu kamar. Setelah dingin dilakukan sentrifugasi dengan kecepatan 3000 rpm selam 15 menit selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 532 nm.
!, " -, '!-,
Daun salam yang diekstraksi diperoleh dalam bentuk simplisia berupa serbuk yang berwarna coklat. Daun salam yang digunakan berasal dari kota Bogor, Sukabumi, dan Cianjur. Ekstraksi daun salam tersebut dilakukan pengulangan sebanyak dua kali. Daun salam yang berasal dari ketiga kota tersebut diekstraksi sebanyak tiga kali selama 6 jam menggunakan pelarut etanol teknis 70% dengan metode refluks. Penggunaan etanol sebagai pelarut untuk ekstraksi bertujuan untuk mengekstrak senyawa3senyawa bioaktif yang bersifat polar dan semi3polar.
Ekstrak yang diperoleh berwarna coklat tua dengan aroma khas salam. Rendemen yang diperoleh dari salam kota Bogor, Sukabumi, dan Cianjur berturut3turut sebesar 18.45%, 11.55%, dan 8.06%. Nilai rendemen yang diperoleh ini jauh lebih rendah dibandingkan dengan nilai rendemen ekstrak daun dewa yaitu 25.71% (Eridani 2006). Perbedaan ini dapat disebabkan hasil ekstrak daun salam berupa serbuk sehingga bobot yang diperoleh menjadi lebih ringan.
Berdasarkan hasil ekstraksi dapat diketahui bahwa rendemen daun salam kota Bogor lebih tinggi daripada salam kota Sukabumi dan Cianjur. Hal ini dikarenakan lingkungan agrobiofisik kota Bogor sesuai dengan persyaratan tumbuh tanaman salam. Persyaratan tersebut meliputi iklim dengan bulan basah antara 638 bulan, ketinggian tempat 032000 meter di atas ppermukaan laut, tekstur tanah yang lempung, keadaan lereng 15%, dan ketersediaan hara tinggi. Keadaan ini sesuai dengan laporan penelitian PSB (2006) yang menyatakan lahan kota bogor termasuk kategori sesuai untuk tanaman salam, sedangkan kota Sukabumi dan Cianjur termasuk dalam kategori agak sesuai untuk tanaman salam. Hal ini sesuai dengan hasil penelitian Hanan (1999) yang menyatakan bahwa aroma dari satu jenis tumbuhan yang sama bisa berbeda karena dipengaruhi iklim, keadaan tanah, sinar matahari dan cara pengolahan.
Perbedaan rendemen ekstraksi dapat menunjukkan kandungan senyawa3senyawa metabolit sekunder daun salam ketiga kota tersebut berbeda3beda. Hal ini sesuai dengan hasil penelitian sebelumnya bahwa daun salam kota Sukabumi memiliki kandungan kuersetin sebesar 0.3% dan kota Cianjur sebesar 0.725% (PSB 2006).
dengan banyaknya busa yang terbentuk saat pengocokan.
Keberadaan senyawa flavonoid pada ekstrak salam ketiga kota tersebut sesuai dengan penelitian Sayekti (1994) yang menyatakan bahwa ekstrak daun salam diduga mengandung saponin, triterpenoid, steroid, flavonoid dan tanin. Ketidakberadaan steroid pada ekstrak salam ketiga kota dapat disebabkan jumlah bahan yang diuji terlalu sedikit yaitu 0.1 gram sehingga senyawa steroid tidak terdeteksi.
Perbedaan kandungan metabolit sekunder pada jenis tanaman yang sama seringkali terjadi dikarenakan adanya pengaruh lingkungan sekitar. Kandungan metabolit yang disekresikan oleh tanaman tergantung pada variasi genetik individual dan kondisi geografis tempat tumbuh (Kardono 2003). Tabel 2 Hasil uji fitokimia ekstrak salam
-, '!- ,!"!# 2 ) )' (-!*(# !$2('
Alkaloid + + +
Saponin ++ + +
Flavonoid + + +
Fenolik + + +
hidrokuinon
Triterpenoid + + +
Steroid 3 3 3
Tanin +++ +++ +++
, &# -, .!, ,!# $)"&! Tujuan dari sistem oksidasi asam linoleat ini adalah untuk menentukan waktu inkubasi maksimum konsentrasi MDA dengan metode diena terkonjugasi. Berdasarkan oksidasi asam linoleat yang dilakukan selama 7 hari diperoleh hasil bahwa pada hari ke33 pembentukan hidroperoksida telah mencapai maksimum (Gambar 6). Oleh karena itu pengukuran konsentrasi malondialdehida (MDA) dilakukan setelah hari ke33 yaitu hari ke35, ketika hidroperoksida telah mengalami dekomposisi membentuk MDA.
Gambar 6 Nilai absorbansi hidroperoksida maksimum terhadap waktu.
-, .!, ,!# $)"&! & ).&
Pengukuran hasil oksidasi asam linoleat dilakukan setelah hari ke33 yaitu pada hari ke3 5 ketika semua hidroperoksida telah mengalami dekomposisi membentuk MDA. Hasil oksidasi asam linoleat ini diukur dengan menggunakan metode TBA yang membentuk kompleks warna TBARS. Oksidasi asam linoleat ini akan dihambat oleh senyawa antioksidan yang telah teruji yaitu vitamin E.
Penambahan vitamin E sebesar 200 ppm mampu menghambat proses oksidasi asam linoleat sebesar 71.22% dengan menekan pembentukan MDA hingga seperlimanya (Gambar 7). Secara statistik konsentrasi MDA pada asam linoleat dengan penambahan vitamin E berbeda nyata terhadap asam linoleat tanpa antioksidan dengan p=0.05. Hal ini sesuai dengan pernyataan bahwa penambahan vitamin E dalam makanan dapat meningkatkan kandungan vitamin E dalam LDL serta meningkatkan perlindungan terhadap proses oksidasi (Karyadi 1997). beberapa ahli kesehatan mengkhawatirkan kadar vitamin E yang berlebih dalam tubuh dapat menyebabkan darah sulit membeku ketika terjadi luka, karena vitamin E berperan sebagai antikoagulan (Tambunan 2005).
Gambar 7 Konsentrasi MDA vitamin E.
) &$, $ )-, .!, -, '!- !($ !"!# ) )'8 (-!*(# 8 .!$ !$2(' //# Pengukuran potensi antioksidasi ekstrak daun salam ketiga kota tersebut akan dibandingkan dengan vitamin E pada konsentrasi yang sama yaitu 200 ppm. Dalam hal ini vitamin E digunakan sebagai pembanding karena vitamin E dipercaya sebagai sumber antioksidan yang mampu menghambat peroksidasi lipid dari asam lemak tak jenuh dalam membran dan mempertahankan kesuburan (Sofia 2006).
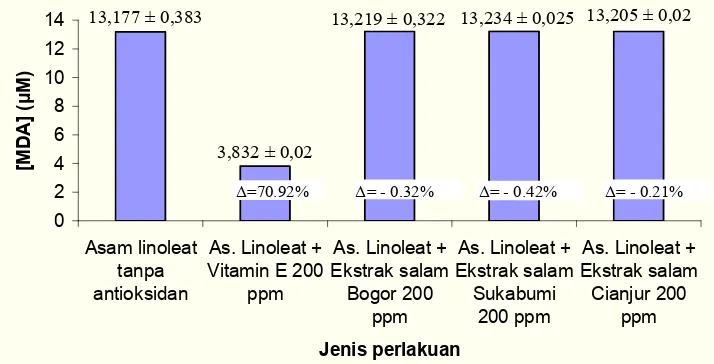
Hasil inkubasi asam linoleat tanpa penambahan ekstrak menghasilkan MDA sebesar 13.18 VM. Asam linoleat dengan penambahan vitamin E sebesar 200 ppm menghasilkan MDA sebesar 3.83 VM. Asam linoleat dengan penambahan ekstrak daun salam Bogor, Sukabumi, dan Cianjur sebesar 200 ppm menghasilkan MDA yang tidak berbeda secara signifikan (Gambar 8). Konsentrasi MDA ekstrak daun salam ketiga kota lebih tinggi dibandingkan dengan vitamin E.
Berdasarkan konsentrasi MDA yang dihasilkan dari lima jenis perlakuan tersebut
maka dapat diketahui potensi antioksidasinya. Potensi antioksidasi vitamin E dengan konsentrasi 200 ppm mampu menghambat proses oksidasi sebesar 70.92%. Ekstrak daun salam Bogor, Sukabumi, dan Cianjur pada konsentrasi 200 ppm tidak menunjukkan sifat antioksidasi. Senyawa bahan alam lain seperti ekstrak mahkota dewa konsentrasi 200 ppm telah mampu menghambat proses oksidasi asam linoleat sebesar 85.75% (Eridani 2006). Oleh karena itu perlu dilakukan uji lebih lanjut untuk mengetahui konsentrasi optimum ekstrak daun salam sebagai antioksidan.
Gambar 8 Konsentrasi MDA ekstrak daun salam ketiga kota 200 ppm dan W = daya hambat oksidasi asam linoleat.
&$&$ (!$ )$,&$ '!, / #(# ) &$, $ )-, .!,
Konsentrasi MDA yang dihasilkan asam linoleat tanpa antioksidan (kontrol negatif) sebesar 13.32 VM. Berdasarkan konsentrasi MDA yang dihasilkan, asam linoleat dengan penambahan ekstrak salam 1000 ppm mampu menghambat pembentukan MDA hingga sepertiga dari konsentrasi MDA asam linoleat tanpa antioksidan (Gambar 9). Pada penambahan ekstrak salam konsentrasi 200 ppm tidak menunjukan potensi antioksidasinya. Hal ini sesuai dengan uji potensi antioksidasi ekstrak daun salam ketiga kota konsentrasi 200 ppm.
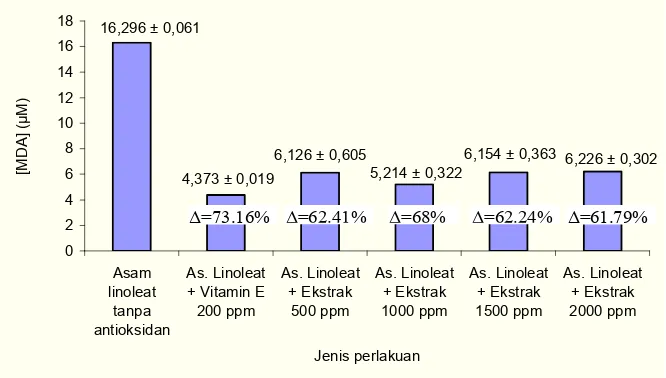
Konsentrasi MDA yang dihasilkan pada kisaran konsentrasi 50–1000 ppm dapat menunjukkan potensi antioksidasinya. Daya hambat oksidasi asam linoleat tertinggi ditunjukkan pada konsentrasi 1000 ppm yaitu sebesar 65.56%. Oleh karena itu untuk lebih
meyakinkan dilakukan penentuan konsentrasi optimum potensi antioksidasi pada konsentrasi diatas 1000 ppm yaitu kisaran konsentrasi 500–2000 ppm.
Intensitas warna yang berbeda3beda dari setiap sampel yang diukur dapat menunjukkan konsentrasi MDA dan potensi antioksidasi. Asam linoleat dengan penambahan vitamin E memiliki konsentrasi MDA jauh lebih rendah dibanding asam linoleat tanpa antioksidan dan penambahan ekstrak daun salam. Ekstrak daun salam 1000 ppm mampu menghambat oksidasi asam linoleat paling tinggi dibanding ekstrak daun salam 500, 1500, dan 2000 ppm (Gambar 10).
Potensi antioksidasi ekstrak daun salam terlihat pada semua seri konsentrasi dengan mampu menghambat proses oksidasi asam linoleat. Meskipun demikian kemampuan menghambat pembentukan MDA yang terbesar terlihat pada konsentrasi ekstrak 1000
13,205 ± 0,02 13,234 ± 0,025
13,219 ± 0,322
3,832 ± 0,02 13,177 ± 0,383
!" #" $ %"
ppm yaitu 68.00%. Hal ini menunjukkan bahwa pemberian konsentrasi ekstrak daun salam diatas 1000 ppm menurunkan potensi antioksidasinya. Oleh karena itu untuk
membandingkan potensi antioksidasi daun salam dari ketiga kota tersebut menggunakan konsentrasi 1000 ppm.
13,319 ± 0,181
12,421 ± 4,432
9,473 ± 3,082
13,917 ± 2,599
8,604 ± 0,645
4,587 ± 0,001
0 2 4 6 8 10 12 14 16 Asam linoleat tanpa antioksidan As. Linoleat + Ekstrak 50
ppm As. Linoleat + Ekstrak 100 ppm As. Linoleat + Ekstrak 200 ppm As. Linoleat + Ekstrak 500 ppm As. Linoleat + Ekstrak 1000 ppm Jenis perlakuan [M D A ] (V M )
Gambar 9 Konsentrasi MDA ekstrak salam pada penentuan konsentrasi optimum I dan W = daya hambat oksidasi asam linoleat.
Gambar 10 Konsentrasi MDA ekstrak salam pada penentuan konsentrasi optimum II dan W = daya hambat oksidasi asam linoleat.
) &$, $ )-, .!, -, '!- !($ !"!# ) )'8 (-!*(# 8 .!$ !$2(' 3 //# Potensi antioksidasi ekstrak daun salam diukur dengan menggunakan metode TBA yang akan menghasilkan kompleks MDA3 TBA berwarna merah muda. Potensi antioksidasi dapat terlihat melalui intensitas warna yang dihasilkan. Semakin pekat warna yang dihasilkan menunjukkan semakin tinggi kadar MDA maka semakin rendah potensi antioksidasinya. Semakin pudar warna merah
muda yang dihasilkan menunjukkan semakin rendah kadar MDA maka semakin tinggi potensi antioksidasinya (Gambar 11).
Pada pengukuran potensi antioksidasi ini, sampel percobaan dibagi menjadi empat kelompok perlakuan. Asam linoleat yang tidak diberi antioksidan diketahui memiliki konsentrasi MDA sebesar 16.07 VM. Hal ini menunjukkan tidak adanya penghambatan proses oksidasi asam linoleat. Pemberian ekstrak daun salam dari kota Bogor, Sukabumi, dan Cianjur sebesar 1000 ppm W=28.88%
W=6.74% W= 3 4.49% W=35.40% W=65.56%
& ' & ( " )* + , -. * / W=62.41%
menunjukkan konsentrasi MDA yang tidak jauh berbeda (Gambar 12). Pada konsentrasi 1000 ppm ekstrak daun salam Cianjur memiliki potensi antioksidasi paling tinggi dari ekstrak daun salam kota Bogor dan
Cianjur yaitu sebesar 68.44%. Meskipun demikian perbedaan potensi antioksidasi ketiga macam ekstrak tersebut tidak terlalu besar.
Gambar 11 Uji potensi antioksidasi (1) Kontrol negatif dengan air; (2) Kontrol positif dengan vitamin E; (3) Ekstrak daun salam Bogor 1000 ppm; (4) Ekstrak daun salam Sukabumi 1000 ppm; (5) Ekstrak daun salam Cianjur 1000 ppm.)
Gambar 12 Potensi antioksidasi ekstrak daun salam ketiga kota 1000 ppm dan W = daya hambat oksidasi asam linoleat.
Berdasarkan uji Duncan diketahui potensi antioksidasi antara ekstrak daun salam kota Bogor, Sukabumi, dan Cianjur tidak jauh berbeda, sehingga secara statistik potensi antioksidasi ekstrak salam ketiga kota tidak berbeda nyata dengan p=0.05. Oleh karena itu dapat dikatakan bahwa ekstrak daun salam yang berasal dari tiga daerah tersebut memiliki potensi antioksidasi yang sama. Hal ini dapat disebabkan lingkungan agrobiofisik dari kota Bogor, Sukabumi, dan Cianjur tidak terlalu jauh berbeda baik suhu, jenis tanah, iklim, dan daerah topografinya. Sedangkan potensi antioksidasi antara ekstrak daun salam ketiga daerah lebih rendah dibanding dengan vitamin E.
Penggunaan ekstrak daun salam sebagai antioksidan mampu memberikan hasil yang maksimum pada konsentrasi 1000 ppm. Dibandingkan dengan vitamin E, penggunaan ekstrak daun salam sebagai antioksidan lima kali lebih besar dari vitamin E.
Potensi antioksidasi ekstrak daun salam ketiga kota tersebut disebabkan oleh adanya senyawa3senyawa fitokimia yang terkandung dalam daun salam. Senyawa fitokimia yang dimiliki ekstrak daun salam ketiga kota tersebut sama yaitu mengandung alkaloid, saponin, flavonoid, fenolik hidrokuinon, triterpenoid dan tanin.
Seperti yang telah diketahui bahwa senyawa3senyawa fitokimia tersebut memiliki
16,068 ± 0,103
5,28 ± 0,414 5,369 ± 0,096 5,071 ± 0,242
!" #" $ %" W=68.44%
potensi antioksidasi. Hal ini sesuai dengan penelitian yang dilakukan Arini et al (2003) menyatakan semakin tinggi kadar flavonoid maka semakin tinggi pula potensi antioksidasinya. Beberapa penelitian membuktikan bahwa alkaloid bersifat sebagai antioksidan dan mampu menekan kejadian kanker. Tanaman cincau yang mengandung alkaliod, polifenol, dan flavonoid mampu menghambat peroksidasi lipid secara nonenzimatik (Chalid 2003). Flavonoid yang terkandung pada herba benalu mangga menghambat pertumbuhan kanker pada mencit yang diinduksi benzopirena (Sukardiman 1999).
Senyawa saponin dalam tumbuhan telah banyak dimanfaatkan untuk pengobatan, terutama saponin dari turunan glikosida dapat menurunkan kolesterol dan menghambat penyakit kanker (Hernani & Rahardjo 2005). Hal ini terbukti dari saponin yang terkandung pada tanaman ciplukan berkhasiat sebagai antitumor dan mampu menghambat pertumbuhan kanker usus besar (Mangan 2003). Selain itu saponin yang terkandung pada akar kuning dan temulawak mampu menghambat peningkatan konsentrasi lipid peroksida (Adji 2004).
Tanin merupakan merupakan golongan senyawa polifenol yang banyak terkandung dalam teh. Tanin yang terkandung dalam teh hijau berperan sebagai pelindung terhadap serangan kanker dan dapat meningkatkan kerja insulin dalam tubuh (Kumalaningsih 2006).
Berdasarkan hasil uji fitokimia dan potensi antiokidasi ekstrak daun salam ketiga kota tersebut, ada tidaknya kandungan senyawa fitokimia pada ekstrak berpengaruh terhadap tinggi rendahnya potensi antioksidasi. Hal ini dikarenakan adanya kemungkinan senyawa fitokimia tersebut bekerja secara sinergis dalam menghambat proses oksidasi.
#/("!$ Ekstrak daun salam (
Wight.) yang berasal dari lingkungan agrobiofisik berbeda yaitu kota Bogor, Sukabumi, dan Cianjur berpotensi sebagai antioksidan optimum secara pada konsentrasi 1000 ppm. Potensi antioksidasi ekstrak daun salam kota Bogor, Sukabumi, dan Cianjur berturut3turut sebesar 67.14%, 66.59%, dan 68.44%.
Berdasarkan hasil tersebut dapat diketahui potensi antioksidasi ekstrak daun salam
cianjur lebih tinggi dari dua kota lainnya. Meskipun demikian dapat disimpulkan bahwa potensi antioksidasi ekstrak daun salam ketiga kota tersebut tidak berbeda nyata. Oleh karena itu ekstrak daun salam tidak terlalu berpotensi sebagai antioksidan.
!'!$
Perlu dilakukan penelitian lebih lanjut tentang potensi antioksidasi pada daerah yang memliki lingkungan agrobiofisik lebih ekstrim. Serta perlu juga dilakukan penelitian lanjutan untuk pemurnian ekstrak kasar, sehingga dapat diketahui secara pasti senyawa bioaktif yang berperan sebagai antioksidan.
Adji P. 2004. Daya antiooksidasi saponin akar
kuning ( (L) Merr)
sebagai mekanisme hepatoproteksi pada tikus yang diberi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Arini S, Nurmawan D, Alfiani F, Hertiani T. 2003. Daya antioksidan dan kadar flavonoid hasil ekstraksi etanol3air daging buah mahkota dewa ("
(Sceheff.) Boerl.).#
" $ %&$10:236.
Chalid SY. 2003. Pengaruh ekstrak daun
cincau hijau ' ( $
" $
terhadap aktivitas enzim antioksidan dan pertumbuhan tumor kelenjar susu mencit C3H [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Cornwell DG, Morisaki N. 1984. ) # . Louisiana: Academic Pr.
Dalimartha S. 2000. *
' . Jilid 2. Jakarta: Trubus Agriwidya.
Hanan A.1999. Etnobotani salam di daerah Cirebon: pemanfaatan sebagai bahan penyedap alami.+
' 5: 738.
Harborne JB. 1987. $ ) ,
" $ $
potensi antioksidasi. Hal ini sesuai dengan penelitian yang dilakukan Arini et al (2003) menyatakan semakin tinggi kadar flavonoid maka semakin tinggi pula potensi antioksidasinya. Beberapa penelitian membuktikan bahwa alkaloid bersifat sebagai antioksidan dan mampu menekan kejadian kanker. Tanaman cincau yang mengandung alkaliod, polifenol, dan flavonoid mampu menghambat peroksidasi lipid secara nonenzimatik (Chalid 2003). Flavonoid yang terkandung pada herba benalu mangga menghambat pertumbuhan kanker pada mencit yang diinduksi benzopirena (Sukardiman 1999).
Senyawa saponin dalam tumbuhan telah banyak dimanfaatkan untuk pengobatan, terutama saponin dari turunan glikosida dapat menurunkan kolesterol dan menghambat penyakit kanker (Hernani & Rahardjo 2005). Hal ini terbukti dari saponin yang terkandung pada tanaman ciplukan berkhasiat sebagai antitumor dan mampu menghambat pertumbuhan kanker usus besar (Mangan 2003). Selain itu saponin yang terkandung pada akar kuning dan temulawak mampu menghambat peningkatan konsentrasi lipid peroksida (Adji 2004).
Tanin merupakan merupakan golongan senyawa polifenol yang banyak terkandung dalam teh. Tanin yang terkandung dalam teh hijau berperan sebagai pelindung terhadap serangan kanker dan dapat meningkatkan kerja insulin dalam tubuh (Kumalaningsih 2006).
Berdasarkan hasil uji fitokimia dan potensi antiokidasi ekstrak daun salam ketiga kota tersebut, ada tidaknya kandungan senyawa fitokimia pada ekstrak berpengaruh terhadap tinggi rendahnya potensi antioksidasi. Hal ini dikarenakan adanya kemungkinan senyawa fitokimia tersebut bekerja secara sinergis dalam menghambat proses oksidasi.
#/("!$ Ekstrak daun salam (
Wight.) yang berasal dari lingkungan agrobiofisik berbeda yaitu kota Bogor, Sukabumi, dan Cianjur berpotensi sebagai antioksidan optimum secara pada konsentrasi 1000 ppm. Potensi antioksidasi ekstrak daun salam kota Bogor, Sukabumi, dan Cianjur berturut3turut sebesar 67.14%, 66.59%, dan 68.44%.
Berdasarkan hasil tersebut dapat diketahui potensi antioksidasi ekstrak daun salam
cianjur lebih tinggi dari dua kota lainnya. Meskipun demikian dapat disimpulkan bahwa potensi antioksidasi ekstrak daun salam ketiga kota tersebut tidak berbeda nyata. Oleh karena itu ekstrak daun salam tidak terlalu berpotensi sebagai antioksidan.
!'!$
Perlu dilakukan penelitian lebih lanjut tentang potensi antioksidasi pada daerah yang memliki lingkungan agrobiofisik lebih ekstrim. Serta perlu juga dilakukan penelitian lanjutan untuk pemurnian ekstrak kasar, sehingga dapat diketahui secara pasti senyawa bioaktif yang berperan sebagai antioksidan.
Adji P. 2004. Daya antiooksidasi saponin akar
kuning ( (L) Merr)
sebagai mekanisme hepatoproteksi pada tikus yang diberi parasetamol [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Arini S, Nurmawan D, Alfiani F, Hertiani T. 2003. Daya antioksidan dan kadar flavonoid hasil ekstraksi etanol3air daging buah mahkota dewa ("
(Sceheff.) Boerl.).#
" $ %&$10:236.
Chalid SY. 2003. Pengaruh ekstrak daun
cincau hijau ' ( $
" $
terhadap aktivitas enzim antioksidan dan pertumbuhan tumor kelenjar susu mencit C3H [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Cornwell DG, Morisaki N. 1984. ) # . Louisiana: Academic Pr.
Dalimartha S. 2000. *
' . Jilid 2. Jakarta: Trubus Agriwidya.
Hanan A.1999. Etnobotani salam di daerah Cirebon: pemanfaatan sebagai bahan penyedap alami.+
' 5: 738.
Harborne JB. 1987. $ ) ,
" $ $
Terjemahan dari "
$ .
Hernani, Rahardjo M. 2005. *
# . Jakarta:
Penebar Swadaya.
Heyne K. 1987. * #
' . Jilid III. Jakarta: Koperasi Karyawan Departemen Kehutanan.
Kardono LBS. 2003. Kajian kandungan kimia mahkota dewa (" ). Di dalam:" " "
*
$ - . Jakarta: Pusat
Penelitian dan Pengembangan Farmasi dan Obat Tradisional Badan Penelitian dan Pengembangan Kesehatan. Departemen Kesehatan.
Kartikawati D. 1999. Studi efek protektif vitamin C dan E terhadap respon imun dan enzim antioksidan pada mencit yang dipapar paraquat [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Karyadi E. 1997. Antioksidan, resep sehat & panjang umur. http:// www.indomedia.com/intisari/1997/juni /antioks.htm 3 16k 3[1 April 2006].
Kikuzaki H, Nobuji N. 1993. Antioxidant effect of some ginger constituents.
. 58(6): 14073
1410.
Krisnayunita P. 2002. Formulasi, karakterisasi kimia dan uji aktivitas antioksidan produk minuman fungsional tradisional campuran sari asam jawa (*
L.) dan sari temulawak
( Roxb.)
[skripsi]. Bogor Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Kumalaningsih S. 2006. .
Surabaya: Trubus Agrisarana.
Lautan J. 1997. Radikal bebas pada eritrosit dan lekosit. - /
116: 49352.
Mangan. 2003. # 0 $ / . Jakarta: Agromedia Pustaka.
Markham KR. 1988. $
) . Penerjemah Padmawinata K. Bandung: ITB. Terjemahan dari
* ) ' .
Muhilal. 1991. Teori radikal bebas dalam gizi
dan kedokteran.
-/ 73: 9311.
Murray RK, Granner DK, Mayes PA, Rodwel VW. 2003. # 1 . Ed 25. Penerjemah Andry Hartono. Jakarta: EGC. Terjemahan dari: 1 2
# .
Musthafa Z, Lawrence GS, Seweang A. 2000. Radikal bebas sebagai prediktor aterosklerosis pada tikus wistar diabetes melitus. -/ 127: 30331.
Napoli C, Lerman LO. 2001. Involvement of oxidation3sensitive mechanism in the cardiovascular effects of hypercholesterolemia.$ " 76: 6193631.
[PSB] Pusat Studi Biofarmaka. 2006.(
" *
" . Bogor: PSB.
Santoso A. 2001. Isolasi senyawa bioaktif yang berpotensi antioksidan dari daun benalu teh
(BL.) danser [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Satria E. 2005. Uji potensi antioksidan dari daging buah tua mahkota dewa
(" (Sceheff.)
Boerl.) sebagai antikanker [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sauriasari R. 2006. Mengenal dan menangkal radikal bebas. http:// www.beritaiptek.com/ zberita 3 berita iptek 2006301322 Mengenal dan Menangkal Radikal Bebas.shtml 3 28k –[8 Februari 2006].
Sayogya AP. 2002. Efek senyawa antioksidan
# $
(BRMTM) terhadap kadar lipid peroksida hati tikus [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sibuea P. 2005. Kuersetin senjata pemusnah radikal bebas. http:;; www.kompas.co.id/kompas cetak/ 0402/10/ilpeng/840926.htm 3 42k [14 Maret 2006].
Siregar P. 1992. Metabolit oksigen radikal bebas dan kerusakan jaringan.
- / 80: 1123115.
Sofia D. 2006. Antioksidan dan radikal bebas. http://www.chem3is3try.org/?sect= artikel & ext=81 3 27k3html [6 Februari 2006].
Sukardiman, IGP Santa, Rahmadany. 1999. Efek antikanker isolat Flavonoid dari herba benalu mangga (
-). - /
122: 538.
Taher A. 2003. Peran fitoestrogen kedelai sebagai antioksidan dalam penanggulangan aterosklerosis [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Tensiska. 2001. Aktivitas antioksidan ekstrak buah andaliman (3
DC) dalam beberapa sistem pangan dan kestabilan aktivitasnya terhadap kondisi suhu dan pH [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Tjitrosoepomo G. 2005. *
* ! . Yogyakarta:
UGM Pr.
Tombilangi AK. 2004. Khasiat ekstrak daun jati belanda (&
Lamk.) terhadap kadar lipid peroksida darah kelinci yang hiperlipidemia [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pangetahuan Alam, Institut Pertanian Bogor.
Trilaksani W. 2003. Antioksidan: jenis, sumber, mekanisme kerja, dan peran
terhadap kesehatan [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Tuminah S. 2000. Radikal bebas dan antioksidan kaitannya dengan nutrisi dan penyakit kronis. -/ 128: 49351.
Tuminah S. 1999. Pencegahan kanker dengan antioksidan. - /
122: 21323.
Wijayakusuma H, Dalimartha S, Wirian AS.
1996. * #
' . Jilid IV. Jakarta: Pustaka Kartini.
Yagi K. 1994. Lipid peroxides in hepatic, gastrointestinal, and pancreatic disease. Di dalam Amstrong D, editor. )
- $ . New
RADEN ANISSA EKAWATI. Potensi Antioksidasi Daun Salam (
Wight.) Pada Lingkungan Agrobiofisik yang Berbeda. Dibimbing oleh
SULISTIYANI dan EDY DJAUHARI PURWAKUSUMAH.
Pengaruh lingkungan agrobiofisik terhadap khasiat antioksidasi dari ekstrak
daun tanaman salam belum dilakukan. Dalam penelitian ini akan digunakan daun
salam dari berbagai daerah dengan lingkungan agrobiofisik yang berbeda, yaitu
Bogor, Sukabumi, dan Cianjur. Penelitian ini bertujuan untuk membuktikan
khasiat antioksidasi ekstrak daun salam pada lingkungan agrobiofisik yang
berbeda.
Daun salam diekstraksi dengan pelarut etanol 70% menggunakan metode
refluks. Potensi antioksidasi ekstrak daun salam ditentukan dengan metode asam
tiobarbiturat (TBA) menggunakan spektrofotometer pada panjang gelombang 532
nm.
RADEN ANISSA EKAWATI. The Antioxidative Potency of Bay Leaves
(
Wight.) on Different Agrobiophysic Environment. Under the
direction of SULISTIYANI and EDY DJAUHARI PURWAKUSUMAH.
The study of the impact of agrobiophysic environment on the antioxidative
potency of bay leaves extract has not been done. In this research, bay leaves were
taken from three places with different agrobiophysic environment: Bogor,
Sukabumi, and Cianjur. The objectives of this research is to determine
antioxidative potency of those extracts.
Bay leaves were extracted by ethanol solution of 70% using reflux method.
The antioxidative potency of bay leaves extract were determine by thiobarbituric
acid (TBA) method using spectrophotometer at 532 nm.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul Skripsi : Potensi Antioksidasi Daun Salam (
Wight.)
Pada Lingkungan Agrobiofisik yang Berbeda
Nama
: Raden Anissa Ekawati
NRP
: G44102043
Disetujui
Komisi Pembimbing
drh. Sulistiyani, M.Sc., Ph.D.
Drs. Edy Djauhari P.K, M.Si.
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131 473 999
Penulis panjatkan puji syukur Alhamdulillah kepada Allah SWT atas
seluruh rahmat dan karunia3Nya sehingga penulis dapat menyelesaikan karya
ilmiah ini. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Program Studi Biokimia Fakultas Matematika dan Ilmu
Pengetahuan Alam. Penelitian ini dilaksanakan selama bulan Juli3November 2006
dengan judul Potensi Antioksidasi Daun Salam (
Wight.) Pada
Lingkungan Agrobiofisik yang Berbeda.
Penulis mengucapkan terima kasih sebesar3besarnya kapada semua pihak
yang telah membantu. Terima kasih penulis ucapkan kepada pembimbing drh.
Sulistiyani, M.Sc., Ph.D dan Drs. Edy Djauhari Purwakusumah, M.Si atas
bimbingan dan dorongannya selama penelitian serta penulisan skripsi ini. Selain
itu penulis juga mengucapkan terima kasih kepada teman seperjuangan Yayu,
Alvi, Fitri, Aris, Liga, Chandra, Bina, Hilya, Laura, dan Peni atas bantuannya
selama penelitian. Terima kasih pula penulis ucapkan kepada Andrew Sakti atas
dukungan, pengertian dan kasih sayangnya serta kepada Innayah atas dukungan
dan bantuan morilnya. Ungkapan terima kasih sedalam3dalamnya juga penulis
sampaikan kepada papa, mama, Ikhsan, dan Bayu atas doa, kasih sayang, dan
dukungan morilnya.
Semoga karya ilmiah ini dapat bermanfaat.
Penulis dilahirkan di kota Bogor pada tanggal 13 Juli 1984 dari ayah
bernama Raden Muhjidin Sumiratmadja dan ibu bernama Lina Nur’aeni. Penulis
merupakan anak pertama dari tiga bersaudara.
Penulis pernah bersekolah di SDN Ciluar V Bogor pada tahun 1990,
kemudian melanjutkan ke SLTPN 5 Bogor pada tahun 1996. Pada tahun 2002,
penulis lulus dari SMUN 2 Bogor dan pada tahun yang sama berhasil masuk
Institut Pertanian Bogor di Program Studi Biokimia Fakultas Matematika dan
Ilmu Pengetahuan Alam melalui jalur Undangan Seleksi Mahasiswa IPB (USMI).
!"!#!$
DAFTAR GAMBAR ...
ix
DAFTAR TABEL ...
ix
DAFTAR LAMPIRAN ...
x
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Salam (
Wight.) ...
1
Pengaruh Agrobiofisik terhadap Bahan Aktif ...
2
Radikal Bebas Penyebab Penyakit Degeneratif ...
3
Tahapan Reaksi Peroksidasi Lipid ...
4
Peranan Antioksidan di Bidang Kesehatan ...
5
Senyawa Antioksidan Alami ...
5
Teknik Penentuan Potensi Antioksidan ...
6
Metode Diena terkonjugasi ...
6
BAHAN DAN METODE
Bahan dan Alat ...
7
Metode ...
7
HASIL DAN PEMBAHASAN
Hasil Ekstraksi ...
9
Analisis Fitokimia Ekstrak Sampel ...
9
Sistem Oksidasi Asam Linoleat ...
10
Oksidasi Asam Linoleat Metode TBA ...
10
Potensi Antioksidasi Ekstrak Daun Salam Bogor, Sukabumi, dan
Cianjur 200 ppm ...
10
Penentuan Konsentrasi Optimum Potensi Antioksidasi ...
11
Potensi Antioksidasi Ekstrak Daun Salam Bogor, Sukabumi, dan
!"!#!$
1 Salam (
Wight.) ...
2
2 Reaksi pembentukan
(ROS) ...
4
3 Reaksi peroksidasi lipid ...
4
4 Reaksi antara malondialdehida dan asam tiobarbiturat ...
4
5 Pembentukan diena terkonjugasi pada asam lemak linoleat ...
7
6 Nilai absorbansi hidroperoksida maksimum terhadap waktu ...
10
7 Konsentrasi MDA vitamin E ...
10
8 Konsentrasi MDA ekstrak salam ketiga kota 200 ppm ...
11
9 Konsentrasi MDA pada penentuan konsentrasi optimum I ...
12
10 Konsentrasi MDA pada penentuan konsentrasi optimum II ...
12
11 Uji potensi antioksidasi ...
13
12 Konsentrasi MDA ekstrak salam ketiga kota 1000 ppm ...
13
!"!#!$
!"!#!$
Pesatnya perkembangan ilmu pengetahuan dan teknologi serta berubahnya pola hidup masyarakat yang lebih mengarah kepada makanan siap saji yang berdampak pada munculnya berbagai penyakit degeneratif. Pola makan yang tidak tepat mengakibatkan terbentuknya radikal bebas dalam tubuh sehingga muncul beragam penyakit seperti kanker, diabetes melitus, aterosklerosis, katarak, dan penyakit jantung koroner (Napoli 2001). Namun, saat ini masyarakat mulai sadar dan mengubah pola hidupnya untuk kembali pada alam ( ), termasuk dalam hal memelihara dan menjaga kesehatan. Keberadaan radikal bebas yang bersifat tidak stabil dan reaktif di dalam tubuh dapat mengakibatkan kerusakan seluler, jaringan, dan genetik (mutasi DNA). Radikal bebas dapat dikurangi dengan mengkonsumsi antioksidan dalam jumlah yang cukup. Secara alami, tubuh mempunyai benteng yang dapat mencegah serangan berbagai penyakit yang disebut antioksidan. Antioksidan memiliki fungsi untuk menghentikan atau memutuskan reaksi berantai dari radikal bebas yang terdapat dalam tubuh sehingga dapat menyelamatkan sel3sel tubuh dari kerusakan akibat radikal bebas (Hernani & Rahardjo 2005).
Tubuh manusia menghasilkan senyawa antioksidan, tetapi tidak cukup kuat