PENDAHULUAN
Latar Belakang
Sektor peternakan merupakan sektor yang strategis, mengingat dalam
rangka mewujudkan ketahanan pangan dan mencerdaskan bangsa, sektor
peternakan berperan penting melalui penyediaan protein hewani, seperti daging,
susu, dan telur untuk makanan sehari- hari. Apabila bangsa Indonesia memenuhi
asupan kecukupan nilai gizi tinggi, insya Allah Indonesia akan memiliki
sumberdaya manusia sehat, cerdas, dan kuat.
Kenyataan yang terjadi saat ini, penyediaan protein hewani untuk memenuhi
kebutuhan masyarakat Indonesia belum mampu untuk dipenuhi. Sebagai
gambaran, kebutuhan konsumsi daging di Indonesia baru terpenuhi 56% oleh
daging ayam, daging sapi baru terpenuhi 23%. Khusus untuk memenuhi
kebutuhan daging sapi, Indonesia masih mengimpor 50 ribu ton daging dan 400
ribu ekor sapi setiap tahunnya dari negara lain. Dalam hal ini yang diuntungkan
kalau mengimpor adalah peternak negara lain. Kondisi ini akan menghambat
program Pemerintah dalam rangka mewujudkan ketahanan pangan dan
mencerdaskan bangsa. Untuk mengatasi belum mampunya sektor peternakan
memenuhi kebutuhan daging, Departemen Pertanian telah mempersiapkan
program kecukupan daging sapi tahun 2010. Program ini merupakan peluang
sekaligus tantangan bagi para peternak, para pengusaha peternakan, dan
Pemerintah dalam rangka mengembangkan sektor peternakan di Indonesia
(Yudhoyono 2006).
Program kecukupan daging sapi tahun 2010 tentunya dapat dilaksanakan
dengan berbagai upaya dan melibatkan semua pihak, Pemerintah perlu
mendorong partisipasi seluruh elemen masyarakat. Namun perlu kiranya disadari
bahwa dalam pelaksanaan program tersebut akan banyak faktor- faktor yang
mempengaruhi keberhasilannya. Faktor-faktor tersebut antara lain politik,
ekonomi, sosial, peternak, dan kondisi ternak.
Khusus masalah kondisi ternak, apabila dilihat secara umum tampak
ternak-ternak yang berada di peternak-ternakan khususnya peternak-ternakan rakyat cenderung
ternak-ternak di Indonesia bertubuh kecil, antara lain genetik dan lingkungan yang
belum optimal untuk mendukung pertumbuhan dan perkembangan ternak.
Seperti diketahui kondisi tubuh akan berdampak terhadap produktivitas
ternak. Artinya ternak yang mempunyai tubuh yang kecil akan menghasilkan
produk daging sedikit atau dengan kata lain produktivitasnya rendah.
Produktivitas ternak yang rendah ditinjau dari aspek fisiologis menggambarkan
pertumbuhan yang belum optimal. Selanjutnya, pertumbuhan yang belum optimal
erat kaitannya dengan proses regulasi komponen utama badan yang kompleks.
Faktor ekspresi potensi genetik, lingkungan (manajemen, pakan, dan kondisi
lingkungan habitat), dan aksi hormon yang belum optimal akan berpengaruh pada
proses pencapaian regulasi pertumbuhan (Ohlsson et al. 1998; Veldhuis et al. 2005).
Periode pertumbuhan pascalahir dibagi menjadi tiga periode pertumbuhan,
yaitu pertumbuhan prapubertas, pasca pubertas, dan dewasa (Veldhuis et al. 2005). Selama pertumbuhan tersebut akan terjadi perubahan ukuran yang
meliputi perubahan bobot hidup, bentuk, dimensi linear, dan komposisi badan.
Perubahan yang terjadi pada komposisi badan berlangsung pada
komponen badan seperti otot, lemak, tulang, dan organ serta
komponen-komponen kimiawi badan terutama air, lemak, protein, dan mineral. Kejadian ini
berlangsung pada komponen badan yang berbeda-beda dengan kadar laju
pertumbuhan yang berbeda pula sehingga perubahan ukuran komponen badan
menghasilkan diferensiasi atau perbedaan karakteristik individual sel dan organ
(Veldhuis et al. 2005). Selama pertumbuhan pascalahir, tulang tumbuh lebih awal dibandingkan dengan pertumbuhan otot dan lemak, dan rusuk merupakan tulang
yang perkembangannya paling akhir. Selanjutnya komponen tubuh yang
merupakan komponen utama penyusun tubuh secara kumulatif akan mengalami
pertambahan bobot sampai mencapai kedewasaan (Burrin et al. 1992; Davis et al. 2000).
Selanjutnya apabila dikaitkan dengan kurva pertumbuhan, akan terjadi fase
cepat (akselerasi) dan fase lambat (deselerasi) yang titik peralihannya disebut titik
infleksi. Titik infleksi ini dicapai bersamaan dengan saat pubertas. Sebagai
kanak-kanak sampai pubertas yang terjadi secara berangsur-angsur dan puncaknya
dicapai pada masa pubertas, setelah itu terjadi pengurangan laju pertumbuhan
jaringan hingga dewasa. Selain itu, pada saat prapubertas hingga pubertas terjadi
peningkatan sekresi hormon- hormon, selanjutnya terjadi penurunan sekresi
hormon-hormon hingga dewasa (Ohlsson et al. 1998).
Menyinggung peranan faktor hormon, aktivitasnya di dalam pertumbuhan
bergantung pada beberapa faktor yang melibatkan suplai makanan, potensi
genetik, dan lingkungan. Secara langsung maupun tidak langsung
hormon-hormon tersebut dapat mengubah reaksi biokimia yang berkaitan dengan proses
pertumbuhan dan perkembangan komponen tubuh. Hormon yang mempengaruhi
pertumbuhan dapat dibagi menjadi dua kelompok, yaitu kelompok anabolik antara
lain somatotropin, testosteron, dan tiroksin dan kelompok katabolik antara lain
estrogen. Hormon yang berpengaruh secara langsung pada pertumbuhan, antara
lain adalah somatotropin, tiroksin, androge n, estrogen, dan glukokortikoid.
Hormon- hormon tersebut me mpengaruhi pertumbuhan, termasuk pertumbuhan
tulang dan metabolisme nitrogen (Robson et al. 2002; Leung et al. 2004).
Pada prinsipnya kerja hormon tidak berdiri sendiri-sendiri dan hormon
yang terkenal dengan aktivitas pertumbuhan dikenal dengan nama somatotropin
(growth hormone). Somatotropin disekresikan oleh pituitari anterior dengan kontrol hipotalamus (Coschigano et al. 2003). Hormon ini disintesis oleh sel-sel somatotrof dalam bentuk polipeptida tunggal dengan massa molekul 22 kDa.
Secara umum target utama somatotropin adalah hati dan pengaruh utamanya
adalah pada laju metabolisme, komposisi badan, dan sekresi IGF-I (Tollet-Egnell
et al. 2001). Somatotropin mengatur dan mengubah reaksi biokimia yang berkaitan dengan proses pertumbuhan dan perkembangan komponen tubuh dan
bekerja pada sel-sel target melalui ik atan reseptor somatotropin yang spesifik
yang berada dalam permukaan sel seperti hati, otot, tulang, dan jaringan adiposa
(Hartman 2000). Selanjutnya, fungsi somatotropin dalam metabolisme tubuh
adalah meningkatkan kecepatan sintesis protein di semua sel tubuh. Somatotropin
mampu mempercepat pengangkutan asam amino melalui dinding sel ke dalam
sitoplasma. Selain itu, somatotropin juga mampu meningkatkan pembentukan
Keadaan ini akan memungkinkan terjadinya sintesis protein dan pertambahan
jumlah sel yang lebih cepat sehingga mempercepat pertumbuhan jaringan (Davis
et al. 2004).
Dari gambaran di atas, tampak somatotropin yang disekresikan selama
periode prapubertas hingga pubertas berperan penting pada pertumbuhan.
Selanjutnya, apabila dikaitkan dengan kondisi belum optimalnya pertumbuhan,
usaha meningkatkan peran dan aksi somatotropin pada masa prapubertas
diharapkan akan mengoptimalkan pertumbuhan ternak. Artinya, suplementasi
somatotropin yang dilakukan pada ternak umur prapubertas diharapkan mampu
meningkatkan pertumbuhan ternak, sehingga diharapkan untuk masa selanjutnya
ternak berpenampilan tubuh yang baik dengan komposisi badan yang memadai.
Penelitian-penelitian tentang pengaruh somatotropin pada pertumbuhan
sudah dimulai sejak tahun 1922 oleh Evans dan Long, pada saat itu ditemukan
suatu zat yang disekresikan dari kelenjar pituitari anterior yang meningkatkan
pertumbuhan bobot badan tikus, zat tersebut dinamakan hormon pertumbuhan
(growth hormone), selanjutnya zat tersebut dinamakan somatotropin karena aktivitasnya pada sel-sel somatik. Li et al. pada tahun 1945 berhasil mengisolasi somatoropin dari kelenjar pituitari anterior sapi. Selanjutnya, dari hasil penelitian
Li et al. pada tahun 1945, berkembang penelitianbioteknologi pada tahun 1970-an yang memungkinkan untuk menghasilkan somatotropin secara teknik DNA
rekombinan (Etherton 2004). Bioteknologi telah dianggap sebagai ilmu yang
akan mempunyai dampak revolusioner dalam bidang pertanian, termasuk
peternakan. Salah satu hasil bioteknologi pertama yang sudah siap digunakan
dalam industri peternakan adalah somatotropin (Manalu, 1994). Teknik bio logis
baru yang dikenal dengan rekayasa gene tik telah dikembangkan. Prosedur ini
memungkinkan isolasi gen somatotropin yang merupakan hormon protein dengan
191 residu asam amino, dan menggabungkannya ke dalam gen bakteri. Bakteri
yang membawa gen somatotropin tadi kemudian akan menghasilkan somatotropin
yang biasanya hanya dihasilkan oleh kelenjar pituitari. Dengan demikian,
sejumlah besar somatotropin dapat dihasilkan oleh bakteri dalam bejana
fermentasi dan kemudian dimurnikan dengan biaya yang relatif murah (Manalu
Pengaruh penyuntikan somatotropin pada pertumbuhan telah
didokumentasikan. Penelitian penyuntikan somatotropin pada hewan maupun
manusia dengan berbagai metode telah dilakukan, secara umum hasil penyuntikan
somatotropin meningkatkan bobot badan dan efisiensi penggunaan pakan sapi
(Rausch et al. 2002), meningkatkan bobot karkas dan mereduksi lemak karkas babi (Sillence et al. 2002), meningkatkan mineral karkas domba (Zainur et al. 2000), meningkatkan bobot organ dalam tikus (Azain et al. 2006), meningkatkan panjang dan kolagen tulang manusia (Longobardi et al. 2000; Wallace et al. 2000), dan meningkatkan kalsium tulang mencit (Kasukawa et al. 2003).
Melihat kondisi pertumbuhan ternak yang belum optimal, selanjutnya
mengamati pentingnya peranan somatotropin pada periode pertumbuhan pra
pubertas, dan tersedianya hasil bioteknologi somatotropin, serta didukung oleh
studi-studi penelitian yang telah dilakukan pada berbagai obyek dan metode
penyuntikan somatotropin selama ini, penelitian tentang perangsangan
pertumbuhan dengan penyuntikan somatotropin pada umur prapubertas untuk
melihat respons penampilan pertumbuhan hewan menarik untuk dilakukan. Dari
penelitian ini dapat dikaji tentang bobot badan, konsumsi pakan, pertambahan
bobot badan, efisiensi penggunaan pakan, laju pertumbuhan relatif, bobot dan
kandungan kimiawi karkas, bobot organ, panjang tulang, dan kandungan kimiawi
tulang. Selanjutnya, diharapkan penelitian penyuntikan somatotropin ini dapat
dijadikan alternatif dalam rangka memperoleh struktur eksternal dan wujud yang
optimal pada hewan (ternak).
Tujuan dan Manfaat Penelitian
Secara umum penelitian ini bertujuan untuk mengkaji potensi somatotropin
pada pertumbuhan sebagai upaya untuk mengoptimalkan produktivitas hewan.
Secara khusus penelitian ini bertujuan untuk mengkaji pengaruh penyuntikan
somatotropin pada bobot badan, konsumsi pakan, pertambahan bobot badan,
efisiensi penggunaan pakan, laju pertumbuhan relatif, bobot karkas, kandungan
(protein, lemak, mineral dan glikogen) karkas, bobot organ (hati, jantung, testis,
dan saluran pencernaan), panjang tulang (kaki depan, kaki belakang, dan tulang
Berdasarkan hasil penelitian ini diharapkan dapat diperoleh informasi dalam
penerapan hasil bioteknologi somatotropin yang selanjutnya dapat dijadikan
informasi dasar bagi peternak, khalayak umum, maupun penentu kebijakan
(Pemerintah), khususnya dalam upaya peningkatan penampilan pertumbuhan
Gambar 1. Kerangka pemikiran penelitian
HIPOTALAMUS
PERTUMBUHAN KERJA SEL SOMATIK ATAU SEL TUBUH
SOMATOTROPIN
FUNGSI SEL PITUITARI ANTERIOR
PRODUKTIVITAS SOMATOTROPIN
STRUKTUR EKSTERNAL DAN
TINJAUAN PUSTAKA
Secara umum, periode pertumbuhan dan perkembangan dapat dibedakan
menjadi dua, yaitu periode prenatal atau sebelum lahir dan periode postnatal atau
sesudah lahir. Pertumbuhan dan perkembangan prenatal dibagi menjadi tiga
periode, berupa proses yang berkesinambungan, yaitu periode ovum, embrio, dan
fetus. Pertumbuhan postnatal dapat dibagi menjadi pertumbuhan prapubertas,
pascapubertas, dan dewasa (Veldhuis et al. 2005). Selama periode pertumbuhan dan perkembangan akan mengalami tiga proses utama. Proses pertama adalah
pertumbuhan selular meliputi hiperplasia (perbanyakan sel atau produksi sel-sel
baru) dan hipertrofi (pembesaran sel dan akresi material struktural nonseluler).
Mula- mula sel tumbuh secara hiperplasia, kemudian dilanjutkan secara hipertropi
sampai mencapai ukuran karakteristik jaringan. Proses kedua adalah diferensiasi
sel-sel induk di dalam embrio menjadi ektoderm, mesoderm, dan endoderm yang
akan menghasilkan sel-sel khusus. Proses ketiga adalah kontrol terhadap
pertumbuhan dan diferensiasi yang melibatkan banyak proses (Woodhouse et al. 2006).
Kejadian selama proses pertumbuhan dan perkembangan pada gilirannya
akan berpengaruh pada perubahan ukuran yang meliputi perubahan bobot hidup,
bentuk, dimensi linear, dan komposisi tubuh. Adapun perubahan yang terjadi
pada komposisi tubuh berlangsung pada komponen-komponen tubuh seperti otot,
lemak, tula ng, dan organ serta komponen-komponen kimia tubuh terutama air,
lemak, protein, dan mineral. Kejadian ini berlangsung pada komponen tubuh
yang berbeda-beda dengan laju pertumbuhan yang berbeda pula sehingga
perubahan ukuran komponen tubuh menghasilkan diferensiasi atau perbedaan
karakteristik individual sel dan organ (Veldhuis et al. 2005). Komponen tubuh secara kumulatif akan mengalami pertambahan bobot sampai mencapai
kedewasaan. Selama proses ini akan mempengaruhi distribusi bobot dan
komposisi kimia komponen-komponen tubuh yang merupakan komponen utama
penyusun tubuh (Burrin et al. 1992; Davis et al. 2000).
Pertumbuhan yang dicerminkan dengan terjadinya perubahan dan
Hewan memerlukan pakan untuk memenuhi berbagai kebutuhan hidupnya.
Kebutuhan akan zat- zat makanan dimulai sejak awal terjadinya kehidupan di
dalam tubuh induk. Anak hewan dan hewan yang belum dewasa memerlukan
pakan untuk dapat bertumbuh terus dan untuk pemeliharaan jaringan-jaringan
yang masih mengalami perubahan bentuk maupun ukuran (Burrin et al. 1992; Davis et al. 2000; Veldhuis et al. 2005). Untuk hewan dewasa, di samping untuk keperluan pembaruan atau penggantian sel-sel serta jaringan yang mati atau rusak,
pakan dipergunakan juga sebagai sumber energi dan produksi (Gallagher et al. 1998; Even et al. 2001).
Untuk mengetahui terjadinya pertumbuhan pada hewan, umumnya
dilakukan pengukuran pertumbuhan yang didasarkan pada peningkatan bobot
badan per satuan waktu tertentu, yang dinyatakan sebagai pertambahan bobot
badan. Adapun rumus yang digunakan untuk menentukan pertambahan bobot
badan adalah pengurangan bobot badan akhir dengan bobot badan awal dibagi
lama waktu pengamatan. Pengukuran pertumbuhan dengan cara ini mudah
dilaksanakan dan menghasilkan nilai pertumbuhan yang mantap (Tulloh 1978;
Edey 1983). Disamping pertambahan bobot badan sebagai ukuran terjadinya
pertumbuhan, dapat pula diukur laju pertumbuha n relatifnya, yaitu dengan
membagi pertambahan bobot badan yang dihasilkan dengan bobot badan pada
waktu itu. Hasil pengukuran laju pertumbuhan relatif mencerminkan seberapa
besar kecepatan pertumbuhan yang terjadi pada hewan tersebut. Laju
pertumbuhan postnatal, mula- mula terjadi sangat lambat, kemudian cepat,
selanjutnya berangsur-angsur menurun atau melambat dan berhenti setelah
mencapai kedewasaan. Kecepatan laju pertumbuhan mengalami akselerasi dari
konsepsi sampai pubertas, kemudian mengalami deselerasi hingga menjadi nol
bila bobot dewasa telah tercapai (Edey 1983; Veldhuis et al. 2005).
Selanjutnya untuk mengetahui sejauh mana pakan yang dikonsumsi
digunakan untuk pertumbuhan (efisiensi penggunaan pakan), dapat diukur dengan
membandingkan pertambahan bobot badan yang terjadi dengan pakan yang
dikonsumsi oleh hewan tersebut. Besar atau kecil nilai yang dihasilkan dari
perbandingan ini mencerminkan keefisiensian hewan dalam memanfaatkan pakan
Selain dengan mengukur kenaikan bobot badan, kuantitas dan kualitas
pertumbuhan hewan dapat pula diukur dari bobot dan kandungan kimiawi karkas
yang dihasilkan. Bobot karkas seekor hewan adalah bobot bagian tubuh dikurangi
kulit, kepala, kaki depan dan belakang, ekor, dan organ dalam (Soeparno 1992;
Husni 1993). Adapun kandungan kimiawi karkas seperti protein, lemak, mineral,
dan glikogen. Bobot dan kandungan kimiawi karkas yang dihasilkan
mencerminkan aktivitas proses metabolisme yang terjadi selama pertumbuhan.
Disamping terjadi perubahan dan peningkatan bobot badan, selama
pertumbuhan terjadi pula pertumbuhan organ. Organ-organ tumbuh sesuai
dengan fungsinya, organ dalam yang berhubungan dengan pencernaan dan
metabolisme menunj ukkan perubahan bobot yang sesuai dengan status nutrien
dan fisiologis hewan. Kecepatan laju pertumbuhan relatif beberapa komponen
nonkarkas hampir sama dengan kadar laju pertumbuhan , misalnya abomasum dan
usus besar pertumbuhannya hampir bersamaan dengan tubuh. Usus kecil tumbuh
lebih cepat daripada usus besar dan abomasum. Adapun bobot rumen, retikulum,
dan omasum meningkat dengan cepat pada awal kehidupan pascalahir (Donovan
et al. 2004).
Seperti telah dikemukakan di atas, selama periode pertumbuhan pascalahir
terjadi perubahan komponen tubuh, salah satunya adalah tulang kerangka.
Tulang tumbuh lebih awal dibandingkan dengan pertumbuhan otot dan lemak.
Pertumbuhan kerangka akan me ngalami percepatan sampai pubertas, kemudian
mengalami penurunan hingga dewasa (Riggs et al. 2002). Tulang tumbuh secara kontinu dengan kecepatan laju pertumbuhan yang relatif lambat. Berdasarkan
laporan berbagai penelitian, pada hewan yang baru lahir, kerangka berkembang
relatif lebih baik daripada otot yang menyusun bagian terbesar dari proporsi bobot
hewan dewasa. Konsekuensinya, kehidupan hewan yang baru lahir
dikarakterisasikan dengan laju pertumbuhan yang relatif lebih tinggi pada kepala
dan kaki belakang. Secara rinci, perubahan pertumbuhan pada ternak disebabkan
oleh gelombang pertumbuhan dari tengkorak menuju ke bagian wajah lalu menuju
ke belakang ke bagian pinggang. Gelombang pertumbuhan kedua mulai dari kaki
mencapai pertumbuhan maksimumnya dan konsekuensinya merupakan bagian
tubuh hewan yang paling terakhir mencapai kedewasaan (Husni 1993). Variasi
pola pertumbuhan tulang selain dipengaruhi oleh status gizi, juga dipengaruhi
oleh faktor-faktor seperti genotipe dan status fisiologis (Veldhuis et al. 2005). Terjadinya proses pertumbuhan tulang akibat dari perkembangan sel-sel
tulang. Terdapat 4 jenis sel tulang, yaitu jenis pertama sel osteoprogenitor yang
merupakan populasi sel induk, yang berkembang dari mesenkim yang memiliki
daya mitotik dan kemampuan untuk berkembang menjadi sel tulang dewasa. Ada
2 tipe sel osteoprogenitor, yaitu preosteoblas yang menghasilkan osteoblas, dan
preosteoklas yang menghasilkan osteoklas. Jenis kedua adalah osteoblas yang
berhubungan dengan pembentukan tulang yang ditemukan pada permukaan
tulang, yaitu tempat matriks tulang ditambahkan. Jenis ketiga adalah osteosit atau
sel tulang adalah osteoblas yang terpendam dalam matriks tulang. Jenis keempat
adalah osteoklas, yaitu sel raksasa berinti banyak dan jumlah anak intinya sangat
bervariasi yang terdapat dekat pada permukaan tulang (Leeson et al. 1996; Manolagas 2000).
Memperhatikan lokasinya, jaringan pembentuk tulang mengandung
osteoblas yang dilepaskan oleh jaringan osteoid yang akan mengalami kalsifikasi
di bawah pengaruh enzim fosfatase dan dinamakan pusat osifikasi. Lingkungan
tempat tulang terbentuk menentukan tipe osifikasinya. Pembentukan tulang yang
terjadi pada waktu fetus kebanyakan dikembangkan dengan tipe osifikasi
endokondral dan pada saat itu kartilago mengalami mineralisasi, kemudian
digantikan perlahan- lahan dengan jaringan tulang. Tulang panjang dapat
melanjutkan pertumbuhan panjangnya jika kartilago antara epifisis dan diafisis
melanjutkan pertumbuhannya. Jika semua kartilago ini telah berubah menjadi
tulang, pertumbuhan panjangnya tidak mungkin terjadi. Tulang panjang
bertambah diameternya dengan memproduksi tulang baru dari periosteum sekitar
korteks tulang, sebagai tulang yang baru dilepaskan bagian tulang yang terdalam
dirangsang untuk menambah ukuran rongga sumsum (Hunziker 1994; Abad et al. 2002).
Seperti diketahui, tulang adalah jaringan hidup dengan matriks protein
kalsium. Protein dalam serabut-serabut kolagen yang membentuk matriks tulang
sangat kompleks. Jumlah protein dan mineral harus tersedia dalam jumlah yang
memadai untuk mempertahankan struktur tulang yang normal. Selama hidup,
mineral di dalam kerangka secara aktif dipertukarkan, dan tulang secara konstan
diresorpsi dan dibentuk kembali. Di dalam tulang hewan yang sedang tumbuh,
material anorganik secara normal lebih rendah daripada material organik
sedangk an kandungan airnya lebih besar. Adapun komposisi proksimat dari
tulang adalah air, mineral, protein, dan lemak secara berturut-turut sebesar 45%,
25%, 20%, dan 10%. Mineral tulang mammalia diperkirakan terdiri atas kalsium,
fosfor, magnesium secara berturut-turut 36%, 17%, dan 0.8%; dan sejumlah kecil
mineral lainnya. Tulang mempunyai suatu kondisi metabolisme yang sangat aktif
dalam hubungannya dengan fase penggantian mineral. Beberapa hasil
perhitungan menunjukkan bahwa kira-kira 99% Ca dan 80% P pada tubuh
sebagian besar terdapat di dalam tulang dan proporsi yang kecil ada di dalam gigi.
Perbandingan Ca dengan P di dalam mineral tulang adalah sekitar 2 : 1 (Yakar
dan Rosen 2003; Rosen 2003).
Menyinggung peranan faktor hormon, aktivitasnya di dalam pertumbuhan
bergantung pada beberapa faktor yang melibatkan suplai makanan, potensi
genetik, dan lingkungan. Secara langsung maupun tidak langsung
hormon-hormon tersebut dapat mengubah reaksi biokimia yang berkaitan dengan proses
pertumbuhan dan perkembangan komponen tubuh. Hormon diproduksi oleh suatu
kelenjar tertentu di dalam tubuh dan berpengaruh pada bagian tubuh lainnya
secara terkoordinir. Penyebaran hormon dari tempat produksi sampai ke bagian
anggota tubuh berlangsung tanpa melalui saluran khusus, tapi melalui aliran darah
(Hartman 2000).
Hormon yang mempengaruhi pertumbuhan dapat dibagi menjadi dua
kelompok, yaitu kelompok anabolik antara lain somatotropin, testosteron, dan
tiroksin dan kelompok katabolik antara lain estrogen. Hormon yang berpengaruh
secara langsung pada pertumbuhan, antara lain adalah somatotropin, tiroksin,
androgen, estrogen, dan glukokortikoid. Hormon-hormon tersebut mempengaruhi
pertumbuhan, termasuk pertumbuhan tulang dan metabolisme nitrogen (Robson et
Pada prinsipnya kerja hormon tidak berdiri sendiri-sendiri dan hormon yang
terkenal dengan aktivitas pertumbuhan dikenal dengan nama somatotropin
(growth hormone). Somatotropin merupakan hormon yang disekresikan oleh pituitari anterior dengan kontrol hipotalamus (Coschigano et al. 2002). Hormon ini disintesis oleh sel-sel somatotrof, berupa polipeptida tunggal dengan massa
molekul 22 kDa. Secara umum target utama somatotropin adalah hati dan
pengaruh utamanya adalah pada laju metabolisme, komposisi tubuh, serta sekresi
IGF-I (Tollet-Egnell et al. 2001; Rieusset et al. 2004). Somatotropin mengatur dan mengubah reaksi biokimia yang berkaitan dengan proses pertumbuhan dan
perkembangan komponen tubuh dan bekerja pada sel-sel target melalui ikatan
reseptor somatotropin yang spesifik yang berada dalam permukaan sel seperti hati,
otot, tulang, dan jaringan adiposa (Hartman 2000). Somatotropin yang dihasilkan
oleh pituitari sebelumnya telah dianggap atau diduga hanya mempunyai aktivitas
pemacu pertumbuhan secara umum, sebagaimana tercermin dari namanya yang
umum dikenal sebagai somatotropin. Somatotropin memainkan peranan fisiologis
dalam pengaturan metabolisme karbohidrat, protein, dan lemak. Akan tetapi,
pengaruh hormon tersebut sangat rumit dan sangat bervariasi dengan keadaan
tempat percobaan dilakukan dan sampai ke keadaan tertentu, dengan spesies yang
digunakan (Manalu 1994).
Somatotropin yang disekresikan berada di bawah kontrol dua hormon
hipotalamus, yaitu growth hormone-relasing factor (GHRF) atau dikenal juga dengan somatokrinin dan somatotropin releasing-inhibitory factor (SRIF) atau somatostatin. Fungsi GHRF adalah merangsang sekresi somatotropin, sedangkan
somatostatin menghambat pelepasan somatotropin dari kelenjar pituitari. Kedua
hormon ini disekresikan oleh neuron sekretoris dalam hipotalamus ke dalam
pembuluh darah portal pituitari (Hartman 2000; Drake et al. 2001).
Neurotransmiter dan neuropeptida mengontrol sekresi somatotropin secara
langsung pada somatotrof atau secara tidak langsung melalui jalur hipotalamik.
Neurotransmiter ini meliputi adenylate cyclase activating polypeptide (PACAP),
intestinal peptide, gastrin, neurotensin, substance P, calcitonin, neuropeptide Y, vasopressin, dan corticotropin-releasing hormone (Franklin dan Ferry 2006).
Telah diketahui paling tidak ada tiga macam bentuk somatotropin yang
dikenal selama ini. Bentuk ya ng pertama mempunyai 191 asam amino dengan
bobot molekul 22 kDa dan bentuk ini yang paling banyak ditemukan dalam
kelenjar pituitari. Bentuk ini mengandung dua jembatan disulfida dalam molekul
somatotropin, yang satu menghubungkan asam amino (asam amino 53 dan 165
pada ma nusia) yang membentuk suatu lengkung besar dan yang lain dekat
terminal atau ujung karboksil dari peptida (asam amino 182 dan 189) membentuk
suatu lengkung yang kecil. Bentuk hormon yang kedua mempunyai urutan
asam amino yang sama seperti asam amino yang pertama kecuali hilangnya 15
asam amino (nomor 32-46) dari terminus asam molekul tersebut. Bentuk ini
mempunyai bobot molekul 20 kDa dan menempati sekitar 10-15% dari hormon
yang ada di pituitari. Bentuk yang ketiga dibentuk dari dimerisasi 2 bentuk
peptida 22 kDa yang dihubungkan dengan ikatan disulfida antarrantai dan
mempunyai bobot molekul 45 kDa dan banyaknya sekitar 1% dari jumlah hormon
pituitari. Perbedaan bentuk struktur somatotropin ini menyebabkan perbedaan
dalam fungsi biologis. Somatotropin dengan bentuk 20 kDa mempunyai ikatan
yang kurang efektif dibandingkan dengan bentuk 22 kDa terhadap reseptor hati
dan kelenjar mammae meskipun kedua bentuk somatotropin ini merangsang
pertumb uhan (Sodhi dan Rajput 2001).
Somatotropin bekerja di permukaan membran sel karena merupakan
molekul peptida dengan reseptornya yang disebut growth hormone receptor
(GHR). Ada dua macam reseptor somatotropin yang berafinitas tinggi dan
rendah, namun ya ng berafinitas tinggi sangat penting karena dikaitkan dengan
pertumbuhan. Reseptor somatotropin adalah suatu glikoprotein berantai tunggal
yang mempunyai 620 asam amino dengan domain ekstraseluler yang luas (246
residu asam amino), domain transmembran tunggal (24 residu) dan domain
Oleh karena somatotropin adalah hormon peptida, reseptornya ada di
permukaan sel yang merupakan superfamili dari reseptor sitokinin. Pada
prinsipnya, ikatan antara somatotropin dengan reseptornya mengakibatkan
aktivasi ensim seperti fosforilasi yang dilakukan oleh enzim kinase dengan cara
memindahkan atau menambahkan gugus fosfat. Hal ini mengakibatkan timbulnya
reaksi intrasel sehingga berpengaruh pada metabolisme dan fungsi sel (Granner
2003). Pengikatan hormon somatotropin akan menyebabkan dimerisasi dua buah
reseptor somatotropin. Akibat pengikatan ini terjadi aktivasi enzim tirosin kinase
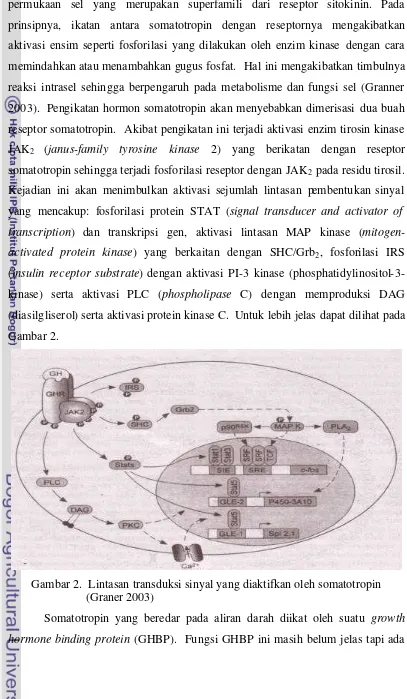
JAK2 (janus-family tyrosine kinase 2) yang berikatan dengan reseptor somatotropin sehingga terjadi fosforilasi reseptor dengan JAK2 pada residu tirosil.
Kejadian ini akan menimbulkan aktivasi sejumlah lintasan pembentukan sinyal
yang mencakup: fosforilasi protein STAT (signal transducer and activator of transcription) dan transkripsi gen, aktivasi lintasan MAP kinase ( mitogen-activated protein kinase) yang berkaitan dengan SHC/Grb2, fosforilasi IRS (insulin receptor substrate) dengan aktivasi PI-3 kinase (phosphatidylinositol-3-kinase) serta aktivasi PLC (phospholipase C) dengan memproduksi DAG (diasilgliserol) serta aktivasi protein kinase C. Untuk lebih jelas dapat dilihat pada
Gambar 2.
Gambar 2. Lintasan transduksi sinyal yang diaktifkan oleh somatotropin (Graner 2003)
yang berpendapat bahwa GHBP meningkatkan waktu paruh somatotropin,
memodifikasi distribusinya, mengurangi efek biologis somatotropin pada
preadiposit dan mengurangi efek biologis dari pulsatil sekresi somatotropin
dengan mengurangi somatotropin bebas selama pulsa sekretori.
Selain somatotropin, ada istilah somatomedin yang ditujukan untuk
mencerminkan kemampuan suatu unsur untuk memperantarai pengaruh
somatotropin. Somatomedin terdiri atas beberapa subtipe, salah satunya adalah
somatomedin C. Setelah dikenalkan dengan istilah somatomedin, kemudian
berganti dan didalilkan menjadi IGF-I (insulin-like growth factor-I) dan IGF-II (insulin-like growth factor-II). Kedua unsur tersebut dimasukkan ke dalam golongan seperti insulin karena kemampuannya untuk merangsang pengambilan
glukosa ke dalam otot dan sel lemak. Di dalam serum, sebagian besar IGF adalah
kompleks molekul berbobot 150 kDa yang mencakup IGFBP-3 (insulin-like growth factor binding protein-3) dan ALS (acid labile subunit) (Yakar et al. 2002). Pada awalnya IGF ditemukan sebagai tiga aktivitas biologis terpisah
dalam serum, yaitu sulfation factor activity (SFA) oleh Salmon dan Daughaday pada tahun 1957, non-suppressible insulin-like activity (NSILA) oleh Froesch et al pada tahun 1963, dan multiplication stimulating activity (MSA) oleh Pierson dan Temin pada tahun 1972. Somatomedin C dan IGF-1 adalah dua penamaan
untuk peptida yang sama sedangkan somatomedin A adalah IGF-II. Penggantian
istilah somatomedin menjadi IGF menyusul purifikasi dua polipeptida yang sama
untuk somatomedin A dan C dengan NSILA dan aktivitasnya yang
mempromosikan pertumbuhan dari serum manusia (Kamil et al. 2001).
Aktivitas biologis IGF bergantung pada reseptor IGF yang spesifik yang ada
pada sel target. Ada dua jenis reseptor IGF, reseptor tipe I merupakan suatu
glikoprotein dengan bobot molekul antara 300 - 350 kDa. Reseptor ini terdiri atas
dua subunit ekstrasellular dengan bobot molekul 130 kDa dan dua subunit B
transmembran dengan bobot molekul 95 kDa. Reseptor IGF ini baik dalam
struktur atau fungsinya sejenis dengan reseptor insulin. Sekalipun mempunyai
persamaan dalam afinitas ikatan, keterikatannya berbeda, afinitas reseptor IGF-I
kurang lebih 1 nM atau 2010 kali lebih rendah untuk IGF-II dan 100-500 kali
perkembangan, berdasarkan informasi hasil penelitian ternyata sudah tampak pada
fetus dan tetap tinggi selama pascalahir dan kemudian menurun ketika menuju ke
tingkat dewasa. Tipe II atau reseptor IGF-II adalah polipeptida rantai tunggal
dengan bobot molekul 250 kDa yang disebut dengan reseptor mannosa-6-fosfat.
Tipe ini secara struktural tidak berkaitan dengan reseptor IGF-I atau insulin.
Reseptor ini mengikat IGF-II dengan afinitas yang lebih tinggi daripada IGF-I dan
tidak dengan insulin (Hartman 2000).
IGF-I merupakan salah satu hormon yang berpotensi pada proses
pertumbuhan. Hal ini dikarenakan IGF-I mempunyai peranan yang penting dalam
pengaturan metabolisme sel mammalia, pertumbuhan, dan diferensiasi (Shen et al. 2002; Kiepe et al. 2005). Sintesis dan konsentrasi IGF-I dalam plasma sangat dipengaruhi oleh somatotropin. IGF-I yang ada di darah sekitar 55% diproduksi
oleh hati, oleh karena itu, tempat ini dianggap sebagai tempat utama produksi
IGF-I. Kondisi perawatan dengan penyuntikan somatotropin akan meningkatkan
konsentrasi IGF-I di dalam darah (Vestergaard et al. 2003; Rausch et al. 2002). Lebih lanjut le vel IGF-I dalam jaringan berbagai organ seperti hati, ginjal,
paru-paru, otot, dan testis bergantung pada somatotropin, dengan derajat
ketergantungannya bervariasi antarorgan. Peningkatan level reseptor
somatotropin berkaitan dengan peningkatan konsentrasi IGF-I dalam plasma dan
peningkatan IGF-I ini diasosiasikan dengan peningkatan bobot badan (Shen et al. 2002). Selain itu, hormon kelamin juga mempengaruhi konsentrasi IGF-I dalam
plasma. Hewan jantan mempunyai IGF-I lebih tinggi dibandingkan pada hewan
betina. Pubertas pada hewan betina ditandai dengan permulaan estrus pertama
yang diasosiasikan dengan peningkatan IGF-I dalam plasma. Kejadian pubertas
yang diiringi dengan peningkatan IGF-I telah diteliti pada hewan lain. Hasil
penelitian menunjukkan peningkatan level IGF-I pada plasma hewan yang diberi
perlakuan estrogen sewaktu mengalami pubertas. Hal ini terjadi karena
peningkatan sirkulasi steroid seks (Hartman 2000).
Peningkatan bobot badan yang diakibatkan penyuntikan somatotropin secara
eksogen juga disertai peningkatan deposisi protein. Hal ini terjadi karena
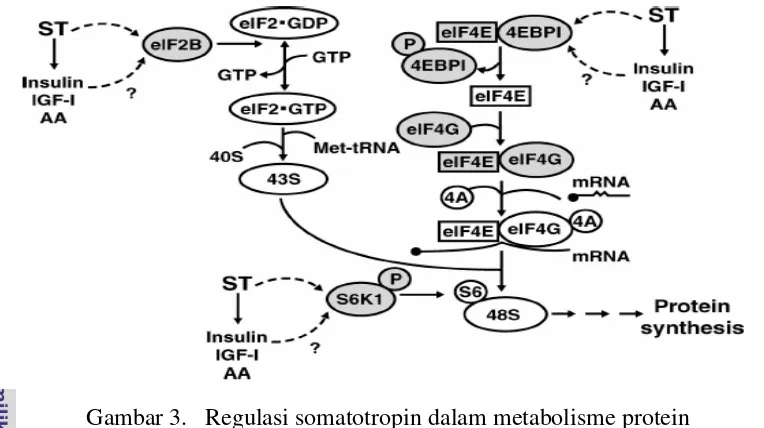
dan yang menjadi regulator utama proses sintesis protein adalah proses inisiasi.
Sebagian besar studi menunjukkan bahwa translasi inisiasi meregulasi dua
langkah penting, yaitu pertama pengikatan met-tRNAi (initiator methionyl tRNA) pada 40 subunit ribosom yang dimediasi oleh eukaryotic initiation factor (eIF)2 sehinggga membentuk formasi 43 subunit ribosom preinisiasi kompleks.
Pengikatan met-tRNAi pada 40 subunit ribosom yang dimediasi oleh (eIF)2
sebelumnya merupakan modulasi aktivitas eIF2B dengan melibatkan pertukaran
GDP (Guanosine diphosphate) menjadi GTP (Guanosine triphosphate) dalam eIF2. Yang kedua adalah pengikatan me t-tRNAi pada 43 subunit ribosom
prainisiasi kompleks yang melibatkan kumpulan kompleks protein eukaryotic initiation factor (eIF) 4E (Davis et al. 2004).
Selanjutnya regulasi eIF4E akan berasosiasi dengan 4E-BP1 (4E-Binding
Protein 1) suatu represor protein, yang berkompeten dengan eIF4G untuk
pengikatan fosforilasi kompleks 4E-BP1. Hasilnya akan menurunkan afinitas
eIF4E terhadap 4E-BP1 dan kemudian melepaskan eIF4E ke dalam kompleks
aktif eIF4E-eIF4G. Regulasi kejadian ini mungkin melalui jalan
phosphatydilinositol 3 kinase (PI-3-kinase) atau S6K1 (ribosomal protein S6 kinase 1) (Gingras et al. 2001; Davis et al. 2004).
Secara umum dijelaskan bahwa inisiasi sintesis protein mengharuskan
dipilihnya suatu molekul mRNA oleh ribosom yang dibagi atas beberapa tahap,
yaitu disosiasi ribosom menjadi subunit 40S dan 60S, pengikatan met-tRNA,
GTP, dan eIF-2 pada ribosom 40S ya ng membentuk kompleks prainisiasi,
pengikatan mRNA pada kompleks prainisiasi 40S, dan penggabungan kompleks
inisiasi 40S dengan subunit ribosom 60S untuk membentuk kompleks inisiasi 80S
(Granner 2003). Adapun gambaran tentang regulasi somatotropin dalam
metabolisme protein yang melibatkan proses inisiasi, elongasi, dan terminasi
Gambar 3. Regulasi somatotropin dalam metabolisme protein (Davis et al. 2004).
Selain hal di atas, fungsi somatotropin dalam metabolisme tubuh yang
penting adalah meningkatkan kecepatan sintesis protein di semua sel tubuh.
Peningkatan ini terjadi karena somatotropin mampu mempercepat pengangkutan
asam amino melalui dinding sel ke dalam sitoplasma sehingga dapat menambah
konsentrasi asam amino di dalam sel. Di lain pihak, somatotropin juga mampu
meningkatkan pembentukan RNA dalam inti sel sehingga dapat mendorong
proses transkripsi dan translasi dalam ribosom di dalam sitoplasma sel. Keadaan
ini yang menyebabkan kemungkinan terjadinya sintesis protein yang lebih cepat
dalam sel dan dorongan proses mitosis yang diikuti oleh pertambahan jumlah sel
sehingga mempercepat pertumbuhan jaringan di berbagai bagian tubuh (Davis et al. 2004).
Peningkatan bobot badan yang disertai peningkatan deposisi protein akibat
penyuntikan somatotropin ternyata berlawanan dengan kondisi pada jaringan
lemak. Berbagai penelitian sampai saat ini dengan jelas menunjukkan bahwa
somatotropin mempunyai pengaruh negatif yang kuat pada metabolisme yang
mengkontrol pertumbuhan jaringan adiposa. Somatotropin memainkan peranan
penting pada proses fisiologis yang berbeda-beda sehingga lebih banyak nutrien
dari bahan makanan yang dapat digunakan untuk pertumbuhan jaringan, dan di
lain pihak sedikit nutrien terutama glukosa yang digunakan pada jaringan adiposa.
lemak (Etherton 2000). Selain itu, somatotropin mempunyai efek yang spesifik
pada asam lemak pada jaringan adiposa, yakni meningkatkan oksidasi asam lemak
sehingga dengan sendirinya menurunkan sintesis lemak yang pada gilirannya akan
terjadi peningkatan kadar asam lemak bebas yang beredar dalam darah.
Ditambahkan pula bahwa somatotropin meningkatkan perubahan asam lemak
menjadi asetil KoA sehingga baik untuk keperluan energi. Pada penelitian invitro
dan in vivo, pemberian somatotropin secara dramatis mengurangi sintesis asam lemak di dalam jaringan adiposa. Pada babi yang sedang bertumbuh, tingkat
sintesis de novo dapat dikurangi lebih dari 90%, sedangkan pengaruhnya pada tingkat lipolisis adalah kecil (Dunshea et al. 1992; Etherton dan Bauman 1998).
Pengaruh penyuntikan somatotropin pada lipogenesis tampak seperti aksi
langsung. Hal ini terlihat pada penelitian in vivo yang mana pengaruh somatotropin terjadi secara berkesinambungan pada kultur jaringan adiposa
(Etherton et al. 1993). Salah satunya adalah somatotropin mampu mengatur respons jaringan terhadap pengaruh insulin (Etherton dan Smith 1991; Etherton et al. 1993; Rhoads et al. 2004). Selanjutnya, pengurangan kepekaan insulin akibat mekanisme somatotropin berdampak pada penurunan pengangkutan glukosa,
aktivitas enzim lipogenik, ekspresi gen enzim lipogenik, dan lipogenesis (Etherton
dan Bauman 1998). Dampak ini hanya terjadi pada jaringan adiposa, sementara
pada otot relatif tidak terpengaruh (Wray-Cahen et al. 1995; Etherton dan Bauman 1998). Konsekuensi pengendalian insulin merupakan proses yang luar bia sa di
dalam pemanfaatan nutrien. Hal ini dikarenakan sebagian besar glukosa untuk
sintesis lipid di dalam jaringan adiposa dapat dialihkan ke otot. Selanjutnya,
glukosa yang dialihkan ke otot akan digunakan sebagai energi tambahan untuk
mendukung peningkatan sintesis protein otot (Etherton 2000).
Penurunan kepekaan insulin yang disebabkan oleh somatotropin di dalam
jaringan adiposa tidak dihubungkan dengan perubahan jumlah reseptor insulin
atau aktivitas tirosin kinase reseptor insulin (Magri et al. 1990). Hal ini sesuai dengan fakta yang terjadi pada babi yang menunjukan pengaruh insulin di dalam
Penyuntikan somatotropin berakibat meningkatnya bobot badan,
peningkatan bobot badan ini menggambarkan peningkatan massa tubuh. Adapun
massa tubuh itu terdiri atas beberapa mineral (Azain et al. 1995). Mineral di dalam pertumbuhan bertindak sebagai komponen yang berhubungan dengan
sistem enzim dalam metabolisme karbohidrat dan protein, antara lain dalam
proses pertumbuhan dan perkembangan, sintesis kolagen dan elastin, integritas
jaringan epitel, perbaikan sel, dan mekanisme pengambilan dan pemanfaatan
vitamin (Johnson dan Swenson 2000). Dalam proses pertumbuhan dan
perkembangan diperlukan kerja sama sistem endokrin dan parakrin yang ditujukan
untuk mencapai pertumbuhan dan perkembangan yang optimal. Pertumbuhan dan
perkembangan yang meningkat akan disertai dengan peningkatan kandungan
mineral tubuh.
Glikogen merupakan bentuk simpanan karbohidrat yang utama di dalam
tubuh hewan. Unsur ini terutama terdapat di dalam hati (sampai 6%) dan otot
yang jarang melampaui jumlah 1%. Namun karena massanya yang jauh lebih
besar, jumlah simpanan glikogen dalam otot bisa mencapai 3 hingga 4 kali
jumlahnya dalam hati (Mayes 2003). Somatotropin umumnya menekan pengaruh
insulin. Hiperglikemia sesudah pemberian somatotropin merupakan kombinasi
akibat penurunan pemakaian glukosa dalam jaringan perifer dengan peningkatan
produksi glukosa dalam hati melalui proses glukoneogenesis. Dalam hati,
somatotropin akan meningkatkan jumlah glikogen, dan peristiwa ini mungkin
terjadi akibat aktivasi proses glukoneogenesis asam amino (Graner 2003; Ganong
2002). Pada hewan, penyuntikan somatotropin akan mengakibatkan pengambilan
glukosa oleh sel meningkat dan konsentrasi glukosa darah sedikit berkurang.
Akan tetapi, apabila sel menjadi jenuh oleh glikogen dan penggunaan glukosa
untuk energi berkurang, pengambilan glukosa akan menurun (Guyton 1995).
Peningkatan bobot badan pada hewan yang disuntik somatotropin selalu
disertai dengan peningkatan pertumbuhan tulang. Proses ini diatur oleh hormon
sistemik dan faktor parakrin atau autokrin, dan somatotropin bertindak sebagai
regulator utama proses selama perkembangan dan pertumbuhan tulang, disamping
Aksi somatotropin terhadap jaringan tulang dapat secara langsung atau
melalui dua perantara, yaitu IGF-I dan IGF-II. Peran IGF-II setelah kelahiran
kurang jelas, namun saat ini terbukti secara substansial IGF-I dan IGF-II berperan
secara komplementer dan unik dalam mengatur pertumbuhan tulang (Reinecke et al. 2000; van der Eerden et al. 2003).
Penelitian yang terbaru tentang mekanisme selular dari kerja somatotropin
dalam mengatur pertumbuhan tulang menyatakan bahwa somatotropin
merangsang pertumbuhan tulang longitudinal secara langsung dengan cara
merangsang prekondrosit di dalam lempeng pertumbuhan yang diikuti oleh
perluasan klonal, dan proses itu dapat diakibatkan baik melalui produksi IGF-I
lokal maupun oleh induksi somatotropin yang meningkatkan sirkulasi IGF-I
(Ohlsson et al. 1998), selanjutnya sel-sel di dalam zona hipertrofi menjadi matang dan secepatnya disatukan ke dalam tulang. Selain itu, somatotropin dapat
merangsang pertumbuhan tulang rawan dan jaringan lainnya dengan terus
meningkatkan banyaknya sel dibandingkan meningkatkan ukuran sel (Ohlsson et al. 1998).
Menurut hipotesis somatomedin yang asli, somatotropin merangsang
pertumbuhan tulang kerangka dengan merangsang hati untuk memproduksi
somatomedin (IGF-I) yang pada gilirannya dengan cara endokrin akan
merangsang pertumbuhan tulang longitudina l. Pada awal tahun 1980-an hipotesis
somatomedin ditentang oleh penelitian yang mempertunjukkan suntikan
somatotropin secara langsung ke dalam lempeng pertumbuhan tulang tibia tikus
yang menyebabkan perangsangan pertumbuhan tulang longitudinal di area
suntikan. Selanjutnya, dari hasil pengamatan ini ditetapkan bahwa somatotropin
merangsang pertumbuhan berbagai jaringan yang berbeda secara langsung
(Vikman et al. 1991; Kassem et al. 1993; Lewinson et al. 1993; Etherton 2004). Pada penelitian dengan menggunakan 3T3 preadiposit, tampak somatotropin dan
IGF-I bekerja pada sel pada tahap-tahap pematangan yang berbeda. Somatotropin
ditemukan merangsang preadiposit muda, sedangkan IGF-I merangsang sel pada
langkah pengembangan berikutnya, selanjutnya dari hasil ini dihipotesiskan
bahwa somatotropin bekerja pada sel progenitor dan selanjutnya IGF-I berperan
Penemuan yang menyatakan somatotropin merangsang pertumbuhan tulang
longitudinal secara langsung dan meningkatkan produksi IGF-I lokal dengan
merangsang transkripsi gen IGF-I menghasilkan suatu pernyataan bahwa dual effector theory dari aksi somatotropin adalah valid pada regulasi pertumbuhan tulang longitudinal (Ohlsson et al. 1994).
Penyuntikan somatotropin mengakibatkan peningkatan panjang tulang yang
disertai dengan peningkatan bobot tulang. Peningkatan bobot tulang kerangka
dengan formasi tulang baru yang disebabkan oleh somatotropin pertama kali
ditunjukkan pada anjing dewasa, setelah dilakukan penyuntikan dengan
somatotropin selama 3 bulan yang menghasilkan peningkatan bobot tulang
kortikal sebesar 2% (Ohlsson et al.1998). Selain itu, somatotropin mempengaruhi perubahan model tulang dengan cara mengatur keseimbangan antara resapan dan
formasi tulang (Bouillon 1991; Eriksen et al. 1993; Eriksen et al. 1996).
Penyuntikan somatotropin meningkatkan sintesis protein pada sel somatik
sehingga dengan sendirinya mempengaruhi pembentukan kolagen. Seperti kita
ketahui, tulang adalah jaringan hidup dengan matriks protein kolagen yang telah
diresapi oleh garam- garam mineral. Kolagen adalah protein yang paling
berlimpah di dalam tulang. Beberapa elastin dan retikulin terdapat dalam jumlah
yang lebih kecil. Lebih dari 90% kandungan yang terdapat pada bagian tulang
organik adalah kolagen. Tulang rawan dan jaringan konektif membran,
mengandung kolagen dan polisakarida, dan merupakan matriks organik yang
mengalami proses diosifikasi menjadi tulang. Umur berkaitan dengan perubahan
di dalam ukuran, kepadatan, dan mungkin jumlah serabut kolagen. Kolagen dari
sumber yang berbeda memperlihatkan variasi yang luas dalam daya larutnya.
Kolagen mammalia dan aves sebagian besar mengandung hidroksiprolin dan
prolin lebih tinggi dan sedikit metionin, serin, dan treonin dibandingkan dengan
kolagen ikan. Serabut kolagen tulang dikemas lebih rapat dibandingkan dengan
jaringan lain yang ada di dalam tubuh. Unsur dasar serabut kolagen ditandai oleh
kehadiran protein polisakarida yang mengandung heksosamin yang dihasilkan
dari proses degradasi dan beberapa tipe komponen kondroitin sulfat yang terdiri
Protein dalam serabut-serabut kolagen yang membentuk matriks tulang
sangat kompleks. Kolagen adalah protein struktural yang secara alami berbentuk
serat, yang tersusun atas 25 - 30% total protein tubuh hewan. Kolagen ini
disintesis pada semua tipe sel dan didepositkan pada semua tipe jaringan. Jumlah
dan kekuatan kolagen dapat meningkat sesuai dengan pertambahan umur
(Soeparno 1992). Susunan kimiawi kolagen menunjukan bahwa ada lima tipe
kolagen yang secara genetik berbeda (Leeson et al. 1996), antara lain tipe I merupakan tipe kolagen yang paling banyak ditemui yang meliputi kurang lebih
90% kolagen tubuh. Kolagen ini berada pada dermis kulit, tendon, tulang, gigi,
dan pada hakekatnya terdapat di semua jaringan penyambung. Sel-sel yang
berperan dalam sintesis kolagen tipe I adalah fibroblas, osteoblas dan odontoblas.
Selanjutnya tipe II, yaitu kolagen dibentuk oleh kondroblas yang merupakan
unsur utama matriks tulang rawan. Kolagen lainnya adalah tipe III. Kolagen tipe
ini ditemukan pada awal perkembangan beberapa jenis jaringan pembangun yang
kemudian sebagian besar digantikan oleh kolagen tipe I. Pada keadaan dewasa,
kolagen ini terdapat dalam jaring- jaring retikular yang berhubungan dengan kulit,
pembuluh darah, uterus, dan saluran pencernaan. Pada jaringan kulit, kolagen ini
dibentuk oleh fibroblas. Selanjutnya tipe IV yang terdapat dalam lamina basal.
Tipe yang terakhir adalah tipe V. Pada tipe ini susunannya membentuk lamina
tipis yang tidak bergurat di bawah membran fetus. Setiap tipe kolagen
mengandung hidroksiprolin, hidroksilisin, glikosilasi hidroksilisin, dan komposisi
molekul yang berbeda (Lawrie 1995).
Penyuntikan somatotropin akan memberikan nilai lebih dalam
memodifikasi prokolagen tipe III, dalam perkembangannya prokalagen tipe III
akan berubah menjadi tipe I (Longorbadi et al. 2000). Selanjutnya, penyuntikan somatotropin dalam waktu yang panjang pada usia lanjut akan mempengaruhi
metabolisme tulang karena mempengaruhi kadar IGF-I dan IGF-I inilah yang
memacu sel-sel prekursor osteoblast sebagai salah satu sel yang berperan dalam
BAHAN DAN METODE PENELITIAN
Bahan dan Alat Penelitian
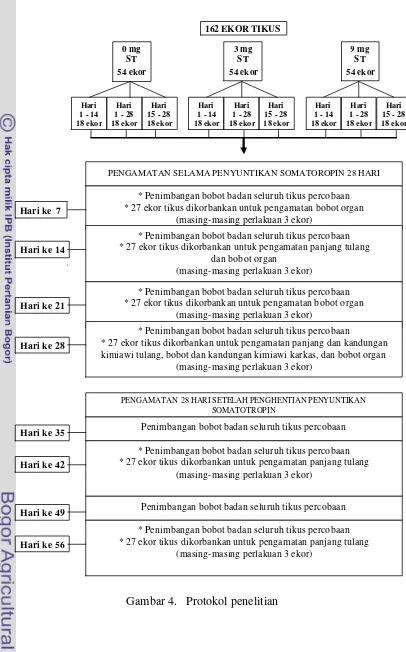
Hewan coba yang digunakan pada penelitian ini adalah tikus jantan (Rattus norvegicus) galur Sprague-Dawley (SD) berumur 2 minggu sebanyak 162 ekor yang pengaturan jumlah setiap perlakuan disesuaikan dengan protokol penelitian
dan ditempatkan dalam kandang individu. Tikus galur Sprague-Dawley (SD)
memiliki cir i-ciri antara lain: warna albino putih, ukuran kepala kecil, panjang
ekor lebih panjang dibandingkan dengan badan. Adapun data fisiologisnya antara
lain: bobot badan dewasa jantan 300 – 800 g dan betina 250 – 450 g, bobot lahir
5 – 6 g, bobot pubertas 150 – 200 g, dan umur pubertas 7 - 8 minggu (Pass dan
Freeth 1993).
Tikus dibiasakan untuk hidup di kandang percobaan dengan pemberian
pakan dan air serta pemeliharaan yang sesuai dengan jadwal yang telah
ditentukan. Pakan yang disuguhkan adalah pakan komersil berupa butiran dengan
kode 594 buatan dari PT Charoen Pokphand yang diberikan secara bertahap agar
terbiasa hingga mencapai jumlah yang sesuai dengan kebutuhannya.
Hormon yang digunakan dalam penelitian ini adalah bovine somatotropin
(bST) dan untuk penyuntikan tikus kontrol digunakan minyak wijen (sesame oil). Alat-alat bantu yang digunakan pada penelitian ini antara lain: alat timbang,
alat Rontgen dan Fluoroskopi Siremobile (Siemens), alat ukur panjang, dan
alat-alat bantu lainnya yang dipergunakan sesuai dengan fungsinya.
Metode Penelitian
Penelitian penyuntikan somatotropin, analisis fisik, dan analisis kandungan
kimiawi karkas dan tulang dimulai bulan Agustus 2005 sampai dengan Agustus
2006 yang dilakukan di Laboratorium Fisiologi, Departemen Anatomi, Fisiologi,
dan Farmakologi, Rumah Sakit Hewan Fakultas Kedokteran Hewan, dan
Laboratorium Kimia Pusat Antar Universitas (PAU) Institut Pertanian Bogor.
Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan
somatotropin: 0, 3, dan 9 mg/kg bobot badan/ekor/hari dan faktor kedua adalah
periode penyuntikan yang tersarang di dalam faktor dosis yang terdiri atas tiga
periode penyuntikan mulai hari penelitian ke 1 – 14, ke 1 – 28, dan ke 15 – 28.
Data yang dikumpulkan dianalisis dengan menggunakan model persamaan
matematika sebagai berikut:
Yijk = µ + α i + βj(i) + εijk
Keterangan: Yijk = respons ke-I, waktu ke-j, dan ulangan ke-k
µ = rataan populasi
α i = dosis ke- i
βj(i) = waktu ke-j dalam dosis ke- i
εijk = pengaruh galat
Data yang diperoleh dari pengukuran dianalisis dengan menggunakan program
komputer Minitab (version 13.20).
Mula- mula tikus diadaptasikan dengan lingkungan selama 1 minggu. Pakan
dan minum disediakan ad libitum. Penyuntikan somatotropin dilakukan pada saat tikus mulai berumur 3 minggu secara intramuskuler pada bagian paha belakang.
Seluruh tikus (sebanyak 162 ekor) dibagi ke dalam tiga kelompok dosis
somatotropin, yaitu 0 (kontrol disuntik sesame oil sebanyak 1 mL/ekor/hari), 3
mg, dan 9 mg masing- masing sebanyak 54 ekor. Setiap kelompok dosis dibagi
tiga sesuai dengan periode penyuntikan, yaitu hari ke 1 – 14, hari ke 1 – 28, dan
hari ke 15 – 28 masing- masing sebanyak 18 ekor. Penyuntikan somatotopin
sesuai dengan rancangan percobaan yang dilakukan selama periode 28 hari.
Setelah periode penyuntikan, sebagian tikus percobaan dipelihara tanpa
penyuntikan somatotropin selama 28 hari berikutnya. Protokol penelitian
penyuntikan somatotropin disajikan pada Gambar 5.
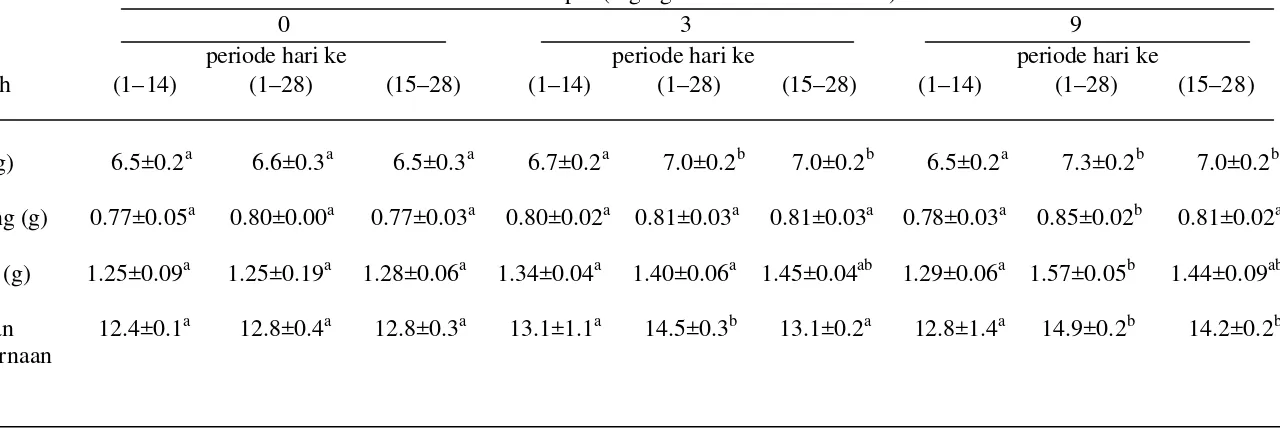
Peubah yang Diamati dan Teknik Peng ukurannya Penampilan Tubuh
1. Bobot Badan
Penimbangan bobot badan dilakukan setiap minggu dengan cara
memasukkan tikus ke dalam kandang khusus yang selanjutnya ditimbang.
Pengukuran bobot badan tikus = bobot tikus dan kandang timbang – bobot
2. Konsumsi Pakan
Konsumsi pakan didapat dari jumlah pakan yang diberikan dikurangi
dengan pakan sisa yang diukur dalam satuan gram per hari.
3. Pertambahan Bobot Badan (PBB)
Tujuan pengamatan ini adalah untuk mengetahui pengaruh penyuntikan
somatotropin pada pertambahan bobot badan hewan percobaan dalam satuan
waktu (hari). Cara pengamatannya adalah bobot badan tikus ditimbang pada hari
ke a (Ba), selanjutnya ditimbang lagi pada hari ke b (Bb), pertambahan bobot
badan didapat dari selisih antara Bb dengan Ba dibagi dengan lama waktu dari hari
penimbangan Ba ke hari penimbangan Bb yang diukur dalam satuan gram per hari.
4. Efisiensi Penggunaan Pakan
Efisiensi penggunaan pakan didapat dengan cara membagi pertambahan
bobot badan dengan konsumsi pakan.
5. Laju Pertumbuhan Relatif
Tujuan pengamatan ini adalah untuk mengetahui kecepatan pertumbuhan
hewan percobaan akibat dari penyuntikan somatotropin. Hasilnya didapat dengan
cara membagi pertambahan bobot badan dengan bobot badan pada waktu itu
dikalikan 100% yang diukur dalam satuan persen.
Karkas dan Kandungan Kimiawi Karkas 1. Bobot Karkas
Tujuan pengamatan ini adalah untuk mengetahui bobot karkas akibat dari
penyuntikan soma totropin. Hasilnya didapat dengan cara menguliti terlebih
dahulu, selanjutnya memotong bagian kepala, kaki depan dan belakang, ekor, dan
mengeluarkan organ dalamnya, kemudian bobot karkasnya ditimbang dalam
satuan gram.
2. Kandungan Protein Karkas
Pengukuran kandungan protein karkas dilakukan dengan cara menimbang
0.5 g karkas yang sudah dihaluskan dan memasukkannya ke dalam labu Kjeldahl
100 mL. Kemudian ditambahkan 1 g campuran selenium dan 10 mL H2SO4 pekat
dan labu Kjeldahl digoyang sampai semua terbasahi oleh H2SO4. Setelah itu,
sampel didestruksi dalam lemari asam sampai jernih dan dibiarkan sampai dingin
Larutan didinginkan kemudian volumenya dipenuhi sampai tanda garis dengan air
suling. Setelah itu, disiapkan penampung yang terdiri atas 10 mL H3BO3 2% dan
4 tetes larutan indikator campuran dalam Erlenmeyer 100 mL. Sebanyak 5 mL
NaOH 30% dan 100 mL air suling dicampurkan dan disuling hingga volume
penampung menjadi kurang lebih 50 mL. Ujung penyuling dibilas dengan air
suling selanjutnya penampung beserta isinya dititrasi dengan larutan HCl atau
H2SO4 0.0222 N.
3. Kandungan lemak karkas
Pengukuran kandungan lemak karkas dilakukan dengan cara menimbang
0.5 g karkas yang sudah dihaluskan kemudian dimasukkan ke dalam tabung reaksi
berskala 10 mL. Kemudian ditambahkan khloroform mendekati skala, kemudian
ditutup rapat lalu dikocok dan dibiarkan bermalam. Volume larutan disamakan
pada tanda skala 10 mL dengan pelarut lemak yang sama kemudian dikocok
hingga homogen, selanjutnya disaring dengan kertas tisu/kertas saring ke dalam
tabung reaksi. Sebanyak 5 mL larutan tersebut dipipet ke dalam cawan yang telah
diketahui beratnya (a g) dan dipanaskan dengan oven pada suhu 100oC selama 3
jam atau dibiarkan bermalam. Setelah itu, cawan yang berisi sampel dimasukkan
ke dalam eksikator kurang lebih 30 menit lalu ditimbang (b g)
Perhitungan : Perhitungan :
V1 x N x 0.014 x 6.25 x P
Kandungan protein = x 100% g contoh
Keterangan : V1 = volume titrasi contoh
N = normalitas larutan HCl atau H2SO4 0.0222 N P = faktor pengencer (100/S)
P (b – a)
Kandungan lemak = x 100% berat contoh
keterangan : P = pengenceran = 10/5 a = berat cawan
4. Kandungan Mineral Karkas
Pengukuran kandungan mineral karkas dilakukan dengan cara mencuci
bersih cawan porselen dengan air kemudian dikeringkan dalam oven pada suhu
105oC selama 1 jam, selanjutnya didinginkan dalam eksikator selama 15 menit
dan menimbang beratnya (X). Sebanyak 3 g karkas yang sudah dihaluskan
dimasukkan ke dalam porselen (Y). Cawan beserta isinya dipijarkan di atas nyala
bunsen sampai tidak berasap lagi. Kemudian cawan ini dimasukkan ke dalam
tanur listrik untuk dibakar atau diabukan pada suhu 400-800 oC. Sesudah abu
menjadi putih, seluruhnya diangkat dan didinginkan dengan cara memasukkannya
ke dalam dessikator. Setelah 1 jam cawan ditimbang kembali dengan berat (Z).
Perhitungan :
5. Kandungan Glikogen Karkas
Pengukuran kandungan glikogen karkas dilakukan dengan cara
mempersiapkan bahan yang digunakan antara lain asam sulfat 95% (95 mL asam
sulfat + 5 mL H2O) yang dibuat dalam ruang asam, antrone 0.2% (0.2 g anthrone
dalam 100 mL asam sulfat 95% yang dibuat dalam kondisi segar, KOH 30% (30
g KOH dalam 100 mL H20), ethanol 95%, glikogen standar [100mg/10mL H2O =
1 µg/ 1 µL (H2O)]. Adapun cara kerjanya adalah sebagai berikut. Sampel karkas yang telah dihaluskan diekstraksi sebanyak 25 mg dalam 1 mL KOH 30%,
selanjutnya campuran tersebut diinkubasi dalam penangas air mendidih selama 20
menit (disebut ekstrak sampel). Kemudian ditambahkan 1.5 mL etanol dan
disent rifus dengan kecepatan 2500 rpm selama 20 menit. Selanjutnya didekantasi
yang hasilnya glikogen akan menempel di dinding tabung. Kemudian
ditambahkan 1 mL H2O, selanjutnya ditambahkan 3 mL antrone. Absorbans
larutan dibaca dengan spektrofotometer dengan panjang gelombang 620 nm. (Z – X) x 100%
Kandungan mineral = Y
Bobot Organ
Organ yang diamati pada penelitian ini antara lain hati, jantung, testis, dan
saluran pencernaan. Sebelum dilakukan penimbangan bobot organ, terlebih
dahulu tikus dimatikan selanjutnya dilakukan pembedahan. Pembedahan
dilakukan untuk mengamati beberapa bagian organ untuk mengetahui
pertumbuhan atau pertambahan bobot dari organ-organ tikus yang disuntik
somatotropin. Masing- masing organ dibersihkan dan dicuci dengan
menggunakan NaCl fisiologis dan selanjutnya ditimbang dengan menggunakan
alat timbang elektronik yang diukur dalam satuan gram.
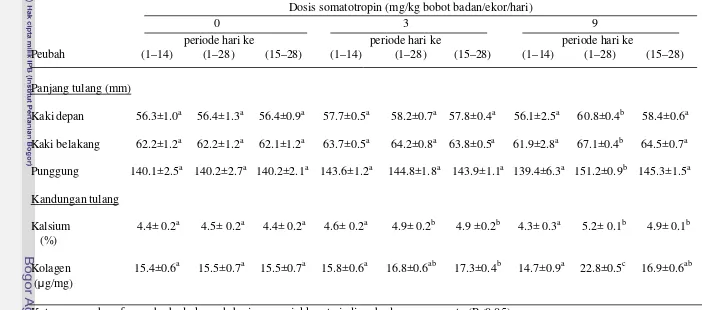
Panjang dan Kandungan Kimiawi Tulang 1. Panjang Tulang
Pengukuran pajang tulang dilakukan dengan cara terlebih dahulu tikus
dipingsankan kemudian dirontgen dengan menggunakan alat Rontgen dan
Fluoroskopi Siremobile (Siemens). Selanjutnya dilakukan pengukuran panjang
tulang yang meliputi tulang kaki depan, tulang kaki belakang, dan tulang
punggung dengan melihat dan mengukur hasil rontgen. Pengukuran tulang kaki
depan maupun belakang diukur dari tapak kaki sampai penonjolan tulang dan
panjang tulang punggung dimulai dari pangkal batang leher sampai pangkal
tulang ekor. Pengukuran panjang tulang menggunakan alat ukur dengan skala
milimeter (mm).
2. Kandungan Kolagen Tulang
Pengamatan ini dilakukan untuk mengetahui besarnya konsentrasi kolagen
atau kadar kolagen pada tulang tikus percobaan akibat penyuntikan somatotropin.
Sampel yang digunakan adalah tulang bagian tibia tikus. Pengukuran kandungan
kolagen tulang dilakukan setelah tulang yang sudah dikeringkan dan dihaluskan
diekstraksi dengan cara menimbang 25 mg ke dalam tabung reaksi dan
menambahkan sebanyak 5 mL HCl 6 N pada setiap sampel. Semua tabung
diletakkan pada penangas air 130 oC selama 3 jam (air mendidih ± 5 jam) sampai
larutan homogen kuning muda. Jika terjadi penguapan selama pemanasan
ditambahkan lagi HCl 6 N sebanyak 5 mL. Isinya dituangkan dan dibaca pada pH
jika kebasaan, dan tetap menghitung pelarutannya. Selanjutnya tabung reaksi
disiapkan kemudian dilabel untuk blank, standar, dan sampel yang masing- masing
dibuat duplo. Masing- masing tabung diisi reagen sehingga akan berwarna kuning,
setelah itu pada setiap tabung ditambahkan 1 mL Chloramin- T dan dikocok
dengan vorteks. Larutan dibiarkan selama 20 menit pada suhu kamar. Setiap
tabung ditambahkan 1 mL asam perklorat (kocok dengan vorteks) dan dibiarkan
selama 5 menit. Setiap tabung ditambahkan 1 mL p-dimetilaminobenzaldehide
dan dikocok kemudian diletakkan pada penangas air 60 oC selama 20 menit.
Larutan didinginkan pada kran air mengalir (tabung direndam dalam wadah berisi
air dingin) selama 5 menit. Absorbans larutan dibaca dengan spektrofotometer
dengan panjang gelombang 557 nm, yang dilakukan dalam jangka waktu 1 jam.
3. Kandungan Kalsium Tulang
Prinsip dari percobaan penentuan kandungan kalsium adalah asam
etilenediamintetraasetat (EDTA) dalam larutan basa membentuk suatu senyawa
yang dapat larut dan kompleks yang sedikit terionisasi oleh kalsium dan
magnesium serta ion- ion logam lain. Bila ion magnesium ada, suatu titik akhir
dapat terlihat dengan indikator Eriochrome Black T. Suatu larutan kalsium yang
tidak diketahui berisi sejumlah magnesium dapat dititrasi dengan EDTA untuk
menentukan adanya kalsium. Peralatan yang digunakan adalah mikro buret dan
pereaksinya antara lain: larutan buffer (campuran 87.5 g ammonium khlorida
dengan 570 mL ammonium hidroksida pekat dan diencerkan menjadi 1 liter),
indikator (0.25 g Eriochrome Black T dilarutkan dalam 50 mL diethanolamin),
larutan magnesium sulfat, larutan EDTA, ammonium oksalat jenuh, asam khlorida
pekat, indikator merah metil, standar kalsium, dan ammonium hidroksida. Cara
kerjanya adalah sebagai berikut. Aliquot dari larutan abu yang berisi 0.05 mg
hingga 1.5 mg kalsium dipipet ke dalam tabung sentrifus berujung bulat 15 mL
yang berisi 3 mL amonium oksalat jenuh. Setelah itu, ditambahkan 1 tetes
indikator merah metil dan disesuaikan pH menjadi 5.0 – 5.5 (warna faint pink dari
indikator) menggunakan larutan encer asam hidroklorida atau amonium
hidroksida. Isinya dicampurkan sampai merata dan dibiarkan selama satu jam dan
disentrifus selama 5 menit pada kecepatan 3000 rpm. Cairan supernatan dibuang
3 mL amonium hidroksida 1%, disentrifus dan sekali lagi dibuat cairan
supernatannya. Selanjutnya endapan dilarutkan dalam 0.5 mL asam hidroklorida
pekat dengan air distilasi ke dalam gelas 100 mL dan diencerkan hingga 30 mL.
Setelah itu, ditambahkan 5.0 mL larutan buffer dan beberapa tetes indikator
Eriochrome Black T, selanjutnya ditambahkan 0.5 mL larutan magnesium sulfat
dari buret sampai warnanya menjadi merah anggur. Kemudian ditambahkan
larutan EDTA dari buret sampai terbentuk warna biru. Selanjutnya dititrasi ulang
dengan larutan magnesium sulfat hingga tampak awal warna merah anggur dalam
larutan biru tersebut. Perhitungannya :
Kandungan kalsium (%) =
titer Ca dari EDTA – (titer Mg dari EDTA x mL MgSO4) x 10 (mL EDTA)
Gambar 4. Protokol penelitian
* Penimbangan bobot badan seluruh tikus percobaan * 27 ekor tikus dikorbankan untuk pengamatan bobot organ
(masing-masing perlakuan 3 ekor)
* Penimbangan bobot badan seluruh tikus percobaan * 27 ekor tikus dikorbankan untuk pengamatan panjang tulang
dan bobot organ (masing-masing perlakuan 3 ekor)
* Penimbangan bobot badan seluruh tikus percobaan * 27 ekor tikus dikorbankan untuk pengamatan bobot organ
(masing-masing perlakuan 3 ekor)
* Penimbangan bobot badan seluruh tikus percobaan
* 27 ekor tikus dikorbankan untuk pengamatan panjang dan kandungan kimiawi tulang, bobot dan kandungan kimiawi karkas, dan bobot organ
(masing-masing perlakuan 3 ekor)
Penimbangan bobot badan seluruh tikus percobaan
PENGAMATAN SELAMA PENYUNTIKAN SOMATOROPIN 28 HARI
PENGAMATAN 28 HARI SETELAH PENGHENTIAN PENYUNTIKAN SOMATOTROPIN
* Penimbangan bobot badan seluruh tikus percobaan * 27 ekor tikus dikorbankan untuk pengamatan panjang tulang
(masing-masing perlakuan 3 ekor)
Penimbangan bobot badan seluruh tikus percobaan
* Penimbangan bobot badan seluruh tikus percobaan * 27 ekor tikus dikorbankan untuk pengamatan panjang tulang
H A S I L
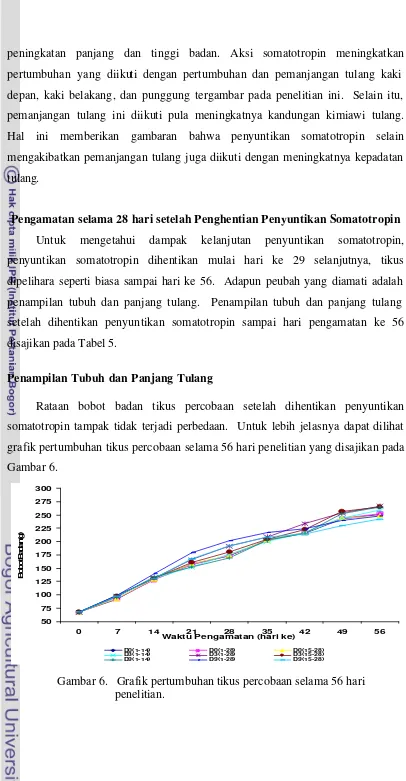
Pengamatan selama Penyuntikan Somatotropin Penampilan Tubuh
Penampilan tub uh tikus percobaan pada penelitian ini menggambarkan
seberapa besar perubahan atau peningkatan bobot badan, konsumsi pakan,
pertambahan bobot badan, efisiensi penggunaan pakan, dan laju pertumbuhan
relatif yang terjadi akibat penyuntikan somatotropin. Hasil pengamatan
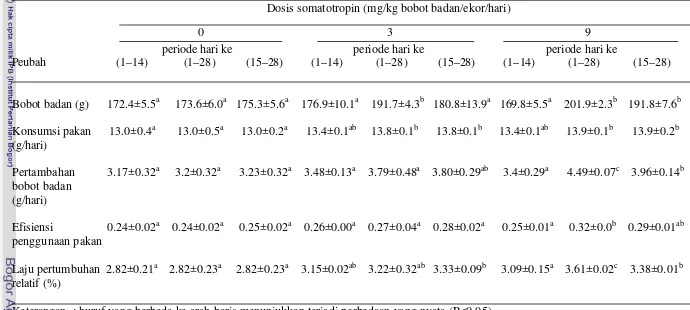
penampilan tubuh dapat dilihat pada Tabel 1.
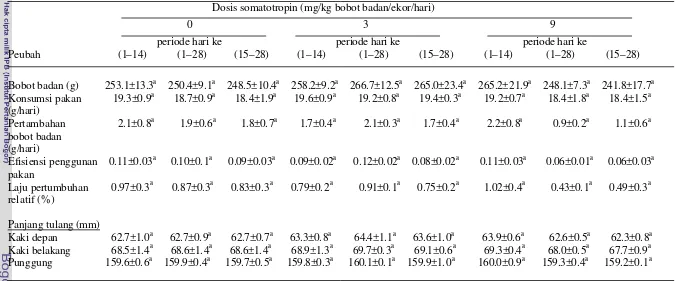
Rataan bobot badan tikus percobaan selama 28 hari untuk penyuntikan
somatotropin dosis 3 dan 9 mg dengan periode penyuntikan hari ke 1 – 28 dan
dosis 9 mg dengan periode penyuntikan hari ke 15 – 28 lebih besar
masing-masing sebesar 10.4%, 16.3%, dan 9.4% dibandingkan dengan kontrol. Untuk
dosis 3 mg, periode penyuntikan somatotropin hari ke 1 – 28 bobot badannya
lebih tinggi masing- masing sebesar 10.4% dan 6.3% dibandingkan hari ke 1 – 14
dan hari ke 15 – 28. Untuk dosis 9 mg, periode penyuntikan hari ke 1 – 28 dan
hari ke 15 – 28 bobot badannya lebih tinggi masing- masing sebesar 18.9% dan
12.9% dibandingkan dengan hari ke 1 – 14. Selanjutnya, apabila dibandingkan
antar dosis penyuntikan somatotropin khususnya pada periode penyuntikan hari
ke 1 – 28 tampak dosis 9 mg bobot badannya lebih tinggi 5.3%.
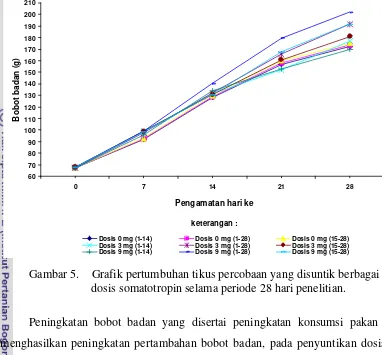
Untuk memperjelas pengamatan bobot badan tikus percobaan selama 28
hari, disajikan grafik pertumbuhan bobot badan tikus percobaan berbagai
penyuntikan selama 28 hari pada Gambar 5. Tampak tikus yang disuntik
somatotropin dosis 9 mg dengan periode penyuntikan hari ke 1 – 28 tumbuh
melebihi tikus yang lainnya.
Pertumbuhan yang dicerminkan dengan meningkatnya bobot badan disertai
pula peningkatan konsumsi pakan. Rataan konsumsi pakan tikus yang disuntik
somatotropin dosis 3 dan 9 mg dengan periode penyuntikan hari ke 1 - 28 dan hari
ke 15 – 28, tampak mengkonsumsi pakan lebih tinggi masing- masing 6.2%, 6.2%,
6.9% dan 6.9% dibandingkan dengan kontrol. Konsumsi pakan tikus yang
disuntik somatotropin dosis 3 mg dan 9 mg tidak terjadi perbedaan antar periode
penyuntikan. Selanjutnya apabila dibandingkan antar dosis penyuntikan, tampak
60
Gambar 5. Grafik pertumbuhan tikus percobaan yang disuntik berbagai dosis somatotropin selama periode 28 hari penelitian.
Peningkatan bobot badan yang disertai peningkatan konsumsi pakan ini
menghasilkan peningkatan pertambahan bobot badan, pada penyuntikan dosis 9
mg dengan periode penyuntikan hari ke 1 – 28 dan hari ke 15 – 28 lebih tinggi
masing- masing 40.3% dan 22.6% dibandingkan dengan kontrol. Untuk dosis 3
mg, tidak terjadi perbedaan pertambahan bobot badannya. Untuk dosis 9 mg,
periode penyuntikan hari ke 1 – 28 lebih tinggi 32.1% dan 13.4% dibandingkan
periode penyuntikan hari ke 1 – 14 dan hari ke 15 – 28, periode penyuntikan hari
ke 15 – 28 pertambahan bobot badannya lebih tinggi 16.5% dibandingkan dengan
hari ke 1 – 14. Selanjutnya apabila dibandingkan antar dosis penyuntikan, tampak
dosis 9 mg pertambahan bobot badannya lebih tinggi dibandingkan dengan dosis
3 mg.
Penyuntikan somatotropin berdampak pula pada efisiensi penggunaan
pakan. Efisiensi penggunaan pakan tikus pada penyuntikan somatotropin dosis 9
mg dengan periode penyuntikan hari ke 1 – 28 lebih tinggi sebesar 34.8%
dibandingkan dengan kontrol. Untuk dosis 3 mg, antar periode penyuntikan tidak
Tabel 1. Rataan bobot badan, konsumsi pakan, pertambahan bobot badan, efisiensi penggunaan pakan, dan laju pertumbuhan relatif tikus yang disuntik berbagai dosis somatotropin selama periode 28 hari
Dosis somatotropin (mg/kg bobot badan/ekor/hari)
0 3 9 periode hari ke periode hari ke periode hari ke
Peubah (1–14) (1–28) (15–28) (1–14) (1–28) (15–28) (1–14) (1–28) (15–28)
Bobot badan (g) 172.4±5.5a 173.6±6.0a 175.3±5.6a 176.9±10.1a 191.7±4.3b 180.8±13.9a 169.8±5.5a 201.9±2.3b 191.8±7.6b
Konsumsi pakan 13.0±0.4a 13.0±0.5a 13.0±0.2a 13.4±0.1ab 13.8±0.1b 13.8±0.1b 13.4±0.1ab 13.9±0.1b 13.9±0.2b (g/hari)
Pertambahan 3.17±0.32a 3.2±0.32a 3.23±0.32a 3.48±0.13a 3.79±0.48a 3.80±0.29ab 3.4±0.29a 4.49±0.07c 3.96±0.14b bobot badan
(g/hari)
Efisiensi 0.24±0.02a 0.24±0.02a 0.25±0.02a 0.26±0.00a 0.27±0.04a 0.28±0.02a 0.25±0.01a 0.32±0.0b 0.29±0.01ab penggunaan pakan
Laju pertumbuhan 2.82±0.21a 2.82±0.23a 2.82±0.23a 3.15±0.02ab 3.22±0.32ab 3.33±0.09b 3.09±0.15a 3.61±0.02c 3.38±0.01b relatif (%)