PENGARUH pH DAN PERUBAHAN TEMPERATUR
TERHADAP PEMBENTUKAN SPORA Bacillus sp. BK17
SKRIPSI
RULYA ANNISA
090805025
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH pH DAN PERUBAHAN TEMPERATUR TERHADAP PEMBENTUKAN SPORA Bacillus sp. BK17
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat untuk mencapai gelar
Sarjana Sains
RULYA ANNISA 090805025
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Disetujui di Medan, Februari 2014
Komisi Pembimbing
Pembimbing 2 , Pembimbing 1,
Dra. Nunuk Priyani, M.Sc. Prof. Dr. Erman Munir, M.Sc. NIP. 19640428 199603 2 001 NIP. 19651101 199103 1 002
Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
Dr. Nursahara Pasaribu, M.Sc. NIP. 19630123 199003 2 001
Judul : Pengaruh pH dan Perubahan Temperatur Terhadap Pembentukan Spora Bacillus sp. BK17
Kategori : Skripsi Nama : Rulya Annisa Nomor Induk Mahasiswa : 090805025
Program Studi : Sarjana (S1) Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
PERNYATAAN
PENGARUH pH DAN PERUBAHAN TEMPERATUR TERHADAP PEMBENTUKAN SPORA Bacillus sp. BK17
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Februari 2014
iii
PENGHARGAAN
Puji Syukur kepada-Mu Allah SWT, segala Puji Bagi-Mu Tuhan semesta alam. Skripsi ini penulis persembahkan kepada Ayahanda tercinta, M. Rusdi, Ibunda tersayang, Milyani, untuk Saudara-saudari tersayang, kak Elvira Ikhwani S.S, dek Yudya Isfhani, dek Fahriza Fahmi, terima kasih atas kehangatan, cinta, canda tawa dan motivasi yang tiada henti.
Penulis menyampaikan ucapan terima kasih kepada Bapak Prof. Dr. Erman Munir, M.Sc., selaku dosen pembimbing I, Ibu Dra. Nunuk Priyani, M.Sc., selaku dosen pembimbing II yang telah memberikan bimbingan dan arahan serta waktu dan perhatiannya kepada penulis dalam menyelesaikan penelitian ini. Penulis juga menyampaikan ucapan terima kasih kepada Ibu Dr. It jamilah, M.Sc. selaku dosen penguji I serta Ibu Dra. Isnaini Nurwahyuni, M.Sc selaku dosen penguji II, sekaligus sebagai dosen pembimbing akademik yang telah memberi saran serta motivasi demi penyempurnaan skripsi ini. Terima kasih kepada Ibu Dr. Nursahara Pasaribu, M.Sc., selaku Ketua Departemen Biologi FMIPA USU serta seluruh Dosen Departemen Biologi FMIPA USU yang telah memberikan ilmu yang sangat berarti dalam hidup penulis. Kepada Bang Endra Raswin, Kak Roslina Ginting, Ibu Nurhasni Muluk, Ibu Mizarwati, terima kasih atas kesabaran dan kabaikannya dalam membantu penulis selama masa pendidikan di Departemen Biologi.
Selanjutnya ucapan terima kasih penulis kepada teman seperjuangan, Hema dan Rachmi, semoga kerja keras kita selama ini memberi arti dalam hidup kita, untuk sahabatku Essy, Nisa Willy, Zuwanna, Nora, Arfah, terimakasih atas persahabatan yang indah ini, teman-teman di Laboratorium Mikrobiologi, bang Albert, kak Novi, Dila, Wulan, Agustina, febrin, Grace, Febri, Andersoon, Raymon, Astri. Teman-teman asisten Mikrobiologi Bang Mirza, Kak Ria, Bang Asril, Bang Frans, kak Nina, kak Ayu, Eryna, Lisa, Sepwin, Bobby, Dila, Devi, Hendika, Riris dan Santa, terimakasih atas ilmu dan hari-hari yang menyenangkan di Lab. Kakak-kakak Mikrobiologi S2, Kak Netti, Kak Ami, Kak Nikmah, Kak abang dan kakak angkatan 2006, 2007, 2008 dan adik-adik angkatan 2010, 2011 dan 2012, terima kasih telah mengisi hari-hari penulis dengan kebersamaan dan mengajarkan penulis untuk saling mengerti dan memahami. Kepada semua pihak yang telah membantu dalam penelitian dan penulisan skripsi ini, penulis ucapkan terima kasih yang sebesar-besarnya.
PENGARUH pH DAN PERUBAHAN TEMPERATUR TERHADAP PEMBENTUKAN SPORA Bacillus sp. BK17
ABSTRAK
Spora bakteri merupakan suatu struktur bertahan hidup dalam kondisi fisik dan kimiawi yang kurang baik. Bacillus sp. BK17 merupakan bakteri pembentuk spora yang telah dilaporkan memiliki kemampuan dalam menghambat pertumbuhan berbagai jenis jamur patogen. Penelitian ini bertujuan untuk mengetahui pH dan temperatur terbaik untuk pembentukan spora. Hasil menunjukkan bahwa Bacillus sp. BK17 membentuk spora tertinggi pada media pH 5,0 dan pada heat shock 70° C selama 60 menit.
Kata Kunci: Bacillus sp. BK17, Endospora, pH, Heat shock.
v
THE EFFECT OF pH AND TEMPERATURE CHANGES FOR SPORE
FORMATION OF Bacillus sp. BK17
ABSTRACT
Bacterial spores are the surviving structure under unfavourable physical and chemical conditions. Bacillus sp. BK17 is a spore forming bacteria that has been reported to have an ability to inhibit the growth of various pathogenic fungi.This study aims to determine the best pH and temperature for the formation of spore. The result showed that Bacillus sp. BK17 has the highest spore formation at the initial pH of media of 5,0 and at a heat shock of 70° C for 60 minutes.
Keywords: Bacillus sp. BK17, Endospore, pH, Heat shock.
DAFTAR ISI
2.2. Faktor Lingkungan yang Mempengaruhi Pembentukan dan Ketahanan Spora
2.3. Bakteri Pembentuk Spora dan Bacillus sp. 13
BAB 3 BAHAN DAN METODE
3.1. Waktu dan Tempat 16
3.2. Alat dan Bahan 16
3.3. Pelaksanaan Penelitian 16
BAB 4 HASIL DAN PEMBAHASAN
4.1. Pengaruh pH 19
4.1.1 Kepadatan Sel Bacillus sp. BK17 19 4.1.2 Kepadatan Spora Bacillus sp. BK17 21
4.2. Pengaruh Perubahan Temperatur 24
4.2.1 Kepadatan Sel Bacillus sp. BK17 24 4.2.2 Kepadatan Spora Bacillus sp. BK17 27
4.3 Pengamatan Spora 31
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 32
5.2. Saran 32
DAFTAR TABEL
Nomor
Tabel Judul Halaman
4.1.1 Kepadatan Sel Bacillus sp. BK17(λ = 600 nm) setelah 72 Jam Inkubasi pada Media dengan pH yang Bervariasi (kontrol = 0 hari)
19
4.1.2 Kepadatan Spora Bacillus sp. BK17 (λ = 660 nm) setelah 72 Jam Inkubasi pada Media dengan pH yang Bervariasi (kontrol = 0 hari)
22
4.2.1 Kepadatan Sel Bacillus sp. BK17 (λ = 600 nm) setelah Perlakuan Temperatur
24
4.2.2 Kepadatan Spora Bacillus sp. BK17 (λ = 660 nm) setelah Perlakuan Temperatur
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1.1 Siklus Sporulasi 6
4.1.1 Kepadatan Sel Bacillus sp. BK17 setelah 72 Jam Inkubasi pada Media dengan pH yang Bervariasi (kontrol = 0 hari)
20
4.1.2 Kepadatan Spora Bacillus sp. BK17 setelah 72 Jam Inkubasi pada Media dengan pH yang Bervariasi (kontrol = 0 hari)
22
4.2.1 Kepadatan Sel Bacillus sp. BK17 setelah Perlakuan Temperatur (kontrol = 28°C)
25
4.2.2 Kepadatan Spora Bacillus sp. BK17 setelah Perlakuan Temperatur (kontrol = 28° C)
29
4.3 Pengamatan Mikroskopis Hasil Pewarnaan Spora Bacillus sp. BK17. Spora (berwarna hijau) dan Sel Vegetatif (berwarna merah) (Perbesaran 10x100)
DAFTAR LAMPIRAN
Nomor
Lampiran Judul Halaman
1 Perbanyakan dan Pembuatan Suspensi Bakteri 39
2 Uji Pengaruh pH Media terhadap Pembentukan Spora 40
3 Uji Pengaruh Perubahan Temperatur terhadap Pembentukan Spora
41
4 Pengamatan Spora 42
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Pembentukan spora (sporulasi) pada bakteri sangat tergantung pada kondisi lingkungan, seperti ketersediaan nutrisi (khususnya sumber karbon, nitrogen dan fosfor), perubahan temperatur dan pH. Proses sporulasi juga dapat diaktifkan melalui perlakuan panas, radiasi, perlakuan tekanan tinggi, pH ekstrim dan sonikasi (Ray, 2004). Spora bakteri paling resisten diantara semua bentuk kehidupan (Pelczar & Chan, 2005). Dalam lingkungan yang menguntungkan spora bergerminasi kembali menjadi sel vegetatif. Bila lingkungan tidak menguntungkan, sel vegetatif berubah menjadi spora. Spora tahan terhadap suhu dan bahan kimia yang mematikan sel vegetatif (Lay, 1994).
Spora dibentuk oleh kelompok bakteri ordo Actinomycetales, Eubacteriales dan Myxobacteriales. Bakteri pembentuk spora dimanfaatkan untuk keperluan industri dan obat-obatan. Anggota dari genus Bacillus banyak digunakan beberapa industri enzim dan agen biokontrol untuk pertanian. Bacillus anthracis dan beberapa genus Clostridium seperti Clostridium tetani, Clostridium botulinum dan Clostridium perfringens merupakan bakteri patogen dan kemampuannya dalam membentuk spora menjadi faktor penting dalam patogenitasnya (Errington, 2003).
Spora dapat bertahan pada perlakuan panas. Spora Bacillus tahan sampai mendekati suhu 100° C (Naufalin, 1999). Pembentukan spora Bacillus
thuringiensis subsp. israelensis dipengaruhi oleh temperatur (Ahdianto, 2006).
Pembentukan spora Bacillus thuringiensis subsp. israelensis dimulai pada jam ke-9 karena kondisi lingkungan yang kurang sesuai bagi sel, seperti pH yang sudah mencapai 8,15 (Salamah, 2002).
Bacillus sp. BK17 yang diisolasi dari tanah Bangka telah dilaporkan
sp. BK17 mampu menghambat jamur patogen Saprolegnia sp. yang menginfeksi ikan nila (Oreochromis sp.). Penghambatan yang terjadi pada jamur air dipengaruhi oleh adanya kemampuan bakteri Bacillus sp. BK17 dalam menghasilkan enzim kitinase, glukanase dan selulase. Substrat kitin pada media dapat menginduksi bakteri antagonis untuk mengeluarkan enzim selain glukanase dan selulase yaitu kitinase (Sembiring, 2012). Menurut Sulistiani (2009), Bacillus
subtilis merupakan bakteri pembentuk endospora yang memiliki ketahanan
terhadap kondisi lingkungan yang kurang baik. Dengan demikian endospora yang terbentuk dapat digunakan sebagai material bakteri inaktif yang bisa diformulasikan pada berbagai bahan pembawa.
Menurut Errington (2003), stimulus utama untuk proses sporulasi adalah kekurangan nutrisi. Hal ini sangat penting untuk memperoleh kepadatan populasi spora yang tinggi. Kompleksitas dari inisiasi pembentukan spora sebagian diatur oleh faktor lingkungan. Oleh karena itu diperlukan penelitian untuk mengetahui faktor lingkungan yang paling baik untuk menginisiasi pembentukan spora bakteri.
1.2 Permasalahan
Berdasarkan hasil penelitian yang telah dilakukan oleh Sembiring (2012) diketahui bahwa Bacillus sp. (sebelumnya disebut isolat BK17) merupakan bakteri yang potensial dalam menghambat pertumbuhan jamur patogen
Saprolegnia sp. dan dapat membentuk spora, maka perlu dilakukan penelitian
untuk mengetahui pengaruh pH dan perubahan temperatur dalam pembentukan spora Bacillus sp. BK17.
1.3 Tujuan
1.4 Hipotesis
Hipotesis penelitian ini ialah:
a. Derajat keasaman (pH) terbaik untuk pembentukan spora Bacillus sp. BK17 adalah pada pH 7,0.
b. Temperatur terbaik untuk pembentukan spora Bacillus sp. BK17 adalah 70°C selama 15 menit.
1.5 Manfaat
Manfaat penelitian ini ialah :
a. Sebagai bahan informasi untuk mengetahui pH dan temperatur yang paling baik untuk pembentukan spora Bacillus sp. BK17.
b. pH dan temperatur yang paling baik dari hasil penelitian dapat diaplikasikan sebagai parameter lingkungan untuk produksi spora Bacillus sp. BK17.
BAB 2
TINJAUAN PUSTAKA
2.1 Pembentukan Spora
Spora bakteri umumnya disebut endospora, karena spora dibentuk di dalam sel. Ada dua tipe sel spora yang terbentuk, yang pertama terbentuk di dalam sel, yang disebut dengan endospora dan spora yang terbentuk di luar sel yang disebut eksospora. Spora bakteri tidak berfungsi untuk perkembangbiakan. Bentuk spora bermacam-macam, bulat atau bulat memanjang, bergantung pada spesiesnya. Ukuran endospora lebih kecil atau lebih besar daripada diameter sel induknya. Kebanyakan bakteri pembentuk spora adalah penghuni tanah, tetapi spora bakteri dapat tersebar dimana saja (Waluyo, 2007).
Letak endospora di dalam sel serta ukurannya tidak sama bagi semua spesies. Beberapa spora letaknya sentral yaitu dibentuk di tengah-tengah sel, terminal, yaitu dibentuk di ujung, subterminal yaitu dibentuk di dekat ujung. Adanya letak serta ukuran endospora sangat bermanfaat di dalam pencirian dan identifikasi bakteri (Pelczar & Chan, 2008). Terdapat enam marga bakteri penghasil endospora yaitu Bacillus, Sporolactobacillus, Clostridium,
Desulfotomaculum, Sporosarcina, Thermoactinomycetes. Sebelum digolongkan
menjadi enam marga, bakteri penghasil endospora dibagi menjadi dua kelompok, yaitu termasuk Marga Bacillus jika merupakan gram positif, dan termasuk marga
Clostridium jika merupakan gram negatif (Hatmanti, 2000).
menyediakan ketahanan untuk spora. Selama germinasi dan pertumbuhan, korteks dihidrolisis dan membran luar paraspora dan mantel spora dihilangkan diikuti dengan munculnya sel (Ray, 2004).
Dinding spora bersifat impermeabel, tetapi zat-zat warna dapat diserap kedalamnya dengan jalan memanaskan preparat. Sifat impermeabel ini mencegah dekolorisasi spora oleh alkohol bila diperlakukan dalam waktu yang sama seperti pada dekolorisasi sel-sel vegetatif (Irianto, 2006). Lapisan luar spora merupakan penahan yang baik terhadap bahan kimia, sehingga spora sukar untuk diwarnai. Spora bakteri dapat diwarnai dengan dipanaskan. Pemanasan menyebabkan lapisan luar spora mengembang, sehingga zat warna dapat masuk (Lay, 1994). Spora bakteri sangat sulit diwarnai dengan pewarna biasa, oleh karena itu harus diwarnai dengan pewarna spesifik (Fardiaz, 1992). Bahan yang digunakan untuk pewarnaan spora dapat memakai larutan malachite green dan larutan safranin (Waluyo, 2010).
Setiap sel bakteri hanya dapat membentuk satu spora. Struktur endospora bervariasi untuk setiap jenis maupun spesies, tetapi struktur umumnya hampir sama. Jika endospora ditempatkan di dalam suatu medium yang baik, akan terjadi germinasi, spora akan mengambil air dari sekelilingnya, membengkak dan berkecambah. Lapisan luar spora pecah dan spora akan tumbuh menjadi sel vegetatif (Fardiaz, 1992).
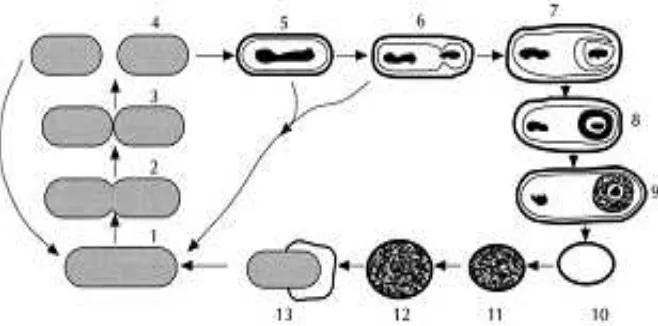
Menurut Ray (2004), proses sporulasi dapat dibagi ke dalam 7 tahap. Pertama tahap penghentian replikasi DNA, diikuti dengan penjajaran kromosom di dalam filamen aksial dan pembentukan mesosom. Invaginasi membran sel dan pembentukan septum. Pembentukan prespora atau paraspora pun terjadi. Pembentukan dinding sel germinal dan korteks, akumulasi ion Ca2+ dan sintesis DPN. Deposisi mantel spora, pematangan spora, dehidrasi protoplas dan resistensi untuk panas. Tahap akhir terjadi lisis enzimatis pada dinding sel dan pembebasan spora. Siklus sporulasi dapat dilihat pada Gambar 2.1.1.
dipikolinik disintesis di dalam sel vegetatif untuk diberikan kepada prespora bersama dengan kation divalen (Ca2+), hal ini menyebabkan dehidrasi dan mineralisasi spora (Todd et al., 2003).
Gambar 2.1.1 Siklus sporulasi. (1–4) Multiplikasi sel, (5) Pembentukan filamen aksial, (6) Pembentukan septat, (7) Pembentukan prespora, (8) Pembentukan korteks, (9) Pembentukan mantel, (10) Spora bebas, (11) Germinasi diikuti dengan aktivasi, (12) Pembengkakan spora, (13) Pertumbuhan sel (Ray, 2004)
Sel bakteri memiliki kemampuan dalam memonitor sejumlah sinyal internal dan eksternal. Informasi disalurkan melalui sistem pengaturan yang terpisah. Komponen regulator transkripsi ini disebut dengan Spo0A. Spo0A dibentuk untuk mengontrol proses transkripsi dan aktivitas protein melalui proses fosforilasi. Fosforilasi Spo0A merupakan regulator sporulasi yang sangat penting dan bekerja mengaktifkan transkripsi pada beberapa proses sporulasi. Gen spesifik yang digunakan dalam proses sporulasi antara lain spoIIA, spoIIE dan spoIIG (Errington, 2003). Spo0A merupakan faktor penting pada proses sporulasi selama perkembangan sel vegetatif (Fujita & Losick, 2003). Fawcett et al. (2000) telah meneliti ratusan gen pada Bacillus subtilis, lebih dari 10% gen Bacillus subtilis dikontrol oleh Spo0A.
berbeda dengan bakteri pembentuk spora lainnya karena menghasilkan beberapa spora (Angert & Losick, 1998). Bahkan ada organisme yang berbentuk bulat, misalnya Sporosarcina yang sulit untuk membentuk sel yang asimetri saat memulai sporulasi, tetapi masih dapat membentuk endospora dengan menggunakan regulator yang umum digunakan (Chary et al., 2000).
Sporulasi menghasilkan dua sekat pada sel dengan ukuran yang berbeda, bagian prespora berukuran lebih kecil dan sel vegetatif dengan ukuran yang lebih besar dengan pemisahan bahan kromosom di dalam setiap kompartemen. Pembentukan septum yang asimetris ini merupakan suatu tahap perkembangan yang diatur oleh beberapa ekspresi gen. Ekspresi gen ini mempunyai program yang berbeda di antara dua sel tersebut. Dua faktor sigma σFdan σE merupakan alat yang mengatur program sel spesifik untuk mengekspresikan gen. Dua faktor sigma tersebut dibentuk sebelum septum dibentuk (Errington, 2003). Selama sporulasi, pembelahan sel diarahkan pada masing-masing kutub sel kemudian terjadi modifikasi septum, sehingga septum mengandung material dinding sel (Yehuda & Losick, 2002).
Setelah aktivasi σF pada sekat prespora, σE menjadi aktif di dalam sel vegetatif. Faktor σE disintesis sebagai preprotein inaktif yang diaktifkan oleh proses proteolitik oleh SpoIIGA yang memiliki aktivitas protein serin (Labell et al., 1987). SpoIIGA membutuhkan protein spesifik prespora yang disebut dengan SpoIIR. Pengontrolan SpoIIR diatur oleh aktivitas σF (Karow & Piggot, 1995; Vallejo & Stragier, 1995).
2.2 Faktor Lingkungan yang Mempengaruhi Pembentukan dan Ketahanan Spora
Menurut Sembiring & Fachmiasari (2004) selain media, kondisi fisik untuk pertumbuhan seperti temperatur, pH, dan ketersediaan oksigen memegang peranan penting dalam pertumbuhan dan sporulasi. Temperatur pertumbuhan
Bacillus thuringiensis berkisar antara 15° C-45°C dengan temperatur optimum
antara 26°C-30°C, tidak terlalu sensitif terhadap pH dan dapat tumbuh pada pH 5,5-8,5 dengan pH optimum 6,5-7,5. Ketersediaan oksigen yang cukup selama proses pertumbuhan memegang peranan penting dalam pertumbuhan Bacillus
thuringiensis dan dalam produksi spora hidup. Faktor lingkungan yang
mempengaruhi pembentukan dan ketahanan spora bakteri dijelaskan sebagai berikut.
2.2.1 Temperatur
Temperatur juga mempengaruhi laju pertumbuhan mikroba. Keragaman temperatur dapat mengubah proses-proses metabolisme tertentu serta morfologi sel, karena semua proses pertumbuhan bergantung pada reaksi kimiawi dan karena laju reaksi-reaksi ini dipengaruhi oleh temperatur, maka pola pertumbuhan bakteri sangat dipengaruhi oleh temperatur (Noviana & Raharjo, 2009).
Beberapa bakteri termofilik pembentuk spora mampu tumbuh pada
temperatur tinggi 55º C, antara lain bakteri anaerobik termofilik hidrogen yang menghasilkan sulfida (Desulfotomaculum), bakteri yang menghasilkan hidrogen dan karbon dioksida (Thermoanaerobacterium), Bacillus dan Geobacillus spp. (Doyle, 2007). Bacillus cereus dapat tumbuh pada temperatur optimum 30-40° C (ESR, 2010). Batas pertumbuhannya antara 4-55° C dan temperatur minimum pertumbuhannya pada temperatur 10° C (Schulz et al., 2004).
Bakteri pembentuk spora merupakan species yang dapat bertahan hidup setelah dipanaskan dengan uap 100° C bahkan lebih (Melliawati, 2009). Spora tahan terhadap temperatur yang mematikan sel vegetatif, spora Clostridium
botulinum tahan terhadap temperatur mendidih selama beberapa jam (Waluyo,
2007). Spora dari famili Bacillaceae tahan terhadap panas. Resistensi spora terhadap panas sebagian disebabkan oleh kadar air yang dikandungnya (Irianto, 2006). Bakteri dalam bentuk spora lebih tahan terhadap panas, hal ini karena dinding spora lebih bersifat impermeabel dan spora mengandung sedikit air, sehingga keadaan ini menyebabkan spora tidak mudah mengalami perubahan temperatur. Kadar air yang rendah dan pembungkus spora yang tebal merupakan faktor pendukung ketahanan spora terhadap panas. Spora mungkin masih dapat bertahan pada temperatur air mendidih selama 20 jam (Waluyo, 2007).
Menurut Naufalin (1999) mekanisme ketahanan panas dari berbagai hasil penelitian menyatakan bahwa senyawa peptidoglikan yang merupakan penyusun korteks dengan struktur ikatan silang dan bersifat elektronegatif, sangat berperan dalam meningkatkan ketahanan spora terhadap panas dengan cara mengontrol kandungan air di dalam protoplas, yaitu mempertahankan kadar air yang rendah. Beberapa faktor yang ikut mempengaruhi sifat polimer peptidoglikan juga ikut berperan menurunkan ketahanan spora terhadap panas, misalnya adanya asam dan beberapa kation multivalen.
Spora Bacillus cereus tahan terhadap panas sampai temperatur 100° C yang menandakan ketahanan sporanya terhadap kondisi ekstrim. Sel vegetatif Bacillus cereus dapat diinaktivasi melalui pemanasan (ESR, 2010). Spora Bacillus cereus dibentuk pada siklus pertumbuhan selama 8 jam setelah mengalami perlakuan panas pada suhu 70-90° C selama 24 jam (Young & James, 1959). Bacillus stearothermophilus dapat membentuk spora dan tumbuh optimum pada suhu 65° C (Zeigler, 2001).
2.2.2 Derajat Keasaman (pH)
terbentuk sebagai bahan aktif bioinsektisida. Faktor lingkungan yang berpengaruh terhadap pertumbuhan dan produksi kristal protein pada Bacillus thuringiensis
subsp. israelensis, salah satunya adalah pH. Pada interval nilai pH 5,5-8,0 menunjukkan bahwa semakin tinggi pH awal medium yang digunakan menyebabkan semakin tinggi potensi produk bioinsektisida yang dihasilkan. Hal ini diduga proses sintesa kristal protein dan sporulasi berjalan optimal. Keadaan ini disebabkan oleh lingkungan pH yang tidak terlalu rendah sehingga pembentukan kompleks spora dan kristal protein dapat berjalan dengan baik (Ahdianto, 2006).
Derajat keasaman (pH) optimum pertumbuhan bagi kebanyakan bakteri berlangsung antara pH 6,5 dan 7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat masam atau sangat alkalin. Bagi kebanyakan spesies, nilai pH minimal dan maksimal ialah antara 4 dan 9 (Noviana & Raharjo, 2009). Pada pH < 5,0 dan > 8,0 bakteri tidak dapat tumbuh dengan baik, kecuali bakteri asam asetat yang mampu tumbuh pada pH rendah dan bakteri Vibrio sp. yang dapat tumbuh pada pH tinggi (Zulaikhah, 2005).
Bacillus cereus memiliki pH optimum pertumbuhan yaitu pada pH 6-7 dan mempunyai batas pertumbuhan antara pH 4,5-9,5. Dari segi ketersediaan oksigen Bacillus cereus termasuk organisme anaerob fakultatif. Spora Bacillus cereus juga tahan pada kondisi asam antara pH 1,0-5,2. Sel vegetatif Bacillus cereus dapat diinaktivasi pada pH 3,7 sampai 5,6 (ESR, 2010). Bacillus laevolacticus DSM 6475 dan strain Sporolactobacillus, kecuali Sporolactobacillus racemicus IAM 12395 tahan terhadap pH 3,0. Bacillus racemilacticus dan Bacillus coagulans toleran terhadap konsentrasi empedu lebih dari 0,3 % (Hyronimus et al., 2000).
tumbuh pada pH 7,0 atau 11,0 (Wu et al., 2010). Bacillus thermantarcticus M1 mampu bertahan pada pH 5,5-9,0 (Zeigler, 2001).
2.2.3 Kekeringan
Kandungan air dalam lingkungan mikroorganisme juga mempengaruhi pertumbuhan mikroorganisme. Dalam lingkungan isotonik, konsentrasi cairan lingkungan setara dengan sel mikroorganisme. Dalam lingkungan ini, cairan dalam sel tidak mengalir keluar, demikian pula cairan dari lingkungan tidak masuk ke dalam sel. Dalam lingkungan hipotonik, konsentrasi cairan lebih rendah dibandingkan di dalam sel mikroorganisme yang menyebabkan cairan dari lingkungan mengalir masuk ke dalam sel mikoorganisme, sehingga sel membengkak dan dapat menjadi pecah. Bila kandungan air di sekitar lingkungannya tidak cukup, maka cairan dalam sel mikroorganisme mengalir keluar sehingga sel akan menciut dan menyebabkan plasmolisis. Sewaktu plasmolisis, metabolisme terhenti karena bahan yang terdapat di dalam sel sangat pekat dan menghambat aktivitas enzim. Kekeringan akan menginduksi pembentukan spora bakteri (Lay, 1994). Spora merupakan sel yang dorman yang sengaja dipersiapkan guna menahan pengeringan untuk waktu yang lama (Irianto, 2006).
Menurut Waluyo (2007) kekeringan tidak menyebabkan kematian pada spora. Dari hasil pengamatan yang telah dilakukan oleh Natalia et al. (2009) diketahui bahwa daya hidup bakteri dipengaruhi oleh kadar air dan nutrisi substrat. Kadar air spora mempengaruhi komponen-komponen yang ada di dalamnya, misalnya protein dan komponen genetik yang sensitif terhadap panas. Menurut Naufalin (1999), kadar air spora yang rendah bertujuan untuk membatasi mobilitas komponen-komponen tersebut. Sebaliknya bila kadar air spora tinggi, mengakibatkan peningkatan kapasitas mengikat air oleh protein dengan terbentuknya gugus sulfidril.
intraselular air menjadi sangat kecil pada bakteri pembentuk spora (Darwis, 2006). Pertumbuhan Bacillus cereus dapat dihambat dengan kandungan air dibawah 0,91% (ESR, 2010). Spora Bacillus cereus mampu bertahan lama pada kondisi kering selama 48 minggu (Jaquette & Beuchat, 1998).
Pengeringan sel mikroba serta lingkungannya akan mengurangi aktivitas metabolik. Pada umumnya, lamanya mikroorganisme bertahan hidup setelah pengeringan bervariasi tergantung dari jenis mikroorganisme, bahan pembawa yang dipakai untuk mengeringkan mikroorganisme, kondisi fisik (cahaya, suhu, kelembaban) pada organisme yang dikeringkan. Spesies kokus gram negatif seperti Neisseria gonorrhoeae dan Neisseria meningitis sangat peka terhadap kekeringan, sehingga akan mati dalam waktu beberapa jam. Streptococcus jauh lebih resisten, beberapa species dapat bertahan berminggu-minggu setelah dikeringkan. Bacillus tuberculosis dapat bertahan dalam kekeringan selama jangka waktu yang lebih lama. Pada proses liofilisasi, mikroorganisme diberi perlakuan dehidrasi yang ekstrim dalam keadaan beku dan kemudian ditutup rapat dalam vakum. Liofilisasi lebih merupakan proses pengawetan daripada pembasmian mikroorganisme. Biakan mikroorganisme yang diliofilisasi akan tetap hidup selama bertahun-tahun (Pelczar & Chan, 2005).
2.2.4 Radiasi
Spora bakteri kurang peka terhadap radiasi atau mempunyai ketahanan yang lebih tinggi terhadap radiasi dibandingkan dengan bakteri yang tidak membentuk spora. Hal ini disebabkan karena struktur spesifik dari spora. Jika spora bakteri sudah dapat diinaktifkan dengan radiasi, maka dianggap bakteri kontaminan lain yang tidak membentuk spora sudah dapat juga dihilangkan dengan proses radiasi yang sama. Daya hidup mikroorganisme setelah radiasi tergantung pada laju radiasi dari dosis yang diabsorbsi sewaktu melakukan radiasi. Clostridium sporogenens
memiliki kemiripan katahanan terhadap radiasi dengan bakteri Clostridium
botulinum yang bersifat sangat toksigenik dalam hal ketahanan terhadap radiasi.
lainnya seperti Staphylococcus spp., Bacillus sp. dan koliform. Cobalt-60 digunakan sebagai sumber radiasi ionisasi (Natalia et al., 2009).
Secara umum sumber sinar ultraviolet dapat diperoleh secara alamiah dan buatan. Sinar matahari merupakan sumber utama ultraviolet di alam. Sumber ultraviolet buatan umumnya berasal dari lampu fluorescent khusus, seperti lampu merkuri tekanan rendah (low pressure) dan lampu merkuri tekanan sedang
(medium pressure). Lampu merkuri medium pressure mampu menghasilkan
radiasi ultraviolet yang lebih besar daripada lampu merkuri low pressure. Namun lampu merkuri low pressure lebih efisien dalam pemakaian listrik dibandingkan lampu merkuri medium pressure. Lampu merkuri low pressure menghasilkan radiasi maksimum pada panjang gelombang 253,7 nm yang letal bagi mikroorganisme, protozoa, virus dan alga, sedangkan radiasi lampu merkuri
medium pressure diemisikan pada panjang gelombang 180-1370 nm. Radiasi
ultraviolet yang diabsorbsi oleh protein pada membran sel akan menyebabkan kerusakan membran sel dan kematian sel (Cahyonugroho, 2010).
Bakteri gram negatif adalah yang paling peka terhadap radiasi (Yulianita, 2007). Untuk bakteri pembentuk spora, adanya kandungan air yang rendah dari spora menyebabkan resistensi spora terhadap radiasi. Selama germinasi, kandungan air protoplas spora bertambah dan karena itu resistensi radiasinya sangat berkurang (Darwis, 2006). Sinar ultraviolet dengan panjang gelombang 265 nm memiliki efisien bakterisidal tertinggi. Sinar X bersifat letal bagi mikroorganisme. Bakteri Escherichia coli dapat letal dengan penyinaran sinar X dengan dosis 5000 rad sedangkan Bacillus mesentericus dapat letal dengan dosis penyinaran sinar X sebesar 130.000 rad. Sinar X memiliki energi dan daya tembus yang tinggi (Pelczar & Chan, 2005).
2.3 Bakteri Pembentuk Spora dan Bacillus sp.
Bacillus merupakan bakteri pembentuk spora yang optimum tumbuh pada suhu mesofilik (35º C-55º C). Kelompok penting bakteri pembentuk spora lainnya adalah spesies Clostridium. Clostridium merupakan bakteri anaerob yang dapat tumbuh pada suhu mesofilik dan termofilik (Cousin, 1989). Clostridium spp. mampu mereduksi sulfat, membentuk spora basil, spora lebih kecil dari kista protozoa dan ookista. Spora Clostridium perfringens sangat tahan terhadap kondisi yang tidak menguntungkan termasuk suhu dan pH ekstrim, juga tahan terhadap proses desinfeksi seperti klorinasi (NHMRC & NRMMC, 2011). Beberapa bakteri menunjukkan tingkat resistensi tinggi terhadap klorin. Bakteri pembentuk spora seperti Bacillus atau Clostridium, Mycobacterium dan Nocardia sangat tahan terhadap desinfeksi klorin. Klorin dioksida sebanding dengan klorin bebas untuk inaktivasi bakteri dan virus pada pH netral (WHO, 2004).
Desulfotomaculum menghasilkan spora berbentuk bulat atau oval pada bagian terminal dan sunterminal yang menyebabkan pembengkakan pada sel. Sporohalobacter menghasilkan spora berbentuk bulat di bagian terminal. Sporolactobacillus menghasilkan spora berbentuk elips dan letaknya terminal, Sporosarcina menghasilkan spora berbentuk bulat diameternya 0,5-1,5 µm, Sulfidobacillus menghasilkan spora berbentuk bulat atau oval dan letaknya di bagian subterminal dan terminal. Syntrophospora menghasilkan spora berbentuk oval dan letaknya di bagian terminal serta membengkak pada sel (Holt et al., 1994).
Transfer interspesifik dan intraspesifik pada DNA di antara beberapa jenis
Bacillus telah dicapai, diantaranya pada Bacillus megaterium, Bacillus
thuringiensis, Bacillus lichenniformis, Bacillus cereus, Bacillus coagulans,
Bacillus brevis, Bacillus sphaericus, dan Bacillus stearothermophilus. Interaksi
genetik ini memberikan pengaruh pada identifikasi isolat dari berbagai habitat (Hatmanti, 2000). Bacillus berbentuk batang panjang dan relatif besar, katalase positif, berspora, oksidasi positif atau negatif, bersifat aerobik atau anaerobik fakultatif, motil atau tidak motil, memfermentasi glukosa atau tidak dan dapat bersifat fermentatif, oksidatif atau tidak keduanya (Naufalin, 1999). Famili
Bacillaceae kadang-kadang berbentuk streptobasil, flagel peritrik atau tanpa
Jenis Bacillus spp. menunjukkan bentuk koloni yang berbeda-beda pada medium agar cawan Nutrien Agar. Warna koloni pada umumnya putih sampai kekuningan atau putih keruh, tepi koloni bermacam-macam namun pada umumnya tidak rata, permukaannya kasar dan tidak berlendir, ada yang cenderung kering berbubuk, koloni besar dan tidak mengkilat. Bentuk koloni dan ukurannya sangat bervariasi tergantung dari jenisnya. Setiap jenis Bacillus spp. juga menunjukkan kemampuan dan ketahanan yang berbeda-beda dalam menghadapi kondisi lingkungannya, misalnya ketahanan terhadap panas, asam, kadar garam, dan sebagainya (Hatmanti, 2000).
Genus Bacillus memiliki 25 spesies dengan letak endospora di tengah atau di ujung sporangium (Irianto, 2006). Spora Bacillus mempunyai resistensi yang lebih dibandingkan sel vegetatifnya (Hatmanti, 2000). Spora Bacillus memiliki dinding yang tebal dan sangat resisten terhadap kondisi fisik yang kurang menguntungkan seperti suhu tinggi, kekeringan, radiasi, asam dan terhadap bahan-bahan kimia seperti desinfektan (Sembiring & Fachmiasari, 2004). Bila Bacillus subtilis berada dalam kondisi kekurangan nutrisi dalam media, Bacillus subtilis memiliki strategi bertahan termasuk motilitas, kemotaksis, produksi enzim, transformasi, pembentukan antibiotik untuk menekan persaingan nutrisi (Errington, 2003).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari sampai dengan Juli 2013, bertempat di laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain tabung reaksi, cawan petri, pro-pipet, pipet serologi, spatula, jarum ose, autoclave, oven, pipet mikro, erlenmeyer, hot-plate, vortex, inkubator, beaker glass, bunsen, mikroskop cahaya,
obyek glass, shaker, spektrofotometer UV-Visibel Shimadzu 1240, pH meter dan
water bath. Sedangkan Bahan-bahan yang digunakan dalam penelitian ini antara
lain akuades, alkohol 70%, larutan Mc-Farland (≈ 108 sel/ml), H2SO4 1 N, NaOH
1 N, media garam minimum kitin (MGMK) agar, media molase tripton, malachite
green, safranin dan isolat bakteri asal tanah Bangka Bacillus sp. yang sebelumnya
disebut sebagai isolat Bacillus sp. BK17 yang telah diketahui berpotensi menghasilkan enzim kitinase dalam aktivitas menghambat pertumbuhan jamur patogen dan dapat membentuk spora (Isolat Bacillus sp. BK17 dapat dilihat pada Lampiran 5 halaman 43).
3.3 Pelaksanaan Penelitian
3.3.1 Perbanyakan dan Pembuatan Suspensi Bakteri
dengan kerapatan sel 108 sel/ml (Perbanyakan dan pembuatan suspensi bakteri dapat dilihat pada Lampiran 1 halaman 39).
3.3.2 Uji Pengaruh pH Media terhadap Pembentukan Spora
Untuk mempelajari pengaruh pH terhadap pembentukan spora Bacillus sp. BK17 digunakan media molase tripton. Derajat keasaman (pH) media diatur dengan menambahkan NaOH 1 N untuk basa dan H2SO4 1 N untuk asam. Derajat
keasaman (pH) perlakuan yaitu 5,0; 6,0; 7,0; 8,0 dan 9. Media disterilkan dengan
autoclave selama 15 menit pada suhu 121o C pada tekanan 15 psi (Ahdianto,
2006). Sebanyak 10% inokulum cair isolat bakteri yang setara dengan kekeruhan larutan Mc-Farland (≈ 108 sel/ml), diinokulasikan ke dalam 50 ml media secara aseptis. Kultur bakteri diinkubasi pada shaker dengan kecepatan 100 rpm selama 72 jam pada suhu 28° C (Kultur bakteri dalam media molase tripton dengan variasi pH dapat dilihat pada Lampiran 5 halaman 43). Pengukuran kepadatan sel dan kepadatan spora dihitung dengan menggunakan spektrofotometer masing-masing dengan panjang gelombang 600 nm dan 660 nm (Sembiring dan Fachmiasari, 2004). Setiap perlakuan dilakukan dengan empat ulangan sehingga total perlakuan pH adalah 20 perlakuan (Uji pengaruh pH media terhadap pembentukan spora dapat dilihat pada Lampiran 2 halaman 40).
3.3.3 Uji Pengaruh Perubahan Temperatur terhadap Pembentukan Spora
Sebanyak 10% inokulum cair isolat bakteri yang setara dengan kekeruhan larutan Mc-Farland (≈ 108 sel/ml), diinokulasikan ke dalam 50 ml media molase tripton secara aseptis. Kultur bakteri diinkubasi pada shaker dengan kecepatan 100 rpm selama 72 jam pada suhu 28° C (Kultur bakteri dalam media molase tripton dengan variasi temperatur dapat dilihat pada Lampiran 5 halaman 43).
spektrofotometer masing-masing dengan panjang gelombang 600 nm dan 660 nm (Sembiring & Fachmiasari, 2004). Setiap perlakuan dilakukan dengan dua kali ulangan, sehingga total perlakuan temperatur adalah 24 perlakuan (Uji pengaruh temperatur terhadap pembentukan spora dapat dilihat pada Lampiran 3 halaman 41).
3.4 Parameter Pengamatan 3.4.1 Kepadatan Sel
Pengukuran kepadatan sel dilakukan dengan menggunakan
spektrofotometer dengan panjang gelombang 600 nm (Sembiring & Fachmiasari,
2004). Pengukuran dilakukan setelah 72 jam masa inkubasi.
3.4.2 Kepadatan Spora
Pengukuran kepadatan spora dilakukan dengan menggunakan
spektrofotometer dengan panjang gelombang 660 nm (Sembiring & Fachmiasari,
2004). Pengukuran dilakukan setelah 72 jam masa inkubasi.
3.4.3 Pengamatan Spora
BAB 4
HASIL DAN PEMBAHASAN
4.1 Pengaruh pH
4.1.1 Kepadatan Sel Bacillussp. BK17
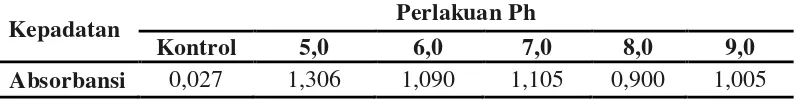
Dari hasil penelitian sebelumnya telah diketahui bahwa media yang paling baik untuk pertumbuhan dan pembentukan spora Bacillus sp. BK17 adalah media molase tripton, sehingga media tersebut digunakan dalam penelitian ini. Kepadatan sel Bacillus sp. BK17 pada media denga pH yang berbeda setelah 72 jam dapat dilihat pada Tabel 4.1.1 berikut.
Kepadatan Perlakuan Ph
Kontrol 5,0 6,0 7,0 8,0 9,0
Absorbansi 0,027 1,306 1,090 1,105 0,900 1,005
Dari data yang diperolehdiketahui bahwakepadatan sel Bacillus sp. BK17 bervariasi setelah masa inkubasi 72 jam. Pada media pH 5,0 kepadatan sel paling tinggi dibandingkan dengan variasi pH yang lainnya yaitu sebesar 1,306, diikuti oleh media pH 7,0 dengan absorbansi sel sebesar 1,105 dan yang paling rendah kepadatan selnya adalah media pH 8,0 yaitu sebesar 0,900, sedangkan yang lainnya pada pH 6,0; 7,0 dan 9,0 kepadatan selnya relatif sama. Pada Gambar 4.1.1 dapat dilihat kepadatan sel Bacillus sp. BK17 setelah masa inkubasi 72 jam.
Dari hasil (Tabel 4.1.1 dan Gambar 4.1.1), dapat dilihat bahwa pertumbuhan Bacillus sp. BK17 dipengaruhi oleh pH media. Hasil di atas menunjukkan bahwa pH 5,0 memiliki pertumbuhan yang paling tinggi pada media molase tripton. Hal ini mungkin disebabkan karena Bacillus sp. BK17 lebih maksimal melakukan metabolisme pada kondisi asam sehingga pertumbuhan yang dihasilkan lebih tinggi pada kondisi tersebut. Pertumbuhan yang tinggi pada pH
Tabel 4.1.1 Kepadatan Sel Bacillus sp. BK17 (λ = 600 nm) setelah 72 Jam
5,0 ini dapat juga disebabkan karena sistem transport dan enzim yang bekerja maksimal pada media pH 5,0.
Media pH 8,0 memiliki aktivitas pertumbuhan yang paling rendah, hal ini menunjukkan proses metabolisme sel terhambat pada kondisi alkali. Namun, pada pH 9,0 aktivitas pertumbuhan meningkat diikuti pertumbuhan sel yang meningkat pada pH 6,0 selanjutnya meningkat lagi pada pH 7,0. Menurut Kurniawan (2012), pertumbuhan bakteri menunjukkan proses pertambahan jumlah dan volume sel.
Mikroorganisme tumbuh dan berkembang biak dengan menggunakan berbagai bahan yang terdapat di lingkungannya. Menurut Sembiring & Fachmiasari (2004), proses metabolisme dan pertumbuhan bakteri sangat membutuhkan nitrogen sebagai unsur pokok dalam pembentukan protein, asam nukleat dan komponen sel lainnya. Kemampuan bakteri untuk menggunakan nutrient organik utama sebagai sumber karbon dan energi bergantung pada mekanisme enzimatik dalam mendegradasi sumber karbon dan bergantung juga pada kemampuan sel untuk mengangkut hasil degradasi nutrient organik untuk selanjutnya digunakan dalam aktivitas metabolisme.
Pertumbuhan mikroorganisme juga dipengaruhi oleh faktor lingkungan, salah satunya pH. Sewaktu pertumbuhan mikroorganisme, konsentrasi ion hidrogen (pH) dalam media mempengaruhi protein yang terdapat dalam membran sel. Struktur protein akan berubah bila pH dalam media berubah. Mikroorganisme memiliki enzim yang berfungsi dengan baik pada pH tertentu. Bila terjadi perubahan pH, pertumbuhan dan metabolisme mikroorganisme dapat terhenti (Lay, 1994). Bakteri tidak tumbuh dengan baik pada pH < 5,0 dan > 8,5 dan tumbuh optimum sekitar pH 6,5-7,5 (Suprihatin, 2010).
Pertumbuhan sel dalam setiap derajat keasaman berbeda pada masing-masing jenis bakteri. Bakteri pengoksidasi ammonium meningkat jumlah selnya sejalan dengan meningkatnya pH yaitu pada pH 7,0-9,0 (Agustiyani et al., 2004). Ciccyliona & Nafwa (2012) melaporkan bahwa Pseudomonas aeruginosa isolat lokal tumbuh maksimal pada pH 8,0 dan bakteri pendegradasi fenol tumbuh optimum pada pH 7,0-9,0 (Ulya, 2012).
Hasil ini berbeda dengan yang dilaporkan oleh Cheong (2006), dimana pertumbuhan maksimal Bacillus sp. pada media dengan sumber karbon glukosa,
berlangsung pada pH 7,0. Perbedaan pertumbuhan ini kemungkinan disebabkan oleh perbedaan jenis Bacillus yang digunakan dan juga jenis media yang
4.1.2 Kepadatan Spora Bacillussp. BK17
Kepadatan Perlakuan pH
Kontrol 5,0 6,0 7,0 8,0 9,0
Absorbansi 0,084 1,161 0,915 0,979 0,772 1,087
Dari hasil (Tabel 4.1.2) dapat dilihat bahwa media pH 5,0 memiliki kepadatan spora paling tinggi dibandingkan dengan pH lainnya dengan kepadatan spora sebesar 1,161, diikuti oleh media pH 9,0 dengan kepadatan spora sebesar 1,087 dan yang paling rendah adalah media pH 8,0 dengan kepadatan spora sebesar 0,772, sedangkan yang lainnya pada pH 6,0 dan 7,0 kepadatan sporanya relatif sama. Gambar 4.1.2 menunjukkan kepadatan spora Bacillus sp. BK17 pada beberapa variasi pH setelah masa inkubasi 72 jam.
Dari Gambar 4.1.2 dapat dilihat bahwa derajat keasaman (pH) media sangat mempengaruhi pembentukan spora yang dihasilkan oleh Bacillus sp. BK17. Pada media pH 5,0 memiliki kepadatan spora paling tinggi dibandingkan
Tabel 4.1.2 Kepadatan Spora Bacillus sp. BK17 (λ = 660 nm) setelah 72 Jam
Inkubasi pada Media dengan pH yang Bervariasi (kontrol = 0 hari)
Gambar 4.1.2 Kepadatan Spora Bacillus sp. BK17 setelah 72 Jam Inkubasi
dengan variasi pH yang lainnya. Hal ini mungkin disebabkan karena sel bakteri yang sudah mengalami pertumbuhan pada kondisi yang optimum memasuki fase stasioner dan banyak spora dibentuk. Pada kondisi tersebut faktor lingkungan sudah pada kondisi optimum untuk pertumbuhan sel sehingga untuk melangsungkan kehidupannnya, sel bakteri dirangsang untuk membentuk spora. Semakin cepat tercapainya fase stasioner pada sel maka semakin cepat terbentuknya spora.
Spora biasanya terbentuk pada lingkungan yang kurang sesuai bagi pertumbuhannya. Menurut Lesmana (2002), spora yang diproduksi beberapa mikroorganisme merupakan suatu mekanisme pertahanan hidup. Keadaan ini ditemukan bila bakteri berada dalam kondisi nutrisi yang kurang. Baik mikroba akuatik maupun tanah mampu berfungsi pada tingkat metabolik rendah misalnya pada waktu keadaan lingkungan sangat ekstrim.
Derajat keasaman (pH) 5,0 merupakan kondisi yang paling sesuai bagi
Bacillus sp. BK17 untuk membentuk spora dan pertumbuhannya juga paling baik
pada kondisi pH 5,0. Oleh karena itu media pH 5,0 tidak merupakan kondisi ekstrim karena petumbuhan Bacillus sp. BK17 paling tinggi pada pH 5,0 tetapi pH ini juga baik untuk pembentukan spora. Dari hasil penelitian yang belum dipublikasi (Rachmi, 2013), pertumbuhan tertinggi Bacillus sp. BK17 setelah 72 jam masa inkubasi merupakan pertumbuhan maksimum.
Media dengan pH 8,0 memiliki kepadatan spora paling rendah di antara variasi pH yang lainnya. Hal ini mungkin disebabkan karena pada media pH 8,0 sel baru akan memulai fase stasioner dan mengalami fase adaptasi pertumbuhan awal yang lama, oleh karena itu hanya sedikit sel yang tumbuh sehingga spora yang terbentuk sedikit.
pertumbuhan sel paling tinggi berlangsung pada media pH 6,75. Jumlah spora Bacillus thuringiensis subsp. israelensis yang terbentuk dapat dipanen pada jam ke-72.
4.2 Pengaruh Perubahan Temperatur 4.2.1 Kepadatan Sel Bacillus sp. BK17
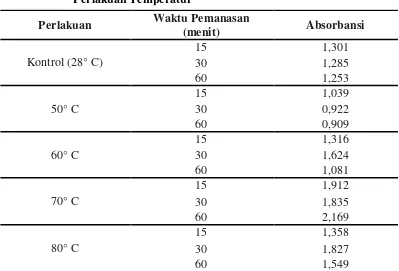
Kepadatan sel Bacillus sp. BK17 dengan panjang gelombang (λ) = 600 nm pada variasi temperatur dapat dilihat pada Tabel 4.2.1 berikut (kultur yang digunakan berumur 72 jam).
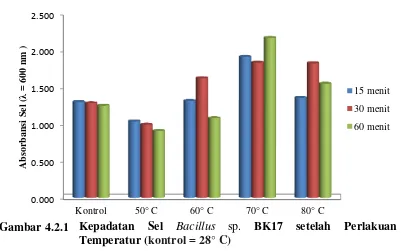
Tabel 4.2.1 menunjukkan bahwa kepadatan sel Bacillus sp. BK17 pada λ = 600 nm bervariasi setelah perlakuan temperatur. Temperatur 70° C selama 60 menit kepadatan sel Bacillus sp. BK17 paling tinggi dibandingkan dengan temperatur lainnya yaitu sebesar 2,169, diikuti oleh temperatur 70° C selama 15 menit dengan absorbansi sel sebesar 1,912 dan yang paling rendah absorbansi selnya adalah pada temperatur 50° C selama 60 menit yaitu 0,909. Pada Gambar 4.2.1 dapat dilihat kepadatan sel Bacillus sp. BK17 setelah perlakuan temperatur (kultur berumur 72 jam).
Tabel 4.2.1 Kepadatan Sel Bacillus sp. BK17 (λ = 600 nm) setelah
Dari hasil yang diperoleh (Tabel 4.2.1 dan Gambar 4.2.1) dapat dilihat bahwa pertumbuhan Bacillus sp. BK17 dipengaruhi oleh temperatur lingkungan. Hasil tersebut menunjukkan bahwa kepadatan sel paling tinggi berlangsung pada
temperatur 70° C selama 60 menit. Hal ini mungkin disebabkan karena pada kondisi tersebut sel bakteri bekerja maksimal melakukan proses-proses metabolisme dan pembelahan sel. Pada temperatur 50° C selama 60 menit kepadatan sel menunjukkan pertumbuhan yang paling rendah dibandingkan temperatur lainnya. Hal ini mungkin disebabkan karena pada kondisi tersebut sel bakteri kurang sesuai dalam melakukan pertumbuhan dan kegiatan-kegiatan seluler lainnya. Selain itu sel mengalami fase adaptasi yang lama sehingga jumlah sel yang tumbuh lebih sedikit. Perbedaan lamanya fase pertumbuhan pada masing-masing temperatur dapat disebabkan oleh perbedaan kemampuan bakteri untuk tumbuh pada jenis kondisi yang tersedia.
Menurut Suprihatin (2010), jika sel bakteri dipindahkan ke dalam suatu medium, sel bakteri akan mengalami fase adaptasi untuk menyesuaikan diri dengan kondisi lingkungan disekitarnya. Lamanya fase adaptasi ini dipengaruhi oleh medium dan lingkungan pertumbuhan. Jika medium dan lingkungan pertumbuhan sama seperti medium dan lingkungan sebelumnya, mungkin tidak diperlukan waktu adaptasi, tetapi jika nutrisi yang tersedia dan kondisi lingkungan
berbeda dengan sebelumnya, diperlukan waktu penyesuaian untuk mensintesis enzim-enzim. Setelah mengalami fase adaptasi, sel bakteri mulai membelah dengan kecepatan yang rendah karena baru mulai menyesuaikan diri.
Kecepatan pertumbuhan sangat dipengaruhi oleh medium tempat tumbuhnya seperti pH dan kandungan nutrien, juga kondisi lingkungan termasuk temperatur dan kelembaban udara (Suprihatin, 2010). Menurut Lay (1994), kisaran temperatur untuk aktivitas enzim menentukan sifat pertumbuhan mikroorganisme. Setiap bakteri mempunyai temperatur optimum. Pada temperatur
optimum ini pertumbuhan bakteri berlangsung dengan cepat. Di luar kisaran
temperatur optimum, pertumbuhan bakteri menjadi menjadi sangat lambat atau tidak ada pertumbuhan. Menurut Haetami et al. (2008) mikroba dapat tumbuh pada temperatur pertumbuhan minimum, tetapi pertumbuhannya tidak maksimal.
Kepadatan sel Bacillus sp. BK17 semakin menurun pada temperatur 50° C yang dimulai pada waktu pemanasan 15 menit, menurun kembali pertumbuhannya pada waktu 30 menit sampai waktu 60 menit. Pada temperatur 60° C, kepadatan sel meningkat dimulai pada waktu 15 menit dan terus meningkat pada waktu 30 menit, tetapi menurun kepadatan selnya pada waktu 60 menit. Pada temperatur 80° C, kepadatan sel perlahan meningkat dimulai pada waktu 15 menit, meningkat lagi pada waktu 30 menit dan mengalami penurunan pada waktu 60 menit. Temperatur 70° C merupakan kondisi optimum pertumbuhan Bacillus sp. BK17 karena dibandingkan dengan temperatur lain, kondisi ini memiliki kepadatan sel yang paling tinggi pada setiap waktu pemanasan.
Pada fase pertumbuhan logaritmik, sel-sel lebih tahan terhadap keadaan ekstrim seperti panas, dingin, radiasi dan bahan-bahan kimia (Suprihatin, 2010). Bacillus licheniformis bersifat thermofil dan mempunyai temperature optimum pertumbuhannya pada 50-55o C (Haetami et al., 2008). Temperatur optimum bagi hampir semua mikroorganisme tanah umumnya 10-40° C, walaupun ada beberapa yang dapat hidup pada temperatur hingga 60° C (bakteri termofilik). Umumnya Bacillus sp. mampu bertahan hingga temperatur 45° C. Kisaran temperatur ini sesuai dengan pertumbuhan bakteri jenis mesofilik, yang dapat hidup pada temperatur 15-45° C, dengan tingkat optimum pertumbuhan pada temperatur 25-35° C (Kurniawan, 2012). Bacillus stearothermophilus F1 yang diisolasi dari cabang kelapa sawit tumbuh optimum pada temperatur 70° C (Zaliha, 1994).
Beberapa bakteri pembentuk spora mampu tumbuh pada temperatur yang tinggi. Desulfotomaculum dapat tumbuh pada temperatur 20-70° C dan tumbuh optimum pada temperatur 30-50° C. Desulfotomaculum geothermicum, Desulfotomaculum nigrificans dan Desulfotomaculum kuznetsovii dapat tumbuh di atas temperatur 40° C, sedangkan Desulfotomaculum acetocidans, Desulfotomaculum antarcticum, Desulfotomaculum guttoideum,
Desulfotomaculum orientis, Desulfotomaculum riminis dan Desulfotomaculum sapomandens tidak dapat tumbuh pada temperatur tinggi. Clostridium tahan pada kondisi lingkungan yang kurang baik termasuk temperatur, mampu bermetabolisme dan melakukan pertumbuhan pada temperatur 10-65° C (Holt et al., 1994).
4.2.2 Kepadatan Spora Bacillus sp. BK17
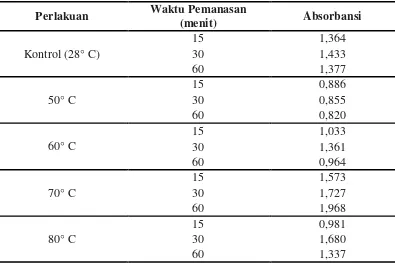
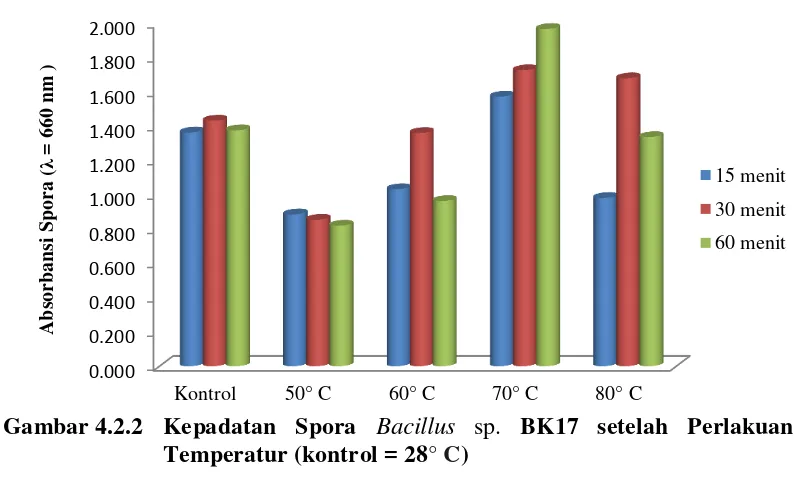
Selain pH media, faktor lainnya yang mempengaruhi pembentukan spora bakteri yaitu temperatur. Dari empat variasi temperatur yang dilakukan, yaitu temperatur 50° C, 60° C, 70° C dan 80° C menunjukkan perbedaan kepadatan spora yang dihasilkan Bacillus sp. BK17 dapat dilihat pada Tabel 4.2.2 (kultur yang digunakan berumur 72 jam).
temperatur yang lainnya dengan absorbansi spora sebesar 1,968, diikuti oleh temperatur 70° C selama 30 menit dengan absorbansi spora sebesar 1,727. Temperatur yang paling rendah kepadatan sporanya adalah pada temperatur 50° C selama 60 menit dengan absorbansi spora sebesar 0,820. Gambar 4.2.2 menunjukkan kepadatan spora yang dihasilkan Bacillus sp. BK17 pada beberapa temperatur (kultur berumur 72 jam). bahwa pembentukan spora Bacillus sp. BK17 dipengaruhi oleh temperatur lingkungan. Pada temperatur 70° C selama 60 menit dihasilkan lebih banyak spora, hal ini mungkin disebabkan karena pada kondisi tersebut setelah sel melakukan pertumbuhan, sel tersebut membentuk spora karena sudah memasuki fase pertumbuhan yang maksimal, sehingga sel yang tumbuh selanjutnya digunakan untuk proses sporulasi agar sel dapat melangsungkan kehidupannya. Temperatur 50° C selama 60 menit merupakan kondisi paling sedikit spora dihasilkan, hal ini dapat disebabkan karena pada kondisi tersebut sel mengalami fase adaptasi
Tabel 4.2.2 Kepadatan Spora Bacillus sp. BK17 (λ = 660 nm) setelah
pertumbuhan yang lama sehingga kepadatan sel menjadi sedikit oleh karena itu sel tidak banyak membentuk spora.
Pembentukan spora bakteri dimulai pada fase stasioner. Menurut Salaki dan Sembiring (2009), pembentukan spora Bacillus thuringiensis berlangsung pada saat sel memasuki fase stasioner, hal ini disebabkan karena kandungan nutrisi pada media telah habis digunakan untuk pertumbuhan bakteri, sehingga dalam kondisi seperti ini bakteri membentuk spora.
Temperatur merupakan salah satu faktor lingkungan yang mempengaruhi pembentukan spora bakteri (Irianto, 2006). Spora Clostridium botulinum tahan pada temperatur mendidih selama pemanasan beberapa jam (Waluyo, 2007).
Pembentukan produk kristal protein oleh Bacillus thuringiensis subsp. israelensis pada saat bersporulasi tergantung pada temperatur yang sama dengan pertumbuhan, tetapi temperatur yang optimum untuk pertumbuhan dan pembentukan produk tidak harus sama (Ahdianto, 2006). Naufalin (1999) dalam penelitiannya melaporkan bahwa Bacillus subtilis mampu tumbuh optimum pada temperatur 45° C dan membentuk spora paling tinggi pada temperatur 90° C selama pemanasan 20 menit dan 121° C selama pemanasan 2 menit.
Pembentukan spora Bacillus sp. BK17 pada beberapa temperatur menunjukkan hasil yang bervariasi. Temperatur 70° C selama 30 menit merupakan kondisi pembentukan spora paling tinggi setelah temperatur 70° C selama 60 menit. Pada kondisi ini sel yang tumbuh mulai membentuk banyak spora. Pada temperatur 80° C pembentukan spora perlahan menurun pada waktu 60 menit. Hal ini mungkin disebabkan karena sel vegetatif untuk membentuk spora sudah mulai berada pada fase kematian. Temperatur 50° C selama 15 menit kepadatan spora meningkat dan perlahan menurun pada waktu 30 menit sampai 60 menit. Pada temperatur 60° C selama 15 menit kepadatan spora perlahan meningkat sampai waktu 30 menit dan kembali turun pada waktu 60 menit.
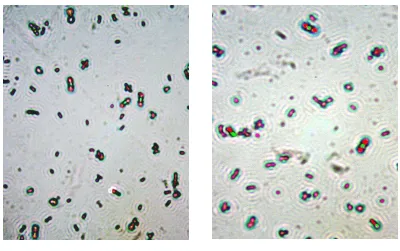
4.3 Pengamatan Spora
Pengamatan spora Bacillus sp. BK17 dilakukan untuk mengetahui spora yang terbentuk pada saat perlakuan pH dan temperatur. Spora yang terbentuk dari hasil perlakuan dapat dilihat pada Gambar 4.3 berikut.
Gambar 4.3 Pengamatan Mikroskopis Hasil Pewarnaan Spora Bacillus sp.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian tentang pengaruh pH dan perubahan temperatur terhadap pembentukan spora Bacillus sp. BK17 dapat diambil kesimpulan sebagai berikut:
a. Derajat keasaman (pH) media terbaik untuk pembentukan spora Bacillus sp. BK17 adalah pH 5.
b. Temperatur terbaik untuk pembentukan spora Bacillus sp. BK17 adalah temperatur 70° C selama 60 menit.
5.2 Saran
DAFTAR PUSTAKA
Agustiyani, D., Imamuddin, H., Faridah, E.N. & Oedjijono. 2004. Pengaruh pH dan Substrat Organik Terhadap Pertumbuhan dan Aktivitas Bakteri Pengoksidasi Amonia. Jurnal Biodiversitas. 5(2): 43-47.
Ahdianto, D.F. 2006. Kajian Pengaruh pH dan Suhu Terhadap Produksi Bioinsektisida oleh Bacillus thuringiensis subsp. israelensis Menggunakan Substrat Onggok Tapioka. [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Angert, E.R. & Losick, R.M. 1998. Propagation by Sporulation in The Guinea Pig Symbiont Metabacterium polyspora. Proceedings of The National Academy of Sciences. USA. 95. pages. 10218–10223.
Cahyonugroho, O.H. 2010. Pengaruh Intensitas Sinar Ultraviolet dan Pengadukan Terhadap Reduksi Jumlah Bakteri E.coli. Jurnal Ilmiah Teknik
Lingkungan. 2(1): 18-23.
Chary, V.K., Hilbert, D.W., Higgins, M.L. & Piggot, P.J. 2000. The Putative DNA Translocase SpoIIIE is Required for Sporulation of The Symmetrically Dividing Coccal Species Sporosarcina ureae. Molecular Microbiology. 35. 612–622.
Cheong, L.K. 2006. Optimization of Conditions for High Cell Density Cultivation of Bacillus subtilis. [Tesis]. Malaysia: Universitas Putra Malaysia.
Ciccyliona & Nafwa, R. 2012. Pengaruh pH terhadap Produksi Biosurfaktan oleh Bakteri Pseudomonas aeruginosa Lokal. Jurnal Sains dan Seni Pomits. 1(1): 1-6.
Cousin, M.A. 1989. Sporeforming Bacteria in Foods. Purdue University Press. West Layfayette.
Darwis, D. 2006. Sterilisasi Produk Kesehatan (Health Care Product) dengan Radiasi Berkas Elektron. Prosiding Pertemuan dan Presentasi Ilmiah Teknologi Ahelerator dan Aplikasinya. Jakarta, Juli 2006. hal. 78-86.
Dephamphilis, J.B & Hanson, R.S. 1969. Relationship between Glucose Utilization and Growth Rate in Bacillus subtilis. Journal Bacteriology. 98(1): 222-225.
Errington, J. 2003. Regulation of Endospore Formation in Bacillus subtilis. Nature Reviews Microbiology. 1: 117-126.
[ESR] Environmental Science and Research. 2010. Bacillus cereus. Client Report. Institute of Environmental Science and Research (ESR) Limited. Porirua.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT. Gramedia Pustaka Utama. Jakarta.
Fawcett, P., Eichenberger, P., Losick, R. & Youngman, P. 2000. The Transcriptional Profile of Early to Middle Sporulation in Bacillus subtilis. Proceedings of the National Academy of Science. USA. 97. pages. 8063-8068.
Fujita, M. & Losick, R. 2003. The Master Regulator for Entry into Sporulation in
Bacillus subtilis becomes a Cell-Specific Transcription Factor After
Asymmetric Division. Genes Development. 17: 1166–1174.
Haetami, K., Abun & Mulyani, Y. 2008. Studi Pembuatan ProbiotikBAS (Bacillus licheniformis, Aspergillus niger, dan Sacharomices cereviseae) Sebagai Feed Suplement serta Implikasinya terhadap Pertumbuhan Ikan Nila Merah. Laporan Penelitian. Fakultas Perikanan Dan Ilmu Kelautan, Universitas Padjadjaran.
Hatmanti, A. 2000. Pengenalan Bacillus spp.. Balitbang Lingkungan Laut,
Puslitbang Oseanologi-LIPI. 25(1): 31-41.
Hidayat, I. 2005. Pengaruh pH terhadap Aktivitas Endo-1,4-β-Glucanase Bacillus
sp. AR 009. Jurnal Biodiversitas. 6(4):242-244.
Holt, J.G., Krieg, N.R., Sneath, P.H.A., Staley, J.T. & Williams, S.T. 1994. Determinative Bacteriology. Ninth Edition. Williams and Wilkins.USA. Hyronimus, B., Marrec C.L., Sassi, A.H. & Deschamps, A. 2000. Acid and Bile
Tolerance of Spore Forming Lactic Acid Bacteria. International Journal of Food Microbiology. 61: 193–197
Irianto, K. 2006. Mikrobiologi Menguak Dunia Mikroorganisme. Jilid 1. CV. Yrama Widya. Bandung.
Jaquette C.B & Beuchat L.R. 1998. Survival and Growth of Psychrotrophic Bacillus cereus in Dry and Reconstituted Infant Rice Cereal. Journal of Food Protection. 61: 1629-1635.
Karow, M.L., Glaser, P. & Piggot, P.J. 1995. Identification of a Gene, spoIIR, that
Links the Activation of σE to The Transcriptional Activity of σF During
Kurniawan, A. 2012. Simulasi Proses Bioremediasi Pada Lahan Terkontaminasi Total Petroleum Hidrokarbon (TPH). Seminar nasional Waste Management I. Surabaya, 21 Februari 2012. hal. 217-222.
Labell, T.L., Trempy, J.E. & Haldenwang, W.G. 1987. Sporulation Specific σ Factor σ29 of Bacillus subtilis is Synthesized from a Precursor Protein, P31. Proceedings of The National Academy of Sciences. USA. 84. pages. 1784–1788.
Lay, B. W. 1994. Analisis Mikroba di Laboratorium. PT Raja Grafindo Persada. Jakarta.
Lesmana, M. 2002. Vibrio cholerae O1, Viable but Nonculturable. Jurnal Kedokteran Trisakti. 21(3): 112.
Margolis, P., Driks, A. & Losick, R. 1993. Sporulation Gene SpoIIB from Bacillus subtilis. Journal Bacteriology. 175: 528–540.
Melliawati, R. 2009. Escherichia coli dalam Kehidupan Manusia. Bio Trends. 4(1): 10-14.
Natalia, L., Priadi, A. & Irawati, Z. 2009. Pengaruh Iradiasi terhadap Daya Hidup Bakteri Kontaminan dalam Makanan. Jurnal Ilmu Ternak dan Veteriner. 14(1): 58-65.
Naufalin, R. 1999. Isolasi, Identifikasi dan Ketahanan Panas Bakteri Pembentuk Spora Aerob pada Bumbu Masakan Tradisional. [Tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
[NHMRC & NRMMC] National Health and Medical Research Council and National Resource Management Ministerial Council. 2011. Australian Drinking Water Guidelines Paper 6 National Water Quality Management Strategy. Commonwealth of Australia. Canberra.
Noviana, L & Raharjo, B. 2009. Viabilitas Rhizobakteri Bacillus sp. DUCC-BR-K1.3 pada Media Pembawa Tanah Gambut Disubstitusi dengan Padatan Limbah Cair Industri Rokok. BIOMA. 11(1): 30-39.
Pelczar, M.J & Chan, E.C.S. 2005. Dasar-Dasar Mikrobiologi. Jilid 2. Penerjemah Ratna Siri Hadioetomo, Teja Mas, S. Sutarmi Tjitrosomo & Sri lestari Angka. UI Press. Jakarta.
. 2008. Dasar-Dasar Mikrobiologi. Jilid 1. Penerjemah Ratna Siri Hadioetomo, Teja Mas, S. Sutarmi Tjitrosomo & Sri lestari Angka. UI Press. Jakarta.
Pertumbuhan Spora Bacillus cereus dan Clostridium perfringens. Jurnal Teknologi dan Industri Pangan. 20(1): 1-8.
Rachmi. 2013. Pengaruh Nutrisi terhadap Pertumbuhan dan Pembentukan Spora Bacillus sp. [Skripsi]. Medan: Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara [In Press].
Ray, B. 2004. Fundamental Food Microbiology. Third Edition. CRC Press. New York.
Salaki, C.L & Sembiring, L. 2009. Eksplorasi Bakteri Bacillus thuringiensis dari berbagai Habitat Alami yang Berpotensi sebagai Agensia Pengendali Hayati Nyamuk Aedes Aegypti Linnaeus. Seminar Nasional Biologi XX dan Kongres PBI XIV UIN Maliki. Malang, 24-25 Juli 2009. hal. 156-161.
Salamah, U. 2002. Kajian Produksi Bioinsektisida Bacillus thuringiensis subsp.
Israelensis pada Media Tapioka. [Skripsi]. Bogor: Fakultas Teknologi
Pertanian, Institut Pertanian Bogor.
Schulz, M.E., Fricker, M. & Scherer, S. 2004. Bacillus cereus the Causative Agent of an Emetic Type of Foodborne Illness. Molecular Nutrition and Food Research. 48: 479-487.
Sembiring, A. 2012. Kemampuan Bakteri Antagonistik dalam Menghambat Infeksi Saprolegnia sp. pada Ikan Nila (Oreochromis niloticus). [Skripsi]. Medan: Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
Sembiring, T & Fachmiasari, A. 2004. Kombinasi Ekstrak Kedelai dengan Tepung Jagung dan Tapioka sebagai Media Produksi Kristal Spora
Bacillus thuringiensis. Jurnal Tekonologi Indonesia LIPI Press. 27: 33-49.
Sulistiani. 2009. Formulasi Spora Bacillus subtilis sebagai Agen Hayati dan PGPR (Plant Growth Promoting Rhizobacteria) pada Berbagai Bahan Pembawa. [Skripsi]. Bogor: Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Suprihatin. 2010. Tekonologi Fermentasi. Penerbit UNESA University Press. Surabaya.
Tanuwidjadja. 1975. Single Cell Protein. Laporan Ceramah Ilmiah. LKN-LIPI. Bandung.
Ulya, A. 2012. Pengaruh Variasi pH dan Suhu terhadap Kemampuan Degradasi Fenol dan Pertumbuhan Bakteri Pendegradasi Fenol dari Limbah Cair Tekstil. [Skripsi]. Yogyakarta: Jurusan Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negri Sunan Kalijaga.
Vallejo, J.A.L. & Stragier, P. 1995. Cell-cell Signaling Pathway Activating a Developmental Transcription Factor in Bacillus subtilis. Genes
Development. 9: 503–508.
Waluyo, L. 2007. Mikrobiologi Umum. Edisi Revisi. UMM Press. Malang.
. . 2010. Teknik Metode Dasar Mikrobiologi. UMM Press. Malang.
[WHO] World Health Organization. 2004. Water Treatment and Pathogen Control: Process Efficiency in Achieving Safe Drinking Water. IWA Publishing. London, UK.
Wu, X.Y., Zheng, G., Zhang, W.W., Wu, M & Zhu, X.F. 2010. Amphibacillus jilinensis sp. nov., a Facultatively Anaerobic, Alkaliphilic Bacillus from a Soda Lake. International Journal of Systematic and Evolutionary Microbiology. 60: 2540–2543.
Yehuda, S.B & Losick, R. 2002. Asymmetric Cell Division in B. subtilis Involves a Spiral-Like Intermediate of the Cytokinetic Protein FtsZ. Cell. 109: 257– 266.
Young, E & James, P.C. 1959. Chemical and Morphological Studies of Bacterial Spore Formation The Formation of Spores in Bacillus cereus. Journal Biophysic and Biocheumical Cytology. 6(3): 467-481.
Yulianita, I. 2007. Kajian Sifat Fisik dan Listrik terhadap Kualitas Daging Sapi pada Suhu Ruang yang Diiradiasi Sinar Gamma 60Co. [Skripsi]. Bogor: Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yunianto, P., Rahayu, K & Wahyuntari, B. 2000. Pengaruh pH dan Suhu terhadap
Produksi β-Siklodekstrin Glikosil Transferase (β-CGT-ase) oleh Bacillus sp. BK-1. Jurnal Sains dan Teknologi Indonesia. 2(2): 27-31.
Zaliha, R.N. 1994. Production and Characterisation of Thermostable Protease from Bacillus stearothermophilus Strain F1. [Tesis]. Malaysia: Master of Science, Faculty of Science and Environmental Studies, Universiti Pertanian Malaysia.
Zeigler, D.R. 2001. Bacillus Genetic Stock Center Catalog of Strains. The Genus Geobacillus Introduction and Strain Catalog. 3(7): 1-23.
LAMPIRAN
Lampiran 1. Perbanyakan dan Pembuatan Suspensi Bakteri
Dikultur dalam media MGMK agar selama ± 2 hari pada suhu kamar
Diambil hasil subkultur menggunakan jarum ose
Dimasukkan kedalam tabung yang berisi 10 ml akuades steril
Dihomogenkan
Disamakan kekeruhannya dengan standart Mc Farland (≈ 108 sel/ml).
.
Biakan Bakteri
Lampiran 2. Uji Pengaruh pH Media terhadap Pembentukan Spora
Ditambahkan 10% inokulum suspensi bakteri yang setara dengan kekeruhan larutan standart Mc Farland (≈ 108 sel/ml).
Diinkubasi kultur bakteri pada shaker dengan kecepatan 100 rpm pada temperatur 28 o C selama 72 jam.
Diukur kepadatan sel dan kepadatan spora dengan menggunakan
spektrofotometer masing-masing dengan panjang gelombang
600 nm dan 660 nm
Media Molase Tripton (pH 5,
6, 7, 8, 9)