ANALISIS VARIASI GENETIK POPULASI TANAMAN
KARET (
Hevea brasiliensis)
SUMBER EKSPLAN UNTUK
PERBANYAKAN
IN VITRO
BERDASARKAN RAPD
TATI HUSNIYATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TATI HUSNIYATI. Analisis Variasi Genetik Populasi Tanaman Karet (
Hevea
brasiliensis
) Sumber Eksplan untuk Perbanyakan
in vitro
Berdasarkan RAPD.
Dibimbing oleh EDY DJAUHARI PURWAKUSUMAH dan NURHAIMI
HARIS
.
Informasi mengenai keragaman genetik sangat diperlukan untuk mendukung
program pemuliaan dan upaya konservasi. Penelitian mengenai variasi genetik
populasi tanaman karet (
Hevea brasiliensis
) dengan teknik RAPD (
Randomly
Amplified Polymorphic DNA
) telah dilakukan di Balai Penelitian Bioteknologi
Perkebunan Indonesia (BPBPI). Populasi yang diamati meliputi 57 genotipe
tanaman yang berasal dari 100 genotipe hasil seleksi semaian biji 3 klon tetua (GT
1, PB 260, dan RRIM 600). Penelitian ini menggunakan 7 primer yaitu OPA 02,
OPA 07, OPA 15, OPB 04, OPC 05, OPC 11, dan OPC 20. Hasil penelitian
menunjukkan bahwa teknik RAPD dapat digunakan untuk menganalisis hubungan
kekerabatan antara 57 genotipe karet dengan 3 klon tetua. Sebagian besar genotipe
tanaman karet memiliki hubungan kekerabatan dengan klon PB260, begitu juga
dengan genotipe tanaman karet yang memiliki respon baik terhadap kultur
in
vitro.
Nilai koefisien kesamaan genetik yang diperoleh berkisar antara 62-96%.
Kesamaan genetik tertinggi (96%) ditemukan antara genotipe 70 dan genotipe 78.
ABSTRACT
TATI HUSNIYATI. Analysis of Genetic Variation Rubber Plant Population
(
Hevea brasiliensis
) as Explants Resources of in vitro propagation by RAPD.
Under the direction of EDY DJAUHARI PURWAKUSUMAH and NURHAIMI
HARIS.
Information on genetic diversity is needed to support breeding and conservation
programs. Research on genetic variation in rubber plant population (
Hevea
brasiliensis
) with RAPD (
Randomly Amplified Polymorphic DNA
) technique has
been performed in the Biotechnology Research Institute of Plantation Indonesia
(BPBPI). The observed population include 57 of 100 genotypes that was resulted
from selection of 3 parental seed groups (GT 1, PB 260 and RRIM 600). This
study used 7 primers, OPA 02, OPA 07, OPA 15, OPB 04, OPC 05, OPC 11 and
OPC 20. The results of research showed that RAPD technique can be used to
analyze the relationship between 57 genotypes of rubber plants with 3 parental
seed. The most genotypes of rubber plant had closest relationship with PB 260
clone, that is similiar with genotypes showed a good response to in vitro culture
.
Genetic similarity coefficient values
were ranged
from 62-96%. The highest
genetic similarity (96%) were found between genotype 70 and genotype 78.
ANALISIS VARIASI GENETIK POPULASI TANAMAN
KARET (
Hevea brasiliensis)
SUMBER EKSPLAN UNTUK
PERBANYAKAN
IN VITRO
BERDASARKAN RAPD
TATI HUSNIYATI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Variasi Genetik Populasi Tanaman Karet (
Hevea
brasiliensis
) Sumber Eksplan untuk Perbanyakan
in vitro
Berdasarkan RAPD
Nama : Tati Husniyati
NIM
: G84080045
Disetujui
Komisi Pembimbing
Diketahui
Ketua Departemen Biokimia
Tanggal Lulus :
Dr. Ir. I Made Artika, M.App.Sc
NIP. 19630117 198903 1 000
Drs. Edy Djauhari PK, M.Si.
Ketua
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan
dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan
skripsi ini. Shalawat dan salam selalu tercurahkan pada Rasulullah SAW.
Penelitian ini berjudul Analisis Variasi Genetik Populasi Tanaman Karet (
Hevea
brasiliensis
) Sumber Eksplan untuk Perbanyakan
in vitro
Berdasarkan RAPD.
Penelitian ini dilakukan di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI), jalan
Taman Kencana no.1 dari bulan Februari sampai Mei 2012.
Terima kasih penulis ucapkan kepada Drs. Edy Djauhari Purwakusumah,
M.Si. dan Dr. Nurhaimi Haris, M.Si. sebagai pembimbing. Terima kasih penulis
ucapkan juga kepada Ibu Nani, Teh Niyah, Mas Irfan, dan staf pegawai
Laboratorium Biologi Molekuler dan Rekayasa Genetika atas bantuannya selama
penelitian. Penulis juga mengucapkan terima kasih untuk Ibu, Bapak, Kang
Habib, Teh Ami, Kang Maman, Teh Siti, Kang Amir, Teh Iroh, Aa Wandi,
Zainal, dan Mas Aji yang slalu memberikan doa, kasih sayang dan motivasinya.
Terima kasih juga kepada Teman-Teman Biokimia 45, Ijah, Esti, Didit, Rena,
Peje, Udith, Riris, Ai, Tya, Rian, Keluarga 214, Keluarga Cendana 53, dan
teman-teman yang tidak bisa disebutkan satu persatu. Semoga penelitian ini bermanfaat
bagi semua pihak.
Bogor, September 2012
RIWAYAT HIDUP
Penulis merupakan putri bungsu dari Bapak M.Shaleh Syukur dan Ibu
Hasunah. Penulis dilahirkan di Serang-Banten pada tanggal 28 Januari 1990.
Pendidikan penulis dimulai dari SDN Krenceng 2 dan melanjutkan
pendidikan ke SMPN 2 Cilegon. Penulis lulus tahun 2008 dari SMAN 1 Cilegon
dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis memilih mayor Departemen Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Struktur dan Fungsi Biomolekul, Biokimia Umum, Struktur dan Fungsi
Subselular. Penulis pernah melakukan Praktik Lapangan (PL) di Laboratorium
Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian Bioteknologi
Perkebunan Indonesia (BPBPI) Jalan Taman Kencana No.1, Bogor selama bulan
Juli - Agustus 2011 dengan judul Membandingkan hasil PCR (
Polymerase Chain
Reaction
) genotipe karet dengan empat primer acak.
Beberapa organisasi yang diikuti penulis selama perkuliahan yakni Badan
Eksekutif Mahasiswa Fakultas Matematika dan Ilmu Pengetahuan Alam (BEM G)
Departemen Sosial dan Lingkungan sebagai bendahara divisi tahun 2010-2011
dan Himpunan Profesi Mahasiswa Biokimia (CREBs) divisi Metabolisme sebagai
bendahara divisi tahun 2011-2012. Penulis mengikuti Unit Kegiatan Mahasiswa
(UKM) Taekwondo IPB dan pernah mengikuti Kejuaraan Nasional (Kejurnas)
antar perguruan tinggi pada tahun 2008. Penulis juga pernah mengikuti berbagai
kepanitiaan acara lingkungan dan kesehatan seperti
Green Society
dan I-
Share
,
TPB Cup tahun 2009, Gebyar Nusantara tahun 2009, Lomba Karya Ilmiah
Populer tahun 2009 dan 2010, Masa Pengenalan Departemen tahun 2010, Seminar
dan Biokimia Expo tahun 2010, IPB
Art Contest
tahun 2010, Seminar Kesehatan
Biokimia tahun 2011. Penulis juga pernah mengikuti seminar-seminar dan
Basic
Training
Emotional Spiritual Quotient
(ESQ).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Tanaman karet (
Hevea brasiliensis
) ...
2
Microcutting
...
3
Isolasi DNA ...
3
Penanda molekuler ...
4
Polymerase Chain Reaction (
PCR) ...
4
Random Amplified Polymorphic DNA (
RAPD) ...
5
Elektroforesis gel agarosa
...
6
BAHAN DAN METODE
Alat dan bahan ...
7
Metode ...
7
HASIL DAN PEMBAHASAN
Hasil isolasi DNA tanaman karet ...
8
Amplikon DNA karet dengan 7 primer acak ...
9
Filogenetik hasil amplifikasi DNA karet
...
10
SIMPULAN DAN SARAN ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Bagian tanaman karet ... 2
2 Perkebunan
karet
...
2
3 Tahapan reaksi PCR ... 5
4 Elektroforegram uji kualitatif DNA pada beberapa genotipe karet ... 8
5 Elektroforegram amplifikasi 60 DNA karet dengan primer OPC 05 ... 10
6 Pohon filogenetik 57 genotipe karet dengan 3 klon tetua ... 11
DAFTAR LAMPIRAN
Halaman
1 Tahapan
penelitian
...
16
2 Tahapan isolasi DNA tanaman karet ... 17
3 Tahapan uji kualitatif DNA karet ... 18
4 Tahapan amplifikasi DNA karet ... 19
5 Hasil uji kuantitatif 60 DNA tanaman karet ... 20
1
PENDAHULUAN
Karet (Hevea brasiliensis) merupakan tanaman perkebunan yang sangat penting dan bernilai ekonomis tinggi bagi Indonesia. Karet sebagai komoditi ekspor mampu memberikan kontribusi dalam upaya peningkatan devisa negara. Ekspor karet Indonesia selama 20 tahun terakhir terus menunjukkan peningkatan dari 1 juta ton pada tahun 1985 menjadi 1.3 juta ton pada tahun 1995 dan meningkat lagi menjadi 1.9 juta ton pada tahun 2004. Pendapatan devisa dari komoditi ini pada tahun 2004 mencapai US$ 2.25 milyar, yang merupakan 5% dari pendapatan devisa nonmigas (Anwar 2006a). Pendapatan tersebut meningkat menjadi US$ 6 milyar pada tahun 2009 (Ditjenbun 2008). Luas perkebunan karet Indonesia pada tahun 2007 mencapai 3.4 juta hektar (ha) dengan produksi mencapai 2.76 juta ton. Dari luasan tersebut, perkebunan karet terdiri atas perkebunan karet milik rakyat sebanyak 85%, perkebunan besar milik negara sebanyak 7%, dan perkebunan besar milik swasta sebanyak 8% (Anwar 2006b). Bahan tanam karet yang digunakan di perkebunan adalah klon penghasil lateks kayu seperti BPM 1, PB 260, PB 330, RRIC 100, IRR 32, IRR 39, IRR 42, IRR 112, dan IRR 18 (Siagian 2006).
Penyediaan bibit tanaman karet yang paling umum dilakukan di perkebunan karet adalah dengan cara okulasi. Okulasi merupakan metode perbanyakan tanaman hasil kombinasi dari metode vegetatif dan generatif. Metode ini membutuhkan ketersediaan batang bawah dan batang atas tanaman. Batang bawah berasal dari biji sedangkan batang atas adalah klon hasil seleksi yang ditanam di kebun kayu okulasi (Nasution 1995). Proses okulasi dilakukan dengan menempelkan mata dari kayu okulasi ke tanaman batang bawah sehingga diperoleh bahan tanam yang disebut stum okulasi mata tidur (Siagian 2006).
Penggunaan batang bawah asal biji memiliki keterbatasan. Misalnya biji yang digunakan tidak tahan kekeringan (biji rekalsitran) sehingga tidak tahan lama, ketersediaan biji terbatas karena musim biji hanya sekali dalam setahun, dan klon yang bijinya direkomendasikan untuk batang bawah terbatas. Selain itu, biji yang dihasilkan tanaman semakin berkurang karena tanaman dieksploitasi untuk produksi lateks yang tinggi. Kendala-kendala tersebut mengakibatkan ketersediaan biji karet sebagai batang bawah tidak mencukupi.
Sejak tahun 2006, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) melakukan penelitian yang intensif untuk mengatasi kelangkaan sumber batang bawah (Nurhaimi-Haris et al. 2009). Teknik yang digunakan adalah microcutting, yaitu suatu teknik perbanyakan tanaman yang didasarkan pada teknik kultur jaringan (kultur in vitro) dengan menggunakan mata tunas aksiler sebagai eksplan.
Perbanyakan bahan tanam dengan teknik
microcutting ini menggunakan 100 genotipe tanaman karet yang berasal dari campuran biji klon GT 1, PB 260, dan RRIM 600. Sebanyak 100 genotipe karet yang akan menjadi tanaman induk sumber eksplan tersebut diseleksi dari hasil semaian 43.000 biji campuran klon GT 1, PB 260, dan RRIM 600 di areal pembibitan batang bawah di Balai Penelitian Sungai Putih (Sumatera Utara). Seleksi didasarkan pada kriteria pertumbuhan terbaik, seperti diameter batang, tinggi batang, pertumbuhan tanaman, dan kesehatan tanaman (Nurhaimi-Haris et al. 2009). Saat ini, 100 genotipe tanaman karet yang telah diseleksi dikembangkan di BPBPI. Genotipe-genotipe tanaman karet tersebut telah diuji kemampuannya untuk diperbanyak dengan cara microcutting, dan beberapa genotipe memiliki respon yang baik terhadap lingkungan kultur in vitro sehingga bisa menghasikan planlet karet.
Sebanyak 100 genotipe karet tersebut tidak diketahui secara pasti tanaman induknya karena dalam teknik pelaksanaan di lapangan seluruh biji dari klon GT 1, PB 260, dan RRIM 600 dicampur. Dengan demikian belum diketahui asal klon dari beberapa genotipe yang memberikan respon baik dalam kultur in vitro. Sebanyak 57 genotipe tanaman karet dari 100 genotipe karet tersebut dianalisis secara molekuler untuk mengetahui hubungan kekerabatannya dengan klon tetuanya (GT 1, PB 260, dan RRIM 600). Teknik yang digunakan adalah RAPD (Random Amplified
Polymorphic DNA) yaitu salah satu cara
analisis genetik yang dapat dimanfaatkan untuk mempelajari hubungan kekerabatan suatu populasi organisme. Teknik RAPD dilakukan berdasarkan reaksi PCR
(Polymerase Chain Reaction) dengan
menggunakan primer acak yang terdiri dari 10 nukleotida (Williams et al. 1990).
Penelitian ini bertujuan menganalisis hubungan kekerabatan genotipe-genotipe tanaman karet sumber eksplan dalam teknik
2
penelitian ini adalah hubungan kekerabatan antara genotipe karet dengan 3 klon tetuanya dapat diketahui dengan analisis RAPD dan genotipe-genotipe tanaman karet dengan respon yang baik terhadap lingkungan kultur
in vitro berasal dari klon tetua yang sama. Manfaat dari penelitian ini adalah dapat mengetahui hubungan kekerabatan genotipe-genotipe karet dengan klon tetuanya. Informasi yang diperoleh dapat menjadi dasar pemilihan tanaman induk sumber biji yang akan digunakan sebagai sumber eksplan untuk perbanyakan batang bawah karet secara klonal dengan teknik in vitro.
TINJAUAN PUSTAKA
Tanaman Karet (Hevea brasiliensis) Karet merupakan tanaman yang berasal dari Amerika Latin, khususnya Brasil. Tanaman ini masuk ke Indonesia sejalan dengan penjajahan negara-negara Eropa. Tahun 1876, Henry A Wickham memasukkan biji karet yang berasal dari Amerika Latin ke Ceylon (Sri Langka), Malaysia, dan beberapa biji ditanam di kebun percobaan Bogor. Pertumbuhan karet di Bogor sangat memuaskan sehingga diikuti pemasukan bibit dari Brasil ke perkebunan Tarik Ngaroem di Jawa Timur. Menurut sistem klasifikasi, tanaman karet berada pada divisi
Spermatophyta, subdivisi Angiospermae, kelas Dycotyledonae, ordo Euphorbiales, famili Euphorbiaceae, genus Hevea, dan spesies Hevea brasiliensis (Tim penulis PS 2008).
Gambar 1 Bagian tanaman karet (a) Buah dan daun karet (b)Tanaman karet
muda (c) Bunga karet (d) Biji karets
Tanaman karet dapat tumbuh tinggi hingga mencapai 25-30 meter. Tanaman ini temasuk tanaman berkeping dua (dikotiledon) dan memiliki akar tunggang. Bagian-bagian dari tanaman karet dapat dilihat pada Gambar 1. Daun karet berwarna hijau yang terdiri atas tangkai daun utama dan anak daun. Panjang tangkai daun utama sekitar 7-20 cm sedangkan anak daun sekitar 3-10 cm. Umumnya terdapat tiga anak daun pada setiap tangkai utama. Anak daun berbentuk elips yang memanjang dengan ujung meruncing dan tepian rata. Pohon karet berbunga setelah berumur 5-6 tahun (Tim Penulis PS 2008). Bunga karet terdiri atas bunga jantan dan bunga betina. Kepala putik yang akan dibuahi berjumlah 3 buah. Bunga jantan mempunyai 10 benang sari yang tersusun menjadi 1 tiang. Buahnya memiliki 3 ruang dengan pembagian yang jelas. Setiap ruang berisi 1 biji (Martiansyah 2010).
Pertumbuhan karet relatif mudah, namun diperlukan waktu yang cukup lama. Karet tumbuh di ketinggian 0-400 m di atas permukaan laut (dpl), namun paling baik apabila ditanam pada ketinggian 200 m dpl. Curah hujan yang cocok untuk pertumbuhan karet adalah 1800-2000 mm/tahun dan suhu udara optimum 240-280C. Daerah tersebut memiliki karakteristik ekosistem hutan tropis basah sehingga budidaya karet paling optimal di daerah beriklim basah dengan curah hujan yang tinggi dan merata. Negara Indonesia memiliki daerah yang cocok untuk budidaya tanaman karet. Perkebunan karet (Gambar 2) tersebar luas di Indonesia, didominasi di daerah Sumatra dan Kalimantan.
3
Gambar 2 Perkebunan karet
Microcutting
Microcutting merupakan salah satu cara perbanyakan tanaman secara kultur in vitro.
Keberhasilannya dipengaruhi oleh beberapa faktor seperti kandungan mineral dan komposisi hormon tanaman dalam media kultur, serta umur eksplan yang digunakan. Eksplan yang digunakan berupa batang tanaman yang masih muda dan memiliki mata tunas aksiler sebagai titik tumbuhnya (Martiansyah 2010). Kultur eksplan yang dilakukan akan menghasilkan planlet, dan planlet yang ditumbuhkan di lingkungan luar akan menghasilkan vitroplant (tanaman karet muda). Teknik microcutting melalui beberapa tahapan proses, yaitu kultur primer, multiplikasi, pengkondisian tunas (hardening), induksi dan inisiasi perakaran, serta aklimatisasi (Nurhaimi-Haris et al.
2009).
Tahap kultur primer merupakan tahapan paling kritis dalam teknik microcutting. Tahap ini merupakan tahap introduksi eksplan pada media steril untuk menginisiasi pembentukan tunas. Tahap multiplikasi merupakan tahap perbanyakan eksplan dengan cara pemotongan eksplan. Pemotongan eksplan dilakukan dengan memisahkan bagian basal, nodal, dan tunas untuk ditumbuhkan dan dipelihara dalam media baru yang sesuai dengan jenis eksplannya. Umumnya setiap multiplikasi memerlukan waktu 3-4 minggu.
Tahap pengkondisian adalah suatu tahap yang berfungsi untuk menguatkan daun atau tunas sebelum memasuki tahap induksi perakaran. Media pada tahap ini dilengkapi dengan arang aktif untuk memberikan lingkungan gelap pada daerah perakaran serta untuk menyerap berbagai komponen pada media. Planlet melalui tahapan ini sekitar 4 minggu dan selanjutnya memasuki tahap induksi perakaran. Tahap induksi perakaran
bertujuan merangsang pembentukan akar yang dilakukan pada media cair selama 3 hari. Inisiasi perakaran dilakukan pada media padat selama 5-12 hari untuk merangsang pemanjangan akar. Selanjutnya tanaman akan melalui tahapan aklimatisasi, proses perpindahan planlet dari lingkungan in vitro
ke lingkungan ex vitro (Nurhaimi-Haris et al.
2009).
Isolasi DNA
Isolasi DNA merupakan tahap awal dari analisis genetik. DNA di dalam sel membentuk asosiasi kompleks dengan RNA dan protein. Teknik isolasi DNA yang ada pada dasarnya mencakup dua proses, yaitu lisis sel dan penghilangan komponen sel selain DNA (Barnum 2005).
Isolasi DNA tanaman diawali dengan penghancuran dinding sel tanaman. Kegagalan dalam memecah dinding sel akan mempengaruhi hasil akhir isolasi. Proses inilah yang membuat isolasi DNA tanaman lebih sulit dibandingkan isolasi DNA bakteri karena tanaman memiliki dinding sel yang kuat dan tebal. Penghancuran dinding sel dapat dilakukan secara kimiawi dan mekanik. Secara mekanik dapat dilakukan dengan cara penggerusan menggunakan mortar dingin dan bantuan nitrogen cair. Penggunaan nitrogen cair membuat daun menjadi kering dan mudah untuk dihancurkan. Nitrogen cair juga menjaga suhu tetap dingin sehingga DNA tidak rusak. Nitrogen cair memiliki suhu minus 196°C. Selain itu, dengan menggunakan nitrogen cair maka hasil penggerusan berupa serbuk sehingga mengurangi peluang berkurangnya sampel dibandingkan bila hasilnya berupa ekstrak cair yang mudah lengket pada mortar. Selain nitrogen cair, penggerusan sampel daun ditambahkan juga Polivynilpolipirolidon
(PVPP). PVPP berfungsi sebagai antioksidan untuk mencegah terbentuknya warna coklat
(browning) pada DNA. PVPP menghambat
enzim polifenol oksidase yang dapat mendegradasi rantai DNA dan menyebabkan teroksidasinya senyawa fenol (Prana & Hartati 2003).
Bahan lain yang yang digunakan selama isolasi antara lain larutan bufer, larutan Tris-HCl, larutan ethylenediamine tetraacetic acid
(EDTA), larutan cetyl trimethyl ammonium
bromide (CTAB) 10%, larutan
4
terdiri dari campuran basa lemah dan asam konjugatnya atau asam lemah dan basa konjugatnya, yang berfungsi untuk mempertahankan perubahan pH larutan walaupun ditambahakan sedikit asam kuat atau basa kuat. Larutan bufer yang digunakan pada isolasi DNA terdiri atas beberapa senyawa yang memiliki fungsi berbeda. Larutan Tris-HCl digunakan untuk memberikan kondisi pH yang optimum dan menjaga kestabilan pH. EDTA digunakan untuk melemahkan kekuatan dinding sel (Barnum 2005), karena dapat mengkelat ion magnesium yang merupakan kofaktor enzim nuklease (Herison et al. 2003). Larutan CTAB 10% dalam bufer ekstraksi berfungsi untuk mengurangi senyawa polisakarida dan menghilangkan polifenol yang juga merupakan kontaminan saat isolasi DNA. Kontaminan tersebut akan mengendap bersama CTAB sedangkan DNA tidak mengendap.
Larutan kloroform:isoamilalkohol (24:1) untuk menghilangkan lemak, protein, polisakarida, dan pengotor lainnya karena keberadaan senyawa-senyawa tersebut dapat mempengaruhi kualitas dan kuantitas DNA yang diisolasi. Larutan tersebut juga berfungsi memisahkan DNA dari membran sel yang memiliki bobot molekul lebih besar. Kloroform:isoamilalkohol yang memiliki densitas paling tinggi akan berada di dasar tabung sentrifus. Larutan yang berada di bagian tengah merupakan protein yang telah larut dalam kloroform:isoamilalkohol. Supernatan yang dihasilkan mengandung DNA, RNA, dan sebagian protein (Sudjadi 2008). Selain itu, penambahan isoamilakohol mengurangi busa yang muncul saat ekstraksi DNA.
Penggunaan larutan NaCl pada konsentrasi tinggi untuk mengatasi keberadaan polisakarida pada konsentrasi yang tinggi (Khanuja et al. 1999). Penambahan isopropanol bertujuan mengendapkan DNA. Penambahan alkohol absolut bertujuan memekatkan larutan DNA dan menghilangkan residu kloroform yang digunakan pada proses deproteinasi (Ausubel
et al. 1990). DNA yang diperoleh dicuci dengan alkohol 70% untuk menghilangkan sisa-sisa pengotor. DNA yang diperoleh dilarutkan dengan bufer TE sehingga dapat disimpan dan digunakan untuk analisis lebih lanjut.
Penanda Molekular
Penanda molekuler atau penanda DNA adalah suatu sekuen pendek DNA yang
menunjukkan adanya polimorfisme antara individu berbeda dalam satu spesies. Penanda molekuler mempunyai tingkat polimorfisme yang sangat tinggi, jumlahnya tidak terbatas, tidak dipengaruhi oleh lingkungan, dan tingkat heritabilitasnya hampir 100%. Suatu penanda akan efektif jika dapat membedakan antara dua tetua yang berbeda genotipenya dan dapat dideteksi dengan mudah dalam populasi yang diuji (Wirnas 2005).
Penanda molekuler akan menganalisis hubungan pada tingkat DNA sehingga perubahan yang tidak terlihat dengan penanda lainnya dapat diketahui. Hal ini bermanfaat untuk identifikasi suatu individu atau genotipe, derajat kekerabatan antar genotipe, adanya variasi genetika suatu populasi tanaman, determinasi gen atau kompleks gen yang diinginkan dalam suatu genotipe spesifik, dan pengembangan varietas tanaman baru melalui transformasi (Brown et al. 1996).
Teknologi penanda molekuler pada tanaman berkembang sejalan dengan semakin banyaknya pilihan penanda molekuler. Penanda pertama berdasarkan pada hibridisasi DNA seperti Restriction Fragment Length
Polymorphism (RFLP). Penanda kedua
berdasarkan pada reaksi rantai polimerase atau
Polymerase Chain Reaction (PCR) dengan
menggunakan sekuen-sekuen nukleotida sebagai primer, seperti Random Amplified
Polymorphic DNA (RAPD) dan Amplified
Fragment Length Polymorphism (AFLP).
Penanda ketiga berdasarkan pada PCR dengan menggunakan primer yang menggabungkan sekuen komplementer spesifik dalam DNA target, seperti Sequence Tagged Sites (STS), Sequence Characterized Amplified Regions
(SCARs), Simple Sequence Repeats (SSRs) atau mikrosatelit, dan Single Nucleotide Polymorphisms (SNPs) (Azrai 2006).
Polymerase Chain Reaction (PCR)
Penggunaan PCR diawali dengan ditemukannya DNA polimerase dari E.coli (Eschericia coli). Reaksi ini ditemukan oleh Karry Mullis tahun 1985. PCR adalah metode untuk melipatgandakan (amplifikasi) potongan DNA dalam waktu singkat secara in vitro dengan bantuan enzim polimerase. PCR merupakan teknik kunci dalam molekuler genetik yang memiliki efisiensi yang sangat tinggi dalam menggandakan potongan DNA.
5
memerlukan waktu beberapa jam. PCR menjadi sarana yang sensitif, selektif, dan sangat cermat untuk memperbanyak rangkaian DNA yang diinginkan. Spesifitas reaksi ini berdasarkan pada penggunaan dua primer oligonukleotida yang berhibrididasi menjadi rangkaian komplementer pada untai DNA yang berlawanan dan mengapit rangkaian sasaran (Bintang 2010).
Komponen yang dibutuhkan dalam reaksi PCR adalah DNA target (template) yaitu fragmen DNA yang akan dilipatgandakan, oligonukleotida primer yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA, deoksiribonukleotida trifosfat (dNTP), bufer, dan yang terakhir enzim DNA polimerase sebagai katalis reaksi sintesis rantai DNA (Yuwono 2006).
Reaksi PCR terdiri atas beberapa siklus, biasanya 20 sampai 40 siklus. Setiap siklus PCR, DNA polimerase akan menggandakan DNA sebanyak dua kali. Reaksi PCR terdiri atas 3 tahapan berulang seperti pada Gambar 3. Tahapan tersebut yaitu denaturasi (denaturation), penempelan (annealing), dan pemanjangan (extension).
Pemisahan untai DNA (denaturasi) dilakukan pada suhu 94°C selama 60 detik sehingga terjadi pemisahan utas ganda DNA menjadi dua utas tunggal DNA yang menjadi cetakan (template) tempat penempelan primer dan tempat kerja DNA polimerase. Selanjutnya proses penempelan yang dilakukan pada suhu 54°C agar terjadi hibridisasi dengan pita DNA selama 45 detik. DNA polimerase akan memasangkan dNTP yang sesuai dengan pasangannya, jika basa pada cetakan adalah A (adenin) maka akan dipasangkan dengan deoxytiamine triphosphate (dTTP) dan begitu seterusnya.
Gambar 3 Tahapan Reaksi PCR
Tahapan yang terakhir yaitu pemanjangan. Suhu pada tahap ini dinaikkan 72°C yang merupakan suhu optimum Taq DNA polimerase untuk polimerisasi selama 30 detik. Polimerisasi DNA akan mensintesis pita-pita DNA baru dengan cara memanjangkan rantai primer (Bintang 2010). Waktu pemanjangan bergantung pada panjang daerah yang akan diamplifikasi. Umumnya 1 menit untuk setiap 1000 bp.
Selain ketiga tahapan tersebut, PCR biasanya diawali dengan proses pradenaturasi dan diakhiri dengan proses pemanjangan akhir. Proses pradenaturasi dilakukan diawal reaksi untuk memastikan kesempurnaan proses denaturasi dan mengaktifkan DNA polimerase. Proses pemanjangan akhir biasanya dilakukan pada suhu optimum enzim selama 5-15 menit untuk memastikan setiap utas tunggal yang tersisa sudah diperpanjang secara sempurna (Weissensteiner et al. 2003).
Random Amplified Polymorphic DNA (RAPD)
Penanda RAPD baru dikembangkan oleh Williams et al. tahun 1990an dengan menunjukkan bahwa DNA genom dari bermacam-macam kelompok organisme dapat diamplifikasi menggunakan primer pendek tunggal yang disusun oleh urutan nukleotida yang berbeda-beda. Pola RAPD suatu genom dihasilkan melalui proses amplifikasi DNA seperti halnya dalam melakukan PCR, namun primer oligonukleotida bersifat acak
(random). Primer yang digunakan dalam
RAPD terdiri atas 9-10 nukleotida sedangkan pada PCR biasa dapat mencapai 30 nukleotida.
Penggunaan teknik RAPD memungkinkan untuk mendeteksi polimorfisme fragmen DNA yang diseleksi dengan menggunakan primer tunggal. Dasar analisis RAPD adalah menggunakan mesin PCR yang mampu mengamplifikasi sekuen DNA secara in vitro
dengan menggunakan primer acak tunggal (Williams et al. 1990).
6
suatu reaksi PCR. Umumnya dengan menggunakan primer oligunukleotida 10-mer, setiap primer secara terus menerus menghasilkan beberapa produk amplifikasi yang berbeda, dan fragmen tersebut dianggap berasal dari lokus-lokus genetik yang berbeda.
Keberhasilan reaksi ini ditentukan oleh suhu yang sesuai untuk mengurai DNA cetakan menjadi utas tunggal, pelekatan primer pada situs DNA cetakan, kemampuan primer mengamplifikasi DNA cetakan dengan bantuan enzim DNA polimerase, dan pemajangan rantai dengan bantuan dNTP (dATP, dTTP, dCTP, dan dGTP).
Keberhasilan suatu primer dalam mengamplifikasi DNA cetakan ditentukan oleh ada tidaknya homologi sekuen nukleotida primer dengan sekuen nukleotida DNA cetakan. Selain itu juga dipengaruhi oleh kualitas dan kuantitas DNA, konsentrasi MgCl2, enzim Taq DNA polimerase, dan suhu pelekatan primer (Wibowo 2010).
Penanda RAPD lebih sederhana dibandingkan penanda lainnya seperti mikrosatelit, RFLP, atau AFLP (Bardacki 2001). Teknik RAPD dipilih untuk analisis genetik dengan berbagai alasan, antara lain tidak membutuhkan latar belakang pengetahuan tentang genom yang akan dianalisis, mampu menghasilkan jumlah karakter yang relatif tidak terbatas, dapat menggunakan primer-primer untuk organisme prokariotik maupun eukariotik, menggunakan bahan-bahan yang relatif murah kecuali enzim
Taq polimerase, cocok untuk membuat diagnosis silsilah (filogeni) suatu spesies, dan amplifikasinya tidak bergantung pada radioaktif.
Keunggulan praktis dari teknik RAPD terletak pada kesederhanaan dan kecepatannya. RAPD lebih efisien 4 – 6 kali dibandingkan RFLP bila digunakan untuk pemetaan polimorfisme yang terpaut dengan resistensi penyakit dan 10 kali lebih efisien dalam waktu dan tenaga kerja (Surahman et al. 2007).
Penelitian menggunakan teknik RAPD sudah banyak dilakukan diantaranya keragaman genetik plasma nutfah jeruk (Karsinah et al. 2002), variabilitas genetik tanaman gambir (Fauza et al. 2007), hubungan genetik Pinanga conota (Witono & Kondo 2007), analisis variabilitas tanaman sukun (Ruwaida et al. 2009), analisis keragaman genetik nila hitam (Iskandariah et al. 2010), dan masih banyak lagi penelitian menggunakan teknik RAPD.
Elektroforesis Gel Agarosa
Elektroforesis merupakan teknik pemisahan suatu molekul bermuatan berdasarkan bobot molekulnya yang dipengaruhi medan listrik di dalam suatu gel. DNA merupakan senyawa bermuatan negatif karena memiliki gugus fosfat sehingga molekul DNA dapat dipisahkan dengan metode elektroforesis. Molekul DNA akan bermigrasi menuju kutub positif. Elektroforesis melalui gel agarosa merupakan metode standar untuk pemisahan, identifikasi, dan pemurnian fragmen DNA (Sudjadi 2008). Kecepatan migrasi ditentukan oleh ukuran DNA, konsentrasi gel agarosa, dan besaran tegangan yang digunakan.
Media yang digunakan dalam elektroforesis umumnya dibuat dari gel agarosa atau gel poliakrilamid. Gel agarosa merupakan polimer dengan struktur dasar G-galaktosa dan 3,6-anhidro-L-G-galaktosa yang diperoleh dari ganggang laut. Gel agarosa memiliki daya pisah yang lebih rendah dibandingkan gel poliakrilamid, tetapi mempunyai rentang pemisahan yang lebih besar. Gel agarosa dapat memisahkan DNA yang berukuran 20 basa sampai 50 kilobasa pada konsentrasi gel yang berbeda (Sudjadi 2008). Konsentrasi agarosa yang sering dipakai berkisar antara 0.8-1.5%. Konsentrasi gel yang sangat encer (0.1-0.2%) dapat meningkatkan daya pisah elektroforesis tetapi hal tersebut sulit dilakukan karena gel yang encer sangat mudah pecah.
Gel agarosa dilarutkan dalam suatu senyawa bufer. Bufer yang umum digunakan adalah bufer Tris-Acetic:EDTA (TAE). Bufer TAE memungkinkan DNA dapat bergerak secara perlahan dalam gel sehingga DNA tersebut akan terpisah. Bufer TAE juga berfungsi dalam optimalisasi pH dan konsentrasi ion di dalam gel sekaligus sebagai konduktor arus listrik yang memungkinkan arus dapat mengalir dalam gel. Senyawa Tris yang terkandung dalam larutan TAE berfungsi mempertahankan konsentrasi pH larutan. Larutan EDTA yang terdapat dalam bufer TAE berfungsi mengkelat kation divalen magnesium (Mg2+) yang mungkin terkandung dalam suspensi DNA (Hartanti 2009).
Sampel DNA yang akan dielektroforesis ditambahkan loading dye yang berperan sebagai bufer dan pemberat agar DNA dapat tertahan di dalam gel dan bermigrasi. Selain sampel, dimasukkan juga penanda (marker)
7
Bila posisi pita DNA sejajar dengan DNA penanda maka dapat dikatakan memiliki jumlah pasangan basa yang sama.
Pewarnaan DNA di dalam gel agarosa dilakukan dengan menggunakan larutan etidium bromida (EtBr). Senyawa EtBr bersifat karsinogenik yang dapat menyebabkan kanker bila terpapar pada kulit. Pemisahan senyawa DNA dengan elektroforesis gel agarosa memanfaatkan arus listrik. Tegangan yang digunakan pada saat elektroforesis adalah 60 volt. Tegangan ini dipilih karena cocok untuk elektroforesis DNA dan dapat menghasilkan resolusi yang lebih baik di antara fragmen-fragmen yang berukuran hampir sama. Penggunaan tegangan yang terlalu tinggi (>100 volt) tidak baik digunakan, karena DNA bersifat sangat rentan terhadap tekanan fisik. Visualisasi dilakukan di bawah sinar UV, dengan sebuah alat pemancar sinar yang disebut UV-Transilluminator.
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan adalah gunting, mortar, tabung sentrifus, mesin centrifuge
5417 R, penangas air, pipet mikro, pipet Mohr, bulp, sudip, autoklaf, gelas piala, labu Erlenmeyer, gelas ukur, neraca analitik, spektrofotometer UV mini-1240, PCR ESCO APBIO, tabung PCR, perangkat elektroforesis
Toylab, cetakan gel, sisir, power supply, sarung tangan, dan alat untuk dokumentasi hasil pengamatan elektroforesis UV (UV
Transilluminator 2201 Sigma dan kamera
Power Shot A640 Canon). Selain itu
digunakan juga program NTSYS versi 2.02 dengan menggunakan metode UPGMA
(Unweight Pair-Grouping Method with
Aritmatic Averaging).
Bahan-bahan yang digunakan untuk isolasi DNA adalah daun karet yang terdiri atas 57 genotipe (genotipe karet nomor 2, 3, 4, 5, 6, 7, 8, 9 11, 12, 13, 14, 15, 17, 22, 23, 25, 26, 27, 28, 29, 30, 34, 36, 37, 38, 39, 40, 43, 44, 46, 47, 48, 49, 51, 52, 53, 55, 56, 58, 59, 60, 66, 68, 69, 70, 72, 75, 77, 78, 79, 80, 83, 85, 86, 88, dan 91) dan 3 klon tetua (GT 1, PB 260, RRIM 600) yang ditanam di rumah kaca BPBPI, polyvinylpyrolidone (PVPP) 1.5%, nitrogen cair, bufer ekstraksi, kloroform : isoamilalkohol (24:1), aquades, isopropanol, bufer TE, Na-asetat 3 M pH 5.2, etanol absolut, dan etanol 70%. Bufer ekstraksi merupakan campuran akuades steril, Tris-HCl 1 M pH 8.0, ethylene diamine tetraacetic acid
(EDTA) 0.5 M pH 8.0, NaCl 5 M, dan cetyl
trimethylammonium bromide (CTAB) 10%.
Bufer TE terdiri atas akuades steril, Tris-HCl 1 M pH 8.0, dan EDTA 0.5 M pH 8.0. Bahan untuk elektroforesis yaitu loading buffer
(bromfenol blue 2.5% : sukrosa 40%),
agarosa, Ethidium bromide (EtBr) 1% (w/v), bufer TAE (Tris Asetat:EDTA) 1X, dan marker 1 kb DNA ladder. Bahan untuk amplifikasi meliputi Aquabides, bufer (KCl, Tris-HCl pH 9, dan 1% tripton x-100), MgCl2 25 mM, dNTPs 2 mMol, Taq DNA Polimerase (Fermentas), dan 7 primer (OPA 02, OPA 07, OPA 15, OPB 04, OPC 05, OPC 11, dan OPC 20). Urutan basa dari masing-masing primer dapat dilihat pada tabel 1.
Metode
Isolasi DNA Tanaman Karet (Castillo et al.
1994)
Isolasi DNA dilakukan tehadap daun tanaman karet yang ditanam di dalam rumah kaca Balai Penelitian Bioteknologi Perkebunan Indonesia. Tahapan isolasi yang dilakukan adalah daun karet dibuang tulang daunnya lalu dicuci dan dikeringkan dengan tisu. Sebanyak 0.2 gram daun karet digerus menggunakan mortar sambil ditambahkan nitrogen cair dan PVPP. Setelah halus, sampel dimasukkan ke dalam tabung sentrifus yang berisi 1 mL bufer ekstraksi kemudian dikocok menggunakan vortex kemudian diinkubasi selama 30 menit pada suhu 650C. setelah itu, diinkubasi pada suhu ruang lalu ditambahkan 750 μL kloroform:isoamilalkohol (24:1).
Sampel disentrifus dengan kecepatan 11.000 rpm selama 10 menit. Supernatan yang diperoleh dipindahkan pada tabung sentrifus lain, lalu ditambahkan 1000 μL kloroform:isoamilalkohol (24:1) dikocok kuat dan disentrifus lagi dengan kecepatan 11.000 rpm selama 10 menit. Supernatan yang diperoleh dipindahkan lalu ditambahkan 1 mL isopropanol dingin. Dihomogenkan dengan membolak-balik tabung lalu disimpan dalam lemari es (40C) selama 10 menit kemudian disentrifus kembali dengan kecepatan 11.000 rpm selama 10 menit. Supernatan yang diperoleh dibuang sedangkan peletnya dilarutkan dengan bufer TE.
Larutan ditambahkan 1/10 volume Na-Asetat 3 M pH 5.2 dan 2.5 volume alkohol absolut dingin. Dihomogenkan dengan membolak-balik kemudian diinkubasi dalam
8
70% dan dikeringanginkan. Pelet DNA yang sudah kering dilarutkan dengan 100-500 mL bufer TE.
Uji Kualitatif DNA (Sambrook et al. 1989)
Gel agarosa 1% dibuat dari 0.3 gr agarosa dan 30 mL larutan TAE 1X. Kemudian dipanaskan hingga larut dalam microwave dan didinginkan pada suhu kamar hingga hangat. Selanjutnya ditambahkan 1.5 µL EtBr dan dituang ke dalam cetakan gel elektroforesis yang telah dipasang sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam bak elektroforesis yang berisi TAE 1X. Sampel yang akan dielektroforesis dicampur dengan loading dye
dengan perbandingan 5:1 (DNA: loading dye)
Setelah tercampur maka diinjeksi ke dalam sumur gel agarosa menggunakan pipet mikro.
Marker yang digunakan adalah 1 kb DNA
ladder sebanyak 0.8 µL. Setelah semua
sampel selesai diinjeksi maka alat elektroforesis dihubungkan pada power supply
yang dialiri tegangan listrik 60 volt selama ±1 jam. Hasil elektroforesis diamati dengan bantuan lampu UV dalam transilluminator.
Uji Kuantitatif DNA (Sambrook et al. 1989)
Pengujian dilakukan dengan metode spektrofotometri. Larutan stok DNA diambil sebanyak 10 µL lalu dilarutkan dengan akuades hingga volume mencapai 750 µL. Blanko akuades disiapkan sebanyak 750 µL. Absorbansi (A) diukur pada panjang gelombang 260 nm dan 280 nm. Tingkat kemurnian DNA ditentukan dengan nilai perbandingan A260/A280.
RAPD DNA Karet (Williams et al. 1990)
Pembuatan master mix PCR dilakukan dalam tabung mikro dengan komposisi untuk satu kali reaksi antara lain aquabides 18.8 µL, bufer mengandung MgCl2 2.5 µL, dNTPs 10 mM 0.5 µL, primer 1 µL, Taq polimerase 0.2 µL, dan DNA sampel 2 µL. Proses amplifikasi dilakukan menggunakan mesin PCR ESCO. Program running PCR sebanyak 45 sikus dengan reaksi: pradenaturasi 94° C selama 1 menit, denaturasi 94° C selama 1 menit,
annealing 36° C selama 1 menit, extension
72° C selama 2 menit, dan terakhir post extension 72° C selama 4 menit.
Elektroforesis Hasil Amplifikasi
Elektroforesis hasil amplifikasi dilakukan menggunakan gel agarosa 1.4 %. Gel dibuat dengan melarutkan 0.42 gr agarosa pada 30 mL bufer TAE 1x. Sampel hasil PCR
sebanyak 25 µL ditambahkan dengan 5 µL
loading buffer kemudian dilakukan running
pada tegangan 60 volt selama ±1 jam. Hasil elektroforesis diamati dengan bantuan lampu UV dalam transilluminator dan didokumentasikan menggunakan gel documentation.
Analisis Hasil Elektroforesis
Pola fragmen DNA yang muncul pada gel diterjemahkan ke dalam data biner dengan skoring manual. Setiap pita mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya pita. Angka satu ”1” untuk pita yang terbentuk dan angka nol ”0” untuk pita yang tidak terbentuk. Data biner yang diperoleh selanjutnya diolah menjadi pohon filogenetik dengan menggunakan program NTSYS
(Numerical Taxonomy and Multivariate
Analisys System) dengan metode UPGMA
(Unweight Pair-Grouping Method with
Aritmatic Averaging).
HASIL DAN PEMBAHASAN
Hasil Isolasi DNA Tanaman Karet
Isolasi DNA tanaman karet menggunakan metode Castillo et al. (1994). Metode ini dipilih karena praktis dan dapat menghasilkan DNA yang baik dari tanaman karet dibandingkan metode lainnya (Ain 2011). Ying dan Zaman (2006) juga menyatakan bahwa metode ini umum digunakan pada tanaman perkebunan.
Uji kualitatif terhadap 60 DNA (57 genotipe karet dan 3 klon tetua) dilakukan dengan elektroforesis gel agarosa 1%. Uji ini dilakukan untuk mengetahui kualitas DNA yang diperoleh. Gambar 4 merupakan elektroforegram uji kualitatif beberapa genotipe tanaman. Elektroforegram menunjukkan isolasi DNA telah berhasil, dapat dilihat dari fragmen DNA yang tampak pada gel. Fragmen DNA yang diperoleh menunjukkan bahwa DNA tidak rusak atau terfragmentasi sehingga baik untuk dipakai dalam analisis RAPD. Apabila fragmen DNA rusak akan terlihat smear pada gel.
9
Smear terbentuk akibat degradasi DNA menjadi potongan yang pendek. Hal ini dapat terjadi karena perlakuan DNA selama isolasi, yaitu sentrifugasi, perlakuan suhu, atau perlakuan dengan larutan-larutan yang digunakan. Smear juga disebabkan oleh volume DNA yang terlalu banyak saat dielektroforesis atau penggunaan tegangan yang terlalu besar (Ausubel et al. 1990).
Uji kuantitatif DNA dilakukan secara spektrofotometri pada panjang gelombang 260 nm dan 280 nm sehingga diperoleh nilai kemurnian dan konsentrasi DNA hasil isolasi. Panjang gelombang 260 nm merupakan serapan maksimum untuk asam nukleat sedangkan panjang gelombang 280 nm merupakan serapan maksimum untuk protein. Hasil pengukuran dapat dilihat pada Lampiran 5.
Kemurnian diperoleh dari perbandingan nilai absorbansi pada panjang gelombang 260 nm dan 280 nm. Kemurnian DNA yang diperoleh pada penelitian ini berkisar antara 0.25-2.76. Menurut Walker & Wilson (2000), sampel DNA murni akan menghasilkan rasio A260/A280 berkisar antara 1.8–2.0. Nilai kemurnian yang lebih dari 2.0 menunjukan bahwa sampel mengandung kontaminan RNA, sedangkan nilai kemurnian yang kurang dari 1.8 menunjukan bahwa sampel mengandung kontaminan protein (Yuwono 2006).
Hasil yang diperoleh menunjukan bahwa dari 60 sampel DNA karet, sebanyak 13 genotipe tanaman karet memiliki nilai kemurnian 1.8-2.0 yang menunjukkan DNA yang diisolasi telah murni. Sampel tersebut yaitu genotipe nomor 2, 3, 4, 5, 7, 27, 30, 44, 59, 60, 66, 68, dan 85. Namun ada juga nilai kemurnian sampel DNA di atas 2.0. Sampel tersebut yaitu genotipe nomor 9, 12, 13, 14, 15, 25, 28, 29, 53, 70, 78, 79, dan 86. Hal tersebut menunjukkan masih adanya kontaminan RNA. RNA tersebut dapat dihilangkan dengan menambahkan RNase saat isolasi DNA. Genotipe-genotipe lainnya memiliki nilai kemurnian DNA dibawah 1.8. Hal tersebut menunjukkan masih adanya kontaminan berupa protein. Protein tersebut dapat dihilangkan dengan menambahkan proteinase K.
Konsentrasi DNA yang dihasilkan berkisar antara 71.25–1766.25 μg/mL. Konsentrasi paling rendah diperoleh pada genotipe 47 sedangkan konsentrasi paling tinggi diperoleh pada genotipe 4. DNA tersebut dapat digunakan untuk proses PCR-RAPD karena secara kuantitatif memiliki konsentrasi yang cukup tinggi. Konsentrasi DNA yang
digunakan untuk proses PCR-RAPD hanya 50
μg/mL yang dihitung dengan memperhatikan faktor pengenceran.
Menurut Nurhaimi-Haris et al. (2003), konsentrasi DNA akan berdampak pada kualitas fragmen hasil amplifikasi. Konsentrasi DNA yang terlalu rendah akan dapat menghasilkan fragmen yang sangat tipis pada gel atau bahkan tidak terlihat secara visual, sebaliknya konsentrasi DNA yang terlalu tinggi akan menyebabkan fragmen terlihat tebal sehingga sulit dibedakan antara satu fragmen dengan fragmen lainnya.
Amplikon DNA Karet dengan 7 Primer Acak
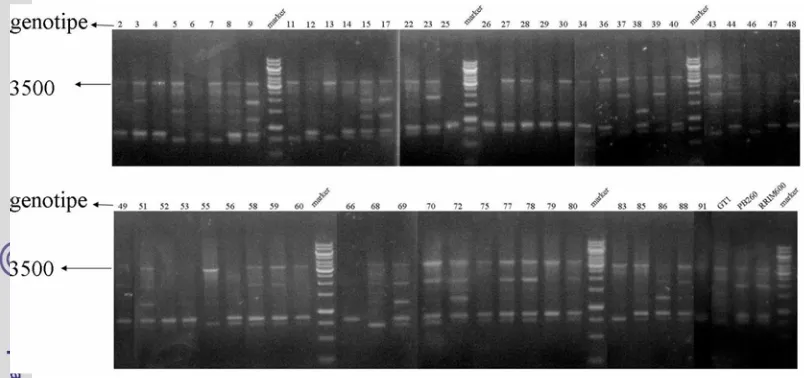
Amplifikasi dilakukan terhadap 57 genotipe karet dan 3 klon tetua. Sebanyak 60 DNA karet tersebut dapat diamplifikasi seluruhnya dengan menggunakan 7 primer acak 10 mers. Ketujuh primer tersebut yaitu OPA 02, OPA 07, OPA 15, OPB 04, OPC 05, OPC 11, dan OPC 20. Urutan basa dari masing-masing primer dapat dilihat pada Tabel 1.
Hasil amplifikasi dari setiap primer menghasilkan 1-13 fragmen dengan total fragmen yang tampak sebanyak 47 (Tabel 1). Ukuran fragmennya berkisar antara 500-5000 bp. Penelitian sebelumnya menggunakan RAPD pada 79 klon tanaman karet menghasilkan 5-11 fragmen DNA (Nurhaimi-Haris et al. 1998). Menurut Demeke dan Adams (1994), amplifikasi DNA dengan primer acak pada analisis RAPD biasanya menghasilkan 5-20 fragmen untuk setiap primer. Jumlah fragmen hasil amplifikasi dengan RAPD memang lebih rendah dibandingkan dengan hasil amplifikasi menggunakan AFLP (Nurhaimi-Haris et al.
2003).
Tabel 1 Urutan sekuen basa primer dan jumlah fragmen DNA hasil amplifikasi 7 primer
Jenis primer
Sekuen Fragmen DNA
OPA02 5’ TGCCGAGCTG 3’ 13 OPA07 5’ GAAACGCGTG 3’ 9 OPA15 5’ TTCCGAACCC 3’ 6 OPB04 5’ GGACTGGAGT 3’ 1 OPC05 5’ GATGACCGCC3’ 7 OPC11 5’ AAAGCTGCGG 3’ 3 OPC20 5’ ACTTCGCCAC 3’ 8
10
Gambar 5 Elektroforegram amplifikasi 60 DNA karet dengan primer OPC 05
Pola fragmen DNA yang dihasilkan dari hasil amplifikasi menunjukkan adanya polimorfisme. Tiap primer menghasilkan jumlah fragmen DNA yang berbeda. Polimorfisme fragmen DNA dapat dipengaruhi oleh banyaknya variasi individu dalam suatu populasi. Fragmen DNA paling banyak dihasilkan primer OPA 02 sebanyak 13 fragmen DNA, sedangkan fragmen paling sedikit dihasilkan primer OPB 04 sebanyak 1 fragmen DNA. Primer OPA 05 dapat menghasilkan 7 fragmen DNA. Elektroforegram hasil amplifikasi dengan primer OPA 05 dapat dilihat pada Gambar 5.
Purwanta (2010) menyebutkan bahwa keberhasilan teknik RAPD ditentukan oleh kemurnian dan keutuhan DNA cetakan. DNA cetakan yang tidak murni akan mengganggu penempelan primer pada situsnya dan akan menghambat aktifitas enzim polimerase DNA. Enzim ini berfungsi untuk melakukan polimerisasi DNA. Sedangkan DNA cetakan yang banyak mengalami fragmentasi dapat menghilangkan situs penempelan primer.
Filogenetik Hasil Amplifikasi DNA Karet
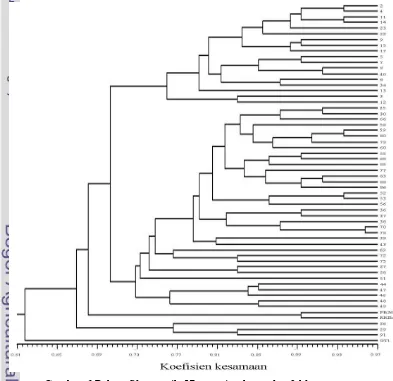
Analisis molekuler menggunakan RAPD telah berhasil mengelompokkan 57 genotipe karet dengan 3 klon tetua sesuai tingkat kekerabatan antar individunya yang ditunjukkan dalam bentuk pohon filogenetik (Gambar 6). Suryanto (2003) menyatakan bahwa analisis keragaman genetik dapat dilakukan melalui analisis hasil elektroforesis DNA.
Hasil analisis hubungan kekerabatan 57 genotipe tanaman karet dan 3 klon tetua berdasarkan RAPD menghasilkan nilai kesamaan genetik sebesar 62%. Nilai tersebut lebih rendah dibandingkan nilai yang
diperoleh pada penelitian sebelumnya terhadap 79 klon karet yaitu sebesar 70% (Nurhaimi-Haris et al. 1998). Berdasarkan pohon filogenetik pada Gambar 6, populasi tanaman karet dibagi menjadi 2 kelompok besar pada nilai kesamaan genetik 62%. Kelompok pertama terdiri atas 56 individu, sedangkan kelompok kedua hanya 1 individu.
Kelompok besar pertama terbagi lagi menjadi 2 kelompok pada kesamaan genetik yang lebih tinggi yaitu 67%. Subkelompok pertama terdiri atas 53 individu dengan nomor genotipe tanaman 2, 3, 4, 5, 6, 7, 8, 9 11, 12, 13, 14, 15, 17, 22, 23, 25, 27, 28, 30, 34, 36, 37, 38, 39, 40, 43, 44, 46, 47, 48, 49, 51, 52, 53, 55, 56, 58, 59, 60, 66, 68, 69, 70, 72, 75, 77, 78, 79, 80, 83, 85, 86, 88, PB 260, dan RRIM 600. Subkelompok kedua terdiri atas 3 individu dengan nomor genotipe tanaman 26, 29, dan 91. Kelompok besar kedua hanya terdiri satu individu yaitu GT 1. GT 1 merupakan salah satu dari 3 klon tetua.
Pengelompokkan lebih jauh lagi dapat memperhatikan koefisien kesamaan genetik yang lebih tinggi. Adanya 3 garis pada pohon filogenetik (Gambar 6) merupakan alternatif pilihan dalam pengelompokan individu. Garis pertama menunjukkan koefisien kesamaan genetik pada nilai 70% yang dapat mengelompokkan kelompok besar kedua yang menghasilkan individu tunggal dan kelompok besar pertama terbagi menjadi dua kelompok. Kelompok pertamanya terbagi lagi menjadi 2 subkelompok.
11
individu tunggal. Kecuali cabang keenam belas yang merupakan cabang GT 1 yang sejak awal merupakan individu tunggal.
Garis ketiga menunjukkan kesamaan genetik sebesar 90% yang dapat mengelompokkan populasi menjadi 51 kelompok yang terbagi lagi menjadi kelompok-kelompok yang lebih spesifik sehingga satu kelompok hanya terdapat dua individu yang saling berdekatan dan satu individu tunggal seperti yang terlihat pada Gambar 6. Suatu sampel (spesies) yang berada pada kelompok kekerabatan yang sama menandakan bahwa sampel tersebut memiliki jarak kekerabatan yang dekat.
Hubungan kekerabatan dapat dilihat dari nilai koefisien kesamaan genetiknya (Lampiran 6). Nilai kesamaan genetik yang diperoleh berkisar antara 60%-96%. Sebagian besar berada pada kisaran diatas 65%, hanya sebagian kecil yang berada dibawah 65%. Kesamaan genetik tertinggi (96%) ditemukan antara genotipe 70 dan genotipe 78.
Nilai kesamaan genetik antara klon tetua yaitu antara GT 1 dan PB 260 sebesar 64%, antara GT 1 dan RRIM 600 sebesar 66%, dan antara PB 260 dengan RRIM 600 sebesar 89%. Nilai yang diperoleh berbeda dengan penelitian sebelumnya. Nurhaimi-Haris et al. (1998) menyebutkan nilai koefisien kesamaan genetik antara GT 1 dan PB 260 sebesar 75%, antara GT 1 dan RRIM 600 sebesar 73%, dan antara PB 260 dengan RRIM 600 sebesar 82%. Perbedaan ini dapat dipengaruhi oleh jumlah primer dan jumlah sampel yang digunakan.
Nilai kesamaan genetik pada matriks kesamaan (Lampiran 6) dapat menunjukkan hubungan kekerabatan setiap genotipe tanaman karet dengan 3 klon tetuanya. Sebagian besar genotipe karet yang diuji memiliki hubungan kekerabatan terdekat dekat dengan klon tetua PB 260. Klon PB 260 merupakan klon anjuran komersial penghasil lateks yang memiliki potensi hasil lateks tinggi tetapi hasil kayu sedang (Siagian 2006).
12
Genotipe-genotipe tanaman karet yang memiliki hubungan kekerabatan terdekat dengan klon PB 260 adalah genotipe nomor 2, 3, 4, 5, 6, 7, 8, 9 11, 13, 14, 17, 22, 25, 26, 28, 30, 34, 37, 38, 39, 40, 46, 49, 51, 52, 53, 55, 56, 58, 59, 60, 66, 68, 69, 70, 72, 75, 77, 78, 79, 80, dan 86. Sedangkan genotipe dengan nomor 12, 15, 23, 27, 43, 48, 83, 88, dan 91 memiliki hubungan kekerabatan terdekat dengan RRIM 600. Genotipe dengan nomor 44, 47, dan 85 memiliki hubungan kekerabatan terdekat dengan GT 1. Genotipe 29 dan 36 memiliki kesamaan genetik yang sama dengan klon GT 1 maupun klon RRIM 600. Sehingga sulit disimpulkan genotipe tersebut berasal dari klon GT 1 atau RRIM 600. Hal ini dapat diakibatkan oleh sedikitnya fragmen DNA yang diperoleh sehingga perlu dilakukan analisis lebih lanjut dengan menambah jumlah primer yang digunakan atau menggunakan penanda molekuler yang lebih spesifik dalam melakukan analisis kekerabatan tersebut.
Genotipe-genotipe tanaman karet yang digunakan pada penelitian ini merupakan sumber ekplan untuk perbanyakan batang bawah karet secara in vitro. Tidak semua dari genotipe tersebut cocok dan memberikan respon baik terhadap kultur in vitro. Beberapa genotipe yang memberikan respon baik terhadap kultur in vitro adalah genotipe 2, 4, 7, 25, 26, 29, 33, 63, 78, dan 91 (Nurhaimi-Haris et al. 2011). Berdasarkan matriks kesamaan genetiknya (Lampiran 6), sebanyak 6 dari 10 genotipe tersebut memiliki hubungan kekerabatan terdekat dengan klon PB 260. Genotipe tersebut yaitu nomor 2, 4, 7, 25, 26, dan 78. Berdasarkan data tersebut, klon PB 260 dapat digunakan sebagai tanaman induk sumber biji yang akan digunakan sebagai sumber eksplan dalam perbanyakan batang bawah karet secara klonal.
SIMPULAN DAN SARAN
Simpulan
Teknik RAPD dapat digunakan untuk melihat hubungan kekerabatan antara 57 genotipe karet dengan 3 tetua. Nilai koefisien kesamaan genetik yang diperoleh berkisar antara 62-96%. Kesamaan genetik tertinggi (96%) ditemukan antara genotipe 70 dan genotipe 78. Sebagian besar genotipe tanaman karet yang diuji memiliki hubungan kekerabatan terdekat dengan klon PB 260,
begitu juga dengan genotipe karet yang memiliki respon baik terhadap kultur in vitro.
Saran
Perlu dilakukan analisis lebih lanjut dengan penambahan jumlah primer RAPD. Selain itu, Penggunaan teknik yang lebih spesifik dari RAPD seperti AFLP, RFLP, atau SSR dapat digunakan sebagai pembanding atau penyempurnaan hasil analisis.
DAFTAR PUSTAKA
Ain YK. 2010. Isolasi DNA daun tanaman karet dengan menggunakan metode Khanuja, kit komersial, dan Castillo. [laporan praktik lapang]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Anwar C. 2006a. Manajemen dan Teknologi budidaya karet. Prosiding Pelatihan Tekno Ekonomi Agribisnis Karet; Jakarta, 18 Mei 2006. Medan: Pusat Penelitian Karet. hlm 1-24.
Anwar C. 2006b. Perkembangan Pasar dan Prospek Agribisnis Karet di Indonesia.
Prosiding Lokakarya Budidaya Tanaman Karet. Medan, 4-6 Sept 2006. Medan: Pusat Penelitian Karet. hlm 1-19.
Ausubel FM et al.1990. Current Protocols in Moleculer Biology. Kanada: John Willey&Sons.
Azrai M. 2006. Sinergi teknologi marka molekular dalam pemuliaan tanaman jagung. Jurnal Litbang Pertanian. 25(3): 81-89.
Bardacki F. 2001. Random Amplified Polymorphic DNA (RAPD) markers. Turk J Biol 25: 185-196.
Barnum SR. 205. Biotechnology an Introduction 2ndEd. USA: Brookks/Cole.
Bintang M. 2010. Teknik Penelitian Biokimia. Jakarta: Erlangga.
Brown SM, Szewc-McFadden, Kresovich S. 1996. Development and application of Simple Sequence Repeats (SSR) loci for plant genome analysis, methods of genome analysis in plants. New York: CRC Pr.
13
Castillo et al. 1994. Detectin of genetic diversity and selective gene in coffea using RAPD markers. Theor.Appl. genet.
87:332-339.
Demeke T, Adams RP. 1994. The use of PCR-RAPD analysis in plant taxonomy and evolution. London: CRC Press, Inc.
[Ditjenbun] Direktorat Jenderal Perkebunan. 2008. Statistik Perkebunan Indonesia. Jakarta: Direktorat Jenderal Bina Produksi Perkebunan, Departemen Pertanian.
Fauza H et al. 2007. Variabilitas genetik tanaman gambir berdasarkan marka RAPD. Zuriat 18(2): 93-99.
Hartanti. 2009. Analisis abnormalitas pada kelapa sawit dengan random amplified polymorphic DNA (RAPD) [laporan praktik lapang]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Horison C, Rustikawati, Eliyanti. 2003. Penentuan protokol yang tepat untuk menyiapkan DNA genom cabai (Capsicum
Sp.). Jurnal Akta Agrosia 6(2): 38-43
Iskandariah, Arifin OZ, Gustiano R. 2010. Analisis keragaman genetik lima populasi nila hitam (Corea chromis sp.) dengan analisis sidik ragam Random Amplified
Polymorphic DNA (RAPD). Prosiding
Forum Inovasi Teknologi Akuakultur. Bogor: Balai Riset Perikanan Budidaya Air Tawar. hlm 523-528.
Karsinah, Sudarsono, Setyobudi L, Aswidinnoor H.2002. Keragaman genetik plasma nutfah jeruk berdasarkan analisis penanda RAPD. Jurnal Bioteknologi Pertanian 7(1): 8-16.
Khanuja SPS, Shasany AK, Darokar MP, Kumar S. 1999. Rapid isolation of DNA from dry and frsh samples of plants producing large amounts of secondary metabolites and essential oils. Plants Moleculer biology Reporter 17:1-7.
Maniatis T. 1982. Molecular cloning: A Laboratory Manual. New York: CSH.
Martiansyah I. 2010. Pengadaan bahan tanam karet untuk seleksi batang bawah dan teknik in vitro microcutting pada tanaman karet. [Laporan Masa Orientasi Kerja dan penelitian]. Bogor: Balai Penelitian Bioteknologi Perkebunan Indonesia.
Nasution U. 1995. Penyediaan bahan tanaman dan teknologi benih untuk mendukung perkebunan. Warta Pusat Penelitian Karet 14(1): 15-26.
Nurhaimi-Haris, S. Woelan, and A. Darussamin. 1998. RAPD Genetics Variability in Plant Rubber (Hevea brasiliensis Muell.Arg) Clones. Menara Perkebunan 66(1): 9-19.
Nurhaimi-Haris, Hajrial A, Nurita TM, Agus P. 2003. Kemiripan genetik klon karet
(Hevea brasiliensis Muell Arg.)
berdasarkan metode amplified fragment length polymorphisms (AFLP). Menara Perkebunan 71(1): 1-15.
Nurhaimi-Haris et al. 2009. Teknologi
microcutting untuk perbanyakan bahan tanam karet. Prosiding Lokakarya Nasional Pemuliaan Tanaman Karet. hlm 188-198.
Nurhaimi-Haris, Sumaryono, Siswanto, Martiansyah I, Sinta MM. 2011. Laporan akhir tahun kerja sama PTPN III dengan BPBPI di bidang penelitian dan perbanyakan in vitro komoditas karet. [Laporan Akhir Kegiatan Tahun 2010]. Bogor: Balai Penelitian Bioteknologi Perkebunan Indonesia.
Prana TK. Hartati NS. 2003. Identifikasi sidik jari DNA talas (Colocasia esculata L. Schoot) Indonesia dengan teknik RAPD,
skrining primer dan optimalisasi kondisi PCR. Jurnal Natur Indonesia 5(2):107-112.
Purwanta. 2010. RAPD (Random Amplified Polymorphic DNA) [terhubung berkala]. http://www.4shared.com/rapd.php?op=mo dload&name=Downloads&file=index&req =getit&lid [17 Juni 2012].
Ruwaida IP, Supriyadi, Parjanto. 2009. Variability analysis of sukun durian plant
(Duria ziberthenius) based on RAPD
marker. Nusantara Bioscience 1(2): 84-91.
Sambrook J, Russel DW. 1989. Moleculer Cloning: A Laboratory Manual, Third Edition. New York: Cold-Spring Harbor Laboratory Pr.
Siagian N. 2006. Pembibitan dan Pengadaan
Bahan Tanam Karet Unggul. Medan:
Balai Penelitian Sungei Putih.
Sudjadi. 2008. Bioteknologi Kesehatan.
14
Surahman M, Muhamad S, Toding T. 2007. Perakitan varietas semangka (Citrullus lanatus (Thunberg) Matsum & Nakai) tanpa biji tahan terhadap penyakit layu fusarium dengan memanfaatkan marka RAPD [laporan penelitian hibah bersaing]. Bogor: Institut Pertanian Bogor.
Suryanto D. 2003. Melihat keanekaragaman organisme melalui beberapa teknik genetika molekuler. USU Digital Library
[terhubung berkala]. http://www.library.usu.ac.id/modules.php [
15 Juni 2012].
[Tim Penulis PS] Tim Penulis Penebar Swadaya. 2008. Panduan Lengkap Karet. Jakarta: Penebar Swadaya.
Walker JM, Wilson K. 2000. Principles and Techniques of Practical Biochemistry. UK: Cambridge University Press.
Weissensteiner T, Griffin HG, Griffin A. 2003. PCR Technology Current Inovation.
London: CRC Pr
Wibowo IY. 2010. Analisis Keragaman genetik tanaman karet hasil persilangan antara RRIM600 dan PN1546 dengan menggunakan teknik RAPD. [skripsi]. Bogor: Institut Pertanian Bogor.
Williams et al. 1990. DNA polymorphism amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Res
18:6531-6535.
Wirnas D. 2005. Analisis kuantitatif dan molekular dalam rangka mempercepat perakitan varietas baru kedelai toleran terhadap intensitas cahaya rendah [makalah]. Bogor: Sekolah Pascasarjana IPB.
Witono JR, Kondo K. 2007. Genetic relationship of Pinanga coronata
accesions by RAPD markers.
Chromosome Botany 2: 93-97.
Ying ST dan Zaman FQ. 2006. DNA extraction from mature oil palm leaves. J. of oil palm research. 18: 219-224.
Lampiran
1 Tahapan
Isolasi D
Analis t
penelitian
DNA dari 60 t
sis kualitatif tanaman kare
Amplifikasi dengan
Skori filog
tanaman kar
f & kuantitati et hasil isola
i DNA tanam n 7 primer ac
Elektrofore
ing fragmen genetik denga
NTS et
if DNA asi
man karet cak
esis
DNA dan an an mengguna SYS
nalisis akan
17
Lampiran 2 Tahapan isolasi DNA tanaman karet (Castillo
et al.
1994)
Sampel ditambahkan nitrogen cair dan PVPP
Sampel ditambahkan 1mL bufer ekstraksi dan
diinkubasi pada suhu 65
0C selama 30 menit
Supernatan ditambahkan 1mL isopropanol dan
diinkubasi pada suhu 4
0C selama 30 menit
Supernatan ditambahkan 1000 μL kloroform:isoamilalkohol (24:1)
dan disentrifus dengan kecepatan 11.000 rpm selama 10 menit
Campuran ditambahkan 750 μL kloroform:isoamilalkohol (24:1)
dan disentrifus dengan kecepatan 11.000 rpm selama 10 menit
Pelet dilarutkan dengan bufer TE
Campuran disentrifus dengan kecepatan
14.000 rpm selama 10 menit
Pelet dicuci dengan etanol 70% dan dikeringanginkan
Pelet dilarutkan dengan bufer TE
Campuran disentrifugasi pada kecepatan 11000 rpm selama 10 menit
Lampiran
3 Tahapan
Alat ele Sampel d Gel yang Larutan g Agarosa s
uji kualitati
Pr ektroforesis d dan loading d telah menge gel dituang k Camp Campuran sebanyak 0.3
if DNA kar
roses running
dihubungkan dye dimasukk
perbandinga eras dipindah bufer TA e dalam ceta puran ditamb
dipanaskan g ditambahk
ret (Sambroo
gdimulai n dengan pow
kan dalam su an (5:1) hkan ke dalam
E 1x
akan yang tel bahkan EtBr dalam micro kan dengan 3
ok
et al.
19
wer supply 60 umur gel den m chamberb lah dipasang r
owave 30 mL bufer
98)
0V ngan berisi
sisir TAE
Lampiran
4 Tahapan
p
amplifikasi
Amp
pradenat
denatur
penemp
pemanja
pemanjanga
ko
a
bufer m
dN
Ta
D
i DNA kare
plifikasi den
45 sikl
turasi 94 C
rasi 94 C se
elan 36 C s
ngan 72 C
an akhir 72
Persiapan s
omposisi ma
aquabides 1
mengandung
NTPs 10 mM
primer 1
aq polimeras
DNA sampe
et (Williams
ngan RAPD
us
selama 1 m
elama 1 men
selama 1 me
selama 2 m
C selama 4
sampel
aster mix:
18.8 µL
MgCl
22.5
M 0.5 µL
µL
se 0.2 µL
el 2 µL
s
et al.
1990
D
menit
nit
enit
menit
4 menit
µL
0)
20
Lampiran 5 Hasil uji kuantitatif 60 DNA tanaman karet
Sampel A260 A280 A260/A280 [DNA] μg/mL
2 0.112 0.056 2.00 420.00
3 0.200 0.106 1.89 750.00
4 0.471 0.239 1.97 1766.25
5 0.197 0.099 1.99 738.75
6 0.231 0.179 1.29 866.25
7 0.395 0.200 1.98 1481.25
8 0.208 0.144 1.44 780.00
9 0.161 0.074 2.18 603.75
11 0.172 0.108 1.59 645.00
12 0.398 0.198 2.01 1492.50
13 0.207 0.103 2.01 77625
14 0.203 0.100 2.03 761.25
15 0.080 0.030 2.67 300.00
17 0.060 0.045 1.33 225.00
22 0.245 0.126 1.94 918.75
23 0.112 0.063 1.78 420.00
25 0.303 0.151 2.01 1136.25
26 0.127 0.099 1.28 476.25
27 0.202 0.104 1.94 757.50
28 0.192 0.095 2.02 720.00
29 0.128 0060 2.13 480.00
30 0.258 0.141 1.83 967.50
34 0.178 0.145 1.23 667.50
36 0.222 0.176 1.26 832.50
37 0.079 0.057 1.39 296.25
38 0.346 0.194 1.78 1297.50
39 0.218 0.125 1.74 817.50
40 0.214 0.141 1.52 802.50
43 0.104 0.086 1.21 390.00
44 0.269 0.143 1.88 1008.75
46 0.282 0.165 1.71 1057.50
47 0.019 0.035 0.54 71.25
48 0.168 0.135 1.24 630.00
49 0.321 0.201 1.60 1203.75
51 0.281 0.169 1.66 1053.75
52 0.128 0.089 1.44 480.00
53 0.207 0.096 2.16 776.25
55 0.219 0.139 1.58 821.25
56 0.351 0.196 1.79 1316.25
58 0.045 0.180 0.25 168.75
21
Lanjutan
Sampel A260 A280 A260/A280 [DNA] μg/mL
60 0.296 0.152 1.95 1110.00
66 0.255 0.132 1.93 956.25
68 0.124 0.069 1.80 465.00
69 0.084 0.072 1.17 315.00
70 0.207 0.102 2.03 776.25
72 0.107 0.131 0.82 401.25
75 0.037 0.060 0.62 138.75
77 0.040 0.043 0.93 150.00
78 0.400 0.167 2.40 1500.00
79 0.151 0.069 2.19 566.25
80 0.029 0.029 1.00 108.75
83 0.138 0.100 1.38 517.50
85 0.170 0.090 1.89 637.50
86 0.188 0.069 2.72 705.00
88 0.100 0.062 1.61 375.00
91 0.430 0.268 1.60 1612.50
GT1 0.261 0.146 1.78 978.25
PB260 0.051 0.040 1.27 191.25
RRIM600 0.102 0.071 1.42 382.25
Contoh perhitungan [DNA]:
FP (Faktor Pengenceran) = 75 kali [DNA]sampel 2 = A260 x FP x 50 μg/mL
22
Lampiran 6 Matriks kesamaan genetik 57 genotipe tanaman karet dan 3 klon tetua
Sampel 2 3 4 5 6 7 8 9 11 12 13 14 15 17 22 23 25 26
2 1.000 3 0.851 1.000
4 0.936 0.830 1.000
5 0.787 0.723 0.809 1.000
6 0.787 0.723 0.851 0.830 1.000
7 0.851 0.745 0.830 0.894 0.851 1.000
8 0.830 0.681 0.809 0.830 0.830 0.894 1.000
23
LanjutanSampel 2 3 4 5 6 7 8 9 11 12 13 14 15 17 22 23 25 26
24
LanjutanSampel 27 28 29 30 34 36 37 38 39 40 43 44 46 47 48 49 51 52 27 1.000
28 0.830 1.000
29 0.638 0.766 1.000
30 0.766 0.809 0.787 1.000
34 0.723 0.681 0.702 0.830 1.000
36 0.851 0.809 0.660 0.830 0.787 1.000
37 0.787 0.787 0.638 0.809 0.723 0.894 1.000
25
LanjutanSampel 27 28 29 30 34 36 37 38 39 40 43 44 46 47 48 49 51 52 78 0.702 0.745 0.638 0.809 0.766 0.766 0.830 0.872 0.851 0.851 0.830 0.787 0.830 0.766 0.745 0.809 0.745 0.787 79 0.723 0.809 0.787 0.915 0.787 0.787 0.766 0.851 0.787 0.872 0.766 0.681 0.809 0.702 0.723 0.745 0.766 0.809 80 0.681 0.723 0.745 0.872 0.830 0.787 0.809 0.851 0.872 0.830 0.851 0.766 0.894 0.787 0.766 0.787 0.809 0.851 83 0.766 0.809 0.702 0.830 0.745 0.745 0.723 0.766 0.787 0.787 0.809 0.681 0.766 0.702 0.723 0.745 0.681 0.766 85 0.766 0.809 0.702 0.872 0.787 0.787 0.809 0.809 0.830 0.787 0.766 0.723 0.766 0.702 0.681 0.660 0.681 0.766 86 0.702 0.745 0.681 0.809 0.723 0.723 0.745 0.787 0.766 0.723 0.830 0.702 0.787 0.723 0.787 0.766 0.745 0.787 88 0.723 0.766 0.745 0.830 0.787 0.787 0.809 0.809 0.830 0.787 0.851 0.766 0.851 0.787 0.766 0.787 0.766 0.809 91 0.553 0.681 0.830 0.745 0.660 0.617 0.638 0.723 0.660 0.702 0.723 0.553 0.723 0.617 0.766 0.745 0.596 0.681 GT1 0.596 0.681 0.617 0.617 0.574 0.660 0.681 0.638 0.660 0.660 0.638 0.723 0.638 0.745 0.596 0.574 0.596 0.638 PB260 0.617 0.702 0.596 0.681 0.638 0.638 0.702 0.660 0.723 0.723 0.745 0.660 0.660 0.638 0.660 0.766 0.702 0.660 RRIM600 0.638 0.681 0.617 0.617 0.617 0.660 0.681 0.638 0.702 0.702 0.809 0.681 0.638 0.617 0.681 0.745 0.681 0.638
Sampel 53 55 56 58 59 60 66 68 69 70 72 75 77 78 79 80 83 85 53 1.000
55 0.830 1.000
56 0.872 0.830 1.000
58 0.787 0.787 0.787 1.000
59 0.809 0.809 0.851 0.894 1.000
60 0.745 0.787 0.787 0.830 0.894 1.000
66 0.809 0.809 0.851 0.809 0.872 0.851 1.000
26
LanjutanSampel 53 55 56 58 59 60 66 68 69 70 72 75 77 78 79 80 83 85 86 0.809 0.809 0.851 0.766 0.830 0.809 0.830 0.872 0.851 0.830 0.766 0.766 0.872 0.830 0.809 0.851 0.894 0.809 88 0.830 0.830 0.872 0.872 0.894 0.787 0.809 0.851 0.787 0.851 0.702 0.745 0.851 0.851 0.830 0.915 0.915 0.872 91 0.702 0.660 0.745 0.702 0.766 0.702 0.809 0.681 0.574 0.681 0.617 0.617 0.681 0.681 0.745 0.745 0.745 0.745 GT1 0.660 0.702 0.702 0.660 0.638 0.617 0.596 0.681 0.617 0.638 0.574 0.660 0.723 0.681 0.660 0.702 0.702 0.702 PB260 0.681 0.766 0.723 0.638 0.745 0.723 0.702 0.787 0.723 0.745 0.681 0.766 0.787 0.787 0.766 0.766 0.723 0.638 RRIM600 0.617 0.702 0.702 0.660 0.723 0.660 0.638 0.723 0.702 0.723 0.574 0.660 0.681 0.723 0.660 0.702 0.745 0.660
Sampel 86 88 91 GT1 PB260 RRIM600
86 1.000
88 0.894 1.000 91 0.723 0.787 1.000
GT1 0.638 0.745 0.660 1.000
PB260 0.745 0.723 0.638 0.638 1.000