ANALISIS MOLEKULER DAN EVALUASI UMUR
BERBUNGA TANAMAN PADI PUTATIF
TRANSGENIK AtCO
FINA FIFIN TRYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FINA FIFIN TRYANI. Analisis Molekuler dan Evaluasi Umur Berbunga
Tanaman Padi Putatif Transgenik AtCO. Dibimbing oleh EMAN KUSTAMAN
dan ATMITRI SISHARMINI.
ABSTRACT
FINA FIFIN TRYANI. Molecular Analysis and flowering time evaluation of Rice
Plant Putative AtCO. Under direction of EMAN KUSTAMAN and ATMITRI
SISHARMINI.
ANALISIS MOLEKULER DAN EVALUASI UMUR
BERBUNGA TANAMAN PADI PUTATIF
TRANSGENIK AtCO
FINA FIFIN TRYANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Molekuler dan Evaluasi Umur Berbunga Tanaman Padi
Putatif Transgenik AtCO
Nama
: Fina Fifin Tryani
NIM
: G84070023
Disetujui
Komisi Pembimbing
Ir. Eman Kustaman
Atmitri Sisharmini, M.Si.
Ketua
Anggota
Diketahui
Dr.Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
berkehendak atas segala sesuatu yang terjadi di alam semesta sehingga skripsi ini
dapat terselesaikan. Penelitian ini dilaksanakan sejak bulan April 2011 sampai
Agustus 2011 yang bertempat di Laboratorium Biologi Molekuler dan Rumah
Kaca Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya
Genetik Pertanian (BB Biogen), Bogor dengan judul Analisis Molekuler dan
Evaluasi Umur Berbunga Tanaman Padi Putatif Transgenik AtCO.
Penulis mengucapkan terima kasih kepada Ir. Eman Kustaman selaku
pembimbing utama yang telah memberikan saran, bimbingan, dan
masukan-masukannya, selain itu penulis juga mengucapkan terima kasih kepada Atmitri
Sisharmini, M.Si dan Aniversari Apriana, M.Si. selaku pembimbing kedua serta
kepada Dr. Tri Joko Santoso, S.P. M.Si. atas arahan, saran, serta semangat yang
diberikan selama penelitian dan penyusunan skripsi ini. Tak lupa penulis ucapkan
terima kasih kepada Kak Dewi Praptiwi, kak Falin Fakhrina, kak Ruth Maduma,
dan teman-teman Biokimia 44 atas dukungan, bantuan, dan semangatnya selama
pengumpulan data. Ucapan terima kasih juga penulis ucapkan kepada ayah, ibu,
dan seluruh keluarga yang senantiasa memberikan dukungan dan doa-doanya.
Penulis menyadari bahwa skripsi ini sangat sederhana dan belum
sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang sifatnya
membangun dari semua pihak. Penulis berharap skripsi ini dapat bermanfaat bagi
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya
Genetik Pertanian (BB Biogen), penulis pada khususnya, dan semua pihak pada
umumnya.
Bogor, Oktober 2011
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis, Jawa Barat pada tanggal 23 Februari 1988
dari ayahanda Maman Sutarman A.Ma dan Ibu Nunung Nurjanah. Penulis
merupakan anak ke tiga dari tiga bersaudara. Tahun 2007 penulis lulus dari SMA
Negeri 1 Pangandaran dan pada tahun yang sama lulus seleksi masuk Institut
Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada
program studi Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam
(FMIPA).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN...
1
TINJAUAN PUSTAKA...
2
Tanaman Padi ...
2
Gen
CONSTANS
...
2
Polymerase Chain Reaction
(PCR) ...
3
Reverse Transcriptio
n
Polymerase Chain
Reaction
(RT-PCR) ...
4
Elektroforesis DNA ...
5
BAHAN DAN METODE ...
6
Bahan dan Alat ...
6
Metode ...
6
HASIL DAN PEMBAHASAN ...
8
Hasil Penanaman Padi NCO...
8
Hasil Amplifikasi Gen
CONSTANS
...
9
Evaluasi Umur Berbunga ... 10
Analisis Ekspresi Gen
CONSTANS
... 11
SIMPULAN DAN SARAN ... 13
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1 Regulasi gen
CONSTANS
pada hari pendek dan hari panjang ...
3
2 Tahapan umum PCR ...
4
3 Denaturasi protein ...
6
4 Pembentukan ikatan silang pada gel poliakrilamid ...
6
5 Alur penanaman padi ...
9
6 Elektroforegram tanaman padi menggunakan primer CO ... 10
7 Proses pembungaan padi ... 11
8 Elektroforegram hasil PCR menggunakan primer aktin dan primer CO ... 13
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian ... 17
2 Proses umum isolasi DNA padi ... 18
3 Komposisi larutan yang digunakan ... 19
4 Isolasi RNA ... 20
5 Data hasil spektrofotometri DNA ... 21
PENDAHULUAN
Padi merupakan tanaman sereal penting bagi 111 negara di dunia yang meliputi seluruh negara Asia, Afrika, Amerika, dan Australia. Selain itu, padi merupakan salah satu makanan pokok bagi sebagian besar penduduk di dunia (Wing et al. 2005). Sebagian besar tanaman padi diproduksi dan dikonsumsi di Asia (Kibria et al. 2008). Padi memegang peranan paling penting di antara berbagai sumber bahan pangan dan penyediaannya yang mendukung ke arah ketahanan pangan nasional. Kebutuhan pangan dunia setiap tahunnya semakin meningkat seiring dengan meningkatnya petumbuhan penduduk dan perkembangan industri pangan. Namun, pada kenyataannya produsen pangan tidak mampu memenuhi kebutuhan konsumen yang semakin meningkat dan beragam (Praptiwi 2010).
Perbaikan dan peningkatan kualitas produksi pertanian untuk beberapa tahun yang lalu masih dapat dipertahankan, karena ketersediaan sumber daya alam dan teknologi pertanian cukup memadai dan berimbang dengan ketersediaan lahan dan peningkatan jumlah penduduk. Keadaan ini sulit untuk dipertahankan di masa yang akan datang, kecuali ada pendekatan baru yang menawarkan ide dan teknik untuk meningkatkan produktivitas pertanian. Penggunaan rekayasa genetika memiliki potensi untuk menjadi solusi dari ancaman krisis pangan tersebut. Rekayasa genetika merupakan transplantasi satu gen ke gen lain dalam suatu organisme sehingga dapat menghasilkan suatu produk. Tujuan rekayasa genetika antara lain meningkatkan produksi, meningkatkan ketahanan terhadap herbisida, meningkatkan kandungan gizi, toleransi terhadap cekaman biotik dan abiotik. Keunggulaan rekayasa genetika adalah mampu memindahkan materi genetik dari sumber yang sangat beragam dengan ketepatan tinggi dan terkontrol dalam waktu yang lebih singkat. Rekayasa genetika diharapkan dapat membantu mengatasi permasalahan pembangunan pertanian yang tidak lagi dapat dipecahkan secara konvensional. Salah satu produk dari rekayasa genetika adalah tanaman transgenik. Pemindahan gen ke dalam genom lain tidak mengenal batas jenis maupun golongan organisme (Winarno & Agustina 2007).
Siklus hidup tanaman terdiri atas dua tahap perkembangan, vegetatif dan reproduktif.
Tahap pembungaan menjadi salah satu karakteristik penting dalam siklus hidup. Perubahan menuju tahap reproduksi dari tahap vegetatif diawali oleh perubahan bunga pada jaringan meristem apikal. Perubahan tersebut pada sebagian besar tanaman dipengaruhi oleh linkungan dan tahapan perkembangan. Faktor lingkungan yang dapat mempengaruhi adalah cahaya, vernalisasi dan hormon (Soo Shin et al. 2003). Umur berbunga merupakan salah satu karakter penting tanaman berbunga yang dapat mempengaruhi hasil dan kualitas tanaman tersebut. Mekanisme genetik dan fisiologi telah berkembang untuk memastikan bahwa umur pembungaan terjadi pada kondisi yang paling menguntungkan untuk penyerbukan, perkembangan, dan penyebaran biji. Kondisi tersebut dapat diaplikasikan dalam bidang pertanian untuk meningkatkan kuantitas pertanian (Laurie et al. 2004). Studi genetik pengendalian umur berbunga ditunjukan dengan baik oleh tanaman model Arabidopsis thaliana. A. thaliana merupakan tanaman dari famili Brassicaceae dengan ukuran genom 125-130 mega pasang basa yang merupakan ukuran genom terkecil dari kelompok tanaman tingkat tinggi. Hasil riset padi yang berkaitan dengan A. thaliana dilaporkan bahwa gen pengendali umur berbunga diatur berdasarkan fotoperiodisitas atau lamanya penyinaran. Aplikasi gen pengatur pembungaan dalam tanaman sereal dimungkinkan akan memberikan keuntungan yang lebih tinggi (Izawa 2007).
Penelitian ini berguna dalam program pembuatan tanaman padi unggul dan komersial memliki sifat pembungaan lebih cepat. Manfaat jangka panjang adalah meningkatkan produktivitas tanaman padi secara berkelanjutan untuk menjaga kondisi ketahanan pangan nasional.
TINJAUAN PUSTAKA
Tanaman Padi
Padi merupakan tanaman semusim yang berumpun kuat dengan tinggi tanaman 0.5-2 m, helai daun berbentuk garis, sebagian besar bertepi kasar dan panjangnya 15-80 cm, serta memiliki malai dengan panjang 14-40 cm yang tumbuh ke atas dan ujungnya menggantung. Malai padi berupa bulir yang beraneka ragam, kadang berjarum pendek atau panjang, licin atau kasar berwarna hijau atau coklat, gundul atau berambut dengan ukuran 7-10 cm. Bulir yang masak akan menghasilkan buah yang kaya akan pati. Tanaman padi umumnya tumbuh di tempat yang basah atau rawa, tetapi adapula yang tumbuh di darat, seperti padi gogo. Tanaman padi diklasifikasikan pada divisi Sphermatophyta, subdivisi Angiospermae, kelas Monocotyledoneae, bangsa Polales (Glumiflorae), suku Gramineae, marga Oryza, dan jenis Oryza stiva L (Remelia 2008).
Padi termasuk dalam suku padi-padian atau Poeceae. Padi memiliki akar serabut, daun berbentuk lanset atau sempit memanjang, urat daun sejajar, memiliki pelepah daun, bunga tersusun sebagai bunga majemuk dengan satuan bunga berupa floret atau spikelet, serta buah dan biji yang sulit dibedakan karena merupakan bulir atau kariopsis (Gardener 1991). Bunga padi memiliki enam kepala sari (anther) dan kepala putik (stigma) bercabang dua berbentuk botol. Kedua organ seksual ini umumnya siap bereproduksi dalam waktu yang bersamaan. Padi melakukan penyerbukan sendiri, karena 95% atau lebih serbuk sari membuahi sel telur tanaman yang sama. Satu set genom padi terdiri atas dua belas kromosom. Setiap sel padi memiliki dua belas pasang kromosom, kecuali sel seksual sehingga disebut juga tanaman diploid (Tjitrosoepomo 1987).
Padi lokal merupakan plasma nutfah yang potensial sebagai sumber gen-gen yang mengendalikan sifat-sifat penting pada tanaman. Keragaman genetik yang tinggi pada padi lokal dapat dimanfaatkan dalam program pemuliaan padi secara umum (Hairmansis et
al. 2005). Remelia (2008) menyebutkan terdapat dua spesies padi yang dibudidayakan manusia yaitu Oryza sativa yang berasal dari daerah hulu sungai di kaki Pegunungan Himalaya (India dan Tibet) dan O. glaberrima yang berasal dari Afrika Barat (hulu Sungai Niger). O. sativa terdiri atas dua varietas yaitu Indica dan Japonica.
Variasi genetik pada padi beras putih cukup tinggi, mulai dari bentuk butir gabah kecil-bulat (kelompok Japonica-Javanica), panjang-langsing (kelompok Indica), sampai pada variasi warna (Utami et al. 2010). Padi kultivar Nipponbare merupakan jenis padi yang termasuk dalam varietas Japonica dengan karakteristik umumnya berumur panjang, postur tanaman tinggi mencapai 110 sampai 120 cm, namun mudah rebah, anakan produktif 14 sampai 17 batang, warna kaki hijau, warna batang hijau, daun tebal, warna daun telinga putih, warna daun hijau, muka daun kasar pada sebelah bawah, posisi daun tegak, warna gabah kuning bersih, paleanya memiliki bulu (awn), bijinya cenderung bulat dan bentuk tanaman tegak. Beras yang dihasilkan padi Nipponbare mengandung komponen amilosa lebih sedikit dan lebih banyak amilopektin dibandingkan dengan jenis-jenis lainnya. Selain itu, padi Nipponbare menghasilkan anakan yang lebih sedikit dibanding padi Indica (Abdullah et al.
2008). Tanaman padi ini sering digunakan sebagai model penelitian bagi tanaman monokotil. Beberapa alasan yang mendukung penggunaan tanaman tersebut, antara lain ukuran genomnya relatif kecil (430 Mbp), mudah ditransformasi, memiliki ketersediaan informasi molekuler dan genetik, serta memiliki nilai ekonomi yang tinggi (Kolesnik
et al. 2004).
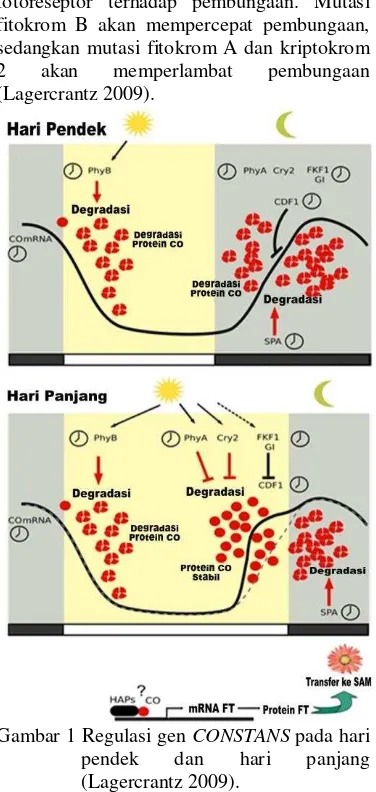
Gen CONSTANS
naik kembali pada sore hari. Protein CONSTANS (protein CO) dengan cepat didegradasi (dalam proteosom) selama pagi dan siang hari serta selama malam (Suarez-Lopez et al 2001; Mizoguchi et al. 2005). Degradasi protein ini dipicu oleh cahaya pagi (kaya akan 660 nm) yang dimediasi oleh fitokrom B (fit. B). Ketika sore hari, jika hari cukup lama, degradasi protein CO berhenti. Hal ini diperantarai oleh absorbs cahaya merah oleh fitokrom A (Fit. A), dan cahaya biru oleh kriptokrom (Valverde et al. 2004; Laubinger et al. 2006).
Akumulasi protein CO dimungkinkan berfungsi untuk mengaktifkan transkripsi gen (contoh FT) yang diperlukan untuk induksi pembungaan (Kardailsky et al. 1999; Kobayashi et al. 1999; Corbeiser et al. 2007). Pada hari yang pendek, dengan munculnya malam sebelum munculmya mRNA CO, protein CO yang disintesiskan untuk menginduksi pembungaan tidak cukup. Aturan ritme sirkadian (jam biologi) dan cahaya pada tumbuhan berhari pendek belum dipahami dengan baik. Studi pada padi menunjukkan bahwa mekanisme yang dijelaskan pada Arabidopsis dapat bekerja tetapi dengan peran gen CONSTANS sebagai suppressor Flowering Locus T dan sebagai inhibitor pembungaan dibawah hari yang panjang (Lagercrantz 2009).
Protein CO terdegradasi pada saat gelap, sehingga CO hanya dapat berfungsi apabila mRNA CO juga terekspresi sebelum gelap. Regulasi CO pada hari pendek menunjukkan bahwa fitokrom B akan mengendalikan FKF1 dan GI. FKF1 dan GI tidak dapat bekerja pada malam hari dan digantikan oleh SPA. Protein CO pada hari pendek akan terdegradasi sepanjang hari. Penekanan mRNA CO oleh CDF1 dihentikan melalui aksi FKF1 dan GI, menghasilkan peningkatan ekspresi CO pada sore hari. Protein CO akan stabil melalui aksi fitokrom A dan kriptokrom 2. Hal ini menyebabkan protein CO stabil yang akan membentuk kompleks dengan HAP (haem activator protein) yang berikatan dengan promotor FT yang akan mentranslasikan protein FT. Protein ini akan diteruskan melalui floem hingga ke SAM untuk menginduksi pembungaan (Gambar 1).
Fitokrom A dan kriptokrom 2 responsif terhadap cahaya merah dan cahaya biru, masing-masing meningkatkan stabilitas CO pada akhir hari dengan menurunkan degradasi. Sementara itu, fitokrom B mereduksi CO pada cahaya merah pada pagi hari. Hal ini sesuai dengan pengaruh
fotoreseptor terhadap pembungaan. Mutasi fitokrom B akan mempercepat pembungaan, sedangkan mutasi fitokrom A dan kriptokrom 2 akan memperlambat pembungaan (Lagercrantz 2009).
Gambar 1 Regulasi gen CONSTANS pada hari pendek dan hari panjang (Lagercrantz 2009).
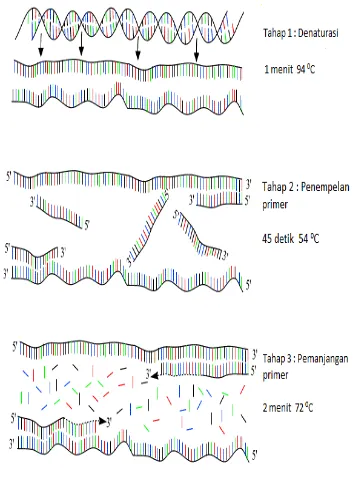
Polymerase Chain Reaction (PCR)
95oC. Primer merupakan sekuen DNA pendek dengan frekuensi 15 hingga 25 panjang basa dan berutas tunggal. PCR melibatkan tahap pemisahan utas DNA pada suhu tinggi (denaturasi), tahap penempelan primer (annealing), dan tahap pemanjangan primer menjadi utas baru DNA (elongasi) oleh enzim DNA polimerase (Gambar 2) (Mikkelsen & Corton 2004).
Tahap denaturasi merupakan tahap awal reaksi yang berlangsung pada suhu tinggi, yaitu 94°C hingga 96°C selama 5 menit. Tahap denaturasi bertujuan memisahkan utas ganda DNA menjadi utas tunggal dengan memutuskan ikatan hidrogen antar pasang basa. Pemisahan ini menyebabkan DNA menjadi tidak stabil dan siap menjadi cetakan bagi primer. Chakrabarti (2004) menyebutkan bahwa peran energi panas dapat menggantikan fungsi enzim helikase, girase, dan protein pelindung utas tunggal (PPUT) sekaligus pada proses replikasi DNA di dalam sel (in vivo). Tahap kedua adalah penempelan primer atau annealing pada kisaran suhu antara 42°C-65°C. Tahapan ini akan memberikan kondisi optimum bagi proses penempelan primer pada DNA cetakan. Suhu penempelan tersebut bersifat spesifik yang merupakan rata-rata dari nilai Tm (temperature melting) yang dimiliki masing-masing primer, yaitu forword (5’-end) dan reverse (3’-end). Primer menempel pada bagian DNA cetakan yang memiliki urutan basa yang bersifat komplementer dengan urutan basa primer. Tahap ini di dalam replikasi sel berfungsi sebagai inisiasi sintesis DNA oleh primase untuk membentuk RNA primer pada situs ori (Chakrabarti 2004).
Tahap ketiga adalah perpanjangan primer atau primer extention yang bertujuan memberikan kondisi optimum bagi kerja enzim Taq polimerase dalam memanjangkan primer untuk membentuk utas DNA baru. Chakrabarti (2004) menyebutkan bahwa peran Taq polimerase dapat menggantikan fungsi enzim DNA polimerase III, DNA polimerase I, dan ligase di dalam replikasi sel. Suhu yang digunakan pada proses ini tergantung dari jenis DNA polimerase yang dipakai. Durasi tahap ini biasanya satu menit. Akibat denaturasi dan renaturasi, beberapa utas baru menjadi cetakan bagi primer lain dan akhirnya tedapat utas DNA yang panjangnya dibatasi oleh primer yang dipakai. Amplifikasi DNA diulang sebanyak 30-40 siklus pengulangan. Proses penggandaan DNA terjadi pada setiap siklus, sehingga DNA hasil amplifikasi akan bertambah secara logaritmik seiring dengan bertambahnya siklus PCR. Fase ini akan
berhenti pada siklus tertentu dan berhenti menjadi fase plateau pada akhir siklus.
Gambar 2 Tahapan umum PCR meliputi (1) denaturasi, (2) penempelan primer, (3) perpanjangan primer (Vierstraete & Vanfleteren 1999).
Reverse Transcription Polymerase Chain Reaction (RT-PCR)
Reverse Transcription Polymerase Chain Reaction (RT-PCR) merupakan salah satu teknik yang digunakan untuk mengamplifikasi RNA yang memiliki kestabilan yang lebih rendah dibandingkan DNA (Sudjadi 2008). Teknik PCR ini dapat diterapkan untuk studi RNA apabila RNA telah ditranskripsi balik menjadi cDNA sehingga dapat dijadikan cetakan dalam proses PCR. cDNA atau complementary DNA merupakan DNA hasil proses transkripsi balik menggunakan RNA sebagai cetakan. RT-PCR merupakan metode paling sensitif untuk deteksi dan kuantifikasi mRNA. Teknik ini antara lain dapat digunakan untuk pembuatan pustaka cDNA, mengidentifikasi mutasi maupun polimorfisme pada skuen hasil transkripsi. Teknik ini hanya membutuhkan RNA dalam jumlah sedikit dan toleran terhadap RNA target yang terdegradasi (Joyce 2002).
dapat digunakan karena adanya UNG pada teknik PCR satu tahap akan menghilangkan cDNA yang telah disintesis. RT-PCR dua tahap terdiri atas dua tahap terpisah, yakni tahap sintesis cDNA dan tahap amplifikasi cDNA. Tahap pertama merupakan penyalinan RNA menjadi cDNA menggunakan enzim reverse transcriptase dengan RNA sebagai cetakan. Primer yang digunakan pada tahap ini umumnya ada tiga jenis, yaitu oligo dT, gene specific primer, dan random hexanucleotide. cDNA yang diperoleh akan diamplifikasi pada tahap ke dua dengan menggunakan teknik PCR. RT-PCR dua tahap berguna untuk mendeteksi transkripsi ganda dari reaksi cDNA tunggal atau apabila cDNA akan disimpan untuk penggunaan selanjutnya (Applied Biosystem 2003).
Elektroforesis DNA
Elektroforesis merupakan salah satu teknik penapisan utama dalam biologi molekuler. Elektroforesis dapat digunakan untuk memisahkan dan memurnikan fragmen-fragmen DNA ataupun RNA yang memiliki muatan listrik di bawah pengaruh medan listrik. Prinsip elektroforesis adalah memisahkan molekul berdasarkan muatannya. DNA yang bermuatan negatif karena adanya gugus fosfat akan bergerak ke arah kutub positif selama elektroforesis. Fragmen DNA mempunyai muatan negatif yang sama untuk tiap-tiap ukuran panjang sehingga pergerakan DNA ini akan memiliki kecepatan yang sama untuk mencapai kutub positif (Clark & Christopher 2008).
Pergerakan yang sama antar molekul DNA tidak dapat digunakan untuk memisahkan DNA berdasarkan ukurannya. Elektroforesis makromolekul, seperti asam nukleat memerlukan matriks penyangga untuk mencegah terjadinya difusi karena timbulnya panas dari arus listrik yang digunakan. Gel poliakrilamid dan agarosa merupakan matriks penyangga yang banyak dipakai untuk separasi protein dan asam nukleat karena dapat memperlambat pergerakan DNA. Gel ini merupakan polimer sehingga akan membentuk semacam jaring-jaring untuk memerangkap DNA. DNA dengan ukuran yang lebih besar akan lebih sulit untuk melewati lubang atau pori dari gel sehingga DNA dengan sendirinya akan terpisah berdasarkan besarnya ukuran karena kemampuan DNA yang berbeda-beda dalam melewati pori dalam gel. Media pendukung yang digunakan dalam elektroforesis, antara lain kertas atau membran selulosa, gel
pati, gel poliakrilamid, dan gel agarosa (Clark & Christopher 2008).
Teknik elektroforesis terdiri atas dua macam, yaitu elektroforesis gel dan elektroforesis SDS PAGE. Elektroforesis gel merupakan teknik utama dalam biologi molekuler dan biasa dilakukan untuk tujuan analisis, namun dapat pula digunakan sebagai teknik preparatif untuk memurnikan molekul sebelum digunakan dalam metode-metode sekuensing DNA, atau immuno blotting yang merupakan metode-metode karakterisasi lebih lanjut. Gel yang biasa digunakan adalah agarosa yang berasal dari ekstrak rumput laut yang telah dimurnikan. Prinsip elektroforesis gel adalah molekul DNA yang bermuatan negatif di dalam medan listrik akan bermigrasi melalui matriks gel menuju kutub positif (anode). Semakin besar ukuran molekul DNA, laju migrasi semakin rendah. Berat molekul suatu fragmen DNA dapat diperkirakan dengan membandingkan laju migrasinya dengan laju migrasi fragmen-fragmen molekul DNA standar (DNA marker) yang telah diketahui ukurannya.
Visulisasi DNA dilakukan di bawah paparan sinar UV setelah terlebih dahulu gel dalam pembuatannya ditambahkan larutan EtBr. Cara lain untuk melihat visualisasi DNA adalah gel direndam di dalam larutan EtBr sebelum dipaparkan di atas sinar UV. Marka atau penanda yang digunakan pada proses running merupakan campuran molekul dengan ukuran berbeda-beda yang dapat digunakan untuk menentukan ukuran molekul dalam pita sampel. Setelah tahap running selesai, dilakukan metode staining dan destaining. Metode staining adalah pewarnaan gel agarosa yang dilakukan dengan menggunakan larutan etidium bromida (EtBr) selama 10 menit. Hal ini dilakukan dengan tujuan agar molekul sampel berpendar dalam sinar ultraviolet. Metode destaining atau penghilangan warna dilakukan dengan cara memasukkan gel ke dalam air (akuades) selama 5 hingga 10 menit (Clark & Christopher 2008).
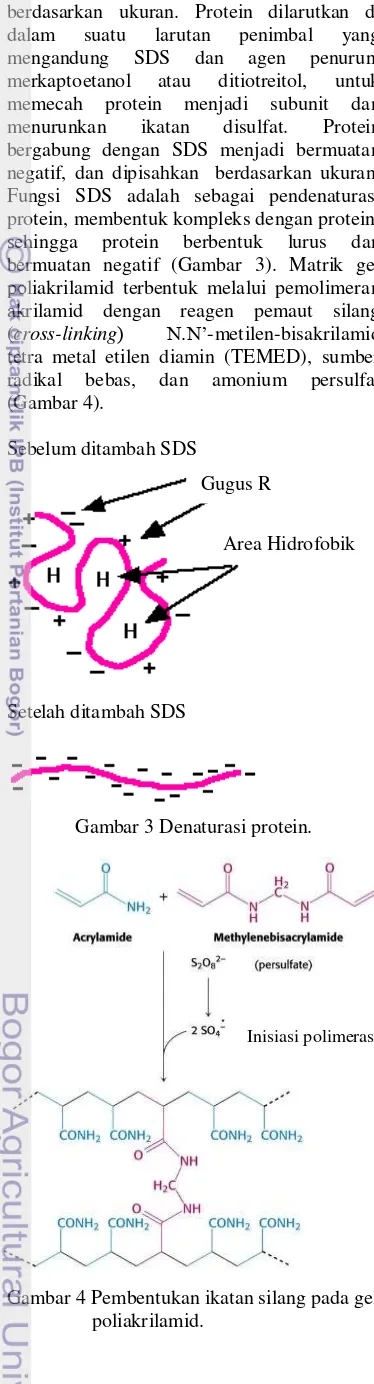
berdasarkan ukuran. Protein dilarutkan di dalam suatu larutan penimbal yang mengandung SDS dan agen penurun, merkaptoetanol atau ditiotreitol, untuk memecah protein menjadi subunit dan menurunkan ikatan disulfat. Protein bergabung dengan SDS menjadi bermuatan negatif, dan dipisahkan berdasarkan ukuran. Fungsi SDS adalah sebagai pendenaturasi protein, membentuk kompleks dengan protein, sehingga protein berbentuk lurus dan bermuatan negatif (Gambar 3). Matrik gel poliakrilamid terbentuk melalui pemolimeran akrilamid dengan reagen pemaut silang (cross-linking) N.N’-metilen-bisakrilamid tetra metal etilen diamin (TEMED), sumber radikal bebas, dan amonium persulfat (Gambar 4).
Sebelum ditambah SDS
Setelah ditambah SDS
Gambar 3 Denaturasi protein.
Gambar 4 Pembentukan ikatan silang pada gel poliakrilamid.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan untuk penumbuhan padi adalah padi transgenik Nipponbare dan padi Nipponbare tipe liar sebagai pembanding (kontrol negatif), tanah, pupuk (NPK), aquades, dan kertas saring. Isolasi DNA tanaman padi menggunakan daun padi, etanol 70%, etanol absolut, dan bufer ekstraksi yang mengandung NaCl 5 M, Tris-HCl 1 M, etilendiamin tetraasetat (EDTA) 0.5 M, setiltrimetil ammonium bromide (CTAB), polivinil pirolidon (PVP), dan merkap -toetanol. Selain itu digunakan pula larutan kloroform isoamilalkohol (chisam), Na-asetat, RNase, dan larutan TE (Tris-EDTA). Reaksi PCR menggunakan bufer PCR, MgCl2, dNTP, sepasang primer, DNA, dan taq polimerase (Faststart). Bahan-bahan yang digunakan untuk elektroforesis adalah loading dye, 1 x bufer TAE, agarosa, DNA hasil PCR, marker 1 kb ladder (invitrogen), etidium bromida, dan aquades. Sekuen primer yang digunakan adalah Forward CO 5’-AAT AGG ATC CGC TCC CAC ACC ATC AAA CT -3’ dan Reverse CO 5’-AGT CAG TCG ACG CCA CAG GAG TCT CAG AAT G-3’ dan Forward primer aktin 5’-TCC ATC TTG GCA TCT CTC AG-’3 1 µL, Reverse primer aktin 5’-GTA CCC GCA TCA GGC ATC-’3 1 µL
Alat-alat yang digunakan adalah gunting, microfuge, mikropipet, neraca analitik, autoklaf, mortar, vorteks, spektrofotometer, UV Illuminator ChemiDoc EQ (Biorad), elektroforesis, spin, tip, labu Erlenmeyer, tabung mikro, kuvet, kertas aluminium, stopwatch, penangas air, microwave, gelas ukur, baki gel agarosa, mesin PCR PTC-100.
Metode
Penumbuhan Padi
Penumbuhan padi dilakukan secara bertahap. Padi disemai dalam cawan petri yang telah dialasi kertas saring. Penyiraman dilakukan setiap hari untuk menghindari kekeringan. Penyemaian dalam cawan Petri dilakukan selama 10 hari. Padi yang sudah cukup tinggi dipindahkan ke dalam bak secara berkelompok. Setelah sekitar dua minggu dalam bak maka padi dipindahkan ke dalam ember dan disimpan di rumah kaca. Padi yang ditanam terdiri atas 8 galur, yakni 7 galur tanaman padi putatif AtCO, yakni galur NCO 211, 214, 215, 221, 231, dan galur 233, dan 1 galur tipe liar (Nipponbare).
Gugus R
Area Hidrofobik
Isolasi DNA Padi
Isolasi DNA dilakukan berdasarkan pada metode CTAB yang mengacu pada Shure et al. (1983) dan Doyle & Doyle (1987). Metode ini dilakukan melalui tiga tahap yaitu persiapan ekstrak sel, pemurnian DNA, dan pemekatan DNA. Preparasi ekstrak sel dimulai dengan perendaman daun padi yang ditempatkan pada tabung mikro 2 mL dengan liquid nitrogen (LN) kemudian digerus menggunakan sumpit dan ditambahkan bufer ekstraksi sebanyak 1000 µL. Hasil gerusan diinkubasi di dalam penangas air pada suhu 65 oC selama 15 menit, kocok (bolak-balik tabung) setiap 5 menit sekali. Pemurnian DNA dilakukan melalui penambahan natrium asetat 3M sebanyak 100 µL dan kloroform isoamilalkohol sebanyak 1000 µL ke dalam tabung, kemudian dikocok hingga merata. Suspensi selanjutnya disentrifus dengan kecepatan 12000 rpm selama 5 menit. Pemekatan DNA dilakukan dengan penambahan natrium asetat 3M sebanyak 70 µL(1/10 volume) dan etanol absolut sebanyak 520 µL (2/3 volume) ke dalam supernatan dan dicampur perlahan. Sampel disentrifus pada kecepatan 12000 rpm selama 5 menit. Pelet yang diperoleh dicuci dengan 500 µL etanol 70%. Campuran disentrifus kembali selama 3 menit pada kecepatan 12000. Pelet selanjutnya dikeringkan dalam oven selama 5 menit. Pelet yang telah kering dilarutkan dalam bufer TE yang mengandung ribonuklease sebanyak 50 µL dan diinkubasi pada suhu 37 oC selama 30 menit.
Uji Kualitas dan Kuantitas DNA dengan Spektrofotometer
Uji kualitas dan kuantitas DNAdilakukan berdasarkan metode Sambrook dan Russel (1989). Metode ini dilakukan dengan menggunakan spektrofotometer menggunakan 2 µL sampel DNA dan 498 µL air steril. Mula-mula disiapkan kuvet dan perlengkapan untuk spektrofotometer. Alat dinyalakan dan diatur display untuk pengukuran kuantitas DNA. Sebanyak 400 µ L bufer TE atau akuades dimasukkan ke dalam kuvet. Kuvet dimasukkan ke tempat pengukuran. Kuvet dicuci, selanjutnya dimasukkan sebanyak 2 µL DNA ditambahkan dengan 498 µL bufer TE. Kuvet ditutup, dimasukkan dalam tempat pengukuran.
Angka yang muncul pada layar merupakan konsentrasi dari DNA sampel yang diukur dan dicatat. Kualitas DNA ditentukan pada OD 260/280 yang merupakan nilai kemurnian dari sampel. DNA yang murni mempunyai OD
260/280 = 1.8 hingga 2.0. Apabila nilainya kurang dari 1.8 maka sampel DNA masih mengandung kontaminan protein, dan untuk menghilangkannya ditambahkan proteinase. Apabila nilainya lebih dari 2.0 maka sampel DNA masih mengandung kontaminan RNA, dan untuk menghilangkannya ditambahkan ribonuklease. Tahap selanjutnya DNA diencerkan dengan konsentrasi akhir 50 ng/µ L untuk proses amplifikasi PCR.
Amplifikasi DNA dengan PCR
Amplifikasi DNA padi mula-mula disiapkan tabung mikro untuk membuat campuran reaksi amplifikasi. Setiap tabung diisi dengan reaksi amplifikasi yang terdiri atas 2 µL buffer PCR , 0.6 µL MgCl2 50 mM, 0.4 µL dNTP mix 10 mM, 2 µL campuran primer gen CO (forward dan reverse), 0.16 U/µL Taq polimerase, 1 µL DNA 50 ng/µL, dan 13.24 µL ddH2O. Kemudian dijalankan program pada mesin PCR. Primer yang digunakan untuk amplifikasi dengan teknik PCR adalah sepasang primer untuk gen CO. Sekuen primer yang digunakan adalah Forward 5’-AAT AGG ATC CGC TCC CAC ACC ATC AAA CT -3’ dan Reverse 5’-AGT CAG TCG ACG CCA CAG GAG TCT CAG AAT G-3’. Total volume reaksi PCR adalah 20 µL. Reaksi amplifikasi dilakukan dengan mesin PCR (PCT 100) dengan program tahap denaturasi pada suhu 94 oC selama 30 detik, penempelan primer pada suhu 60 oC selama 30 detik, dan pemanjangan pada suhu 72 oC selama 45 detik. Program PCR diulang sebanyak 30 siklus. Proses pemanjangan akhir pada suhu 72 oC selama 5 menit.
Elektroforesis Hasil PCR
dihilangkan pewarnaannya dengan air selama 5 menit. Visualisasi DNA dilakukan pada UV Illuminator ChemiDoc EQ (Biorad).
Isolasi RNA (Qiagen 2006)
Isolasi RNA dilakukan berdasarkan metode Qiagen 2006. Sebelumnya semua peralatan yang akan digunakan direndam pada larutan DEPC sebanyak 0.1 mL dalam 100 mL air selama 12 jam dan diautokalaf. Isolasi RNA diawali dengan sebanyak 10 sampel tanaman yang terdiri atas 7 sampel tanaman padi positif AtCO, 2 sampel tanaman padi negatif AtCO, dan 1 sampel tanaman sebagai kontrol negatif. Sebanyak 0.1 gram daun padi ditimbang terlebih dahulu kemudian diletakkan pada mortar dan ditambahkan nitrogen cair secukupnya kemudian digerus hingga lembut. Daun padi yang telah digerus ditambahkan dengan 450 µL bufer RLT kemudian masukkan ke dalam tabung mikro 2 mL. Campuran tersebut di vorteks selama 1-2 menit hingga homogen, kemudian diinkubasi pada suhu 56oC selama 3 menit. Suspensi dipindahkan ke dalam tabung QIAshredder spin column (warna ungu) menggunakan tip yang ujungnya sudah dipotong. Sampel disentrifus selama 2 menit dengan kecepatan 12000 rpm. Supernatan yang dihasilkan dipindahkan ke dalam tabung mikro 2 mL yang baru kemudian ditambahkan etanol absolut (96%) sebanyak 0.5 volume total (lakukan pipeting). Sebanyak 650 µL suspensi dipindahkan ke dalam tabung Rneasy mini column (warna pink) kemudian disentrifus kembali pada kecepatan 10000 rpm selama 15 detik.
Supernatan yang dihasilkan pada tahap sentrifus sebelumnya dibuang dan ditambahkan dengan larutan RW1 sebanyak 700 µL ke dalam kolom RNeasy. Suspensi disentrifus kembali dengan kecepatan 10000 rpm selama 15 detik. Supernatan yang dihasilkan dibuang kemudian ditambahkan larutan bufer RPE sebanyak 500 µL. Sebanyak 500 µL bufer RPE ditambahkan kembali melalui kolom RNeasy dan disentrifus selama 2 menit dengan kecepatan 10000 rpm. Kolom RNeasy dipindahkan ke dalam tabung mikro 1.5 mL kemudian ditambahkan 30-50 µL RNase bebas air kemudian disentrifus pada kecepatan 10000 selama 1 menit. RNA yang didapatkan di spektro untuk mendapatkan konsentrasi.
Sintesis cDNA (Superscript II)
Sintesis cDNA dilakukan melalui 3 tahap, yaitu tahap S1, SII, dan SIII. Tahap S1 RNA
yang digunakan sebagai template pada sinteis cDNA adalah RNA hasil isolasi. RNA diambil sebagai cetakan beberapa mikro sesuai dengan konsentrasi RNA yang didapatkan, kemudian ditambahkan dengan aquades hingga volume 11 µL, selain itu ditambahkan dengan dNTP mix 10 mM sebanyak 1 µ L, dan oligo (dT) (500µg/mL) sebanyak 1µL kemudian di spin sampai homogen. Campuran tersebut di inkubasi pada suhu 65 oC selama 5 menit.
Tahap SII merupakan tahap inkubasi lanjut. Bufer yang digunakan pada tahap ini terdiri atas 5x bufer first strand sebanyak 4 µL, dan 0.1 M dTT sebanyak 2 µ L. Larutan diaduk hingga homogen kemudian di inkubasi pada suhu 42oC selama 2 menit. Tahap SIII merupakan penambahan enzim Superscript II pada larutan yang telah diinkubasi kemudian diaduk dan di inkubasi pada suhu 42 oC selama 50 menit dan untuk penghentian panas larutan dipanaskan pada suhu 70 oC selama 15 menit.
Tahapan selanjutnya adalah amplifikasi PCR produk yang berupa cDNA, mula-mula disiapkan campuran reaksi PCR yang terdiri atas 10x PCR bufer (200 mM Tris-HCl pH 8.4, 500 mM dNTP mix 1 µL, Forward primer (10 µM) 5’-TCC ATC TTG GCA TCT CTC AG-3’ 1 µL, Reverse primer (10 µM) 5’-GTA CCC GCA TCA GGC ATC-3' 1 µL, Taq DNA polymerase (5 U/µL) 0.4 µL, cDNA 2 µL, aquades.
Pengamatan Umur Berbunga
Pengamatan umur berbunga dilakukan setelah tanaman padi mulai mengeluarkan malai dan bunga. Umur berbunga tersebut di hitung sejak hari pertama semai hingga tumbuh bunga. Pengamatan dilakukan dengan kategori tanaman putatif transgenik AtCO dan tanaman non-transgenik (tipe liar sebagai kontrol negatif.
HASIL DAN PEMBAHASAN
Hasil Penanaman Padi NCO
Padi NCO (Nipponbare CONSTANS) merupakan padi generasi T0 yang diduga mengandung gen CONSTANS (putatif transgenik AtCO). Penyemaian padi di dalam cawan Petri dilakukan selama sepuluh hari atau hingga padi tumbuh berkecambah dan timbul daun. Padi yang disemai pada petri disiram setiap hari untuk menghindari kekeringan. Tidak semua jumlah padi yang disemai dapat tumbuh, hal ini berkaitan dengan kualitas padi itersebut. Jumlah padi yang tumbuh pada masing-masing galur dapat dilihat pada Tabel 1.
Tabel 1 Jumlah benih padi NCO yang tumbuh No. No. Lapang ∑semai ∑tumbuh 1 NCO 211 25 16 2 NCO 2.4 24 11 3 NCO 215 25 10 4 NCO 221 25 14 5 NCO 222 25 11 6 NCO 231 4 2 7 NCO 233 25 19 8 Nipponbare 25 9
Berdasarkan tabel di atas jumlah padi NCO yang tumbuh dari masing-masing galur mencapai setengah dari jumlah semainya. Tanaman padi yang digunakan sebagai kontrol, yaitu padi Nipponbare tumbuh paling sedikit dari jumlah semai awal. Hal ini berkaitan dengan lama penyimpanan benih.
Tanaman padi yang sudah tumbuh dipindahkan ke dalam bak secara berkelompok untuk memudahkan penamaan. Pemindahan padi tersebut bertujuan untuk penyesuaian nutrisi. Setelah dua minggu, padi dipindahkan ke dalam ember dengan kondisi dua tanaman dalam satu ember untuk ditumbuhkan hingga berbunga dan menghasilkan biji. Pemindahan padi pada peneltian ini dilakukan setelah padi bermur tiga minggu di dalam bak. Hal ini dikarenakan belum tersedianya bahan penanaman. Alur penumbuhan padi dapat dilihat pada Gambar 5.
Media tanam terdiri atas campuran tanah liat, pupuk kandang, dan pupuk nitrogen dengan perbandingan 1:1. Ketiga unsur tersebut memiliki peranan yang sangat penting bagi pertumbuhan dan produktivitas tanaman. Unsur-unsur tersebut saling berinteraksi dalam menunjang pertumbuhan tanaman. Unsur nitrogen dapat diperoleh dari pupuk urea, unsur P dari TSP, dan unsur K dalam KCL. Peranan utama unsur N pada tanaman adalah merangsang pertumbuhan vegetatif batang dan daun, meningkatkan jumlah
anakan, dan meningkatkan bulir. Pemberian nitrogen yang berlebihan dapat menurunkan kualitas bulir dan penghambatan pertumbuhan. Fungsi fosfor dalam pertumbuhan tanaman adalah memacu terbentuknya bunga, bulir pada malai, perkembangan akar halus dan akar rambut, memperkuat jerami sehingga tidak mudah patah, dan memperbaiki kualitas gabah. Kekurangan fosfor menyebabkan tanaman kerdil, jumlah anakan sedikit, dan daun meruncing berwarna hijau gelap (Tejasarwana 1995).
Gambar 5 Alur penanaman padi.
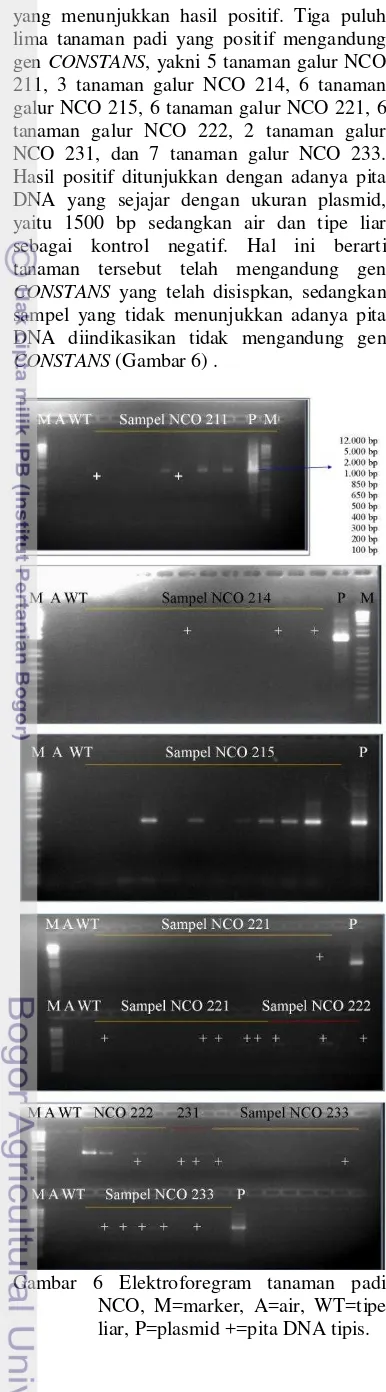
Hasil Amplifikasi Gen CONSTANS Hasil PCR ini akan menghasilkan DNA yang telah teramplifikasi dengan primer tententu. Sebelum melakukan amplifikasi gen CONSTANS, sampel DNA memerlukan pengujian kualitas DNA. Pengujian kualitas DNA dilakukan dengan metode Sambrook and Russel (1989). Uji kuantitas DNA dapat dilakukan dengan mengukur konsentrasi menggunakan spektrofotometer pada panjang gelombang 260 nm dan kemurnian DNA pada perbandingan panjang gelombang 260/280. Nilai kemurnian DNA yang baik berkisar antara 1.8-2.0. DNA sampel yang telah terkuantifikasi dengan spektrofotometer dapat digunakan sebagai cetakan pada proses PCR. Uji kualitas DNA dapat dilakukan melalui elektroforesis gel agarosa. Uji ini akan menghasilkan pita-pita DNA pada ukuran tertentu.
yang menunjukkan hasil positif. Tiga puluh lima tanaman padi yang positif mengandung gen CONSTANS, yakni 5 tanaman galur NCO 211, 3 tanaman galur NCO 214, 6 tanaman galur NCO 215, 6 tanaman galur NCO 221, 6 tanaman galur NCO 222, 2 tanaman galur NCO 231, dan 7 tanaman galur NCO 233. Hasil positif ditunjukkan dengan adanya pita DNA yang sejajar dengan ukuran plasmid, yaitu 1500 bp sedangkan air dan tipe liar sebagai kontrol negatif. Hal ini berarti tanaman tersebut telah mengandung gen CONSTANS yang telah disispkan, sedangkan sampel yang tidak menunjukkan adanya pita DNA diindikasikan tidak mengandung gen CONSTANS (Gambar 6) .
Gambar 6 Elektroforegram tanaman padi NCO, M=marker, A=air, WT=tipe liar, P=plasmid +=pita DNA tipis.
DNA yang telah diamplifikasi gennya melalui teknik PCR tersebut merupakan DNA hasil isolasi dari tanaman padi yang terdiri atas tanaman padi non-transgenik dan tanaman padi putatif transgenik AtCO. Isolasi DNA dilakukan berdasarkan metode Shure et al (1983) yang dimodifikasi dengan penambahan metode CTAB dari Doyle & Doyle (1987). Metode ini dipilih karena cara pengerjaanya yang realtif mudah dan sangat tepat untuk isolasi padi yang banyak mengandung pati atau polisakarida. Larutan CTAB merupakan deterjen kationik yang melarutkan membran dan membentuk kompleks dengan DNA sehingga memungkinkan dilakukan presipitasi selektif pada konsentrasi garam rendah (<0.5 M) atau dengan penambahan isopropanol. Hasil uji kuantitatif DNA menunjukan kemurnian yang tinggi yang berkisar antara 1.8-2.0 dengan konsentrasi yang berbeda-beda. Konsentrasi yang didapat sangatlah bervariasi. Namun, dalam hal ini konsentrasi tidak terlalu diperhatikan. Tingginya konsentrasi dipengaruhi oleh cara penggerusan masing-masing sampel. Konsentasi dan kemurnian DNA hasil isolasi dapat dilihat pada Lampiran 5.
Evaluasi Umur Berbunga Tanaman Padi
Gambar 7 Proses pembungaan padi.
Tanaman transgenik putatif AtCO yang telah dikarakterisasi secara molekuler untuk mengetahui keberadaan gen yang diintroduksikan kemudian perlu di evaluasi berdasarkan karakteristik yang diperlukan. Karakteristik suatu tanaman padi dapat dapat diamati berdasarkan karakter yang tampak dan diamati secara visual. Karakter tanaman dapat dibedakan menjadi dua bentuk, yaitu karakter kualitatif dan karakter kuantitatif (Nasir 2001). Karakteristik yang diamati pada penelitian ini di antaranya umur berbunga, jumlah anakan, tinggi tanaman, dan umur panen. Evaluasi umur berbunga dilakukan dengan membandingkan umur berbunga antara tanaman transgenik dan tanaman non transgenik. Berdasarkan pengamatan tersebut diperoleh padi transgenik AtCO yang bersifat genjah, yakni yang memiliki umur berbunga kurang dari 100 hari. Umur berbunga tanaman padi ini berkisar antara 63 hari hingga 6 hari. Umur berbunga tersebut dihitung sejak tanggal semai. Tanaman padi transgenik pada penelitian ini memiliki umur berbunga tercepat yakni 63 hari dibandingkan dengan tipe liarnya yang memiliki umur berbunga 68 hari (Lampiran 6).
Berdasarkan umur panen padi, Samaullah (2009) menggolongkan menjadi lima yaitu, ultra genjah (<90 hari), sangat genjah (90-104 hari), genjah (105-124 hari), sedang (125-150 hari) dan dalam (>150 hari). Tanaman padi Nipponbare transgenik memiliki umur panen 118 hari hingga 128 hari. Hal ini menunjukkan bahwa tanaman padi Nipponbare transgenik memiliki sifat genjah hingga sedang. Tanaman padi yang berumur pendek (genjah) cenderung memiliki jumlah produksi yang tinggi. Berdasarkan tinggi tanaman, tanaman padi di ukur sebanyak dua kali, yakni pada masa pertumbuhan vegetatif dan masa pertumbuhan reproduksi atau generatif. Tinggi tanaman padi diukur dari batang paling bawah di atas permukaan tanah sampai daun tertinggi. Departemen Pertanian (2003) menggolongkan tinggi tanaman padi
ke dalam tiga golongan yaitu tinggi (>130 cm), sedang (110 cm – 130 cm), dan rendah (<110 cm) (Lampiran 7). Tinggi tanaman padi pada penelitian ini berkisar antara 44-80 cm dan digolongkan ke dalam tanaman rendah. Menurut Abdullah et al. (2008), padi jenis Nipponbare memiliki tinggi berkisar antara 110-120 cm. Hal ini dapat disebabkan kurangnya unsur hara yang tersedia.
Analisis Ekspresi Gen CONSTANS Analisis ekspresi gen CONSTANS (CO) dilakukan melalui analisis RNA menggunakan metode RT-PCR. Analisis RT-PCR dilakukan terhadap 7 sampel tanaman padi transgenik, 2 sampel tanaman padi non transgenik, dan 1 sampel tipe liar yang berhasil diisolasi RNA dan dibuat cDNA-nya. Sampel tersebut dipilih sebagai perwakilan dari setiap galur. Sampel tersebut dipilih karena memiliki pita DNA yang cukup tebal dan jelas pada amplifikasi PCR. Analisis tersebut termasuk cara yang mudah untuk menguji tingkat ekspresi gen yang telah diketahui sekuen nukleotidanya (Chaidamsari et al. 2006). Kelimpahan RNA transkrip di dalam sel merupakan parameter ekspresi gen. Oleh karena itu, proses analisis ekspresi gen diawali dengan isolasi RNA. RNA total diisoalasi dari daun tanaman padi dengan menggunakan kit RNeasy. Metode ini merupakan metode baru untuk mengisolasi RNA dengan cepat dan mudah (Pertiwi 2010). Sampel daun padi yang telah dihaluskan dihomogenisasi dengan bufer lisis RLT yang mengandung guanidin tiosianat yang berfungsi untuk menghambat kerja RNase dan akan menghancurkan sel-sel pengganggu. Larutan ditempatkan pada tabung QIA shredder spin column. Etanol ditambahkan untuk menyediakan kondisi pengikatan yang tepat antara RNA dengan membran gel silika dalam tabung. RNA akan terikat pada membran silika di dalam kolom dan kontaminan akan hilang bersama suspensi setelah di sentrifus. Beberapa bufer yang digunakan pada isolasi RNA adalah bufer RLT, RW1, dan RPE. Bufer RW1 dan RPE masing-masing mengandung etanol yang berfungsi untuk mengendapkan jaringan pengganggu sehingga terikat pada membran silika. Menurut Qiagen (2006) metode ini mengisolasi RNA dengan panjang lebih dari 200 nukleotida. RNA kecil, seperti 5.8S rRNA, 5S rRNA, dan tRNAs yang memiliki panjang masing-masing 160, 120, dan 70-90 nukleotida tidak dapat terikat dan terisolasi dengan metode ini. RNA dengan bobot molekul rendah berjumlah 15-20% dari RNA
pemasakan
pembungaan
total, oleh karena itu molekul RNA besar lebih banyak terisolasi.
Gambaran kuantitatif mengenai hasil yang diperoleh dari isolasi RNA dilakukan dengan pengukuran kuantitas dan kemurnian RNA total hasil ekstraksi menggunakan spektrofotometer. Pengukuran konsentrasi RNA dilakukan pada panjang gelombang 260 nm dengan perhitungan 1 nilai absorbansi sama dengan 40 μg/mL. Kemurnian RNA diukur pada rasio A260/A280, karena protein diserap pada panjang gelombang 280 nm (Rapley & Heptinstall 1998). Nilai konsentrasi yang diperoleh dapat dilihat pada Tabel 2.
Tabel 2 Konsentrasi RNA tanaman padi NCO Sampel Konsentrasi A260 A280 260/280 NCO (ng/μL)
211.11 78.8 1.971 0.957 2.06 214.5 290.8 7.271 3.421 2.09 215.1 578.1 14.452 6.870 2.10 215.10 162.2 4.056 1.903 2.13 221.13 320.2 8.004 3.809 2.10 214.1 308.1 7.702 3.633 2.12 231.1 378.1 9.453 4.481 2.11 222.8 174.4 4.361 2.082 2.09 233.15 77.5 1.938 0.888 2.18 NB 351.8 8.794 4.157 2.12
Berdasarkan tabel di atas nilai konsentrasi masing-masing RNA sangat beragam, berkisar antara 70-500 ng/µL dengan kemurnian masing-masing di atas 2.0. Menurut Wilfinger (1997), kemurnian RNA berkisar antara 1.9-2.3 pada pH 7.5. Konsentrasi yang telah didapatkan digunakan untuk menghitung konsentrasi sintesis cDNA. Menurut Qiagen (2006) setiap konsentrasi 1000 ng/µ L maka RNA yang digunakan sebanyak 1 µL. RNA total hasil isolasi kemudian disintesis menjadi cDNA melalui transkripsi balik (reverse transcription). Proses transkripsi ini melalui 3 tahap, yaitu tahap sintesis 1 selama 5 menit, sintesis 2 selama 2 menit, dan sintesis 3 selama 65 menit. Tahap sintesis 1 merupakan tahapan penambahan oligo(dT) yang akan berikatan dengan mRNA sehingga dapat disintesis menjadi cDNA (complementary DNA). Hal ini dikarenakan mRNA memiliki poli A pada ujung 3’ sedangkan rRNA dan tRNA tidak memiliki poli A. Tahap sintesis 2 adalah penambahan bufer. Tahap sintesis 3 merupakan tahapan penambahan enzim superscript II dan merupakan tahap akhir dari sintesis cDNA.
Hasil analisis cDNA selanjutnya digunakan untuk analisis ekspresi gen.
Ekspresi gen dianalisis menggunakan program PCR dengan primer aktin dan primer CO. Menurut Suharsono (2010), ekspresi gen aktin digunakan sebagai kontrol internal pada RT-PCR. Penggunaan primer aktin dipilih karena penggunaannya yang cukup mudah dan dapat menunjukkan hasil amplifikasi secara jelas dan cepat. Selain itu, aktin ini telah banyak digunakan sebagai kontrol internal yang stabil pada uji ekspresi gen pada daun dan akar Chicorium intibus. Penggunaan primer CO merupakan primer spesifik terhadap gen CONSTANS, sehingga dapat menunjukkan adanya gen yang diiontroduksikan. Kontrol internal RNA sangat penting untuk mendeteksi adanya kesalahan hasil negatif karena degradasi RNA selama proses ekstraksi atau keberadaan inhibitor pada proses transkripsi balik dan PCR (Gambino & Grimbaudo 2006). Selain itu, hasil amplifikasi menggunakan kontrol internal dapat digunakan sebagai indikasi keberhasilan isolasi RNA.
Hasil amplifikasi RNA menunjukkan bahwa dari masing-masing sampel mengandung RNA hasil isolasi. Berbeda dengan primer aktin yang tidak bersifat spesifik, penggunaan primer CO yang spesifik terhadap gen CONSTANS menunjukkan bahwa dari lima sampel RNA yang di isolasi, ekspresi gen hanya ditunjukkan oleh sampel NCO 211-11 yang memiliki umur berbunga 67 hari (Lampiran 6). Hal ini dibuktikan dengan adanya pita DNA yang sejajar dengan plasmid serta DNA hasil isolasi yang digunakan sebagai kontrol positif. Namun, dihubungkan dengan umur berbunga sampel tersebut memiliki umur berbunga yang hanya berselisih 1 hari dengan tipe liarnya. Hal ini menunjukkan adanya tingkat ekspresi, namun tidak sesuai dengan yang diharapkan. Sementara itu, sampel yang telah positif DNA namun tidak menunjukkan adanya ekspresi gen dimungkinkan adanya proses pembungkaman gen yang mengacu pada sejumlah proses regulasi gen yang mencegah ekspresi gen. Gen dihalangi oleh mekanisme tertentu sehingga tidak dapat ditranskripsikan, atau dapat ditranskripsikan namun tidak dapat diproses menuju tahap berikutnya (translasi) (Gambar 8).
kecil dibandingkan dengan ukuran DNA. Hasil ini menunjukkan bahwa daerah yang diamplifikasi adalah daerah ekson pada cDNA sedangkan daerah intronnya dibuang saat pembentukan RNA. Sedangkan pada DNA daerah ekson dan intron tetap ditranskripsikan (Suharsono et al. 2008).
Gambar 8 Elektroforegram hasil PCR menggunakan primer aktin dan primer CO. M=marker, A=air, 1=kontrol, 2=NCO 211.11, 3=NCO 215.10, 4=NCO 214.1, 5=NCO 233.15, 6=kontrol, 7=NCO 215.10, 8=plasmid.
SIMPULAN DAN SARAN
Simpulan
Hasil analisis yang dilakukan terhadap 80 tanaman padi putatif transgenik AtCO, didapatkan sebanyak 35 tanaman yang positif mengandung gen CONSTANS. Berdasarkan evaluasi umur berbunga, tanaman yang positif mengandung gen CONSTANS memiliki umur berbunga yang lebih cepat dibandingkan dengan tanaman kontrol (wild type). Analisis ekspresi gen CONSTANS didapatkan satu sampel yang menunjukkan adanya ekspresi dari mRNA CO, yakni tanaman padi galur NCO 2.1.1-11.
Saran
Penanaman kembali tanaman padi yang sudah positif (generasi T2) perlu dilakukan untuk mengetahui kestabilan gen yang telah diintroduksikan sehingga dapat dihasilkan tanaman positif AtCO yang memiliki umur berbunga yang lebih cepat yang dapat disilangkan dengan padi dari jenis yang lainnya.
DAFTAR PUSTAKA
Abdullah et al. 2008. Perkembangan dan prospek perakitan padi tipe baru di Indonesia. J Litbang Pertanian 27:1-9.
Applied Biosystem. 2003. Sequence Detection System AB1 Prism. Singapura : Aplera. Chaidamsari T, Samanhudi H, Sugiarti D,
Santoso GC, Angenent, de Maagd RA. (2006). Isolation and characterization of an AGAMOUS homologue from cocoa. Plant Sci 170: 968-975.
Chakrabarti R. 2004. PCR Technology: Current Innovation. Boca Raton: CRC Pr. Clark W, Christopher K. 2008. An
Introduction to DNA : Spectrophotometry, Degradation and The Frangekel Eksperiment. Alberta: University of Alberta.
Corbesier I, Vincent C, Jang S, et al. 2007. FT protein movement contributes to long distance signaling in floral induction of Arabidopsis. Science 316:1030-1033. Doyle JJ, Doyle JL. 1987. A rapid DNA
isolation from small amount of fresh leaf tissue. J Phytochem Bull 19:11-15. Gambino G, Gribaudo I. 2006. Simultaneous
detection of nine grapevine viruses by multiplex reverse transcription-polymerase chain reaction with coamplification of a plant RNA as internal control. Phytopathology 96:1223-1229.
Gardener FP, Pearce RB, Michell RL.1991. Fisiologi Tanaman Budidaya. Jakarta: UI Pr.
Harmansis A, Hajrial A, Koesoemaningtyas T, Suwarno. 2005. Evaluasi daya pemulih padi lokal dari kelompok tropikal japonica. Bul. Agron 33:1-6.
Izawa T. 2007. Adaptation of flowering-time by natural and artificial selection in Arabidopsis and rice. Journal of Experimental Botany 58: 3091-3097. Joyce C. 2002. Quantitive RT-PCR a review
of current methodologies. Methods in molecular Biology : 193.
Kardailsky I et al. 1999. Activation tagging og the floral inducer FT. Science 286: 1962-1965.
Kibria et al. 2008. Screening of aromatic rice lines by phenotypic and molecular markers. J Bot 37:141-147.
Kolesnik et al. 2004. Establishing and efficient Ac/Ds tagging system in rice: Large scale analysis of Ds flanking sequences. The Plant Journal 37:301-314. Lagercrantz U. 2009. At the end of the day: a
commn molecular mechanism for photoperiod responses in plants. Journal of Experimental Botany :1-15.
Laubinger S et al. 2006. Arabidopsis SPA proteins regulate photoperiodic flowering and interact with the floral inducer CONSTANS to regulate its stability. Development. 133:3212-3222.
Laurie DA et al. 2004. Comparative genetic approaches to the identification of flowering time genes in temperate cereals. Field Crops Research (90) : 87-99. Mikkelsen SR, Corton E. 2004. Bioanalytical
Chemistry. New Jersey: John Wiley & Sons.
Mizoguchi T, Wright L, Fujiwara S, et al. 2005. Distinct roles of GIGANTEA in promoting flowering and regulating circadian rhythms in Arabidopsis. The Plant Cell 17:2255-2270.
Nasir M. 2001. Pengantar Pemuliaan Tanaman. Jakarta : Direktorat Jerderal Pendidikan Tinggi Departemen Pendidikan Nasional.
Pertiwi Nurani. 2010. Ekspresi gen CsNitrl-L pada padi transgenik dan pengaruhnya terhadap variasi pemupukan nitrogen [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Praptiwi Dewi. 2010. Pembentukan dan seleksi f1 padi ciherang-pandan wangi dan fatmawati-mentik wangi menggunakan marka aromatik [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Putterill J, Robson F, Lee K, Simon R, Coupland G. 1995. The CONSTANS gene of Arabidopsis promotes flowering and encodes a protein showing similarities to zinc finger transcription factors. Cell 80: 847-857.
Qiagen. 2006. RNeasy Mini Handbook. Jerman : Qiagen.
Rapley R, Heptinstall J. 1998. Di dalam: Rapley R, Manning DL, Editor. RNA
Isolation and Characterization Protocols. New Jersey: Humana Press hlm. 65-68. Remelia M. 2008. Analisis insersi T-DNA
pembawa transposon AC/Ds pada T0 dan aktivitas Ds pada T1 tanaman padi (Oryza sativa L) kultivar nipponbare [skripsi]. Jakarta : UI Pr.
Robson et al. 2001. Functional importance of conserved domains in the flowering-time gene CONSTANS demonstrated by analysisnof mutant alleles and transgenic plants. Plant J. 28 :619-631.
Samaullah, Y. 2009. Indeks pertanaman padi IP 400 strategi, kebijakan, program dan uji coba [terhubung berkala]. http://www.litbang.deptan.go.id/press/one/ 18/pdf/Indeks%20Pertanaman%20Padi%2 0400%20Strategi,%20Kebijakan,%20Prog ram%20dan%20Uji% 20Coba.pdf [21 Mei 2010].
Sambrook J, Russel DW. 1989. Molecular Cloning: A Laboratory Manual, Third Edition. New York: Cold-Spring Harbor Laboratory Pr.
Shure M, S Wessler, N Fedorrof. 1983. Molecular identification ang isolastion of the waxy locus in maize cell. J Cell 35 : 225-233.
Soo Shin et al. 2003. Circadian regulation of rice (Oryza sativa L) CONSTANS-like gene transcripts. Mol. Cells 17(1):10-16. Suarez-Lopez P, Wheatley K, Robson F,
Onouchi H, Valverde R, Coupland G. 2001. CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis. Nature. 410: 1116-1120.
Sudjadi. 2008. Bioteknologi Kesehatan. Jakarta:Kanisius.
Suharsono, Firdaus S, Suharsono UW. 2008. Isolasi dan pengklonan fragmen cDNA dari gen penyandi multidrug resistance associated protein dari Melastome affine. Makara Sains 2 (12) :102-107.
Suharsono, Widyastuti U. 2010. Analisis gen penyandi protein heterotrimetik g subunit α yang terlibat dalam sistem toleransi tanaman kedelai terhadap cekaman alumunium. LPPM: IPB.
Kinerja Penelitian Tanaman Pangan (Bulan III). Prosiding Simposium Penelitian Tanaman Pangan III.. Badan Penelitian dan Pengembangan Pangan. Tjitrosoepomo SS. 1987. Botani umum.
Bandung: Angkasa.
Utami et al. 2010. Sidikjari DNA plasma nutfah padi local menggunakan marka molekuler spesifik untuk sifat padi beras merah. Berita Biologi 10(2).
Vergara BS. 1980. Rice plant growth and development, In BS Luh (Ed) Rice: Production and Utilization. AVI Publishing Company. Wesport Connection :75-86.
Vierstraete AR & Vanfleteren JR. 1999. Insertional RNA editing In Metazoan Mitochondria: The Cytochrome B Gene In
The Nematode Teratocfphalus lirellus. USA:Cambridge University press.
Winarno FG, Agustina W. 2007. Pengantar Bioteknologi (Revised Edition). Jakarta: MBrio Pr.
Wing Rod A et al. 2005. The Oryza map alignment project:the golden path to unlocking the genetic potential of wild rice species. Plant Molecular Biology 59: 53-62.
Wlifinger WW, Mackey M, and Chomczynski P. 1997. Effect of pH and ionic strength on the spectrophotometric assessment of nucleic acid purity. Biotechniques (22):474.
Lampiran 1 Alur Penelitian
Penyemaian benih padi
Nipponbare putatif AtCO dan
kontrol pada cawan Petri
Pemindahan padi dari cawan
Petri ke bak
Pemindahan tanaman padi
ke ember
Isolasi DNA
Pengujian kualitas dan
kuantitas DNA
PCR
Elektroforesis gel dan
visualisasi hasil amplifikasi
DNA
Isolasi RNA tanaman padi
positif AtCO
Sintesis cDNA
Lampiran 2 Isolasi DNA tanaman padi
Daun padi
Bufer CTAB 1000 µ L (2 x 500 µ L)
Lisis sel secara mekanik dengan penggerusan
Hasil gerusan dimasukkan ke tabung mikro 2 mL
Sampel diinkubasi pada 65
oC selama 15 m3nit
(setiap 5 menit dibolak-balik)
+ 100 µ L natrium asetat 3M
+ 1000 µ L kloroform isoamilalkohol
Supernatan disentrifus pada 12000 rpm selama 5 menit
+ 70 µ L natrium asetat 3M
Supernatan
+ 600 µ L isopropanol dingin
Supernatan disentrifus pada 12000 rpm selama 5 menit
Pelet DNA yang dihasilkan dicuci
dengan etanol 70% sebanyak 200 µ L
pelet disentrifus kembali pada kecepatan 12.000
selama 3 menit
Supernatan dibuang
DNA dikeringkan selama 5 menit
Lampiran
3 Komposisi larutan yang digunakan
Komposisi bufer ekstraksi DNA untuk 500 mL
Bahan kimia
Jumlah
NaCl 5 M
Tris-HCl 1 M
EDTA 0,5 M
CTAB
PVP
140 mL
150 mL
40 mL
10 g
10 g
Komposisi bufer TE
Bahan Kimia
Jumlah
EDTA
2.5 M
Tris-Cl 10 mM
0.5 mL
Aquades
500 mL
Komposisi mix PCR CO
Bahan Kimia
Jumlah (µ L)
Bufer PCR
2
MgCl2
1.2
dNTPs
0.5
CO Forward
1
CO Reverse
1
Taq
Polimerase DNA
0.08
ddH2O
13.22
DNA cetakan
1
Komposisi mix PCR Aktin
Bahan Kimia
Jumlah (µ L)
Bufer PCR
2
MgCl2
1.2
dNTPs
0.5
Aktin Forward
1
Aktin Reverse
1
Taq
Polimerasi DNA
0.2
ddH2O
12.1
Lampiran 4 Isolasi RNA Padi
Daun padi transgenik
Sampel divorteks 1-2 menit dan
diinkubasi pada 56
oC
Sampel dipindahkan ke dalam
tabung QIAshredder
Supernatan dibuang
Supernatan dibuang
Supernatan dibuang
Supernatan dibuang
sampel disentrifus pada
10000 rpm 1 menit
RNA total didapatkan
digerus dengan penambahan N2 cair dan bufer RLT
Sampel disentrifus pada 12000 rpm 2menit
+ etanol absolut
Sampel dipindahkan ke tabung RNeasy
Supernatan disentrifus pada 10000 rpm 15 detik
+ 700 µL RW1
Supernatan disentrifus pada 10000 rpm, 15 detik
+ 500 µL buffer RPE
Supernatan disentrifus pada 10000 rpm 15 detik
+500 µL buffer RPE
Supernatan disentrifus pada 10000 rpm, 2 menit
Kolom RNeasy dipindahkan ke tabung 1.5 mL
Lampiran 5 Data hasil spektrofotometri DNA
No.
Sampel
[DNA]
A260
A280
A260/A280
Hasil
ng/µ L
1 NCO 2.1.1-1 88,1 1,762 0,973 1,81 -
2 NCO 2.1.1-2 495,8 9,917 5,202 1,91 +
3 NCO 2.1.1-3 138,1 2,762 1,471 1,88 -
4 NCO 2.1.1-4 241,6 4,833 2,553 1,89 -
5 NCO 2.1.1-5 351,8 7,036 3,703 1,9 -
6 NCO 2.1.1-6 356,7 7,134 3,668 1,95 -
7 NCO 2.1.1-7 81,2 1,623 0,885 1,83 -
8 NCO 2.1.1-8 456 9,121 4,834 1.89 +
9 NCO 2.1.1-9 313,7 6,273 3,225 1,94 +
10 NCO 2.1.1-10 258,1 5,163 2,709 1,91 -
11 NCO 2.1.1-11 1457,1 29,142 14,899 1,96 +
12 NCO 2.1.1-12 324,2 6,483 3,4 1,91 -
13 NCO 2.1.1-13 1596,2 31,924 15,674 2,04 +
14 NCO 2.1.1-14 79,2 1,584 0,859 1,84 -
15 NCO 2.1.4-1 259,8 5,197 2,712 1,92 -
16 NCO 2.1.4-2 198,7 3,973 2,106 1,89 -
17 NCO 2.1.4-3 324 6,481 3,347 1,94 -
18 NCO 2.1.4-4 521,1 10,421 5,781 1,8 -
19 NCO 2.1.4-5 699,6 13,993 7,243 1,93 +
20 NCO 2.1.4-6 401,6 8,033 4,168 1,93 -
21 NCO 2.1.4-7 177,1 3,542 1,905 1,86 -
22 NCO 2.1.4-8 239,1 4,783 2,501 1,91 -
23 NCO 2.1.4-9 1934,8 38,696 19,278 2,01 -
24 NCO 2.1.4-10 594,5 11,889 6,356 1,87 -
25 NCO 2.1.4-11 633,5 12,67 6,694 1,89 -
26 NCO 2.1.5-1 464,8 9,296 4,84 1,92 -
27 NCO 2.1.5-2 267,5 5,35 2,841 1,88 -
28 NCO 2.1.5-3 622,7 12,454 6,448 1,93 +
29 NCO 2.1.5-4 141,4 2,828 1,52 1,86 -
30 NCO 2.1.5-5 465,3 9,306 5,064 1,84 +
31 NCO 2.1.5-6 304,8 6,097 3,193 1,91 -
32 NCO 2.1.5-7 221,4 4,428 2,318 1,91 +
33 NCO 2.1.5-8 198,2 3,964 2,085 1,9 +
34 NCO 2.1.5-9 272 5,44 2,878 1,89 +
35 NCO 2.1.5-10 1612,8 32,256 16,277 1,98 +
36 NCO 2.2.1-1 231,3 4,627 2,412 1,92 -
37 NCO 2.2.1-2 487,8 9,757 5,065 1,93 +
38 NCO 2.2.1-3 235 4,701 2,428 1,94 -
39 NCO 2.2.1-4 470 9,401 4,825 1,95 +
40 NCO 2.2.1-5 256,5 5,129 2,648 1,94 -
41 NCO 2.2.1-6 300,5 6,011 3,147 1,91 -
42 NCO 2.2.1-7 210,7 4,215 2,212 1,91 -
43 NCO 2.2.1-8 483,8 9,677 5,021 1,93 -
44 NCO 2.2.1-9 203,8 4,076 2,147 1,9 -
45 NCO 2.2.1-10 412,8 8,256 4,295 1,92 +
46 NCO 2.2.1-11 310,2 6,203 3,25 1,91 +
47 NCO 2.2.1-12 179,6 3,592 1,899 1,89 -
Ket.
-
= Tanaman padi negatif AtCO
+ = Tanaman padi positif AtCO
49 NCO 2.2.1-14 311,3 6,227 3,224 1,93 +
50 NCO 2.2.2-1 335,4 6,708 3,49 1,92 +
51 NCO 2.2.2-2 122,1 2,441 1,311 1,86 -
52 NCO 2.2.2-3 554,9 11,097 5,772 1,92 -
53 NCO 2.2.2-4 403,8 8,077 4,186 1,93 +
54 NCO 2.2.2-5 383,1 7,663 4,101 1,87 -
55 NCO 2.2.2-6 399,4 7,988 4,299 1,86 +
56 NCO 2.2.2-7 386 7,72 3,979 1,94 +
57 NCO 2.2.2-8 299,3 5,987 3,068 1,95 +
58 NCO 2.2.2-9 164,4 3,288 1,79 1,84 -
59 NCO 2.2.2-10 238,8 4,775 2,489 1,92 +
60 NCO 2.2.2-11 355,2 7,104 3,696 1,92 -
61 NCO 2.3.1-1 441,9 8,837 4,537 1,95 +
62 NCO 2.3.1-2 300,6 6,012 3,296 1,82 +
63 NCO 2.3.3-1 153,5 3,07 1,636 1,88 +
64 NCO 2.3.3-2 195,8 3,917 2,049 1,91 -
65 NCO 2.3.3-3 220,8 4,417 2,359 1,87 -
66 NCO 2.3.3-4 244,3 4,886 2,531 1,93 -
67 NCO 2.3.3-5 381,7 7,634 3,985 1,92 -
68 NCO 2.3.3-6 205,4 4,107 2,22 1,85 -
69 NCO 2.3.3-7 118 2,36 1,301 1,81 -
70 NCO 2.3.3-8 292,1 5,842 3,133 1,86 -
71 NCO 2.3.3-9 99,2 1,985 1,091 1,82 +
72 NCO 2.3.3-10 543,2 10,863 5,699 1,91 -
73 NCO 2.3.3-11 250,3 5,007 2,705 1,85 -
74 NCO 2.3.3-12 468,8 9,376 4,869 1,93 +
75 NCO 2.3.3-13 1881 37,619 19,034 1,98 +
76 NCO 2.3.3-14 508,6 10,172 5,354 1,9 +
77 NCO 2.3.3-15 901,8 18,036 9,53 1,89 +
78 NCO 2.3.3-16 265,1 5,303 2,78 1,91 -
79 NCO 2.3.3-17 456 9,12 4,862 1,88 +
80 NCO 2.3.3-18 31,9 0,639 0,346 1,85 -
Lampiran 6 Evaluasi umur berbunga, umur panen, dan tinggi tanaman
No.
Sampel
Umur
Umur
Tinggi
Jumlah
Hasil
Berbunga
(Hari)
Panen
(Hari)
Tanaman
(CM)
Anakan
(Buah)
1 NCO 2.1.1-1 69 112 79 12 -
2 NCO 2.1.1-2 64 112 69 13 +
3 NCO 2.1.1-3 63 112 74 11 -
4 NCO 2.1.1-4 63 112 71 11 -
5 NCO 2.1.1-5 64 112 81 14 -
6 NCO 2.1.1-6 69 112 72.5 15 -
7 NCO 2.1.1-7 64 116 69.2 10 -
8 NCO 2.1.1-8 65 109 77 12 +
9 NCO 2.1.1-9 65 116 69 19 +
10 NCO 2.1.1-10 65 116 74 15 -
11 NCO 2.1.1-11 67 119 73.5 13 +
12 NCO 2.1.1-12 64 119 76.5 16 -
13 NCO 2.1.1-13 64 116 67 16 +
14 NCO 2.1.1-14 65 112 66.5 9 -
15 NCO 2.1.4-1 68 116 44 -
16 NCO 2.1.4-2 69 116 46 -
17 NCO 2.1.4-3 66 116 81.5 18 -
18 NCO 2.1.4-4 64 116 74 18 -
19 NCO 2.1.4-5 64 112 71.5 14 +
20 NCO 2.1.4-6 63 116 82 15 -
21 NCO 2.1.4-7 64 116 73.5 12 -
22 NCO 2.1.4-8 63 112 73 14 -
23 NCO 2.1.4-9 63 112 72.8 14 -
24 NCO 2.1.4-10 64 119 61.5 12 -
25 NCO 2.1.4-11 64 116 72.5 15 -
26 NCO 2.1.5-1 71 120 74 26 -
27 NCO 2.1.5-2 67 116 71 13 -
28 NCO 2.1.5-3 65 119 70 14 +
29 NCO 2.1.5-4 67 119 74.5 17 -
30 NCO 2.1.5-5 64 116 65 15 +
31 NCO 2.1.5-6 63 112 62.5 13 -
32 NCO 2.1.5-7 63 119 63.5 10 +
33 NCO 2.1.5-8 65 119 70 10 +
34 NCO 2.1.5-9 63 116 66 12 +
35 NCO 2.1.5-10 66 119 72 17 +
36 NCO 2.2.1-1 63 116 72 15 -
37 NCO 2.2.1-2 64 120 69 13 +
38 NCO 2.2.1-3 67 116 66.5 15 -
39 NCO 2.2.1-4 63 67 15 +
40 NCO 2.2.1-5 63 64 19 -
41 NCO 2.2.1-6 64 116 66.5 13 -
42 NCO 2.2.1-7 67 119 67.8 11 -
43 NCO 2.2.1-8 64 116 67.6 17 -
44 NCO 2.2.1-9 65 119 64 15 -
45 NCO 2.2.1-10 64 116 73.5 17 +
46 NCO 2.2.1-11 66 116 74.5 14 +
48 NCO 2.2.1-13 64 112 67.5 20 +
49 NCO 2.2.1-14 66 116 69.5 14 +
50 NCO 2.2.2-1 66 116 69 15 +
51 NCO 2.2.2-2 63 120 69 13 -
52 NCO 2.2.2-3 64 119 67 10 -
53 NCO 2.2.2-4 63 119 68 13 +
54 NCO 2.2.2-5 63 112 63 11 -
55 NCO 2.2.2-6 63 119 65 10 +
56 NCO 2.2.2-7 64 71 13 +
57 NCO 2.2.2-8 64 62 13 +
58 NCO 2.2.2-9 67 119 71 12 -
59 NCO 2.2.2-10 67 119 70 13 +
60 NCO 2.2.2-11 66 119 71.5 12 -
61 NCO 2.3.1-1 69 116 74 15 +
62 NCO 2.3.1-2 68 116 68 17 +
63 NCO 2.3.3-1 63 112 68.5 12 +
64 NCO 2.3.3-2 66 116 75 16 -
65 NCO 2.3.3-3 64 116 64 11 -
66 NCO 2.3.3-4 64 116 65 13 -
67 NCO 2.3.3-5 64 119 69 12 -
68 NCO 2.3.3-6 64 119 67 11 -
69 NCO 2.3.3-7 64 119 63 16 -
70 NCO 2.3.3-8 63 116 66 17 -
71 NCO 2.3.3-9 66 119 72 17 +
72 NCO 2.3.3-10 64 119 71 14 -
73 NCO 2.3.3-11 66 116 75 11 -
74 NCO 2.3.3-12 64 119 66.5 14 +
75 NCO 2.3.3-13 67 68 15 +
76 NCO 2.3.3-14 65 119 71.5 14 +
77 NCO 2.3.3-15 66 119 66 14 +
78 NCO 2.3.3-16 66 112 73 21 -
79 NCO 2.3.3-17 63 119 75 19 +
80 NCO 2.3.3-18 64 119 77 13 -
81 NB WT 68 119 69.5 14 -
Ket.