CUCUMBER MOSAIC VIRUS
DAN
CHILLI VEINAL MOTTLE
VIRUS:
KARAKTERISASI ISOLAT CABAl DAN STRATEGI
PENGENDALIANNYA
MUHAMMAD TAUFIK
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURATPERNYATAAN
Dengan ini saya menyatakan bahwa disertasi
cucumber mosaic virus
danchilli veinal mottle virus:
Karakterisasi Isolat Cabai dan Strategi Pengeodaliannya adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telab disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.Bogor, Agustus 2005
ABSTRAK
Muhammad Taufik,
Cucumber mosaic virus
danchiUi veinal mottle
virus: Karakterisasi Isolat Cabai dan Strategi PengendalianDya. Dibimbing
oleh SRI HENDRASTUTI HIDA Y AT, GEDE SUASTIKA, SIENTIE MANDANG SUMARA W, dan SRlANI SUJIPRlliATI
Tanaman cabai merupakan komoditi penting hortikultura karena diperlukan oleh semua lapisan masyarakan sepanjang tahun. Masalah dalam budidaya cabai diantaranya gangguan biotik yang disebabkan oleh infeksi CMV danChiVMV.
Tujuan penelitian adalah 1) Mengetahui tingkat serangan CMV dan ChiVMV di daerah pertanaman cabai, 2) Mengumpulkan dan melakukan isolasi beberapa isolat lapang CMV dan ChiVMV, 3) Mempelajari karakter isolat CMV dan ChiVMV berdasarkan inang diferensial dan melalui karakterisasi dengan
reverse transcriptase-poiymerase chain reaction CRT -peR) dan double-strand
RNA (dsRNA), dan purifIkasi, 4) Mempelajari respon berbagai kultivar cabai terhadap infeksi CMV dan ChiVMV, 5) Mempelajari respon aplikasi PGPR pada benih kultivar Tit Segitiga yang diinokulasi CMV dan ChiVMV, 6). Mengamati respon kuItivar cabai toleran terhadap infeksi CMV
dan
ChiVMV di lapang.Survei Japang yang dilakukan memperkuat bukti penyebaran CMV dan ChiVMV yang sangat luas. Kedua virus tersebut ditemukan pada setiap pertanaman cabai yang diamati dengan proporsi kejadian penyakit berbeda-beda untuk setiap tempat. Di daerah Jawa Barat infeksi oleh CMV lebih dominan daripada infeksi oleh ChiVMV, tetapi di daerah Sulawesi Selatan keadaannya berbeda. Empat isolat CMV dan enam isolat ChiVMV dengan keragaman gejala berhasil diperoleh. Isolat-isolat ChiVMV dan CMV diperbanyak pada Paprika
(Capsicum annuum var. Grosum) dan Nicotiana tabacum secara berturut-turut. Isolat CMV asal Cimangkok, kabupaten Cianjur dan ChiVMV asal Cikabayan, kabupaten Bogor lebih virulen dibandingkan dengan isolat-isolat lainnya. Kedua isolat tersebut diketahui memberikan respons yang berbeda pada inang diferensial. Metode RT-PCR berhasil mengamplifikasi genom CMV yang berukuran 940 bp. Dengan menggunakan metode ekstraksi dsRNA berhasil dibuktikan bahwa CMV mempunyai genom yang multipartit, sedangkan ChiVMV bergenom monopartit. Berdasarkan analisis elektroforesis secara SDS-PAGE diketahui bahwa ukuran protein selubung CMV sekitar 26 kDa dan ChiVMV 36 kDA.
IV
toleran terhadap inokulasi CMV. Kultivar Cilibangi 4 toleran terhadap ChiVMV, sedangkan
Tit
Super toleran terhadap inokulasi campuran CMV dan ChiVMV.Aplikasi PGPR secara oyata dapat meningkatkan perkecambahan benih cabai. Enam hari setelah semai jwnlah benih yang diberi perlakuan PGPR telah berkecambah sebanyak 50-84%, sedangkan perkecambahan benih yang
tidak
diberi PGPR ham mencapai 18%. Seeara umum, hasil pengujian membuktikan
bahwa perlakuan PGPR dapa! menghamba! kejadian penyaki! dan mereduksi pengaruh infeksi virus terhadap pertumbuhan tanaman. Aplikasi PGPR isolat BTP2H (Bacillus substilis) dan BTP3G (Bacillus stearothermopillus) pada benih cabai tidak menyebabkan berkurangnya hobot buah yang nyata ketika tanamandiinokulasi dengan CMV dan Chi VMV walaupun konsentrasi virus cukup tinggi.
Oleh karena itu, perlakuan PGPR sangat menjanjikan sebagai altematif pengendalian terhadap penyakit virus pada tanaman cabai.v
ABSTRACT
Muhammad Taufik.
Cucumber mosaic virus
andchilli veinal mottle virus:
Characterization of Virus Isolates from Chillipepper and Its Control Strategies. SupelVised by SRI HENDRASTUTI HIDAYAT, GEDE SUASTIKA, SIENTJE MANDANG SUMARA W, and SRIANI SUJIPRlliAn.
Chilli peppers (Capsicum spp.) is an important vegetable crops in Indonesia, providing income especially to smallholders farmers. Infection of the disease seriously affect crop productivity and reduces supply reliability.
Cucumber mosaic virus (CMV) and chilli veinal mottle virus (ChiVMV) are the two most serious viral problems in most chilli growing areas in Indonesia.
The aims of this research are: 1) To confirm the disease incidence caused by CMV and ChiVMV in chilli pepper growing areas; 2) To collect and characterize some field isolates of CMV dan ChiVMV based on differential host and moleculer characters; 3) To study the effect of plant growth promoting rhizobacteria (PGPR) on infection of CMV and ChiVMV; 4) To evaluate chilli pepper cultivars for CMV and ChiVMV resistance.
It was evidenced from the survey that CMV and ChiVMV were widely distributed in chilli pepper growing area. Both viruses was always found in chillipepper growing area although the proportion of each disease incidence was different from one place to another. Infection of CMV was more prominent in West Java, whereas in South Sulawesi ChiVMV was more dominant. Different responses among nine chillipepper cultivars to CMV and ChiVMV were showed by differences incubation period of virus, symptoms, and percentage of disease incidences. Four isolates of CMV and six isolates of ChiVMV showing different symptoms was collected. Maintenance of CMV and ChiVMV isolates was done using Nicotiana tabacum and Capsicum annum var Groshum, respectively.
CMV isolate from Cimangkok and ChiVMV isolate from Cikabayan was considered the most virulent isolates among the virus isolates tested based on the reaction of differential hosts. Using specific primers for CMV a 940 bp DNA product was successfully amplified using RT-PCR technique. Using the same technique alSO bp DNA product was amplified from ChiVMV infected plant. Multipartite genome of CMV, having RNA 1, 2 dan 3, and monopartite genome of ChiVMV was confirmed by extraction of dsRNA from infected leaf tissues. Purification of the virus facilitated analysis of virus coat protein and observation of virus particles using transmission electron microscopy (TEM). Moleculer weight of virus coat protein was 26 kDa and 36 kDa for CMV and ChiVMV, respectively. Unique character of cucumovirus and potyvirus particles was observed using 1EM from CMV and ChiVMV preparation respectively.
VI
response to all virus inoculation treatment was observed on CiIibangi 5. Cultivars latilaba, Tit Super and Tampar were toleran to CMV, Cilibangi 4
was
toleran to ChiVMV, whereas Tit Super was toleran to mix inoculation of CMV and ChiVMV.Seed germination was significantly improved by PGPR. Eight days after sowing the percentage of seed germination of PGPR - treated seed reached 50-84%; whereas those of untreated seed only reached 18%. In general, PGPR treatment was significantly reduced the effect of virus infection on plant growth. In term of maintaining fruit weight, two isolates of PGPR performed well, i.e isolate BPT2H and BPT3G. The isolates can maintain fruit weight although virus is in high concentration. Based on ELISA it was also evidenced that PGPR was able to inhibit the disease incidence. Therefore, PGPR treatment is very promising to be applied as alternative strategies to control viral diseases on chillipepper.
VII
CUCUMBER MOSAIC VIRUS
DAN
CHILLI VEINAL MOTTLE
VIRUS:
KARAKTERISASI ISOLAT CABAl DAN STRATEGI
PENGENDALIANNYA
MUHAMMAD TAUFIK
Disertasi
Sebagai salah satu syarat uDtuk memperoleh gelar
Doktorpada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Vlll
Judu] Penelitian : Cucumber mosaic ... irus dan chilli veinal motile virus: Karakterisasi Isolat Cabai dan Strategi Pengendaliannya
Nama : Muhammad Taufik
NomorPokok
: A426010081
f'rogram Studi : Entomoiogi dan Fitopatologi, Pascasarjana IPB
Menyetujui: Komisi Pembimbing
Dr. Jr. Sri Hendrastuti Hidayat. M.Sc. Ketua
Prof. Dr. Sientje Mandang Sumaraw Anggota
Ketua Program Studi
Entomologi dan Fitopatologi
Tanggal Ujian: 13 Juli 2005
Dr.
Ir. Gede Suastika. M.Sc.
Anggota
セ@
Dr. Ir. Sriani Sujiprihati. MS.
Anggota
セ[・ォHIャ。ィ@
Pascasarjana
セセセ。ヲイゥGャ。@
Manuwoto, M.Sc.
PRAKATA
Puji ,yukur ke hadapan Allah SWT alas rakhmat dan karunia-Nya ,ebinga penelitian yang berjudul: "Cucumber mosaic virus dan chilli veinal mol/Ie virus:
Karakterisasi isolat virus dan strategi pengendaliannya" dapat diselesaikan. Penulis menyampaikan rasa terimakasih yang talc terhingga kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc., Dr. Ir. Gede Suastika, M.Sc., Prof Dr. Ir. Sientje Mandang Sumaraw, dan Dr.
Jr.
8riani Sujiprihati, MS, atas segala kesabaran, bimbingan, pengkayaan wawasan, kritik, saran, serta dukungan moril yang sangat besar peranannya dalam terselesaikannya penulisan disertasi ini.Terimakasih pula saya sampaikan pada Dr. Ir. Widodo, M.Sc yang telah memherikan masukan mulai pada ujian Prelim dan Tertutup. Dr. Surnamo, M.Sc. (mantan Direktur lenderal Bina Produksi Hortikultura, Departemen Pertanian, Jakarta) dan Dr. Ir. Suryo Wiyono, M.Sc. yang telah memberikan koreksi dan saran sehingga melengkapi penulisan disertasi ini.
Ueapan terimakasih juga disampaikan kepada Rektor dan Direktur Program Paseasarjana IPB atas kesempatan yang diberikan kepada penulis untuk mengikuti program doktor di IPB; Rektor Universitas Haluoleo dan dセォ。ョ@
Fakultas Pertanian Universitas Haluoleo yang telah memberi ijin untuk mengikuti program doktor di IPB. Ucapan terimakasih juga penulis sampaikan kepada Departemen Pendidikan Nasional melalui BPPS Dikti yang telah memberikan dukungan dana untuk mengikuti program doktor.
Kepada teman-teman Laboratorium Virologi mbak Eliza, Ida, Tuti, mas Supri, pak Irwan dan pak Edi yang telah banyak memberi bantuan ,elama penelitian dan penulisan disertasi ini, begitupula kepada sahabat-sahabat saya Andi Khaeruni, Lisnawita dan Hiasinta J Matulo atas kerjasama selama ini penulis ueapkan banyak terimakasih.
x
semua itu penulis ucapkan banyak terimakasih. Semoga Allah SWT selalu
memberi ampunan dan maghfirah-NY A, Amieo.
Kepada yang tercinta ayah dan ibu mertua, Hj. Andi Asiah dan H. Andi Altin penulis ucapkan terimakasih atas doa dan kasih sayangnya. Kepada kakanda Sukmawaty SE, serta adik-adik Rahmat SH dan keluarga, Ir. Syamsurijal dan keluarga, Nurwanita ST dan keiuarga, Muammar ST dan keluarga, Muslihul SE yang telah banyak membantu doa dan materi selama menempuh pendidikan di Bogor. Ucapan terimaksih pula kepada kakak ipar Drs. Andi Awaluddin dan adik ipar Andi Asrial Allin dan Andi Aswin Allin yang telah banyak membantu memperhatikan anak-anak saya selama ini.
Yang tersayang kedua putriku, Tasyah Karnilah Taufik dan Aulika Nabilah Taufik atas kesabaran, pengertian dan segenap pengorbanan yang telah diberikan selama ini. Suara tawa, cerita dan komentar-komentar ananda di telepon memicu semangat ayah untuk bertahan menyelesaikan studi yang berat ini. Kepada yang tersayang istriku Andi Astuty. SP, saya ucapkan terimakasih yang tak terhingga atas dca, kasih sayang, ォ・ウ・エゥセ@ dan dorongan semangat selama ini. Selama ini adinda dengan seorang diri mengurus, mendidik dan mengantar anak-anak ke sekolah sementara adinda juga barns bekerja sebagai staf Bappeda Maros, Sulawesi Selatan.
T erakhir ucapan terimakasih kepada keluarga di Jakarta khususnya Drs. H. Dahlan Husain yang telah memberikan dorongan mori! dan bantuan selama ananda di Bogor. Begitu pula kepada H. Nur Mahmud (ahnarhum) yang telah mendidik ananda selama di Enrekang.
Semoga hasil penelitian ini bennanfaat untuk kepentingan umat manusia dan ilmu pengetahuan.
Bogor, Agustus 2005
Xl
RIWAYAT HIDUP
Penulis dilahirkan di Pangkajene, Pangkep, Sulawesi Selatan pada tanggal
24 Juli 1968
darilbu Hj. Suhaenah
danBapak Drs. H. Muhay_ Nurdin, dan
merupakan anak kedua daritujuh
bersaudara. Penulis menikah denganAndi Astuly, SP
dandikaruniai dua orang putri yaitu Tasyah Karnilah Taufik
(5th)
danAulika Nabilah Taufik (4th).
Pendidikan dasar sampai menengah diselesaikan di Enrekang, Sulawesi
Selatan dan pada tahun 1987 diterima sebagai mahasiswa di Fakultas Pertanian
Universitas Hasanuddin, Makassar. Tabun 1991 penulis memperoleh geiar
Srujana Pertanian (Ir.), sedangkan gelar Magister Sains (M.Si.) diperoleh pada
tabun 2000 di Program Studi Entomologi
danFitopatologi, pada program
pascasarjana Institut Pertanian Bogor. Mulai tahun 2001 penulis mengikutiProgram Doktor (S3) di Program Studi Entomologi dan Fitopatologi, Sekolah
Pascasarjana IPB.Pada tahun 1992 sampai 1995 bekerja sebagai staf teknis (PT Supin Raya,
Makassar) pada Proyek Pengembangan Wilayah Khusus (P2WK), Dinas
Perkebunan Provinsi Sulawesi Se1atan. Sejak tahun 1996 sampai saatini
penulisbekerja sebagai staf pengajar pada Program Studi limn Hama
dan
PenyakitXIl
DAFTARISI
Halaman DAFTAR TABEL ... Xlii
DAFTARGAMBAR... XV
I. PENDAHULUAN
Latar Belakang ... . Tujuan Penelitian ... .
Hipotesis Penelitian ... .
n.
TINJAUAN PUSTAKAI 5 5
Pentingnya Tanaman Cabai ... 7
Hama dan Penyakit Tanarnan Cabai... 9
Biologi, Ekologi dan Gejala CMV ... 10
Biologi, Ekologi dan Gejala ChiVMV ... II Deteksi
dan
Karakterisasi Virus ... ... 12Ketahanan Tanaman ... 13
!1l SURVEI LAPANG DAN KOLEKSI ISOLAT CMV DAN ChiVMV Abstrak Abstract Pendahuluan... ... ... ... ... ... ... ... ... ... ... 17
Tujuan Penelitian... 18
Baban dan Metode ... ... 19
Hasil... 22
Pembabasan ... 28
Xlll
IV DETEKSI DAN KARAKTERISASI ISOLAT CMV DAN ChiVMV
BERDASARKAN !NANG DIFERENSIAL, RT-PCR, UNTAI GANDA RNA DAN PURIFIKASI
Abstrak
Abstract
Pendahuluan." .... " ... """." .... " " .. " ... """"""."" ... ".... 31
Tujuan Penelitian ...
33
Bahan dan Metode ... "... 34
Hasil... 41
Pembahasan ... 48
Simpulan dan Saran ... 53
V KAJIAN KET AHANAN BEBERAPA KUL TIV AR CABAl TERHADAP CMV DAN ChiVMV Abstrak Abstract Pendahuluan ... "... 54
Tujuan Penelitian ...
55
Bahan dan Metode ... ... ... ... ... ... 56
Hasil... . 59
Pembabasan ... 70
Simpulan dan Saran ... 74
VI UJI BEBERAPA ISOLAT PGPR (PLANT GROWTH PROMOTING
RHIZOBACTERIA) UNTUK PROTEKSI TANAMAN CABAl
TERHADAP INFEKSI CMV DAN ChiVMV Abstrak
Abstract
PendabuJuan ... .
Tujuan Penelitian ... .
Bahan dan Metode ... . Hasil... ... . Pembahasan ... .
Simpulan dan Saran ... .
VII EVALUASI KETAHANAN BEBERAPA KULTIV AR CABAl TERHADAP CMV DAN ChiVMV Dl LAPANG
Abstrak
Abstract
XIV
Pendahuluan...
94
Tujuan Penelitian... 95
Bahan dan
Metode ... ....
96
Hasil...
98
Pembahasan ...
102SimpulandanSaran ...
106
Vlll PEMBAHASAN UMUM ... 107
IX SIMPULAN UMUM ... 113
DAFTARPUSTAKA ... 114
xv
DAFTAR TABEL
Halaman
2.1. Produksi cabai nasional pada setiap provinsi... 8 3.1. Kejadian penyakit CMV dan ChiVMV dengan uji ELISAdi beberapa lokasi pertanaman cabai... ... ... ... ... 23 3.2. Sampel tanaman yang terinfeksi oleh CMV,
ChiVMV dan virus lain ... 24 3.3. Koleksi isolat CMV dan ChiVMV yang akan
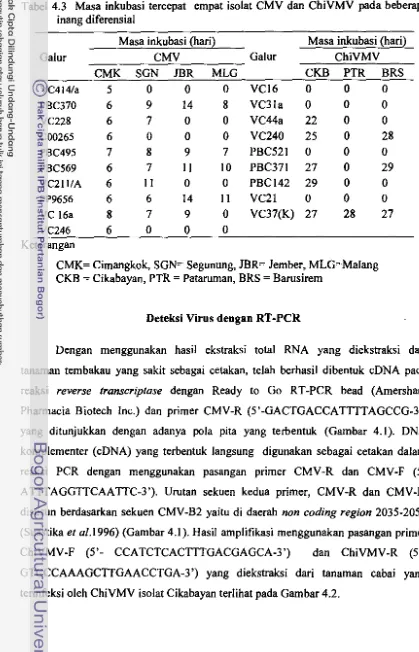
digunakan dalaIn penelitian... ... ... ... ... ... ... 25 4.1. Respon beberapa inang diferensial terhadap empat isolat CMV ... 41 4.2. Respon beberapa inang diferensial terhadap tiga isolat ChiVMV... 42 4.3. Masa inkubasi tercepat isolat CMV dan ChiVMV pada beberapa
inang
diferensial...
43
5.1. Pengelompokkan tipe ketahanan tanaman berdasarkan reaksi
terhadap infeksi CMV dan ChiVMV ... 58 5.2. Kejadian penyakitdan macam gejala akibat inokulasi CMV
pada sembilan kultivar cabai yang diuji ... 59 5.3. Kejadian penyakit dan macam gejala akibat inokulasi ChiVMV
pada sembilan kultivar cabai yang diuji ... 60 5.4. Kejadian penyakit dan macam gejala akibat inokulasi CMV dan
ChiVMV pada sembilan kultivar cabai yang diuji... 61 5.5. Pengarub inokulasi CMV dan ChiVMV terhadap
persen penghambatan tinggi tanaman ... 64 5.6. Persentase penghambatanjumlah cabang pada sembilan
kultivar cabai yang diinokulasi dengan
CMV dan ChiVMV ... 66
5.7.
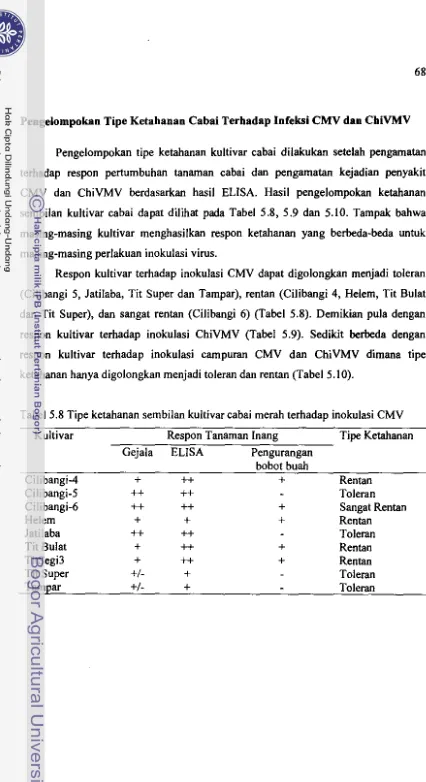
Persen penguranganbasil
inokulasi CMV dan ChiVMV terhadap totalbobot buah/tanaman ... 67 5.8. Tipe ketahanan sembilan kultivar cabai merah terhadap
inokulasi CMV ... ' 68 5.9. Tipe ketahenan sembilan kultivar cabai merah terhadap
XVI
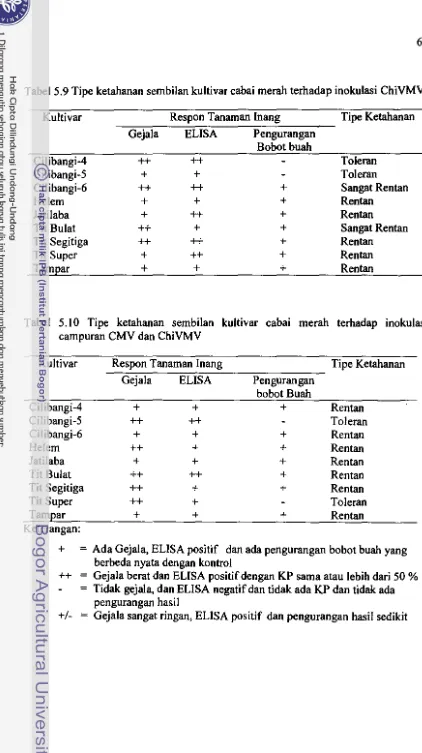
5.10. Tipe ketahanan sembilan kultivar cabai merah terhadap
inokulasi campuran CMV dan ChiVMV ... 69 6.1. Koleksi isolat PGPR yang digunakan untuk menginduksi ketahanan
tanaman cabai kultivar Tit Segitiga... ... 77 6.2. Persentase perkecambahan benih cabai kultivar Tit Segitiga
setelab perlakuan PGPR... 81 6.3. Rata-rata nilai absorban dan kejadian penyakit tanaman cabai
Tit Segitiga ... 87 6.4. Konsentrasi asam salisilat dengan analisis HPLC
dan
aktivitas enzimperoksidase. ... ... ... ... ... 88 7.1. Keragaan kuItivar Tampar, Cilibangi 5, Keriting Taro,
Tit Super dan Pelita di lapang yang terinfeksi
XVll
DAFfAR GAMBAR
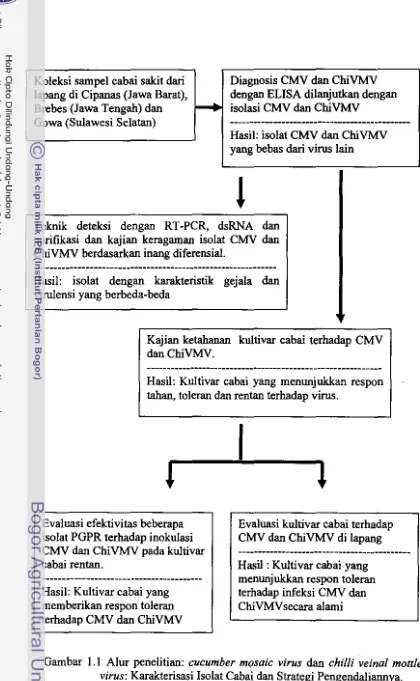
Halaman 1.1. Alur penelitian: cucumber mosaic virus
dan
chilli veinal mottle virus: Karakterisasi Isolat Cabai dan
Strategi Pengendaliannya ... 6
3.1. Lokasi pengambilan beberapa sampel tanaman cabai sakit. Pertanaman cabai di Brebes, Jawa Tengab (A dan B).
Cikabayan, Jawa Barat (C), dan Cipanas, Jawa Barat (D)... 26 3.2. Gejala CMV dan ChiVMV pada tanaman perbanyakan virus. Isolat
CMV asal Cimangkok (A), isolat CMV asal Segunung (B), isolat CMV asal Jember (C), isolat CMV asal Malang (D), isolat ChiVMV
asal Sumatera Barat (E), isolat ChiVMV asal Cikabayan (F)... 27 4.1. Hasil amplifikasi RT-PCR isolat CMV asal Cimangkok
menggunakan primer CMV-F dan CMV-R (I dan 2)
dan
Marker (M)... 44 4.2 Hasil amplifikasi RT-PCR isolat ChiVMV asal Cikabayan
menggunakan primer CMV-F dan CMV-R ( 1 dan 4), tanaman
sehat (2), bufer (3) dan marker IOObp (M) ... 44 4.3. Hasil visualisasi elektroforesis ekstraksi dsRNa dari daun
tembakau terinfeksi CMV asal Cimangkok (1), CMV asal
Segunung (2), ekstraksi dari daun cabai terinfeksi ChiVMV (3) ...45 4.4. Zona virus murni CMV (kiri) dan ChiVMV (kanan) setelab
ultrasentrifugasi dengan sesium sulfat ... 45
4.5. HasH analisis protein selubung isolat CMV asal Cimangkok secara SDS-PAGE. Marker (M), tanaman sebat (1), tanarnan terinfeksi CMV asal Cimangkok (2), basil purifikasi CMV
asal Cimangkok (3 dan 4) ... 46 4.6. Hasil analisis protein selubung isolat ChiVMV asal Cikabayan
secara SDS-PAGE. Marker (M), tanaman sebat (I), tanaman terinfeksi ChiVMV asal Cikabayan (2), basil purifikasi ChiVMV
asalCikabayan(3 dan4) ... 47 4.7. Hasil.pengamatan dengan mikroskop elektron terhadap siapan virus
munn... 47
5.1. Respon gejala akibat inokulasi CMV (A dan B), inokulasi ChiVMV (C dan D) dan inokulasi campuran CMV dan
6.1. Respon pertumbuhan tanaman cabai yang diberi PGPR dan tanpa PGPR. I). Tanpa PGPR dan inokulasi ChiVMV; 2). Tanpa PGPR dan inokulasi CMV; 3). PGPR dan tanpa inokulasi virus;
4). PGPR dan inokulasi CMV; 5). PGPR dan inokulasi ChiVMV;
XVlll
6) tanpa PGPR dan inokulasi virus ... ... ... ... .... .... 82
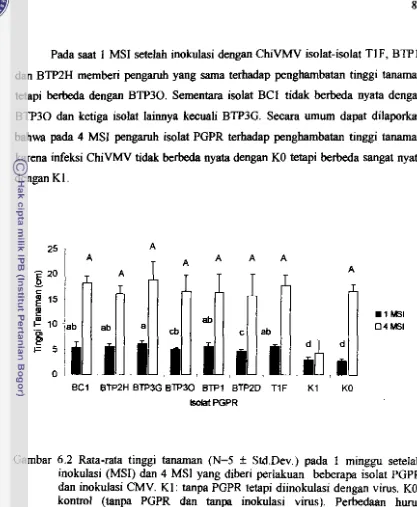
6.2. Rata-rata tinggi tanaman HnセUᄆ@ Std.Dev.) pada I minggu setelab inokulasi (MSI) dan 4 MSJ yang diberi perlakuan beberapa isolat PGPR dan inokulasi CMV. KI: tanpa PGPR tetapi diinokulasi dengan virus. KO: kontrol
(tanpa PGPR dan tanpa inokulasi virus). Perbedaan huruf menunjukkan beda nyata berdasarkan
DMR T pada taraf nyata 5 %. ... ... 83 6.3. Rata-rata tinggi tanaman HnセUᄆ@ Std.Dev.) pada I minggu
setelab inokulasi (MSJ) dan 4 MSI yang diberi perlakuan
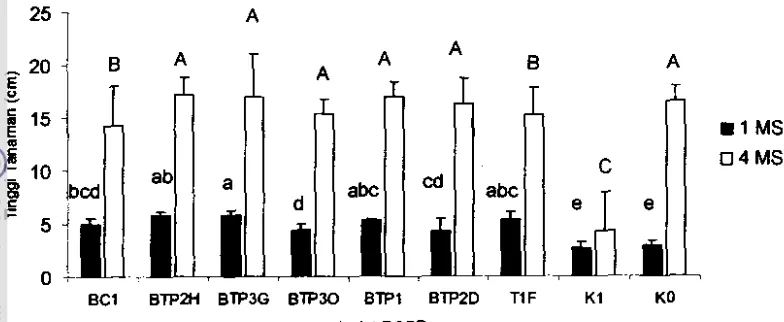
beberapa isolat PGPR dan inokulasi ChiVMV. KI: tanpa PGPR tetapi diinokulasi dengan virus. KO: kontrol
(tanpa PGPR dan tanpa inokulasi virus). Perbedaan huruf menunjukkan beda nyata berdasarkan
DMRT pada taraf nyata 5 %. ... 84 6.4. Pengaruh infeksi CMV dan ChiVMV terhadap jumlab
cabang tanaman cabai HnセUᄆ@ Std.Dev.) yang telab diberi perlakuan beberapa isolat PGPR. K I: tanpa PGPR tetapi diinokulasi dengan virus. KO: kontrol
(tanpa PGPR dan tanpa inokulasi virus). Perbedaan huruf
menunjukkan heda nyata berdasarkan DMRT pada tarafnyata 5 %.
Data ditransformasi dengan
vx. ...
856.5. Pengarub infeksi CMV dan ChiVMV terhadap hobot buab cabai HnセUᄆ@ Std.Dev.) yang telab diberi perlakuan PGPR. K 1: tanpa PGPR tetapi diinokulasi dengan virus. KO: kontrol (tanpa PGPR dan tanpa inokulasi virus). Perbedaan huruf
menunjukkan beda nyata berdasarkan DMRT pada tarafnyata 5 %.
Data ditransformasi dengan Vx+O.5. ... 86
7.1. Gejala infeksi ChiVMV pada tanaman cabai kultivar Tit Super (A) dan kultivar Cilibangi 5 (B), gejala infeksi CMV pada tanaman cabai kultivar Cilibangi 5 (C) dan kultivar Tit Super (D). Tanaman cabai kultivar Tampar (E) dan Pelita (F) yang hebas
dari infeksi CMV dan ChiVMV... 99 7.2. Rata-rata kejadian penyakit berdasarkan uji DAS-ELISA pada
lima kultivar cabai umur dua bulan di kebun percobaan Cikabayan ... 100 7.3. Rata-rata kejadian penyakit berdasarkan uji DAS-ELISA pada lima
kultivar cabai umur tiga bulan setelah tanam di kebun
I.
PENDAHULUAN
Latar Belakang
Tanaman cabai merab (Capsicum spp.) merupakan salah satu komoditas
penting hortikultura di Indonesia. Menurut data Direktorat lenderal Bina Produksi
Hortikultura luas panen cabai merupakan luas panen terbesar diantara tanaman
sayuran lainnya yaitu berturut-turut 150.598 ribu ha untuk tabun 2002 dan 176.264 ribu ha untuk tahun 2003. Tanaman tersebut ditanam di seluruh provinsi
di Indonesia dan memiliki nilai ekonomis yang cukup baik sehingga mendapat
prioritas untuk dikembangkan (Biro Pusat Statistik 1996; DBPH 2004).
Cabai merupakan komponen penting dalam resep masakan Indonesia
karena membentuk rasa dan aroma masakan
dan mengandung sejumlah kalori,
protein,
dan
vitamin, selain mempunyai rasa pedas yang dapat menambah seleramakan. Rasa dan komposisi kimiawi buah cabai baik yang berwama merah
maupun warna lainnya, beragam menurut varietas tanaman, kondisi pertumbuhan
tanaman, derajat kematangan buah dan cara pengelolaarulY8. Rata-rata setiap
1,80 g buah cabai merah mengandung 23,958 kJ energi, 0,145 g air, 0,216 g protein, 0,059 g asam lemak dan 1,019 g karbohidrat. Selain itu terkandung pula sejumlah kaisium (2,664 mg), fosfor (5,274 mg), besi (0,140 mg), serta vitamin-vitamin seperri vitamin-vitamin A (748,980 JU), B6 (0,037 mg) dan C (1,375 mg) (Indian Institute of Spices Research 2004).
Mengingat kegunaannya dalam menu makanan, stimulan, antiseptik dan
bahan obat-obatan menjadikan cabai sebagai salah satu komoditas perdagangan,
sehingga produktivitasnya harus tetap tetjaga. Produksi cabai di Indonesia masih
sangat rendah apahila dibandingkan dengan potensi produksi yang dapat mencapai
10 tonlha atau sekitar 0,5 - I kg/tanaman (Suwandi et of. 1989). Secara umum produksi nasional cabai dari tabun 1999 sampai tabun 2002 mengalami penurunan yaitu 1.007.726 ton (1999), 727.747 ton (2000), 580.464 ton (2001), dan 635.089 ton (2002). Faktor penyebab turunnya produksi cabai secara nasional diantaranya disebabkan berl<urangnya luas panen. Selain itu rendahnya produksi cabai nasional juga diakibatkan oleh adanya ganggnan hama dan penyakit (Duriat
2
parvis pinus
Kamy), tungau (Polyphagotarsonemus latus Banks), kutudaun(Myzus persicae Sulz. dan Aphis gossypii)(Rubatzky dan Yamaguchi 1997).
Berdasarkan data kumulalif luas serangan OPT pada tanaman cabai (Ditlinhorti 2004) patogen yang banyak menyerang pertanaman cabai adalab C.
gloeosporioides Penz atau Co//elolrichum capsici Sydow, atau lebih dikenal
sebagai penyebab penyakit antraknosa, patogen virus (virus keriting
dan kwring),
Pseudomonas solanacearum E.F. Smith sebagai penyebab layu bakteri yang
sekarang dikenal dengan nama
Ralstonia soianacearum(E.F. Smith) (Yabuuchi
et af.
1995),
Fusarium oxysporumSnyder
&Hausen atau dikenal dengan penyakit
layu fusarium,
dan
Phytophthora capsid
Leoman atau penyakit busukphytophthora. Hasil beberapa laporan penelitian menunjukkan bahwa virus utama
yang menyerang tanaman cabai adalah cucumber mosaic virus (CMV) dan chilli
veinal mottle virus (ChiVMV) (Dolores 1996; Sulyo et al. 1995; Duriat et al.
1996; Chiemsombat dan Kittipakom 1996).
Dolores (1996) melaporkan bahwa CMV, ChiVMV,
tobacco etch virus(TEV), pepper mottle virus (PeMV) dan lomato spotted wilt virus (TSWV) adalab
virus-virus yang menginfeksi pertanaman cabai di Philipina. Yoon (1987)
melaporkan babwa CMV dan ChiVMV adalab dua virus utama dari lima virus
yang umum menginfeksi pertanaman cabai di Asia. Berdasarkan uji ELISA,
beberapa virus dilaporkan telah menginfeksi cabai di Indonesia diantaranya CMV,
ChiVMV, pOlalo virus Y (pVY), TEV, alfalfa mosaic virus (AMV) dan lomato
mosaic virus (ToMV) (Sulyo el al. 1995). Lebih lanjut dijelaskan babwa
ChiVMV, CMV dan PVY sebagai virus utama yang menyerang pertanaman
cabai di Asia Tenggara (Duriat
et al. 1995).Infeksi CMV dan ChiVMV menjadi penling karena kerugian yang ditimbulkarmya cukup besar. Ong dan Ting (1977 dalam Ong 1995) melaporkan
bahwa kerugian karena infeksi CMV dapat mencapai 75%. Di Malaysia, ChiVMV
dapat mereduksi hasil sarnpai 60% dan menurunkan kualitas buah (Ong 1995). Di
Indonesia, infeksi CMV dapat menyebabkan kerugian hasil panen pada tujuh
Petani di Indonesia melakukan pengendalian penyakit tumbuhan melalui
penggunaan pestisida termasuk pengendalian penyakit yang disebabkan oleh
CMV dan ChiVMV. Mereka masib sangat bergantung pada penggunaan insektisida untuk menekan populasi serangga vektomya bahkan dengan frekuensi
dan
dosis penyemprotan yang melebihi anjuran. Pemakaian pestisida secaraliberal dapat mengurangi populasi serangga yang berguna
dan
dapat memberikandampak negatif terhadap lingkungan. Hal tersebut disebabkan serangga vektor
mempunyai mobilitas yang sangat tinggi, perkembangan populasi yang sangat
cepat,
dan
didukung oleh cara penularan secara nonpersisten (Zehnder et al.2001).
8eberapa faktor yang menyebabkan sulitnya pengendalian CMV
dan
ChiVMV adalab (I) Tanaman yang telab terinfeksi oleh CMV dan ChiVMV tidak dapat disembuhkan
dan
dapat menjadi swober inokulwo untuk tanaman disekitarnya; (2) CMV mempunyai kisaran inang yang sangat luas, lebib dan 800 spesies dari
85
famili tanaman monokotil dan dikotil (palukaitis et al. 1992),sedangkan ChiVMV dilaporkan dapat menginfeksi 48 spesies tanaman dari
sebelas famili tennasuk Capsicum annum, C. jrustescens, Datura, Lycopersicun
esculantum, Nicotiana glutinosa, N. tabacum, Petunia hybrida,
dan
Physalisf/oridana
(Siriwongel aZ.
1995); (3) CMV dan ChiVMV dapa! ditularkan secara nonpersisten oleh lebih dari 75 spesies kutudaun. Strategi pengendalian dengansanitasi dan pengendalian serangga vektor dengan insektisida dilaporkan tidak
efektif; (4) CMV dan ChiVMV memiliki keragaman genetik yang tinggi yang ditunjukkan oleh banyaknya strain virus tersebut yang dapat menimbulkan gejala
atau keparaban penyakit yang berbeda-beda (palukaitis
el aZ. 1992).
Untuk meminimalisasi penggunaan insektisida maka diperlukan altematif
pengendalian. Penggunaan kultivar toleran disertai perlakuan benih cabai tersebut
dengan PGPR (Plant Growth-Promoting Rhizobacteria) perlu diteliti sebagai
altematif pengendalian. Penggunaan kultivar tahan apabila tersedia merupakan
strategi pengendalian yang efektif untuk mengurangi kehilangan
hasH
yangdisebabkan eleh infeksi virus. Keuntungan utama penanaman kultivar tahan
4
sehingga dapat dikombinasikan dengan metode pengendalian lain seperti
biokontrol atau dengan pestisida sekalipun.
Evaluasi ketahanan beberapa galur cabai lerhadap CMV lelab beberapa
kali dilakukan oleh Balai Penelitian Sayuran, Lembang, dengan menggunakan
beberapa strain CMV lokal yang lelab berhasil diisolasi (Durial el al. 1995; Sulyo
et al. 1996), sedangkan evaluasi ketahanan kultivar-kultivar cabai terhadap
ChiVMV belum banyak dilakukan. Hingga saal ini belum diperoleh kultivar yang
tahan
terhadap CMV, selain itu CMV mempunyai kemampuan untuk membentuk.strain baru yang dapat mematahkan ketahanan kultivar-kultivar yang banyak
digunakan oleh
petani.
Oleh karenaitu
evaluasi ketahanan terhadap kedua virustetap penting untuk dilakukan sebagai salah satu tahap awal pencarian sumber
ketahanan terhadap virus.
Penggunaan PGPR sebagai agens hayati untuk mengendalikan penyakit
yang disebabkan oleh virus tumbuhan belum banyak dipraktekkan di Indonesia.
Berbagai artikel ilmiah dari luar negeri menunjukkan potensi penggunaan PGPR
untuk mengendalikan berbagai jenis penyakit (Raupach
et al.1996; Murphy
et al.2000; Zehnder ef al. 2001). Perlakuan PGPR pada benih cabai dan saal pindab
tanarn ke lapang secara umum dapat meningkatkan jumlah daun, tinggi
dan hasil
tanarnan (Tuzun dan Kloepper 1994; Cook el
at.
2002). Aplikasi PGPRdiharapkan dapat menginduksi ketahanan tanaman (Raupach
et al.1996;Zehnder
et al.
2001; Van Loon
et al.1997), sehingga cabai yang sebelumnya bersifat
toleran mungkin akan menjadi lebih
tahan.Se1ain dapat menginduksi ketahanan
PGPR dapat mengkolonisasi akar secara efektif sehingga bersifat sebagai
kompetitor bagi organisme pengganggu lain yaitu melalui mekanisme antibiosis,
kompelisi nutrisi dan enzimalik (Van Loon el
at.
1997; Haas dan Keel 1997).Penggunaan kultivar cabai yang toleran atau tahan
dan perlakuan PGPR apabila
efektif diperkirakan memberikan harapan yang besar unluk digunakan di dalarn
strategi pengendalian penyakit yang terpadu dalam sistem pertanian yang
5
Tujuan Penelitian
Tujuan penelitian ini adalah untuk I) Mengetahui tingkat serangan CMV dan ChiVMV di daerah sentra pertanaman cabai, 2) Mengumpulkan dan melakukan isolasi CMV dan ChiVMV dari tanaman cabai yang terinfeksi, 3)
Mempeiajari karakter isolat CMV dan ChiVMV berdasarkan inang diferensial
dan
deteksi dengan reverse transcriptase-polymerase chain reaction (RT-peR),
double strand RNA (dsRNA), dan purifikasi virus, 4) Mempelajari respon
berbagai kultivar cabai terhadap infeksi CMV dan ChiVMV, 5) Mempelajari pengaruh aplikasi PGPR pada benih cabai terhadap respon ketahanan kultivar
yang diinokulasi CMV dan ChiVMV, 6) Mempelajari respon kultivar cabai toleran terhadap infeksi CMV dan ChiVMV di lapang.
Strategi Penelitian
Untuk mencapai tujuan tersebut di atas, strategi penelitian yang ditempuh
adalah meliputi tahapan penelitian sebagai berikut: I) Survei dan koleksi isolat
CMV dan ChiVMV ; 2) Kajian keragarnan isolat CMV dan ChiVMV berdasarkan inang diferensial dan deteksi dengan reverse transcriptase-poiymerase chain
reaction (RT-PCR), double stranded-RNA (dsRNA) dan purifikasi; 3) Evaluasi ketahanan beberapa kultivar cabai terhadap infeksi CMV dan ChiVMV; 4) Uji
beberapa isolat PGPR (plant growth promoting rhizobacleria) untuk proteksi
tanarnan cabai terhadap infeksi CMV dan ChiVMV; 5) Evaluasi ketahanan
kultivar cabai toleran terhadap infeksi CMV dan ChiVMV. Skema alur penelitian
ini
disajikan pada Gambar 1.1.Hipotesis Penelitian
1. Terdapat perbedaan kejadian penyakit pada lokasi yang berbeda.
2. Terdapat beberapa isolat CMV dan ChiVMV yang berbeda.
3. Kultivar cabai yang diuji terhadap isolat CMV
dan
ChiVMV memilikirespon ketahanan yang berbeda-beda.
4. Aplikasi PGPR dapat me:Iingkatkan ketahanan tanarnan cahai terhadap infeksi CMV dan ChiVMV.
5. Hasil evaluasi ketahanan kultivar di lapang konsisten dengan hasil
Koleksi sampeJ cabai sakit dari
Diagnosis CMV dao ChiVMV lapang di Cipanas (Jawa Barat),r-
dengan ELISA dilanjutkao dengaoBrebes (Jawa Tengab) dan isolasi CMV dao ChiVMV
Gowa (Sulawesi Selatan)
---Hasil: isolat CMV dao Chi VMV
yang bebas dari virus lain
l
Teknikdeteksi dengan
RT-PCR, dsRNA daopurifikasi
dan
kajian keragaman isolat CMVdan
ChiVMV berdasarkan inang diferensial.
---Hasil: isolat dengan karakteristik gejala dao
virulensi yang berbeda-beda
Kajian ketahanan kultivar cabai terhadap CMV
danChiVMV.---Hasil: Kultivar cabai yang menunjukkan respon tahan, toleran dan rentan terhadap virus.
Evaluasi efektivitas beberapa
isolat PGPR terhadap inokulasi
CMV dao ChiVMV pada kultivar cabai rentan.Hasil: Kultivar cabai yang memberikan respon toleran terhadap CMV dao ChiVMV
I
1
Evaluasi kultivar cabai terhadap
CMV dao ChiVMV di lapang Hasil : Kultivar cabai yang menunjukkan respen toleran terhadap infeksi CMV daoChiVMV secara alami
6
[image:24.555.52.472.52.733.2]7
II. TINJAUAN PUSTAKA
Pentingnya Tanaman Cabai
Cabai merah pertaIna kali dibudidayakan di Meksiko dan Amerika Tengah, berasal dari spesies liar 'Chiltepin' (Capsicum annuum var. aviculare).
C. annuum adalah spesies yang paling luas dibudidayakan dan merupakan spesies
yang bemilai ekonomi penting dari genus Capsicum, yang meliputi tipe buah manis hingga sangat pedas (Rubatzky dan Yamaguchi 1997). Di Indonesia, tanaman cabai telah lama diusahakan oleh
petani
sebagai usaha budidaya yang bersifat komersial, yaitu dicirikan oleh sebagian besar atau seluruh hasil produksinya ditujukan untuk memenuhi permintaan pasar. Karakteristik pengembangan produk. yang dimiliki oleh cabai merah ditujukan untuk memenuhi permintaan rumah tangga dan industri pengolahan, baik di pasar domestik maupun ekspor (Adiyoga dan Soetiarso 1995).Produksi cabai di Indonesia masih sangat rendah apabila dibandingkan dengan potensi produksi yang dapat mencapai 10 tonlha (Suwandi et aJ. 1989).
8
Produksi cabai beberapa provinsi di Indonesia pada tahun 2003 sangat
beragam (TabeI2.1).
Tabel 2.1 Produksi cabai besar nasional
pada
setiap provinsi
NO.
Provinsi
Produksi (ton)
I
Jawa Barat
196.481
2
Jawa Timur
82.719
3
Jawa Tengab
97.243
4
Bengkulu
31.348
5
Sumatera Utara
128.991
6 Surnatera Barat 46.928
8
Jarnbi
40.272
9
Bali
16.289
10
NusaTenggaraBarat
2.179
11
Sulawesi Utara
2.201
12
Sulawesi Selatan
28.120
13
Kalimantan Timur
2.235
14
Kalimantan Selatan
3.626
15
Papua
5.302
Sumber: Direktorat lenderal Bina Produksi Hortikultura 2004
Morfologi Tanaman Cabai
Tanaman cabai (c. annuum) termasuk tanaman semusim berbentuk perdu
atau setengah perdu yang sistem perakarannya agak menyebar, batang utama
tumbuh tegak dan pangkalnya berkayu. Daunnya tumbuh seeara tunggal dengan
bentuk yang sangat bervariasi yaitu dari lancip sampai bulat telur dan ujungnya
runcing. Warna daun hijau kelam sampai keunguan, tetapi ada pula jenis cahai
kecil yang daunnya berwama hijau kekuningan (DBPH 2001).
Tanaman cabai mempunyai sistem perakaran yang dangkal dan menyebar
hingga satu meter. Struktur perakaran diawali
dari
akar tunggang yang sangatkuat, selanjutnya diikuti oleh akar lateral yang bercabang-cabang ke samping
dengan akar-akar rambu!. Cabai memiliki batang utarna yang agak tegak, berkayu
dan bereabang banyak dengan tinggi tanarnan 45 -
150 em. Adapun tipe
pereabangannya adalab tegak atau menyebar dengan karakter yang berbeda-beda
tergantung spesiesnya (Purseglove et al. 1981).Tipe percabangan tanaman cabai menurut Nonnecke (1989) dapat
9
daun sembilan sampai sebelas helai, maka akan tumbuh cabang tunggal yang menghasilkan bunga. Daun cabai merupakan daun tunggal dengan helai daun berbentuk lanset hingga bulat telur, berwama bijau atau bijau tua. Dari ketiak daUD yang teratas juga tumbuh cabang yang menghasilkan bunga. Tipe pertumbuhan ini akan berlangsung selama periode pertumbuhan hingga munculnya bunga.
Tanaman cabai berbunga hennaprodit, herdiri tegak tunggal atau berkelompok pada ketiak claun. Tiap bunga mempunyai 5 daun buah, 5 sampai 6 mahkota yang berwarna putih atau ungu bergantung pada varietas atau spesiesnya. Bunga cabai mempunyai sebuah putik dengan kepala bulat dan benang sari yang terdiri atas 5 sampai 6 buah dengan kepala sari berbentuk lonjong. Pada tanaman cabai, penyerbukan sendiri lebih umum terjadi
dan
kadang-kadang terjadi penyerbukan silang. Dilaporkan juga bahwa penyerbukan silang seeara alami dapat teIjadi dengan bantuan lebah dengan persentase persilangan berkisar 7,6 -36,8% dan rata-rata 16,5%. Ukuran, bentuk dan wama buah cabai sangat bervariasi tergantung varielasnya (DBPH 2001, Greenleaf 1986).Hama dan Penyakit Tanaman Cabai
10
Biologi, Ekologi dan Gejala CMV
Partikel cucumovirus adalah isometrik, kira-kira berdiameter 29 nm. Genom terdiri atas tiga molekul ssRNAs dengan ukuran berturut-twut 3,4, 3,1, dan 2,2 kb. SeiaiD itujuga memiliki ssRNA ke eropat dengan ukuran 1,0 kb yang berfungsi mengkode pembentukan selubung protein virus, serta tidak mengandung lipid atau karbohidrat (Agrios 1997). CMV dapat dibagi ke dalaro 2 subgroup I dan II herdasarkan karakter serologi dan sekuen asam nukIeat (Palukaitis ef al. 1992). Matthews (1991) meneatat babwa CMV akan mudab rusak dalam larutan garam klorit dan sodium dodesil sulfat (SDS), partikel peka terhadap ribonuklease, dan kadang-kadang kristal virus ditemukan dalam vakuola.
Cucumber mosaic virus
dapat menampakkan berbagai macam gejala
bergantung inang dan isolat virus. Gejala CMV diantaranya adalah penghambatan pertwnbuhan, hawar, daun berbentuk kipas, shoestring, bercak cincin, buah mengeras dan nekrosis yang diikuti dengan kematian tanaman, namun gejaia yang umum adalab belang dan mosaik (Hsu ef at. 2000). Pada buab eabai dapat juga menyebabkan terbentuknya bercak-bercak nekrotik kecil yang banyak dan sangat jelas, atou bercak eekung berwarna coklat (Moormandan
Woodbridgge 1993).Kisaran Inang dan Mekanisme Penularan CMV
Cucumber mosaic virus termasuk dalam genus yang mempunyai kisaran
11
Penularan CMV dapat dilakukan secara mekanik, dan pada beberapa spesies tanaman dapat ditularkan melalui benih (Matthews 1991). Virus ini dapat juga ditularkan melalui serangga vektor utamanya
yaitu
Myzus persicae Sulzer dan Aphis gossypii Glover secara non persisten (Whitam 1974 dolam Greenleaf 1986). Paling tidak 86 spesies kutudaun te1ab di1aporkan sebagai vektor CMV (Edwardson dan Christie 1986 dalam Hobbs et al. 2000). Hobss et al. (2000)melaporkan bahwa A. fabae subsp. solanella Scopoli, A. gossypii Glover, M
persicae Sulzer, Rhopalosiphum padi Linnaeus dan Sitohion avenae
dapat
menularkan CMV dari gulma yang ada di sekitar pertanaman ke tanaman cahai.
A. gossypii adalah vektor yang paling efisien di dalam kondisi percobaan rumah plastik dan lapangan (Raccab et al. 1985 dalam Escriu et al. 2000). Efektivitas penularan CMV dari tanaman terinfeksi ke tanaman lainnya oleh serangga vektor bergantung pada konsentrasi virus di dalam tanaman terinfeksi (Escriu el al.
2000).
Biologi, Ekologi dan Gejala ChiVMV
Virus ini pertama kali dilaporkan oleh Burnett pada tabun 1947 pada
Capsicum annum di Malaysia. Ong e/ 01. (1979 dalam Ong e/ al. 1995) telah mendeskripsi ChiVMV di Malaysia. Selanjutnya virus ini telah menyebabkan penyakit di banyak negara-negara Asia dimana eabai ditanam seeara komersial. Di Indonesia, keberadaan ChiVMV telah dilaporkan oleh Duriat et al. (1989).
Partikel virus berbentuk batang lentur yang kira-kira panjangnya 750 run dengan diameter kira-kira 12 nm (Ong ef al1979 dalam Ong \995). ChiVMV termasuk di dalam kelompok potyvirus. Kelompok ini tennasuk yang terbanyak diantara virus-virus yang menyerang tanaman yaitu lebih dari 100 anggota yang dimasukkan ke dalarn kelompok ini (Francki et al. 1985 dalam Ong 1995).
12
kualitasnya menjadi rendah (Ong 1995; Sulyo et al. 1995; Chiemsombat dan Kittipakom 1996).
Kisaran Inang dan Mekanisme Penularan ChiVMV
Beberapa penulis melaporkan tanaman yang dapat menjadi inang bagi ChiVMV diantaranya adalah Nicotiana tabacum, N benthamiana, Physalis minima, P. jloridana, C. annum, C. frutescens, N. g/utinosa, Nicandro physalodes, Solanum me/ongena • dan
S.
aethiopicum (Womdim et al. 2001).ChiVMV dapat ditularkan melalui inokulasi mekanik, penyambungan dan serangga vektar seperti A. craccivora, A. gossypii, A. spiraeco!a, M persicae, Toxoptera citricidus, Hysteroneura setariae dan R. maydis seeara non persisten, tetapi tidak dapat ditularkan melalui biji (Ong et al. 1979). Infeksi ChiVMV pada tanaman cabai teIjadi seeara sistemik pada seluruh fase pertumbuhan tanaman (Anonim 2002).
Deteksi dan Karakterisasi Virus
Dewasa ini untuk karakterisasi maupun deteksi VIrus tumbuhan te1ah
banyak menggunakan teknik molekuler seperti polymerase chain reaction (PCR). F ragmen DNA yang kita inginkan dapat diamplifikasi seeara enzimatik (in vitro)
oleh reaksi PCR (Saiki et al. 1990). Pengujian dengan teknik tersebut memerlukan sepasang primer yang spesifik yang akan menginduksi pembentukan dan perbanyakan rangkaian asam nukleat atau untai DNA tertentu dengan bantuan enzim Taq polymerase dalam mesin PCR atau thermocycler. Proses selanjutnya adalah siklus perbanyakan melalui tahapan denaturasi, penempelan dan pemanjangan primer (Hull 2002; Innis et al. 1990).
Metode PCR memerlukan DNA sebagai sumber amplifikasi (template DNA) sehingga tidak bisa secara langsung diaplikasikan terhadap kebanyakan virus tumbuhan yang bergenom RNA. Oleh karena itu RNA
hams
dikonversi menjadi eDNA dengan bantuan enzim reverse transcriptase. RT -PCR adalah metode yang sangat sensitif, eepat dan popular untuk mendeteksi virus tanaman tennasuk. anggota genus Cucumovirus (Rizos et aZ. 1992; Choi et aZ. 1999;13
Vntai
ganda RNA (dsRNA) dapat dengan mudab ditemukan di dalam jaringan tanaman terinfeksi bersama untai tunggai RNA (ssRNA) ViruS.Keberadan dsRNA di dalam jaringan tanaman biasanya digunakan untuk mendiagnosis dan mempelajari sifat dan proses infeksi virus (Dodds dan Bar-Joseph 1983; Morris dao Dodds 1979).
Vntai
gaoda yaog diisolasi dari jaringan tanaman terinfeksi virus, kemudian divisualisasi padagel agarose
atauaerylamide yang hasilnya dapat digunakan dengan membandingkan pola pita
virus yang telab diketahui (Dodds ef aJ. 1984).
Serodiagnosis merupakan cara deteksi virus dengan memanfaatkan reaksi antara antigen dan antibodi (Agrios 1997). Metode ini mempunyai banyak keuntungan antara lain cepat, tepat dan dapat digunakan untuk karakterisasi virus serta untuk mengetahui hubungan kekerabatan suatu virus (Hsu et
01.
2000). Salah satu uji serologi adalah enzyme linked immunosorbent assay (ELISA) yang pertaIna kali dikembangkan oleh Clark dao Adam (1977). Salab satu bahao dasar yang digunakan untuk pengujian seeara serologi adalah tersedianya antibodi. Sebagai langkah awal untuk membuat antibodi adalah melakukan isolasi virus dari inangnya dengan eara purifikasi virus. Metode pemurnian virus sangat tergantung dari sifat dan jenis virusnya (Matthews 1992). Purifikasi CMV telah banyak dilakukan seperti yang telab dilaporkan oleh Hsu ef af. (1989) dan Suastika ef al. (1996), sedaogkan Siriwong ef al. (1995) berhasil melakukao purifikasi ChIVMV isolat CMl. Selain itu hasil purifikasi dapat digunakan untuk analisis selubung protein virus dan pengamatan morfologi virus (Hull 2002).lnang diferensial atau tanaman indikator merupakan salah satu eara untuk mengkarakterisasi masing-masing isolat berdasarkan kesesuaian pada suatu iuang. Selain itu dapat juga digunakan untuk mengetahui virulensi masing-masing isolat tersebut. Pada awal perkembangan ilmu virologi penggunaan inang diferensial menjadi salah satu metode yang rutin digunakan untuk mendeteksi dan mengkarakterisasi virus tanaman. Hal ini dilakukan karena gejala penyakit yang dari lapang kadang-kadang meragukan sehingga sulit dilakukan identiftkasi yaog jelas tentang virus yang menyebabkan penyakit tersebut (Hull 2002; Matthews
14
Ketahanan Tauaman
Tanaman yang tahan terhadap virus adalah tanaman yang mampu menghambat replikasi virus dan penyebaran virus di dalam tanaman (Russel 1981). Ketahanan ini dapat diwujudkan sebagai kemampuan tanaman untuk membatasi perkembangan virus pada sel tertentu sehingga virus tidak menyebar ke sel-sel yang lain (Matthews 1991). Goodman
et at.
(\986) mengelompokkan respon tanaman inang terhadap infeksi virus yaitu rentan dan taban. Respon inang yang rentan dicirikan oleh adanya gejala yang jelas dan replikasi virus yang tinggi. Sementara respon inang taban terdiri atas imun. agak tahan. toteran dan hipersensitif. Imun dicirikan oleh tidak adanya gejala dan ketidakmampuan virus untuk bereplikasi. Toleran dicirikan oleh adanya gejala dan replikasi virus namun tidak mempengaruhi kehilangan hasil. Hipersensitif ditunjukkan oleh adanya gejala khas (lesio lokal) sehingga dapal menghambal replikasi virus (Fraser 2000). Untuk mendapatkan kultivar yang tahan terhadap patogen dapat diperoleh dari koleksi plasma nutfah cahai yang selanjutnya dilakukan seleksi atau skrining. Selaindari
plasma Dutfah sifat tahan juga dapat diperoleh dari varietas komersial, spesies liar sekerabat, spesies lain dalam satu genus, atau genus lain. Hasil seleksi pada koleksi plasma nutfah diperoleh genotipe yang tahan terhadap patogen yang selanjutnya akan dihibridisasi dengan tetua yang mempunyai sifat baik seperti produksi yang tinggi. Untuk memindahkan sifat tahan ke tetua yang mempunyai produksi yang tinggi dapat dilakukan metode back cross atau silang balik selama beberapa kali sehingga diperoleh individu yang mempunyai sifat atau karakter yang tahan terhadap patogen namun memiliki sifat sarna seperti tetua wang(recurent parents) (Nicks et af. 1993).
15
berbeda-beda sesuai lokasi dan kondisi di mana pengujian dilakukan (Duriat et of.
1995). Oleh karena itu penelitian tentang ketahanan eabai terhadap CMV dan ChiVMV barns terus-menerus dilakukan.
Ketahanan Terinduksi Tanaman melalui Aplikasi PGPR
Plant growth-promoting rhizobacteria (pGPR) adalah bakteri pengkoloni
akar yang memberi efek menguntungkan terhadap pertumbnhan tanarnan. Ketahanan terinduksi secara sistemik terhadap penyakit tanaman setelah adanya infeksi sebelumnya telah dilapnrkan pada awal abad ke 19 oleh Chester (1933
daTam
Van Loonet al.
1998). Ketahanan penyakit terinduksi dapat didefinisikan sebagai proses aktivasi ketahanan tanaman secara fisik atau kimia yang dipicu oleh agens biotik (PGPR) atau abiotik (Kloepper ef al. 1992; Pieterse ef al. 1996,Liu ef at. 1995; Murphy ef al. 2000). Mekanisme PGPR untuk memberi efek antagonis terhadap patogen dapat melalui beberapa cara yaitu: produksi antibiotik, siderofor, senyawa volatil, parasitisme, kompetisi sumber nutrisi dan relung ekologi, serta ketahanan terinduksi (Brimecombe
el al. 2001).
Ketahanan sistemik terinduksi (induced systemic resistance) bergantung pada kolonisasi sistem perakaran oleh PGPR. Kolonisasi oleh PGPR dapat terjadi melalui penyelubungan benih atau penambahan suspensi PGPR ke dalam tanah pada saat pindah tanarn (Kloepper 1996). Cook ef al. (2002) melapnrkan bahwa perlakuan rhizobacteria (Bacillus sp. dan Pseudomonas jluorescens) pada biji gandum cenderung meningkatkan produksi yang lebih tinggi dibandingkan dengan perlakuan kontrol yang tidak diberi rhizobaeferia. Raupaeh ef al. (1996)
melaporkan bahwa perlakuan benih ketimun dan tomat dengan PGPR menghasilkan induksi ketahanan sistemik terhadap infeksi sistemik CMV. Maurhofer ef al. (1994) meneatat bahwa P. fluoreseens (pGPR) yang diaplikasikan pada akar dapat menginduksi ketahanan tembakau terhadap infeksi
16
Pertahanan tanaman melawan hama dan penyakit merupakan proses yang bersifat kompleks yang diatur oleh beberapa persenyawaan dengan herat molekul rendah, meliputi asam salisilat (SA), jasmonic acid (IA) dan etilen (Tuzun dan Bent 2000). Salah satu fungsi SA adalah sebagai signal translokasi yang bersifat sistemik dan terlibat di dalam systemic acquired resistance (SAR). Rasmussen el
a/. (1991) menyimpulkan babwa SA adalab suatu signal sekunder yang terutama diinduksi oleh signal translokasi yang dihasilkan pada tempat infeksi awal.
Percobaan dengan menggunakan fenilalanin amonia lyase (PAL) yang telah dilabel menunjukkan adanya akumulasi SA. Peningkatan aktivitas PAL yang ada di dalam petiole daun batang atas dan daW} batang bawah yang diinokulasi, menyimpuIkan bahwa SA disintesis di jaringan pembuluh (Hammerschmidt dan Becker 2000). Coquoz e/ al. (1998) melaparkan lintasan biosintesis untuk membentuk SA dengan prekursor PAL, dengan senyawa antara asam sinamik dan asam benzoik yang mana lintasan ini tidak terjadi pada tanaman sehat.
Keberadaan SA di dalam eksudat fioem mendukung hipotesis bahwa SA ditranslokasikan ke seluruh bagian tanaman untuk: mengaktivasi ekspresi
pathogenesis - related protein (pR-protein) dan selanjutnya membentuk: SAR (Smith-Becker ef af. 1998). Gessler dan Kuc (1982 da/am Oku 1994) berhasil mengisolasi adanya sebuah protein yang mempunyai berat molekul 16.000 kda dari ekstrak daun terinfeksi. Protein ini stabil dalam bufer asam dan tidak dideteksi di dalam ekstrak daun yang rusak atau luka karena perlakuan fisiko Agrios (1997) mencatat bahwa PR protein dapat sangat asam atau sangat basa oleh karena itu menjadi sangat reaktif. Beberapa PR protein yang banyak dikenal seperti PR protein I yaitu P-I,3 glukanase, kitinase, dan lisosim (Agrios 1997, Oku 1994), PR protein 4 seperti thaumatinelike protein, glicine-rich protein,
proteinase inhibitor, dan peroksidase (Agrios 1997; Oku 1994). Chivasa et al.
III. SURVEI LAPANG DAN KOLEKSI ISOLAT CMV DAN ChiVMV'
ABSTRAK
MUHAMMAD TAUFIK. Survei dan Koleksi Isolat CMV dan ChiVMV. Dibimbing oleh SRI HENDRASTUTI IflDAYAT, GEDE SUASTIKA, SIENTJE MANDANG SUMARA W, dan SRIANI SUJIPRIHATI.
Penyakit yang disebabkan oleh virus mengakibatkan kerugian ekonomi yang cukup nyata karena infeksi virus dapat menurunkan kualitas dan kuantitas hasil tanaman cabai. Dua virus utama yang dapat menimbulkan kerugian hasi I pada tanaman cabai di Indonesia adalah CMV dan ChiVMV. Melalui metode suevei dilakukan penelitian untuk mempelajari kejadian penyakit CMV dan ChiVMV pada beberapa sentra pertanaman cabai di Jawa Barat, Jawa Tengah dan Sulawesi Selatan. Selama suevei dilakukan pula pengumpulan beberapa isolat lapang CMV dan ChiVMV yang alcan digunakan untuk penelitian lebih lanjut.
Hasil survei lapang yang dilakukan memperkuat bukti penyebaran CMV dan ChiVMV yang sangat luas. Kedua virus tersebut selalu ditemukan pada setiap pertanaman cabai yang diamati walaupun proporsi kejadian penyakit berbeda·beda untuk setiap tempat. Di daerah Jawa Barat infeksi oleh CMV lebih dominan daripada infeksi oleh ChiVMV, tetapi di daerah Sulawesi Selatan keadaannya berbeda. Empat isolat CMV dan enam isolat ChiVMV dengan keragaman gejala berhasil diperoleh. Isolat-isolat ChiVMV diperbanyak dan dipelihara pada cabai Paprika (Capsicum annuum var. grosum) sedangkan isolat CMV pada Nicotiana tabacum.
I Bagian dari disertasi ini telah dikirimkan dan telah diserujui untuk dipublikasikan di Jumal
III. SURVEY OF CMV AND CbiVMV INFECTION ON CHILLI PEPPER AND COLLECTION OF VIRUS ISOLATES'
ABSTRACT
MUHAMMAD TAUFIK. Survey of CMV and ChiVMV infection on chilli pepper and collection of virus isolates. Supervised by SRI HENDRASTUTI HIDA Y A T, GEDE SUASTIKA, SIENTJE MANDANG SUMARAW, and SRIANI SUJlPRIHATI.
Virus infection on chillipepper can cause significant economic and yield loss because it reduces the quality and quantity of fruits per plant. Two most important viral disease of chillipepper in Indonesia are CMV and ChiVMV. A survey was conducted in several chillipepper growing areas in West Java, Central Java, and South Sulawesi to study the disease incidence on chillipepper caused by CMV and ChiVMV. Field isolates of CMV and ChiVMV was collected during the survey which will be used later on for further investigation.
It was evidenced from the survey that CMV and ChiVMV were widely distributed in chillipepper growing area. Both viruses was always found in chillipepper growing area although proportion of disease incidence is different from one place to another. Infection of CMV was more prominent in West Java, whereas in South Sulawesi ChiVMV was more dominant. Different response of different chillipepper cultivars on infection by CMV and ChiVMV was showed by diversity of incubation period of virus, symptoms, and percentage of disease incidence. Four isolates of CMV dan six isolates of ChiVMV with different symptoms was collected. ChiVMV isolates was maintained in Capsicum annum var Grosum whereas CMV was maintained in Nicotiana tabacum
I Part of the disertasi was submited and has been accepted for publication in lournaJ Agrikultura, the
PENDAHULUAN
Salah
satu penyakit utama tanamancabai adalah penyakit yang disebabkan
oleh infeksi virus yang mengakibatkan kerugian ekonomi yang cukup nyata
karena infeksi virus dapat menurunkan kualitas dan kuantitas hasil tanaman cabai.
Paling tidak ada 35 macam virus yang dapat menyerang berbagai kultivar cabai
(Green dan Kim 1994). Beberapa virus yang banyak menginfeksi pertanaman
cabai adalah
cucumber mosaic viros(CMV).
chilli veinal mottle virus(ChiVMV),
potato virus
Y
(pVY) dan tomato mosaic virus (ToMV) (Duriat et al. 1989).Chiemsombat dan Kittipakom (1995) meneatat babwa diantara 336 sampel yang
menunjukkan gejala be1ang. gugur daun, nekrosis,
dan bercak klorotik sebanyak
41,2% terinfeksi oleh CMV diikuti oleh ChiVMV (25,0%), lEV (6,8%), TSWV
(5,1 %) dan PeMV (4,2%). Hord
et al
(2001) melaporkan babwa
dari284 total
sampeJ yang diamati 40% terinfeksi oleh CMV sub grup
1.Chilli veinal mottle virus adalah salah satu virus yang cukup banyak
menginfeksi pertanaman cahai di Asia. Hasil survei di 16 negara Asia
menunjukkan bahwa ChiVMV dapat menginfeksi pertanaman cabai sampai 30%.
Virus tersebut dilaporkan mereduksi hasH pada paprika sebanyak 55-95%' dan
pada eabai rawit sebanyak 7 - 74% (Green 2004). ChiVMV pertama kali
dilaporkan di Malaysia sekitar 25 tahun yang lalu (Ong et al. 1979 da/am Ang1995). Sejak itu telah dilaporkan tersebar luas ke negara lain seperti Taiwan,
Thailand, Indonesia, Filipina dan Cina (Ang 1995).
Di Malaysia ChiVMV
merupakan virus utama yang menginfeksi pertanaman cabai meskipun ditemukanadanya infeksi virus lain seperti CMV yang juga ditularkan secara nonpersisten
oleh kutudaun (Ang 1995).
Infeksi ChiVMV menunjukkan gejala bercak hijau, penebalan tulang daun,
daun menjadi lebih keci! dan kadang diikuti dengan malformasi daun (Siriwong
et al. 1995; Kittipakom 1991). Di Indonesia, informasi mengenai keberadaan
ChiVMV masih sangat sedikit dan penelitian tentang kejadian penyakit di lapang
18
Penelitian tentang keberadaan virus ini menjadi penting untuk dilakukan karena
infeksi virus ini dapat menurunkan kualitas dan kuantitas buah cabaL
Hasil survei dari lokasi pertanaman cabai di Indonesia dapat dikumpulkan
sebanyak 692 contoh tanaman cabai yang terinfeksi
dan
berdasarkan uji ELISAmenunjukkan bahwa sebanyak 45,73% dari contoh tersebut memberikan reaksi
positif terinfeksi CMV (Duriat 1993). Sulyo melaporkan babwa infeksi CMV pada tanaman cabai dapat menyebabkan kehilangan
hasil
32- 75% .Gejala tanaman cabai merah yang terinfeksi CMV sangat bervariasi dan
sangat dipengaruhi oleh beberapa faktor, diantaranya kultivar cabai, strain virus,
kondisi lingkungan, dan fase perturnbuhan. Kultivar cabai yang
tahan
hanyamenunjukkan gejala mosaik yang sangat ringan atall tidak bergejala, sedangkan
kultivar cabai rentan menunjukkan gejala mosaik yang berat sampai terjadinya
malformasi dann (Sulyo dan Duri.t 1996; Chiemsombat dan Kittipakom 1996). Seeara umurn daun muda
dan
daun tua relatif lehih tahan dibandingkan dengandaun muda yang telab membuk. penub (Matthews 1991). Strain virus y.ng baru mungkin akan ditemukan di alam
dan
menyebabkan variasi gejala. Sulyo danDuriat (1996) melaporkan bahwa strain CMV-RIV2 merupakan strain CMV yang
sangat virulen.
Kejadian penyakit CMV dan ChiVMV pada tanaman cabai yang dilaporkan oleh Duriat (lebih dari 10 tabun yang 1.lu 1993). Sejak saat itu belum ada laporan lagi tentang kejadian penyakit di sentra-sentra pertanaman cabai.
Berdasarkan pengamatan lapang saat ini telah teIjadi perubahan kejadian penyakit
yang disebabkan oleh infeksi virus khususnya CMV dan ChiVMV pada tanaman
cabai. Oleh karena itu perlu dilakukan pengamatan tentang sebaran infeksi CMV
dan ChiVMV di sentra-sentra pertanaman cabai.
Tujuan Penelitian
Survei ke beberapa pertanaman cabai dimaksudkan untuk melakukan
19
BAHAN DAN METODE
Tempat dan Waldu Penelitian
Survei dilaksanakan di sentra-sentra pertanaman cabai di Jawa Barat, Jawa T engah, dan Sulawesi Selatan. Sampel tanaman sakit yang diperoleh dari survei lapang selanjutnya dibawa ke Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanarnan. Fakultas Pertanian, IPB untuk dilakukan diagnosis dan perbanyakan sumber inokulum. Penelitian dilaksanakan dari bulan Agustus 2002 sampai Maret 2003.
Survei dan Pengambilan Sam pel dari Lapang
Pengambilan sampel tanaman dari l'pang dilakukan di beber.p. pertanaman cabai di Jawa Barat (kabupaten Bogar dan Cianjur). Jawa Tengah (kabupaten Brebes) dan Sul.wesi Selatan (k.bupaten Gowa dan Enrekang). Pada saat yang bersamaan dilakukan penghitungan kejadian penyakit melalui pengambilan sampe1 seeara aeak minimal sekitar 10% dari populasi tanaman. Sampel yang diduga menunjukkan gejala CMV dan ChiVMV seperti mosaik. heiang, daun keci!, leaf cupping. ujung daun meruncing dimasukkan ke dalam plastik sampel tembus pandang dan selanjutnya disimpan ke dalam kotak pendingin. Sampel tanaman tersebut kemudian diuji dengan metode ELISA
(enzyme linked immunosorbent assay) dengan menggunakan antiserum CM\'.
ChiVMV, TMV, PMMV, PVY dan ToMV. Sampel y.ng terinfeksi banya oleh CMV atau ChiVMV selanjutnya disimpan dan ditularkan ke tanaman tembakau
(Nicotiana tabacum) atau paprika untuk perbanyakan isolat virus.
Diagnosis CMV dan ChiVMV dengan ELISA
20
pada suhu 4
°c
selama semalam. Setelah proses inkubasi selesai platmikrotiter dicuci dengan PBST sebanyak 5 - 7 kali. Selanjutnya sumuran platmikrotiter diisi dengan 100 ... 1 sap tanaman terinfeksi virus, kemudian diinkubasi pada subu ruang selama 2 jam. Platmikrotiter dicuci lagi dengan PBST dengan eara seperti di atas. Ke dalam surnuran yang te1ah dicuci ditambah enzim konyugat sebanyak 100セャOウオュオイ。ョ@ kemudian diinkubasi lagi pada suhu ruang selama 2 jam.
Platmikrotiter dicuci lagi dengan PBST dengan cara seperti di atas. Akhimya platmikrotiter yang telah dicuci ditambahkan PNP 100 J1lIsumuran dan diinkubasi selama 30 - 60 menit pada suhu ruang. Jika terjadi perubahan warna, menunjukkan bahwa sampel tersebut positif terinfeksi dengan CMV danlatau ChiVMV. Untuk menghentikan perubahan warna, kedalam sumuran ditambahkan
sodium hydroxide 50 J.1l/sumuran. Untuk mengkuantifikasi hasil digunakan ELISA
reader pada panjang gelombang 405 nm.
Perbanyakan Sumber Inokulum
Persiapan Tanaman Inang Sumber Inokulum
Sebelurn survei lapang dilakukan, terlebih dahulu disiapkan tanaman untuk perbanyakan sumber inokuIum. Tanaman yang digunakan untuk perbanyakan sumber inokulum adalah Nicotiana tabacum,
N.
glutinosa dan C. annuum var. Grosum (paprika). Benih-benih tanaman tersebut disemai di dalam baki yang berisi media semai. Setelah mencapai umur 2 minggu setelah semai tanaman dipindah ke polibag. Selama masa pertumbuhan bibit dipelihara dengan baik di dalam rumah kaca. Tanaman yang siap diinokulasi adalah tanaman yang berumur relatif muda yaitu telab memiliki daun muda yang telah membuka penuh.Metode Inoklilasi Virus Seeara Mekanik
21
pada 2 helai daun tennuda yaug telah membuka penub (30 hari setelah semai). Sebehun diinokulasi diberi karborundum pada bagian permukaan atas daun, kemudian sap dioleskan dengan kapas steril pada permukaan daun yang dimulai dari daun bagian bawah ke bagian atas secara searab dengan tidak mengulangi pada daerah yang sarna. Segera setelah pengolesan sap dilakukan pembilasan sisa-sisa sap yang masih melekat pada permukaan daun tanaman uji menggunakan air mengalir.
Pengawetan Isolat CMV dan ChiVMV
Penyimpanan isolat-isolat virus untuk waktu yang lama dilakukan dengan metode dehidrasi sesuai dengan prosedur Dijkstra dan Jager (1998). Daun yang
positif terinfeksi oleh CMV atau ChiVMV dicacah dengan sHet bebas virus.
Bagian bawah cawau petri diisi dengan kalsium klorida (CaCh) dengan perbandingau 1 : 20 (bib) selanjutnya dilapisi dengan kertas merang atau kertas saring kemudian bahan yang telah dicacah sebe1umnya disebarkan di atas kertas saring. Cawan petri kemudian ditutup dan direkat dengan parafilm sehingga menjadi kedap udara. Isolat awetan tersebut disimpan di dalam kulkas bersuhu 4°c
untuk pengeringan selama satu minggu. Selanjutnya dipindah ke dalam tabung plastik bertutup yaug 113 bagiau tabung terse but telah diisi dengan CaC!,. Pada bagian atas ditutup dengan kapas steri!. Setelah tabung ditutup parafilm disimpan pada suhu 40c.
Untuk reaktivasi isolat virus yang telah disimpan atau jika akau digunakan untuk inokulasi maka ditambahkau 1.9 ml buffer/ 0.1 g bahan22
HasH
Survei Lapang dan Pengambilan Sampel di Lapang
Hasil pengamatan di lapang menWljukkan adanya variasi pola tanam, varietas tanaman dan ketinggian tempat untuk menanam cabai (Tabel 2). Cabai dapat ditanam dengan pola tumpangsari atau monokultur. Pada lokasi pengambilan sampel di Jawa Barat tanaman cabai di tanam secara twnpangsari bersama dengan tanaman kentang, wortel, tomat, bawang daun dan jenis labu-labuan, namun ada juga tanaman cabai yang ditanam seeara monokultur dalam areal yang cukup luas. Di daerah Brebes, umumnya cabai ditanam bersamaan dengan bawang, worte!, tomat dan kadang-kadang padi. Pola budidaya di lokasi tersebut adalah sistem bedengan yang disekelilingnya tetap digenangi dengan air sebagai sumher penyiraman. Di Sulawesi Selatan khususnya di Enrekang tanaman cabai ditanam bersama kentang, tomato
wortel
dankol,
sedangkan diGowa
umumnya monokultur. Kultivar yang ditanam di Brehes (Jawa Tengah) dan Gowa dan Enrekang (Sulawesi Selatan) adalah cabai keriting (TM 999) dan cabai besar bukan keriting. Lokasi penanaman cabai terdapat di dataran rendah sampai dataran tinggi.Hasil uji ELISA pada 246 sampel bergejala yang dikumpulkan dari II lokasi survei menunjukkan bahwa sebanyak 41,46% terinfeksi oleh CMV dan 32,93% terinfeksi oleh ChiVMV. Distribusi kejadian penyakit per lokasi pengambilan sampel dapat dilihat pada Tabel 3.1.
Kejadian penyakit CMV t