Y A T N O
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Isolasi Protein Bungkil Inti Sawit dan Kajian Nilai Biologinya sebagai Alternatif Bungkil Kedelai pada Puyuh adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2009
Yatno
Alternative of Soybean Meal in Quail (Coturnix-coturnix japonica). Under direction of NAHROWI, HARDJOSWORO P, PURWADARIA T, and SETIYONO A.
Local feedstuffs are rarely available as soybean meal (SBM) alternative in poultry diet. Consequently, the amount of imported SBM is increasing as the increase of poultry population. Palm Kernel Meal (PKM), one of by products from palm oil processing industry, has high potency as feedstuffs due to its availability. PKM, however, has combination problems of shell contamination, containing high non starch-polysaccharide (NSP) dominated with mannan molecules, and low protein content which causes the utilization of PKM in poultry diet is very limited (< 3%). On the other hand, mannanoligosaccharides from PKM may be used to inhibit pathogenic bacteria in poultry gut. Therefore, separation of cell wall of PKM to isolate mannan molecules and extraction of its protein compounds was alternative methods to solve the feed problem. The protein extraction increases the protein content at least 3 folds. The aims of the study were to fractionate and characterize physical-chemical properties of PKM, isolate protein from PKM, evaluate chemical and biological of isolated protein (concentrate protein/PKMCP), and to investigate the effect of PKMCP inclusion with and without fortification in ration on performance and liver and small intestine histopathology of layer quails.
Fractionation of palm kernel meal was done using vibrator ball mill equipped with sieve 4, 8, 16, 30, 50, 100 and 400 mesh. Protein, crude fiber, Neutral Detergent Fiber (NDF) and Acid Detergent Fiber (ADF) of the fractionation products were evaluated and the data were analyzed descriptively.
However, the protein content of each fraction was similar. Fractionation were distributed at sieve 30, 50 and 100 mesh producing 37.0, 30.2 and 15.3% respectively. Specific gravity, bulk density, compacted bulk density and angle of repose of PKM were higher than those of SBM (1.53 vs 1.46 g/ml, 0.56 vs 0.46 g/ml, 0.76 vs 0.65 g/ml and 35.44 vs 29.60o respectively). On the other hand, PKM has pH and protein solubility lower than those of SBM (6.3 vs 6.5 and 55.25 vs 75.21%).
Crude protein content of two step extracted PKM using 1N NaOH was better than that using 0.05N NaOH (33.88 vs.45.54%). The extraction produced dry matter yield 12.18% and protein recovery 50.38%. Isoelectric point of PKM protein was reached at pH 4. The protein contents of E2 and E1 were higher than those of E3 and E4 (54.11, 53.17, 45.56 and 45.32% respectively). The highest of total precipitation yield was observed at E3 (12.18%) then E4 (11.89%), E2 (8.57%) dan E1 (5.30%). Both protein content and total yield data resulted the highest protein recovery was observed at E3 (50.38%) following by E4, E2 and E1 (42.99, 32.62 and 20.27% respectively). The optimum protein precipitation of PKM might be determined in the equation of y= -0.009x + 11.66 (y is the pH value; x is the volume of 0.1N HCl to 200 ml extract). Essential amino acid profile of concentrate PKM at E3 was better than those of E1, E2 and E4 (16.80, 10.17, 16.22 and 14.52% respectively), while PKM and soybean meal were 6.62 and 21.17%.
EAAI value of PKMCP, PKM, and soybean meal was 62.40, 60.00, and 77.20 % respectively. Nitrogen retention and metabolizable energy of quails received PKMCP were 69.82% and 2 578.94 kkal/kg, while nitrogen retention and metabolizable energy of quails received PKM and SBM were 61.19 and 2 485.06 kkal/kg, and 70,57% and 2 826.30 kkal/kg, respectively. FCR, PER and HEP of quails received PKMCP were 3.18, 1.05 and 35%, while SBM were 2.97, 1.08 and 47.41% respectively. Final body weight and yellow egg colour index of quails received PKMCP were better than those of SBM (124.65 vs 117.29 g/bird and 10.20 vs 8.00). Score lesion of duodenum, jejunum, ileum and liver of quails received PKMCP were 0.70, 0.64, 0.68 and 1.76, while SBM were 0.82, 0.66, 0.76 and 1.02 respectively.
It is concluded that fractionation of PKM using vibrator ball mill was not capable of increasing protein content of PKM fractions. Physical properties of PKM were higher, while chemical properties were lower compared with those of SBM (6.3 vs 6.5 and 55.25 vs 75.2%). Two step of extraction using 1 N NaOH following precipitation with 0.1N HCl was the best method in term of precipitation yield weight (12.18%) and crude protein content (45.56%). The addition of 0.1N HCL into PKM extract to reach iso-electric point follows the equation of y = -0.009x + 11.66. PKMCP did not give negative effect on quails performance observed from score lesion and histopathology evaluation of small intestine and liver, even PKMCP gives positive effect of yellow egg colour index and final body weight of laying quails.
sebagai Alternatif Bungkil Kedelai pada Puyuh. Dibimbing oleh NAHROWI, HARDJOSWORO P, PURWADARIA T DAN SETIYONO A.
Sumber protein nabati untuk pakan unggas sampai saat ini sangat terbatas dan masih mengandalkan bungkil kedelai. Di sisi lain impor bungkil kedelai dari tahun ke tahun mengalami peningkatan seiring dengan meningkatnya populasi unggas di Indonesia, sehingga perlu upaya untuk menggunakan bahan pakan lokal sebagai alternatif bungkil kedelai. Salah satu bahan tersebut adalah bungkil inti sawit (BIS).
Pemakaian BIS pada ransum unggas masih sangat rendah (<3%), hal ini terkait dengan kandungan serat dan keberadaan batok yang tidak dapat dicerna oleh ternak monogastrik. Kajian pendahuluan tentang tingkat degradasi BIS menunjukkan bahwa dinding sel BIS sangat sulit didegradasi oleh larutan NaOH konsentrasi rendah, sehingga pengembangan metode ekstraksi memungkinkan untuk memisahkan seluruh protein BIS dan pada gilirannya dapat dilakukan optimalisasi pemakaian BIS sebagai pakan unggas.
Tujuan penelitian adalah untuk; memisahkan cangkang dengan bungkilnya menggunakan vibrator ball mill dan mengetahui sifat fisiko-kimia BIS, mengisolasi protein BIS dengan metode ekstraksi bertingkat sebagai konsentrat protein, mengevaluasi kualitas kimia dan biologi konsentrat protein BIS dan mengetahui pengaruh penggunaan protein BIS terfortifikasi terhadap peforma dan produksi telur pada puyuh masa bertelur.
Empat tahapan penelitian yang saling terkait telah dilakukan meliputi; 1) fraksinasi menggunakan vibrator ballmill dan sifat fisiko-kimia bungkil inti sawit 2) isolasi protein dari bungkil inti sawit menggunakan metode ekstraksi bertingkat 3) evaluasi kimia dan biologi konsentrat protein bungkil inti sawit dan 4) penggunaan konsentrat protein BIS terfortifikasi/BISPLUS pada puyuh masa bertelur.
Fraksinasi dilakukan menggunakan vibrator ball mill yang dilengkapi dengan saringan (sieve) berukuran 4, 8 16, 30, 50, 100 dan 400 mesh pada kecepatan goyangan 35 rpm selama 15 menit. BIS yang tidak lolos/tertahan pada setiap fraksi ditimbang dan dilakukan analisis protein, serat kasar, Neutral Detergen Fiber (NDF) dan Acid Detergen Fiber (ADF).
metabolis dilakukan terhadap konsentrat protein produk terbaik dari hasil evaluasi kimia (R1), kemudian dibandingkan dengan BIS (R2) dan bungkil kedelai (R3). Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap dengan 3 perlakuan dan 5 ulangan serta menggunakan Uji Kontras Ortogonal.
Uji lapang dilakukan terhadap produk konsentrat protein BIS terfortifikasi “BISPLUS” dengan perlakuan sebagai berikut; R1 (ransum mengandung 12% BISPLUS), R2 (ransum mengandung 12% BIS) dan R3 (ransum mengandung 12% bungkil kedelai). Peubah yang diukur antara lain konsumsi ransum, pertambahan bobot badan, konversi ransum, bobot badan akhir, produksi telur, indeks kuning telur dan gambaran histopatologis hati dan usus halus. Penelitian didisain menggunakan Rancangan Acak Lengkap dengan 3 perlakuan dan 5 ulangan. Uji Kontras Ortogonal digunakan untuk membandingkan antar perlakuan.
Hasil penelitian menunjukkan bahwa fraksinasi bungkil inti sawit menggunakan vibrator ball mill telah mampu memisahkan antara batok dengan bungkilnya namun belum secara signifikan mempengaruhi keberadaan protein karena protein relatif menyebar pada setiap fraksi, begitu juga halnya dengan serat kasar. Distribusi bahan terkonsentrasi pada saringan berukuran 30, 50 dan 100 mesh masing-masing sebesar 37.0, 30.2 dan 15.3%, sehingga sisanya sekitar 18% merupakan batok atau benda asing. Sebaliknya penyaringan secara manual menghasilkan batok sebesar 30%. Bungkil inti sawit mempunyai sifat fisik seperti berat jenis, kerapatan tumpukan, kerapatan pemadatan tumpukan dan sudut tumpukan yang lebih tinggi dari bungkil kedelai masing-masing sebesar 1.53 vs 1.46 g/ml, 0.56 vs 0.46 g/ml, 0.76 vs 0.65 g/ml dan 35.44 vs 29.60o, sebaliknya BIS mempunyai mempunyai sifat kimiawi seperti pH dan kelarutan protein yang lebih rendah dari bungkil kedelai masing-masing sebesar 6.3 vs 6.5 dan 55.25 vs 75.21%
Kombinasi esktraksi fisik dan kimiawi menghasilkan konsentrat protein BIS dengan kandungan protein sebesar 45.56%, rendemen 12.18% dan protein recovery 50.38%. Jumlah endapan tertinggi pada proses pengendapan protein bungkil inti sawit dicapai pada pH 4. Nilai indeks asam amino esensial pada konsentrat protein BIS lebih tinggi dari BIS masing-masing sebesar 62.40 dan 60.00%, sedangkan bungkil kedelai sebesar 77.2%. Konsentrat protein BIS yang dihasilkan defisien terhadap lisina dan treonina. Retensi protein dan energi metabolis konsentrat protein BIS masing-masing sebesar 69.82% dan 2 578.94 kkal/kg, sedangkan BIS dan bungkil kedelai masing-masing sebesar 61.19 dan 2 485.06 kkal/kg serta 70,57% dan 2 826.30 kkal/kg.
Dapat disimpulkan bahwa kandungan protein BIS sulit ditingkatkan dengan hanya mengandalkan fraksinasi dan ekstraksi tunggal menggunakan NaOH pada konsentrasi yang rendah (< 1N). Metode ekstraksi bertingkat pada BIS dapat meningkatkan kandungan protein kasar 3 kali lebih tinggi dari BIS awal (16.84 vs 45.56%) dan menurunkan serat kasar dari 24.22 menjadi 2%. Bungkil inti sawit mempunyai sifat fisik seperti berat jenis, kerapatan tumpukan, kerapatan pemadatan tumpukan dan sudut tumpukan yang lebih tinggi dari bungkil kedelai namun mempunyai sifat kimiawi seperti pH dan kelarutan protein yang lebih rendah dari bungkil kedelai masing-masing sebesar 6.3 vs 6.5 dan 55.25 vs 75.21%.
Konsentrat protein BIS terfortifikasi tidak memberikan efek negatif pada puyuh yang tergambar dari skor lesio dan gambaran histopatologi usus halus dan hati bahkan memberikan efek positif terhadap bobot badan akhir dan indeks warna kuning telur puyuh masa bertelur.
---
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
Y A T N O
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Prof. Dr. Ir. Komang Gede Wiryawan
2. Dr. Ir. Sumiati, M.Sc.
Penguji pada Ujian Terbuka : 1. Prof. Dr. Ir. Tjeppy D Soedjana, M.Sc.
Nama : Yatno
NIM : D061030101
Disetujui
Komisi Pembimbing
Dr. Ir. Nahrowi, M.Sc. Prof. Dr. Peni S. Hardjosworo, M.Sc. Ketua Anggota
Dr. Tresnawati Purwadaria Dr. drh. Agus Setiyono, M.S. Anggota Anggota
Diketahui
Ketua Departemen Dekan Sekolah Pascasarjana Ilmu Nutrisi dan Teknologi Pakan
Dr. Ir. Idat Galih Permana, M.Sc.Agr. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Rasa syukur penulis panjatkan kepada Allah SWT, karena atas tuntunan dan kehendak-Mu tugas ini dapat terselesaikan dengan baik. Hasil penelitian ini diharapkan dapat memberikan terobosan baru mengenai diversifikasi produk dari bungkil inti sawit sebagai konsentrat protein alternatif bungkil kedelai pada pakan unggas.
Disertasi ini memuat beberapa tahap penelitian yang saling terkait dan telah diterbitkan pada jurnal serta disajikan pada pertemuan ilmiah sebagai berikut : 1. “Sifat Kimiawi dan Nilai Biologi Konsentrat Protein Bungkil Inti Sawit
Hasil Ekstraksi Kombinasi Fisik dan Kimiawi “ telah diterbitkan pada Jurnal Media Peternakan volume 31 no 3 tahun 2008 hlm. 178-185.
2. “Evaluasi Sifat Fisiko-Kimia dan Nilai Energi Metabolis Konsentrat Protein Bungkil Inti Sawit pada Broiler “ telah diterbitkan pada Jurnal Ilmu Ternak dan Veteriner (JITV) volume 13 no 4 tahun 2008 hlm. 249-255. 3. ”Sifat Fisik dan Energi Metabolis Konsentrat Protein Asal Bungkil Inti
Sawit Hasil Ekstraksi Fisik dan Kimia”. Disampaikan pada Seminar Nasional Teknologi Peternakan dan Veteriner di Bogor pada tanggal 21-22 Agustus 2007.
4. “Retensi Protein dan Nilai Energi Metabolis Konsentrat Protein Bungkil Inti Sawit Hasil Ekstraksi Kombinasi Fisik dan Kimiawi” Disampaikan pada Seminar Nasional Teknologi Peternakan dan Veteriner di Bogor pada tanggal 11-12 Nopember 2008.
5. ” Polisakarida Mannan Produk Samping Pembuatan Konsentrat Protein dari Bungkil Inti Sawit sebagai Pengendali Escherichia coli (in-vitro)”. Disampaikan pada Seminar Nasional Teknologi Peternakan dan Veteriner di Bogor pada tanggal 11-12 Nopember 2008.
6. ”Protein Isolation from Palm Kernel Meal Using Two Step Extraction Methods”. Disampaikan pada Seminar Internasional AINI tanggal 18-19 Juli 2009 di Universitas Jendral Soedirman, Purwokerto.
Penelitian ini dapat terselesaikan atas bimbingan, arahan, saran dan kerjasama yang sangat baik dari komisi pembimbing, oleh karena itu pada kesempatan ini saya menyampaikan ucapan terima kasih kepada Dr. Ir. Nahrowi, M.Sc, Prof. Peni Hardjosworo, M.Sc, Dr. Tresnawati Purwadaria dan Dr. drh. Agus Setiyono,MS. Cukup banyak sumbangan pemikiran, waktu dan segala pengertian yang telah diberikan komisi pembimbing kepada saya, dengan harapan agar bekal tersebut digunakan kepada orang lain yang membutuhkan. Selain itu penulis juga mengucapkan terima kasih kepada Prof. Dr. Ir Komang Gede Wiryawan dan Dr. Ir. Sumiati, M.Sc sebagai penguji luar komisi pada ujian tertutup.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada Dirjen Dikti yang telah memberikan Beasiswa Program Pascasarjana (BPPS) dan Tim Penelitian Hibah Pascasarjana serta Hibah Penelitian Program Doktor yang telah mendanai penelitian ini serta pimpinan dan staf Sekolah Pascasarjana, Fakultas Peternakan dan Program Studi Mayor Ilmu Nutrisi dan Teknologi Pakan atas penerimaan dan pelayanan selama penulis mengikuti pendidikan program doktor pada Sekolah Pascasarjana IPB. Ucapan yang sama juga penulis sampaikan kepada Dekan Fakultas Peternakan dan Rektor Universitas Jambi (Univ. Jambi) yang telah memberikan kesempatan kepada saya untuk mengikuti pendidikan program doktor di IPB.
Teknologi Pakan yang tidak bisa disebutkan satu persatu yang telah bahu-membahu selama studi di IPB.
Dorongan Moril dan Materiil sangat penulis rasakan dari keluarga, oleh karena itu penulis mengucapkan terima kasih setinggi-tingginya kepada Ayahnda Karyomo dan Ibunda tercinta Sukinem serta Bapak dan Ibu mertua Bimo Sukarno dan Suwarni serta saudaraku (Kasinem, Paino, Paimun, Warno, Paikem dan Suyadi, S.Ag). Ucapan yang sama juga penulis sampaikan kepada Kel. Sunyoto, keluarga Kasdi, keluarga Eko Bekti Purwanto, keluarga Agus Wiyanto dan keluarga Siti Rahayu, keluarga H. Nawawi, keluarga Hari Sunarto, Keluarga Syarief serta keluarga besar RW 09 Yasmin 6 yang banyak membantu selama studi di IPB.
Akhirnya kepada istri tercinta Titik Suci Prihati (Titik), anakku tersayang Adelina Sekar Sucialma (Alma) dan Anisa Nur Fitriyatno (Anisa), penulis ucapkan terima kasih atas segala dorongan, semangat, kesabaran dan pengorbanan yang kalian berikan selama studi di IPB, mudah-mudahan semua itu menjadikan kita keluarga sakinah mawaddah warahmah. Akhir kata, penulis berharap tulisan ini bisa memberikan manfaat dalam perkembangan industri peternakan, khususnya pakan unggas pada saat ini maupun yang akan datang.
Bogor, Agustus 2009
Yatno
Penulis dilahirkan pada tanggal 01 September 1968 di Desa Ngungking Kecamatan Wuryantoro Kabupaten Wonogiri Propinsi Jawa Tengah, anak ke-enam dari tujuh bersaudara pasangan dari Bapak Karyomo dan Ibu Sukinem. Menikah dengan Titik Suci Prihati pada tanggal 10 Juli 2000 dan alhamdulillah dikaruniai dua orang putri; Adelina Sekar Sucialma (Alma) yang lahir pada tanggal 30 April 2001 di Jambi dan Anisa Nur Fitriyatno (Anisa) lahir di Bogor pada tanggal 1 Desember 2008.
DAFTAR TABEL ………... xvi
Kelapa Sawit dan Hasil Sampingnya ………... BIS dan Teknologi Pengolahannya sebagai Pakan Ternak …….. Kacang Kedelai dan Hasil Sampingnya ……… Sifat Fisiko-kimia Bungkil Inti Sawit dan Bungkil Kedelai …... Struktur, Sifat dan Klasifikasi Protein ….………. Isolasi, Ekstraksi dan Pembuatan Konsentrat Protein…..……….. Puyuh dan Kebutuhan Nutrisinya……… Retensi Protein dan Energi Metabolis ……….. Organ Hati dan Usus Halus pada Unggas ……… Perkembangan Penelitian tentang Isolasi dan Ekstraksi Protein sebagai Konsentrat Protein ………
III. FRAKSINASI DAN SIFAT FISIKO-KIMIA BUNGKIL INTI SAWIT ……….. IV. ISOLASI PROTEIN BUNGKIL INTI SAWIT MENGGUNAKAN
METODE EKSTRAKSI BERTINGKAT ..
48 V. KUALITAS KIMIA DAN BIOLOGI KONSENTRAT PROTEIN
Lanjutan ………..
VI. PENGGUNAAN KONSENTRAT PROTEIN BUNGKIL INTI SAWIT TERFORTIFIKASI (BISPLUS) DALAM RANSUM TERHADAP PERFORMA DAN PRODUKSI TELUR PUYUH
83
Pendahuluan ………. Materi dan Metode …...………. Hasil dan Pembahasan. ………. Kesimpulan ………
83 84 88 107
VII. PEMBAHASAN UMUM………. 108
VIII. KESIMPULAN UMUM ……….……….. 117
IX. DAFTAR PUSTAKA ……… 118
DAFTAR TABEL
2. Komposisi zat makanan hasil samping tanaman dan pengolahan buah sawit ………
9
3. Kandungan protein dan asam amino bungkil inti sawit ………….. 11 4. Kandungan protein dan asam amino bungkil kedelai ……….. 13 5. Kandungan nutrisi bungkil kedelai dari berbagai negara asal ……. 14 6. Sifat fisikokimia bungkil inti sawit dan bungkil kedelai ………… 15 7. Klasifikasi asam amino berdasarkan polaritas relatif gugus
R-nya………. 18
8. Pengaruh cara ekstraksi terhadap kandungan total gula ………… 20 9. Pengaruh cara ekstraksi terhadap kandungan dan rasio komponen
gula yang dideteksi dengan HPLC yang dilengkapi Carbohydrate column ………..
20
10. Kandungan bahan kering dan komposisi proksimat konsentrat protein daun dari Azolla africana Desv dan duckweed (Spirodela polyrrhiza L. Schleiden) ………..
24
11. Kandungan asam amino esensial konsentrat protein daun dari berbagai bahan ……….
25
12. Komposisi kimia pollard yang telah mengalami ekstraksi (konsentrat pollard) dan pollard awal ………..
26
13. Kebutuhan nutrisi puyuh berbagai fase umur ……….. 28 14. Perkembangan penelitian tentang isolasi dan ekstraksi protein
sebagai konsentrat protein ………..
36
15. Komposisi kimia bungkil inti sawit pada beberapa ukuran saringan ………
41
16. Sifat fisik dan kimia bungkil inti sawit dan bungkil kedelai ……... 43 17 Kandungan protein kasar dan asam amino bungkil inti sawit dan
bungkil kedelai ………. 46
18. Kandungan protein kasar konsentrat protein BIS hasil ekstraksi tunggal dan bertingkat ……….
56
19. Berat endapan hasil ekstraksi bertingkat (air:NaOH 0.05N) menggunakan bahan pengendap etanol berbagai konsentrasi dari 100 gram BIS ………...
Lanjutan ………
20 Rataan kandungan protein kasar, jumlah rendemen dan protein
recovery konsentrat protein BIS berbagai perlakuan ekstraksi…
59
21. Kandungan protein dan asam amino BIS, konsentrat protein BIS dan bungkil kedelai ……….
65
22. Komposisi bahan dan kandungan nutrisi ransum perlakuan ... 73 23. Rataan retensi protein pada ransum konsentrat protein bungkil
inti sawit, ransum bungkil inti sawit dan ransum bungkil kedelai pada puyuh ………..
79
24. Rataan konsumsi dan ekskresi energi dan energi metabolis ransum ransum konsentrat protein bungkil inti sawit, ransum bungkil inti sawit dan ransum bungkil kedelai pada puyuh ………
82
25. Susunan ransum penelitian (%) ……….. 86 26 Kandungan zat makanan ransum penelitian (%) ………. 86 27. Skor lesio usus halus dan hati puyuh umur 55 hari di bawah
mikroskop ………
91
28. Rataan konsumsi ransum, konsumsi protein, bobot badan akhir, pertambahan bobot badan, konversi ransum dan protein eficiency ratio pada puyuh umur 21- 41 dan 42-55 hari ………
98
29. Umur induk mulai bertelur, bobot telur pertama danm produksi telur sampai umur 55 hari ………
103
30. Rataan bobot telur, persentase kuning telur, putih telur, cangkang dan indeks warna kuning telur puyuh sampai umur 55 hari …...
105
DAFTAR GAMBAR
Halaman 1. Kerangka penelitian isolasi protein bungkil inti sawit dan kajian
nilai biologinya sebagai alternatif bungkil kedelai pada puyuh …..
5
2. Profil buah sawit dan lapisan penyusunnya ………. 7
3. Buah sawit utuh dan bagian dalamnya ……….……. 7
4. Brondolan buah sawit yang sudah masak ……….. 7
5. Proporsi hasil pengolahan buah sawit menjadi minyak sawit ….. 9
6. Proses pembuatan bungkil kedelai ……….. 12
7. Visualisasi bungkil inti sawit dan bungkil kedelai ………. 15
8. Struktur umum asam amino pada protein ……….. 16
9. Struktur asam amino dan pembentukan ikatan peptida …………. 17
10. Diagram alur ekstraksi protein Rosa rubiginosa dengan membran ultrafiltrasi ………. 23 11. Diagram alur pembuatan konsentrat protein tepung kembang matahari ……….. 24 12. Diagram alur penyiapan protein konsentrat dari mucuna bean …. 25 13. Modifikasi vibrator ball mill pada proses fraksinasi BIS ………... 38
14. Alur proses ekstraksi BIS tunggal (ET1 s/d ET4 ………. 54
15. Alur proses ekstraksi BIS bertingkat (EB1 s/d EB4) ………. 55
16. Alur proses ekstraksi BIS bertingkat (E1 s/d E4) ……… 56
17. Titik isoelektrik protein bungkil inti sawit ……….. 61 18. Profil fraksi protein dan polisakarida mannan hasil ekstraksi BIS
pada kromatografi filtrasi gel Sephadex G-50……….. 63
19 Kandungan asam amino esensial (AAE) dan non esensial (AANE) bungkil inti sawit (BIS), konsentrat protein BIS dan bungkil kedelai (BKD)……….
67
20. Profil asam amino esensial konsentrat protein bungkil inti sawit (KPBIS), bungkil inti sawit (BIS), bungkil kedelai (BKD) dan telur ………..
68
21. Profil nilai IAAE BIS, konsentrat protein BIS dan bungkil kedelai (BKD) dibandingkan dengan putih telur……….
76
22. Rasio asam amino metionina, treonina, arginina dan lisina konsentrat protein BIS, bungkil inti sawit (BIS), bungkil kedelai (BKD) dibandingkan telur………...
78
23. Profil asam amino esensial konsentrat protein BIS sebelum fortifikasi (KPBIS) dan bungkil kedelai ……….
Lanjutan ………
24. Profil asam amino esensial konsentrat protein BIS setelah fortifikasi (BISPLUS) dan bungkil kedelai ………
90
25. Gambaran histopatologis duodenum puyuh umur 55 hari (perbesaran obyektif 10x) ………
93
26. Gambaran histopatologis jejunum puyuh umur 55 hari perbesaran obyektif 20x) …...
94
27. Gambaran histopatologis ileum puyuh umur 55 hari (perbesaran obyektif 20x) ……….
96
28. Gambaran histopatologis hati puyuh umur 55 hari (perbesaran obyektif 10x) ………
97
29. Bungkil inti sawit dan cangkang hasil penyaringan manual... 109 30. Diagram alur proses ekstraksi bertingkat pembuatan konsentrat
protein dari bungkil inti sawit ………. 110
31. Konsentrat protein BIS hasil ekstraksi dan bungkil kedelai ……… 111 32. Konsentrat protein BIS terfortifikasi “BISPLUS” dan bungkil inti
sawit ……….
DAFTAR LAMPIRAN
Halaman 1. Hasil ANOVA dan uji kontras ortogonal bobot badan awal
puyuh petelur (gram) ……… 128
2. Hasil ANOVA dan uji kontras ortogonal rataan skor lesio
duodenum puyuh umur 55 hari……….. 128
3. Hasil ANOVA dan uji kontras ortogonal rataan skor lesio jejunum
puyuh umur 55 hari……….. 129
4. Hasil ANOVA dan uji kontras ortogonal rataan skor lesio ileum
puyuh umur 55 hari……….….. 129
5. Hasil ANOVA dan uji kontras ortogonal rataan skor lesio hati
puyuh umur 55 hari……….. 130
6. Hasil ANOVA dan uji kontras ortogonal konsumsi pakan puyuh petelur umur 41 hari (gram) ……….. 130 7. Hasil ANOVA dan uji kontras orthogonal konsumsi pakan
puyuh petelur umur 55 hari (gram) ……….. 131 8. Hasil ANOVA dan uji kontras orthogonal konsumsi protein
puyuh petelur umur 41 hari (gram) ……….. 131 9 Hasil ANOVA dan uji kontras ortogonal pertambahan bobot
badan puyuh petelur umur 41 hari (gram) ……….. 132 10. Hasil ANOVA dan uji kontras ortogonal pertambahan bobot
badan puyuh petelur umur 55 hari (gram)………... 132 11. Hasil ANOVA dan uji kontras ortogonal konversi pakan
puyuh petelur umur 41 hari ………. 133 12. Hasil ANOVA dan uji kontras ortogonal konversi pakan
puyuh petelur umur 55 hari ………. 133 13. Hasil ANOVA dan uji kontras ortogonal PER puyuh umur 41
hari ………. 134
14. Hasil ANOVA dan uji kontras ortogonal bobot badan puyuh
petelur umur 41 hari (gram)………... 134 15. Hasil ANOVA dan uji kontras ortogonal bobot badan puyuh
petelur umur 55 hari (gram) ……….. 135 16 Hasil ANOVA dan uji kontras ortogonal umur induk pertama
kali bertelur (hari) ………….………. 135 17. Hasil ANOVA dan uji kontras ortogonal berat telur pertama
kali (gram) ……… 136
18. Hasil ANOVA dan uji kontras ortogonal rataan berat telur
Lanjutan ……….
19. Hasil ANOVA dan uji kontras ortogonal bobot relatif kuning
telur puyuh (%)………... 137
20. Hasil ANOVA dan uji kontras ortogonal bobot relatif putih
telur puyuh (%) ..……… 137
21. Hasil ANOVA dan uji kontras ortogonal bobot relatif
cangkang telur puyuh (%) ………..………….. 138 22. Hasil ANOVA dan uji kontras ortogonal indeks warna kuning
telur ……… 138
23. Teknik pembuatan preparat histologi usus dan hati ………. 139 24. Teknik pewarnaan preparat histologi dengan zat warna
hematoksilin dan eosin ………. 140 25. Persamaan regresi antara jumlah HCl 0.1N yang ditambahkan
pada ekstrak BIS untuk mencapai titik isoelektrik ……… 141 26. IAAE, nilai biologis, skor kimia dan asam amino pembatas pada
Penyediaan pakan ternak unggas di Indonesia saat ini masih mengalami kendala, satu diantaranya adalah masih tingginya komponen penyusun ransum berupa pakan import. Tentu saja hal ini secara langsung berimplikasi terhadap tingginya harga pakan pada tataran konsumen. Sampai saat ini sekitar 80% dari seluruh komponen penyusun ransum unggas merupakan produk import seperti,
corn gluten meal (CGM), bungkil kedelai, meat bone meal (MBM) dan tepung ikan. Bungkil kedelai sampai saat ini masih merupakan komponen utama sumber protein nabati pada pakan unggas di Indonesia.
Kondisi demikian diperlukan upaya untuk mencari pakan sumber protein lain sebagai alternatif bungkil kedelai pada ransum unggas. Bahan pakan tersebut disyaratkan tersedia secara kontinyu, produksinya terkonsentrasi pada suatu tempat dan secara sosial dapat diterima oleh masyarakat. Salah satu bahan pakan tersebut adalah bungkil inti sawit (palm kernel meal) yang merupakan hasil samping agroindustri pengolahan inti sawit (kernel meal) menjadi minyak sawit (palm kernel oil).
Indonesia, Malaysia dan Nigeria merupakan 3 negara didunia yang memproduksi sekitar 84% minyak kelapa sawit dunia. Luas area perkebunan kelapa sawit di Indonesia pada tahun 2008 diperkirakan 7 juta hektar dengan total produksi minyaknya mencapai 18.1 juta ton (Dirjen Perkebunan 2008) dan BIS diperkirakan tersedia sekitar 1.3 juta ton per tahun.
demikian akan mengurangi kualitas protein, sehingga merendahkan penggunaan BIS dalam ransum. Beberapa peneliti melaporkan bahwa retensi nitrogen ransum yang mengandung BIS pada broiler sebesar 45.2% (Ramli et al. 2008) dan 57.9% (Ezieshi & Olomu 2008). Oleh karena itu perlu upaya perbaikan kualitas gizi BIS dengan cara mengurangi faktor pembatas, sehingga secara bersamaan dapat meningkatkan jumlah dan kualitas proteinnya.
Teknologi ekstraksi untuk mengisolasi kandungan protein bahan merupakan cara yang menjanjikan, karena dapat memisahkan protein dari komponen lainnya sehingga terjadi optimalisasi penggunaan BIS sebagai sumber protein. Beberapa peneliti melaporkan bahwa ekstraksi protein tanaman menggunakan larutan alkali mampu mengisolasi protein sebesar 45% pada buah tomat (Liadakis et al. 1995) dan 64% pada jojoba meal (Nabetani et al. 1995), sedangkan Moure et al. (2001) melaporkan bahwa ekstraksi protein dari tanaman Rosa rubiginosa dengan menggunakan alkali lebih efektif dibandingkan menggunakan asam dan protein yang terambil mencapai 80-88%.
Pada teknologi ekstraksi dinding sel BIS akan dihancurkan, sehingga protein (yang ada didalam sel maupun yang terikat pada dinding sel) dapat terekstrak secara optimal dan dengan teknik pengendapan diharapkan dapat diperoleh rendemen dan protein recovery seoptimal mungkin. Selanjutnya setelah diperoleh produk endapan sebagai “konsentrat protein BIS” maka dilakukan fortifikasi guna memperbaiki kualitas protein yang akan setara dengan bungkil kedelai, sehingga konsentrat protein BIS yang telah difortifikasi tersebut dapat diandalkan sebagai pengganti bungkil kedelai.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mengisolasi protein bungkil inti sawit dan mengkaji nilai biologinya sebagai alternatif bungkil kedelai pada puyuh.
Adapun tujuan khusus yang akan dicapai pada penelitian ini adalah untuk mengetahui ;
1. Sifat fisik dan kimiawi BIS dan bungkil kedelai
2. Metode ekstraksi bungkil inti sawit terbaik dalam mengisolasi protein. 3. Sifat kimia dan biologi konsentrat protein BIS hasil ekstraksi terbaik
4. Penggunaan konsentrat protein BIS terfortifikasi (BISPLUS) pada ransum terhadap performa puyuh.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi khususnya kepada praktisi dan pihak industri pakan ternak tentang ;
1. Peningkatan manfaat BIS sebagai komponen pakan unggas
2. Adanya teknologi ekstraksi protein BIS dalam memperoleh pakan sumber protein lokal yang dapat diandalkan sebagai alternatif bungkil kedelai, sehingga tidak selalu tergantung dari bahan baku import
3. Sumbangan pada kemajuan ilmu pengetahuan guna memacu para peneliti untuk menggunakan metode ekstraksi pada pakan sumber protein yang lain 4. Memberi masukan kepada pemerintah dalam hal kebijakan di bidang pakan
tentang pemanfaatan bahan baku sumber protein lokal sebagai pengganti bungkil kedelai dalam upaya mendukung ketahanan pakan nasional.
Kerangka Penelitian
daya lokal yang cukup prospektif dijadikan sebagai sumber protein alternatif bungkil kedelai.
Upaya yang dapat dilakukan adalah dengan melakukan eksplorasi bahan balu pakan lokal yang bisa dijadikan sumber protein. Salah satu bahan tersebut adalah bungkil inti sawit dengan cara membuat konsentrat protein melalui teknologi ekstraksi yang mengkombinasikan metode fisiko-kimia. Sejauh ini belum ada penelitian sejenis ke arah itu.
Gambar 1 Kerangka penelitian isolasi protein bungkil inti sawit dan kajian nilai biologinya sebagai alternatif bungkil kedelai pada puyuh
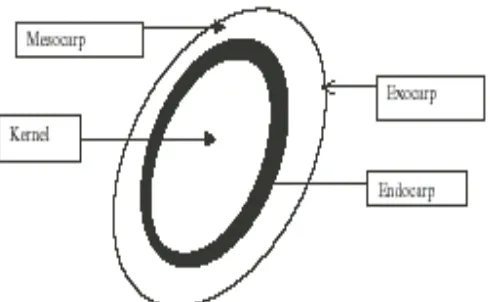
Menurut FAO (2006), tanaman kelapa sawit awal mulanya berasal dari Afrika Barat dan selanjutnya menyebar ke berbagai negara termasuk Indonesia. Tanaman tersebut mulai dipanen pada umur 3.5–4.5 tahun, umur ekonomis 25 tahun, setiap pohon terdapat sekitar enam tandan buah yang tumbuh dan masak secara berurutan, setiap tandan mengandung 250–600 buah berbentuk brondolan, setiap tandan buah beratnya 10–40 kg sekitar 60-65% berupa brondolan. Buah sawit terdiri dari 4 bagian, antara lain pada bagian paling luar disebut lapisan
eksocarp, bagian daging buah disebut mesocarp, bagian tempurung/cangkang/shell disebut endocarp dan bagian inti disebut kernel.
Kelapa sawit adalah salah satu komoditi non migas andalan Indonesia yang menempati nomor 2 terbesar di dunia setelah Malaysia. Menurut laporan Lembaga Oil World, lembaga penyedia jasa informasi dan perkiraan produksi minyak nabati berbasis di Hamburg, Jerman memproyeksikan, produksi minyak sawit Indonesia akan melebihi Malaysia pada tahun 2010 dengan produksi 12 293 juta ton, sedangkan Malaysia sekitar 11 052 juta ton. Hal ini disebabkan karena Malaysia mengalami kendala terbatasnya lahan, sehingga hanya bisa dapat meningkatkan produksinya melalui intensifikasi, sedangkan Indonesia masih dapat meningkatkan produksinya melalui intensifikasi dan ekstensifikasi. Dengan demikian Malaysia dan Indonesia merupakan produsen utama minyak sawit dunia, Malaysia dengan tingkat pertumbuhan 7.47% telah memenuhi 51.54% produksi minyak sawit dunia, sedangkan Indonesia dengan tingkat pertumbuhan 11.64% mensuplai 29.32% produksi minyak sawit dunia, sehingga 80.86% seluruh minyak sawit dunia berasal dari Malaysia dan Indonesia (Dja’far & Wahyono 2003). Secara umum terdapat 2 metode dalam menghasilkan minyak sawit, yaitu menggunakan mesin ekspeller dan ekstraksi menggunakan pelarut organik (Sundu & Dingle 2000). Buah sawit disusun oleh beberapa lapisan mulai dari lapisan paling luar sampai dengan bagian intinya (Gambar 2, 3 dan 4).
Gambar 2 Profil buah sawit dan lapisan penyusunnya.
Gambar 3 Buah sawit utuh dan bagian dalamnya.
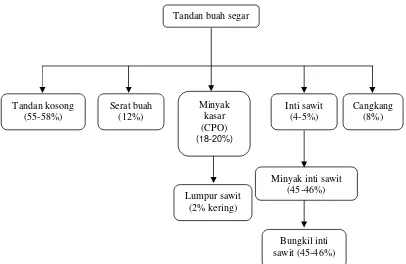
Menurut Dirjen Perkebunan (2008) perkiraan total luas areal kelapa sawit tahun 2008 sebesar 7 007 876 ha dan luas areal produktif sebesar 4 953 382 ha dengan produksi minyak sawit mencapai 18 089 503 ton (Tabel 1). Selain itu juga diperoleh hasil samping berupa bungkil inti sawit, lumpur sawit dan serabut sawit yang berpotensi sebagai pakan ternak masing-masing sebesar 1.3, 2.5 dan 6 juta ton/tahun. Berdasarkan wilayah diketahui bahwa Pulau Sumatera merupakan penyumbang terbesar CPO yaitu 14 091 007 ton (77. 89%) diikuti masing-masing oleh Kalimantan (17.87%), Sulawesi (3.18%), Maluku dan Papua (0.76%) serta Jawa (0.30%).
Tabel 1 Luas areal dan produksi minyak sawit di Indonesia tahun 2008
Wilayah Luas total area (ha) Luas area produktif (ha)
Produksi CPO (ton)
Sumatera 4 895 022 3 702 863 14 091 007 (77.8)
Jawa 26 619 16 090 53 601 (0.30)
Kalimantan 1 819 788 1 023 336 3 232 832 (17.87)
Sulawesi 206 875 165 345 574 998 (3.18)
Maluku+Papua 59 572 45 748 137 065 (0.76)
Indonesia 7 007 876 4 953 385 18 089 503
Sumber: Dirjen Perkebunan (2008). angka didalam kurung merupakan persentase nasional
Tabel 1 memperlihatkan bahwa produksi minyak sawit di Indonesai cukup tinggi, maka bersamaan dengan itu dihasilkan bungkil inti sawit tinggi juga. Hal ini merupakan potensi yang cukup menjanjikan sebagai pakan ternak bila dimanfaatkan dengan baik. Hem et al. (2008) melaporkan bahwa buah kelapa sawit menghasilkan dua macam minyak sawit yaitu crude palm oil (CPO), berwarna merah yang dihasilkan dari ekstraksi buah kelapa sawit bagian luar/serat sawit dan digunakan sebagai minyak makan. Selain itu juga dihasilkan
Tabel 2 Komposisi zat makanan hasil samping tanaman dan pengolahan buah sawit
Zat Makanan (%)
Hasil samping tanaman kelapa sawit Daun BIS (bungkil inti sawit), TBK (tandan buah kosong)
Proses pengolahan buah sawit menjadi minyak sawit akan menghasilkan by product berupa lumpur sawit, bungkil inti sawit dan serabut sawit yang berpotensi sebagai pakan ternak (Gambar 5).
BIS dan Teknologi Pengolahannya sebagai Pakan Ternak
Aritonang (1986) menyatakan beberapa hasil olahan kelapa sawit yang paling banyak digunakan sebagai pakan ternak antara lain minyak sawit (CPO) terutama yang kualitasnya rendah seperti Palm Stearin (PS) dan juga berupa hasil ikutan yaitu Bungkil Inti Sawit (BIS). Mengingat beberapa keterbatasan yang dimiliki oleh BIS sebagai pakan ternak unggas, maka beberapa peneliti telah melakukan upaya perbaikan kualitas dengan menerapkan teknologi tertentu. Menurut Simanjuntak (1998) fermentasi dapat meningkatkan zat makanan bahan berkualitas rendah dan berfungsi sebagai salah satu cara pengolahan dalam rangka pengawetan bahan, serta cara untuk mengurangi bahkan menghilangkan zat racun yang terkandung pada suatu bahan.
Penggunaan BIS pada unggas telah dilaporkan beberapa peneliti antara lain Kamal (1984) melaporkan bahwa pemberian sebanyak 10–20% pada pakan ayam pedaging dapat meningkatkan berat badan. Penggunaan 6% BIS dapat menggantikan 6% bungkil kelapa Widjaja (1986). Sabrina (2001) melaporkan bahwa BIS yang difermentasi dengan kapang Neurospora sitophila dapat diberikan pada ransum broiler sampai level 20% tanpa mengganggu penampilannya. BIS dalam ransum dapat digunakan hingga 10% tanpa mengganggu bobot badan, konsumsi dan konversi ransum (Jaelani 2007). BIS yang belum difermentasi maupun sudah difermentasi (FBIS) dapat digunakan 5% dalam pakan ayam pedaging dengan menghasilkan angka konversi yang lebih baik dari kontrol, serta tidak menyebabkan perbedaan persentase karkas ayam yang dihasilkan tetapi pemberian FBIS nyata menghasilkan lemak abdomen yang lebih rendah dibandingkan dengan BIS dan pakan kontrol (tidak menggunakan BIS maupun FBIS).
melaporkan bahwa penggunaan BIS sebanyak 30% tidak mempengaruhi pertambahan bobot badan, konversi ransum dan persentase karkas yang dihasilkan.
Tabel 3 Kandungan protein dan asam amino bungkil inti sawit Protein dan Asam Amino
Ket. 1) Laboratorium Makanan Ternak IPB (2008), 2) Hartadi et al. (1980) (Ekstraksi : a) mekanik,b) kimia), 3) Nwokolo et al. (1976)
Kacang Kedelai dan Hasil Sampingnya
Menurut Deptan (2004) luasan tanaman kedelai di Indonesia pada tahun 2003 sebesar 530 244 ha dengan produksi 677 531 ton (rata-rata 1.2 ton/ha). Kacang kedelai jarang digunakan sebagai ransum dalam bentuk mentah, karena mengandung anti tripsin yang dapat mengganggu penyerapan beberapa asam amino, namun zat antinutrisi tersebut akan berkurang atau bahkan hilang dengan pemanasan yang tepat. Kandungan protein dan minyak yang dihasilkan pada kacang kedelai masing-masing sebesar 38 dan 20% (Leeson & Summers 2005).
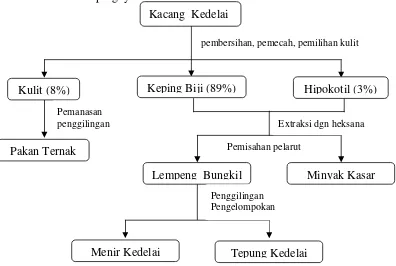
Bungkil kedelai mengandung semua asam amino essensial kecuali metionina, yang merupakan asam amino pembatas (McDonald et al. 2002). Pada ransum unggas, bungkil kedelai mensuplai sampai 50% protein dan sekitar 25% energi metabolis (Swick 2001). Gambar 6 disajikan proses pengolahan kacang kedelai dan hasil sampingnya.
Gambar 6 Proses pembuatan bungkil kedelai (Harris & Karmas 1989)
Menurut Sipos et al. (1983) bahwa proses pembuatan bungkil kedelai dimulai dengan membersihkan kedelai dari kedelai yang rusak dan bahan-bahan asing, kemudian dilakukan pemecahan sehingga kulitnya bisa terpisah. Kulit kedelai mengalami proses pemanasan (85-105 0C), dihaluskan dan dijual sebagai pakan. Kotiledon atau keping biji kedelai dipanaskan (60-65 0C) supaya lebih lunak untuk dipecah. Minyak dipisahkan dari pecahan keping kedelai dengan ekstraksi larutan heksana. Sisa dari pengolahan minyak kedelai adalah lempeng bungkil, yang kemudian menghasilkan tiga produk yaitu: bungkil kedelai, konsentrat protein kedelai dan isolat protein kedelai. Bungkil kedelai dihasilkan setelah pecahan keping kedelai mengalami pemisahan dan penghilangan pelarut heksana serta digiling.
Kacang Kedelai
pembersihan, pemecah, pemilihan kulit
Kulit (8%) Keping Biji (89%) Hipokotil (3%)
Parsons et al. (1991) melaporkan bahwa kualitas bungkil kedelai ditentukan oleh proses pengolahan dan juga ukuran partikel, pada pengolahan dengan ekstraksi menggunakan pelarut, kelarutan protein mencapai 77%, sedangkan semakin besar ukuran partikel kelarutannya semakin menurun, pada ukuran partikel 184, 251, 299 dan 556 µm mempunyai kelarutan protein masing-masing sebesar 89.6, 83.3, 81.6 dan 79.2%. Begitu juga semakin lama waktu autoclaf makin menurunkan kelarutan proteinnya. Tabel 4 disajikan kandungan protein dan asam amino pada bungkil kedelai berbagai sumber.
Tabel 4 Kandungan protein dan asam amino bungkil kedelai
Protein dan Asam Amino (%) 1 2 3
Protein 46.58 44.00 48.00
Metionina 0.53 0.62 0.75
Arginina 3.31 3.14 3.45
Treonina 1.62 1.72 1.88
Histidina 1.21 1.17 1.23
Isoleusina 2.26 1.96 1.92
Lisina 2.79 2.69 2.95
Ket. 1) Laboratorium Makanan Ternak IPB (2008) 2) NRC(1994) 3) Nwokolo et al. (1976) Angka dalam kurung menunjukkan persentase asam amino esensial terhadap protein
kasar
Kebutuhan bungkil kedelai Indonesia 54% dipasok oleh Brazil, 31% oleh AS, dan 10% oleh Argentina dan China. Saat ini ada lima Perusahaan Makanan Ternak (PMT) yang menggunakan subsidi impor bungkil kedelai, padahal Indonesia termasuk penghasil kelima terbesar kacang kedelai setelah Amerika Serikat, Cina, Brazil dan Rusia.
Tabel 5 Kandungan nutrisi bungkil kedelai dari berbagai negara asal
Zat Makanan Negara
USA Argentina Brazil India China Protein Kasar (%)
Bungkil kedelai mensuplai hampir 25% kebutuhan protein pada unggas. Tangendjaja (1997) melaporkan bahwa batas penggunaan bungkil kedelai untuk broiler dapat mencapai 41%. Hasil penelitian Agustin (1990) menunjukkan bahwa keuntungan bungkil kedelai sebagai penyusun ransum antara lain dapat meningkatkan kualitas protein dan efisiensi penggunaan ransum. Bungkil kedelai memiliki profil asam amino yang cukup baik sebagai penyusun ransum unggas,
namun memiliki metionina sebagai faktor pembatas asam amino (Lesson & Summer 2005).
Sifat Fisikokimia Bungkil Inti Sawit dan Bungkil Kedelai
Lebih lanjut dinyatakan bahwa keberhasilan teknologi pakan dalam hal homogenitas pengadukan pakan, laju aliran pakan dalam organ pencernaan, proses absorpsi dan kadar nutrisi semuanya terkait erat dengan sifat fisik bahan. Secara visual BIS dan bungkil kedelai berbeda warna maupun teksturnya. Biasanya warna BIS adalah coklat muda, sedangkan bungkil kedelai berwarna putih kekuningan (Gambar 7).
Gambar 7 Visualisasi bungkil inti sawit dan bungkil kedelai
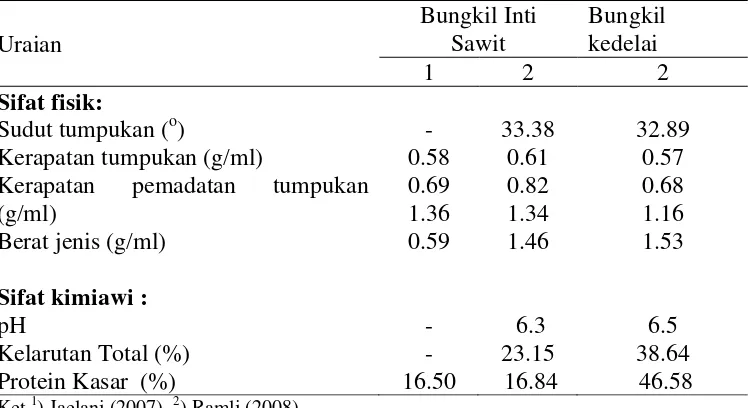
Terdapat minimal enam sifat fisik pakan yang penting diketahui yaitu berat jenis, kerapatan tumpukan, kerapatan pemadatan tumpukan, sudut tumpukan, daya ambang dan faktor higroskopis (Khalil 1999), sedangkan sifat kimiawi meliputi kelarutan dan tingkat keasamannya (Tabel 6).
Tabel 6 Sifat fisikokimia bungkil inti sawit dan bungkil kedelai
Uraian
Amaefule et al. (2009) melaporkan bahwa BIS mempunyai kandungan protein kasar 20.53%, lemak kasar 6.15% BETN dan energi bruto masing-masing sebesar 42.47 % dan 1 927 kkal/kg. Lebih lanjut dilaporkan bahwa bungkil inti
sawit mempunyai kecernaan bahan organik dan energi masing-masing sebesar 77.66 dan 78.83% pada ternak babi masa pertumbuhan. Semakin kecil ukuran partikel, maka nilai kerapatan tumpukan akan semakin meningkat sehingga akan mengurangi volume ruang penyimpanan (Syarief & Irawaty 1993). Niro (2005) menambahkan bahwa bahan yang memiliki nilai kerapatan tinggi akan menghemat biaya pengeluaran untuk pengemasan dan penyimpanan bahan.
Struktur, Sifat dan Klasifikasi Potein
Protein merupakan suatu makromolekul kompleks yang tersusun dari rantai asam amino yang terikat melalui ikatan-ikatan peptida. Terdapat 20 macam asam amino yang membentuk badan dasar dari protein. Menurut McDonald et al.
(2002) semua asam amino yang ada pada protein mempunyai ciri yang sama (dua gugus fungsional yang penting) yaitu gugus karboksil (COOH) dan gugus amino (NH2) diikat pada atom karbon yang sama. Selain itu asam amino juga
mempunyai atom hidrogen, kadang-kadang gugus hidroksil (OH) dan belerang (S). Asam amino terdiri dari rantai karbon (radikal R), atom hidrogen (OH), belerang (S), serta gugus amino (NH2). Gambar 8 dan 9 disajikan struktur asam
amino dan pembentukan ikatan peptida.
COOH
H2N C H
R
Gambar 8 Struktur umum asam amino pada protein.
sedangkan asam amino yang lainnya tergolong diantara dua kelompok ekstrim ini.
Yu (2007) melaporkan bahwa kualitas protein, karakteristik degradasi, penggunaan dan ketersediannya tidak hanya ditentukan oleh jumlah total komposisi kimiawi protein, tetapi juga ditentukan struktur intrinsik protein seperti struktur protein skunder (alfa helix, beta sheet dan rasio keduanya) dan komponen matrik biologi (protein yang berhubungan dengan pati atau protein yang berhubungan dengan matrik karbohidrat). Sifat asam amino berdasarkan kelarutan, yaitu larut dalam pelarut polar seperti air dan etanol, tetapi tidak larut dalam pelarut non polar atau sebaliknya, serta mempunyai titik didih yang tinggi yaitu sekitar 200oC (Lehninger 1993). Ke-20 asam amino mempunyai struktur umum yang sama kecuali prolin yang tidak mempunyai gugus R seperti asam amino lainnya (Tabel 7).
O H H
C C N
OH R H
Gugus karboksil
Rantai cabang
Gugus amino
O H H O H H H2O O H O H H
C C N C C N Sintesis,
hidrolisis C C N C C N
OH R H OH R H H2O OH R H R H
Ikatan peptida
Gambar 9 Struktur asam amino dan pembentukan ikatan peptida.
struktur protein ini, maka protein lebih peka terhadap peranan enzim pencernaan, asam klorida juga berfungsi untuk mengkonversi precursor enzim pepsinogen yang tidak aktif menjadi enzim pepsin. Segera setelah isi lambung masuk dalam duodenum, hormon intestin (pankreozymin) merangsang sel-sel pankreas untuk melepaskan enzim-enzim yang merupakan pelengkap enzim-enzim proteolitik dan enzim-enzim lain yang diperlukan untuk pencernaan karbohidrat dan lemak. Asam amino arginina merupakan precursor untuk pembentukan beberapa zat seperti protein, urea, creatin, polyamin, NO, prolina, glutamat, protein turnover, sintesis indogenus dan pakan. Tabel 7 menyajikan klasifikasi asam berdasarkan polaritas relatif gugus R-nya.
Tabel 7 Klasifikasi asam amino berdasarkan polaritas relatif gugus R-nya Gugus
Sumber : Lehninger (1993), 1) asam amino mengandung S, 2) asam amino aromatik
Isolasi, Ekstraksi dan Pembuatan Konsentrat Protein
Isolasi dan Ekstraksi Protein
terbentuknya emulsi dan stabil secara kimia. Ada dua syarat agar pelarut dapat digunakan dalam proses ekstraksi, yaitu: (1) pelarut tersebut merupakan pelarut terbaik untuk bahan yang akan diekstraksi, (2) pelarut tersebut harus terpisah setelah pengocokan. Oleh karena pelarut yang digunakan harus yang terbaik, maka dalam proses ekstraksi dikenal adanya istilah ”all or nothing”, yaitu terekstrak seluruhnya atau tidak sama sekali (Winarno et al. 1973)
Ekstraksi protein merupakan proses pemisahan atau pemindahan protein dari komponen lain pada suatu bahan yang bertujuan untuk mendapatkan protein sebanyak mungkin agar dapat memanfaatkan protein tersebut secara optimal khususnya sebagai komponen pada pakan ternak. Proses ekstraksi merupakan tahap awal yang sangat menentukan untuk melakukan penelitian tentang protein atau enzim tertentu. Sedangkan fortifikasi adalah proses memperkuat atau melengkapi suatu bahan dengan bahan yang lain.
Menurut Lehninger (1993) pola kelarutan protein pada umumnya sangat tinggi pada pH ekstrim (keadaan basa dan sangat asam). Oleh karena itu pakan sumber protein yang akan dipisahkan proteinnya terlebih dahulu dilarutkan dengan menggunakan larutan yang relatif basa dan kemudian diendapkan sampai tercapai titik isoelektrik, yaitu pada pH dimana kelarutan protein paling rendah. Titik isoelektrik (isoelectric point/pI) suatu asam amino adalah pH dimana asam amino tidak mempunyai selisih muatan dan karena itu tidak bergerak dalam medan listrik. Sebagian besar protein hasil ekstraksi berdasarkan studi yang dilakukan mengendap pada pH antara 4 dan 5 (Pirie 1987).
Tabel 8 Pengaruh cara ekstraksi terhadap kandungan total gula*
Perlakuan Total Gula (mg) % manosa yang dihasilkan
Akuades 1 353.6c±119.8 2.49
Sumber : Tafsin (2007), *) dihasilkan dari ekstraksi 100 g BIS
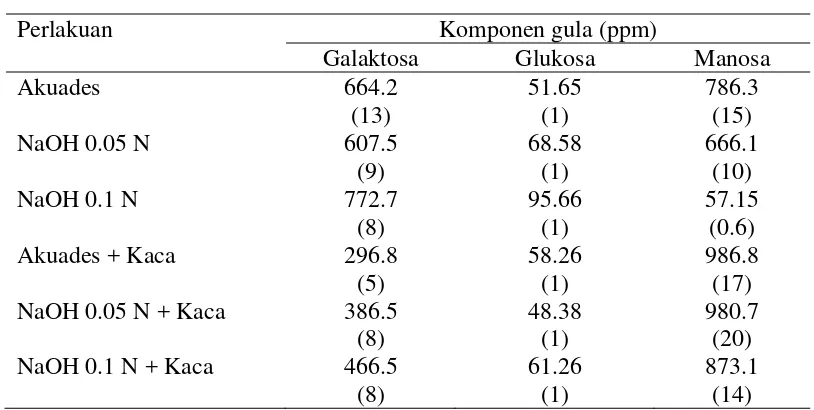
Tabel 9 Pengaruh cara ekstraksi terhadap kandungan dan rasio komponen gula yang dideteksi dengan HPLC yang dilengkapi Carbohydrate column
Perlakuan Komponen gula (ppm)
Galaktosa Glukosa Manosa
Sumber : Tafsin (2007), angka dalam kurung menunjukkan rasio komponen gula terhadap glukosa
Beberapa metode bisa digunakan untuk memisahkan protein antara lain elektroforesis yaitu pemisahan protein berdasarkan tanda dan muatan listrik pada gugus R dan gugus terminal amino dan karboksil yang bermuatan (Lehninger 1993 & Bailey 1990). Lebih lanjut dinyatakan bahwa setiap pH tertentu suatu campuran protein akan mengandung beberapa gugus yang bermuatan total negatif, beberapa yang bermuatan total positif dan beberapa yang tidak bermuatan. Jika campuran ini ditempatkan di dalam medan listrik, protein bermuatan positif akan bergerak menuju elektroda bermuatan negatif, dan protein bermuatan total negatif akan bergerak menuju elektroda bermuatan positif, serta protein yang
muatan yang relatif tinggi akan bergerak menuju elektroda secara lebih cepat dibandingkan dengan protein yang memiliki densitas muatan yang lebih rendah.
Harris & Angal (1989) melaporkan bahwa pemisahan protein dari komponen lain bisa dilakukan dengan menggunakan filtrasi gel yaitu dengan cara mengalirkan campuran mengandung protein ke dalam kolom yang mengandung butiran berpori yang amat kecil, terbuat dari polimer berhidrat tinggi. Metode ini berguna untuk pemisahan protein dalam volume yang kecil, molekul protein yang lebih kecil dapat menembus ke dalam pori-pori butiran, tetapi molekul protein besar tidak dapat menembus ke dalam butiran dan melewati kolom dengan lebih cepat. Protein berukuran menengah akan mengalir ke bawah pada kecepatan antara, tergantung pada kemampuan menembus butiran.
Pengendapan protein juga dapat dilakukan dengan pengaturan pH dan suhu serta penggunaan pelarut organik. Protein akan menjadi bermuatan negatif atau positif jika pH medium dinaikkan di atas atau diturunkan dibawah titik isoelektriknya. Pada pH yang rendah terjadinya penambahan proton dari gugus amida, sehingga bermuatan positif, sedangkan pada pH yang tinggi mempunyai muatan negatif, karena gugus karboksil pada protein backbone kehilangan proton. Pada titik isoelektrik, protein tidak mempunyai muatan dan solubilitasnya rendah karena protein tidak mampu berinteraksi dengan medium dan kemudian mengendap ke dalam larutan (Scope 1982, Harris & Angal 1989). Dengan demikian merubah pH dari larutan yang mengandung protein akan dapat menyebabkan pengendapan sebagian protein. Pengaturan suhu juga dapat digunakan untuk mengisolasi protein, dimana pengaturan suhu tergantung dari jenis proteinnya karena penyusun protein mempunyai suhu dan pH yang berbeda-beda.
Penggunaan pelarut organik dapat menurunkan kelarutan protein. Penurunan kelarutan tersebut disebabkan oleh pengaruh turunnya konstanta dielektrik dari medium (gaya tarik menarik diantara residu-residu yang bermuatan berlawanan akan naik, sehingga akan terbentuk suatu agregat yang besar yang kemudian mengendap dalam larutan) dan pengaruh dehidrasi (pelarut-pelarut organik ini harus juga larut dalam dan berinteraksi dengan air, sehingga akan terjadi juga dehidrasi).
Pembuatan Konsentrat Protein dan Suplementasi Asam Amino
Moure et al. (2001) melakukan ekstraksi dan isolasi protein dari biji
Rosa rubiginosa menggunakan larutan akuades dan NaCl 0.5M pada suhu 30– 60oC selama 90 menit. Langkah pertama sampel dicampur larutan akuades atau NaCl 0.5M pada suhu 35oC, pH 11 selama 90 menit, kemudian dilakukan penyaringan, filtrat yang diperoleh ditampung, kemudian residu ditambah lagi dengan larutan maupun waktu yang sama dengan sebelumnya, kemudian disaring lagi. Filtrat yang diperoleh dari kedua langkah tersebut diendapkan sebagai konsentrat protein (Gambar 10).
Ramli et al. (2008) melaporkan bahwa isolasi protein dari BIS dengan ekstraksi menggunakan pelarut air: NaOH 0.05N dan diendapkan dengan etanol 80% (1:1) menghasilkan rendemen sebesar 3%, kandungan protein kasar 42.92%. Sedangkan pada metode ekstraksi yang sama namun di tingkatkan konsentrasi NaOH menjadi 1 N dan menggunakan bahan pengendap HCl 0.1N pada titik isoelektrik (pH 4) menghasilkan rendemen sebesar 5.3%, kandungan protein 53.17% dan protein recovery 20.27% (Yatno et al. 2008). Pembuatan konsentrat dari pollard menggunakan air dan NaOH mampu menghasilkan protein sebesar 35.10% (Haryati & Tangendjaja 1993).
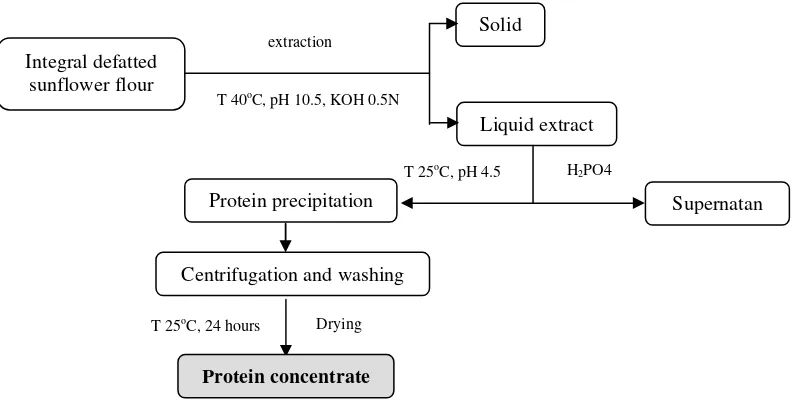
Ordonez et al. (2001) melaporkan bahwa pembuatan konsentrat protein dari tepung kembang matahari dengan cara mengesktrak menggunakan KOH 0.5N pada suhu 40oC, pH awal 10.5 serta diendapkan dengan H2PO4 0.5N suhu
25oC pada pH 4.5 menghasilkan protein tertinggi (71.50%) dibandingkan dengan pH lainnya (2.5, 3.5 dan 5.5) masing-masing sebesar 56.57, 60.15 dan 56.23% (Gambar 11) .
Akuades atau 0.5M NaCl+sampel
T=35oC , pH= 11, t= 90 mnt
Saring Residu +akuades atau
0.5 M NaCl Saring
Filtrat
Endapan Konsentrat Protein
Gambar 10 Diagram alur ekstraksi protein Rosa rubiginosa dengan membran Ultrafiltrasi (Moure et al. 2001)
T=35oC , pH= 11, t= 90 mnt
Adebowale & Lawal (2003) melaporkan bahwa pembuatan konsentrat protein dari Mucuna bean seeds (Mucuna pruriens) menggunakan akuades: NaOH 0.1M diatur pada pH 8 dan kemudian direaksikan dengan HCl 0.5M pada pH 4 serta disentrifugasi pada 5000xg selama 30 menit dapat meningkatkan protein dari 25.4 menjadi 78.3% (Gambar 12). Menurut Fasakin (1999) kualitas nutrisi konsentrat protein daun yang diekstraksi dari Azolla africana
Desv dan duckweed (Spirodela polyrrhiza L. Schleiden) menggunakan
waterbath pada suhu 80oC kemudian disentrifugasi mampu meningkatkan kandungan protein 3 kali lebih besar dibandingkan kandungan protein awal (Tabel 10).
Tabel 10 Kandungan bahan kering dan komposisi proksimat konsentrat protein daun dari Azolla africana Desv dan duckweed (Spirodela polyrrhiza L. Schleiden)
Bahan pakan
Sumber : (Fasakin 1999), BETN/bahan ekstrak tanpa nitrogen [100–(% protein kasar + serat kasar + lemak kasar + abu + kadar air)]
Gambar 12 Diagram alur penyiapan protein konsentrat dari mucuna bean
(Adebowale & Lawal 2003).
Pengolahan cassava secara mekanik dan dipanaskan pada suhu 80–90oC selama 10 menit mampu menghasilkan konsentrat protein dengan kandungan protein kasar sebesar 47 %, sedangkan serat kasar, lemak kasar, abu dan BETN masing-masing sebesar 2.0, 21.6, 7.8 dan 15.9% (Fasuyi & Aletor 2005) serta kandungan asam amino cukup baik (Tabel 11).
Tabel 11 Kandungan asam amino esensial konsentrat protein daun dari berbagai bahan (Sunflower flour protein concentrate), CLPC (Cassava leaf protein concentrate), CNPC (Cashew nut protein concentrate)
1 kg Mucuna flour
Mix flour with distilled water 1:10%(w/v).Adjust the pH to 8 with 01M NaOH. Stir continuously for 4 hrs,. While maintaining the pH at 8, centrifuge for 20 min at 3500 x g water and adjust the pH to 8. Stir for 2 hrs and centrifuge
Adjust the pH to 4 with 0.5M HCl, centrifuge for 30 min at 5000xg
Protein Whey
Suspend in distilled water and adjust pH to 4. Freeze dry
Pembuatan konsentrat protein selain bisa dilakukan dengan pengendapan pada titik isoelektrik juga dapat menggunakan ultrafiltrasi, seperti yang dilaporkan oleh Chew et al. (2003) bahwa proses pembuatan konsentrat protein dari lupin (Lupinus angustifolius) menggunakan metode ultrafiltrasi menghasilkan kandungan maupun kelarutan protein yang lebih tinggi dibandingkan dengan proses presipitasi pada titik isoelektrik namun mempunyai kecernaan zat makanan yang hampir sama.
Konsentrat protein hasil ekstraksi dari bungkil inti sawit (BISPRO) menggunakan ekstraksi kombinasi air:NaOH 0.05N dan diendapkan dengan etanol 80% (1:1) menghasilkan rendemen sebesar 3% dengan kandungan protein kasar 42.92% (Ramli et al. 2008). Sejalan dengan hal itu, Haryati & Tangendjaja (1993) melaporkan bahwa kelarutan protein terendah pada pollard gandum dicapai pada pH 4.0–5.5, teknik pengendapan protein dengan pemanasan pada suhu 55oC menghasilkan berat rata-rata protein terekstrak sebesar 18.3%, selain itu juga terjadi peningkatan kandungan protein dan penurunan NDF pada pollard yang diekstrak dengan air:NaOH (Tabel 12).
Tabel 12 Komposisi kimia pollard yang telah mengalami ekstraksi (konsentrat pollard) dan pollard awal
Zat Makanan Pollard awal Konsentrat Pollard
Sumber : Haryati dan Tangendjaja (1993)
menghasilkan produk dengan protein kasar sebesar 65%. Pembuatan konsentrat protein dari kacang-kacangan (Groundnut protein concentrate /GPC) menggunakan hidrogen peroksida dicapai titik isoelektriknya pada pH 4 dan kecernaan protein sebesar 71.00–92.10% serta terjadi penurunan beberapa asam amino seperti treonina, prolina, sistina, metionina dan triftopana (Lhekoronye 2006)
Suplementasi asam amino sintetis seperti lisina dan metionina dapat memperbaiki kualitas pakan dan penampilan unggas (Dari et al. 2005). Suplementasi asam amino treonina pada ransum puyuh umur 1–7 hari yang paling optimal adalah sebanyak 1.06% dengan menghasilkan angka konversi pakan sebesar 1.85 dan bobot badan sebesar 249.9 gram per ekor pada umur 35 hari (Baylan et al. 2006). Harm & Russel (2001) melaporkan bahwa suplementasi asam amino valina ke dalam ransum komersil layer sebesar 0.77% menghasilkan produksi telur 87.4%, berat telur 59.5 gram dan konsumsi pakan 94.4 gram/ekor/hari dan jika penggunaan valina diturunkan sampai 0.630% diikuti oleh menurunnya produksi telur (85.4%), berat telur (58.2%) dan konsumsi pakan (91.8 gram/ekor/hari).
Baker (2007) melaporkan bahwa 90% dari total produksi lisina didunia digunakan untuk suplementasi pada pakan ternak. Lebih lanjut dilaporkan bahwa antagonisme antara arginina dengan lisina menyebabkan arginase ginjal pada unggas. Pada ternak babi muda tidak terjadi pertumbuhan optimal jika pakan kekurangan asam amino arginina namun pada ternak yang dewasa asam amino tersebut bisa dibentuk dalam jaringan ginjal.
Puyuh (Coturnix coturnix japonica) dan Kebutuhan Nutrisinya
mencapai dewasa kelamin pada umur 5–6 minggu dengan bobot badan 100–140 gram. Puyuh betina dapat diidentifikasi dengan melihat bulu pada bagian leher dan dada yang warnanya lebih cerah, mulai bertelur pada umur 35 hari pada kondisi yang baik dan memproduksi sekitar 200–300 telur per tahun (Varghese 2007). Menurut Cowell (1997) puyuh akan mencapai dewasa kelamin pada umur 6 minggu dan akan segera memulai periode bertelur. Tabel 13 ditamplikan kebutuhan nutrisi puyuh berbagai fase umur.
Puyuh merupakan hewan yang memiliki saluran pencernaan yang dapat menyesuaikan diri terhadap kondisi lingkungan. Gizzard dan usus halus puyuh memberikan respons yang fleksibel terhadap ransum dengan kandungan serat kasar yang tinggi (Starck & Rahman 2003). Puyuh umur 35 hari dengan densitas pakan yang tinggi akan mengkonsumsi pakan lebih banyak dibandingkan dengan densitas pakan yang rendah pada umur yang sama (Atmamihardja et al. 1983). Djouvinov & Mihailov (2005) melaporkan bahwa pengurangan kandungan protein kasar pada ransum puyuh grower dan layer dengan kandungan asam amino tercerna yang tetap seimbang tidak berpengaruh terhadap performans.
Tabel 13 Kebutuhan nutrisi puyuh berbagai fase umur
Kebutuhan nutrisi Starter Grower Layer
Kadar Air maks. (%) 14 14 14
Protein Kasar (%) 24 20 22
Lemak Kasar (%) 2.8 2.8 3.96
Serat Kasar maks.(%) 4.5 5 6
Lisina (%) 1.15 1.1 0.86
Metionina (%) 0.4 0.35 0.3
Metionina+sistina (%) 0.8 0.7 0.656
Abu (%) 8 8 10
Ca (%) 0.8-1.0 0.8-1.0 3.25- 4.0
P total (%) 0.6 0.6 0.6
P tersedia (%) 0.4 0.4 0.4
Energi Metabolis (kkal/kg) 2 900 2 700 2 900
Retensi Protein dan Energi Metabolis
Retensi protein adalah sejumlah nitrogen dalam protein pakan yang mampu ditahan dan dipergunakan oleh tubuh (Sibbald & Wolynetz 1985). Protein memiliki peran penting dalam berbagai fungsi tubuh termasuk di dalamnya regenerasi dan menjaga fungsi sel dan jaringan tubuh, produksi hormon dan enzim, serta keseimbangan cairan tubuh (Radecki & Kim 2007). Tidak semua protein yang masuk dalam tubuh dapat diretensi, tergantung dari dari faktor genetik dan umur. Perhitungan retensi nitrogen adalah untuk mengetahui kualitas bahan pakan, dimana retensi nitrogen adalah jumlah konsumsi nitrogen dikurangi dengan ekskresi nitrogen dan nitrogen endogenous. Nitrogen indogenous menurut Sibbald & Wolynetz (1985) adalah nitrogen ekskreta yang berasal dari selain bahan pakan seperti peluruhan sel mukosa usus, empedu dan saluran pencernaan. Menurut Hill & Anderson dalam NRC (1994) bahwa jika nitrogen tidak diretensi maka akan muncul sebagian asam urat dengan nilai koreksi sebesar 8.22 kkal/kg retensi nitrogen, yaitu nilai energi yang dihasilkan ketika asam urat dioksidasi secara sempurna. Pengaturan ekskresi nitrogen pada bahan pakan mengandung tinggi protein adalah sebagai asam urat, N-amonia dan urea masing-masing sebesar 72.1, 10.8 dan 9.7% (Goldstein & Skadhauge 2000)
Davidson (2004) menyatakan bahwa asam amino merupakan bahan dasar penyusun protein yang terdiri dari karbon, hidrogen, oksigen, nitrogen, dan terkadang sulfur. Rantai panjang asam amino atau polipeptida membentuk kompleks senyawa protein. Urutan atau struktur asam amino menentukan struktur dan sifat kimiawi protein. Selain itu terkait dengan peran dan fungsinya dalam sintesis protein, enzim dan hormon, asam amino terlibat aktif secara luas dalam berbagai aktivitas tubuh.
Faktor yang mempengaruhi kualitas protein adalah imbangan asam amino dan ketersediaan biologisnya (Gallagher 1997). Bioavailability atau ketersediaan biologis merupakan suatu istilah yang mencakup semua proses yang mencakup pencernaan, penyerapan dan metabolisme atau penggunaan oleh tubuh.
Bioavailability menyangkut penyerapan nutrien dan penggunaannya pada hewan yang sedang tumbuh (Parsons et al. 1992).
Percobaan biologis digunakan untuk menentukan berapa daya cerna nutrisi terutama protein dan energi metabolis(Widodo 2002). Lebih lanjut dinyatakan bahwa evaluasi kimiawi suatu bahan pakan harus didukung oleh percobaan biologis untuk mengetahui kegunaan dan kandungan nutrisi pakan. Parsons et al. (1992) menyatakan banyak faktor yang mempengaruhi ketersediaan biologis asam amino suatu bahan pakan, antara lain pengolahan, ada tidaknya komponen anti nutrisi, komposisi kimia dan fisik protein dan kandungan serat kasar. Selain itu, retensi protein berkurang perlahan-lahan dengan bertambahnya umur (Krajcovicova-Kudlackova 1986).
menentukan nilai energi metabolis murni dengan pemberian pakan selama 4-6 jam (Parsons et al. 1992), namun sebelumnya Farrel (1978) mengembangkan suatu metode untuk menentukan energi metabolis semu pada ayam yang dilakukan dengan memberikan masa adaptasi pakan pada ayam percobaan untuk menghabiskan bahan makanan (berbentuk pellet sebanyak 70-100 g) dalam waktu satu jam. Sibbald (1989) menyatakan bahwa nilai energi metabolis semu diperoleh dari selisih kandungan energi pakan dengan energi yang terkandung pada ekskreta (feses dan urin).
Beberapa faktor yang dapat mempengaruhi kandungan energi metabolis antara lain; variasi dan karakteristik sumber bahan pakan unggas baik secara fisik maupun kimia, pengaruh musim, fase pertumbuhan, pengolahan pakan, saat pemanenan serta kondisi dan lama waktu penyimpanan. Kandungan energi dan protein yang tersedia ditentukan juga oleh antinutrisi berupa polisakarida bukan pati (PBP), tannin, alkyl resorcinol, protein inhibitor, alfa-amilase inhibitor, senyawa alkaloid, phytohaemagglutinin, saponin dan lathyrogen (Hughes 2003). Polisakarida bukan pati yang terkandung pada pakan mempunyai pengaruh terhadap saluran pencernaan (Iji et al. 200; Hughes 2003) terutama pada struktur dan fungsinya. Kandungan PBP yang dapat dicerna pada pakan menentukan nilai energi dan zat makanan lain yang dapat dicerna (Hughes & Choct 1999).
Sakomura et al. (2005) melaporkan bahwa keakuratan dalam prediksi penentuan kebutuhan energi metabolis harian dipengaruhi oleh temperatur lingkungan pemeliharaan dapat mempengaruhi komposisi tubuh dan efisiensi penggunaan energi untuk protein dan deposisi lemak. Konsumsi ransum dan keseimbangan energi termetabolis pada ayam pedaging dipengaruhi oleh lama waktu terang (Ohtani & Leeson 2000).
Nilai energi metabolis (kkal/kg) semu, energi metabolis semu terkoreksi nitrogen, energi metabolis sejati dan energi metabolis sejati terkoreksi nitrogen pada BIS hasil fermentasi menggunakan T. reesei secara nyata lebih tinggi daripada BIS yang tidak difermentasi (Jaelani 2007). Nitrogen endogenous
bahan pakan, yakni berasal dari peluruhan sel mukosa usus, empedu dan berbagai saluran pencernaan lainnya (Sibbald 1989).
Ezieshi & Olomu (2007) melaporkan bahwa kandungan energi metabolis murni (EMM) BIS pada broiler berkisar antara 1 817–2 654 kkal/kg dan energi metabolis murni terkoreksi nitrogen (EMMn) sebesar 1 784–2 599 kkal/kg. Lebih lanjut dinyatakan bahwa nilai energi metabolis tersebut tergantung dari proses atau metode dalam proses pengolahan BIS. Yatno et al. (2008) melaporkan bahwa energi metabolis murni (EMM) dan energi metabolis murni terkoreksi nitrogen (EMMn) BIS dan bungkil kedelai pada ternak puyuh masing-masing sebesar 2 480.07 vs 2 857.35 dan 2 485.06 vs 2 826.30 kkal/kg. Senada dengan hal tersebut Ramli et al. (2008) melaporkan bahwa rataan energi metabolis (EMS, EMM, EMSn dan EMSn) ransum yang mengandung bungkil kedelai nyata lebih tinggi dibandingkan dengan ransum yang mengandung BIS pada percobaan menggunakan broiler. Lebih lanjut dinyatakan bahwa selisih antara energi metabolis ransum bungkil kedelai dengan energi metabolis ransum BIS berkisar antara 3.38–4.38%.
Retensi protein BIS pada broiler berdasarkan hasil penelitian Ezieshi & Olomu (2008) berkisar antara 57.90–64.67%, sedangkan Ramli et al. (2008) melaporkan bahwa retensi protein pada BIS dan bungkil kedelai masing-masing sebesar 45.20 dan 55.7%. Yatno et al. (2008) melaporkan bahwa retensi protein BIS dan bungkil kedelai pada puyuh masing-masing sebesar 61.19 dan 70.57%.
Organ Hati dan Usus pada Unggas
Organ Hati