AVIAN INFLUENZA PADA AYAM DAN ITIK
SYAHRUDDIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi Polisakarida Mannan dari Bungkil Inti Sawit sebagai Oral Adjuvan Vaksin Avian Influenza pada Ayam dan Itik adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Syahruddin
SYAHRUDDIN. Isolation of Mannan Containing Polysaccharides from Palm Kernel Meal as Oral Adjuvant Avian Influenza Vaccine in Chicken and Duck. Under the supervisions of RITA MUTIA, NAHROWI, and KAMALUDDIN ZARKASIE.
The objectives of the research were to study profile of mannan containing polysaccharide (PM) from Palm Kernel Meal (PKM) in gel filtration chromatography equipped by sephadex G-50 in a column sized 135x630 mm and to study immunological respons of broiler, layer and duck vaccinated orally with 0.25 ml/bird inactive AI vaccine containing PM in completely randomized design. The vaccination treatments were un-vaccinated birds (R0A), birds vaccinated with antigen H5N1+0 µg PM (R0B), birds vaccinated with antigen H5N1+50 µg PM (R1), birds vaccinated with antigen H5N1+100 µg PM (R2) and birds vaccinated with antigen H5N1+200 µg PM (R3). The parameters measured were AI antibody, Immunoglobulin A and body weight gain. The result showed that PM profile in gel filtration chromatography was comprised of height and low molecular weight. AI antibody titer of broiler increased significantly (P<0.05) one week after first vaccination, while serum IgA of broiler increased (P<0.05) two weeks after second vaccination. In layer, AI antibody titer increased (P<0.05) three weeks after second vaccination, while serum IgA increased (P<0.01) one weeks after first vaccination and three weeks after second vaccination. In duck, AI antibody titer was inconsistent and revealed significantly (P<0.05) only one week after first vaccination, while serum IgA of duck increased (P<0.05) two weeks after second vaccination. Broiler received R3 treatment produced higher HI titer ≤ 5 log2 and serum IgA 1.6 fold higher compared with those of broiler received R0B and R0A. Layer received R2 treatment produced higher HI titer ≤ 7 log2 and serum IgA 3-4 fold higher compared with those of layer received R0B. Duck received R1 treatment increased HI titer ≤ 4 log2 only one weeks after first vaccination, and serum IgA 2.5 fold higher compared with those of duck received R0B. The treatment did not influence body weight gain of broiler, layer and duck. It is concluded that inclusion of PM as adjuvant inactive AI vaccine was effective to stimulate immune response in broiler, layer and duck, and could be used as material for oral adjuvant in inactive AI vaccine.
SYAHRUDDIN. Isolasi Polisakarida Mannan dari Bungkil Inti Sawit sebagai Oral Adjuvan Vaksin Avian Influenza pada Ayam dan Itik. Dibimbing oleh RITA MUTIA, NAHROWI, dan KAMALUDDIN ZARKASIE.
Bungkil Inti Sawit (BIS) merupakan hasil ikutan dari industri pengolahan minyak inti sawit yang ketersediaanya di Indonesia cukup tinggi. Penggunaan BIS dalam pakan unggas perlu dibatasi, yang disebabkan tingginya kandungan polisakarida bukan pati (PBP) yang didominasi oleh ikatan β-mannan. Namun mempunyai fungsi lain khususnya dapat meningkatkan respon kekebalan dan kemampuannya menghambat beberapa mikroorganime patogen yang merugikan ternak. Tujuan penelitian ini adalah untuk mengkaji profil polisakarida dari BIS dan menguji kemampuan polisakarida mannan (PM) sebagai oral adjuvan vaksin Avian Influenza (AI) untuk meningkatkan respon kekebalan tubuh pada ayam dan itik.
Proses isolasi untuk mendapatkan PM dari dinding sel BIS diawali dengan proses ekstraksi menggunakan kombinasi fisik dan kimia (pecahan kaca + asam asetat 0.05 N + NaOH 1 N). Selanjutnya pemisahan fraksi karbohidrat dan protein menggunakan teknik pengendapan dengan HCl 0.1 N sampai tercapai titik isoelektrik pada pH 4.0-4.5, sehingga protein mengendap dan diperoleh supernatan yang merupakan “Polisakarida Mannan (PM)”. Sebelum digunakan PM dipekatkan, disentrifugasi dan dilakukan proses dialisis. Profil polisakarida dan protein dilihat berdasarkan keragaman berat molekul menggunakan kromatografi filtrasi yang mengandung gel sephadex-G 50 (135X630 mm). Untuk mengetahui kemampuan PM sebagai oral adjuvan vaksin AI inaktif dilakukan dengan vaksinasi secara oral (dicekok) pada ayam broiler umur 1-6 minggu, ayam petelur umur 16-21 minggu dan itik umur 14-19 minggu. Dosis vaksin yang diberikan sebanyak 0.25 ml/ekor yang mengandung 0.1 ml antigen H5N1 inaktif (Strain A/CK/Legok/2003 Homolog; 512 HAU/ml) dan ditambah 0.15 ml campuran Phosphate buffer saline (PBS) dan PM dengan konsentrasi sesuai perlakuan. Setiap jenis ternak dalam penelitian ini diatur menggunakan Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing tiga ulangan. Perlakuan yang diberikan yaitu : R0A = tidak divaksinasi, R0B = vaksinasi dengan antigen H5N1 + 0 µg PM, R1 = vaksinasi dengan antigen H5N1 + 50 µg PM, R2 = vaksinasi dengan antigen H5N1 + 100 µg PM dan R3 = vaksinasi dengan antigen H5N1 + 200 µg PM. Pengambilan sampel darah dilakukan setiap minggu selama penelitian. Peubah yang diukur adalah pertambahan bobot badan, titer antibodi dan Imunoglobulin A (IgA) serum.
kedua. Pada ayam petelur, tingkat 100 µg mampu memberikan titer HI ≤ 7 log2 tiga minggu setelah vaksinasi kedua dan meningkatkan IgA serum 3-4 kali lebih tinggi dibandingkan ayam petelur yang divaksinasi antigen H5N1 tanpa PM. Penggunaan 50 µg PM pada itik memberikan titer HI ≤ 4 log2 hanya satu minggu setelah vaksinasi pertama dan dapat meningkatkan IgA serum 2.5 kali lebih tinggi dibandingkan itik yang divaksinasi antigen H5N1 tanpa PM, dua minggu setelah vaksinasi kedua. Vaksinasi dengan antigen H5N1 tanpa PM secara oral tidak dapat meningkatkan respon imun ayam petelur dan itik kecuali pada ayam broiler. Dapat disimpulkan bahwa PM sebagai adjuvan vaksin AI inaktif dapat meningkatkan respon imun pada broiler, layer dan itik, dan dapat digunakan sebagai material untuk oral adjuvan vaksin AI inaktif.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
AVIAN INFLUENZA PADA AYAM DAN ITIK
SYAHRUDDIN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Syahruddin
NIM : D051060061
Disetujui
Komisi Pembimbing
Dr. Ir. Rita Mutia, M.Agr. Ketua
Dr. Ir. Nahrowi, M.Sc. Dr. drh. Kamaluddin Zarkasie Anggota Anggota
Diketahui
Ketua Departemen Dekan Sekolah Pascasarjana Ilmu Nutrisi dan Teknologi Pakan
Dr. Ir. Idat Galih Permana, M.Sc.Agr Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2008 ini adalah oral adjuvan vaksin, dengan judul Isolasi Polisakarida Mannan dari Bungkil Inti Sawit sebagai Oral Adjuvan Vaksin Avian Influenza pada Ayam dan Itik.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Rita Mutia, M.Agr, Bapak Dr. Ir. Nahrowi, M.Sc dan Bapak Dr. drh. Kamaluddin Zarkasie selaku pembimbing yang telah banyak memberikan bimbingan dan motivasi. Ucapan terima kasih kepada Ibu Dr. Ir. Dewi Apri Astuti, M.S atas kesediaannya menjadi penguji serta beberapa masukan dan saran untuk perbaikan di dalam tesis ini. Ucapan terima kasih juga kepada Bapak Dr. Ir. M. Ridla, M.Agr selaku ketua Program Studi Ilmu Ternak. Ucapan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional yang telah memberikan dana melalui tim Hibah Pascasarjana IPB tahun 2007. Ucapan terima kasih penulis sampaikan kepada Dr. Yatno, S.Pt M.Si, Heru Handoko S.Pt, Lendrawati S.Pt M.Si, Windu Negara S.Pt M.Si, Anwar Effendi Harahap S.Pt M.Si, Ir. Agus Budiansyah M.S selaku rekan-rekan di laboratorium Teknologi Pakan yang telah banyak membantu selama penelitian. Ucapan terima kasih kepada staf dan karyawan laboratorium Ilmu Makanan Ternak, laboratorium lapangan Kandang C Fapet IPB, PT. IPB-Shigeta yang telah banyak membantu, dan kepada rekan-rekan Pascasarjana Peternakan IPB. Ungkapan terima kasih juga disampaikan kepada kedua orang tua, kepada istri tercinta Suriani SE, ananda tercinta Achsal Rivaldi dan Mohammad Fadli, serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2009
Penulis dilahirkan di Tonronge Sidrap pada tanggal 29 September 1970 dari ayah Hi. Malla dan ibu Hj. Sitti Kawe. Penulis adalah anak pertama dari dua bersaudara.
Tahun 1990 penulis lulus dari SMA Negeri 157 Rappang, Sulawesi Selatan dan pada tahun 1991 melanjutkan studi sarjana S-1 di Universitas Hasanuddin (UNHAS) Fakultas Peternakan Jurusan Nutrisi dan Makanan Ternak dan lulus pada tahun 1996.
DAFTAR TABEL ... iii
Peranan Mannan untuk Meningkatkan Sistem Kekebalan Tubuh ... 7
Sistem Kekebalan Tubuh ... 9
Sistem Kekebalan umum dari Mukosa ... 12
Adjuvan ... 14
Penyakit Avian Influenza (AI) ... 15
Vaksinasi Avian Influenza ... 18
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 20
Tahap I Proses Isolasi Polisakarida Mengandung Mannan dari Bungkil Inti Sawit ... 20
Bahan Penelitian ... 20
Metode Penelitian ... 20
Peubah yang Diamati ... 21
Tahap II Penggunaan Polisakarida Mannan dari Bungkil Inti Sawit Sebagai Oral Adjuvan Vaksin AI pada Ayam dan Itik ... 21
Bahan Penelitian ... 21
Metode Penelitian ... 24
Peubah yang Diamati ... 25
Rancangan Percobaan dan Analisis Data ... 25
HASIL DAN PEMBAHASAN Tahap I Proses Isolasi Polisakarida Mengandung Mannan dari Bungkil Inti Sawit ... 27
Kandungan Total Gula Terekstrak ... 27
Profil Polisakarida Bungkil Inti Sawit ... 27
Tahap II Penggunaan Polisakarida Mannan dari Bungkil Inti Sawit Sebagai Oral Adjuvan Vaksin AI pada Ayam dan Itik ... 31
Pertambahan Bobot Badan dan Bobot Badan Akhir Ayam dan Itik ... 31
Titer Antibodi AI dan Imunoglobulin A (IgA) Serum Ayam Broiler... 37
Titer Antibodi AI dan Imunoglobulin A (IgA) Serum Ayam Petelur ... 40
Titer Antibodi AI dan Imunoglobulin A (IgA) Serum Itik ... 44
LAMPIRAN ... 58
Halaman
1 Persentase komponen gula netral pada bungkil inti sawit (BIS) ... 6
2 Pengaruh cara ekstraksi terhadap kandungan dan rasio komponen gula yang dideteksi dengan HPLC yang dilengkapi Carbohydrate column ... 6
3 Jumlah unggas yang dilaporkan terserang AI dan penyebarannya di Indonesia ... 16
4 Susunan ransum ayam broiler yang digunakan ... 22
5 Susunan ransum ayam petelur yang digunakan ... 23
6 Susunan ransum itik yang digunakan ... 24
7 Kandungan total gula, mannosa dan rendemen mannosa polisakarida BIS yang dihasilkan dari 100 g BIS ... 27
8 Pengaruh penggunaan polisakarida mannan (PM) dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap titer antibodi (HI log2) broiler ... 37
9 Pengaruh penggunaan polisakarida mannan (PM) dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap titer antibodi (HI log2) petelur ... 40
10 Pengaruh penggunaan polisakarida mannan (PM) dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap titer antibodi (HI log2) itik... 44
Halaman
7 Perjalanan waktu respon kebal primer dan sekunder terhadap antigen ... 11
8 Sel-sel M dan induksi kekebalan mukosa ... 13
9 Profil produk campuran fraksi karbohidrat dan protein hasil ekstrak BIS pada Sephadex G-50 ... 28
10 Profil Polisakarida mannan BIS hasil isolasi pada Sephadex G-50 ... 29
11 Struktur mannan dari guaran ... 30
12 Dugaan struktur galaktomannan dari bungkil inti sawit ... 30
13 Bobot badan mingguan ayam broiler selama penelitian (umur 1-6 minggu) ... 31
14 Pengaruh PM sebagai oral adjuvan vaksin AI terhadap pertambahan bobot badan fase starter dan finisher (a), dan bobot badan akhir ayam broiler (b) ... 32
15 Bobot badan mingguan ayam petelur selama penelitian (umur 16-21 minggu) ... 33
16 Pengaruh PM sebagai oral adjuvan vaksin AI terhadap pertambahan bobot badan (a) dan bobot badan akhir ayam petelur (b) ... 34
17 Bobot badan mingguan itik selama penelitian (umur 14-19 minggu)... 35
18 Pengaruh PM sebagai oral adjuvan vaksin AI terhadap pertambahan bobot badan (a) dan bobot badan akhir (b) itik ... 36
19 Pengaruh penggunaan PM dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap optical density (OD) IgA serum ayam broiler umur 1-6 minggu ... 37
20 Pengaruh penggunaan PM dari BIS sebagai oral adjuvan vaksin AI terhadap optical density (OD) IgA serum ayam petelur umur 16-21 minggu ... 40
21 Pengaruh penggunaan PM dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap optical density (OD) IgA serum itik umur 14-19 minggu ... 44
Halaman
1 Formulasi penggunaan polisakarida mannan dari bungkil inti sawit
sebagai oral adjuvan vaksin avian influenza ... 58
2 Prosedur Uji Haemaglutination Agglutination (HA) dan Haemaglutination Inhibition(HI) ... 59
3 Prosedur metode ELISA ... 60
4 Analisis ragam pertambahan bobot badan (PBB) dan bobot badan akhir ayam dan itik ... 61
5 Analisis ragam titer antibodi AI ayam broiler ... 62
6 Analisis ragam IgA serum ayam broiler ... 63
7 Analisis ragam titer antibodi AI ayam petelur ... 64
8 Analisis ragam IgA serum ayam petelur... 65
9 Analisis ragam titer antibodi AI itik ... 66
10 Analisis ragam IgA serum itik ... 66
PENDAHULUAN
Latar BelakangBungkil Inti Sawit (BIS) adalah hasil ikutan dari industri pengolahan inti sawit menjadi minyak inti sawit yang ketersediaanya di Indonesia cukup tinggi. Menurut Dirjen Perkebunan (2008) perkiraan total luas areal kelapa sawit tahun 2008 sebesar 7 007 876 ha dan luas areal produktif sebesar 4 953 382 ha dengan produksi minyak inti sawit mencapai 18 089 503 ton, maka bersamaan dengan itu dihasilkan bungkil inti sawit cukup tinggi (diperkirakan 1.3 juta ton per tahun).
Penggunaan bungkil inti sawit dalam pakan unggas perlu dibatasi, yang disebabkan tingginya kandungan polisakarida bukan pati (PBP) yang didominasi oleh ikatan β-mannan. Tafsin (2007) melaporkan bahwa komponen gula polisakarida dari BIS tersusun atas glukosa, galaktosa dan mannosa, dimana komponen gula yang terdeteksi berupa galaktomannan dengan rasio antara galaktosa dan mannosa mencapai 1:3 dan sejumlah kecil glukosa. Namun disisi
lain, polisakarida mannan (PM) mempunyai fungsi lain khususnya dapat meningkatkan respon kekebalan dan kemampuannya menghambat beberapa mikroorganime patogen yang merugikan ternak. Kandungan mannan yang tinggi pada BIS perlu diambil dan dimanfaatkan. Salah satu upaya yang dilakukan yaitu mengisolasi dan memisahkan polisakarida mengandung mannan melalui proses ekstraksi.
Pada saat ini, salah satu penyakit yang masih menjadi ancaman bagi dunia perunggasan adalah penyakit Avian Influenza (AI) yang disebabkan oleh virus influenza tipe A subtipe H5N1. Penanggulangan penyakit AI dapat ditempuh diantaranya melalui program vaksinasi. Tingkat keberhasilan vaksinasi AI sampai tahun 2007 sangat bervariasi. Ayam pedaging, ayam buras, puyuh hanya divaksinasi dalam skala terbatas dan bahkan unggas air sangat terbatas sehingga membuka peluang sebagai reservoir AI dengan cara membawa virus AI pada sistem pencernaan dan shedding di fesesnya.
Penggunaan vaksin AI aktif tidak diperbolehkan karena mengandung mikroorganisme yang dapat berkembang di dalam tubuh dan dapat bersifat zoonosis, sehingga digunakan vaksin AI inaktif. Akan tetapi kandungan mikroorganisme di dalam vaksin inaktif menjadi kritis. Agar vaksin AI inaktif memberikan respon imun yang baik, maka dibutuhkan adjuvan. Dewasa ini vaksin AI inaktif umumnya menggunakan adjuvan oil emulsion, yang diberikan secara intramuskuler atau subkutan. Selain dari oil emulsion dipandang perlu untuk mendapatkan suatu bahan adjuvan yang aman serta dapat diberikan secara oral atau lewat air minum, dengan maksud merangsang sistem kekebalan melalui mukosa. Salah satu bahan yang menarik untuk dikaji dan dijadikan sebagai bahan adjuvan yaitu polisakarida mengandung mannan dari BIS.
Penggunaan mannan sebagai adjuvan telah dilaporkan oleh Pietersz et al.
(2008) bahwa vaksinasi dengan antigen H5N1 ditambah mannosa dari
Tujuan Penelitian
1. Mengkaji profil polisakarida mengandung mannan dari bungkil inti sawit 2. Menguji kemampuan polisakarida mannan dari bungkil inti sawit sebagai oral
adjuvan vaksin avian influenza untuk memperbaiki sistem kekebalan tubuh pada ayam dan itik.
Manfaat Penelitian
1. Memberikan informasi tentang kandungan polisakarida mannan hasil samping pembuatan konsentrat protein BIS
TINJAUAN PUSTAKA
Polisakarida Mengandung MannanDinding sel tanaman mengandung 38-50% selulosa, 15-25% lignin, 23-32% sebagai hemiselulosa (Puls dan Schuseil 1993). Polisakarida mannan adalah biopolimer kompleks yang berhubungan dengan dinding sel tanaman dimana mannan terikat bersama dengan selulosa dan lignin (de Vires 2003).
Polisakarida adalah polimer monosakarida yang bergabung dengan ikatan glikosidik dan klasifikasinya berdasarkan struktur: jenis monosakarida, posisi ikatan glikosidik, komfigurasi ikatan glikosidik α dan β serta ada tidaknya
substituen non karbohidrat. Dalam pengelompokan polisakarida bukan pati (Non Starch Polysaccharides), terdiri atas 3 kelompok besar yakni selulosa, polimer non selulosa, dan pektic polisakarida. Polimer non selulosa ini terdiri dari arabinoxylan, glukan, mannan, araban, galaktan dan xyloglukan. Komponen polisakarida bukan pati antara lain hemiselulosa, dimana dalam bahan akan
menghalangi proses penyerapan karbohidrat, asam amino dan mineral dalam usus yang mempunyai efek penghalang (protective box effect) (Vranjes dan Wenk 1995). Polisakarida bukan pati pada hewan non ruminansia termasuk unggas mempunyai aktivitas anti nutrisi yang mempunyai pengaruh menekan pencernaan dan penyerapan serat serta menyebabkan kotoran menjadi basah.
Mannan merupakan polimer mannopyranosil yang berhubungan dari satu
ke yang lain oleh ikatan (1-4)- β-D-Manp (Buckeridge et al. 2000). Struktur mannan dapat dilihat pada Gambar 1.
Gambar 1 Polimer mannopyranosil (Buckeridge et al. 2000)
Gambar 2 Gambaran struktur locust bean galaktomannan (Buckeridge et al. 2000)
Glukomannan merupakan polimer dengan rantai utama terdiri dari
D-glukosa dan D-mannosa terikat bersama-sama dengan ikatan β-(1,4). Polisakarida ini diperkirakan terdiri dari 60% D-mannosa dan 40% D-glukosa (Li et al. 2005). Unit mannosa yang berulang dengan subtitusi glukosa pada rantai utama dan mengandung beberapa group acetyl. Pada beberapa spesies tanaman mengandung rantai pendek 11-16 molekul heksosa berikatan pada rantai sisi ikatan β-(1,6) atau β-(1,3) (Ratcliffe et al. 2005). Adapun struktur glukomannan dapat dilihat pada Gambar 3.
Gambar 3 Gambaran struktur glukomannan (Li et al. 2005; Ratcliffe et al. 2005)
Galakto-glukomannan, rantai utama polisakarida ini terdiri dari ikatan
(1-4)-β-D-Manp diselang-selingi dengan unit glukosa. Molekul D-galaktosa berikatan pada mannosa dengan ikatan α-(1,6). Beberapa studi ikatan β-(1,2) telah diamati (Sims et al. 1997). Pada rantai utama, mannosa dan glukosa kadang-kadang terdapat ikatan group acetyl pada C2 atau C3. Adapun struktur galakto-glukomannan dapat dilihat pada Gambar 4.
Gambar 4 Struktur galakto-glukomannan (Schr der et al. 2001)
terdapat pada fraksi hemiselulosa dari biomass bungkil inti sawit (BIS) (Daud dan Jarvis 1992). Selanjutnya dilaporkan bahwa total dinding sel terbanyak dari BIS adalah mannosa sebesar 56.4%. Adapun secara lengkap komponen dinding sel dari bungkil inti sawit dapat dilihat pada Tabel 1.
Tabel 1 Persentase komponen gula netral pada bungkil inti sawit (BIS)
Komponen gula netral Persentase dari dinding sel (%)
Mannosa 56.4 ± 7.0
Selulosa 11.6 ± 0.7
Xylosa 3.7 ± 0.1
Galaktosa 1.4 ± 0.2
Total 73.1 ± 7.2
Sumber : Daud dan Jarvis (1992).
Dusterhoft et al. (1992) melaporkan struktur kimia BIS berupa ikatan mannosa sebanyak 78%, selulosa 12%, arabinoxylans dan (4-O-methyl)-glucuronoxylans masing-masing 3%.
Tafsin (2007) melaporkan bahwa kandungan total gula yang dihasilkan
dari setiap 100 g BIS berkisar antara 1 218-3 168 mg, jumlah mannosa yang dihasilkan dari total mannan yang ada dalam BIS berkisar 0.15-7.58%. Selanjutnya dilaporkan bahwa komponen gula polisakarida dari BIS tersusun atas glukosa, galaktosa dan mannosa. Komponen gula dominan berupa galaktomannan dengan rasio antara galaktosa dan mannosa mencapai 1:3. Adapun komponen gula dominan yang terdeteksi dengan HPLC disajikan pada Tabel 2.
Tabel 2 Pengaruh cara ekstraksi terhadap kandungan dan rasio komponen gula yang dideteksi dengan HPLC yang dilengkapi Carbohydrate column
Komponen gula (ppm) Perlakuan
Galaktosa Glukosa Mannosa Mannosa (%)
Akuades 664.2
Yokomizo (2005) menggunakan enzim mannanase terhadap BIS, jumlah mannosa yang diperoleh berkisar antara 12.5-19.9% dari total mannan yang ada pada BIS yang diperoleh dengan waktu reaksi selama 24-72 jam. Selanjutnya Jaelani (2007) melaporkan bahwa pengolahan secara biologis seperti fermentasi dengan menggunakan Trichoderma reesei juga mampu memperbaiki nilai nutrisi BIS.
Peranan Mannan untuk Meningkatkan Sistem Kekebalan Tubuh
Komponen gula mannosa dari MOS mempengaruhi sistem kekebalan dengan jalan merangsang sekresi protein pengikat mannosa, dan dikenal dengan istilah mannosa binding lectin (MBL). MBL disintesa di hati dan disekresikan ke dalam serum sebagai komponen dengan fase respon yang bersifat akut. MBL dapat berikatan dengan karbohidrat dari dinding sel bakteri, ragi atau virus (Janeway et al. 2005).
Laursen dan Nielsen (2000) menjelaskan bahwa ada tiga jalur aktivasi komplemen yaitu; jalur komplemen klasik diaktifkan melalui kompleks imun, jalur lektin diaktifkan oleh karbohidrat dari permukaan sel mikroba. Jalur alternatif diaktifkan oleh beragam campuran dan permukaan sel yang terkait dengan pengaturan dan pembentukan C3 convertase. Adapun gambaran aktivasi
sistem komplemen dilihat pada Gambar 5.
Khusus pada aktivasi komplemen melalui jalur lektin dimediasi oleh mannosa binding lectin (MBL) yang merupakan reseptor spesifik dari karbohidrat mikroba. Jalur ini meliputi MBL protein, MASP-1, MASP-2, C4, dan C2. MBL berasosiasi dengan serin protease (MASP) bersama-sama membentuk C3 konvertase, dari pragmen C3 membentuk C3b. C3b berikatan dengan permukaan patogen dan ikatan-ikatan reseptor yang dikenal dengan pagositosis. C3b dapat juga berkombinasi dengan protein-protein pada permukaan patogen dan dari kompleks lapisan permukaan luar. Kompleks MBL dan fungsi protease sama dengan kompleks C1 dari komplemen klasik (Janeway et al. 2005).
Devegowda et al. (1994) menyebutkan bahwa MOS diturunkan dari dinding sel ragi Saccharomyces cerevisiae dan mempunyai derajat antigenitas yang tinggi yang disebabkan adanya komponen mannan dan glukan. Mannanoligosakarida (MOS) digunakan sebagai prebiotik, namun penggunaannya tidak secara selektif meningkatkan beberapa jenis bakteri yang menguntungkan. Perannya lebih sebagai pengikat dan memindahkan bakteri patogen dari saluran pencernaan dan merangsang sistem imunitas (Spring et al. 2000). Selanjutnya Turner et al. (2000) menunjukkan adanya efek yang menguntungkan dari MOS terhadap kesehatan pada saluran pencernaan dan sistem kekebalan. Pada ternak kalkun ternyata penggunaan MOS akan meningkatkan level plasma IgG dan konsentrasi IgA pada
cairan empedu.
Penelitian Swanson et al. (2002) yang dilakukan terhadap anjing menunjukkan hasil yang serupa. Pemberian MOS menunjukkan kandungan limfosit yang lebih tinggi dibandingkan dengan kontrol. Selanjutnya ketika perlakuan ini dikombinasikan dengan fruktooligosakarida (FOS) ternyata secara signifikan kandungan IgA lebih tinggi dibandingkan dengan kontrol. Kesimpulan umum penelitian ini yaitu suplementasi FOS dan MOS mempunyai efek yang menguntungkan terhadap kesehatan kolon dan status kekebalan dari anjing.
Lyons (1996) melaporkan penggunaan MOS pada tingkat 1-2 kg/ton pakan akan memperbaiki kekebalan yang ditunjukkan dengan meningkatnya level Ig (Imunoglobulin) dan menigkatkan aktivitas fagosit. Selain itu juga mempunyai fungsi untuk mengikat bahan patogen pada saluran pencernaan (seperti E. coli dan
Tafsin (2007) melaporkan bahwa penggunaan polisakarida mannan (PM) dari BIS 1 000; 3 000; 4 000 ppm dalam ransum ayam titer antibodi terhadap IBD nyata lebih tinggi dibanding kontrol, namun tidak berpengaruh terhadap titer ND.
Sistem Kekebalan Tubuh
Secara garis besar kekebalan yang diperoleh hewan dapat terjadi secara alami dan buatan. Kekebalan secara alami mencakup penghalang secara fisik dan fisiologis yang mencegah masuknya agen infeksi seperti kulit, saliva, asam lambung, dan anti bakteri seperti lysozim. Kekebalan alami yang terjadi pada jaringan dan sirkulasi diperantarai sel efektor yang disebut fagosit dan sel “natural killer (NK)”. Selain itu ada juga komplemen darah yang mendukung fagositosis dan melisiskan patogen. Kekebalan secara buatan biasanya diperoleh secara aktif melalui infeksi alami atau dengan vaksinasi. Kekebalannya akan berkembang setelah beberapa hari atau minggu setelah pemaparan dan diperantarai oleh limfosit (Decker 2000).
Secara umum sistem kekebalan pada unggas tidak jauh berbeda dengan sistem kekebalan manusia maupun mamalia lainnya. Unggas mempunyai dua organ limfoid primer yaitu timus dan bursa fabricius. Stimulasi antigenik menginduksi respons imun yang dilakukan sistem seluler secara bersama-sama
Mekanisme kerja sistem imun disajikan pada Gambar 6 (Cann 1997 diacu dalam: Samsi 2007).
Gambar 6 Mekanisme secara umum sistem imun (Cann 1997 diacu dalam: Samsi 2007)
Sel limfosit B berasal dari sumsum tulang belakang dan mengalami pendewasaan pada jaringan ekivalen bursa. Jumlah sel limfosit B dalam keadaan normal berkisar antara 10 dan 15%. Setiap limfosit B memiliki 105 B cell receptor (BCR), dan setiap BCR memiliki dua tempat pengikatan yang identik. Antigen yang umum bagi sel B adalah protein yang memiliki struktur tiga dimensi. BCR dan antibodi mengikat antigen dalam bentuk aslinya. Hal ini membedakan antara sel B dan sel T, yang mengikat antigen yang sudah terproses dalam sel (Kresno 1996).
Limfosit dapat membentuk beratus-ratus jenis antibodi sensitif yang berbeda-beda, sifatnya spesifik untuk suatu antigen khusus dan tiap jenisnya dapat berganda mencapai jumlah yang sangat besar apabila digertak oleh antigen spesifik yang jumlahnya cukup (Frandson 1996). Sebelum terpapar dengan antigen yang spesifik, klon limfosit B tetap dalam keadaan dormant di dalam jaringan limfoid. Limfosit B berproliferasi menghasilkan sel plasma dan sel B
Antibodi bekerja melalui dua cara yang berbeda untuk mempertahankan tubuh terhadap agen penyebab penyakit yaitu; 1) dengan cara langsung menginaktivasi agen penyebab penyakit, atau 2) dengan mengaktifkan sistem komplemen yang kemudian akan menghancurkan agen penyakit tersebut (Guyton 1995). Antibodi tidak dapat menembus sel, sehingga antibodi hanya akan bisa bekerja selama antigen berada di luar sel (Malole 1988).
Jajaran ketiga sel limfoid adalah natural killer cells (sel NK) yang tidak memiliki reseptor antigen spesifik dan merupakan bagian dari sistem imun nonspesifik. Sel ini beredar di dalam darah sebagai limfosit besar yang khusus memiliki granula spesifik yang memiliki kemampuan mengenal dan membunuh sel abnormal, seperti sel tumor dan sel yang terinfeksi virus. Sel NK berperan penting dalam imunitas nonspesifik pada patogen intraseluler (Janeway et al. 2001).
Kuby (2007) memberikan gambaran respon kebal primer dan sekunder terhadap antigen yang diukur dari tingkat antibodi di dalam serum (respon humoral) dapat dilihat pada Gambar 7. Ketika hewan disuntikkan dengan
Gambar 7 Perjalanan waktu respon kebal primer dan sekunder terhadap antigen (Kuby 2007).
antigen A memperlihatkan respon antibodi primer di dalam serum yang rendah dan waktunya singkat puncaknya kira-kira 10-17 hari, penyuntikan dengan antigen yang sama (antigen A) ditambah antigen B menghasilkan respon sekunder yang mulai meningkat pada hari ke-7 dan bertahan lama (bulan atau tahun) daripada respon primer pada tikus.
Sistem Kekebalan umum dari Mukosa
Permukaan mukosa terdapat di sepanjang rongga internal yang meliputi rongga hidung, rongga mulut, saluran pernapasan, saluran pencernaan (gastrointestinal tract=GI tract), dan saluran genital. Kurang lebih 80% dari permukaan mukosa menyelubungi saluran pencernaan (Kiyono 1997).
Permukaan mukosa yang dilindungi oleh sistem kekebalan lokal yang berfungsi terpisah dari sistem kekebalan sistemik. Mekanisme pertahanan mukosa tersebut terdiri atas rintangan fisik dan seluler, termasuk garis epitel yang hubungannya dengan lapisan lendir mukosa. Sistem imun pada permukaan mukosa disebut dengan MALT (mucosal associated lymphoid tissue). Pada prinsipnya struktur jaringan kerja immunologik pada permukaan mukosa bagian luar (MALT) terdiri atas gut associated lymphoid tissue (GALT), bronchus associated lymphoid tissue (BALT), nasopharyngeal lymphoid tissue (NALT),
larynx lymphoid tissue (LALT), dan genitourinary lymphoid tissue (GULT) (Ogra
et al. 2001; Bar-Shira dan Friedman 2005). MALT membentuk suatu sistem hubungan sekretori dimana sel limfosit yang teraktivasi oleh antigen, terutama yang memproduksi IgA dan IgE, akan bersirkulasi pada seluruh permukaan mukosa membentuk sistem imun mukosal (Roitt dan Delves 2001). Mekanisme respon imun mukosal ini akan terjadi jika antigen masuk melalui jalur mulut.
Respon imun yang paling umum terjadi adalah respon mukosal yaitu peningkatan jumlah sel pensekresi IgA dan IgA sekretori (Perdigon et al. 1995).
Sel M diduga mempunyai peran penting dalam pengolahan antigen dan kemungkinan induksi kekebalan mukosa yang antigen spesifik di tempat efektor
Gambar 8 Sel-sel M dan induksi kekebalan mukosa (Van Ginkel et al. 2000)
mukosa (mucosal effector sites). Kekebalan pada permukaan mukosa terutama terdiri atas CD4+ sel, secretory Imunoglobulin A (S-IgA), dan T lymphocytes
yang bersifat antigen spesifik sitotoksik atau cytotoxic T lymphocytes (CTLs) (Van Ginkel et al. 2000).
Imunoglobulin A plasma pada umumnya dijumpai dalam bentuk monomerik, berbeda dengan IgA sekretori (sIgA) ada dalam bentuk dimer atau polimer yang banyak dijumpai pada sekresi permukaan mukosa (Salminen et al. 1998). IgA sekretori berbentuk dimer yang dihubungkan dengan sebuah rantai J (sistein kaya polipeptida) dan mengandung komponen sekretori (Roitt dan Delves 2001; Kindt et al. 2007). IgA monomer adalah molekul 7S dengan BM 160 000 dalton, IgA dimer adalah molekul 11S BM 320 000 dalton dan IgA sekretori adalah molekul 11.4S BM 390 000 dalton (Tizard 1982). Komponen sekretori diduga bertindak sebagai reseptor IgA untuk menembus epitel mukosa dengan cara endositosis dan melindungi molekul IgA terhadap enzim proteolitik (Kresno 1996).
merupakan produk dari sistem imun humoral dan jumlahnya terbanyak ketiga dalam serum ayam setelah IgG dan IgM (Tizard 1982). Selanjutnya dijelaskan bahwa tingkat perkiraan IgA pada ayam yaitu; dalam serum 50 mg/100 ml, sekresi air liur 20 mg/100 ml, sekresi air mata 15 mg/100 ml dan sekresi hidung belum diketahui.
Imunoglobulin A tidak bakterisidal, tidak terikat pada makrofag atau memperkuat fagositosis dan mengikat komplemen hanya dengan jalur alternatif. Tetapi IgA mempunyai aktifitas netralisasi dan juga menetralkan beberapa enzim virus dan bakteri. Cara kerjanya yang paling penting adalah mencegah perlekatan bakteri dan virus ke permukaan epitel. Menjaga permukaan mukosa dari antigen karena tahan terhadap proteolisis intraluminal dan tidak menimbulkan respon inflamasi (Tizard 1982; Salminen et al. 1998).
Spector (1993) menjelaskan bahwa virus terkadang dapat dihilangkan diluar sel pada membran mukosa atau dalam aliran darah, sebelum kolonisasi sel utama terjadi. Garis pertahanan pertama terhadap virus ialah interferon dan IgA sekretori dari sel epitel yang reaktif terhadap antigen virus yang dihasilkan oleh imunisasi atau infeksi sebelumnya, akan melenyapkan virus dengan bantuan komplemen teraktifkan.
Adjuvan
Berdasarkan penemuan Pietersz et al. (2008) yang menyatakan hubungan antara komposisi vaksin yang terdiri dari karbohidrat yang merupakan polimer dari mannosa yang dicampur dengan antigen virus influenza inaktif yang diberikan pada tikus secara intranasal menunjukkan hasil peningkatan titer HI lebih tinggi dibandingkan pemberian antigen H5N1 sendiri ( HI titer 80 vs 40) 12 hari setelah vaksinasi pertama.
Mannan, sebuah polimannosa atau polisakarida dari dinding sel ragi, dimana penambahan dan dikonjugasikan saliva manusia (menekan antigen kanker) telah digunakan pada tikus untuk menginduksi respon imun (Apostolopoulos et al. 1995). Imunisasi intraperitoneal didalam merangsang imunitas seluler juga memperlihatkan produksi sitotoksik limfosit T (CTLs) dan beberapa prekursor, Th1 cytokines IFN- dan IL-12. Telah dicobakan pada lebih dari 100 ekor tikus, dan mannan tidak memperlihatkan efek toksik atau autoimmun (Karanikas et al. 1997). Reseptor yang terikat mannosa telah diidentifikasi pada makrofag dan sel dendrit. Penambahan mannan memperlihatkan respon produksi IL-12 pada makrofag, dan juga merangsang sel T, dan mempercepat antigen jalur class I untuk produksi cytotoxic sel T pada tikus (Apostolopoulos et al. 2000).
Penyakit Avian Influenza (AI)
Kejadian Penyakit Avian Influenza dan Penularannya
Virus AI di Indonesia telah ditemukan sejak September 2003, kasus avian influenza di Indonesia mencapai puncaknya pada bulan Januari-Februari 2004. Wabah AI gelombang ke dua di Indonesia sekitar akhir bulan Oktober 2004-Maret 2005 (Dharmayanti et al. 2005a).
adalah subtipe H5 atau H7, tetapi tidak semua subtipe H5 atau H7 menyebabkan HPAI (Suarez et al. 2004).
Kejadian AI pada unggas dari tahun 2003 sampai tahun 2007 dan penyebarannya di Indonesia disajikan pada Tabel 3.
Tabel 3 Jumlah unggas yang dilaporkan terserang AI dan penyebarannya di Indonesia
Tahun Jumlah unggas yang dilaporkan terserang AI (dalam ribuan ekor)
Jumlah Propinsi yang
Keterangan : Sumber data UPP-AI Departemen Pertanian (Laporan Dinas) (diacu dalam: Jatmiko 2007)
*Data sampai 9 maret 2007 (Deptan). **Data sampai 27 Juli 2007 (Komnas FBPI).
Penularan virus AI dapat terjadi secara langsung dan tidak langsung. Virus AI dapat menyebar dengan cepat diantara populasi unggas, penularan dapat dipengaruhi oleh banyak faktor yaitu, strain virus, strain unggas dan faktor lingkungan. Sumber penularan virus AI adalah ekskreta yang berasal dari hidung, konjuntiva, dan kloaka unggas yang terinfeksi ke lingkungan karena virus bereplikasi di dalam saluran pernafasan, pencernaan, ginjal, dan organ reproduksi. Penularan virus AI juga dapat terjadi secara oral melalui pakan dan air minum yang tercemar oleh virus AI (Swayne dan Suarez 2000; Soejoedono dan Handharyani 2005).
Virus Avian Influenza pada Unggas Air
2005). Secara periodik virus influenza disebarkan ke inang lain, termasuk mamalia, dan menyebabkan infeksi yang sifatnya sementara dan kadang-kadang menimbulkan kematian. Itik dianggap sebagai sumber virus H5N1 pada outbreak
di Cina tahun 2000-2004 (Li et al. 2005). Outbreak H5N1 di Hongkong tahun 2001 juga berasal dari reservoir itik dan angsa yang mengalami reassortment
dengan virus AI lainnya sehingga muncul virus yang bersifat patogen pada unggas darat (Sturm-Ramirez 2004). Strain patogenik H5N1 hanya menyebabkan gejala klinis ringan pada itik, tetapi secara “silently” dapat mempropagasi virus pada unggas lain (Sturm-Ramirez 2005).
Gambaran Klinis Penyakit Avian Influenza (AI)
Gambaran klinis penyakit AI pada unggas bervariasi serta gejalanya sering tidak spesifik, oleh karena itu tidak mungkin untuk menegakkan diagnosis hanya berdasarkan gambaran klinis. Virus berkembang selama beberapa hari, tergantung pada karakteristik isolat, dosis inokulum, spesies dan usia unggas. Unggas yang menderita AI dapat mengeluarkan virus dalam jumlah besar di kotorannya. Virus tersebut dapat bertahan hidup di air sampai 4 hari pada suhu 22oC dan lebih dari 30 hari pada suhu 0oC. Di dalam feses unggas dan dalam tubuh unggas yang sakit, virus dapat bertahan lebih lama, tetapi akan mati pada pemanasan 60oC selama 30 menit (Soejoedono & Handharyani 2005).
lebih cepat daripada yang dipelihara dalam kandang. Namun masih diperlukan beberapa hari untuk terjadinya penularan yang sempurna (Capua et al. 2000).
Infeksi virus pada peternakan unggas skala besar, terjadinya penurunan konsumsi air dan makanan yang drastis dalam waktu singkat. Hal ini dapat menjadi tanda akan adanya penyakit sistemik. Pada ayam petelur, terhentinya produksi telur sangat nyata. Secara individual ayam yang terkena penyakit HPAI sering hanya menunjukkan apatis dan imobilitas. Pembengkakan nampak pada daerah kepala yang tidak ditumbuhi bulu, terjadi sianosis pada jengger, gelambir dan kaki, diare dengan kotoran berwarna kehijauan, dan susah bernafas, dapat dijumpai meskipun tidak selalu (inkonsisten). Pada ayam petelur, awalnya telur yang dihasilkan berkulit lembek, tetapi kemudian produksi telur berhenti secara cepat sejalan dengan perkembangan penyakit (Elbers et al. 2005). Gejala sistem saraf termasuk tremaor, tortikolis, dan ataxia mendominasi gambaran klinis pada spesies yang begitu rentan seperti bebek, angsa, serta burung onta.
Vaksinasi Avian Influenza (AI)
Pelaksanaan pencegahan, pengendalian dan pemberantasan penyakit dilakukan dengan melaksanakan 9 (sembilan) strategi penanggulangan avian influenza yang terdiri atas; (1) Peningkatan keamanan dari penularan (biosekuriti); (2) Vaksinasi; (3) Pemusnahan terbatas (depopulasi) di daerah tertular; (4) Pengendalian lalu lintas unggas, produk unggas dan limbah peternakan unggas; (5) Surveilans dan penelusuran (tracing back); (6) Pengisian kandang kembali (restocking); (7) Pemusnahan menyeluruh (stamping-out) di daerah tertular baru; (8) Peningkatan kesadaran masyarakat (public awareness); (9) Monitoring dan evaluasi (Departemen Komunikasi dan Informatika Badan Informasi Publik 2005).
Vaksinasi diperlukan dalam penanganan AI karena akan melindungi gejala klinis dan mortalitas disebabkan virus highly pathogenic avian influenza (HPAI). Dengan vaksinasi akan mengurangi populasi yang rentan, mengurangi pencemaran/shedding virus di lokasi peternakan dan tujuan utamanya adalah mencegah kerugian ekonomi (Machdum 2008).
Zarkasie (2007) menjelaskan bahwa vaksin H5N1 buatan lokal diproduksi pada tahun 2003. Vaksin ini tak melalui proses reverse genetic yang memperhatikan tingkat patogenitas virus. Padahal virus H5N1 tercatat amat patogen yang pembuatan antigennya tidak bisa dilakukan dengan cara biasa. Akibatnya vaksin tidak memiliki kompatibilitas (keampuhan) seratus persen membasmi virus. Penggunaan vaksin H5N2 dinilai tidak tepat. Dari tinjauan molekuler, struktur RNA virus H5N2 berbeda dengan H5N1.
Pernyataan Malole (1988) bahwa titer antibodi protektif akan mengalami penurunan yang disebabkan oleh adanya waktu paruh antibodi. Antibodi dengan titer yang tinggi bersifat protektif terhadap adanya infeksi lapangan. Rahardjo (2004) menjelaskan bahwa berdasarkan standar OIE, 3 minggu setelah vaksinasi minimal terbentuk antibodi setinggi 24. Selanjutnya Darminto (2006) menyatakan bahwa pemeriksaan serologis dapat dilakukan untuk mengetahui adanya pembentukan antibodi terhadap virus AI yang dapat diamati pada hari ke-7
sampai hari ke-14 pasca infeksi. Seekor ayam yang dinyatakan kebal terhadap penyakit AI jika memiliki titer antibodi HI serendah-rendahnya 4 (log 2).
BAHAN DAN METODE
Waktu dan Tempat PenelitianPenelitian ini telah dilaksanakan mulai bulan Maret sampai dengan Desember 2008. Proses ekstraksi, separasi dan analisis dilaksanakan di Laboratorim Ilmu dan Teknologi Pakan, Departemen INTP Fapet-IPB. Pengujian PM BIS sebagai oral adjuvan vaksin AI pada ayam dan itik dilaksanakan di kandang C Fapet-IPB. Pemeriksaan titer antibodi AI dan imunoglobulin A (IgA) dilaksanakan di Laboratorium Imunologi FKH-IPB.
Tahap I. Proses Isolasi Polisakarida Mengandung Mannan dari Bungkil Inti Sawit
Bahan Penelitian
Bahan yang digunakan pada penelitian ini antara lain; bungkil inti sawit (BIS) yang diperoleh dari PT. Indofeed Bogor, pecahan kaca, asam asetat 0.05 N,
NaOH 1 N dan HCl 0.1 N. Alat yang digunakan antara lain mortal grinder, autoklaf, mesin cuci, ruang pemekatan, baki plastik, sentrifuge, tabung dialisis,
rotary evaporator, kolom kromatografi filtrasi gel dan spektrofotometer.
Metode Penelitian
Proses Ekstraksi BIS
sehingga protein mengendap dan diperoleh cairan yang akan digunakan pada penelitian ini.
Cairan tersebut dipekatkan pada ruang pemekatan (100 x 50 x 50 cm; 41oC; 96 jam) sampai kental kemudian disentrifugasi (himac CR 21G; pada 12 000 G; 15 menit). Supernatan yang diperoleh dinetralkan dari pengaruh bahan kimia dengan cara dialisis menggunakan tabung dialisis (dialysis tube 33 x 21 mm) dan disimpan pada suhu 4oC selama empat hari dalam akuades. Proses selanjutnya dievaporasi menggunakan rotary evaporator dan disentrifugasi. Supernatan yang diperoleh merupakan “Polisakarida Mannan/PM”.
Kandungan Total Gula
Pengukuran total gula dilakukan pada ekstrak sebelum dan setelah dipisahkan proteinnya. Demikian juga dilakukan terhadap sampel polisakarida sebelum maupun sesudah diinjek pada kolom mengandung gel Sephadex G-50.
Kromatografi Filtrasi Gel
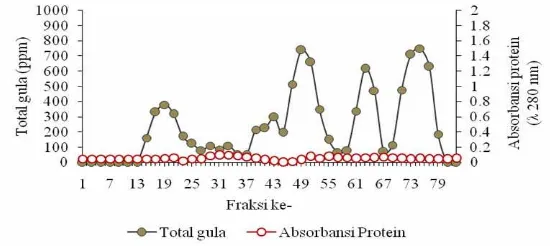
Kromatografi filtrasi gel menggunakan kolom (135 mm x 630 mm) mengandung gel Sephadex G-50, yang dilengkapi fraction collector dengan volume setiap fraksi sebanyak 10 ml. Sampel yang diinjeksikan mengandung total gula sebanyak 9 902 ppm/ml dan laju alir yang digunakan adalah 0.5 ml/menit. Setiap fraksi dari fraction collector diukur kandungan total gula pada panjang gelombang 490 nm dan absorbansi protein pada panjang gelombang (ultra violet) 280 nm.
Peubah yang Diamati
Kandungan total gula terekstrak dari BIS dihitung berdasarkan metode Dubois et al. (1956). Profil polisakarida bungkil inti sawit dilihat berdasarkan bobot molekul dengan kromatografi filtrasi gel.
Tahap II. Penggunaan Polisakarida Mannan dari Bungkil Inti Sawit sebagai Oral Adjuvan Vaksin Avian Influenza pada Ayam dan Itik
Bahan Penelitian
sebagai oral adjuvan vaksin AI inaktif dilakukan terhadap tiga jenis ternak yaitu ayam broiler, ayam petelur dan itik.
Ternak ayam (broiler; petelur) dan itik dipelihara dalam petak-petak kandang percobaan. Jumlah petak yang digunakan untuk setiap jenis ternak sebanyak 15 petak, ukuran setiap petak 50 x 50 x 50 cm.
Ayam broiler yang digunakan pada penelitian ini adalah broiler strain Ross
sebanyak 30 ekor dengan jenis kelamin campuran (unsexed). Ayam broiler dipelihara sejak DOC yang kemudian dipisahkan pada umur 7 hari sesuai dengan perlakuan.
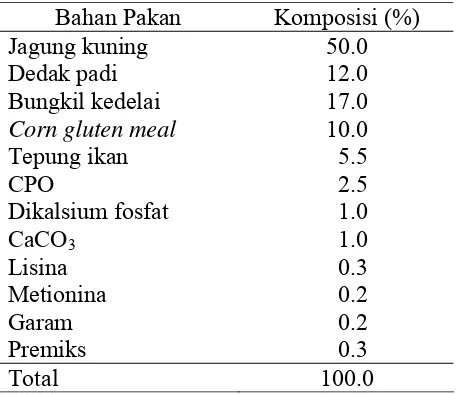
Ransum yang digunakan pada ayam broiler umur 7-42 hari disusun berdasarkan perhitungan dari tabel komposisi zat makanan (NRC 1994) dengan kandungan nutrisi sebagai berikut: Protein kasar 23.09%, energi metabolisme 3 018 kkal/kg, lemak kasar 6.94%, serat kasar 3.13%, Ca 1.08%, P 0.81%, Na 0.14%, Cl 0.13%, K 0.58%, lisina 1.20% dan metionina 0.64%. Adapun susunan ransum ayam broiler yang digunakan disajikan pada Tabel 4.
Tabel 4 Susunan ransum ayam broiler yang digunakan.
Bahan Pakan Komposisi (%)
Jagung kuning 50.0
Ayam petelur yang digunakan pada penelitian ini adalah pullet (umur 16
minggu) CP 909 dari PT. Proskar Pertiwi sebanyak 30 ekor dengan jenis kelamin betina. Ayam petelur kemudian dipisahkan sesuai dengan perlakuan.
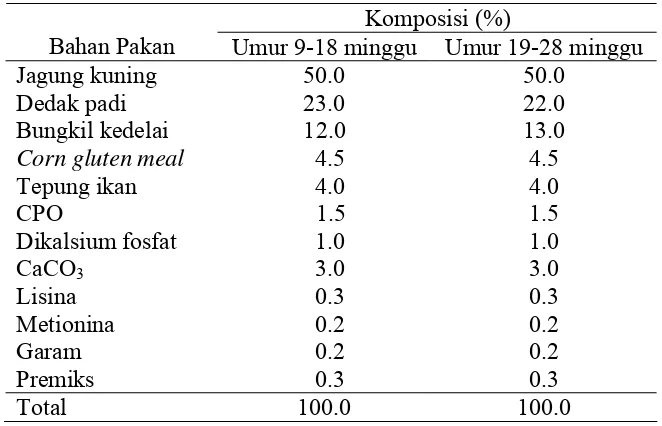
2 783 kkal/kg, lemak kasar 6.99%, serat kasar 3.67%, Ca 1.77%, P 0.87%, Na 0.16%, Cl 0.18%, K 0.49%, lisina 0.99% dan metionina 0.54%. Selanjutnya ransum yang digunakan pada ayam petelur umur 19-28 minggu dengan kandungan nutrisi sebagai berikut: Protein kasar 18.01%, energi metabolisme 2 790 kkal/kg, lemak kasar 6.88%, serat kasar 3.65%, Ca 1.77%, P 0.86%, Na 0.16%, Cl 0.18%, K 0.50%, lisina 1.01% dan metionina 0.54%. Adapun susunan ransum ayam petelur yang digunakan disajikan pada Tabel 5.
Tabel 5 Susunan ransum ayam petelur yang digunakan.
Komposisi (%)
Bahan Pakan Umur 9-18 minggu Umur 19-28 minggu
Jagung kuning 50.0 50.0
Itik yang digunakan pada penelitian ini adalah itik asal Cirebon (umur 14
minggu) sebanyak 30 ekor dengan jenis kelamin campuran (unsexed). Itik dipelihara kemudian dipisahkan sesuai dengan perlakuan.
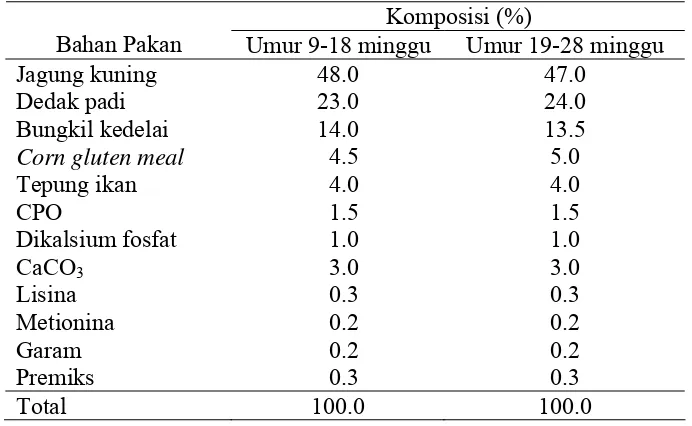
Tabel 6 Susunan ransum itik yang digunakan.
Komposisi (%)
Bahan Pakan Umur 9-18 minggu Umur 19-28 minggu
Jagung kuning 48.0 47.0
Untuk mengetahui kemampuan polisakarida mengandung mannan (PM) sebagai oral adjuvan vaksin AI inaktif terhadap perbaikan respon imun pada tiga jenis ternak (ayam broiler, ayam petelur dan itik), dilakukan dengan vaksinasi
secara oral (dicekok). Dosis vaksin yang diberikan sebanyak 0.25 ml/ekor yang mengandung 0.1 ml antigen H5N1 inaktif dan ditambah 0.15 ml campuran Phosphate buffer saline (PBS) dan PM dengan konsentrasi sesuai perlakuan.
Vaksinasi pertama pada ayam broiler umur satu minggu (7 hari) dengan dosis vaksin AI inaktif/ekor (0.25 ml/ekor; oral). Selanjutnya vaksinasi kedua (booster) dilakukan pada umur tiga minggu (21 hari) dengan dosis vaksin AI inaktif/ekor (0.25 ml/ekor; oral).
Vaksinasi pertama pada ayam petelur umur 16 minggu dengan dosis vaksin AI inaktif/ekor (0.25 ml/ekor; oral). Selanjutnya vaksinasi kedua (booster) dilakukan pada ayam petelur umur 18 minggu dengan dosis vaksin AI inaktif/ekor (0.25 ml/ekor; oral).
Pengambilan sampel darah untuk tiga jenis ternak dilakukan setiap minggu dan diambil satu ekor untuk tiap-tiap ulangan, melalui vena sayap sebanyak 1-1.5 ml menggunakan syringe. Sampel darah yang diperoleh diambil serumnya kemudian disimpan pada suhu -20oC sampai saat pemeriksaan titer antibodi AI dan IgA. Ayam (broiler; petelur) dan itik juga ditimbang bobot badan setiap minggu selama penelitian, untuk mengetahui pertambahan bobot badan.
Peubah yang Diamati
1. Pertambahan Bobot Badan yang diamati setiap minggu
2. Evaluasi Titer Antibodi AI menggunakan uji Haemagglutination Inhibition (HI Test) (OIE 2004)
3. Pengukuran Immunoglubulin A (IgA) dengan Metode Enzyme linked immunosorbent assay (ELISA) (Crowther 1995)
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan untuk setiap jenis ternak (ayam broiler; ayam petelur dan itik) yaitu Rancangan Acak Lengkap (RAL) dengan lima perlakuan dan masing-masing tiga ulangan. Perlakuan yang diberikan yaitu :
R0A = Tidak divaksinasi
R0B = Vaksinasi dengan antigen H5N1 + 0 µg PM R1 = Vaksinasi dengan antigen H5N1 + 50 µg PM
R2 = Vaksinasi dengan antigen H5N1 + 100 µg PM R3 = Vaksinasi dengan antigen H5N1 + 200 µg PM
Model matematik yang digunakan untuk rancangan tersebut adalah : Yij = µ + αi + εij i = 1, 2, …,5 dan j = 1, 2, 3
Keterangan :
Yij = Respon pengamatan satuan percobaan yang memperoleh perlakuan ke-i
dan ulangan ke-j
µ = Rataan umum
αi = Pengaruh perlakuan ke-i
Data pertambahan bobot badan, titer antibodi AI dan IgA serum (OD;
HASIL DAN PEMBAHASAN
Tahap I. Proses Isolasi Polisakarida Mengandung Mannan dari Bungkil Inti Sawit
Kandungan Total Gula Terekstrak
Hasil isolasi polisakarida BIS sebelum dan setelah dipisahkan proteinnya dapat dilihat pada Tabel 7.
Tabel 7 Kandungan total gula, mannosa dan rendemen mannosa polisakarida BIS yang dihasilkan dari 100 gram BIS1
Kandungan Polisakarida BIS kasar Polisakarida mannan BIS
total gula (g) 8.35-8.59 5.70-7.61
mannosa2 (g) 6.14-6.31 4.19-5.59
rendemen mannosa3 (%) 45.38-46.63 30.96-41.32
Keterangan : 1 Kandungan mannosa 56.4% (Daud & Jarvis 1992) dari total serat kasar.
Kandungan SK BIS 24% (Hasil analisis Lab. Makanan Ternak IPB 2007) 2
Kandungan mannosa BIS 73.54% dari total gula (Tafsin 2007) 3
Rendemen mannosa dari 100 g BIS
Kandungan total gula (Tabel 7) yang dihasilkan dari 100 g BIS sebelum dipisahkan proteinnya berkisar antara 8.35-8.59 g dengan jumlah mannosa yang
terambil sebanyak 6.14-6.31 g atau sebanyak 45.38-46.63% dari serat kasar BIS. Penelitian sebelumnya memperoleh total gula berkisar antara 1.22-3.20 g dari 100 g BIS (Tafsin 2007). Kandungan total gula yang lebih tinggi diduga disebabkan oleh penggunaan asam asetat 0.05 N sebagai pengganti air dan peningkatan konsentrasi NaOH dari 0.05 N (penelitian sebelumnya) menjadi 1 N.
Secara umum hasil diperoleh dari isolasi polisakarida BIS memberikan gambaran bahwa total gula yang dihasilkan cukup tinggi yaitu berkisar antara 5.70-7.61 g dengan rendemen mannosa mencapai 30.96-41.32% dari serat kasar BIS. Dengan demikian masih ada sekitar 7.94-9.34 g mannosa dari 13.53 g/100 g BIS atau 58-69% yang belum terambil. Kuat dugaan sebagian besar fraksi karbohidrat tersebut ada dalam ampas, sehingga sangat terbuka kemungkinan untuk mengeksplorasi nutrien tersebut pada proses ekstraksi kembali.
Profil Polisakarida Bungkil Inti Sawit (BIS)
menggunakan pelarut air gel sephadex (deret G) dapat memisahkan campuran berdasarkan ukuran molekul, dimana molekul besar terelusi lebih dulu (Markham 1988). Profil produk campuran fraksi karbohidrat dan protein (sebelum pengendapan protein) pada gel Sephadex G-50 dapat dilihat pada Gambar 9.
Gambar 9 Profil produk campuran fraksi karbohidrat dan protein hasil ekstrak BIS pada Sephadex G-50
Kajian berikutnya profil polisakarida mengandung mannan yang telah diisolasi dengan cara pengendapan proteinnya menggunakan HCl 0.1 N disajikan pada Gambar 10.
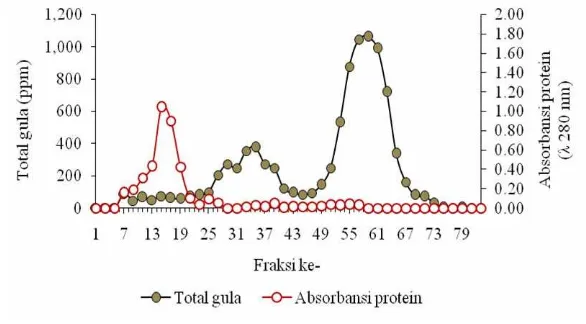
Gambar 10 Profil Polisakarida mannan BIS hasil isolasi pada Sephadex G-50
Gambar 10 menunjukkan bahwa komponen polisakarida mulai muncul pada fraksi ke 13 dan terbentuk 4 peak besar yaitu, peak pertama muncul pada fraksi ke 13-35, peak kedua pada fraksi ke 37-57, peak ketiga pada fraksi ke 59-67 dan
peak ke empat pada fraksi ke 69-79. Gambaran absorbansi protein terlihat seragam dan tidak terbentuk peak besar maupun kecil. Artinya komponen karbohidrat yang berikatan dengan protein dalam bentuk glikoprotein sebagian besar sudah terpisah. Yatno et al. (2008) melaporkan bahwa ekstraksi kombinasi fisik kimia (kaca + asam asetat 0.05 N + NaOH 1 N) yang dilanjutkan dengan pengendapan protein menggunakan HCl 0.1 N menghasilkan protein kasar 45.56% dengan rendemen 12.18% dan protein recovery 50.38% dari protein kasar BIS.
Gambar 10 dapat dilihat bahwa peak yang terbentuk dari fraksi ke-13-35 diasumsikan sebagai fraksi karbohidrat yang memiliki bobot molekul lebih berat, sedangkan fraksi ke-37-80 diasumsikan sebagai fraksi karbohidrat yang mempunyai bobot molekul lebih ringan. Profil ini menunjukkan bahwa pemisahan fraksi karbohidrat dan protein menghasilkan bobot molekul fraksi karbohidrat
pada BIS diduga lebih banyak, sehingga dapat diartikan bahwa ikatan galaktosa pada polisakarida BIS mempunyai ikatan kimia yang lebih labil dari ikatan mannosa (Ramli et al. 2008a). Lebih lajut dijelaskan bahwa kandungan mannosa pada BIS adalah sebesar 68,9%. Hal yang sama dilaporkan oleh Tafsin (2007) bahwa komponen gula polisakarida dari BIS tersusun atas glukosa, galaktosa dan mannosa. Komponen gula yang terdeteksi berupa galaktomannan dengan rasio antara galaktosa dan mannosa mencapai 1:3. Selanjutnya dilaporkan bahwa ekstraksi BIS didominasi oleh mannosa dengan kandungan mencapai 73.54% dari total gulanya. Carre (2002) melaporkan bahwa komponen utama dari dinding sel bungkil kelapa dan bungkil inti sawit (BIS) adalah linier (1-4)- β D-Manp dan menunjukkan kesamaan dengan guar gum, tetapi dengan rasio galaktomannan yang berbeda. Kennedy dan White (1988) menyebutkan bahwa struktur polisakarida mannan bervariasi tergantung sumber bahan. Rasio komponen monosakarida antara galaktosa : mannosa berkisar antara 1:1 sampai 1:5, akan tetapi keseluruhannya mempunyai kesamaan struktur yaitu ikatan (1 4) β -D-mannopyranosil dengan rantai cabang berisi gugus tunggal α-D-galactopyranosil dengan ikatan (1 6). Gambaran struktur mannan dari guaran disajikan pada Gambar berikut :
4)- β-D-manp-(1 4)- β-D-manp-(1 4)- β-D-manp-(1 4)- β-D-manp-(1 4)- (1 6 6
α-D-galp α-D-galp
Gambar 11 Struktur mannan dari guaran (Kennedy dan White 1988)
Gambar 11 menunjukkan struktur mannan dari guaran dengan rasio komponen galaktosa : mannosa yaitu 1:2. Struktur mannan dari BIS tampaknya hampir sama dengan dari guaran, hanya rasio komponen gulanya berbeda. Dugaan struktur dominan galaktomannan dari dinding sel BIS adalah sebagai berikut :
4)- β-D-manp-(1 4)- β-D-manp-(1 4)- β-D-manp-(1 4)- β-D-manp-(1 4)- (1 6 6
α-D-galp α-D-galp
Secara umum ekstrak bungkil inti sawit sebelum maupun setelah diendapkan proteinnya didominasi oleh peak besar yang terkoleksi pada fraksi yang lebih tinggi dalam sephadex G-50. Hasil tersebut menunjukkan bahwa produk tersebut didominasi oleh bobot molekul yang lebih ringan dan beragam. Polisakarida mannan BIS ini adalah merupakan salah satu hasil dari diversifikasi produk dari bungkil inti sawit yang digunakan sebagai bahan adjuvan vaksin pada tahapan selanjutnya pada penelitian ini.
Tahap II. Penggunaan Polisakarida Mannan dari Bungkil Inti Sawit sebagai Oral Adjuvan Vaksin Avian Influenza (AI) pada Ayam dan Itik
Pertambahan Bobot Badan dan Bobot Akhir Ayam dan Itik
Pertambahan Bobot Badan dan Bobot Badan Akhir Ayam Broiler
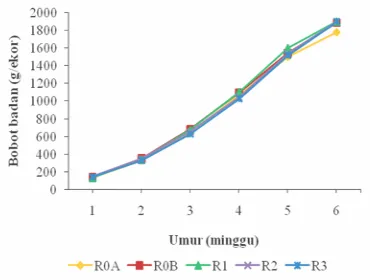
Pengamatan terhadap bobot badan mingguan ayam broiler selama lima
minggu pengamatan ditunjukkan pada Gambar 13.
Gambar 13 Bobot badan mingguan ayam broiler selama penelitian (umur 1-6 minggu)
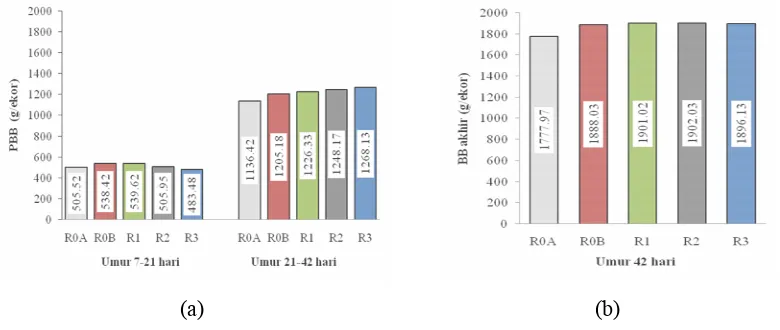
Pengaruh penggunaan polisakarida mannan dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap pertambahan bobot badan (PBB) dan bobot akhir ayam broiler umur 7-42 hari dapat dilihat pada Gambar berikut.
(a) (b)
Gambar 14 Pengaruh PM sebagai oral adjuvan vaksin AI inaktif terhadap pertambahan bobot badan fase starter dan finisher (a), dan bobot badan akhir ayam broiler (b)
Perlakuan tidak berpengaruh nyata (P>0.05) terhadap pertambahan bobot badan ayam broiler broiler fase starter (umur 7-21 hari) maupun fase finisher (umur 21-42 hari) (Gambar 14a). Demikian juga terhadap bobot badan akhir ayam broiler (Gambar 14b). Namun demikian perlakuan R1 (50 µg PM) selama lima
minggu pengamatan memperlihatkan pertumbuhan yang lebih baik dibandingkan yang lain. Hal ini menunjukkan bahwa polisakarida mannan (PM) sebagai oral adjuvan vaksin tidak menurunkan bobot badan atau tidak bersifat toksik.
Perlakuan tidak mempengaruhi PBB maupun bobot badan akhir ayam broiler. Hal tersebut kemungkinan disebabkan oleh pengaruh antigen bersama PM lebih banyak untuk merangsang imunogenisitas. Kemungkinan lain yaitu kebutuhan zat-zat nutrisi terbagi untuk pertumbuhan dan perkembangan organ kekebalan sehingga pengaruhnya terhadap bobot badan tidak tampak. Takahashi
untuk sistem kekebalan relatif lebih kecil dibanding untuk pertumbuhan. Stress kekebalan yang diakibatkan efek imunostimulan berbeda dengan stress yang diakibatkan infeksi yang dapat menyebabkan reaksi keseluruhan dari tubuh yang meliputi perubahan fisiologis dan metabolis seperti demam, menurunnya konsumsi dan menigkatnya katabolisme nutrien.
Beberapa peneliti yang menggunakan bahan yang sejenis yaitu mannanoligosakarida (MOS), penggunaan 0.05% MOS (Flemming et al. 2004), dan 0.3% MOS (Shafey et al. 2001) menunjukkan tidak adanya pengaruh terhadap pertambahan bobot badan. Selanjutnya Waldroup et al. (2003) menyebutkan penambahan Bio-MOS 1 g/kg pada ransum broiler umur 1-42 hari yang dilanjutkan dengan 0.75 g/kg sampai umur 63 hari tidak mempengaruhi pertumbuhan, tetapi dapat memperbaiki konversi ransum. Sebaliknya, Tafsin (2007) melaporkan bahwa penggunaan PM dari BIS sampai tingkat 3 000 ppm dalam ransum dapat meningkatkan PBB ayam broiler, pengaruh penggunaan bahan yang mengandung komponen mannosa (MOS atau PM) terhadap pertumbuhan tergantung pada kadar yang digunakan.
Pertambahan Bobot Badan (PBB) dan Bobot Badan Akhir Ayam Petelur
Pengamatan terhadap bobot badan mingguan ayam petelur selama lima minggu pengamatan ditunjukkan pada Gambar 15.
Gambar 15 Bobot badan mingguan ayam petelur selama penelitian (umur 16-21 minggu)
19 minggu. Sebaliknya, penurunan bobot badan mulai terlihat pada umur 20 dan 21 kecuali R0B (antigen H5N1 tanpa PM).
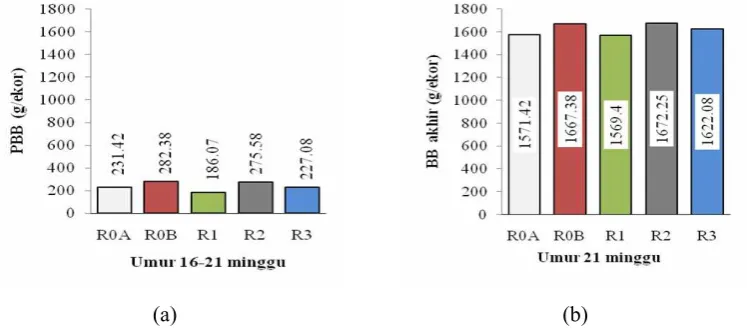
Pengaruh perlakuan terhadap pertambahan bobot badan dan bobot badan akhir ayam petelur disajikan pada Gambar 16.
(a) (b)
Gambar 16 Pengaruh PM sebagai oral adjuvan vaksin AI inaktif terhadap pertambahan bobot badan (a) dan bobot badan akhir ayam petelur (b)
Perlakuan tidak berpengaruh nyata (P>0.05) terhadap pertambahan bobot badan ayam petelur (Gambar 16a). Demikian juga perlakuan tidak berpengaruh nyata (P>0.05) terhadap bobot badan akhir ayam petelur (Gambar 16b). Namun demikian penggunaan PM sebagai oral adjuvan vaksin AI inaktif menunjukkan adanya sedikit peningkatan terhadap bobot badan selama penelitian, yang menunjukkan bahwa PM tidak bersifat toksik.
merupakan tindakan memasukkan bahan asing ke dalam tubuh dan infeksi penyakit sehingga menyebabkan stress dan mengalami penurunan bobot badan (3) stress perlakuan akibat penanganan ayam pada saat melakukan vaksinansi (Anonim 2005).
Suplementasi mannanoligosakarida 0.05 dan 0.1% pada pakan kalkun tidak mempengaruhi bobot badan, tetapi penambahan antibiotik (bacitracin methylene disalicylate) dan 0.1% Bio-MOS nyata memperbaiki konversi ransum (Fritts dan Waldroup 2003).
Pertambahan Bobot Badan (PBB) dan Bobot Badan Akhir Itik
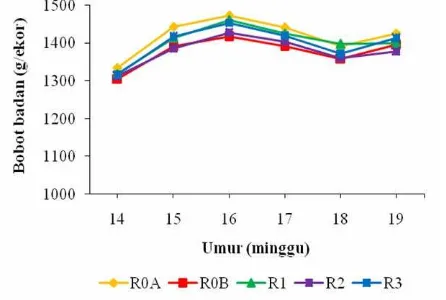
Pengamatan terhadap bobot badan mingguan itik selama lima minggu pengamatan ditunjukkan pada Gambar 17.
Gambar 17 Bobot badan mingguan itik selama penelitian (umur 14-19 minggu)
Data pengaruh perlakuan terhadap pertambahan bobot badan dan bobot badan akhir itik disajikan pada Gambar 18.
(a) (b)
Gambar 18 Pengaruh PM sebagai oral adjuvan vaksin AI inaktif terhadap pertambahan bobot badan (a) dan bobot badan akhir (b) itik.
Analisis statistik menunjukkan bahwa perlakuan tidak berpengaruh nyata (P>0.05) terhadap pertambahan bobot badan itik (Gambar 18a), demikian juga pelakuan tidak berpengaruh nyata (P>0.05) terhadap bobot badan akhir itik (Gambar 18b). Hal ini menunjukkan bahwa penggunaan PM tidak dapat meningkatkan bobot badan itik, namun demikian PM dari BIS tidak bersifat toksik. Hal ini terlihat masih terdapat sedikit peningkatan terhadap rataan PBB itik umur 14-19 minggu.
Titer Antibodi AI dan Imunoglobulin A (IgA) Serum Ayam Broiler
Pengaruh perlakuan terhadap titer antibodi AI H5N1 pada ayam broiler disajikan pada Tabel 8.
Tabel 8 Pengaruh penggunaan polisakarida mannan (PM) dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap titer antibodi (HI log2) broiler
Minggu setelah
Keterangan : Superskrip dengan huruf yang berbeda kearah kolom menunjukkan perbedaan
nyata (P<0.05) R0A (tidak divaksinasi), R0B (vaksinasi dengan antigen H5N1 + 0
µg PM), R1 (vaksinasi dengan antigen H5N1 + 50 µg PM), R2 (vaksinasi dengan antigen H5N1 + 100 µg PM), R3 (vaksinasi dengan antigen H5N1 + 200 µg PM).
Selanjutnya pengaruh perlakuan terhadap OD IgA serum ayam broiler disajikan pada Gambar 19.
Gambar 19 Pengaruh penggunaan PM dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap optical density (OD) IgA serum ayam broiler umur 1-6 minggu.
5.00; 4.67; 5.00 vs 4.00 log2. Vaksinasi secara oral juga berpengaruh nyata (P<0.05) terhadap titer HI dibandingkan dengan titer HI ayam yang tidak divaksinasi. Selanjutnya dua minggu setelah vaksinasi pertama perlakuan tidak berpengaruh nyata (P>0.05) terhadap titer antibodi ayam broiler.
Perlakuan memiliki kecenderungan meningkatkan titer HI. Hal ini menunjukkan bahwa komponen mannan dari BIS sebagai oral adjuvan vaksin AI inaktif dapat meningkatkan atau menimbulkan efek yang merangsang sistem kekebalan lebih aktif untuk pembentukan antibodi. Mekanisme bagaimana PM ini dapat menstimulasi pembentukan antibodi belum diketahui secara pasti, namun diduga bahwa sel pertahanan tubuh mendeteksi kehadiran mikroba akibat adanya molekul unik yang disebut PAMP (pathogen-associated molecular pattern) yang selanjutnya akan mengaktifkan sistem kekebalan seperti fagositosis dan jalur lektin. Komponen gula mannosa mempengaruhi sistem kekebalan dengan jalan merangsang sekresi protein pengikat mannosa, dan dikenal dengan istilah
mannosa binding lectin (MBL). MBL disintesa di hati dan disekresikan ke dalam serum sebagai komponen dengan fase respon yang bersifat akut. MBL dapat berikatan dengan karbohidrat dari dinding sel bakteri, ragi atau virus (Janeway et al. 2005).
Vaksin AI inaktif yang baik akan menimbulkan kekebalan yang tinggi dan
berlangsung lama, yakni dalam waktu tiga minggu setelah vaksinasi akan menghasilkan titer antibodi minimal 4 log2, seperti yang direkomendasikan oleh organisasi kesehatan hewan (OIE 2004). Respon perlakuan dalam penelitian ini sesuai yang direkomendasikan OIE yaitu dapat mempertahankan titer antibodi protektif selama lima minggu pengamatan. Namun demikian pada penelitian ini tidak dilakukan uji tantang dengan infeksi virus H5N1 karena tidak punya fasilitas kandang bioseptik yang memenuhi persyaratan keamanan, mengingat virus H5N1 amat patogen. Dalam penelitian ini titer antibodi yang terbentuk yaitu berkisar antara 3.67 log2 - 5.67 log2.
titer antibodi HI lebih tinggi dibandingkan vaksinasi dengan antigen H5N1 sendiri (HI titer 80 vs 40) 12 hari setelah vaksinasi pertama.
Gambar 19 menunjukkan bahwa satu sampai dua minggu setelah vaksinasi pertama, semua perlakuan tidak menunjukkan perbedaan yang nyata terhadap IgA serum. Satu minggu setelah vaksinasi kedua (booster), vaksinasi dengan antigen H5N1 secara oral nyata (P<0.05) meningkatkan IgA serum dibandingkan ayam broiler yang tidak divaksinasi (R0A). Hal ini menunjukkan bahwa vaksinasi dengan antigen H5N1 secara oral mampu merespon peningkatan IgA serum setelah vaksinasi kedua. Dua minggu setelah vaksinasi kedua berlangsung, perlakuan R3 (200 µg PM) dapat meningkatkan IgA serum lebih tinggi dibandingkan R0B (OD; 0.137 ± 0.040 vs 0.085 ± 0.026). Hal ini menunjukkan bahwa PM sebagai oral adjuvan dapat meningkatkan IgA serum broiler. Namun demikian respon PM terhadap peningkatan titer antibodi terlihat lebih cepat (satu minggu setelah vaksinasi pertama) dibandingkan peningkatan IgA serum.
Nilai optical density (OD) IgA serum ayam broiler yang diperoleh mencapai 0.137, hasil ini hampir sama yang dilaporkan oleh Worrall et al. (2009) bahwa vaksinasi sebanyak 0.03 ml secara intranasal dengan sialidase/neuraminidase dari
Clostridium perfringens tipe A 107 dan citosan sebagai adjuvan vaksin AI H5N1 memberikan nilai OD IgA mukosa berkisar antara 0.12-0.18 selama lima minggu
pengamatan.
Mekanisme bagaimana PM ini dapat menstimulasi pembentukan immunoglobulin belum diketahui secara pasti. Diduga sel-sel limfosit dipermukaan sel epitel usus teraktivasi oleh antigen H5N1 bersama PM dipermukaan mukosa, selanjutnya bersirkulasi ke seluruh tubuh dan mengaktifkan respon imun sistemik atau sistem imun keseluruhan. Pada umumnya, permukaan luar mukosa dipenuhi oleh folikel yang terorganisir, elemen limfoid yang tersebar dan bersifat antigen reaktif, termasuk sel B, limfosit T, sel T dan sel plasma dan berbagai elemen seluler yang terlibat dalam induksi dan terjadinya respon kekebalan (Sudarisman 2006).
tercermin dari meningkatnya IgG serum dan IgA cairan empedu. Selain itu dapat meningkatkan pertambahan bobot badan serta menurunkan konversi ransum. Sebaliknya Spearman (2004) melaporkan bahwa suplementasi Bio-MOS 10 g/ekor/hari tidak dapat meningkatkan konsentrasi IgA serum pada kuda.
Titer Antibodi AI dan Imunoglobulin A (IgA) Serum Ayam Petelur
Pengaruh perlakuan terhadap titer antibodi AI H5N1 ayam petelur disajikan pada Tabel 9.
Tabel 9 Pengaruh penggunaan polisakarida mannan (PM) dari BIS sebagai oral adjuvan vaksin AI inaktif terhadap titer antibodi (HI log2) petelur
Minggu setelah vaksinasi pertama
Minggu setelah vaksinasi kedua Perlakuan
Sebelum vaksinasi
1 2 1 2 3
R0A 3.67±0.58 4.33±0.58 4.67±1.15 6.50±0.71 4.33±0.58 5.50ab±0.71
R0B 5.00±0.00 6.33±1.15 4.67±1.15 5.33±0.58 3.67±1.15 4.33b ±0.58
R1 4.33±0.58 6.33±0.58 5.67±0.58 6.67±1.53 5.00±2.00 6.00ab±1.73
R2 0.00±0.00 5.33±1.53 4.67±0.58 6.33±1.15 6.33±0.58 7.00a ±0.00
R3 4.00±1.00 5.50±0.71 4.67±1.15 5.00±0.00 5.00±1.00 4.33b ±1.15
Keterangan : Superskrip dengan huruf yang berbeda kearah kolom menunjukkan perbedaan nyata
(P<0.05) R0A (tidak divaksinasi), R0B (vaksinasi dengan antigen H5N1 + 0 µg
PM), R1 (vaksinasi dengan antigen H5N1 + 50 µg PM), R2 (vaksinasi dengan antigen H5N1 + 100 µg PM), R3 (vaksinasi dengan antigen H5N1 + 200 µg PM).
Selanjutnya pengaruh perlakuan terhadap OD IgA serum ayam petelur disajikan pada Gambar 20.
Pengaruh penggunaan PM sebagai oral adjuvan vaksin AI inaktif terhadap titer HI (Tabel 9) menunjukkan bahwa satu sampai dua minggu setelah vaksinasi pertama maupun kedua semua perlakuan tidak memberikan perbedaan yang nyata terhadap titer antibodi ayam petelur. Namun demikian tiga minggu setelah vaksinasi kedua, titer antibodi ayam pada perlakuan R2 (100 µg PM) nyata (P<0.05) lebih tinggi dibandingkan R0B (7.00 log2 vs 4.33 log2), tetapi secara statistik tidak berbeda nyata dibandingkan R0A. Hal ini juga terlihat dari nilai titer yang meningkat selama lima minggu pengamatan. Tampaknya komponen mannan dari BIS dapat meningkatkan imunogenisitas antigen H5N1 inaktif atau memainkan peran untuk merangsang sistem kekebalan lebih aktif untuk pembentukan antibodi pada ayam petelur.
Rataan titer HI pada penelitian ini cukup tinggi dibandingkan vaksinasi secara intramuskuler yang telah dilakukan oleh Indriani et al. (2004) bahwa respon titer antibodi ayam buras yang divaksinasi dengan vaksin cair A/Jatim/2003 (H5N1) inaktif setelah tiga minggu pasca vaksinasi, dengan rataan respon titer 3.94 log2 atau titer 15.78. Selanjutnya Indriani et al. (2005) melaporkan bahwa vaksinasi pada ayam petelur umur 3 minggu menggunakan isolat lokal AI subtipe H5N1 inaktif A/Chicken/West Java/67-2/2003 dengan adjuvan Drakeol 6 VR (10% arlacel 80 (sorbitan monooleate) dan 1% tween 80) dan vaksin komersial dengan dosis 0.5 ml/ekor. Pada saat 8 minggu setelah vaksinasi memiliki rataan titer antibodi 4.04 log2 dan 4.14 log2 secara berurutan dan mampu memberikan proteksi 90% terhadap virus tantang.
Penggunaan bahan yang sama yaitu PM dari BIS telah dilaporkan oleh Tafsin (2007) bahwa titer antibodi ND tidak dipengaruhi oleh perlakuan penggunaan PM. Sebaliknya, penggunaan PM pada tingkat 1 000; 3 000; dan 4 000 ppm dalam ransum titer IBD nyata lebih tinggi dibandingkan kontrol. Hasil tersebut menunjukkan adanya aktivitas immunostimulan dari PM pada ternak ayam.