UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KIMIA FARMA
UNIT RESEARCH AND DEVELOPMENT
JL. CIHAMPELAS NO. 5, BANDUNG, JAWA BARAT
PERIODE 3 MARET - 28 MARET 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
ANINDITA RATNAWATI ADITYA, S. Farm.
1306343372
ANGKATAN LXXVIII
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KIMIA FARMA
UNIT RESEARCH AND DEVELOPMENT
JL. CIHAMPELAS NO. 5, BANDUNG, JAWA BARAT
PERIODE 3 MARET - 28 MARET 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
ANINDITA RATNAWATI ADITYA, S. Farm.
1306343372
ANGKATAN LXXVIII
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
Segala puji dan syukur hanya kepada Allah SWT atas segala limpahan rahmat dan kasih saying-Nya sehingga penulis mampu menyelesaikan laporan ini. Penulisan laporan ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Apoteker di Fakultas Farmasi, Universitas Indonesia.
Penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, sangatlah sulit untuk menyelesaikan laporan ini. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Dra. Fitrileni, M.Si., Apt. selaku Asisten Manajer Bagian Pemastian Mutu dan pembimbing penulis dalam Praktek Kerja Profesi Apoteker di PT. Kimia Farma Tbk. Unit Research and Development.
2. Dra. Maryati Kurniadi, M.Si, Apt, selaku dosen pembimbing PKPA yang telah menyediakan waktu, bantuan, tenaga, dan pikiran untuk mengarahkan penulis selama PKPA berlangsung;
3. Dra. Endang Widiastuti, selaku Manajer PT. Kimia Farma Tbk. Unit
Research and Development.
4. Dr. Mahdi Jufri, M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Indonesia;
5.
Dr. Hayun, M.Si, Apt., selaku Ketua Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia dan pembimbing PKPA.6. Karyawan dan staf PT. Kimia Farma Tbk. Unit Research and Development yang telah membantu dalam pelaksanaan dan penyusunan laporan Praktek Kerja Profesi Apoteker ini.
7. Bapak dan Ibu staf pengajar atas ilmu pengetahuan dan bantuan yang telah diberikan selama menempuh pendidikan di Fakultas Farmasi Universitas Indonesia.
8. Orang tua (Adityo T. Prakoso dan Dyah Retnowati) dan kakak (Indra A. Aditya), serta abang yang senantiasa memberikan kasih sayang, bantuan, semangat, dan doa demi kelancaran studi penulis;
penyusunan dan penulisan laporan yang tidak dapat saya sebutkan satu persatu.
10. Semua pihak yang tidak dapat disebutkan namanya satu persatu yang telah membantu proses penelitian dan penyusunan skripsi ini.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna, oleh sebab itu penulis mengharapkan saran dan kritik yang membangun dari pembaca. Akhir kata, penulis berharap semoga pengetahuan dan pengalaman yang penulis peroleh selama menjalani Praktek Kerja Profesi Apoteker ini dapat bermanfaat bagi rekan-rekan sejawat dan semua pihak yang membutuhkan.
Penulis
ABSTRAK
Nama : Anindita Ratnawati Aditya, S. Farm
NPM : 1306343372
Program Studi : Profesi Apoteker
Judul : Laporan Praktek Kerja Profesi Apoteker di PT Kimia Farma Unit Research and Development Jl. Cihampelas No. 5 Bandung Periode 3 Maret – 28 Maret 2014
Praktek Kerja Profesi Apoteker di PT Kimia Farma Unit Research and
Development bertujuan untuk mengetahui dan memahami fungsi dan peran PT.
Kimia Farma Tbk. Unit Research and Development serta mengetahui dan memahami peran dan tugas Apoteker secara umum di bidang riset dan pengembangan dan secara khusus di PT. Kimia Farma Tbk. Unit Research and
Development. Tugas khusus yang diberikan berjudul Prosedur Validasi Metode
Analisis Larutan Topikal Klotrimazol secara Kromatografi Cair Kinerja Tinggi (KCKT). Tujuan dari tugas khusus ini adalah untuk mengetahui dan mempelajari prosedur metode validasi Kromatografi Cair Kinerja Tinggi (KCKT) serta parameternya.
Kata kunci : PT Kimia Farma, riset dan pengembangan, Kromatografi Cair Kinerja Tinggi (KCKT)
Tugas umum : xiv + 51 halaman; 2 gambar; 13 lampiran Tugas khusus : v + 30 halaman; 1 gambar; 2 tabel
Daftar Acuan Tugas Umum : 7 (2001-2009) Daftar Acuan Tugas Khusus : 13 (1974-2013)
Name : Anindita Ratnawati Aditya, S. Farm
NPM : 1306343372
Program Study : Profesi Apoteker
Title : Report of Apothecary Profession Internship at PT Kimia Farma Research and Development Unit Jl. Cihampelas No. 5 Bandung on March 3rd – March 28th 2014
Pharmacists Professional Practice at PT Kimia Farma Research and Development Unit aims to identify and understand the function and role of PT. Kimia Farma Tbk. Research and Development Unit and to know and understand the roles and tasks of Pharmacists in research and development and in particular in PT. Kimia Farma Tbk. Research and Development Unit. Given a special assignment titled Analytical Method Validation Procedures of Clotrimazole Topical Solution in High Performance Liquid Chromatography (HPLC). The purpose of this special assignment is to know and learn the method validation procedures of High Performance Liquid Chromatography (HPLC) and its parameters.
Keywords : PT Kimia Farma, research and development, High Performance Liquid Chromatography (HPLC)
General Assignment : xiv + 51 pages; 2 pictures; 13 appendices Specific Assignment : v + 30 pages; 1 pictures; 2 tables
Bibliography of General Assignment : 7 (2001-2009) Bibliography of Specific Assignment : 13 (1974-2013)
DAFTAR ISI
HALAMAN JUDUL ... ii
SURAT PERNYATAAN BEBAS PLAGIARISME ... iii
HALAMAN PERNYATAAN ORISINALITAS ... iv
HALAMAN PENGESAHAN ... v
KATA PENGANTAR ... vi
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... viii
ABSTRAK ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB 1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN UMUM PT. KIMIA FARMA Tbk. ... 3
2.1 Sejarah Singkat ... 3
2.2 Visi dan Misi ... 4
2.2.1 Visi ... 4
2.2.2 Misi ... 4
2.3 Struktur Organisasi ... 5
2.4 Sumber Daya Manusia ... 5
2.5 Budaya Perusahaan ... 5
2.6 Bidang Usaha ... 6
2.6.1 PT. Kimia Farma (holding) ... 6
2.6.2 PT. Kimia Farma Trading and Distribution (PT. KFTD) ... 8
2.6.3 PT. Kimia Farma Apotek (PT. KFA) ... 9
2.6.4 PT. Sinkona Indonesia Lestari ... 10
BAB 3. TINJAUAN KHUSUS PT. KIMIA FARMA Tbk. UNIT RESEARCH AND DEVELOPMENT ... 11
3.1Latar Belakang Berdirinya Unit Research and Development ... 11
3.2 Visi dan Misi ... 11
3.2.1 Visi ... 11
3.2.2 Misi ... 11
3.3 Fungsi ... 12
3.4 Struktur Organisasi ... 12
3.4.1 Bagian Pengembangan Produk ... 12
3.4.1.1 Sub Bagian Pengembangan Produk Farma ... 13
3.4.1.2 Sub Bagian Pengembangan Produk Non Farma ... 14
3.4.2 Bagian Pemastian Mutu ... 16
3.4.3 Bagian Umum dan Sumber Daya Manusia ... 22
3.4.3.1 Pemeliharaan dan Keamanan ... 22
BAB 4. PEMBAHASAN ... 26
4.1 PT. Kimia Farma Tbk ... 26
4.2 PT. Kimia Farma Tbk. Unit Research and Development ... 27
4.2.1 Sub Bagian Pengembangan Produk Farma ... 28
4.2.2 Sub Bagian Pengembangan Produk Non Farma dan Produk Bioteknologi ... 30
4.2.3 Bagian Pemastian Mutu ... 33
4.2.4 Gudang ... 34
4.3 Peran Apoteker dalam Riset dan Pengembangan Obat ... 35
BAB 5. KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR GAMBAR
Gambar 3.1 Bagan Manajemen Proses ... 17 Gambar 3.2 Bagan Proses Analisa ... 18
Lampiran 1. Struktur Organisasi Unit Research and Development, PT Kimia
Farma Tbk ... 39
Lampiran 2. Form Surat Permintaan Pengadaan Barang/Jasa (SPPB/J) ... 40
Lampiran 3. Form Bon Permintaan Bahan Penelitian dari Gudang ... 41
Lampiran 4. Form Bon Permintaan Barang Alat Lab/Kemasan dari Gudang ... 42
Lampiran 5. Form Bon Permintaan Aquadest dari Gudang... 43
Lampiran 6. Form Bon Permintaan Alkohol TK 95% dari Gudang ... 44
Lampiran 7. Form Bon Permintaan Barang Teknis/Investasi dari Gudang ... 45
Lampiran 8. Form Bon Permintaan Barang Lain-Lain dari Gudang ... 46
Lampiran 9. Form Berita Acara Penerimaan Barang (BAPB) Barang Dagangan .. 47
Lampiran 10. Form Berita Acara Penerimaan Barang (BAPB) Non Barang Dagangan ... 48
Lampiran 11. Contoh Surat Pesanan Barang ... 49
Lampiran 12. Contoh Surat Pengantar ... 50
1 Universitas Indonesia
BAB 1 PENDAHULUAN 1.1. Latar Belakang
Industri farmasi merupakan salah satu industri strategis yang menyangkut kesehatan manusia dalam rangka perwujudan kesehatan nasional. Oleh karena itu, industri farmasi menjadi salah satu industri yang dikontrol dan diawasi dengan ketat oleh pemerintah, dalam hal ini oleh Badan Pengawasan Obat dan Makanan (BPOM) baik ditinjau dari segi lisensi, sertifikasi maupun evaluasi produk obat yang diedarkan (Badan Pengawas Obat dan Makanan Republik Indonesia, 2001). Hal tersebut menuntut industri farmasi agar dapat menghasilkan produk obat yang memenuhi standar mutu yang dipersyaratkan. Ketersediaan obat yang bermutu tentunya ditunjang penelitian, pengembangan dan penerapan IPTEK kesehatan di bidang obat (Kementerian Negara Riset dan Teknologi Republik Indonesia, 2006). PT. Kimia Farma, Tbk. merupakan salah satu Badan Usaha Milik Negara dan merupakan industri farmasi besar di Indonesia yang memproduksi produk-produk paten baik produk-produk sintesis maupun produk-produk herbal serta juga memproduk-produksi produk generik sebagai bentuk kerjasama dengan pemerintah (PT. Kimia Farma Tbk., 2013). Produk-produk yang dihasilkan tersebut merupakan hasil penelitian dan pengembangan yang dilakukan oleh PT. Kimia Farma, Tbk. Unit Research
and Development.
Sumber daya manusia yang berkompeten diperlukan agar pelaksanaan tugas PT. Kimia Farma, Tbk., berjalan secara profesional. Sebagai salah satu sumber daya manusia yang dibutuhkan di PT. Kimia Farma, Tbk., apoteker sangat dibutuhkan kesiapannya sebagai tenaga kesehatan yang memiliki dasar pengetahuan di bidang formulasi, analisis dan registrasi obat. Apoteker diharapkan dapat memberikan kontribusi yang positif bagi tercapainya produksi obat yang terjamin aman, bermanfaat dan bermutu.
Untuk mencapai hal tersebut, Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia bekerjasama dengan PT. Kimia Farma Tbk., khususnya di Unit Research and Development menyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) pada tanggal 6 Mei – 29 Mei 2013. Praktek kerja ini diharapkan
dapat memberikan pengetahuan praktis yang dapat berguna nantinya untuk diterapkan dalam dunia kesehatan.
1.2. Tujuan
Tujuan Praktek Kerja Profesi Apoteker di PT. Kimia Farma Tbk. Unit
Research and Development adalah :
a. Untuk mengetahui dan memahami fungsi dan peran PT. Kimia Farma Tbk. Unit Research and Development.
b. Untuk mengetahui dan memahami peran dan tugas Apoteker secara umum di bidang riset dan pengembangan dan secara khusus di PT. Kimia Farma Tbk. Unit Research and Development.
3 Universitas Indonesia
BAB 2
TINJAUAN UMUM PT. KIMIA FARMA Tbk. 2.1. Sejarah Singkat
Kimia Farma adalah perusahaan industri farmasi pertama di Indonesia yang didirikan oleh Pemerintah Hindia Belanda tahun 1817. Nama perusahaan ini pada awalnya adalah NV Chemicalien Handle Rathkamp & Co. Berdasarkan kebijaksanaan nasionalisasi atas eks perusahaan Belanda di masa awal kemerdekaan, pada tahun 1958, Pemerintah Republik Indonesia melakukan peleburan sejumlah perusahaan farmasi menjadi PNF (Perusahaan Negara Farmasi) Bhinneka Kimia Farma. Pada tanggal 16 Agustus 1971, bentuk badan hukum PNF diubah menjadi Perseroan Terbatas sehingga nama perusahaan berubah menjadi PT Kimia Farma (Persero).
Sejarah berdirinya PT. Kimia Farma (Persero) Tbk. terdiri atas beberapa periode yaitu :
a.. Periode I (1957-1959)
Pada periode ini dilaksanakan nasionalisasi perusahaan farmasi milik bangsa Belanda yang ada di Indonesia. Program nasionalisasi ini dikoordinasi oleh Badan Pengambilalihan Farmasi (BAPHAR).
b. Periode II (1960-1968)
Periode ini adalah periode pembentukan Perusahaan Negara farmasi (PNF) dari perusahaan-perusahaan farmasi milik Belanda yang telah di nasionalisasikan sebelumnya. Pembentukan PNF ini berdasarkan PP. No.60/1961 dibawah koordinasi Badan Pimpinan Umum Farmasi Negara sebagai peleburan BAPHAR yang bernaung di bawah Departemen kesehatan.
c. Periode III
Untuk meningkatkan efisiensi setiap BUMN maka dikeluarkan instruksi Presiden No.17/1967 sehingga Departemen Kesehatan melebur perusahaan milik negara tersebut ke dalam Perusahaan Negara Farmasi dan Alat-Alat Kesehatan Bhinneka Kimia Farma dan PNF Kasa Husada di Surabaya dirubah menjadi perusahaan umum dan perusahaan daerah, kemudian PN Sari Husada di Yogyakarta berdiri sendiri sebagai anak perusahaan.
d. Periode IV
Periode IV dimulai tahun 1971 dan ditandai dengan dikeluarkannya PP No. 116 tahun 1971 yang berlaku sejak tanggal 19 maret 1971. Perusahaan Negara Farmasi dan Alat-Alat Kesehatan Bhinneka Kimia Farma setelah melalui proses audit dinyatakan lulus untuk menjadi Perseroan Terbatas (PT) yang selanjutnya disahkan pada tanggal 16 agustus 1971 sebagai PT. Kimia Farma (Persero) dengan Akta Notaris dan diumumkan dalam berita negara.
e. Periode V
Pada periode ini tepatnya tanggal 28 Juni 2001, PT. Kimia Farma (Persero) menjadi Perusahaan terbuka (Tbk) dengan nama PT. Kimia Farma (Persero) Tbk. Bersama dengan perubahan tersebut, PT. Kimia Farma (Persero) Tbk. telah dicatat pada Bursa Efek Jakarta dan Bursa Efek Surabaya (sekarang kedua bursa telah merger dan kini bernama Bursa Efek Indonesia).
Berbekal pengalaman selama puluhan tahun, Perseroan telah berkembang menjadi perusahaan dengan pelayanan kesehatan terintegrasi di Indonesia. Perseroan kian diperhitungkan kiprahnya dalam pengembangan dan pembangunan bangsa khususnya pembangunan kesehatan masyarakat Indonesia.
2.2. Visi dan Misi 2.2.1. Visi
Menjadi korporasi bidang kesehatan terintegrasi dan mampu menghasilkan pertumbuhan nilai yang berkesinambungan melalui konfigurasi dan koordinasi bisnis yang sinergis.
2.2.2. Misi
Menghasilkan pertumbuhan nilai korporasi melalui usaha di bidang-bidang :
a. Industri kimia dan farmasi dengan basis penelitian dan pengembangan produk yang inovatif.
b. Perdagangan dan jaringan distribusi.
5
2.3. Struktur Organisasi
PT. Kimia Farma Tbk. dipimpin oleh seorang Direktur Utama yang membawahi empat Direktorat, yaitu Direktorat Pemasaran, Direktorat Produksi, Direktorat Umum dan SDM, dan Direktorat Keuangan, yang masing-masing dipimpin oleh seorang direktur.
2.4. Sumber Daya Manusia
Jumlah karyawan perusahaan dan anak perusahaan per 30 Juni 2011 yaitu sebanyak 5.306 orang. Dalam menjalankan operasional perusahaan, manajemen menyadari bahwa peran sumber daya manusia sangat penting. Strategi manajemen untuk menggali kemampuan karyawan yaitu dengan mengalokasikan dana setiap tahunnya untuk program pengembangan sumber daya manusia, meliputi pelatihan, seminar, lokakarya di dalam negeri maupun luar negeri. Selain itu, setiap tahunnya perusahaan juga mengirimkan karyawannya untuk mengikuti pendidikan di perguruan tinggi untuk menambah wawasan dan meningkatkan kemampuan karyawan (PT. Kimia Farma Tbk., 2007).
2.5. Budaya Perusahaan (PT. Kimia Farma Tbk., 2013)
Dalam menjalankan usaha, PT. Kimia Farma Tbk. mengacu pada nilai-nilai perusahaan “I CARE” (Innovative, Costumer First, Accountability,
Responsibility, Eco Friendly) yang menjadi pedoman dalam berkarya membangun
kesehatan bangsa. Yang dimaksud dengan I CARE tersebut adalah:
I : Innovative, memiliki budaya berpikir out of the box dan membangun produk unggulan.
C : Costumer First, mengutamakan pelanggan sebagai rekan kerja/mitra. A : Accountability, bertanggung jawab atas amanah yang dipercayakan oleh
perusahaan dengan memegang teguh profesionalisme, integritas, dan kerjasama.
R : Responsibility, memiliki tanggung jawab pribadi untuk bekerja tepat waktu, tepat sasaran dan dapat diandalkan.
E : Eco Friendly, menciptakan dan menyediakan produk maupun jasa layanan yang ramah lingkungan.
2.6. Bidang Usaha
PT. Kimia Farma Tbk. memiliki beberapa bidang usaha yang pengelolaannya dibagi antara PT. Kimia Farma Tbk. dan dua anak perusahaannya. Bidang usaha industri didukung oleh riset dan pengembangan serta pemasaran, yang dikelola oleh PT. Kimia Farma Tbk. (holding). Sedangkan, bidang usaha ritel farmasi/ apotek, klinik, dan laboratorium klinik, serta perdagangan dan distribusi dikelola oleh anak perusahaan, yaitu PT. Kimia Farma Apotek dan PT. Kimia Farma Trading and Distribution (PT. Kimia Farma Tbk., 2013).
2.6.1. PT. Kimia Farma (holding)
Dengan dukungan kuat riset dan pengembangan, segmen usaha yang dikelola oleh perusahaan induk ini memproduksi obat jadi dan obat tradisional, yodium, kina, dan produk-produk turunannya, serta minyak nabati. Lima fasilitas produksi yang tersebar di kota-kota besar di Indonesia merupakan tulang punggung dari segmen industri, dimana kelimanya telah mendapatkan sertifikat Cara Pembuatan Obat yang Baik (CPOB) dan sertifikat ISO 9001 dan 140001 dari institusi luar negeri (Llyod’s, SGS, TUV).
Hasil produksi yang dihasilkan berupa produk obat-obat kimia dan herbal, dibagi dalam enam lini produksi yaitu etikal, obat bebas, generik, narkotik, lisensi dan bahan baku. Hampir semua kelas terapi diakomodasi oleh produk perusahaan yang terdiri dari 385 item produk dan dipasarkan ke seluruh Indonesia serta diekspor ke beberapa negara melalui jaringan distribusi perseroan atau yang memiliki perjanjian dengan perseroan.
PT. Kimia Farma Tbk. memiliki lima fasilitas produksi yang tersebar di lima kota di Indonesia. Kelima fasilitas produksi tersebut, yaitu:
a. Unit Produksi Jakarta di Pulogadung DKI Jakarta
Pabrik Jakarta merupakan satu-satunya pabrik obat di Indonesia yang mendapat tugas dari Pemerintah untuk memproduksi obat golongan narkotika. Pabrik ini telah memperoleh sertifikat Cara Pembuatan Obat yang Baik (CPOB) dan ISO-9002 serta mendapat rating ”A” untuk sertifikasi dari Badan POM. Di pabrik ini telah beroperasi fasilitas pembuatan produk Antiretroviral
7
obat HIV/ AIDS dalam negeri. Pabrik ini juga mendapatkan Proper Biru dalam pengolahan limbah dari Kementerian Lingkungan Hidup dan penghargaan dari Gubernur DKI Jakarta untuk Ketaatan dan Kinerja Pengolahan Lingkungan. Sediaan yang diproduksi di Pabrik Jakarta antara lain tablet, tablet salut, kapsul, granul, sirup kering, suspensi/ sirup, tetes mata, krim, dan injeksi (PT. Kimia Farma Tbk., 2011).
b. Unit Produksi Bandung di Jawa Barat
Pabrik Bandung memproduksi bahan baku kina dan turunannya, obat-obat herbal, serta Alat Kontrasepsi dalam Rahim (AKDR). Pabrik ini telah mendapatkan US-FDA Approval (Badan Pengawas Makanan dan Obat-Obatan Amerika Serikat) dan menerima sertifikat Cara Pembuatan Obat yang Baik (CPOB) untuk produksi tablet, sirup, serbuk, dan pil KB. Selain itu, pabrik ini juga menerapkan Sistem Manajemen Mutu ISO-9002, serta mendapat rating ”A” untuk sertifikasi dari Badan POM dan Kosher Certificated dari Court of the Chief Rabbi Beth Din London. Pabrik Bandung juga mendapatkan sertifikat produk garam kina dari European Directorate for the Quality of Medicines (EDQM) dan sertifikat halal MUI Jawa Barat (PT. Kimia Farma Tbk., 2011).
c. Unit Produksi Semarang di Jawa Tengah
Pabrik Semarang mengkhususkan diri pada produksi minyak jarak, minyak nabati, dan kosmetik (bedak). Pabrik ini telah menerapkan Sistem Manajemen Mutu ISO-9001 serta telah mendapatkan sertifikat Cara Pembuatan Kosmetik yang Baik (CPKB) (PT. Kimia Farma Tbk., 2011).
d. Unit Produksi Watudakon di Jombang Jawa Timur
Pabrik Watudakon merupakan satu-satunya pabrik yang mengolah tambang yodium di Indonesia dan telah mendapatkan sertifikat CPOB, ISO-9001 dan ISO 14001. Pabrik ini juga memproduksi bahan baku fero sulfat sebagai bahan utama pembuatan tablet besi untuk obat penambah darah serta kapsul lunak “yodiol” yang merupakan obat untuk pencegahan gondok. Selain itu, Pabrik Watudakon juga memproduksi obat dalam sediaan tablet, tablet salut, salep, sirup, dan cairan obat untuk penggunaan luar dan dalam (PT. Kimia Farma Tbk., 2011).
e. Unit Produksi Tanjung Morawa di Medan Sumatera Utara
Produk dari Pabrik Tanjung Morawa ditujukan untuk memasok kebutuhan obat di wilayah Sumatera dan sudah mendapatkan sertifikat Cara Pembuatan Obat yang Baik (CPOB) serta mendapat rating ”A” untuk sertifikasi dari Badan POM. Sediaan yang diproduksi oleh pabrik ini antara lain tablet, krim, dan kapsul (PT. Kimia Farma Tbk., 2011).
Bidang industri PT. Kimia Farma Tbk. didukung oleh Unit Research and
Development yang berlokasi di Bandung. Unit Research and Development ini
melaksanakan kegiatan penciptaan produk baru dan pengembangan produk-produk PT. Kimia Farma Tbk. Dalam bidang riset dan pengembangan, PT. Kimia Farma Tbk. telah menjalin kerja sama dengan beberapa perguruan tinggi, antara lain Universitas Indonesia, Institut Teknologi Bandung, Universitas Sumatra Utara, Universitas Padjajaran, Universitas Airlangga, dan Universitas Gadjah Mada (PT. Kimia Farma Tbk., 2011).
2.6.2. PT. Kimia Farma Trading and Distribution (PT. KFTD)
Awalnya bidang perdagangan dan distribusi dikelola oleh Divisi Pedagang Besar Farmasi (PBF) dari PT. Kimia Farma Tbk. Berbekal kemampuan dan pengalaman dalam menangani pendistribusian produk-produk PT. Kimia Farma Tbk., pada tanggal 4 Januari 2003, Divisi PBF berkembang menjadi anak perusahaan dengan nama PT. Kimia Farma Trading and Distribution (PT. KFTD).
Tugas utama PT. KFTD adalah mendistribusikan produk-produk Kimia Farma ke berbagai jaringan yang tersebar di seluruh nusantara, yang mencakup 33 provinsi dan 466 kabupaten/ kota. Saat ini, terdapat 41 cabang PT. KFTD yang tersebar di berbagai daerah di Indonesia.
Sebagai penyedia Jasa Layanan Distribusi, KFTD mendistribusikan aneka produk dari perusahaan induk, produk dari prinsipal lainnya serta produk-produk non prinsipal. KFTD mendistribusikan produk-produk tersebut melalui penjualan reguler ke Apotek (Apotek Kimia Farma dan Apotek selain Kimia Farma), Rumah Sakit, Toko Obat, Supermarket dan lain sebaginya. Di bidang Jasa Perdagangan atau Trading, KFTD melayani dan membantu program-program Pemerintah untuk
9
memenuhi kebutuhan obat-obatan bagi masyarakat di seluruh Indonesian (PT. Kimia Farma Tbk., 2011).
2.6.3. PT. Kimia Farma Apotek (PT. KFA)
PT. KFA adalah anak perusahaan PT. Kimia Farma Tbk. yang didirikan berdasarkan akta pendirian Nomor 6 tanggal 4 Januari 2003 yang dibuat dihadapan notaris yang telah mendapatkan persetujuan dari Menteri Kehakiman dan Hak Asasi Manusia. PT. KFA memiliki tujuan untuk memberikan layanan prima atas penjualan produk farmasi, serta solusi jasa layanan kefarmasian untuk seluruh rakyat Indonesia. Untuk mencapai hal tersebut, PT. KFA melakukan beberapa hal antara lain usaha dalam bidang pengelolaan apotek dan klinik (PT. Kimia Farma Tbk., 2011).
Jumlah outlet Apotek Kimia Farma saat ini berjumlah 390 dan menyumbang pendapatan terbesar. Klinik Kimia Farma menyediakan layanan berupa klinik dasar, klinik spesialis, dan klinik gigi. Saat ini klinik kesehatan Kimia Farma berjumlah 9 buah (PT. Kimia Farma Tbk., 2011).
Pada tahun 2010 dibentuk anak perusahaan PT. KFA, yaitu PT. Kimia Farma Diagnostika (PT. KFD). Tujuannya adalah agar bisnis jasa layanan kesehatan dapat lebih fokus sehingga makin berkembang mendukung layanan one
stop health care service. PT. KFD menyediakan layanan laboratorium klinik.
Untuk meningkatkan penjualan, PT. KFD melakukan kerja sama dengan beberapa perusahaan BUMN dan swasta untuk melaksanakan medical check up karyawan. Saat ini, terdapat 38 laboratorium klinik yang dikelola oleh PT. KFD (PT. Kimia Farma Tbk., 2011).
2.6.4. PT. Sinkona Indonesia Lestari
PT. Sinkona Indonesia Lestari (SIL) berdiri di kawasan hijau perkebunan teh milik PTPN VIII di Ciater, Kabupaten Subang, Jawa Barat. Perusahaan yang bergerak di bidang industri garam kina dan derivatnya ini diresmikan oleh Menteri Pertanian RI dan Menteri Kesehatan RI pada 31 Agustus 1991.
Saham PT. SIL saat ini dimiliki oleh tiga pemegang saham yaitu PT. Kimia Farma (Persero) Tbk, PTP Nusantara VIII dan Yayasan Kartika Eka Paksi
dimana PT. Kimia Farma (Persero) Tbk. merupakan pemegang saham mayoritas dengan 56% saham. Pemasaran produk hampir 100% ke luar negeri, sehingga agar dapat bersaing di pasar global, sejak tahun 1996 SIL telah menerapkan SMM ISO 9002 : 1994 dan tahun 1999 menerapkan SML ISO 14001 : 1996 dengan sertifikasi PT SGS Indonesia. Selanjutnya, sertifikasi sistem-sistem manajemen tersebut diperbaharui hingga saat ini menjadi SMM ISO 9001 : 2008 dan ISO 14001 : 2004. Selain SMM dan SML, SIL mendapatkan pula sertifikat CPOB dari Badan POM, Halal dari MUI dan Kosher dari London Beth Din.
11 Universitas Indonesia
BAB 3
TINJAUAN KHUSUS
PT. KIMIA FARMA Tbk. UNIT RESEARCH AND DEVELOPMENT 3.1. Latar Belakang Berdirinya Unit Research and Development
Kegiatan penelitian dan pengembangan pada mulanya dilakukan oleh setiap unit produksi PT. Kimia Farma Tbk. Seiring berjalannya waktu, dilakukan pemusatan kegiatan penelitian dan pengembangan tersebut. Hal ini dikaitkan dengan adanya perubahan pola konsumsi di tengah masyarakat dan persaingan pasar sehingga diperlukan penelitian dan pengembangan secara terpadu dan terfokus dari seluruh unit produksi untuk memenuhi keinginan dan kebutuhan masyarakat terhadap obat. Untuk mewujudkan hal tersebut maka PT. Kimia Farma Tbk. membangun Divisi Riset dan Teknologi di bawah Direktorat Produksi pada tanggal 19 Juni 1991 yang berlokasi di Jalan Cihampelas Nomor 5 Bandung. Pada tahun 2003 bersamaan dengan perubahan struktur organisasinya, divisi ini berubah menjadi Unit Research and Development.
3.2. Visi dan Misi 3.2.1. Visi
Menjadi unit yang menghasilkan produk unggulan yang bermutu, inovatif dan kompetitif di pasar.
3.2.2. Misi
a. Mengembangkan produk baru farmasi, bahan baku kimia dan bahan baku obat alami unggulan yang bermutu, berkhasiat dan kompetitif di pasaran.
b. Mengembangkan produk baru melalui kerja sama dengan lembaga penelitian alam dan luar negeri.
c. Mengembangkan penelitian produk eksis di pabrik untuk meningkatkan mutu dan efisiensi.
d. Mengembangkan sumber daya manusia yang mempunyai akhlak tinggi, berkompetensi tinggi dalam kaidah-kaidah pengembangan teknologi dan ilmu pengetahuan yang berorientasi pasar.
3.3. Fungsi (PT. Kimia Farma Tbk., 2013)
a. Sebagai pusat penelitian produk baru dari bahan sintesis dan bahan alam melingkupi penyediaan bahan baku, formulasi, dan analisis.
b. Sebagai pusat penelitian renovasi produk eksis, bantuan teknis teknologi bagi unit lain, dan pengembangan berkelanjutan yang efisien dalam proses.
c. Sebagai pusat informasi produk dan perkembangan ilmu pengetahuan serta peraturan yang berhubungan dengan kefarmasian.
d. Sebagai koordinator kerja sama penelitian dengan institusi di luar PT. Kimia Farma Tbk.
e. Pemantauan paten produk baru.
3.4. Struktur Organisasi
Menurut SK. Dir. No 38/ DIR/ IX/ 2012 tanggal 18 September 2012, struktur organisasi Unit Research and Development dipimpin oleh seorang manajer yang terdiri dari dua bagian yaitu Bagian Pengembangan Produk dan Bagian Pemastian Mutu. Kedua bagian ini dipimpin oleh asisten manajer. Bagian pengembangan produk membawahi sub bagian pengembangan produk farma, sub bagian pengembangan produk non farma, sub bagian pengembangan produk bioteknologi, dan sub bagian pengembangan tanaman obat sedangkan bagian pemastian mutu membawahi sub bagian pemastian mutu dan sub bagian sistem mutu.
Sub bagian Sumber Daya Manusia dan Umum serta Sub bagian Akuntansi dan keuangan berada langsung dibawah manajer. Setiap sub bagian dipimpin oleh supervisor. Sementara itu, terdapat jabatan fungsional yang dalam hal ini adalah peneliti. Jabatan fungsional ini mempunyai kedudukan setara dengan asisten manajer. Struktur Organisasi Divisi Pengembangan Bisnis Strategi PT. Kimia Farma Tbk. dapat dilihat pada Lampiran 1.
3.4.1. Bagian Pengembangan Produk
Bagian Pengembangan Produk memiliki tugas dan fungsi, antara lain menciptakan produk baru dengan mengembangkan formula dari zat aktif bahan sintesis atau bahan alam, mengerjakan reformulasi produk yang sudah ada atau
13
sudah eksis, dan melakukan bantuan teknis baik untuk internal maupun eksternal PT. Kimia Farma Tbk.
Pengembangan produk baru dilaksanakan berdasarkan ide yang diusulkan oleh Unit Research and Development, Unit Marketing, Unit Produksi, Direksi PT. Kimia Farma Tbk., maupun program Pemerintah yang kemudian diajukan dalam rapat koordinasi yang dinamakan rapat produk baru, penelitian tiap tahun dituangkan dalam RKAP sedangkan reformulasi produk eksis berasal dari pemintaan pabrik.
Bagian Pengembangan Produk mempunyai empat sub bagian yaitu Sub Bagian Pengembangan Produk Farma, Sub Bagian Pengembangan produk Non Farma, Sub Pengembangan Produk Bioteknologi, dan Sub Bagian Pengembangan Tanaman Obat.
3.4.1.1. Sub Bagian Pengembangan Produk Farma
Proses pengembangan produk diawali dengan preformulasi. Formulator melakukan studi literatur mengenai zat aktif dan zat tambahan yang akan digunakan, juga tentang bentuk sediaan yang akan dibuat serta fasilitas pabrik yang akan memproduksinya.
Sebelum membuat rancangan formula, dilakukan uji interaksi antar zat yang digunakan. Uji interaksi dilakukan dengan mencampur bahan aktif dan bahan tambahan dengan perbandingan 1:5 kemudian campuran ini disimpan pada suhu ruang dan 60oC selama 1 bulan. Campuran ini diperiksa ada tidaknya interaksi fisik yang muncul pada hari ke 15 dan hari ke 30. Uji interaksi dilakukan untuk semua bahan tambahan. Pemeriksaan terhadap hasil uji interaksi terbatas pada pengamatan fisik saja.
Formula alternatif dirancang berdasarkan hasil preformulasi dan hasil uji interaksi. Formula-formula tersebut dibuat dalam skala laboratorium. Sediaan yang baik dan memenuhi spesifikasi secara fisik diserahkan ke Sub bagian pemastian untuk dievaluasi. Jika hasil analisis menunjukkan sediaan tersebut dapat memenuhi spesifikasi yang dipersyaratkan maka selanjutnya akan dilakukan validasi proses pembuatan skala laboratorium.
Setelah dipilih formula yang terbaik, tahap berikutnya yang dapat dilakukan adalah uji stabilitas. Uji yang dilakukan adalah uji stabilitas dipercepat
yang dilakukan pada suhu 40±2ºC dengan RH 75±5% dan uji stabilitas jangka panjang pada suhu 30±2ºC dengan RH 75±5%. Untuk skala laboratorium, uji stabilitas boleh dilakukan atau tidak dilakukan dimana uji ini berfungsi sebagai percepatan informasi mengenai stabilitas sebelum masuk ke tahap skala pilot. Sediaan yang stabil kemudian dibuat dalam skala pilot dan divalidasi proses pembuatannya. Selanjutnya, juga dilakukan uji stabilitas dipercepat selama 6 bulan dan uji stabilitas jangka panjang hingga diperoleh waktu kadaluwarsa produk. Untuk persyaratan dokumen registrasi dibutuhkan data stabilitas selama 1 tahun baik uji stabilitas dipercepat maupun jangka panjang.
Sebanyak 40 jenis obat disyaratkan oleh Badan POM untuk diuji ekuivalensi atau bioavailabilitas dan uji bioekuivalensi (Uji BA/BE). Jika sediaan yang dibuat termasuk dalam obat yang harus diuji ekuivalensi, maka sediaan tersebut dapat diuji ekuivalensi bersamaan dengan pendaftaran pra registrasi, dengan syarat uji ekivalensi harus selesai pada pendaftaran registrasi tersebut.
Ada beberapa dokumen dan laporan yang harus dibuat oleh Subunit Formulasi, antara lain Catatan Pengolahan/ Pengemasan Bets (CPB), protokol validasi, laporan validasi, dan dokumen pengembangan produk. Dokumen dan laporan tersebut digunakan untuk melengkapi dokumen registrasi. Jika sediaan telah mendapatkan nomor izin edar, maka tahap selanjutnya adalah pembuatan skala produksi yang dilakukan di Unit Produksi. Tiga bets pertama dari skala produksi sediaan tersebut dalam pembuatannya masih didampingi dan merupakan tanggung jawab Unit Pengembangan Produk Farma.
3.4.1.2. Sub Bagian Pengembangan Produk Non Farma
Sub bagian Pengembangan Produk Non Farma melakukan kegiatannya di Laboratorium Ekstraksi bahan Alam (EBA). Sub bagian ini terdiri dari dua unit yaitu budidaya dan penyediaan bahan alam serta laboratorium atau pilot ekstraksi bahan alam. Sasaran Sub bagian Pengembangan Produk Non Farma adalah: a. Perbaikan proses produksi yang eksis di pabrik, yaitu memperoleh teknologi
15
b. Pengembangan produk dari produk yang eksis di pabrik, yaitu memperoleh produk kimia dan bahan alam bermutu dan efisien yang berasal dari produk yang sudah ada.
c. Perolehan produk dan proses baru, yaitu memperoleh produk baru kimia dan bahan alam bermutu dan efisien sebagai bahan baku farmasi, produk penunjang pertanian, dan produk pengolahan limbah
d. Pelayanan kebutuhan ekstrak, yaitu melayani kebutuhan bahan alam dan proses bahan alam baik untuk internal maupun eksternal Kimia Farma.
Terdapat tiga fasilitas yang menunjang budidaya tanaman di PT. Kimia Farma Tbk. Unit Research and Development, yaitu Kebun Tanaman Obat Bintang di Cianjur seluas 500 Ha, Kebun Percobaan Banjaran di Bandung seluas 5 Ha, dan laboratorium kultur jaringan. Bagian budidaya tanaman memiliki dua target dalam pelaksanaannya yaitu menghasilkan kuantitas tanaman yang maksimal dan kualitas tanaman yang memenuhi persyaratan mutu yang telah ditetapkan (kadar zat identitas maksimal).
Sebelum melakukan budidaya tanaman, dilakukan studi literatur meliputi pencarian informasi nomenklatur tanaman, bagian tanaman yang digunakan, khasiat, dan kandungan kimia. Lalu pada pembudidayaan tanaman, diaplikasikan teknologi budidaya mulai saat pembibitan, penanaman (meliputi kondisi tanah, perlakukan jarak tanam, pemupukan, dan kondisi lain), pemeliharaan (meliputi pemupukan dan penyiraman), panen (meliputi cara panen dan umur panen), serta pacapanen (meliputi penyimpanan tanaman segar, pengeringan menjadi simplisia, dan pengemasannya).
Bagian laboratorium atau pilot ekstraksi bahan alam bertanggung jawab dalam pembuatan bahan baku dari bahan alam berupa ekstrak atau isolat untuk kepentingan penelitian atau produksi. Dalam pelaksanaannya terdapat tiga target yaitu kualitas memenuhi standar mutu, kuantitas maksimal (rendemen maksimal), layak secara teknik (dapat diaplikasikan skala industri), ekonomis (biaya relatif rendah), dan ramah lingkungan (relatif tidak memberikan dampak negatif terhadap lingkungan).
Sebagian besar ekstraksi dilakukan dengan metode refluks. Ekstrak yang dihasilkan disampling untuk dihitung kadarnya, kemudian disaring dan ditampung
sebelum dipekatkan. Pemekatan ekstrak dilakukan dengan menggunakan metode pemanasan dan destilasi etanol. Setelah didapatkan ekstrak pekat, dilakukan sampling kembali sebelum diserahkan ke bagian produksi.
3.4.2. Bagian Pemastian Mutu
Bagian Lab. Pemastian Mutu mempunyai fungsi: a. Penelitian
Sebagai Lab. Penelitian yang harus dapat menunjang proses penelitian yang benar.
b. Pengujian
Sebagai Lab. Pengujian harus memenuhi sistem manajemen mutu laboratorium pengujian yaitu SNI 19-17025-2005
Unit Research and Development dimana terdiri dari produk bahan kimia dan produk bahan alam, serta melakukan analisis produk-produk tersebut. Penelitian metode analisis dilakukan dengan studi literatur yang dicari dari farmakope dan percobaan. Jika tidak ada, digunakan metode analisis yang berasal dari jurnal atau supplier. Metode analisis juga bisa diperkirakan dari metode analisis bahan yang memilki kesamaan atau analog. Penelitian metode analisis bahan alam lebih sulit karena beragamnya kandungan kimia dalam bahan alam.
Bagian pemastian mutu melakukan pengujian produk berdasarkan produk farma atau non farma, produk baru atau me too, dan bentuk sediaan, sehingga pengujian yang dilakukan berbeda. Contohnya, sediaan tablet dilakukan pengujian profil disolusi, uji sterilitas dan endotoksin untuk sediaan steril, dan uji bioekivalensi untuk produk me too. Pengujian yang dilakukan di bagian pemastian mutu untuk bahan baku dan produk jadi.Pengujian bahan baku dilakukan terhadap senyawa aktif dan bahan pembantu. Pengujian yang dilakukan seperti: pemerian, identifikasi, kelarutan, logam berat, kadar air, Ph, titik leleh/lebur, kadar, distribusi partikel, disolusi, bulk density, isomer, dan lain-lain.
17
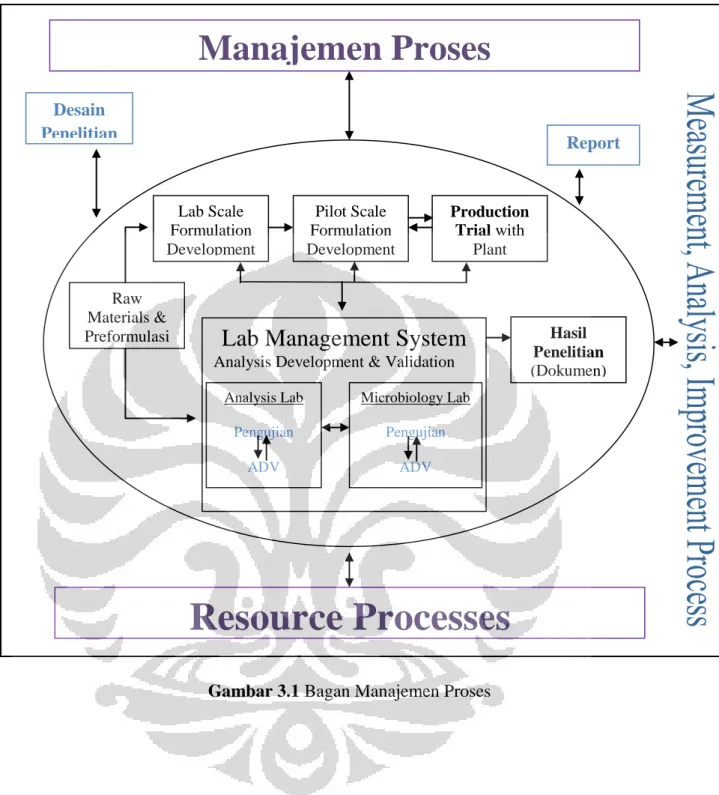
Gambar 3.1 Bagan Manajemen Proses Desain Penelitian Raw Materials & Preformulasi Lab Scale Formulation Development Pilot Scale Formulation Development Production Trial with Plant Hasil Penelitian (Dokumen)
Lab Management System
Analysis Development & Validation Analysis Lab Pengujian ADV Microbiology Lab Pengujian ADV Report
Resource Processes
Manajemen Proses
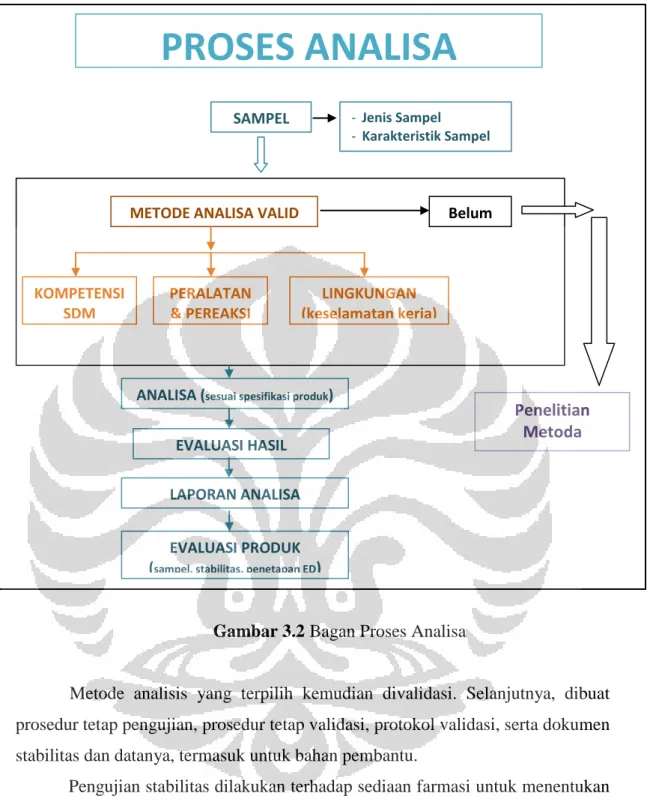
Gambar 3.2 Bagan Proses Analisa
Metode analisis yang terpilih kemudian divalidasi. Selanjutnya, dibuat prosedur tetap pengujian, prosedur tetap validasi, protokol validasi, serta dokumen stabilitas dan datanya, termasuk untuk bahan pembantu.
Pengujian stabilitas dilakukan terhadap sediaan farmasi untuk menentukan waktu kadaluarsa dari suatu sediaan farmasi serta menjamin apakah produk farmasi tersebut memenuhi persyaratan mutu, keamanan dan khasiat. Bagian stabilitas memiliki tugas untuk membuat protokol dan uji stabilitas terhadap suatu formulasi. Uji stabilitas ini dibagi menjadi dua yaitu uji stabilitas dipercepat sebagai perkiraan awal batas kadaluarsa produk dan uji stabilitas jangka panjang (on going) untuk menentukkan tanggal kadaluarsa suatu produk jadi. Kegunaan
PROSES ANALISA
SAMPEL - Jenis Sampel- Karakteristik Sampel
METODE ANALISA VALID Belum
KOMPETENSI SDM PERALATAN & PEREAKSI LINGKUNGAN (keselamatan kerja)
ANALISA (sesuai spesifikasi produk)
EVALUASI HASIL LAPORAN ANALISA EVALUASI PRODUK (sampel, stabilitas, penetapan ED)
Penelitian Metoda
19
lain uji stabilitas yaitu untuk meningkatkan penggunaan dan kepercayaan konsumen karena dapat memperkirakan penggunaan produk farmasi yang telah diketahui waktu kadaluarsanya.
Uji mikrobiologi dilakukan pada produk bahan alam, antibiotik, dan sediaan steril. Analisis mikrobiologi yang dilakukan oleh subunit ini meliputi uji potensi sediaan antibiotik, uji sterilitas sediaan steril, dan uji Angka Lempeng Total (ALT). Uji potensi digunakan pada sediaan antibiotika untuk menetapkan konsentrasi minimal obat yang dapat menghambat pertumbuhan mikroba. Uji sterilitas digunakan pada sediaan steril yang bertujuan untuk menentukan apakah sediaan steril tersebut memenuhi persyaratan yang telah ditetapkan sedangkan uji Angka Lempeng Total (ALT) untuk menentukan jumlah total bakteri yang terdapat pada sampel yang diperiksa. Pada bahan baku herbal dilakukan juga pengujian berdasarkan jenis bahan bahan baku, simplisia, ekstrak, isolat, atau crude. Pengujian bahan baku herbal secara umum adalah pemerian, identikasi TLC, ALT, bakteri pathogen, angka kapang dan kamir, pengujian lainnya untuk simplisia seperti makrokopi/mikrokopis, kadar air, kadar abu total, tidak larut asam dan kadar sari larut etanol.
Untuk dokumen yang harus disiapkan yaitu: a. Bahan Aktif
Spesifikasi bahan baku aktif
Prosedur tetap pengujian bahan aktif - Prosedur tetap identifikasi bahan aktif - Prosedur tetap pengujian kadar
- Prosedur tetap pengujian lainnya tergantung pada parameter yang tertera spesifikasi bahan aktif
Laporan pengujian bahan baku aktif
CoA bahan baku aktif dari produsen b. Bahan Baku Pembantu
Spesifikasi bahan baku pembantu
Prosedur tetap pengujian
- Prosedur tetap identifikasi bahan baku pembantu - Prosedur tetap kadar
- Prosedur tetap pengujian lainnya tergantung pada parameter yang tertera
Laporan pengujian bahan baku pembantu
CoA bahan baku pembantu dari produsen c. Produk Jadi
Spesifikasi produk jadi
Prosedur tetap pengujian produk jadi
- Prosedur tetap identifikasi bahan aktif dalam produk jadi - Prosedur tetap pengujian kadar bahan aktif dalam produk jadi
- Prosedur tetap pengujian lainnya tergantung pada parameter yang tertera spesifikasi produk jadi
Laporan pengujian produk jadi dari 3 batch sesuai dengan bahan baku aktif yang digunakan.
Protokol profil disolusi terbanding produk jadi dengan kompetitor/inovator.
Laporan profil disolusi terbanding produk jadi dengan kompetitor/inovator.
Kromatogram HPLC dari produk jadi sebanyak 2 batch. d. Validasi Metoda Analisis
Protokol validasi metoda analisa
Prosedur tetap validasi metode analisa
Data validasi metoda analisa e. Stabilitas
Protokol stabilitas skala pilot
Data stabilitas on going sampai ED dan dipercepat minimal 6 bulan.
Evaluasi data stabilitas untuk memprakiraan waktu daluarsa/expire date (ED)
f. Baku Pembanding
CoA Reference Standard (USP/BP/EP/ ...)
MSDS Reference Standard (USP/BP/EP/ ...)
Prosedur Tetap Pembuatan Working Standard
21
Prosedur Tetap Pengujian Antara Working Standard
Laporan Pengujian Working Standard
Bagian Pemastian Mutu juga melakukan uji ekuivalensi in vitro yaitu uji disolusi terbanding (UDT) yaitu uji disolusi komparatif yang dilakukan untuk menunjukkan similiaritas profil disolusi antara obat uji dengan obat innovator atau komparator. UDT dapat dilakukan sebagai pendahuluan uji BE. Jika UDT menunjukkan hasil yang kurang baik maka tidak perlu membuang dana dan waktu untuk melakukan uji BE. Selain melakukan analisis sampel yang berasal dari internal Unit Research and Development dan unit lain di Kimia Farma, juga menyediakan layanan jasa analisis untuk eksternal Kimia Farma.
Instrumen yang menunjang proses analisis antara lain kromatografi cair kinerja tinggi (KCKT), spektrofotometer UV-Vis, spektrofotometer infra merah, spektrofotometer serapan atom, kromatografi lapis tipis densitometer, potensiometer, alat uji disolusi, dan lain-lain. Alat-alat tersebut dikaliberasi secara berkala, yaitu antara enam bulan sampai setahun sekali oleh orang yang memiliki sertifikat kompetensi dalam bidang kalibrasi.
Laboratorium penguji harus memenuhi persyaratan sesuai Sistem Manajemen Mutu Laboratorium SNI 19-17025-2005, yaitu:
a. Persyaratan Manajemen (15 komponen) - Organisasi
- Sistem manajemen - Pengendalian dokumen
- Kaji ulang permintaan, tender, dan kontrak - Subkontrak pengujian dan kalibrasi
- Pembelian jasa dan perbekalan - Pelayanan kepada customer - Pengaduan
- Pengendalian pekerjaan pengujian dan/atau kalibrasi yang tidak sesuai - Peningkatan
- Tindakan perbaikan - Tindakan pencegahan - Pengendalian rekaman
- Audit internal
- Kaji ulang manajemen
b. Persyaratan Teknis (10 komponen) - Umum
- Personil
- Kondisi akomodasi dan kondisi lingkungan
- Metode pengujian, metode kalibrasi, dan validasi metode - Peralatan
- Ketertelusuran pengukuran - Pengambilan sampel
- Penanganan barang yang diuji dan dikalibrasi - Jaminan mutu hasil pengujian dan kalibrasi - Pelaporan hasil
3.4.3. Sub Bagian Umum dan Sumber Daya Manusia
Bagian ini dipimpin oleh seorang supervisor yang membawahi beberapa bagian, yaitu Umum, Bagian Sumber Daya Manusia (SDM), Bagian Pemeliharaan dan Keamanan, Bagian Pengadaan, Bagian Gudang.
3.4.3.1. Pemeliharaan dan Keamanan
Bagian Pemeliharaan dan Bagian Keamanan bertugas melakukan pemeliharaaan dan menjaga keamanan gedung, laboratorium, rumah dinas, kendaraan dinas, kebun tanaman obat, kebun percobaan, dan instalasi listrik di PT. Kimia Farma Tbk. Unit Research and Development.
3.4.3.2. Pengadaan
Bagian Pengadaan PT. Kimia Farma Tbk. Unit Research and Development bertanggung jawab terhadap pengadaan barang dan jasa. Pengadaan barang yang dilakukan, antara lain bahan baku dan zat kimia, alat laboratorium, kemasan, barang teknik, dan barang lain-lain. Beberapa contoh bahan baku dan zat kimia yang diadakan adalah zat aktif obat, zat tambahan obat, zat kimia pro analisis, dan pelarut. Contoh pengadaan jasa yang dilakukan, antara lain jasa perbaikan alat
23
Permintaan pengadaan barang diajukan oleh masing-masing subunit dan bagian dengan menggunakan Surat Permintaan Pemesanan Barang/ Jasa (SPPBJ) ke Bagian Pengadaan (Lampiran 2). SPPBJ tersebut diisi oleh subunit atau bagian yang meminta dengan persetujuan penanggung jawab (asisten manajer atau supervisor) subunit atau bagian tersebut. Formulir juga harus mendapat persetujuan bagian keuangan dan akuntansi, serta dari Manajer Unit Research and
Development. Setelah SPPBJ mendapatkan persetujuan dari Manajer Unit Research and Development untuk diadakan selanjutnya Bagian Pengadaan
mencari penawaran dari supplier.
Hal yang menjadi pertimbangan dalam pemilihan supplier adalah kualitas barang, harga, ketepatan waktu pengiriman barang, dan jangka waktu pembayaran. Pengadaan barang atau jasa selain dari supplier juga bisa dari unit lain di PT. Kimia Farma Tbk. Contoh pengadaan dari unit lain adalah pengadaan bahan baku obat dari Unit Produksi. Permohonan pengadaan bahan baku ke PT. Kimia Farma unit produksi ini dilakukan langsung oleh pimpinan unit Research
and Development ke Manajer bagian Produksi. Bahan yang dimaksud dihitung
sebagai barang pembebanan dan pembayarannya langsung diurus antar bagian akuntansi kedua perusahaan melalui NPI (Nota Pembebanan Intern).
Setelah supplier didapatkan, Bagian Pengadaan membuat Surat Pemesanan Barang atau Jasa (SPB) ke supplier (Lampiran 11). Untuk pembelian bahan baku impor, pemesanan dilakukan melalui kantor pusat di Jakarta, namun pembebanan biaya tetap dikenakan kepada Unit Research and Development.
3.4.3.3. Gudang
Bagian Gudang PT. Kimia Farma Tbk. Unit Research and Development bertanggung jawab terhadap penerimaan, penyimpanan, dan pendistribusian barang yang datang ke Unit Research and Development. Selain itu, Bagian Gudang juga bertanggung jawab dalam pengiriman barang dari unit Research and
Development ke unit lain di Kimia Farma. Supplier akan mengantarkan barang
yang dipesan bersama dengan Surat Jalan dan Surat Pengantar (Lampiran 11 dan Lampiran 13). Bagian gudang akan memeriksa Surat Jalan dan Surat Pengantar, kemudian memeriksa kesesuaian barang dengan SPPBJ dan melakukan
pemeriksaan fisik barang yang diterima. Jika sudah sesuai maka dibuatkan Berita Acara Penerimaan Barang (BAPB) baik berupa barang dagangan atau non barang dagangan (Lampiran 9 dan Lampiran 10).
BAPB tersebut kemudian diserahkan ke Bagian Keuangan dan Akuntansi untuk dicatat dan dibayarkan tagihannya ke supplier. Untuk bahan baku dan zat kimia, BAPB harus disertai Laporan Analisis (LA) yang menyatakan bahwa barang yang datang tersebut benar dan memenuhi spesifikasi yang dipesan. Barang yang datang juga diberi kode, antara lain menunjukkan subunit atau bagian yang meminta barang, bulan dan tahun permintaan barang, serta nomor urut permintaan barang.
Gudang Unit Research and Development merupakan gudang transit. Hampir tidak ada barang yang disimpan di gudang. Barang yang datang langsung didistribusikan ke masing-masing subunit atau bagian yang meminta. Barang yang disimpan di gudang hanya alkohol 95% dan aquadest. Gudang tempat penyimpanan alkohol dibuat terpisah dari bangunan gedung Unit Research and
Development.
Pengiriman barang dari gudang Unit Research and Development ke unit lain disertai dengan Surat Pengantar. Barang tersebut baru dapat dikirim jika Surat Pengantar tersebut telah ditandatangi oleh Bagian Gudang, Bagian Umum dan Administrasi Personalia, serta Manajer Unit Research and Development. Contoh pengiriman barang yang dilakukan adalah pengiriman ekstrak kental tanaman ke Unit Produksi.
Barang yang masuk ke Gudang dibedakan menjadi dua yaitu Barang Dagangan (BD) dan Barang Non Dagangan (BND). Barang Dagangan yaitu semua barang yang berperan dalam produksi suatu barang lain yang mempunyai nilai jual. Contoh Barang Dagangan adalah bahan baku dan bahan kimia, bahan kemasan, serta alat-alat lab. Sedangkan Barang Non Dagangan adalah barang lain yang hasilnya tidak mempunyai nilai jual seperti kebutuhan rumah tangga, Alat Tulis Kantor (ATK), dan lain-lain.
Selain itu, terdapat juga Bon Permintaan yang dibuat oleh bagian gudang sebagai pendukung SPPBJ. Bon Permintaan ini berbeda-beda tergantung pada
25
teknis 95%, aquadest, alat laboratorium/ kemasan, barang teknik/ investasi dan barang lain-lain dimana bon tersebut akan diserahkan kepada bagian keuangan (Lampiran 3 – Lampiran 8).
3.4.4. Sub Bagian Akuntansi dan Keuangan
Bagian Keuangan dan Akuntansi terdiri dari Bagian Akuntansi dan Bagian Keuangan. Bagian Akuntansi bertanggung jawab untuk melakukan verifikasi keuangan dan memeriksa kelengkapan dokumen. Bagian Akuntansi membukukan semua biaya kegiatan di Unit Research and Development, serta membuat laporan yang ditujukan kepada kantor pusat setiap bulannya dalam bentuk laporan neraca laba rugi dan cash flow. Bagian Keuangan bertanggung jawab terhadap pembayaran penagihan atas pengeluaran dana Unit Research and Development, termasuk biaya pajak.
Unit Research and Development hanya melakukan pengeluaran dana dan tidak ada dana pemasukan. Oleh karena itu, Unit Research and Development disebut sebagai Cost Center. Permintaan dana dari ke PT. Kimia Farma Tbk. Unit
Research and Development dinyatakan dalam bentuk Rencana Kerja Anggaran
Perusahaan (RKAP) yang dibuat setiap tahun. RKAP tersebut merupakan gabungan dari rencana kerja dari semua subunit dan bagian di Unit Research and
Development. RKAP dibuat berdasarkan rapat koordinasi dengan seluruh subunit
dan bagian, kemudian dievaluasi oleh Bagian Keuangan. Setelah diketahui dan disetujui oleh Manajer Research and Development, RKAP ini diserahkan ke kantor pusat untuk mendapatkan persetujuan direksi.
Laporan realisasi anggaran harus dibuat dan diserahkan kepada pihak manajemen kantor pusat. Laporan tersebut dibuat per bulan, per triwulan, per semester, dan per tahun. Laporan keuangan juga dibuat setiap akhir periode akuntansi (tutup buku). Setiap tiga bulan dilakukan konsolidasi neraca untuk pelaporan penggunaan dana kepada direksi dan komisaris. Auditor PT. Kimia Farma Tbk. dapat berasal dari pemegang saham yang menggunakan jasa akuntan publik, pemerintah melalui Badan Pemeriksa Keuangan, dan pihak internal perusahaan yang tergabung dalam Satuan Pengawas Intern dari kantor pusat di Jakarta.
4.1. PT. Kimia Farma Tbk.
PT. Kimia Farma Tbk. merupakan salah satu perusahaan BUMN yang bergerak di bidang farmasi yang berperan penting dalam menghasilkan obat baru dan produksi obat-obat generik di Indonesia. Selain bidang industri farmasi, perusahaan juga melakukan pengembangan usaha dalam bidang ritel farmasi atau apotek, klinik, dan laboratorium klinik, serta dalam bidang perdagangan dan distribusi. Pengelolaan bidang-bidang usaha tersebut dibagi antara PT. Kimia Farma Tbk. (holding) dan dua anak perusahaannya, yaitu PT. Kimia Farma Apotek dan PT. Kimia Farma Trading and Distribution.
PT. Kimia Farma Tbk. (holding) mengelola bidang usaha industri yang didukung oleh riset dan pengembangan, serta pemasaran. Produk-produk yang dihasilkan Kimia Farma tidak terbatas pada obat saja, namun ada juga obat tradisional, kosmetik, minyak, dan senyawa kimia. Fasilitas produksi PT. Kimia Farma Tbk. tersebar di lima kota di Indonesia, antara lain di Pulogadung DKI Jakarta, di Bandung Jawa Barat, di Semarang Jawa Tengah, di Watudakon Jombang Jawa Timur, dan di Tanjung Morawa Medan Sumatera Utara. Masing-masing unit produksi memiliki kekhususan jenis produk yang dihasilkan (PT. Kimia Farma Tbk., 2011).
PT. Kimia Farma Trading and Distribution (PT. KFTD) mengelola bidang usaha perdagangan dan distribusi dengan tugas utamanya yaitu mendistribusikan produk-produk Kimia Farma ke berbagai jaringan yang tersebar di seluruh nusantara. Saat ini terdapat 41 cabang PT. KFTD yang tersebar di berbagai daerah di Indonesia (PT. Kimia Farma Tbk., 2011).
PT. Kimia Farma Apotek (PT. KFA) mengelola usaha ritel farmasi atau apotek, klinik, dan laboratorium klinik. Pada tahun 2010 layanan laboratorium klinik diserahkan pengelolaannya kepada anak perusahaan PT. KFA, yaitu PT. Kimia Farma Diagnostika (PT. KFD). Saat ini terdapat 390 apotek, 9 klinik, dan 38 laboratorium klinik yang tersebar di seluruh nusantara (PT. Kimia Farma Tbk., 2011).
27
Seiring dengan pertumbuhan industri farmasi yang semakin pesat maka diperlukan inovasi baru dalam perkembangan obat di Indonesia. Oleh karena itu, PT. Kimia Farma, Tbk. membentuk Unit Research and Development yang bertugas melakukan penelitian dan pengembangan produk Kimia Farma.
4.2. PT. Kimia Farma Tbk. Unit Research and Development
Secara struktural, terdapat dua bagian dan delapan sub bagian di Unit
Research and Development. Selain itu, juga terdapat jabatan fungsional yaitu
kelompok peneliti. Dua bagian di PT. Kimia Farma Tbk. Unit Research and
Development adalah Bagian Pengembangan Produk dan Bagian Pemastian Mutu.
Masing-masing bagian dipimpin oleh asisten manajer yang bertanggung jawab kepada Manajer Research and Development. Bagian pengembangan produk membawahi Sub bagian Pengembangan Produk Farma, Sub Bagian Pengembangan Produk Non Farma, Sub Bagian Pengembangan Produk Bioteknologi, dan Sub Bagian Pengembangan Tanaman Obat sedangkan Bagian Pemastian Mutu membawahi dua Sub Bagian, yaitu Sub Bagian Pengawasan Mutu dan Sub Bagian Sistem Mutu. Dua sub bagian lainnya adalah Sub Bagian Sumber Daya Manusia dan Umum serta Sub Bagian Akuntansi dan Keuangan.
Bagian Pengadaan PT. Kimia Farma Tbk. Unit Research and Development bertanggung jawab terhadap pengadaan barang yang diperlukan untuk menunjang kegiatan riset dan pengembangan. Permintaan pengadaan barang diajukan oleh masing-masing subunit dan bagian dengan menggunakan Surat Permintaan Pemesanan Barang/ Jasa (SPPBJ) ke Bagian Pengadaan. SPPBJ tersebut diisi oleh subunit atau bagian yang meminta dengan persetujuan penanggung jawab (asisten manajer atau supervisor) subunit atau bagian tersebut. Formulir juga harus mendapat persetujuan bagian keuangan dan akuntansi, serta dari Manajer Unit
Research and Development. Setelah SPPBJ mendapatkan persetujuan dari
Manajer Unit Research and Development untuk diadakan, selanjutnya Bagian Pengadaan mencari penawaran dari supplier.
Hal yang menjadi pertimbangan dalam pemilihan supplier adalah kualitas barang, harga, ketepatan waktu pengiriman barang, dan jangka waktu pembayaran. Pengadaan barang atau jasa selain dari supplier juga bisa dari unit
lain di PT. Kimia Farma Tbk. Contoh pengadaan dari unit lain adalah pengadan bahan baku obat dari Unit Produksi. Permohonan pengadaan bahan baku ke PT. Kimia Farma unit produksi ini dilakukan langsung oleh pimpinan unit Research
and Development ke Manajer bagian Produksi. Bahan yang dimaksud dihitung
sebagai barang pembebanan dan pembayarannya langsung diurus antar bagian akuntansi kedua perusahaan melalui NPI (Nota Pembebanan Intern).
Setelah supplier didapatkan, Bagian Pengadaan membuat Surat Pemesanan Barang atau Jasa (SPB) ke supplier. Untuk pembelian bahan baku impor, pemesanan dilakukan melalui kantor pusat di Jakarta, namun pembebanan biaya tetap dikenakan kepada Unit Research and Development.
4.2.1. Sub Bagian Pengembangan Produk Farma
Sumber ide untuk pengembangan produk baru maupun reformulasi produk eksis dapat berasal dari Unit Research and Development, Unit Marketing, Unit Produksi, Direksi PT. Kimia Farma Tbk., ataupun berasal dari program pemerintah. Seluruh ide tersebut akan dibahas pada rapat koordinasi yang dilakukan setiap 1 bulan atau 2 bulan sekali. Hasil rapat tersebut akan dituangkan dalam Rencana Kerja Anggaran Perusahaan (RKAP) yang berisi keputusan produk baru yang akan diproduksi, waktu produk tersebut mulai diproduksi dan mulai diedarkan ke pasaran. Pemilihan produk baru yang akan diproduksi dilakukan berdasarkan pertimbangan tren pasar, minat konsumen dan anggaran dana yang ada. Setelah itu, manajer Research and Development akan melakukan disposisi ke sub bagian Research and Development terkait mengenai produk baru yang akan diproduksi kemudian masing-masing sub bagian akan melakukan kegiatan untuk merealisasikan produk baru tersebut sesuai dengan bidang kerjanya masing-masing.
Proses pengembangan produk diawali dengan proses praformulasi. Formulator melakukan studi literatur untuk mengetahui sifat fisikokimia bahan aktif dan bahan tambahan seperti pemerian, kelarutan, stabilitas, kompatibilitas, pH dan sifat lain yang diperlukan informasinya sehubungan dengan formulasi. Selanjutnya mencari informasi mengenai produk kompetitor, teknologi yang dimiliki serta ketersediaan bahan baku dan kesiapan alat produksi.
29
Sebelum rancangan formula dibuat, dilakukan uji interaksi untuk melihat ada tidaknya interaksi yang terjadi antara zat aktif dan zat tambahan. Uji interaksi ini dilakukan dengan mencampur bahan aktif dan bahan tambahan (tunggal) dengan perbandingan 1 : 5. Campuran ini disimpan pada suhu 60ºC kemudian diamati tampilan fisiknya apakah terjadi interaksi atau tidak. Uji interaksi dilakukan untuk semua bahan tambahan.
Selanjutnya, dirancang formula alternatif berdasarkan hasil preformulasi dan hasil uji interaksi untuk dibuat dalam skala laboratorium terlebih dahulu. Hasil sediaan yang baik dan memenuhi spesifikasi secara fisik akan diserahkan ke sub bagian Pemastian Mutu untuk dievaluasi. Apabila hasil dari bagian Pemastian Mutu menunjukkan sediaan tersebut dapat memenuhi spesifikasi yang dipersyaratkan, selanjutnya dilakukan validasi proses skala laboratorium. Pembuatan formula skala laboratorium ini harus diulang dua sampai tiga kali untuk memastikan bahwa hasil yang diperoleh bukan karena faktor kebetulan. Tahapan selanjutnya adalah uji stabilitas dipercepat untuk skala laboratorium. Uji ini dilakukan untuk mendapatkan profil stabilitas suatu sediaan secara cepat.
Formula sediaan yang memenuhi syarat stabilitas kemudian dibuat dalam skala pilot yang jumlahnya 1/10 dari bets atau 100.000 tablet dan pembuatan formula skala pilot ini juga harus diulang dua sampai tiga kali untuk memastikan bahwa hasil yang diperoleh bukan karena faktor kebetulan. Kemudian, hasil dari skala pilot dikirim ke sub bagian Pemastian Mutu kemudian dievaluasi. Sebagai tambahan, pada skala pilot dilakukan stabilitas jangka panjang (on going) . Hasil dari uji stabilitas ini digunakan untuk menentukan perkiraan masa kadaluwarsa suatu produk. Dari skala pilot sudah dapat dibuat dokumen batch record, protokol validasi proses dan metode analisis, data stabilitas, dan data pengembangan produk. Dokumen-dokumen tersebut untuk kelengkapan registrasi obat di Badan POM.
Untuk produk obat yang mengandung zat aktif berupa zat kimia baru dibutuhkan penilaian efikasi, keamanan,dan mutu secara lengkap. Sedangkan untuk produk obat yang merupakan obat copy dibutuhkan standar mutu antara lain berupa uji biokeivalensi (BE) dengan produk obat innovator sebagai produk pembanding/komparator. Uji ekuivalensi adalah uji in vivo dan/ atau in vitro
untuk menentukan ekuivalensi antara obat uji (obat copy) dengan obat komparator. Uji BE untuk membuktikan kesetaraan terapetik antara obat copy terhadap obat inovatornya agar dapat dikatakan interchangeable.
Sub bagian pengembangan produk farma bekerja sama dengan institusi atau laboratorium independen yang telah terakreditasi untuk melakukan uji BE sesuai dengan protokol yang telah disetujui komisi etik. Sebelum melakukan uji BE perlu diketahui profil disolusi obat copy dibandingkan dengan obat inovator dengan uji disolusi terbanding.
Pada proses uji BE, PT. Kimia Farma, Tbk. bertindak sebagai sponsor yang berperan menyediakan dana, produk uji, data pendukung awal dan mengawasi jalannya uji BE. Beberapa hal yang perlu diawasi diantaranya adalah fasilitas, pemenuhan prosedur Good Laboratory Practice (GLP), kesesuaian alur proses BE dengan protokol serta pemenuhan hak volunter oleh institusi pelaksana BE.
Ada sebelas kategori dalam daftar obat copy yang mengandung zat aktif yang wajib uji biokuivalensi. Daftar lengkap obat-obat tersebut dapat dilihat pada Peraturan Kepala Badan POM RI Tahun 2011 tentang Obat Wajib Uji Ekuivalensi (Badan Pengawas Obat dan Makanan Republik Indonesia, 2011). Jika sediaan telah mendapatkan nomor izin edar, maka tahap selanjutnya adalah pembuatan skala produksi. Tiga bets pertama dari skala produksi sediaan tersebut dalam pembuatannya masih didampingi dan merupakan tanggung jawab sub bagian pengembangan produk farma. Pada tiga bets pertama tersebut juga dilakukan uji stabilitas on going untuk mengetahui stabilitas dan masa kadaluwarsa sebenarnya dari sediaan.
4.2.2. Sub Bagian Pengembangan Produk Non Farma dan Produk Bioteknologi Saat ini, banyak bukti penelitian tentang bahan alam yang memberikan khasiat yang bermanfaat bagi manusia. Hal ini yang memperkuat perkembangan budidaya tanaman berhasiat sebagai lahan potensial di bidang farmasi. Bahan alam yang digunakan sebagai bahan baku antara lain tanaman segar, simplisia, ekstrak atau isolat yang diperoleh melalui proses tertentu dan terstandardisasi.
31
Sub Bagian Pengembangan Produk Non Farma yang bekerja di Laboratorium Ekstraksi Bahan Alam (EBA).
Sub Bagian Pengembangan Produk Non Farma Dalam memiliki tiga sasaran, yaitu perbaikan proses produksi yang eksis di pabrik (memperoleh teknologi proses yang efisien); pengembangan produk dari produk yang eksis di pabrik (memperoleh produk kimia dan bahan alam yang bermutu dan efisien yang berasal dari produk yang sudah ada); produk dan proses baru (memperoleh produk baru kimia/isolat dan bahan alam yang bermutu dan efisien untuk obat tradisional, pangan, pertanian dan alternatif bahan bakar minyak) dan pelayanan (melayani kebutuhan bahan alam dan proses pengolahan bahan alam).
Terdapat tiga fasilitas yang menunjang budidaya tanaman di PT. Kimia Farma Tbk. Unit Research and Development yaitu Kebun Percobaan Banjaran di Bandung, Kebun Tanaman Obat Bintang di Cianjur dan laboratorium kultur jaringan. Budidaya tanaman memiliki dua target dalam pelaksanaannya yaitu menghasilkan kuantitas tanaman yang maksimal dan kualitas tanaman yang memenuhi persyaratan mutu yang telah ditetapkan (kadar zat identitas maksimal).
Program untuk tanaman kina di Kebun Tanaman Obat Bintang (KTO Bintang) yang dilaksanakan bersama dengan Sub Bagian Pengembangan Produk Bioteknologi yaitu :
a. Kultur jaringan kina
Tujuan dilakukan kultur jaringan kina adalah untuk mempertahankan kualitas bibit, untuk mempercepat proses perbanyakan bibit, serta untuk mengurangi biaya pembibitan, tingkat kematian bibit, dan tingkat keragaman kualitas bibit.
b. Optimalisasi pembibitan tanaman kina dan peremajaan tanaman kina dengan sistem sambung tempel
Optimalisasi dan peremajaan ini bertujuan supaya didapatkan bibit kina yang optimal dalam sisi kualitas, waktu, dan jumlah. Cara sambung silang yang diterapkan adalah dengan menyambungsilangkan (stek) dua varietas kina, yaitu ledgeriana dan succirubra. Kina ledgeriana memiliki kadar kinin yan tinggi, namun kurang tahan terhadap penyakit. Sedangkan, kina succirubra lebih than terhadap penyakit, namun kadar kininnya rendah. Dengan melakukan stek
terhadap dua varietas tersebut, diharapkan didapat kina yang tahan penyakit dengan kadar kinin tinggi.
c. Sistem panen baru tanaman kina
Selama ini sistem panen kina adalah dengan menebang pohon kina. Sistem panen baru yang diterapkan adalah dengan menguliti batang kina secara selang-seling atau berjarak. Diharapkan dengan sistem panen ini untuk mendapatkan kulit batang kina yang siap panen, tidak perlu menunggu waktu delapan tahun seperti sebelumnya. Sistem panen ini masih beberapa bulan diterapkan dan masih dalam tahap penelitian mengenai kadar kinin dalam kinanya.
Dalam memulai pembudidayaan tanaman, ada dua cara atau jalur yang dilakukan. Pertama atas usul dari Direksi atau Unit Marketing untuk membuat sediaan yang menggunakan ekstrak tanaman tertentu. Kemudian, ditindaklanjuti dengan penelitian dan pembudidayaan tanaman tersebut. Kedua adalah atas ide Subunit EBA tentang tanaman berkhasiat tertentu. Tanaman tersebut dijadikan tanaman koleksi dan diteliti. Jika khasiatnya terbukti, maka tanaman tersebut dapat diusulkan untuk dimanfaatkan dengan dibuat sediaannya.
Tahap awal dalam pengembangan produk bahan alam adalah melakukan studi literatur berkaitan dengan budidaya tanaman untuk mendapatkan informasi mengenai tanaman yang digunakan sebagai bahan baku, kandungan kimia yang terkandung dalam tanaman yang memiliki efek farmakologi, bagian tanaman yang akan digunakan, efek farmakologi yang ditimbulkan, cara pembibitan, penanaman, pemeliharaan dan pemanenan yang baik serta metode ekstraksi dan isolasi yang sesuai. Setelah tanaman berhasil dipanen akan didistribusikan ke subunit laboratorium Ekstraksi Bahan Alam (EBA) untuk dilakukan trial metode ekstraksi. Setelah diperoleh metode ekstraksi yang sesuai maka dilakukan optimasi jenis pelarut, jumlah pelarut, waktu ekstraksi dan suhu. Selanjutnya dilakukan validasi metode ekstraksi sebanyak 3 bets untuk menunjukan hasil yang konstan. Jika metode ekstraksi valid, maka prosedurnya dicatat dalam Catatan Pengolahan Bets untuk dilakukan scale up skala pilot.