BAB 2
TINJAUAN PUSTAKA
2.1. Air
Air bersih merupakan salah satu kebutuhan pokok manusia yang diperoleh dari berbagai sumber, tergantung pada kondisi daerah setempat. Saat ini, masalah yang dihadapi oleh sumber daya air meliputi kuantitas air yang sudah tidak mampu memenuhi kebutuhan yang terus meningkat dan kualitas air untuk kebutuhan domestik yang semakin menurun. Kegiatan industri, domestik dan kegiatan lain berdampak negatif terhadap sumber daya air, antara lain menyebabkan penurunan kualitas air. Kondisi ini dapat menimbulkan gangguan, kerusakan dan bahaya bagi semua mahluk hidup yang bergantung pada sumber daya air. Oleh karena itu, diperlukan pengelolahan dan perlindungan sumber daya air saksama.
Adapun penggolongan air menurut peruntukannya adalah sebagai berikut : a. Golongan A, yaitu air yang dapat digunakan sebagai air minum secara
langsung, tanpa pengolohan terlebih dahulu
b. Golongan B, yaitu air yang dapat digunakan sebagai air baku air minum c. Golongan C, yaitu air dapat digunakan keperluan perikanan dan peternakan d. Golongan D, yaitu air yang dapat digunakan untuk keperluan pertanian, usaha
Pengelolahan sumber daya air sangat penting, agar dapat dimanfaatkan secara berkelanjutan dengan tingkat mutu yang diinginkan. Salah satu langkah pengelolaan yang dilakukan adalah pemantauan dan interpretasi data kualitas air. Mencakup kualitas fisika, kimia, dan biologi. Namun, sebelum melangkah pada tahap pengelolaan, diperlukan pemahaman yang baik tentang terminology, karakteristik, dan interkoneksi parameter – parameter kualitas air (Effendi, 2003).
Air merupakan senyawa kimia yang sangat penting bagi kehidupan umat manusia dan makhluk hidup lainnya dan fungsinya bagi kehidupan tersebut tidak akan dapat digantikan oleh senyawa lainnya. Hampir semua kegiatan yang dilakukan manusia membutuhkan air, mulai dari menyiapkan diri (mandi), membersihkan ruangan tempat tinggalnya, menyiapkan makanan, dan minuman sampai dengan aktivitas – aktivitas lainnya.
Dalam jaringan hidup, air merupakan medium untuk berbagai reaksi dan proses ekskresi. Air merupakan komponen utama baik dalam tanaman maupun hewan termasuk manusia. Tubuh manusia terdiri dari 60-70% air. Transportasi zat – zat makanan dalam tubuh semuanya dalam bentuk larutan dengan pelarut air. Juga hara – hara dalam tanah hanya dapat diserap oleh akar dalam bentuk larutannya (Achmad, 2004).
2.1.1. Sifat Air
1. Pada kisaran suhu yang sesuai bagi kehidupan, yakni 0°C (32°F) - 100°C, air berwujud cair. Suhu 0°C merupakan titik beku (freezing point) dan suhu 100°C merupakan titik didih (boiling point) air. Tanpa sifat tersebut, air yang terdapat didalam jaringan tubuh makhluk hidup maupun air yang terdapat dilaut, sungai, danau, dan badan air yang lain akan berada dalam bentuk gas atau padatan ; sehingga tidak akan terdapat kehidupan di muka bumi, karena sekitar 60 % - 90 % bagian sel makhluk hidup adalah air.
2. Perubahan suhu air berlangsung lambat sehingga air memiliki sifat sebagai penyimpan panas yang sangat baik. Sifat ini memungkinkan air tidak menjadi panas atau pun dingin seketika. Perubahan suhu air yang lambat mencegah terjadinya stress pada makhluk hidup karena adanya perubahan suhu yang mendadak dan memelihara suhu bumi agar sesuai bagi makhluk hidup. Sifat ini juga menyebabkan air sangat baik sebagai pendingin mesin.
3. Air memerlukan panas yang tinggi dalam proses penguapan. Penguapan (evaporasi) adalah proses perubahan air menjadi uap air. Proses ini memerlukan energi panas dalam jumlah yang besar. Sebaliknya, proses perubahan uap air menjadi cairan (kondensasi) melepaskan energi panas yang besar. Pelepasan energi ini merupakan salah satu penyebab mengapa kita merasa sejuk pada saat berkeringat. Sifat ini juga merupakan salah satu faktor utama yang menyebabkan terjadinya penyebaran panas secara baik di bumi.
memungkinkan unsur hara (nutrient) terlarut diangkut ke seluruh jaringan tubuh makhluk hidup dan memungkinkan bahan – bahan toksik yang masuk kedalam jaringan tubuh makhluk hidup dilarutkan untuk dikeluarkan kembali. Sifat ini juga memungkinkan air digunakan sebagai pencuci yang baik dan pengencer bahan pencemar (polutan) yang masuk kebadan air.
5. Air memiliki tegangan permukaan yang tinggi. Suatu cairan dikatakan memiliki tegangan permukaan yang tinggi jika tekanan antar molekul cairan tersebut tinggi. Tegangan permukaan yang tinggi menyebabkan air memiliki sifat membasahi suatu bahan secara baik. Tegangan permukaan yang tinggi juga memungkinkan terjadinya sistem kapiler, yaitu kemampuan untuk bergerak dalam pipa kapiler (pipa dengan lubang yang kecil). Dengan adanya sistem kapiler dan sifat pelarut yang baik, air dapat membawa nutrient dari dalam tanah ke jaringan tumbuhan (akar, batang, dan daun). Adanya tegangan permukaan memungkinkan beberapa organisme, misalnya jenis – jenis insekta, dapat merayap di permukaan air.
2.1.2. Masalah Pencemaran Air
Sesuai dengan sifat dan proses produksi terdapat pabrik-pabrik yang menggunakan bahan-bahan beracun dan berbahaya, baik dalam bentuk bahan baku, hasil produksi maupun hasil sampingan. Sifat bahaya dan racun yang ditimbulkannya dapat karena sentuhan, penyimpanan yang kurang baik maupun penggunannya melebihi lethal dosis. Bahan-bahan beracun dan bahaya timbul dalam proses ekstraksi, proses kimia. Bahan-bahan ini juga harus dijaga dalam sistem pengangkutan, maupun sistem penyimpanan serta penggunaannya. Bahan-bahan beracun dan berbahaya tergabung sebagai limbah karenaa tumpahan atau kebocoran. Suatu bahan tergolong beracun dan berbahaya dapat diketahui antara lain : mudah terbakar, sifat korosif, menyengat sifat oxidator, sifat membunuh serta menimbulkan luka-luka bila tersentuh. Bahan- bahan yang termasuk golongan ini adalah obat-obatan, insektisida, herbisida, pelarut-perlarut seperti aseton, karbon tetra khlorida, bahan-bahan pembersih detergent, amoiak, lem, cat dengan elemen dasar timbal.
Sifat-sifat beracun menunjukkan efek biologis, misalnya kemampuan bahan menciptakan luka bila tersentuh tubuh dan menimbulkan ancaman terhadap lingkungan hidup bila konsentrasinya melebihi nilai ambang batas. Sifat racun bahan kimia belum tentu menimbulkan bahaya, apabila penggunaan bahan dilakukan secara tepat dalam dosis yang tepat (Ginting, 2007).
membawa pencemaran dari lokasi – lokasi khusus seperti pabrik – pabrik, instalasi pengolahan limbah dan tanker minyak, ddan sumber tak terpusat, yang ditimbulkan jika hujan dan salju cair mengalir melewati lahan dan menghanyutkan pencemar – pencemar diatasnya seperti pestisida dan pupuk dan mengendapkannya dalam danau, telaga, rawa, perairan, pantai, dan air bawah tanah.
Polusi air berasal dari aktivitas manusia : dari industri dibuang melewati pipa – pipa atau bocoran dari pipa – pipa itu dan tangki penyimpanannya. Air tercemar dapat juga berasal dari pertambangan ketika rembesan air melarutkan dan tercemar zat – zat kimia sisa proses produksi dan sisa galian.
Beberapa jenis bahan kimia beracun yang dijumpai manusia secara teratur dapat menimbulkan resiko – resiko kesehatan. Sisa pestisida pada sayur – mayur, merkuri dalam ikan dan banyak bahan kimia hasil industri dapat menimbulkan kanker, cacat bawaan, mutasi genetika atau bahan kematian (Mulyanto, 2007).
2.1.3. Sumber Pencemaran Air
Beberapa sumber pencemaran air, antara lain : a. Domestik (Rumah Tangga)
Yaitu yang berasal dari pembuangan air kotor dari kamar mandi, kakus, dan dapur.
b. Industri
1. Fisik
Pasir atau lumpur yang tercampur dengan limbah air. 2. Kimia
Bahan pencemar yang berbahaya: Merkuri (Hg), Cadmium (Cd), Timah Hitam (Pb), pestisida, dan jenis logam berat lainnya.
3. Mikrobiologi
Berbagai macam bakteri, virus, parasit, dan lain – lainnya. Misalnya yang berasal dari pabrik yang mengolah hasil ternak, rumah potong, dan tempat pemerahan susu sapi.
4. Radioaktif
Beberapa bahan radioaktif yang dihasilkan oleh Pembangkit Listrik Tenaga Nuklir (PLTN) dapat pula menimbulkan pencemaran air. c. Pertanian dan Perkebunan
Polutan air dari pertanian/perkebunan dapat berupa: 1. Zat Kimia
Misalnya: berasal dari penggunaan pupuk, pestisida seperti (DDT, Dieldrin, dan lain-lain).
2. Mikrobiologi
3. Zat radioaktif
Berasal dari penggunaan zat radioaktif yang dipakai dalam proses pematangan buah, mendapatkan bibit unggul, dan mempercepat pertumuhan tanaman (Mukono, 2000).
2.1.4. Persyaratan Air Minum
Agar air minum tidak menyebabkan gangguan kesehatan, maka air tersebut haruslah memenuhi persyaratan-persyaratan kesehatan. Di Indonesia, standar air minum yang berlaku dapat dilihat pada Peraturan Menteri Kesehatan RI No.416/MENKES/IX/1990.
Di dalam Peraturan Menteri Kesehatan RI No.416/MENKES/IX/1990, persyaratan air minum dapat ditinjau dari parameter fisika, parameter kimia, parameter mikrobiologi, dan parameter radioaktivitas yang terdapat didalam air minum tersebut.
1. Parameter Fisika
Parameter fisika umumnya dapat diidentifikasi dari kondisi fisik air tersebut. Parameter fisika meliputi bau, kekeruhan, rasa, suhu, warna, dan jumlah zat padat terlarut (TDS). Air yang baik idealnya tidak berbau. Air yang berbau busuk tidaak menarik dipandang dari sudut estetika. Selain itu, bau busuk juga bisa disebabkan proses penguraian bahan organik yang terdapat di dalam air.
itu, air yang keruh sulit didesinfeksi, karena mikroba patogen dapat terlindung oleh partikel.
Air idelanya juga tidak memiliki rasa/tawar. Air yang tidak tawar mengindikasikan adanya zat-zat tertentu di dalam air tersebut. Rasa asin disebabkan adanya garam-garam tertentu di dalam air, begitu juga rasa asam disebabkan adanya asam di dalam air dan rasa pahit disebabkan oleh adanya basa di dalam air tersebut.
Selain itu juga, air yang baik tidak boleh memiliki perbedaan suhu yang mencolok dengan udara sekitar. Di Indonesia, suhu air idealnya ±3oC dari suhu udara. Air secara mencolokmempunyai suhu diatas atau dibawaah suhu udara berarti mengandung zat-zat tertentu (misalnya fenol yang terlarut) atau sedang terjadi proses biokimia yang mengeluarkan atau menyerap energi di dalam air.
Padatan terlarut total (Total Dissolved Solid-TDS) adalah bahan-bahan terlarut (diameter < 10-6) dan kloid (diameter 106-103mm) yang berupa senyawa-senyawa kimia dan bahan-bahan lain. Bila TDS bertambah maka kesadahan akan naik. Kesadahan yang tinggi dapat mengakibatkan terjadinya endaapan/kerak pada sistem perpipaan.
2. Parameter Kimiawi
Sumber logam dalam air dapat berasal dari industri, pertambangan ataupun proses pelapukan secara alamiah. Korosi dari pipa penyalur air minum dapat juga menyebabkan kehadiran logam dalam air minum.
Bahan kimia organik dalam air minum dapat dibedakan menjadi 3 kategori. Kategori 1 adalah bahan kimia yang mungkin bersifat karsinogenik bagi manusia. Kategori 2 adalah bahan kimia yang tidak bersifat karsinogenik bagi manusia. Kategori 3 adalah bahan kimia yang dapat menyebabkan penyakit kronis tanpa ada fakta karsinogenik.
3. Parameter Mikrobiologi
Parameter mikrobiologi menggunakan bakteri koliform sebagai organisme petunjuk (indicator organism). Dalam laboratorium, istilah total coliform menunjukkan bakteri coliform dari tinja, tanah, atau sumber alamiah lainnya. Istilah fecal coliform (koliform tinja) menunjukkan bakteri koliform berasal dari tinja manusia atau hewan berdarah panas lainnya. Penetuan parameter mikrobiologi dimaksudkan untuk mencegah adanya patogen di dalam air minum.
4. Parameter Radioaktivitas
Apapun bentuk radio aktivitas efeknya sama, yakni menimbulkan kerusakan pada sel yang terpapar. Kerusakan dapat berupa kematian dan perubahan komposisi genetik. Kematian sel-sel dapat diganti kembali apabila sel dapat beregenerasi dan apabila tidak seluruhnya sel mati. Perubahan genetis dapat menimbulkan penyakit seperti kanker dan mutasi.
dalam. Kerusakan yang terjadi ditentukan oleh intensits serta frekuensi dan luasnya pemaparan (Mulia, 2005).
2.2. Nikel
Nikel adalah logam berwarna putih perak dengan berat jenis 8,5 dan berat atom 58,71 g/mol. Ni merupakan logam yang resistensi terhadap korosi dan oksidasi pada temperatur tinggi sehingga bisa digunakan untuk memproduksi stainless steel. Bijih nickel lateric (nickel ore) mengandung kadar Ni tinggi, sedangkan ferronikel adalah paduan logam antara nikel dan besi. Logam nikel memiliki sifat kuat, dapat ditempa, serta tahan terhadap karat dan tahan terhadap oksidasi (Widowaty, 2008).
Nikel adalah logam yang cukup keras putih mengkilat terdapat didalam kerak bumi sebanyak kurang lebih 0.002%. Nikel terdapat pada batuan ultrabasa seperti dunit dan peridotit yang mengalami serpentinisasi dan lapuk yang menghasilkan mineral sekunder bijih nikel garnierit.
Nikel digunakan untuk membuat campuran logam (non-ferros alloy),misal alloy nikel-besi dengan kandungan nikel antara 50-80 %, sisanya besi. Alloy alni yaitu campuran alluminium, nikel, dan besi, yang dalam penggunaannya sama dengan penggunaan baja karbon. Alloy ferrit yang mengandung nikel oksida (NiO) dan oksida seng. Alloy tersebut biasanya dimanfaatkan untuk peralatan elektronika (Sukandarrumidi, 2009).
sedangkan kadar Ni pada air tanah mencapai 0,005-0,05 ppm dan kadar Ni pada tumbuhan tidak lebih dari 1 ppm (Sukandarrumidi, 2009).
Pada kondisi pH < 9, nikel membentuk senyawa kompleks dengan hidroksida, karbonat, dan sulfat. Pada pH > 9, nikel akan membentuk senyawa kompleks dengan hidroksida dan karbonat, dan selanjutnya mengalami presipitasi. Demikian juga pada kondisi anaerob, nikel bersifat tidak larut.
Sumber nikel di perairan adalah niccolite (NiAs), pentladite [(Fe3Ni)9S8], garnierite [(Ni,Mg)6(OH)6(Si4O11).H2O], limonite [(Ni,Fe)O(OH).nH2O], dan pyrhotile. Nikel banyak digunakan dalam industri metalurgi, pelapisan logam, industri kimia, pembakaran minyak, dan pembakaran limbah.
Nikel merupakan unsur yang memiliki toksisitas rendah. Toksisitas nikel (EC50) terhadap Lemma minor adalah 0,45 mg/L. nilai LC50 nikel terhadap Daphina magna adalah 19.5 mg/L, terhadap beberapa jenis ikan tawar dan ikan air laut berkisar antara 1-100 mg/L. Bersama-sama dengan Cu dan Zn, nikel memiliki sifat aditif. Urutan toksisitas beberapa logam dari yang sangat rendah sampai yang sangat tinggi berturut adalah: Sn<Ni<Pb<Cr<Co<Cd<Zn<Cu<Ag<Hg (Effendi, 2003).
2.2.1. Manfaat Nikel
Alloy tembaga-nikel berbentuk tabung banyak digunakan untuk pembuatan instalasi proses penghilangan garam untuk mengubah air laut menjadi air segar. Nikel digunakan pula dalam industri keramik. Nikel yang sangat halus, digunakan sebagai katalis untuk menghidrogenasi minyak sayur (menjadikannya padat). Pembuatan magnet elnico. Baterai Penyimpanan Edison®. Koin 5 sen Amerika mengandung 75% Cu dan 25% Ni, di kanada Nikel digunakan antara 1922-1981 dengan kandungan 99,99% dan magnetik lain, di Negara lain ada juga yang menggunakan nikel untuk mata uang koin.
Nikel (Ni) merupakan zat gizi esensial untuk beberapa jenis hewan dan manusia. Ni terdapat pada DNA dan RNA. Ni berfungsi menstabilisasi struktur asam nukleat serta protein, dan sebagai kofaktor berbagai enzim. Defisiensi Ni bisa mengakibatkan kerusakan hati dan alat tubuh lain. Ni merupakan nonspesifik akifator enzim. Enzim yang mengandung Ni telah diidentifikasi dalam tanaman dan mikroorganisme, tetapi belum terdapat bukti mengenai enzim hewan yang diaktivasi oleh Ni. Ni spesifik untuk enzim urease dalam rumen sebagai Ni-metalloenzyme. Ni berperan dalam metabolisme tubuh bersama dengan vitamin B-12. Ni mengatur kadar lipid dalam jaringan dan Ni juga berperan dalam sintesis fosfolipid.
Kadar Ni dalam jaringan akan dijaga dan diatur oleh mekanisme kontrol homeostatik. Sebagai contoh, anak sapi membutuhkan Ni dalam makanan sejumlah lebih dari 250 ppm. Kebutuhan Ni untuk hewan nonruminansia lebih besarr dibandingkan hewan ruminansia sebesar < 200 µg/kg makanan. Kebutuhan Ni hewan ruminansia adalah sebesar 1 ppm. Hewan ruminansia akan mengalami defisiensi Ni apabila makanan mengandung 100 ppb. Manusia ada umumnya mengkonsumsi Ni dari makanan sebesar 150 µg/hari, sedangkan intake Ni makanan pada orang dewasa rata-rata sebesar 100-300 µg/hari (Widowati, 2008).
2.2.2. Bahaya Nikel
Daya racun yang dimiliki oleh kelas-kelas logam sebagai berikut :
1. Ion kelas B merupakan golongan ion-ion logam yang mempunyai daya racun besar (atau ion logam sangat beracun) karena :
a) Paling efektif untuk berikatan dengan gugus sulfihidril (-SH), seperti dalam sistein: dengan struktur molekul yang memiliki gugus nitrogen (N), seperti yang terdapat dalam lisin dan hstidin. Gugus sulfur dan nitrogen merupakan gugus aktif dari enzim-enzim logam (metalloenzim).
b) Dapat menggantikan posisi dari ion-ion logam kelas antara, seperti ion seng (Zn++) dari enzim logam (metalloenzim). c) Bersama dengan ion-ion logam kelas antara, ion-ion logam
dalam lemak (lipid soluble). Ion-ion logam yang dapat larut dalam lemak mampu melakukan penetrasi pada membran sel, sehingga akhirnya ion-ion logam tersebut akan menumpuk (terakumulasi) di dalam sel dan organ-organ lain. Sebagai contoh ion-ion logam Hg, Pb, dan Sn.
d) Beberapa ion logam dari golongan ion-ion logam kelas B, dalam metallo-protein menunjukkan kemampuan oksidasi reduksi (redoks), seperti Cu2+ Cu+. Ion logam tembaga (Cu) ini akan mengubah kesatuan fungsional dari protein terkait. 2. Ion-ion logam kelas antara, merupakan golongan ion logam dimana daya
racun yang ada lebih disebabkan oleh kemampuan dari ion-ion logam ini untuk menggantikan ion-ion logam yang sudah ada secara alamiah pada molekulnya. Salah satu contoh dari kelompok ion-ion logam kelas antara ini adalah ion logam Nikel (Ni2+). Ion tersebut dapat menggeser gugus Zn2+ yang merupakan faktor aktif pada enzim karbonat anhidrase.
Pada umumnya, orang bisa terpapar Ni ditempak kerja daalam produksi atau proses yang menggunakan bahan Ni atau bisa juga melalui kontak dengan perhiasan dengan perhiasan yang mengandung Ni, stainless steel, serta peralatan masak yang mengandung Ni atau berbahan asam tembakau.
Paparan nikel (Ni) bisa terjadi melalui inhalasi, oral, dan kontak kulit. Reaksi Ni dan karbonmonoksida (CO) menghasilkan nikel karbonil (Ni[CO]4) yang bisa terurai menjadi Ni dan CO pada pemanasan 200oC. Proses tersebut merupakan metode yang mudah untuk pemurnian Ni. Nikel karbonil bersifat lebih toksik dan bisa mengganggu kesehatan masyarakat dibandingkan senyawa nikel lainnya dikarenakan nikel karbonil berbentuk cairan yang mudah menguap (volatile liquid) dan banyak digunakan dalam berbagai industri sehingga resiko manusia terkontaminasi nikel karbonil sangat tinggi. Gejala awal dari paparan (Ni[CO]4) berupa sakit kepala, mual, muntah, epigatrik, sakit dada, yang disertai gejala batuk-batuk, hiperne, sianosis, sakit lambung dan usus, serta keadaan lemah. Gejala-gejala tersebut bisa disertai berbagai gejala demam, leukosistosis, dan pneumonia yang parah, kegagalan pernafasan, kadang-kadang edema sereberal, yang kemudian dapat mengakibatkan kematian. Berdasarkan hasil autopsi terhadap korban yang meninggal akibat paparan (Ni[CO]4) diketahui bahwa kadar Ni tertinggi adalah di paru-paru, selanjutnya dalam jumlah rendah terdapat di ginjal, hati, dan otak.
Paparan Ni lewat kulit secara kronis bisa menimbulkan gejala, antara lain dermatitis nikel berupa eksema (kulit kemerahan, gatal) pada jari-jari, tangan pergelangan tangan, serta lengan. Paparan kronis Ni secara inhalasi bisa mengakibatkan gangguan pada alat pernafasan, berupa asma, penurunan fungsi paru-paru, serta bronkitis.
Tingginya kadar Ni dalam jaringan tubuh manusia bisa mengakibatkan munculnya berbagai efek samping, yaitu akumulaasi Ni pada kelenjar pituitari yang bisa mengakibatkan depresi sehingga mengurangi sekresi hormon prolaktin di bawah normal. Akumulasi Ni pada pankreas dapat menghambat sekresi hormon insulin (Widowati, 2008).
2.2.3. Penanggulangan Toksisitas Nikel
Untuk mengurangi dan menanggulangi pencemaran Ni, bisa dilakukan metode fitomidiasi atau bioremoval yang menggunakan mikroorganisme dan menggunakan modul membran.
2.3. ICP (Inductively Coupled Plasma)
ICP adalah sebuah teknik analisis yang digunakan untuk mendeteksi jejak logam dalam sampel. ICP digunakan untuk menganalisis kadar unsur-unsur logam dari suatu sampel dengan menggunakan metode yang didasarkan pada pengukuran intensitas emisi pada panjang gelombang yang khas untuk setiap unsur.
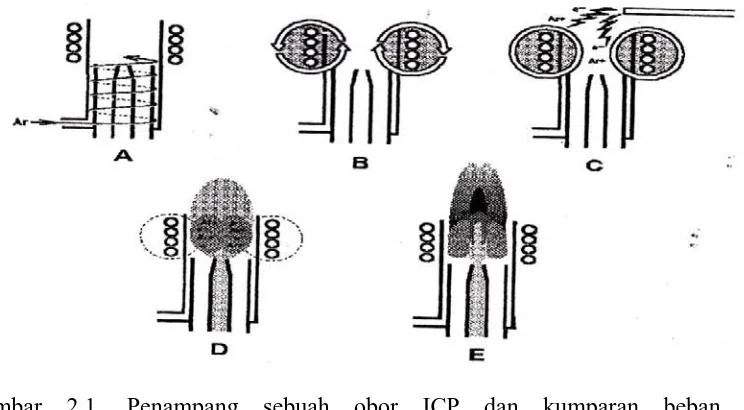
Inductively Coupled Plasma pada saat ini banyak sekali digunakan untuk oprikal emisi spektrofotometri seperti yang sama dikemukakan oleh Valmer Fassel pada awal-awal tahun 1970-an. Gas argon diarahkan melalui obor yang terdiri dari tiga tabung konsentris yang terbuat dari kuarsa atau bahan lain yang cocok, seperti yang ditunjukkan oleh gambar 2.1 sebagai berikut :
menyebabkan ionisasi lebih lanjut daan membentuk plasma. E. sampel aerosol membawa aliran ke nebulizer melalui lubang plasma.
Sebuah kumparan tembaga, disebut kumparan beban, mengelilingi ujung atas obor dan dihubungkan ke generator frekuensi radio (RF). Ketika daya RF (biasanya 700-1500 watt) diterapkan ke kumparan, atau berisolasi, pada tingkat yang sesuai dengan frekuensi generator. Dalam instrumen ICP paling frekuensi ini adalah baik 20 atau 40 megaherzt (MHz). Osilasi RF ini dari arus dalam kumparan menyebabkan medan listrik RF dan magnetik yang akan dibentuk di daerah pada bagian atas obor. Dengan gas argon yang berputar-putar melalui obor, percikan digunakan ke gas yang menyebabkan beberapa elektron akan dilucuti dari atom argonnya. Elektron ini kemudian akan tertangkap dalam medan magnet dan dipercepat oleh medan magnetnya. Menambah energi ke elektron dengan menggunakan kumparan dengan cara ini dikenal sebagai kopling induktif. Elektron berenergi tinggi ini pada gilirannya bertabrakan dengan atom argon lain, masih melepaskan elektron yang berlebih. Tumbukan ionisasi dari gas argon berlanjut dalam sebuah reaksi rantai, perpecahan gas menjadi plasma yang terdiri dari atom argon, elektron, dan argon ion, membentuk apa yang diketahui sebagai pengeluaran Induktif Coupled Plasma (ICP). Pengeluaran ICP kemudian dipertahankan dalam obor dan kumparan beban sebagai energi RF kemudian ditransfer melalui proses kopling induktif.
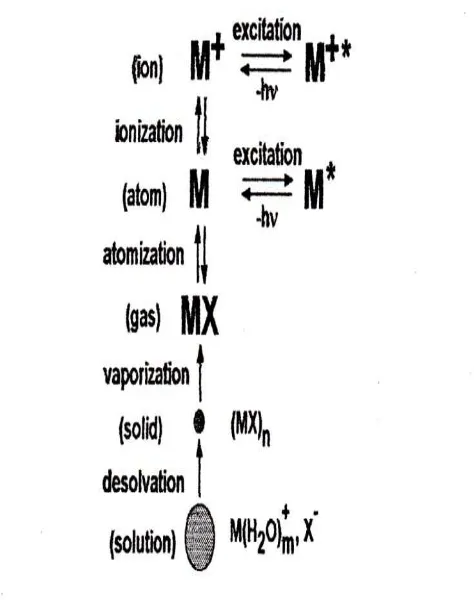
aerosol kemudian dibawa ke pusat plasma temperatur tinggi adalah untuk memindahkan larutan, pelarut, aerosolnya, biasanya meninggalkan sampel sebagai partikel garam mikroskopis. Langkah selanjutnya melibatkan dekomposisi partikel garamnya menjadi sebuah gas dari molekul tunggal (vaporasi) yang kemudian memisahkan diri menjadi atom (atomisasi). Proses-proses ini, dimana terjadi paling utama di zina pemanasan (PHZ). Proses yang sama terjadi dalam nyala api dan tungku yang digunakan untuk atom spektrofotometri serapan atom.
2.3.1. Prinsip Kerja Alat ICP (Inductively Coupled Plasma)
Energi yang ditimbulkan oleh plasma pada ICP menyebabkan elektron terluar dari atom atau ion logam akan berpindah ke lintasan energi yang lebih tinggi dengan menyerap energi dari plasma. Saat kembali ke kondisi groundstate (kondisi energi terendah) terjadi pelepasan energi berupa cahaya, dimana intensitas cahaya yang dipancarkan sebanding dengan konsentrasi elemen logam yang akan di ukur.
1. Nebulizer
untuk menghasilkan bercak kecil pada berbagai jenis sampel yang banyak tergantung pada keperluan dari sebuah nebulizer dari ICP.
2. Pompa Peristaltik (Pumb)
Pompa peristaltik adalah jenis pompa perpindahan yang digunakan untuk memompa berbagai cairan. Pompa ini menggunakan sebuah penggulungan yang mendorong larutan sampel dimana tabung menggunakan proses peristaltik. Tabung pompa peristaltik adalah satu bagian dari sitem ICP yang biasanya memerlukan penggantian yang sering. Analis harus memeriksa tabung pompa untuk pemakaian sehari-hari, yang umumnya ditandai dengan tekanan permanen di pipa yang dapat dirasakan dengan menjalankan jari seorang melalui pipa. Kegagalan untuk menggantikan tabung pompa yang aus dapat mengakibatkan kinerja instrumen menurun, karena ini dapat mencegah aliran sampel akan disampaikan ke nebulizer. Memakai tabung dapat dikurangi dengan melepaskan ketegangan pada pipa ketika pompa tidak digunakan.
3. Spray Chamber
khas, kisaran tetesan merupakan sekitar 1-5% dari sampel yang diperkenalkan ke nebulizer. Yang tersisa 95-99% dari sampel dikeringkan kedalam wadah buangan. Spray chamber terbuat dari bahan tahan korosi yang memungkinkan analis untuk menggunakan sampel yang mengandung asam fluorida yang dapat merusak kaca ruang semprot.
4. Drains (Saluran Air)
5. Obor (Thorch)
Obor yang digunakan saat ini dalam ICP-OES sangat mirip dalam desain dan fungsi dengan yang dilaporkan oleh fassel di awal-awal ICP. Obor terdiri dari tiga tabung konsentris untuk aliran argon dan injeksi aerosol. Jarak antara dua tabung luar dijaga bersempitan sehingga gas yang dialirkan diantara mereka muncul dengan kecepatan tinggi. Chamber terluar seperti melanjutkan ke atas. Salah satu fungsi dari gas ini adalah untuk menjaga dinding kuarsa aliran obor dingin dan dengan demikian aliran gas ini awalnya disebut aliran pendingin atau aliran plasma tetapi sekarang disebut “pengeluaran” aliran gas. Untuk argon ICP, aliran gas luar sekitar 7-15 liter per menit.
6. Generator Frekuensi Radio
Generator Frekuensi Radio (RF) adalah perangkat yang menyediakan daya lanjutan dan memelihara ketahanan dari debit plasma. Tenaga ini, biasanya dimulai dari sekitar 700-1500 watt, yang sudah ditransfer ke gas plasma melalui kumparan beban sekitar bagian atas obor. Kumparan beban, yang bertindak sebagai antena untuk mentransfer daya RF untuk plasma, biasanya terbuat dari pipa tembaga dan diinginkan oleh air atau gas selama operasi.
7. Transfer Optik
8. Microprocesor (Detektor)
Detektor berfungsi sebagai pendeteksi kadar logam. Setelah garis emisi yang tepat telah diisolasi dengan spektrometer, detektor, dan elektronik yang terkait digunakan untuk mengukur intensitas garis emisi. Sejauh ini detektor paling banyak digunakan untuk ICP adalah tabung photomultiplier atau PMT.
9. Komputer dan Prosesor
Bagian penting dari instrumen ICP adalah kontrol komputer dimasukkan ke dalam instrumen. Mayoritas fungsi otomatis instrumen ICP secara langsung dikontrol oleh on-board komputer. Untuk instrumen paling sederhana, analis berinteraksi langsung dengan on-board komputer melalui tombol atau keypad yang terletak pada instrumen. Namun, gunakan komputer eksternal, yang dihubungkan ke on-board komputer instrumen, untuk bertindak sebagai penghubung antara analis dan instrumen. Fungsi penting komputer ini adalah menunjukkan hasil kadar logam yang terkandung atau terdeteksi didalam sampel (Montaser, 1992).
2.4. Titrasi
Larutan standar biasanya ditambahkan dari dalam sebuah buret. Proses penambahan larutan standar sampai reaksi tepat lengkap, disebut titrasi, zat yang akan ditetapkan, dititrasi. Titik (saat) pada mana reaksi itu tepat lengkap, disebut titik ekuivalen (setara) atau titik-akhir teoritis (atau titik-akhir stoikiometri). Lengkapnya titrasi, lazimnya harus terdeteksi oleh suatu perubahan, yang tidak dapat disalah-lihat oleh mata, yang dihasilkan oleh larutan standar itu sendiri (misalnya kalium permanganat), atau lebih lazim lagi, oleh penambahan suuatu reagensia pembantu yang dikenal sebagai indikator. Setelah reaksi antara zat dan larutan standar praktis lengkap, indikator harus memberikan perubahan visual yang jelas (entah suatu perubahan warna atau pembentukan kekeruhan), dalam cairan yang sedang dititrasi. Titik (saat) pada mana ini terjadi, disebut titik akhir titrasi. Pada titrasi yang ideal, titik akhir yang terlihat, akan terjadi berbarengan dengan titik akhir stoikiometri atau teoritis. Namun, dalam praktek, biasanya akan terjadi perbedaan yang sangat sedikit; ini merupakan sesatan (error) titrasi. Indikator dan kondisi-kondisi eksperimen harus dipilih sedemikian, sehingga perbedaan antara titik-akhir dan titik ekuivalen, adalah sekecil mungkin.
masih dipertahankan, (tetapi mungkin lebih baik untuk memakai istilah alat kaca berskala dan labu berskala, seperti yang digunakan diseluruh buku ini).
Untuk digunakan dalam analisis titrimetri, suatu reaksi harus memenuhi kondisi-kondisi berikut :
1. Harus ada suatu reaksi yang sederhana, yang dapat dinyatakan dengan suatu persamaan kimia, zat yang akan ditetapkan harus bereaksi lengkap dengan dengan reagensia dalam proporsi yang stoikiometri atau ekuivalen.
2. Reaksi harus praktis berlangsung dalam sekejap atau berjalan dengansangat cepat sekali (kebanyakan reaksi ionik memenuhi kondisi ini). Dalam beberapa keadaan, penambahan suatu katalis akan menaikkan kecepatan reaksi itu.
3. Harus ada perubahan yang menyolok dalam energi-bebas, yang menimbulkan perubahan dalam beberapa sifat fisika atau kimia larutan pada titik-ekuivalen. 4. Harus tersedia suatu indikator, yang oleh perubahan sifat-sifat fisika (warna
atau pembentukan endapan), harus dengan tajam menetapkan titik akhir reaksi. Jika titik ekuivalen ini sering dapat ditetapkan dengan mengikuti hal-hal berikut selama jalannya titrasi :
a) Potensial antara sebuah elektrode indikator dan sebuah elektrode indikator dan sebuah elektrode pembanding (elektrode refrensi); titrasi potensiometri.
c) Arus listrikyang mengalir melalui sel titrasi antara sebuah elektrode indikator (Vogel, 1994).
2.4.1. Titrasi Kompleksiometri
Reaksi pengkompleksan dengan suatu ion logam, melibatkan penggantian satu molekul pelarut atau lebih yang terkoordinasi, dengan gugus-gugus nukleofilik lain. Gugus-gugus terkait pada ion pusat, disebut ligan, dan dalam larutan air, reaksi dapat dinyatakan oleh persamaan :
M(H2O)n + L = M(H2O)(n-1) + H2O
Disini ligan (L) dapat berupa sebuah molekul netral atau sebuah ion bermuatan, dengan penggantian molekul-molekul air berturut-turut selanjutnya dapat terjadi, sampai terbentuk kompleks MLn; n adalah bilangan-koordinasi dari ion logam itu, dan menyatakan jumlah maksimum ligan monodentat yang dapat terikat padanya.
Ada beberapa jenis titrasi kompleksiometri dengan EDTA, antara lain : 1) Titrasi langsung, larutan yang mengandung ion logam yang akan ditetapkan,
dibufferkan sampai ke pH yang dikehendaki (misalnya, sampai pH = 10 dengan NH4+ larutan-air NH3), dan titrasi langsung dengan larutan langsung dengan larutan EDTA standar.
hal-hal demikian, ditambahkan larutan EDTA standart berlebih, larutan yang dihasilkan dibufferkan sampai ke pH yang dikehendaki, daan kelebihan reagensia dititrasi-balik dengan suatu larutan ion logam standar; larutan zink klorida atau sulfat atau magnesium klorida atau sulfat sering digunakan untuk tujuan ini. Titik-akhir dideteksi dengan bantuan indikator logam yang berespons terhadap ion logam yang ditambahkan pada titrasi-balik.
3) Titrasi pengganti atau titrasi substitusi, titrasi-titrasi substitusi dapat digunakan untuk ion logam yang tidak bereaksi (atau bereaksi dengan tidak memuaskan) dengan indikator logam, atau untuk ion logam yang membentuk kompleks EDTA yang stabil dari pada kompleks EDTA dari logam-logam lainnya seperti magnesium dan kalsium.
4) Titrasi alkalimetri, bila suatu larutan dinatrium etilendiamintetraasetat, Na2H2Y, ditambahkan kepada suatu larutan yang mengandung ion-ion logam, terbentuklah kompleks-kompleks dengan disertai pembebasan dua ekuivalen ion hidrogen (Vogel, 1994).
2.4.2. Indikator Logam
Persyaratan untuk sebuah indiator logam untuk digunakan pada pendeteksi visual dari titik-titik-akhir meliputi :
1) Reaksi warna harus sedemikian sehingga sebelum titik akhir, hampir semua logam telah berkompleks dengan EDTA, larutan akan berwarna kuat.
3) Kompleks-indikator logam itu harus memiliki kestabilan yang cukup, kalau tidak, karena disosiasi, tidak akan diperoleh perubahan warna yang tajam. Namun, kompleks-indikator logam itu harus kurang stabil dibanding kompleks logam-EDTA untuk menjamin agar pada titik akhir, EDTA memindahkan ion-ion logam dari kompleks-indikator logam itu. Perubahan dalam kesetimbangan dari kompleks-indikator logam ke kompleks logam-EDTA harus lebih tajam dan cepat.
4) Kontras warna antara indikator bebas dan kompleks-indikator logam harus sedemikian sehingga mudah diamati.
5) Indikator harus sangat peka terhadap ion logam (yaitu, terhadap pM) sehingga perubahan warna terjadi sedikit mungkin dengan titik-ekuivalen.