BAB II
TINJAUAN PUSTAKA
2.1 Kanker payudara
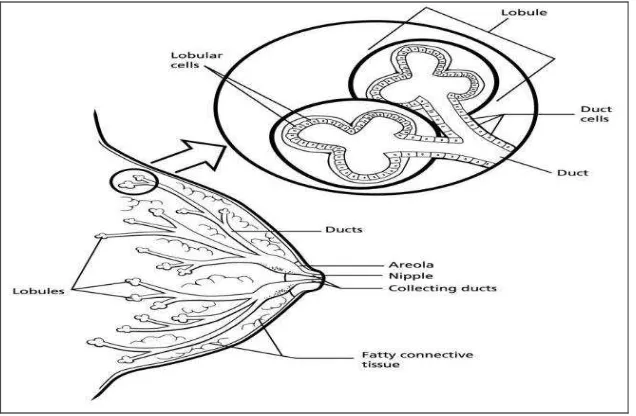
Kanker payudara merupakan kanker tersering yang diderita oleh wanita di seluruh dunia dan merupakan pembunuh kedua setelah kanker paru (Ih, 2013). Faktor resiko terjadinya kanker payudara adalah multifaktorial meliputi usia, ras, diet, aktivitas fisik, paparan terhadap estrogen, indeks masa tubuh, depresi, riwayat keluarga (Ostad & Parsa, 2011). Kanker payudara merupakan suatu tumor ganas yang berasal dari sel-sel payudara. Kanker payudara ini umumnya ditemui pada wanita, sangat jarang pada pria. Sel-sel kanker dapat tumbuh dan menginvasi jaringan sekitarnya hingga bermetastasis ke organ lain yang jauh dari tempat tumbuhnya sel-sel kanker tersebut.(ACS, 2011) Umumnya, kanker payudara berasal dari sel-sel epitel yang terletak di duktus, sebagian yang lain berasal dari sel-sel epitel yang terletak di lobulus maupun jaringan sekitarnya.
Terdapat beberapa jenis kanker payudara, berdasarkan atas histologinya adalah ductal carsinoma in situ (DCIS, dikenal juga sebagai karsinoma intraduktus), lobular carsinoma in situ, invasive/infiltrating ductal carsinoma, invasive/infiltrating lobular carsinoma.
Pada DCIS, terjadi perubahan pada sel-sel epitel yang terletak di duktus yang menyerupai sel kanker, DCIS juga dianggap sebagai pre-kanker karena dapat berpotensi menjadi kanker invasif. Pada lobular carsinoma in situ (LCIS),terdapat perubahan pada sel-sel epitel yang terletak pada lobulus, dianggap sama seperti DCIS sebagai bentuk kanker non invasif, namun berbeda dalam hal LCIS tidak memiliki potensi menjadi bentuk invasif. invasive/infiltrating ductal carsinoma merupakan jenis yang paling umum pada kanker payudara, perubahan sel-sel bermula dari duktus yang kemudian dapat berkembang hingga ke jaringan lemak pada payudara. Jenis kanker ini dapat bermetastasis melalui sistem limfatik ataupun aliran darah. Pada invasive/infiltrating lobular carsinoma, perubahan sel-sel bermula dari lobulus yang kemudian dapat bermetastasis juga melalui sistem limfatik ataupun aliran darah. (ACS, 2011)
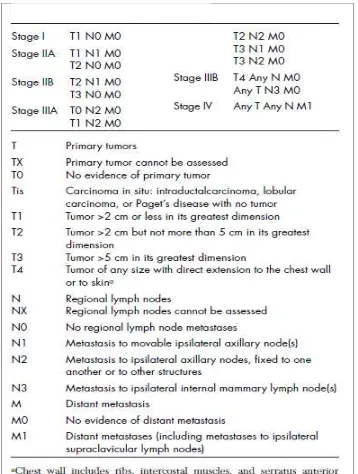
Tabel 2.1 Staging Tumor Payudara berdasarkan AJCC
2.2 Terapi pada kanker payudara
Terdapat beberapa jenis terapi pada kanker payudara meliputi pembedahan, radioterapi, kemoterapi, terapi hormon, targeted therapy dan bone-directed therapy. Pembedahan dan radioterapi dianggap sebagai terapi lokal yang bertujuan untuk menghilangkan sel kanker tanpa mempengaruhi bagian tubuh lain yang tidak terkena sedangkan kemoterapi, terapi hormon, targeted therapy dan bone-directed therapy merupakan terapi sistemik yang diberikan bisa secara peroral atau langsung melalui aliran darah untuk mencapai sel-sel kanker yang terdapat dimana-mana dalam tubuh (ACS, 2011) Kombinasi terapi /terapi multimodalitas yaitu gabungan antara pembedahan, radioterapi, kemoterapi/terapi hormonal juga biasa dipergunakan (Moss, 1997)
Pasien yang sudah tidak terdeteksi memiliki sel-sel kanker setelah pembedahan biasanya akan diberikan terapi tambahan untuk mencegah sel-sel kanker tumbuh kembali. Terapi ini dikenal dengan istilah terapi ajuvant (adjuvant therapy). Baik terapi sistemik seperti kemoterapi, terapi hormon, targeted therapy ,bone-directed therapy dan radiasi dapat digunakan sebagai terapi ajuvant. Beberapa pasien diberikan terapi, apakah kemoterapi atau terapi hormon yang dikenal dengan terapi neoajuvan (neoadjuvant therapy), terapi ini bertujuan untuk menyusutkan tumor sebelum dilakukan tindakan pembedahan. (ACS, 2011)
2.3 Kemoterapi pada kanker payudara
beberapa bulan. Kemoterapi dapat diberikan sebagai terapi ajuvant ataupun terapi neoajuvant. Pemberian kemoterapi sebagai ajuvant berguna untuk mematikan sel-sel kanker yang masih ada namun tidak terlihat. Pemberian kemoterapi sebagai terapi neoajuvant berguna bukan hanya untuk menyusutkan ukuran tumor sehingga ukuran tumor lebih kecil pada saat dilakukan tindakan pembedahan namun juga berguna bagi dokter untuk melihat respon terapi dilihat dari ukuran tumor yang berkurang dan toksisitas yang terjadi serta berperan untuk membunuh sel-sel kanker yang mikrometastasis. (ACS, 2011)
Terdapat berbagai macam obat-obatan yang bekerja sebagai agen kemoterapi (Plana, 2011). Beberapa agen kemoterapi tersebut terdiri dari golongan:
1. Agen pengalkilasi: bekerja dengan cara mengikatkan gugus alkil ke dalam struktur DNA. Yang termasuk dalam agen pengalkilasi adalah nitrogen mustard (mechloretamine, melphalan, siklofosfamid, ifosfamide, chlorambucil), nitrosoureas( lomustine, streptozotocin, dacarbazine, procarbazine)
2. Antibiotik antitumor: merupakan produk alami yang diperoleh dari fermentasi mikroba. Termasuk dalam golongan ini adalah doksorubisin, mitoxantrone, dactinomysin.
3. Golongan antimetabolit: bekerja dengan cara menghambat penggunaan metabolit sel untuk pertumbuhan dan pembelahan sel. Yang termasuk dalam golongan ini adalah cytarabine, metotreksate, gemcitabine, 5-fluorourasil
termasuk golongan ini adalah taksan (paclitaksel dan docetaxel), alkaloid vinka (vinblastine da vincristine).
5. Golongan penghambat topoisomerase (Topoisomerase inhibitor): bekerja dengan menghambat baik topoisomerase I maupun II yang berperan dalam proses replikasi dan traskripsi. Yang termasuk golongan ini adalah epidopolitoxin (etoposide dan teniposide)
6. Golongan lain: platinum (carboplatin dan cisplatin), hidroksiurea, L-asparagine, (Gustafson & Page, 2013)
Diketahui bahwa kemoterapi mengandung regimen doksorubisin lebih efektif dibandingkan dengan regimen tidak mengandung doksorubisin terutama bila dibandingkan dengan regimen CMF (Siklofosfamide, Methotreksate, 5-fluorourasil) (Goldhirsch, Glick, Gelber, & Coates, 2001). Doksorubisin juga paling banyak digunakan sebagai agen kemoterapi pada kanker payudara selain golongan taksan. (Society, 2011)
Umumnya, agen kemoterapi bersifat sitotoksik dan memiliki indeks terapi yang sempit serta adanya interindividual variabilitas berkaitan dengan respon terapi yang melibatkan baik efikasi dan toksisitas yang dapat timbul menyebabkan pemberian kemoterapi berbasis individu menjadi suatu hal yang penting (Gasparini et al., 2006)
2.4 Farmakologi doksorubisin 2.4.1 Struktur kimia doksorubisin
tahun 1960 (Minotti et al. 2004). Doksorubisin memiliki kerja dengan spektrum luas dengan aktivitas antitumor dan digunakan secara luas pada limfoma, leukemia, kanker payudara, kanker paru, kanker ovarium, kanker lambung dan tiroid (Vávrová et al., 2011)
Doksorubisin memiliki gugus gula dan aglikone. Gugus aglikone terdiri dari cincin tetrasiklin dengan grup quinone-hidroquinone berdekatan pada cincin C-B, substitusi methoksi pada C-4 di cincin D dan suatu rantai samping pendek dengan karboksil pada C-13. Gugus gula, yang disebut daunosamine, berdekatan dengan ikatan glikosidik ke C-7 pada cincin A dan terdiri dari 3-amino-2,3,6-trideoxy-L-fucosyl (Minotti et al., 2004). Doksorubisin memiliki cincin poliaromatic dengan adanya struktur quinone yang dihubungkan dengan ikatan O-glikosidic terhadap gula amino (Monneret, 2001). Doksorubisin dikarakteristikkan dengan adanya fungsi difenol pada cincin B pada aglikone dan rantai samping yang terasetilasi pada cincin A. Doksorubisin berwarna merah orange dan sensitif terhadap cahaya, menyerap cahaya pada rentang UV (254 nm), memiliki berat molekul 580 kDa dan biasanya digunakan dalam bentuk hidrochloric yang larut dalam air dan dalam pelarut yang polar. Sebagai alkaloid lemah, doksorubisin menjadi lebih polar, molekul bermuatan pada pH yang rendah, yang kemudian berkontribusi pada retensi selektif dalam suasana asam, lingkungan hipoksia yang merupakan karakteristik pada tumor padat.(Bartoszek, 2002)
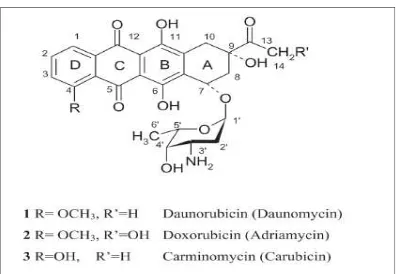
jaringan lunak dan limfoma yang agresif sedangkan daunorubisin memiliki aktivitas pada limfoblastik akut atau leukemia myeloblastik.(Minotti et al., 2004). Berikut ini adalah gambar struktur kimia doksorubisin dan struktur yang membedakannya dengan turunannya yaitu daunorubicin dan carminomycin.(Preobrazhenskaya, Tevyashova, & Olsufyeva, 2006)
Gambar 2.2: Struktur Kimia Doksorubisin dan Turunannya 2.4.2. Absorbsi
Doksorubisin diberikan secara intravena dengan dosis 35-70 mg/m2, secara pemberian infus untuk mencegah terjadinya ekstravasasi (Puma et al., 2008). Konsentrasi doksorubisin di dalam plasma menurun dengan cepat sesuai dengan distribusi obat ke dalam jaringan dan berpenetrasi dan bertahan ke dalam sel-sel yang memiliki inti sel (Sugunan, 2008)
doksorubisin adalah 50 kali lebih tinggi dibandingkan di dalam sitoplasma, mempresentasikan bahwa 1 molekul doksorubisin menginterkalasi 5 pasang basa DNA (Sugunan, 2008). Doksorubisin yang bebas adalah sangat rendah (hanya 0,2% dari total obat intraseluler) dan secara heterogen didistribusikan ke lisosom, mitokondria dan apparatus Golgi (Peterson & Trouet, 1978). Konsentrasi doksorubisin mencapai 25% dari plasma level setelah 75 menit selang pemberian dan dapat mencapai konsentrasi plasma setelah 2 jam (Bressolle, Jacquet, Galtier, Jourdan, & Donadio, 1992). Konsentrasi signifikan doksorubisin juga dapat dideteksi pada cairan pleural dan asites pasien kanker setelah pemberian (Lazo & Schwartzt, 1985).
2.4.3. Distribusi
Doksorubisin dapat ditemukan di hati, ginjal, usus kecil dan besar, sel-sel endotelial di otak, ovarium, testis, juga di sel-sel hematopoietik.(Ambudkar, Kimchi-Sarfaty, Sauna, & Gottesman, 2003). Doksorubisin berikatan dengan plasma protein berkisar antara 50%-80% dan memiliki volume distribusi (Vd) berkisar antara 500-800 L/m2 (Danesi, Fogli, Gennari, Conte, & Tacca, 2002). Akumulasi tertinggi doksorubisin terdapat pada jaringan hati sedangkan konsentrasi doksorubisin di sel-sel darah putih dan sumsum tulang berkisar antara 200-500 kali lebih tinggi dibandingkan dengan yang di plasma. Doksorubisin tidak melintasi sawar darah otak tapi doksorubin dapat melewati sawar plasenta dan dapat dijumpai di air susu (Sugunan, 2008).
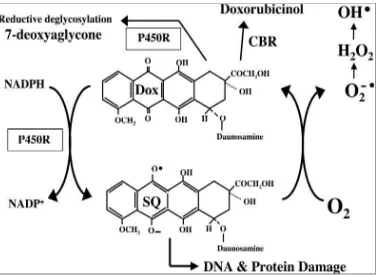
Metabolisme doksorubisin adalah kompleks dan melibatkan berbagai variasi enzim seperti carbonyl reductase, NADH dehydrogenase, NADPH-dependent cytochrome P450 reductase (P450R) (Westbrook & Stearns, 2013). Doksorubisin terutama dimetabolisme di hati oleh carbonyl reduktase, menghasilkan metabolit utama yaitu doksorubisinol. Doksorubisinol diperoleh dengan reduksi keton pada C-13 dari doksorubisin (Joerger, Huitema, Meenhorst, Schellens, & Beijnen, 2005). Doksorubisinol tetap memiliki aktivitas antitumor dan dimetabolisme juga oleh P450R yang memotong ikatan glikosida dan melepaskan metabolit yaitu 7-deoxydoxorubicinolone (Danesi et al., 2002). P450R juga mengkatalisis reduksi deglikosilasi pada doksorubisin sehingga dihasilkan metabolit 7-deoxydoxorubicinone (Riddick et al., 2005)
Gambar 2.3: Metabolit semiquinone menghasilkan spesies oksigen reaktif 2.4.5.Ekskresi
Klirens doksorubisin sebagian besar terjadi di jalur hepatobilier dengan lebih dari 50% obat diekskresikan dalam empedu dalam 7 hari setelah terapi Sekitar 10-20% dan 40-50% dosis diekskresikan dalam feses dalam 24 hingga 150 jam secara berturut-turut (Danesi et al., 2002). Klirens di ginjal dari doksorubisin adalah rendah, dan sekitar 12% dari total dosis ditemukan pada kencing setelah 6 hari setelah terapi. Doksorubisin mengalami 3 waktu paruh yang berbeda yang dikenal dengan trifasik yaitu waktu paruh awal (t1⁄βα) sekitar 5 menit, t1⁄β
sekitar γ jam dan waktu paruh akhir (t1⁄β ) sekitar γ0 jam (Shi, Moon, Dawood,
McManus, & Liu, 2011)
Konsentrasi plasma doksorubisinol meningkat secara cepat dan menurun secara paralel pada doksorubisin pada pemberian bolus (Callies et al., 2003). Selama pemberian infus doksorubisin, konsentrasi doksorubisinol mungkin bisa meningkat. Doksorubisinol berkontribusi pada 23% ekskresi bilier dimana sisanya terdiri dari metabolit-metabolit lain (Sugunan, 2008). Peningkatan konsentrasi plasma dari doksorubisinol telah diobservasi 4-8 jam setelah pemberian doksorubisin menunjukkan adanya eksistensi resirkulasi enterohepatik (Bressolle et al., 1992).
Oleh karena doksorubisin diekskresikan melalui jalur hepatobilier, maka pemberian harus hati-hati pada pasien dengan gangguan fungsi hati.(Shi et al., 2011). Pengurangan yang signifikan pada klirens doksorubisin dan peningkatan signifikan pada doksorubisinol telah diobservasi pada pasien-pasien hemodialisa. Klirens doksorubisin menurun kurang lebih 17% pada dosis > 50 mg/m2 (Rudek et al., 2004)
2.4.6 Mekanisme kerja doksorubisin
Mekanisme utama dari kerja doksorubisin dalam menimbulkan efek sitotoksisitas adalah dengan interkalasi DNA dan merusak DNA melalui inhibisi enzim topoisomerase II (Goto et al., 2001). Selain kedua mekanisme diatas, diketahui terdapat beberapa mekanisme kerja lain dari doksorubisin yang menimbulkan efek sitotoksik yaitu dengan pembentukan spesies oksigen reaktif dan peroksidasi lipid (Riddick et al., 2005)
Doksorubisin masuk ke dalam sel hingga menembus nukleus. (Garattini, 2006). Interkalasi DNA dilakukan dengan memasukkan gugus tertentu dari struktur doksorubisin ke dalam susunan pasangan basa dari DNA yang akan menyebabkan terhentinya proses replikasi dari sel-sel kanker.(Simůnek et al., 2009). Masuknya gugus tertentu dari struktur doksorubisin ke dalam susunan pasangan basa DNA diketahui melalui lekukan kecil (minor groove) DNA (Lei, Wang, & Wu, 2012)
Enzim topoisomerase berfungsi memodifikasi topologi DNA tanpa merubah struktur dan susunan /sekuense dari DNA (Minotti et al., 2004). Struktur molekul DNA yang terletak dalam sel selalu berada dalam keadaan dinamis, terkadang molekul DNA berada pada fase relaxed, pada fase yang lain, molekul DNA berada pada keadaan terpillin (supercoiled). Keadaan berpilin ini merupakan bagian sangat penting dalam proses pengemasan DNA (Yuwono, β005). Pada keadaan berpilin, struktur heliks akan mengalami proses “pemutaran”
(twist) lebih lanjut. Proses pemutaran ini melibatkan enzim topoisomerase.
untuk membentuk konformasi pilinan negatif. Pilinan negatif terbentuk dengan cara DNA diputar ke arah berkebalikan dari arah pemutaran heliksnya yang berupa heliks ganda putar-kanan (right-handed double helix) (Minotti et al. 2004; Yuwono, 2005)
Gambar 2.4: pilinan DNA
Dalam pembentukan spesies oksigen reaktif, diketahui bahwa doksorubisin dalam proses metabolismenya dapat mengalami oksidasi yang menyebabkan timbulnya semiquinone, suatu metabolit tidak stabil yang dalam prosesnya kembali dalam bentuk doksorubisin dengan melepaskan berbagai spesies oksigen reaktif seperti anion superoksida, hidrogen peroksida dan radikal hidroksil. Spesies oksigen reaktif inilah yang dapat menimbulkan peroksidasi lipid dan kerusakan DNA hingga akhirnya memicu jalur apoptosis dari kematian sel (Thorn et al., 2011)
Pengikatan doksorubisin terhadap berbagai variasi membran sel menyebabkan perubahan stabilitas membran. Perubahan pada permeabilitas terhadap berbagai variasi ion dan kemampuannya untuk mengkelasi berbagai variasi metal seperti tembaga, zink dan besi, berkontribusi terhadap sitotoksisitas dari doksorubisin (Gewirtz, 1999)
2.4.7. Toksisitas
myocardiosite yang memiliki kemampuan terbatas untuk memperbaharui diri (Chargari et al., 2011). Doksorubisin diketahui dapat menyebabkan kerusakan mitokondria dari kardiomiosit. Beberapa enzim mitokondria seperti NADH
dehydrogenase, sitokrom P-450 reduktase dan xanthine oksidase terlibat dalam
pembentukan spesies oksigen reaktif. (Chatterjee, Zhang, Honbo, & Karliner,
2010)
Toksisitas akut utama lainnya yang dapat terjadi adalah mielosupresi yang mana kejadian neutropenia lebih umum terjadi dibandingkan dengan trombositopenia. Toksisitas lainnya yang dapat terjadi adalah stomatitis, alopesia, mual dan muntah (Katzung, 2003)
Terdapat dua parameter yang telah diadopsi untuk melihat efek mielotoksik pada obat yaitu pengukuran dari jumlah neutrofil yang turun sebelum dan sesudah terapi. Pemberian doksorubisin mempengaruhi sel-sel progenitor hematopoietik dan mengganggu kemampuan mereka untuk menghasilkan sel-sel nonproliferasi, berdiferensiasi yang mana kelangsungan hidup dan rentang hidup leukosit pada darah tepi tidak dipengaruhi oleh terapi. Interval antara pemberian doksorubisin dan pengurangan jumlah neutrofil dibawah nilai normal berlangsung kurang lebih 10 hari dan 4-6 hari lebih jauh untuk mencapai titik nadir, dengan total kurang lebih 2 minggu. Pematangan stem sel granulosit menjadi neutrofil matang membutuhkan waktu 10 hari dan setelah mencapai sirkulasi, granulosit tetap bertahan sekitar 8-12 jam(Danesi et al., 2002)
Golongan taksan dibagi menjadi dua yaitu paclitaksel dan docetaxel Paclitaksel diisolasi dari cemara Pasifik (Taxus brevifolia) pada tahun 1971 dan docetaxel, suatu semisintetis analog taksan diisolasi dari cemara Eropa (Taxus baccata), docetaxel lebih bersifat larut air bila dibandingkan dengan paclitaksel. Baik paclitaksel maupun docetaxel terdiri dari cincin kompleks taksan yang berhubungan dengan gugus ester pada posisi C-13. Sebagian rantai samping posisi C-β’ dan C-γ’ serta C-13 berhubungan dengan aktivitas antimikrotubulusnya (Rowinsky, 1997a)
Gambar 2.5: Struktur golongan Taksan,(A)Paclitaksel (B) Docetaxel 2.5.2 Absorpsi
Paclitaxel berikatan dengan protein plasma lebih dari 95% sedangkan docetaxel lebih dari 90%. (Rowinsky, 1997b)
2.5.3 Distribusi
Paclitaksel didistribusikan secara luas dalam tubuh terkecuali pada sistem syaraf pusat dan testis sedangkan docetaxel didistribusikan secara luas kecuali pada sistem syaraf pusat. Volume distribusi paclitaksel adalah sekitar 182 L/m2 dan docetaxel adalah 74 L/m2.(Rowinsky, 1997b)
2.5.4 Metabolisme
Baik paclitaksel maupun docetaxel dimetabolisme di hati oleh enzim sitokrom P-450.
2.5.5 Ekskresi
Klirens paclitaksel sebagian besar terjadi di jalur hepatobilier dengan lebih dari 80% obat diekskresikan dalam feses.(Katzung, 2003). Klirens docetaxel juga sama seperti paclitaksel dengan klirens di ginjal adalah minor, berkisar kurang dari 5- 10% (Rowinsky, 1997b). Waktu paruh paclitaksel berkisar antara 7- 20 jam sedangkan waktu paruh docetaxel adalah 12-13 jam.
2.5.6 Mekanisme Kerja
Paclitaksel memiliki aktivitas signifikan pada berbagai jenis tumor solid meliputi kanker ovarium, kanker payudara tahap lanjut, kanker sel kecil dan non-sel kecil pada paru, kanker kepala dan leher, kanker esofagus, kanker prostat dan kanker kandung kemih. Docetaxel diketahui memiliki aktivitas signifikan pada kanker payudara tahap lanjut, kanker non-sel kecil pada paru (Katzung, 2003)
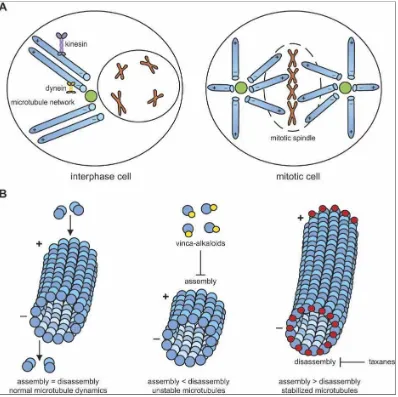
Stabilisasi ini menyebabkan tertahannya siklus sel pada fase G2/M yang kemudian menyebabkan terhambatnya mitosis. Docetaxel dan paclitaksel berbeda pada molekular farmakologinya yang secara potensial menjelaskan perbedaan aktivitas dan toksisitas. Docetaxel memiliki afinitas lebih kuat pada -tubulin, mempengaruhi organisasi sentrosom dan bekerja pada tiga fase pada siklus sel (S/G2/M) sedangkan paclitaksel menyebabkan kerusakan sel dengan mempengaruhi siklus sel pada fase G2 dan M.
Docetaxel diketahui masuk ke dalam sel-sel tumor dalam jumlah yang banyak sedangkan mengalami efluks secara lambat dari sel-sel tumor hal ini akan menyebabkan waktu retensi yang lebih lama. Berikut ini adalah perbedaan dalam mekanisme kerja docetaxel dengan paclitaksel.
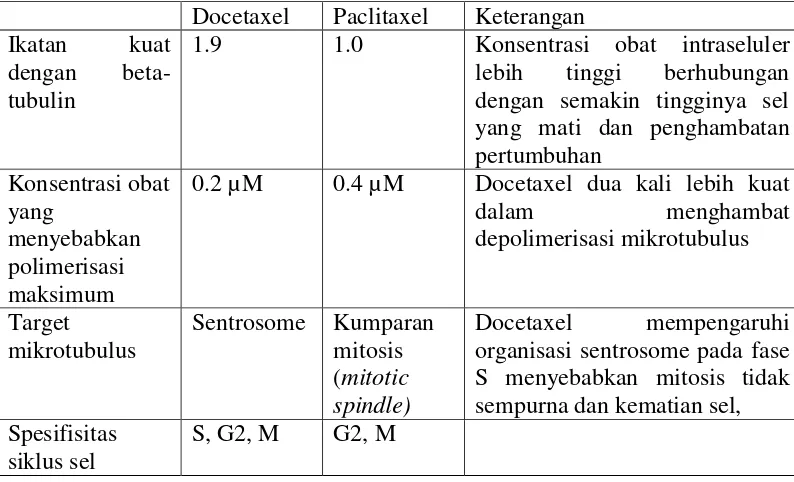
Tabel 2.2 Perbedaan mekanisme docetaxel dan paclitaxel ((Gligorov & Lotz, 2004a)
Docetaxel Paclitaxel Keterangan Ikatan kuat
dengan beta-tubulin
1.9 1.0 Konsentrasi obat intraseluler lebih tinggi berhubungan dengan semakin tingginya sel yang mati dan penghambatan S menyebabkan mitosis tidak sempurna dan kematian sel, Spesifisitas
siklus sel
S, G2, M G2, M
dan berdegradasi di kutub negatif (-) akhir yang akhirnya subunit α dan tubulin akan dilepas ke sitosol. Proses penyatuan dan pelepasan mikrotubulus ini berada dalam keadaan yang dinamis (dynamic instability) yang menyebabkan pemanjangan dan pemendekan mikrotubulus terjadi. Taksan bekerja dengan cara berikatan dengan tubulin yang telah menyatu dalam mikrotubulus. Hal ini
menyebabkan stabilisasi mikrotubulus dan mencegah terjadinya degradasi sehingga akhirnya mikrotubulus menumpuk dalam sel dan tentu saja menghambat terjadinya proses pembelahan sel.(Amerongen & Berns, 2006)
Saat ini, kemajuan terapi untuk penanganan pasien kanker payudara berkembang sangat pesat namun sering dihalangi dengan adanya kejadian resistensi obat dan toksisitas akibat penggunaan obat terutama agen kemoterapi. Adanya respon interindividual dan interetnis yang berbeda tidak dapat dimengerti dengan jelas sehingga diyakini bahwa terdapat pengaruh genetik yang mempengaruhi efikasi dan toksisitas agen kemoterapi. (Tan, Lee, & Goh, 2008).
Gen ATP-Binding Cassette (ABC) yang mengkode protein transporter merupakan salah satu gen yang diteliti berperan dalam menimbulkan perbedaan respon serta toksisitas akibat agen kemoterapi, salah satunya adalah doksorubisin dan taksan.(Mary Ameyaw & McLeod, 2006)
2.6 Keluarga protein transporter ATP-Binding Cassette (ABC)
sejumlah komponen hidrofobik dan metabolit melintasi plasma membran dan juga membran intraseluler (Huang, 2007). Protein transporter ABC dipercaya berperan dalam proteksi dari substrat xenobiotic. (Franke, Gardner, & Sparreboom, 2010)
Gen manusia mengandung 49 gen ABC, tersusun dalam 8 subfamili dan diberi nama melalui evolusi yang beragam. Transporter ABC juga berpartisipasi pada perpindahan beberapa obat dan metabolit, mereka melintasi permukaan sel dan organela membran sel. Oleh karena itu, defek gen ini dapat berperan penting pada terapi kanker, farmakokinetik dan gangguan farmakogenetik (Vasiliou, Vasiliou, & Nebert, 2009)
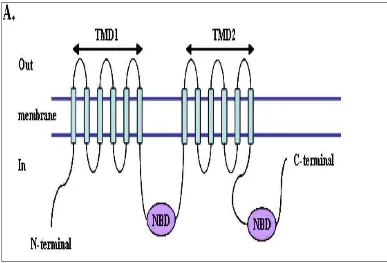
Transporter dapat bersifat pasif maupun aktif. Pada transporter aktif, untuk memindahkan suatu molekul dari luar ke dalam ataupun sebaliknya, memerlukan ATP. Transporter yang bersifat aktif salah satunya adalah pompa terikat ATP (ATP-binding cassette). Pompa ini menggunakan energi yang dihasilkan dari hidrolisis ATP untuk memindahkan substrat melintasi membran ke dalam dan keluar sel dengan melawan gradien elektrokimia. Pompa protein ABC terdiri dari superfamili yang luas. Kebanyakan gen ABC mengkode protein terikat membran yang juga dikenal sebagai nucleotide-binding domain (NBD)(Sparreboom et al., 2003).
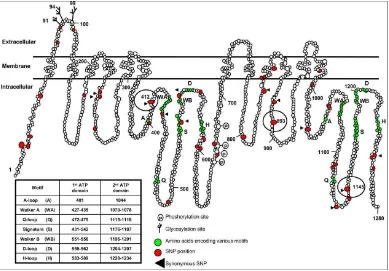
NBD mengandung beberapa motif termasuk sekuensi Walker A dan Walker B, motif signature ABC, lengkung H dan lengkung Q (H loop and Q loop). Transporter ABC juga mengandung transmembrane domain (TMDs), setiap dari masing-masing terdiri dari beberapa heliks hidrofobik.
dorongan untuk transport) sedangkan TMDs berpartisipasi pada pengenalan substrat dan translokasi melintasi membran lipid. Beberapa gen ABC mengkode protein yang bersifat setengah transporter “half transporter” terdiri dari dua subunit berikatan sebagai homodimer atau heterodimer dimana yang lain bersifat “full transporter” (Vasiliou et al., 2009). Berikut ini adalah struktur klan dari
Gambar 2.7: Struktur famili protein transporter ABC 2.6.1 Gen ABCB1 dan Protein P-glicoprotein (P-gp)
diekspresikan di kelenjar adrenal, ginjal, hati, kolon, jejunum, pankreas dan pada sel endotel kapiler di testis, sawar darah otak, jaringan payudara, sel-sel hematopoietik dan sel-sel leukosit (Fung & Gottesman, 2009b)
P-gp merupakan suatu protein transporter yang bekerja sebagai pompa effluks dengan menggunakan energi (Vasiliou et al., 2009). Protein ini dikodekan oleh gen ABCB1.(Patel & Tannock, 2009). P-gp ditemukan di banyak organ dan jaringan termasuk brush border dari sel-sel luminal saluran pencernaan bagian bawah, hati, tubulus proksimal ginjal, sel-sel endotelial pada sawar darah otak dan plasenta, testis, juga di payudara dan sel-sel hematopoietik(Sissung et al., 2006).
P-gp ditemukan pada jaringan tersebut di atas membuktikan bahwa protein ini berfungsi untuk mengekskresikan zat-zat yang berpotensi toksik atau xenobiotik yang tidak penting dan metabolit-metabolit dari sel. (Cizmarikova et al., 2009). Xenobiotik yang diekskresikan meliputi obat-obat antineoplastik (doksorubisin, vinca alkaloid, epipodophyllotoxins, actinomycin D dan golongan taxane juga obat-obatan antiretroviral (Calado, Falcao, Garcia, & Gabellini, 2002)
Akses obat melalui transporter terjadi melalui sitoplasma dan berdifusi dalam membran. Proses efluks obat dimediasi dengan konversi ATP menjadi ADP. Proses efluks terjadi dengan perubahan struktur protein sehingga membentuk aksi “flippase”, yang mengeluarkan obat ke dalam lingkungan
ekstraseluler dan bersifat seperti vakum cleaner (membrane vacuum cleaner) yang mengakses obat masuk melalui membran plasma.(Ambudkar et al., 2003)
Gambar 2.9: Struktur protein P-gp beserta tempat berikatan ATP 2.6.2 Polimorfisme pada gen ABCB1 dan doksorubisin
Saat ini, >100 varian pada gen ABCB1 telah dilaporkan. Terdapat 3 SNP yang umum pada ABCB1 yang mempengaruhi ekspresi ABCB1 dan ditemukan memiliki impikasi farmakokinetik dan farmakodinamik berbagai obat yaitu 1236C>T, 2667G>T/A dan 3435C>T(Sissung et al., 2006). Dari berbagai macam variasi tersebut, single nucleotide polymorphism (SNP) yang berlokasi di exon 26 (C3435T) telah ditemukan berhubungan dengan fungsi P-gp yang berubah(Cizmarikova et al., 2009).
varian varian homozigot dan prevalensi lebih rendah pada ras Afrika dan Afrika-Amerika. (Robert, Morvan, Smith, Pourquier, & Bonnet, 2005)
SNP didefinisikan sebagai variasi pada satu nukleotida yangmana satu alel dipresentasikan lebih dari 1% populasi studi (Wiechec & Hansen, 2009). Studi analisis menunjukkan bahwa ABCB1 sangat polimorfik dan sudah digunakan secara luas untuk menginvestigasi hubungan struktur-fungsi P-gp. Dari keseluruhan 28 ekson, termasuk regio promoter dan batas ekson-intron berada pada rentang 49-587. Beberapa dari polimorfisme ABCB1 adalah “silent” dan tidak menyebabkan perubahan asam amino. Ada yang bersifat non synonym yang tidak mengubah asam amino dan terletak pada domain transmembran, ada yang terletak sangat dekat pada ATP-binding site. Empat SNP terletak pada posisi “wobble” dengan tidak ada perubahan asam amino. Perhatian banyak terfokus
pada ABCB1 C3435T di ekson 26 yang sejauh ini merupakan silent polimorfisme yang paling banyak diamati untuk melihat hubungannya dengan ekspresi P-gp pada jaringan manusia yang berbeda dan ras yang berbeda (Yan-hong, Yong-hua, Yan, & Ling, 2006)
Adanya presentasi alel T pada C3435T menyebabkan penurunan level P-gp pada ras Kaukasia, Cina, Filipina, Portugisa dan Saudi Arabia. (Ambudkar et al., 2003). Terdapat 3 polimofisme ABCB1 yang paling umum yaitu C1236T, G2677A/T dan C3435T yang mana polimorfisme ABCB1 C3435T merupakan yang paling sering dipelajari.(Franke et al., 2010). Walaupun ABCB1 C3435T merupakan sinonim, namun diketahui terjadi penurunan level P-gp 2 kali lipat pada orang yang memiliki homozigot alel T (genotipe TT) dibandingkan dengan tipe normal / wild-type (genotipe CC).(Franke et al., 2010)
Perubahan pada fungsi protein disebabkan oleh polimorfisme sinonim
tidak dapat dijelaskan dari sekuensi asam amino dari protein, oleh karena
perubahan alel C homozigot (CC) menjadi homozigot/heterozigot alel T (TT/CT)
tetap mengkode asam amino yang sama yaitu isoleusin. Oleh karenanya, pelipatan
protein memprediksikan bahwa konformasi ABCB1 yang alami (wild-type) dan
ABCB1 varian seharusnya identik karena sekuensi asam aminonya juga identik
(Yan-hong et al. 2006). Namun, baik secara observasi in vitro dan in vivo pada ABCB1 , polimorfisme C3435T menunjukkan bahwa polimorfisme “silent” ini
merubah pelipatan dan fungsi ABCB1.
Terdapat beberapa mekanisme yang menjelaskan polimorfisme “silent” ini
merubah pelipatan dan fungsi ABCB1 yakni hal ini dapat disebabkan karena
adanya kodon yang jarang (wooble) yang bertanggung jawab menimbulkan
perubahan pada proses translasi.(Fung & Gottesman, 2009b).
Proses translasi merupakan proses penerjemahan urutan nukleotida pada
molekul MRNA menjadi rangkaian asam-asam amino yang membentuk
pemanjangan (elongasi) dan terminasi (Kimchi-sarfaty et al). Pada proses inisiasi,
regio 5’ dari mRNA berinteraksi dengan faktor inisiasi translasi yang
membutuhkan kompleks ribosom. Kompleks ini berjalan sepanjang mRNA dan
mulai untuk mensintesa polipeptida saat kodon metionine pertama dideteksi
(AUG). Fase berikutnya, elongasi, pada fase ini terdapat tiga tahapan yaitu
pengikatan aminoasil-tRNA pada sisi A yang ada di ribosom, pemindahan rantai
polipeptida yang tumbuh dari tRNA yang ada pada sisi P (peptidil) ke arah sisi A
(aminoasil) dengan membentuk ikatan peptida dan translokasi ribosom sepanjang
mRNA ke posisi kodon selanjutnya yang ada di sisi A (Yuwono 2005). Pada akhir
translasi, kompleks ribosom menghentikan produksi polipeptida/protein saat satu
dari tiga kodon terminasi (UAA/UAG/UGA) yang ada pada mRNA mencapai
posisi A pada ribosom.(Tsai et al., 2008)
Pada awal translasi, tRNA inisiator (tRNA yang berikatan dengan
metionin) berikatan dengan sisi P kemudian aminoasil tRNA (tRNA yang
berikatan dengan asam amino) akan mampu memasangkan kodon pada mRNA
yang tiba pada sisi A. Kompleks ribosom akan bergerak oleh satu kodon yang
akan mendorong tRNA dari sisi P menuju sisi E dan sesudah itu akan lepas dari
unit besar kompleks ribosom. Aksi ini akan menyebabkan sisi A kosong sehingga
mampu untuk ditempati oleh aminoasil-tRNA baru dan formasi asam amino baru
pada rantai polipeptida yang mulai timbul. Sebagaimana ribosom membutuhkan
tRNA untuk bergerak sepanjang MRNA, elongasi translasi dapat dipengaruhi oleh
dua faktor ini. Pada mRNA, mutasi nukleotida dapat mengubah kodon yang
mempengaruhi waktu yang dibutuhkan oleh aminoasill-tRNA untuk masuk pada
mRNA yang membangkitkan atau mengeliminasi struktur sekunder yang baru
sebagai contoh hairpins atau pseudoknots. Berbagai bentuk perubahan ini dapat mengelakkan ribosom dan mempengaruhi translasi. (Fung & Gottesman, 2009b)
Gambar 2.10: Proses translasi
Jika polimorfisme ABCB1 C3435T SNP mengubah kecepatan kompleks
ribosom selama translasi, terdapat beberapa konsekuensi, yang pertama
penghentian ribosom dapat menyebabkan disosiasi tRNA dari ribosom, diikuti
oleh perekrutan aminoasil-tRNA yang sama dari tRNA dan melanjutkan translasi.
Yang kedua, kompleks ribosom dapat semakin lambat berjalan kemudian terhenti.
Ketiga, suatu ribosom terkadang terhenti (ribosom stalling) dan mengenali kodon
baru dengan menggerakkan satu nukleotida, yang dikenal dengan istilah
itu akan terpisah dari mRNA cetakan (template). Penundaan translasi yang
signifikan akan menginterupsi interaksi protein chaperon dan menghasilkan
produksi protein dengan bentuk yang sedikit berbeda (Fung & Gottesman, 2009b)
Gambar 2.11: proses penundaan translasi
Polimorfisme gen ABCB1 terdiri dari homozigot wildtype (CC), heterozigot varian (CT) dan homozigot varian (TT). Pada bentuk wildtype CC , tidak terjadi perubahan struktur dan fungsi pada protein P-glikoprotein yang dikodekan oleh gen ABCB1 sedangkan pada bentuk homozigot varian (TT) terjadi perubahan struktur protein P-gp karena pelipatan protein (protein folding) yang tidak sempurna disebabkan karena adanya penghentian ribosom secara tiba-tiba (ribosom stalling). Protein P-gp yang tidak sempurna bisa didegradasi oleh proteasome sehingga level P-gp menurun. (Fung & Gottesman, 2009a)
2.6.3 Polimorfisme ABCB1 3435C>T dan neutropenia
dan berfungsi untuk melindungi sel dari zat yang bersifat toksik (Oswald, Grube, Siegmund, & Kroemer, 2007)
Dari penelitian yang dilakukan Sissung dkk (2006) diketahui bahwa varian homozigot (TT) C3435T mengalami 1,5 kali penurunan jumlah absolut neutrofil lebih rendah dibandingkan dengan kelompok yang mengandung varian normal (CC). (Sissung et al., 2006). Data ini juga sejalan dengan observasi terdahulu yang berhubungan dengan ABCB1 Alel T yang berhubungan dengan ekspresi yang menurun pada ABCB1 di hati dan penurunan aktivitas sel CD56+, suatu efek yang diketahui berhubungan dengan stabilitas mRNA yang menurun berhubungan dengan SNP ini.(Wang, Johnson, Papp, Kroetz, & Abcb, 2005). SNP pada ABCB1 dapat meningkatkan efluks dari doksorubisin dan meningkatkan eliminasi dari tubuh, menghasilkan penurunan pada konsentrasi plasma, dan selanjutnya mempengaruhi efikasi terapi.(Chang et al., 2008). Level mRNA pada 3435CC menunjukkan dua sampai tiga kali lebih tinggi dibandingkan level mRNA pada sampel dengan 3435TT homozigot. (Wang et al., 2005)
2.6.4 Polimorfisme ABCB1 pada pasien kanker Payudara
kejadian efikasi terapi pada pasien yang mendapatkan obat kemoterapi yang menjadi substrat bagi P-gp. (Cizmarikova et al., 2009).
Ket:
: Variabel yang diteliti