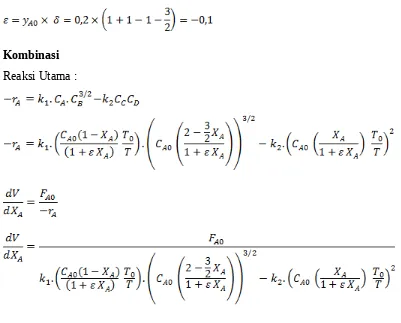LAPORAN TUGAS BESAR
MATA KULIAH MODEL DAN KOMPUTASI PROSES
Perancangan dan Simulasi Reaktor Plug Flow Adiabatis Untuk Reaksi Oksidasi H2S Menggunakan Program Scilab 5.1.1
Oleh :
1. Kartika Cintya Sulistyani NIM : 21030114120029 2. Fadillah Fathir Mahmud Fofana NIM : 21030114140173
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO
▸ Baca selengkapnya: contoh laporan mata kuliah pkm ut
(2)BAB I PENDAHULUAN 1.1 Latar Belakang
Teknik Kimia adalah suatu cabang ilmu teknik/rekayasa yang mempelajari pemrosesan barang mentah menjadi barang yang berguna secara ekonomis, dengan langkah-langkah yang melibatkan peristiwa kimia, biologis dan /atau fisis sehingga mengalami perubahan tingkat wujud, kandungan energi, atau komposisi. Pada dasarnya ilmu Teknik Kimia merupakan aplikasi dari ilmu kimia dengan menggabungkan kaidah-kaidah engineering serta memasukkan faktor-faktor ekonomi dan sosial dalam aplikasi industrinya (HMTK AKPRIND, 2013). Dalam dunia pendidikan tinggi, Teknik Kimia mempelajari teknik perancangan pabrik (Janiarto, 2014). Saat ini kebutuhan dunia akan Industri terus meningkat sehingga peran sarjana Teknik Kimia dalam perancangan pabrik sangat dibutuhkan untuk pembangunan berkelanjutan (sustainable
development). Pabrik yang dirancang dapat berupa pabrik kimia, bioproses, makanan,
dan masih banyak lainnya namun lebih fokus ke arah proses, baik meningkatkan kapasitas produksi maupun memperbaiki proses yang ada (FTI ITB, 2015). Sebelum lebih jauh merancang sebuah pabrik, perlu perancangan reaktor yaitu tempat berlangsungnya reaksi kimia.
Reaksi kimia adalah suatu proses yang menghasilkan konversi bahan kimia (Pharm, 2008). Bahan atau zat awalnya terlibat dalam reaksi kimia yang disebut reaktan. reaktan ini ditandai dengan perubahan kimia dan mereka menghasilkan satu atau lebih produk. Produk-produk ini umumnya berbeda dari reaktan asli. reaksi kimia mungkin alam yang berbeda tergantung pada jenis reaktan, jenis produk yang diinginkan, kondisi dan waktu reaksi, misalnya, sintesis, dekomposisi, perpindahan,
percipitation, isomerisasi, asam-basa, redoks atau reaksi organik. Hal-hal yang perlu diperhatikan terhadap reaksi reaksi kimia yaitu utilitas, keuntungan, dan keterbatasan. Dengan memperhatikan banyak hal untuk mendapatkan produk dari reaksi kimia yang sesuai, tempat berlangungnya reaksi kimia yang biasa disebut reaktor, perlu dirancang agar efisien.
teknik kimia. Karena itu adalah langkah yang sangat penting dalam desain keseluruhan proses, desainer memastikan bahwa reaksi berlangsung dengan efisiensi tertinggi terhadap output yang diinginkan, memproduksi hasil tertinggi dari produk dengan cara yang paling efektif. Hal-hal yang perlu diperhatikan dalam perancangan reaktor adalah ukuran reaktor, tipe reaktor dan metode operasi paling tepat untuk menghasilkan kinerja reaktor terbaik. Temperatur dan komposisi fluida yang bereaksi pada reaktor perubahannya sangat bervariasi dari titik ke titik, tergantung pada sifat reaksi yaitu endotermis atau eksotermis, ada tidaknya penambahan atau penghilangan panas pada sistem, dan pola aliran fluida dalam bejana. Dibutuhkan juga bentuk matematis yang dapat mendiskripsikan reaksi yang terjadi didalam reaktor. Salah satunya adalah persamaan laju reaksi, dari integral persamaan tersebut dapat diketahui waktu tinggal didalam reaktor. Namun, hal ini tidak dapat memprediksi secara keseluruhan kinerja reaktor. Perlakuan paling tepat pada faktor-faktor tersebut merupakan masalah utama dalam perancangan reaktor (Levenspiel, 1999).
Pada beberapa perancangan reaktor yang telah ada, perhitungan berbagai macam data dilakukan dengan metode numerik secara manual. Perhitungan tersebut merupakan masalah numerik yang kompleks. Sebagai perbaikan metode yang telah ada, akan dilakukan perancangan dan simulasi reaktor secara numerik menggunakan perangkat lunak yang disebut Scilab. Perangkat lunak ini hampir menyerupai Matlab, sebagai sebuah program interaktif untuk komputasi numerik dan visualisasi data (Sasongko, 2010).
1.2 Rumusan Masalah
Berdasarkan uraian diatas, akan dilakukan perancangan dan simulasi reaktor Plug Flow pada kondisi adiabatis untuk reaksi oksidasi H2S reaksinya bersifat eksotermis dan reversible. Perancangan dan simulasi tersebut dilakukan menggunakan program Scilab 5.1.1.
1.3 Tujuan
1. Mengoperasikan software Scilab 5.1.1 dengan benar 2. Mensimulasikan dan merancang ukuran reaktor Plug Flow
3. Mensimulasikan dan menentukan profil hubungan konversi terhadap volume 4. Mensimulasikan dan menentukan profil hubungan suhu terhadap konversi 1.4 Manfaat
3. Mampu mensimulasikan dan menentukan profil hubungan konversi terhadap volume
4. Mampu mensimulasikan dan menentukan profil hubungan suhu terhadap konversi 5. Mampu mensimulasikan dan menentukan profil hubungan konversi terhadap
BAB II
TINJAUAN PUSTAKA 2.1 Dasar Teori
2.1.1 Jenis-Jenis Reaktor
Jenis-jenis reaktor menurut Levenspiel (1999) adalah: a. Berdasarkan bentuk
1. Reaktor Tangki
Reaktor tangki dikatakan ideal apabila terjadi pengadukan sempurna, sehingga komposisi dan suhu didalam reaktor setiap saat selalu uniform. Reaktor tangki dapat dipakai untuk proses batch, semi batch, dan proses alir.
2. Reaktor Pipa
Reaktor Alir Pipa merupakan reaktor tanpa menggunakan pengaduk. Reaktor dikatakan ideal bila zat pereaksi yang berupa gas atau cairan, mengalir didalam pipa dengan arah sejajar sumbu pipa.
b. Berdasarkan proses 1. Reaktor Batch
Reaktor batch biasanya digunakan untuk reaksi fase cair dan pada kapasitas produksi yang kecil.
Neraca massa reaktor batch:
input = output + disappearance + accumulation
dimana nilai input dan output adalah nol, sehingga secara matematis dapat dinyatakan kecepatan berkurangnya zat A sesuai reaksi yang terjadi = -kecepatan akumulasi A di dalam reaktor.
Gambar 2.1 Reaktor Batch
Keuntungan reaktor batch:
Lebih murah dibanding reaktor alir karena ongkos dan biaya instrumentasi rendah
Kebutuhan ruangan yang relatif kecil Pengoperasian lebih mudah
Lebih mudah dikontrol dan penggunaannya fleksibel, artinya dapat dihentikan secara mudah dan cepat pada waktu yang diinginkan
Reaktor ini dapat digunakan untuk reaksi yang menggunakan campuran bahan kuat dan beracun
Kerugian reaktor batch:
Tidak begitu baik untuk reaksi fase gas (mudah terjadi kebocoran pada lubang pengaduk)
Pengendalian kualitas produk yang susah
Waktu yang dibutuhkan lama, serta tidak produktif (untuk pengisian, pemanasan zat pereaksi, pendinginan zat hasil, pembersihan reaktor, waktu reaksi)
2. Reaktor Alir (Continuous Flow)
Kerja reaktor alir berlangsung secara kontinyu, artinya terdapat pemasukan zat pereaksi dan pengeluaran zat hasil secara terus-menerus.
Terdapat 2 jenis reaktor alir, yaitu:
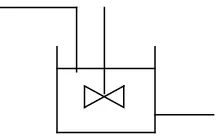
a. Reaktor Alir Tangki Berpengaduk (RATB/CSTR/Mixed Reactor)
Continuous Stirred Tank Reactor (CSTR) adalah reaktor yang bekerja
dengan cara mengaduk za-zat reaktan secara kontinyu selama proses berlangsung untuk menghasilkan produk yang diinginkan dan menghasilkan panas pada proses kimianya (Sylvia dkk., 2014).
Neraca massa reaktor alir tangki berpengaduk:
Laju reaktan masuk reaktor = laju reaktan keluar reaktor + laju reaktan yang bereaksi + laju reaktan yang terakumulasi.
Gambar 2.2 Reaktor Alir Tangki Berpengaduk Keuntungan RATB:
Suhu dan komposisi campuran dalam reaktor sama
Volume reaktor besar, maka waktu tinggal juga besar, sehingga zat pereaksi lebih lama bereaksi dalam reaktor
Kerugian RATB:
Tidak efisien untuk reaksi fase gas dan reaksi bertekanan tinggi Kecepatan perpindahan panas lebih rendah dibanding reaktor alir
pipa
Untuk menghasilkan konversi yang sama, volume yang dibutuhkan reaktor alir tangki berpengaduk lebih besar dari volume reaktor alir pipa
b. Reaktor Alir Pipa (RAP/PFR/Tubular Flow Reactor)
Neraca massa reaktor alir pipa:
Laju reaktan masuk reaktor = laju reaktan yang bereaksi + laju reaktan keluar reaktor
Gambar 2.3 Reaktor Alir Pipa
Reaktor alir pipa dikatakan ideal jika zat pereaksi dan hasil reaksi mengalir dengan kecepatan yang sama di seluruh penampang pipa. Keuntungan RAP:
Memberikan volume yang lebih kecil daripada reaktor alir tangki berpengaduk, untuk konversi yang sama
Kerugian RAP:
Harga alat dan biaya instalasi mahal
Memerlukan waktu untuk mencapai kondisi steady state
Untuk reaksi eksotermis kadang terjadi ‘Hot Spot’ (bagian yang suhunya sangat tinggi) pada tempat pemasukan sehingga dapat menyebabkan kerusakan pada dinding reactor
Beberapa aspek penting pada reaktor PFR adalah :
1. Di dalam PFR, fluida mengalir dengan perlakuan yang sama sehingga waktu tinggal (τ) sama untuk semua elemen fluida. Fluida sejenis yang mengalir melalui reaktor ideal disebut plug. Saat plug mengalir sepanjang PFR, fluida bercampur sempurna dalam arah radial bukan dalam arah axial (dari arah depan atau belakang). Setiap plug dengan volume berbeda dinyatakan sebagai kesatuan yang terpisah-pisah (hampir seperti batch reaktor) saat mengalir turun melalui pipa PFR. 2. Pereaksi dapat dimasukkan dalam PFR melalui lokasi yang
berbeda dari infeed. Dengan cara ini efisiensi tinggi dapat diperoleh atau ukuran dan biaya PFR dapat dikurangi.
3. Sebuah PFR mempunyai efisiensi lebih tinggi dari pada RATB pada volume yang sama. Pada space time yang sama, suatu reaksi akan menghasilkan konversi PFR yang lebih tinggi dari pada RATB (Dewajani, 2011).
3. Reaktor Semi Batch
Gambar 2.4 Reaktor Semi Batch
2.1.2 Kondisi Operasi Reaktor
Jenis-jenis reaktor berdasarkan kondisi operasinya (Levenspiel, 1999): a. Reaktor Adiabatis
Reaktor dikatakan adiabatis jika tidak ada perpindahan panas antara reaktor dengan sekelilingnya. Ditinjau dari segi operasionalnya, reaktor adiabatis merupakan reaktor yang paling sederhana, cukup dengan menyekat reaktor sehingga tidak ada panas yang keluar ke sekeliling maupun masuk dari sekeliling. Jika reaksi berjalan eksotermis, maka panas yang terjadi karena reaksi dapat dipakai untuk menaikkan suhu campuran di reaktor (K naik dan – rA besar sehingga waktu reaksi menjadi lebih pendek).
Neraca panas reaksi adiabatis:
b. Reaktor Non-Adiabatis
Non-adiabatis merupakan kondisi reaksi dimana terdapat perpindahan kalor dari sistem ke lingkungan atau dari lingkungan ke sistem. Sehingga untuk reaktor diperlukan aksesoris perpindahan panas seperti jaket atau coil. Jika reaksi bersifat eksotermis maka diperlukan pendingin, sedangkan bila reaksi bersifat endotermis maka perlu adanya pemanasan (Smith et al., 2001).
c. Reaksi Isothermal
Reaksi dikatakan isothermal jika suhu umpan yang masuk, suhu campuran dalam reaktor, dan suhu aliran yang keluar dari reaktor selalu seragam dan sama.
2.1.3 Panas Reaksi
Berdasarkan aliran perpindahan kalor, jenis reaksi dibagi menjadi: 1. Reaksi Eksotermis
kenaikan suhu sistem saat reaksi berlangsung. Perubahan entalpi dihitung dengan ∆H= energi untuk memutus ikatan-energi untuk membuat produk reaksi. Dengan demikian, perubahan entalpi bertanda negatif (∆H<0). Hal ini dikarenakan energi yang dilepaskan lebih besar daripada energi yang digunakan untuk reaksi.
2. Reaksi Endotermis
Reaksi endoterm adalah reaksi dimana terjadinya perpindahan kalor dari lingkungan ke sistem. Reaksi endotermis ditandai dengan adanya penurunan suhu sistem. Dengan demikian kalor dipindahkan dari lingkungan ke dalam sistem reaksi. Reaksi endotermis mempunyai entalpi bernilai positif (∆H>0). Hal ini dikarenakan energi yang dilepaskan lebih kecil daripada energi yang digunakan saat reaksi.
2.1.4 Jenis Reaksi
Mekanisme suatu reaksi rumit dapat tersusun dari dua atau lebih reaksi sederhana. Terdapat dua cara puenggabungan dua reaksi sederhana, yaitu : 1) reaksi sederhana disusun secara paralel (sejajar); 2) reaksi sederhana disusun secara seri (berurutan); 3) Reaksi Independen (Prianto,2008).
1. Reaksi Paralel
Reaksi paralel atau reaksi samping (competitive reaction) yaitu dari reaktan yang sama dihasilkan produk yang berbeda melalui jalur reaksi yang berbeda pula.
Contoh:
A R R
atau A
A S S
Contoh reaksi paralel pada skala industri adalah reaksi oksidasi terhadap etilen yang akan menghasilkan produk etilen oksida. Selama reaksi oksidasi berlangsung, sebagian etilen terbakar sempurna dan menghasilkan produk samping yang tidak diinginkan, yaitu uap air dan karbon dioksida.
C2H4 + ½ O2 C2H4O
C2H4 + 3 O2 2CO2 + 2 H2O
2. Reaksi Seri
Reaksi seri atau reaksi konsekutif yaitu dari reaktan terbentuk produk antara yang aktif kemudian lebih lanjut berubah menjadi produk lain yang stabil. Contoh :
A R k S
Contoh reaksi seri pada skala industri adalah reaksi antara etilen oksida dan amonia yang membentuk mono-etanol-amin, kemudian reaksi berlanjut membentuk di-etanol-amin dan produk akhir adalah tri-etanol-amin.
C2H4O + NH3 HOCH2CH2NH2
(HOCH2CH2NH)2NH (HOCH2CH2)3N 3. Reaksi Independen
Reaksi independen terjadi karena di dalam umpan terkandung berbagai macam reaktan. Contoh dari reaksi independen adalah proses pengolahan minyak bumi menjadi gasolin (bensin).
Contoh :
A → 2B dan B → C
2.1.5 Jenis Proses
1. Reaksi Monomolekuler
Reaksi monomolekuler merupakan reaksi yang melibatkan satu jenis molekul reaktan. Contoh: reaksi dehidrogenisasi, dekomposisi, cracking, polimerisasi kondensasi.
Skema reaksi : A B 2. Reaksi Bimolekuler
Reaksi bimolekuler merupakan reaksi yang melibatkan dua jenis molekul reaktan yang berbeda.
Skema reaksi : A + B C 3. Reaksi Trimolekuler atau Termolekuler
Reaksi trimolekuler merupakan reaksi yang melibatkan tiga jenis molekul reaktan yang berbeda.
Skema reaksi : A + B + C D
2.1.6 Arah Reaksi
1. Reaksi Reversible
Reaksi reversible merupakan reaksi yang berlangsung dua arah. Dalam hal ini akan terjadinya kesetimbangan. Dimana zat hasil reaksi akan dapat bereaksi kembali membentuk zat pereaksi. Misalnya reaksi pembentukan amonia dari gas hidrogen dan gas nitrogen.
2. Reaksi Irreversible
Reaksi irreversible merupakan reaksi satu arah dan tidak ada keadaan setimbang, meskipun sesungguhnya tidak ada reaksi kimia yang betul-betul tidak dapat balik. Dimana zat hasil reaksi tidak dapat bereaksi membentuk pereaksi. Banyak kasus kesetimbangan berada sangat jauh di kanan sedemikian sehingga dianggap irreversible. Misal reaksi pembentukan garam
E O
natrium klorida dari asam klorida dan natrium hidroksida (Kristianingrum, 2010).
2.1.7 Konversi
Konversi fraksional atau fraksi dari reaktan misal A, dikonversi menjadi produk. Konversi dari A (XA). Misalkan NA0 adalah jumlah awal A di reaktor pada waktu t = 0, dan NA adalah produk yang terkonversi pada waktu t. Konversi A pada volume konstan sebagai berikut:
XA= =1−
=1-Dan
Dxa = − (Levenspiel.O,1999)
2.2Studi Kasus
2.2.1 Deskripsi Proses
Berdasarkan tugas besar mata kuliah Model dan Komputasi Proses tahun 2016, studi kasus yang diberikan adalah perancangan dan simulasi reaktor plug flow adiabatis dengan reaksi bimolekuler, seri dan bersifat eksotermis serta reversible. Reaksi yang digunakan adalah reaksi oksidasi H2S.
Reaksi oksidasi H2S merupakan reaksi reversible fasa gas-gas katalitik. Proses ini terjadi dalam sebuah reactor plug flow pada suhu 250⁰C dan tekanan 21,75 atm. Reaksi oksidasi H2S merupakan reaksi eksotermis rendah, sehingga untuk mempertahankan suhu di dalam reactor perlu dilengkapi dengan jaket pendingin yang berfungi sebagai tempat aliran air pendingin.
Reaksi utama
H2S + O2 SO2 + H2O
Reaksi samping
SO2 + O2 SO3
2.2.2 Kondisi Operasi
Kondisi operasi dalam reaksi oksidasi H2S adalah reaksi terjadi dalam sebuah reaktor plug flow pada suhu 250⁰C dan tekanan 21,75 atm. Reaksi oksidasi H2S merupakan reaksi eksotermis rendah, sehingga untuk mempertahankan suhu di dalam reactor perlu dilengkapi dengan jaket pendingin yang berfungi sebagai tempat aliran air pendingin.
2.2.3 Tinjauan Termodinamika
Tinjauan secara termodinamika dimaksudkan untuk mengetahui sifat reaksi (endotermis/eksotermis) dan arah reaksi (reversible/irreversible).
Reaksi utama:
H2S + O2 SO2 + H2O
∆H reaksi = ∆H produk - ∆H reaktan
= (∆Hof298 SO2 + ∆Hof298 H2O) – (∆Hof298 H2S + x ∆Hof298 O2)
= (-296840000 J/kmol + (-241814000) J/kmol) – (-20630000J/kmol + 0)
= -518024000 J/kmol = - 518024 J/mol = - 123,814 cal/gmol
Dari harga ∆Hof298 sebesar - 518024J/mol maka dapat dikatakan bahwa reaksi yang terjadi merupakan reaksi eksotermis.
Arah reaksi ditentukan dengan mengetahui harga K (konstanta kesetimbangan reaksi). Harga K dapat dihitung dengan menggunakan persamaan:
∆G reaksi = ∆G produk - ∆G reaktan
= (∆Go298 SO2 + 2 x ∆Go298 H2O) – (∆Go298 H2S + x ∆Go298 O2)
= (-300120000 J/kmol + (-228590000) J/kmol) – (-33440000 J/kmol + 0)
= (-(-118,375 cal/gmol)) / (1,987 cal/gmol.⁰K ×298.15 K) = - 0,199
Ko = 0,819
Sehingga harga K pada suhu operasi 250oC (523,15 K) dapat dihitung dengan persamaan:
K = 0,748
Dapat dilihat bahwa harga K sangat kecil sehingga reaksi berjalan secara
reversible.
2.2.4 Tinjauan Kinetika
Reaksi oksidasi H2S adalah sebagai berikut: Reaksi utama :
H2S + O2 SO2 + H2O
A + B C + D
Reaksi samping :
SO2 + O2 SO3
C + B E k1
k2
k1
k2
k3
k4
k3
Persamaan kecepatan reaksinya adalah:
dimana: -rA = kecepatan reaksi (mol/m3.menit) k = konstanta kecepatan reaksi (menit-1) CA = konsentrasi H2S (mol/m3)
CB = konsentrasi O2 (mol/m3) CC = konsentrasi SO2 (mol/m3) CD = konsentrasi H2O (mol/m3) CE = konsentrasi SO3 (mol/m3)
Reaksi oksidasi H2S pada berbagai suhu diperoleh harga konstanta kecepatan reaksinya adalah:
Dimana : A1 = 15762 sekon-1
E1 = 49,4 kJ/mol = 11,807 cal/gmol A2 = 506 sekon-1
E2 = -89,3 kJ/mol = -21,34 cal/gmol A3 = 13215 sekon-1
E3 = 44,39 kJ/mol = 10,61 cal/gmol A4 = 303 sekon-1
E4 = 57,86 kJ/mol = 13,83 cal/gmol R = 1,987 cal/mol⁰K
Sehingga harga k untuk suhu 298,15⁰K dapat dihitung:
Dari harga ΔH yang besarnya negatif, dapat disimpulkan bahwa reaksi yang terjadi bersifat eksotermis rendah yang artinya ada sedikit pembebasan panas dari reaksi tersebut. Hal ini mengakibatkan suhu reaktor akan mengalami kenaikan sedikit demi sedikit sehingga untuk menjaga suhu reaksi, reaktor dilengkapi dengan jaket pendingin.
2.2.5 Kasus yang akan dirancang
Proses reaksi oksidasi H2S dilakukan pada suhu 250⁰C dan tekanan 21,75 atm. Reaksi oksidasi H2S merupakan reaksi antara H2S dan oksigen. Reaktor bekerja secara adiabatis. Dari tinjauan termodinamika dan kinetika maka dapat diperoleh harga K dan k yaitu :
K1 pada suhu 298,15⁰K = 0,819
K1 pada suhu 523,15⁰K = 0,748
k1 pada suhu 298,15⁰K = 15450,97 sekon-1
k1 pada suhu 523,15⁰K = 15583,98 sekon-1
Berdasarkan data dan ketentuan tersebut ingin didapatkan:
BAB III
METODE PENYELESAIAN
3.1 Permodelan (Penurunan Rumus)
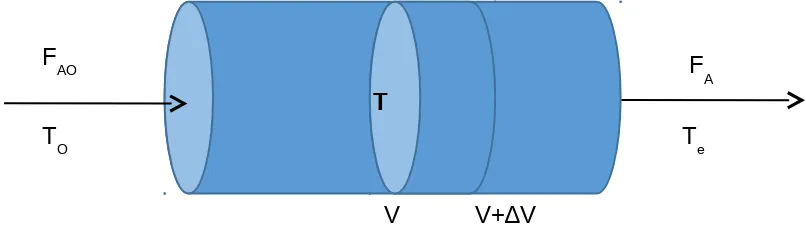
Simulasi dan perancangan reaktor yang akan dibuat adalah PFR ( plug flow reactor), adiabatis dari reaksi yang bersifat reversible, eksotermis, bimolekular dan reaksinya seri.
Gambar 3.1 Permodelan reaktor plug flow adiabatis
Reaksi oksidasi H2S : Reaksi utama :
H2S(g) + O2(g) SO2(g) + H2O(g)
Reaksi samping :
SO2(g) + O2(g) SO3(g)
Kondisi Operasi :
1. Temperatur : 250⁰C
2. Tekanan : 21,75 atm
3. Sifat Reaksi : Eksotermis , Reversible 4. Fase : Gas-gas
5. Reaktan : Hidrogen sulfida dan Oksigen yang berlebih 3.2 Algoritma Penyelesaian
Reaksi utama :
H2S + O2 SO2 + H2O
Neraca Massa :
T FAO
TO
FA
Te
- + =
Pada reaktor jenis plug flow, aliran bersifat steady-state selama reaksi berlangsung sehingga tidak terbentuk akumulasi produk dan reaktan di dalam reaktor. Oleh karena itu, persamaan menjadi:
Karena pada kondisi steady state, maka (akumulasi) = 0
Reaksi oksidasi hidrogen sulfida dengan mereaksikan hidrogen sufida dengan oksigen dalam fase gas-gas merupakan reaksi bimolekuler reversible. Sehingga persamaan reaksinya adalah sebagai berikut :
Reaksi utama :
H2S(g) + O2(g) SO2(g) + H2O(g)
A + B C + D
Reaksi samping :
SO2(g) + O2(g) SO3(g)
C + B E
Sehingga persamaan reaksinya sebagai berikut : Hidrogen sulfida : -rA = k1.CA.CB3/2 – k2.CC.CD
Oksigen : -rB = k1.CA. CB3/2 – k2.CC.CD + k3. CC .CB0.5 - k4.CE Sulfur dioksida : rC = k1.CA. CB3/2 – k2.CC.CD - k3. CC .CB0.5 + k4.CE Air : rD = k1.CA. CB3/2 – k2.CC.CD
Sulfur trioksida : rE = k3. CC .CB0.5 – k4.CE
Neraca massa dapat diketahui dari profil laju alir massa dari tiap senyawa yang terlibat
terhadap volume yang dinyatakan dalam persamaan diferensial . Penyelesaian
persamaan tersebut dapat dilakukan dengan menggunakan algoritma persamaan diferensial biasa pada program scilab.
Stoikiometri
k1
k2
k1
k2
k3
k4
k3
Reaksi utama :
H2S(g) + O2(g) SO2(g) + H2O(g)
A + B C + D
Reaksi samping :
SO2(g) + O2(g) SO3(g)
C + B E
Dengan menganggap H2S (A) sebagai pereaktan pembatas, maka stoikiometri reaksi dapat disusun sebagai berikut:
Asumsi :
k1
k2
k1
k2
k3
k4
k3
Fase gas, dan dianggap pressure drop kecil sehingga persamaan menjadi :
Jika umpan terdiri dari 20 % A dan 80 % B dimasukkan dalam reaktor maka faktor
Kombinasi Reaksi Utama :
Neraca Panas
Neraca panas dapat diketahui dari profil temperatur terhadap volume yang dapat dinyatakan dalam persamaan di bawah ini :
Penyelesaian persamaan tersebut dapat dilakukan dengan menggunakan algoritma persamaan diferensial biasa pada program scilab. Karena bekerja secara adiabatis maka Q=0. Sehingga persamaan diatas menjadi :
Harga Cp tiap komponen diperoleh dari literatur dengan persamaan:
Tabel 3.1. Konstanta kapasitas panas dari senyawa-senyawa yang terlibat
Spesies C1 C2 C3 C4 C5
(A)
Oksigen (B) 2,910E-06 2,958E-06 1,522E-03 2,715E-06 680,35
Sulfur Dioksida (C) 33375 215030 772 99900 423,7
Air (D) 33363 87350 1649,2 65560 1169
Sulfur Trioksida
(E) 33408 25864 932,8 10880 393,74
Untuk menghitung panas reaksi digunakan persamaan :
Dengan :
Dari Tabel 3.1 diperoleh nilai Cp untuk T =523 setiap senyawa yaitu :
Sehingga persamaannya menjadi :
Menghitung nilai untuk reaksi utama :
Menghitung nilai untuk reaksi samping :
3.3 Logika Pemrograman
DAFTAR PUSTAKA
Abedini, R., Salooki, Koolivand M., and Ghasemian, S., 2010, “Modelling and Simulation of Condensed Sulfur in Catalytic Beds of Claus Process: Rapid Estimation, Chemical Engineering Research Bulletin.
Dewajani, Henny. 2011. “Pembuatan Biodiesel dari Minyak Sawit Secara Kontinyu Dalam Model Reaktor Berisian”. Jurusan Teknik Kimia Politeknik Negeri Malang.
FTI ITB. 2015. "Teknik Kimia ITB". http://www.che.itb.ac.id/ diakses pada 7 November 2016.
HMTK AKPRIND.2013. "Apa itu Teknik Kimia dan Pentingnya Teknik Kimia". http://hmtk-akprind.blogspot.co.id/ diakses pada 7 November 2016.
Janiarto. 2014. "Perkuliahan dan Prospek Kerja Jurusan Teknik Kimia". www.jurusankuliah.info diakses pada 7 November 2016.
Levenspiel, Octave, 1999, “Chemical Reaction Engineering”, 3nd ed., John Willey and Sons Inc., Singapore.
Nanda, Sanju. 2008. "Reactors and Fundamentals of Reactors Design for Chemical Reaction". Pharmaceutical Enineering of M. D. University, Rohtak.
Prianto, Bayu. 2008. “Peran Kimia Komputasi Dalam Mempelajari Mekanisme Reaksi Proses Elektrolisis NaCl Menjadi NaClO4”. Berita Dirgantara Vol. 9 No. 4. Peneliti Bidang Material Dirgantara, LAPAN.
Kristianingrum, Susila. 2010. “Kesetimbangan Kimia”. Jurusan Pendidikan Kimia FMIPA UNY.
NO TANGGAL
DIPERIKSA KETERANGAN
TANDA TANGAN ASISTEN 1. 3 November 2016 Asistensi Judul