Pemanfaatan Teknik Kultur In Vitro untuk Konservasi
Plasma Nutfah Ubi-ubian
Nurwita Dewi*, Iswari S. Dewi, dan Ika Roostika
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Jl. Tentara Pelajar 3A, Bogor 16111 Telp. (0251) 8337975; Faks. (0251) 8338820; *E-mail: nurwitadewi@gmail.com
Diajukan: 18 September 2013; Diterima: 10 Januari 2014
ABSTRACT
Utilization of In Vitro Culture Technique for Tuber Crops Conservation. Nurwita Dewi, Isw ari S. Dew i, and Ika Roostika. Exc e pt fo r po tato , sw e et po tato, taro , yam, and c assava, m o st o f tuber c ro ps are c o nside re d as unde rutilize d c ro ps. Ho w e ve r, tuber c ro ps are po tential as alternative c arbo hydrate so urc e s, so the y c an be use d as fo o d re se rve s to fac e glo bal c lim ate c hange that affe c ts fo o d sec urity in c e rtain are a thro ugho ut the w o rld, inc luding Indo nesia. Having high dive rsity in tuber c ro ps germ plasm , Indo nesia m ust be able to c o nse rve tho se ge rm plasm to e nsure their availability in the future. In the future , w itho ut igno ring all the pro bable c o nstraints, the pro spec t in utilizatio n o f in vitro c ulture te c hnique w ill be highe r fo r im pro vem ent o f c o nservatio n and m anage m ent o f ge netic reso urc es in the fo rm o f ac tive and base c o llec tio ns. In this paper, strate gy in de velo ping in vitro c o lle c tio n o f tuber c ro ps germ plasm , i.e. slo w gro w th te c hnique fo r m e dium term sto rage and c ryo pre se rvatio n te c hnique fo r lo ng te rm sto rage, is disc usse d inc luding ho w to analyze ge netic stability o f the c o llec tio ns. Se veral natio nal and internatio nal re se arc h c e nters de aling w ith re se arc h and de velo pm e nt o f in vitro c o nservatio n te c hnique are pre se nte d.
Keywords: In vitro c ulture, c o nse rvatio n, tuber c ro ps.
ABSTRAK
Pemanfaatan Teknik Kultur I n Vitro untuk Konservasi Plasma Nutfah Ubi-ubian. Nurwita Dewi, Isw ari S. Dew i, dan I ka Roostika. Se lain kentang, ubi jalar dan ubi kayu, um um nya tanam an ubi-ubian m asih kurang pe m anfaatannya. Tanam an ubiubian berpo te nsi sebagai sumbe r karbo -hidrat alternatif se hingga dapat me njadi c adangan pangan dalam m enghadapi perubahan iklim glo bal yang saat ini m e m pe ngaruhi ketahanan pangan di beberapa dae rah ter-te ntu di dunia, ter-te rm asuk di Indo nesia. Indo nesia yang me-m iliki diversitas yang tinggi untuk plasme-m a nutfah ubi-ubian harus dapat me m pe rtahankan keterse diaannya di m asa de pan. Tanpa me ngesam pingkan ke ndala yang akan tim bul, pe luang pe m anfaatan te knik kultur in vitro sangat besar dalam pe rbaikan c ara ko nse rvasi dan pe ngelo laan sum ber daya ge ne tik tanam an ubi-ubian di Indo ne sia, baik dalam be ntuk ko le ksi aktif m aupun ko le ksi dasar. Dalam tinjauan ini, dipaparkan pe m anfaatan strategi penyim panan plasma nutfah ubi-ubian in vitro m elalui te knik pe rtumbuhan lam bat
Hak Cipta © 2014, BB Biogen
untuk ko nservasi jangka m ene ngah dan pe nghe ntian per-tum buhan m elalui krio preservasi untuk pe nyim panan jangka panjang, term asuk c ara m e nganalisis ke stabilan ge netik ko le ksi. Di sam ping itu, dike mukakan juga be berapa institusi nasio nal dan internasio nal yang m elakukan pe ne litian dan penge m bangan te knik ko nservasi in vitro.
Kata kunci: Kultur in vitro, ko nservasi, ubi-ubian.
PENDAHULUAN
Indo ne sia yang telah diakui se bagai salah satu pusat keane karagam an hayati te rbe sar (m e ga bio dive rsity) di dunia m e m iliki banyak plasm a nutfah tanam an pangan, di antaranya plasm a nutfah ubi-ubian. Me nurut Flac h dan Rum aw as ( 1996) , Indo nesia m e m iliki be be rapa plasm a nutfah ubi-ubian sam pai ke tingkat spe sie s, se pe rti pada Dio sco re a, yaitu D. alata ( ubi ke lapa), D. hispida ( gadung) , dan D. e scule nta, D. acue lata, dan D. bulbife ra, serta pada
Am o rpho phallus, yaitu A. cam panulatus ( suw e g) , A. m ulle ri atau A. o nco phyllus ( iles-iles) .
Di Indo ne sia, ubi jalar (Ipo m o e a batatas) dan ubi kayu (Maniho t e scule nta) sudah lam a digunakan se bagai tanam an pangan pe nghasil karbo hidrat di sam ping se re alia yang m e njadi tanam an pangan utam a. Se lain ke dua ubi-ubian terse but, be be rapa jenis ubi-ubian, sepe rti garut (Marantha arundina) , ganyo ng (Canna e dulis) , ke ntang hitam (Co le us tube ro sus) , talas (Co lo casia e scule nta) , be litung (Xantho so m as agittifo lium) , dan Dio sco re a spp. sangat po tensial se bagai bahan pangan alte rnatif, te rutam a untuk m enghadapi raw an pangan akibat pe -ningkatan jum lah pe nduduk dan perubahan iklim glo bal yang m e m pe ngaruhi pro ses pro duksi pangan. Be be rapa je nis ubi-ubian, se pe rti ke ntang hitam dan
Untuk m e njam in kete rsediaannya di m asa de pan, usaha ko nservasi perlu dilakukan kare na plasm a nutfah ubi-ubian te rse but dikhaw atirkan m en-jadi punah, baik akibat dinam ika alam m aupun ulah m anusia, se pe rti de fo re stasi, te rjadinya pe nge m bang-an se c ara be rle bihbang-an te rhadap suatu kultivar ybang-ang dianggap m e nguntungkan se c ara e ko no mi, dan juga m e ningkatnya alih fungsi lahan se iring de ngan m e -ningkatnya pe m bangunan infrastruktur ( To w ill, 2005) . Biji m e rupakan m ate rial yang um um digunakan untuk ko nse rvasi. Nam un de mikian, tidak se m ua akse si plasm a nutfah tanam an ubi-ubian dapat be rbunga dan m e nghasilkan biji. W alaupun ada yang m e nghasilkan biji, biji ubi-ubian tidak dapat disim pan dalam ko ndisi kele m baban dan suhu re ndah dalam jangka w aktu yang lam a (re calcitrant) . Ole h se bab itu, um um nya ko nse rvasi plasm a nutfah ubi-ubian dilakukan dalam ke adaan tanam an tum buh o ptim al se c ara e x situ di lapang atau fie ld ge ne bank ( Go nzales-Be nito e t al., 2004) . Nam un, terdapat ke le m ahan ko nse rvasi e x situ
di lapang, yaitu te rjadinya ke hilangan plasm a nutfah akibat se rangan o rganisme pe ngganggu tanam an ( OPT) , se pe rti ham a dan pe nyakit, se lain c ekam an lingkungan abio tik ( To w ill, 2005) . Untuk m engatasi m asalah te rse but, pe nge m bangan ko le ksi plasm a nutfah se c ara in vitro m e rupakan strate gi alte rnatif se bagai c adangan plasm a nutfah yang diko nse rvasi di lapang. Te kno lo gi in vitro saat ini sudah m e njadi ke -butuhan dalam strate gi pem e liharaan diversitas ta-nam an dalam be ntuk ko le ksi aktif (active co lle ctio ns) dan ko le ksi dasar (base co lle ctio ns) , te rutam a untuk spesie s yang pe rbanyakannya dilakukan se c ara ve ge tatif, se pe rti tanam an ubi-ubian ( Kelle r e t al., 2006) . Bebe rapa strate gi yang dapat digunakan dalam ko nse rvasi plasm a nutfah tanam an se c ara in vitro, antara lain pe nyim panan dalam ke adaan ( a) kultur tum buh no rm al untuk pe nyimpanan jangka pe nde k, ( b) kultur tum buh de ngan pe nam pilan m inim al (gro w th re ductio n o r m iniaturiz atio n) kare na kultur tum buh sangat lam bat untuk pe nyim panan jangka m e ne ngah, dan ( c ) kultur sam a se kali tidak tum buh (suspe nd o r sto p the gro w th) kare na kultur disim pan pada suhu sangat re ndah ( -196°C) untuk pe nyim pan-an jpan-angka ppan-anjpan-ang ( Dube e t al., 2011) .
Tinjauan ini akan m em aparkan strate gi, peluang, dan kendala pe nyim panan me lalui te knik kultur in vitro , yaitu m e to de pertum buhan lam bat (m inim al o r
slo w gro w th) dan pe nghe ntian pe rtum buhan (cryo pre se rvatio n) , yang te lah dike m bangkan untuk m e nyim pan plasm a nutfah ubi-ubian, se rta te knik bio lo gi m o lekule r yang dapat diaplikasikan untuk pengujian stabilitas ge ne tik pada plasm a nutfah te r-se but r-se telah pe nyim panan. Di sam ping itu, tinjauan
ini juga m e m be rikan info rm asi te ntang be rbagai le m baga pe ne litian inte rnasio nal yang m e lakukan pe -ne litian dan pe nge m bangan te knik ko nse rvasi plasm a nutfah ubi-ubian in vitro.
STRATEGI METODE PERTUMBUHAN LAMBAT
Penyim panan tanam an se c ara in vitro untuk ko le ksi aktif um um nya dilakukan dalam ke adaan ta-nam an tum buh no rm al de ngan m e nggunakan fo rm ulasi m e dia untuk pe rbanyakan. Tanam an yang disim -pan di m e dia te rse but biasanya hanya dapat be rtahan 23 bulan akibat ke habisan nutrisi dan dipe rlukan subkultur ke m bali ke m edia baru ( Ram khrisna e t al., 2005) . Siklus subkultur akan be rpe ngaruh te rhadap lam a pe nyim panan dan biaya pe m e liharaan yang di-pe rlukan dalam ko nse rvasi plasm a nutfah in vitro. Se baliknya, pada pe nyim panan de ngan m e to de pe r-tum buhan lam bat m e lalui induksi pe ngham batan laju pe rtum buhan, tanam an tum buh m inim al se hingga fre-kue nsi subkultur berkurang dan inte rvalnya m e ning-kat. Hal ini te ntu akan m e nghindarkan risiko te rhadap hilangnya ko le ksi se bagai akibat dari pe nurunan vigo r, ko ntam inasi atau te rjadi ke salahan pe labelan. Pada dasarnya strate gi pe nyim panan in vitro ditujukan agar kapan saja dipe rlukan, tanam an se ge ra dapat dipe r-banyak dan didistribusikan ( To w ill, 2005) .
Laju m e tabo lism e tanam an in vitro dapat diham bat de ngan dua c ara, yaitu ( 1) m e m o difikasi ko m po -ne n m e dia, m elalui pe nggunaan re gulato r o sm o tik (o sm o re gulato r) dan zat pengham bat tum buh (re tardant) , pe nurunan ko nse ntrasi garam -garam m akro , peningkatan atau pe nurunan ko nse ntrasi sukro sa, se rta ( 2) m e m o difikasi lingkungan tum buh, de ngan pe nyim panan pada suhu rendah dan pe ngu-rangan inte nsitas c ahaya. Ko m binasi dari ke dua c ara te rse but dapat pula dilakukan ( Ke lle r e t al., 2006) .
Modifikasi Komponen Media
Penggunaan regulator osmotik
Sukro sa se be narnya m e rupakan sum be r e ne rgi dan sum be r karbo n utam a dalam kultur in vitro dan sangat be rpe ran dalam siklus se l ( Tyas e t al., 2013) , se rta pe m be lahan dan pe m be ntukan se l ( De w itte dan Murray, 2003) . Pe rtum buhan tanam an dalam kultur in vitro sangat te rgantung pada ko nse ntrasi sukro sa yang dibe rikan. Ko nse ntrasi sukro sa dalam m e dia dasar untuk m e ndapatkan pe rtum buhan no rm al adalah 30 g/l ( Murashige dan Sko o g, 1962) , sedangkan dalam ko nse ntrasi yang sangat tinggi ( 90 g/l) sukro sa dapat berfungsi se bagai o sm o re gulato r yang m e ngham bat pertum buhan tanam an ( Po o km anee e t al., 2001) .
Dalam hubungannya se bagai sum be r e ne rgi, pe -nurunan ko nsentrasi sukro sa ( < 30 g/l) dalam m e dia kultur akan m enye babkan tanam an m e m pe rlam bat siklus selnya se hingga pe m be lahan dan pe m bentukan se l yang berjalan lam bat m e nye babkan pe rtum buhan te rham bat. Hal ini ditunjukkan o leh Hassan e t al.
( 2007) pada tanam an baw ang putih, yaitu pada m e dia yang dibe ri 0,1 M dan 0,2 M sukro sa dan Dio sco re a
spp. ( Malaurie e t al., 1993) yang te rham bat pe rtum -buhan akar dan tunasnya. Dari hasil pene litian Tyas e t al. ( 2012) dike tahui bahw a je ruk besar hanya dapat di-sim pan m inim al tujuh bulan pada m e dia MS de ngan sukro sa 12%. Dalam ko ndisi e kstrim , yaitu m e dia tanpa dibe ri sukro sa, pe rtum buhan tanam an sangat te rham bat, m isalnya pada kultur ke ntang hitam ( Ro o stika e t al., 2005) . Kultur ubi jalar dalam m e dia tanpa sukro sa, se te lah disim pan delapan bulan, bah-kan tidak dapat be rtahan hidup dan m ati ( Ro o stika dan Sunarlim , 2001) .
Manito l dan so rbito l m erupakan gula alko ho l po lihidrik yang pada be be rapa tanam an be rpe ran penting dalam translo kasi asim ilat di dalam flo em ( De guc hi e t al., 2004) . Pe nam bahan m anito l atau so rbito l pada ko nse ntrasi te rte ntu ke dalam m e dia kultur dapat m e ngham bat pe rtum buhan ubi-ubian ( Ac e do , 1995; Be sse m binde r at al., 1993; Bo rge s e t al., 2004; De w i, 2002; Sunarlim e t al., 2004; Unnikrishnan
e t al., 1992; Xin, 1988; Zandvo o rt e t al., 1994) . Hal ini dise babkan te rjadinya pe ningkatan te kanan o sm o tik m e dia se hingga aliran nutrisi ke dalam jaringan ta-nam an terham bat. Manito l dan so rbito l, se pe rti halnya gula, juga dapat dim e tabo lism e kan se bagai sum be r e ne rgi o le h tanam an se sudah be be rapa bulan dalam penyim panan se hingga m e ngurangi efektivitas w aktu sim pan kare na pe rtum buhan yang m e ningkat.
Di Inte rnatio nal Po tato Ce nte r ( CIP) , pro to ko l penyim panan ubi-ubian, khususnya ubi jalar, diguna-kan so rbito l 34% ( Panta e t al., 2009) . Pada um um nya, be be rapa pe ne liti m enyatakan bahw a m anito l tidak c o c o k untuk pe nyim panan plasm a nutfah ubi-ubian ( Enge lm ann, 1991; Ro o stika e t al., 2005; Sunarlim e t
al., 1999) . De ngan penggunaan m anito l 4%, be be rapa aksesi ubi jalar m e nurun kete garannya ( Sunarlim e t al., 1999) atau m e m be ntuk kalus ( Go lm irzaie dan To le do , 1999) . Oleh kare na itu, pe m berian m anito l um um nya diko m binasikan de ngan pe m be rian sukro -sa. Pada vanila, penam bahan m anito l ( 1015 g/l) yang se im bang de ngan pe m be rian sukro sa pada ko nse n-trasi re ndah ( 1510 g/l) dapat m enginduksi pe rtum -buhan lam bat dan 8090% kultur dapat disim pan sam pai 360 hari ( 1 tahun) de ngan syarat pe nyim panan dalam w adah yang te rtutup rapat dengan alum inium fo il. De ngan disim pan be rkali-kali pada m e dia yang sam a, baru se te lah 7 tahun, planlet vanila pada m e dia te rse but m ulai m e nunjukkan pe nurunan laju pe r-tum buhan dan akhirnya m ati ( Divakaran e t al., 2006) .
Penggunaan zat penghambat tumbuh
Zat pe ngham bat tum buh yang dapat digunakan untuk ko nse rvasi in vitro antara lain paclo butrazo l
( PBZ), cyco ce l (chlo rm e quat chlo ride /chlo ro cho line chlo ride/CCC) , ancym ido l, dan asam absisat ( ABA) . PBZ m e rupakan se nyaw a o rganik sinte tik yang m e ng-ham bat urutan re aksi o ksidasi dari e nt-kaure ne m e n-jadi asam e nt-kaure no id dalam pe m be ntukan asam gibe re lin ( GA) dan se ring ditam bahkan ke dalam m e-dia kultur untuk m em pe rpanjang m asa sim pan. Ketika pe m be ntukan GA te rham bat, w alaupun pe m be lahan se l m asih te rjadi, sel tidak m e m anjang se hingga m e -nye babkan buku dan tunas m e njadi pende k ( Arte c a, 1996) . PBZ juga be rpe ran dalam m e nginduksi m o difi-kasi m o rfo lo gi, se perti po ri sto m ata daun m e njadi lebih ke c il dan daun le bih te bal ( Ke atm e tha e t al., 2006) , m e ningkatkan bio sinte sis klo ro fil dalam jaring-an tjaring-anam jaring-an ( Pinc he ra djaring-an Fle tc he v, 1994) se hingga batang m e njadi le bih te gar dan daun m e njadi le bih hijau, m engham bat pe m anjangan se l pada m e riste m subapikal, m e m pe rpe nde k ruas tanam an, dan m e m -pe rte bal batang ( Cathey, 1975) . PBZ dapat m e m -pe rbaiki pe nam pilan tanam an yang disim pan dan m e m -pe rpanjang m asa sim pan pada -pe nyim panan be be-rapa akse si ubi jalar ( Ro o stika dan Sunarlim , 2001) .
Ancym ido l se ring digunakan se bagai pe ngganti m anito l dalam ko nse rvasi tanam an in vitro kare na pada ko nse ntrasi re npadah padapat m e ngham bat pe rtum -buhan de ngan m enghalangi tahap pe m be ntukan kaurene m e njadi e nt-kaure no l dan o ksidasi ent-kaurenal m e njadi asam e nt-kaure no id pada lintasan bio sinte sis GA ( Sarkar e t al., 2001) . Di sam ping itu,
ancym ido l juga dapat m e ngham bat sintesis se lulo sa se hingga m e ngham bat sintesis dan pe m anjangan dinding se l ( Ho fm anno vá e t al., 2008) . Penggunaan
m e m pe rpanjang m asa sim pan, pe ningkatan ko nse n-trasi diduga dapat dilakukan kare na ancym ido l tidak m e nim bulkan to ksisitas, nam un hal ini tidak disaran-kan kare na harga ancym ido l re latif m ahal ( Ro o stika dan Sunarlim , 2001) .
Cyco ce l dapat m e ngham bat pe rtum buhan ta-nam an. Pe nggunaannya hingga ko nse ntrasi 500 m g/l dapat m e ngham bat pe rtum buhan ubi jalar, nam un ko nse ntrasi yang lebih tinggi dapat be rsifat to ksik bagi tanam an ( Go lm irzaie dan To le do , 1999) . ABA m e rupa-kan ho rm o n pe rtum buhan yang be rpe ran se bagai inhibito r se hingga dapat m e ngham bat pem be lahan dan pe m anjangan se l. Penam bahan ABA 520 m g/l ke dalam m e dia dapat m e ngham bat pe rtum buhan ubi jalar ( Go lm irzaie dan To le do , 1999) dan Dio sco re a
( IITA, 2012) , nam un pe nggunaan ABA, sepe rti juga
Cyco ce l, dalam ko nse rvasi in vitro jarang dilakukan.
Pengenceran garam-garam mineral
Pe rtum buhan lam bat dapat dilakukan de ngan m e nggunakan m e dia dasar yang die nc e rkan antara se te ngah dan se pe re m pat bagian dari fo rm ulasi dasar. Pe nge nc e ran m e dia m e njadi se te ngah atau sepe r-e m pat bagiannya m r-e nyr-e babkan br-erkurangnya unsur m akro , te rutam a NH4
+ dan NO
3-, se hingga nitro ge n
( N) se bagai unsur yang pe nting untuk pe rtum buhan m e njadi be rkurang dan be rakibat pertum buhan biak-an te rham bat. Pe nggunabiak-an ¼ MS pada Am o rpho pallus o ncho phyllus dapat m e m pe rpanjang m asa sim pan ( Po o km ane e e t al., 2001) , nam un pe nggunaan ½ MS dan ¼ MS pada ubi jalar m e nye babkan pe ngkalusan pada batang. Keadaan ini se suai de ngan pendapat Ge o rge dan She ringto n ( 1984) yang m e nyatakan bah-w a m e dia de ngan ko nse ntrasi hara m akro sangat ren-dah akan m e ndo ro ng pe rtum buhan kalus dan akar. Ko ndisi ini tidak direko m e ndasikan untuk ko nse rvasi
in vitro kare na pem be ntukan kalus c e nde rung m e nye -babkan variasi so m aklo nal.
Modifikasi Lingkungan Fisik
Suhu rendah
Me nurunkan suhu lingkungan tum buh hingga m e nde kati 0°C untuk tanam an subtro pis dan be be -rapa de rajat di baw ah no rm al untuk tanam an tro pis dapat m e ngurangi ke c e patan pe rtum buhan pada ba-nyak tanam an ( Do dds dan Ro be rts, 1985; Geo rge dan She ringto n, 1984) . Hal ini disebabkan suhu rendah m e nginduksi akum ulasi le m ak tidak je nuh pada m e m bran se l se hingga m em bran sel m enjadi tebal dan akibatnya pem be lahan dan pem anjangan se l ter-ham bat. Ko nse rvasi pada suhu 9°C dalam ke adaan gelap ( Staritsky e t al., 1986) dan suhu 4°C ( He dan Li, 1999) pada talas, se rta suhu 10°C pada be litung
(Xantho so m a sagittifo lium) ( Ac he am pe o ng, 1982
dalam He nsaw , 1987) dapat m e m pe rpanjang m asa simpan hingga 13 tahun. Penurunan suhu juga te lah diaplikasikan pada Dio sco re a, yaitu de ngan suhu inkubasi 1022°C se hingga dapat disim pan se lam a 12 tahun ( Ng dan Ng, 1997) , se dangkan be be rapa akse si talas dapat disim pan pada suhu 20°C se lam a 912 bulan ( Taylo r, 1996) . Dalam kisaran ge no tipe yang luas, ubi jalar m e m e rlukan kisaran suhu pe nyim panan yang c ukup be sar, yaitu 1827°C ( Panta e t al., 2009) . Se baliknya, be be rapa spe sies, sepe rti ubi kayu ( Aladele dan Kuta, 2008) dan Dio sco re a ( Mandal dan Chandel, 1996) , sangat sensitif te rhadap pe nyim panan de ngan suhu re ndah kare na dapat m e nim bulkan fe no lisasi dan nekro sis ( De sam ero , 1990 dalam
Go lm irzaie dan To le do , 1999) . Um um nya, pe ngguna-an suhu re ndah untuk pe nyim pngguna-anngguna-an in vitro diko m -binasikan de ngan mo difikasi m e dia ( Po o km anee , 2001; Zandvo o rt e t al., 1994) . Se c ara um um , tanam an tro pis biasanya ke hilangan viabilitasnya bila disim pan pada suhu re ndah ( Go lm irzaie dan To le do , 1999) .
Pengurangan intensitas cahaya
Se lain m e nggunakan gula yang te rse dia dalam m e dia se bagai sum ber karbo n, biakan juga m e nggu-nakan gula dari hasil fo to sinte sis. Me lalui pengurang-an inte nsitas c ahaya, m asa sim ppengurang-an dapat dipe rppengurang-an- rpan-jang kare na inte nsitas c ahaya rendah dapat m e ngham bat ke c e patan tum buh de ngan m e ngurangi pro -se s fo to sinte sis dan m etabo lism e ( Huge s, 1981 dalam
Go lm irzaie dan To le do , 1999) .
KRIOPRESERVASI
Te knik krio pre se rvasi m e rupakan pe nyim panan m ate rial tanam an pada suhu sangat re ndah dalam nitro ge n c air ( suhu -196°C) . Te knik ini m e rupakan c a-ra yang ide al untuk m e nyim pan plasm a nutfah dalam jangka panjang kare na tidak dipe rlukan subkultur ( Enge lm ann, 1997; Kartha dan Enge lm ann, 1994; Ree d, 2001) . Ke stabilan ge ne tik tanam an diasum sikan dapat terjaga pada saat e ksplan ditum buhkan kem -bali. Ke adaan ini dim ungkinkan kare na pada suhu sangat re ndah se luruh pro se s m e tabo lism e dan pe m -be lahan se l -be rlangsung sangat lam bat atau bahkan te rhe nti ( Kartha dan Enge lm ann, 1994) . Teknik krio -pre se rvasi yang dapat digunakan m e liputi teknik kla-sik yang didasarkan pada teknik pe m be kuan lam bat/ be rtahap (slo w -fre e z ing/tw o -ste p fre e z ing) dan te knik baru yang didasarkan pada vitrifikasi ( Enge lm ann, 2000) .
-40°C) . Te knik lam a se ring dise but juga se bagai te knik pem be kuan lam bat atau te knik pe m be kuan dua tahap yang m e liputi inkubasi sel pada krio pro te ktan ( 12 µl) yang m e nye babkan de hidrasi m o de rat lalu diikuti de ngan pe m be kuan lam bat de ngan kec e patan 1°C/m e nit dan pe m be kuan dalam nitro ge n c air. Eksplan yang c o c o k digunakan pada krio pre se rvasi de ngan teknik klasik, yaitu yang be rasal dari kultur yang tidak te rdife re nsiasi, se pe rti suspe nsi se l dan kalus serta spe sies yang to le ran terhadap suhu ren-dah, se dangkan yang tidak c o c o k digunakan, yaitu tunas apikal, e m brio zigo tik dan e m brio so m atik se rta spesie s tanam an tro pis ( Enge lm ann, 1997; Takagi, 2000) . Teknik ini telah be rhasil digunakan untuk krio -pre servasi ubi kayu, nam un te knik pe m bekuan be rtahap kurang diaplikasikan se c ara luas kare na m e -m e rlukan pe ralatan pe ndingin (fre e z e r) yang m ahal ( Danso dan Fo rd-Llyo d, 2011; Esc o bar e t al., 1997) . Pada ubi jalar dan ge m bili, pe nggunaan te knik klasik m e nunjukkan ke m am puan hidup kultur yang rendah ( Be nso n e t al., 2011) .
Te knik baru yang be rdasarkan vitrifikasi, terdiri atas e nkapsulasi de hidrasi, vitrifikasi, e nkapsulasi vitri-fikasi, de sikasi, pratum buh (pre gro w th) , pratum buh de sikasi, dan dro ple t.
Enkapsulasi-dehidrasi
Te knik ini didasarkan pada pe nggunaan be nih sinte tik. Me to de nya se de rhana, nam un m e m e rlukan be nih sinte tik yang c ukup banyak dan hanya dapat di-gunakan pada tanam an yang to leran te rhadap ko n-se ntrasi sukro sa tinggi. Te knik ini te lah dike m bangkan pada ubi kayu ( Sakai, 2004) .
Vitrifikasi
Te knik ini didasarkan pada pro ses vitrifikasi, yaitu pro se s pe m be ntukan struktur be rupa kac a (m e ta-stable glass) pada suhu yang sam a de ngan atau di baw ah titik beku larutan terte ntu. Me to de nya le bih se de rhana daripada e nkapsulasi-de hidrasi, banyak di-gunakan untuk tanam an yang peka terhadap pe rlaku-an suhu re ndah ( Takagi e t al., 1997) . Teknik vitrifikasi te lah digunakan se c ara luas pada banyak tanam an ( Sakai dan Enge lm ann, 2007) , di antaranya ubi kayu, ubi jalar, dan Dio sco re a spp. Fakto r pe m batas te knik ini, yaitu dipe rlukannya to leransi yang c ukup tinggi dari bahan tanam an te rhadap larutan vitrifikasi ( Sakai dan Enge lm ann, 2007) .
Enkapsulasi-vitrifikasi
Te knik ini m e rupakan ko m binasi antara te knik e nkapsulasi-de hidrasi dan vitrifikasi. Pada te knik ini, bahan tanam an die nkapsulasi dalam kapsul alginat,
ke m udian dilakukan de hidrasi jaringan de ngan m e ng-gunakan larutan krio pro te ktan, se lanjutnya dilakukan pe m be kuan jaringan. Te knik ini dapat digunakan pada tanam an yang pe ka te rhadap pe rlakuan de sikasi dan te lah digunakan pada banyak tanam an, se pe rti
Dio sco re a spp., ubi jalar, dan ubi kayu ( Sakai dan Enge lm ann, 2007; Sakai e t al., 2008) .
Desikasi
Desikasi m e rupakan te knik yang paling se de r-hana, yaitu tanam an yang te lah dide sikasi, kem udian se c ara c epat dire ndam ke dalam nitro ge n c air. Te knik ini sangat se suai untuk tanam an yang to le ran te r-hadap de sikasi. Te knik ini tidak dike m bangkan untuk pe nyim panan ubi-ubian.
Pratumbuh (pregrowth)
Pratum buh m e rupakan te knik dengan bahan tanam an yang dipe rlakukan de ngan krio pro te ktan, ke-m udian se c ara c e pat direndake-m ke dalake-m nitro ge n c air. Te knik ini re latif se de rhana dan m urah, te tapi ke-sulitannya te rjadi dalam m e m anipulasi jaringan e m brio ge nik tanpa e nkapsulasi. Teknik ini tidak di-ke m bangkan untuk pe nyim panan ubi-ubian.
Pratumbuh-desikasi
Pratum buh-de sikasi adalah te knik krio prese rvasi de ngan bahan tanam an yang dipe rlakukan de ngan krio pro te ktan, ke m udian sec ara c e pat dim asukkan ke nitro ge n c air. Te knik ini te lah digunakan pada e m brio zigo tik ke lapa dan kelapa saw it ( Enge lm ann, 2000) , nam un be lum dite m ukan lapo ran pada ubi-ubian.
Droplet-vitrifikasi
Dro plet-vitrifikasi adalah te knik krio prese rvasi de ngan m ate ri tanam an yang dipe rlakukan de ngan larutan krio pro te ktan, ke m udian dile takkan di atas
alum inium fo il dan dite te si larutan krio pro te ktan, ke -m udian sec ara c e pat di-m asukkan ke dala-m nitro ge n c air. Te knik ini se c ara rutin telah dite rapkan untuk ko nse rvasi jangka panjang pada ke ntang dan pisang ( Panis e t al., 2005) , juga te lah be rhasil digunakan pada be rbagai je nis tanam an, se pe rti baw ang putih, pe -paya, dan ubi-ubian se pe rti talas, Dio sco re a spp., dan ubi jalar ( Le unufna, 2007; Sakai dan Enge lm ann, 2007) .
Pene litian krio pre se rvasi telah banyak dilakukan pada be be rapa je nis plasm a nutfah ubi-ubian ( Tabe l 1) . Pro to ko l krio prese rvasi untuk ubi kayu te lah dipe r-o le h dengan m e nggunakan m e tr-o de klasik ( Esc r-o bar e t al., 1997) dan e nkapsulasi-dehidrasi ( Esc o bar e t al.,
Aplikasi te knik krio pre servasi sec ara rutin pada tanam an ubi-ubian m asih te rbatas pada le m baga-le m baga pe nelitian te rtentu, se pe rti CIP untuk ko nse r-vasi plasm a nutfah ubi jalar ( Lizzaraga e t al., 1992; Tay, 2000) dan ganyo ng ( Panta, 2009) , Inte rnatio nal Institute o f Tro pical Agriculture ( IITA) untuk Dio sco re a
spp. dan ubi kayu, Inte rnatio nal Ce nte r fo r Tro pical Agriculture ( CIAT) untuk ubi kayu ( Ashmo re , 1997) , dan Ce ntre fo r Pacific Cro ps and Tre e s-Se cre tariat o f the Pacific Co m m unity ( Ce PaCT-SPC) untuk talas. Di Indo ne sia, be be rapa pe ne litian te knik krio pre se rvasi te lah dilakukan, antara lain di Balai Besar Pe ne litian dan Penge m bangan Bio te kno lo gi dan Sum be r Daya Ge ne tik Pe rtanian ( BB Bio ge n) pada tanam an ubi kayu dan ubi jalar ( Ro o stika e t al., 2004a; 2004b) dan Lem baga Ilm u Pe nge tahuan Indo ne sia ( LIPI) pada tanam an ubi kayu ( Sudarm o no w ati, 2000) .
PENGUJIAN STABILITAS GENETIK PADA PLASMA NUTFAH PASCAKONSERVASI
Tujuan ko nse rvasi adalah m e le starikan plasm a nutfah yang dim iliki agar dapat dim anfaatkan untuk m asa kini dan m e ndatang. Dalam ke giatan te rse but, pem e liharaan stabilitas gene tik m e rupakan hal yang sangat pe nting dipe rhatikan untuk m e njam in plasm a nutfah yang disim pan te tap se suai de ngan ide ntitas asalnya. Dalam ke giatan ko nse rvasi in vitro, untuk m e nghindari ke tidakstabilan ge ne tik, biasanya diguna-kan bahan tanam an yang te lah m engalam i difere n-siasi, se pe rti kultur e m brio , tunas, dan planle t ( W ithe rs, 1991) kare na je nis e ksplan yang digunakan re latif stabil te rhadap variasi so m aklo nal. Be rbagai m e to de dapat digunakan untuk m e nge valuasi ke -stabilan ge netik dan ke rusakan yang m ungkin te rjadi akibat ko nservasi in vitro ( Be nso n e t al., 2011) , di antaranya analisis m o rfo lo gi, histo lo gi, sito lo gi, bio kim ia, dan m o lekule r.
Analisis morfologi
Analisis m o rfo lo gi di lapang dapat dilakukan de ngan m e nggunakan de skripto r tanam an yang diam ati. Analisis dilakukan de ngan m em bandingkan pe -nam pilan fe no tipik ta-nam an hasil ko nservasi in vitro
de ngan tanam an asalnya. Untuk m e njam in ke pastian ke stabilan gene tik, analisis ( karakte risasi) m o rfo lo gi pe rlu diko m binasikan de ngan analisis m o le kuler ka-re na hasil analisis m o rfo lo gi sangat dipe ngaruhi o leh lingkungan. Analisis m o rfo lo gi dilakukan se c ara rutin te rhadap ko le ksi kultur in vitro ubi kayu di CIAT dan ubi jalar di CIP.
Analisis histologi dan sitologi
Analisis histo lo gi dan sito lo gi dapat dilakukan de ngan m e ngam ati inte gritas jaringan, analisis kro m o -so m , dan tingkat plo idi. Analisis te rse but te lah dilaku-kan pada ke ntang yang disim pan sec ara e nkapsulasi-de hidrasi ( Be nso n e t al., 1996) . Hasilnya m e nunjukkan bahw a tanam an ke ntang hasil krio pre se rvasi bersifat stabil dan tidak be rbe da de ngan tanam an ko ntro lnya.
Analisis biokimia
Analisis bio kim ia dapat dilakukan me lalui anali-sis iso e nzim . Iso e nzim dapat digunakan untuk m e nga-rakte risasi plasm a nutfah kare na analisis te rse but re latif le bih stabil te rhadap lingkungan daripada anali-sis mo rfo lo gi dan um um nya be rsifat po lim o rfik, nam un pe nggunaannya te rbatas kare na tidak dapat m e nde te ksi tingkat variasi yang se dikit ( Shukla e t al., 2004) . Di CIAT, analisis iso e nzim te lah digunakan untuk m e nganalisis ke stabilan ge netik ubi kayu hasil pe nyim panan in vitro .
Analisis molekuler
Analisis m o le kule r dapat dilakukan antara lain de ngan Rando m Am plifie d Po lym o rphic DNA ( RAPD) ,
Sim ple Se que nce Re pe at ( SSR) , dan Am plifie d Fragm e nt Le ngth Po lym o rphism ( AFLP) . Analisis m o le kule r digunakan untuk m e nganalisis tanam an
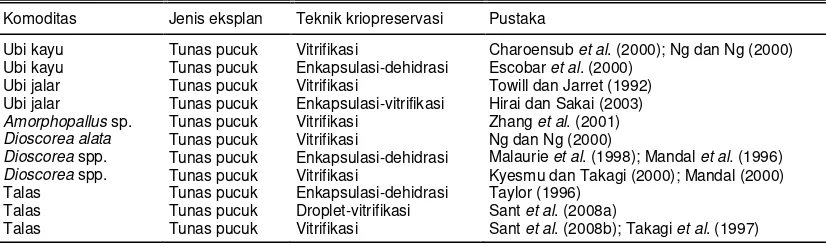
Tabel 1. Hasil penelitian kriopreservasi pada berbagai jenis ubi-ubian.
Komoditas Jenis eksplan Teknik kriopreservasi Pustaka
Ubi kayu Tunas pucuk Vitrifikasi Charoensub et al. (2000); Ng dan Ng (2000) Ubi kayu Tunas pucuk Enkapsulasi-dehidrasi Escobar et al. (2000)
Ubi jalar Tunas pucuk Vitrifikasi Towill dan Jarret (1992) Ubi jalar Tunas pucuk Enkapsulasi-vitrifikasi Hirai dan Sakai (2003)
Amorphopallus sp. Tunas pucuk Vitrifikasi Zhang et al. (2001) Dioscorea alata Tunas pucuk Vitrifikasi Ng dan Ng (2000)
Dioscorea spp. Tunas pucuk Enkapsulasi-dehidrasi Malaurie et al. (1998); Mandal et al. (1996) Dioscorea spp. Tunas pucuk Vitrifikasi Kyesmu dan Takagi (2000); Mandal (2000) Talas Tunas pucuk Enkapsulasi-dehidrasi Taylor (1996)
Talas Tunas pucuk Droplet-vitrifikasi Sant et al. (2008a)
sam pai pada tingkat DNA te rhadap ada tidaknya perubahan ge ne tik pada m ateri yang diko nse rvasi. Analisis be rbasis DNA ini le bih disukai kare na be rsifat po lim o rfis dan tidak dipe ngaruhi lingkungan ( Pe re do
e t al., 2008) .
Be be rapa c o nto h aplikasi analisis m o lekule r pada tanam an hasil ko nse rvasi, yaitu analisis RFLP dan RAPD pada ubi kayu yang disim pan de ngan pe r-tum buhan lam bat ( Ange l e t al., 1996) dan analisis RAPD untuk Dio sco re a spp. yang disim pan se c ara krio pre se rvasi de ngan teknik vitrifikasi dan e nkapsulasi-de hidrasi ( Mandal e t al., 2008) . Hasil analisis m o le kule r me nunjukkan adanya ke stabilan gene tik dari bahan tanam an yang disim pan de ngan ke dua te knik ko nse rvasi te rse but.
Analisis epigenetik
Adanya ke tidakstabilan ge ne tik be rupa m e tilasi DNA dilapo rkan pada ke ntang yang dikrio pre se rvasi de ngan pe m be kuan c e pat ( Harding, 1997) dan pada je ruk yang dikrio pre se rvasi de ngan c ara vitrifikasi ( Hao dan De ng, 2002) , se rta pe rubahan kro m atin pada m aho gani (Sw ie te ria m acro phylla) yang dikrio pre se r-vasi de ngan pe m bekuan lam bat ( Harding e t al., 2000) .
KONSERVASI IN VITRO UBI-UBIAN DI BERBAGAI LEMBAGA PENELITIAN
Pe ne litian, pe nge m bangan, dan pe m anfaatan te knik kultur in vitro untuk ko nse rvasi tanam an ubi-ubian te lah dilakukan di be rbagai pusat pe ne litian yang be rada di baw ah naungan Co nso rtium o f Inte rnatio nal Agricultural Re se arch ( CGIAR) , se perti
Bio ve rsity, CIP, CIAT, dan IITA. CGIAR te lah m e nge m -bangkan dan m e nggunakan strate gi ko nse rvasi in vitro
se c ara rutin pada tanam an ke ntang, ubi jalar, ubi kayu, Dio sco re a spp., dan pisang di le m baga-lem baga pene litian te rkait, juga m e ne rim a duplikat kultur in vitro yang diko nse rvasi dari le m baga pe ne litian lain.
Bio ve rsity, sebe lum nya dike nal se bagai
Inte rnatio nal Plant Ge ne tic Re se arch Institute ( IPGRI) atau Inte rnatio nal Bo ard fo r Plant Ge ne tic Re so uce s
( IBPGR) , m e naruh pe rhatian te rhadap pe nge m bangan strategi dan te kno lo gi ko nse rvasi de ngan m enggunaan m e to de yang tepat, di antaranya ko nservasi in vitro
untuk jangka pende k dan jangka panjang ( krio pre se r-vasi) . Bio ve rsity se c ara rutin m e nggunakan m e to de ko nse rvasi in vitro untuk kentang, ubi jalar, ubi kayu, dan Dio sco re a di le m baga-le m baga pene litian terkait, juga m e m be rikan pe latihan, bantuan, dan distribusi pustaka yang be rhubungan de ngan ko nse rvasi in vitro .
Be be rapa bank ge n in vitro m e ngo leksi ubi-ubian se c ara rutin. Se bagai c o nto h, ko le ksi in vitro terbanyak
te rdapat di bank ge n in vitro CIP ( Tay, 2000) , te rutam a untuk ubi jalar dan ganyo ng yang disim pan de ngan m e to de pe rtum buhan lam bat untuk pe nyim panan jangka m e ne ngah ( Lizzaraga e t al., 1992) dan krio pre -se rvasi untuk pe nyim panan jangka panjang ( Tay, 2000) . Bank ge n in vitro CIAT m e ngo le ksi le bih dari lim a ribu ge no tipe ubi kayu de ngan m e to de pe rtum -buhan lam bat, yaitu m e nggunakan pe nge nc e ran m e dia dasar atau pe nurunan taraf sukro sa ( Ashmo re , 1997) untuk pe nyim panan jangka m e ne ngah dan krio -pre se rvasi untuk jangka panjang ( Thro e t al., 1996) . CePaCT-SPC m e m iliki ko le ksi in vitro talas te rbanyak yang disim pan de ngan m e to de pe rtum buhan lam bat ( Se c re tariat o f the Pac ific Co m m unity, 2002; Taylo r, 2000) , se dangkan IITA telah m e ngo le ksi 1.000 akse si
Dio sco re a de ngan m e to de pertum buhan lam bat ( IITA, 2012) . Meskipun BB Bio ge n be lum m e m iliki bank ge n
in vitro hingga tahun 2012, ke giatan ko nse rvasi in vitro
te lah rutin dilakukan untuk tanam an ubi jalar, ubi kayu, dan talas.
Dalam rangka m e nge m bangkan kualitas dan siste m m anaje m e n risiko di bank gen in vitro, baik CIAT, CIP m aupun IITA telah m e lakukan pe rbaikan dan standardisasi pro se dur pe nyim panan tanam an yang dipe rbanyak se c ara ve getatif dan m e lakukan
safe ty back up co lle ctio n di antara bank ge n tersebut, yaitu black bo x ubi jalar di CIAT dan black bo x ubi kayu di CIP ( Panta e t al., 2009) . BB Bio ge n te lah m e nyim pan ko le ksi in vitro ubi jalar di CIP dan talas di CePaCT se bagai duplikat. Standar bank gen untuk in vitro dan krio pre se rvasi te lah disusun o le h FAO ( FAO, 2014)
PROSPEK DAN KENDALA APLIKASI KONSERVASI
IN VITRO DI INDONESIA
Ke ane karagam an jenis ubiubian dan be ragam -nya varie tas yang ada di Indo ne sia harus dipe rtahan-kan. Te knik kultur in vitro dan krio pre se rvasi dapat di-gunakan untuk m e ngo nse rvasi plasm a nutfah ubi-ubian kare na spe sie s ini sulit diko nservasi dalam be n-tuk biji. Banyak pe luang pe ne litian dan pe ngujian untuk m e m pero le h m e to de ko nservasi in vitro yang te pat bagi m asing-m asing jenis dan varie tas, baik de ngan te knik pertum buhan lam bat m aupun krio pre -se rvasi. Nam un de m ikian, pe ne rapan teknik ko n-se r-vasi se c ara in vitro tentu akan m em e rlukan biaya, ruangan khusus, peralatan, dan sum be r daya m anusia ( SDM) yang m e m adai dan te rlatih (skillfull) . Hal ini dise babkan ke giatan m e ngo nservasi harus didukung o le h pro to ko l standar.
r-tum buhan de ngan suhu sangat rendah (cryo pre se rvatio n) , baru be be rapa je nis ubi-ubian yang te rm asuk ge nus Ipo m o e a, Maniho t, Dio sco re a, dan Am o rpho phallus yang te lah be rhasil diko nse rvasi, nam un kegiatan pe ngujian ke stabilan ge ne tik belum dilakukan pada plasm a nutfah yang te lah diko nse rvasi pada jangka w aktu terte ntu. Ke rja sam a pe nelitian tam paknya pe rlu dilakukan dengan m anaje m e n be r-ada di baw ah CGIAR yang le bih m aju dalam te knik ko nse rvasi in vitro untuk m e ningkatkan pe ngetahuan dan te knik dari SDM yang ditugaskan untuk m e nge lo la pele starian plasm a nutfah ubi-ubian. Bahan kim ia dan be be rapa syarat khusus, se perti paso kan aliran listrik yang stabil, khususnya untuk te knik pe rtum buhan lam bat, dan ke te rse diaan nitro ge n c air se rta sistem ke am anan (safe ty) dalam pe nanganan tangki nitro ge n c air, khusus untuk krio pre servasi, harus dapat dijam in ko ntinu.
KESIMPULAN
Ke m ajuan bidang bio tekno lo gi m e m buka ke -se m patan untuk le bih baik lagi dalam usaha ko n-se r-vasi dan pe m anfaatan plasm a nutfah ubi-ubian di Indo ne sia. De ngan be rbagai keuntungan yang dipe r-o le h dari kr-o nse rvasi plasm a nutfah se c ara in vitro, antara lain hem at dalam pe m akaian ruangan, dapat m e nyim pan ko le ksi tanam an yang ham pir punah dan tanam an yang tidak m e nghasilkan biji, bebas dari c e -kam an bio tik dan abio tik, dan m em pe rm udah distribusi te rutam a untuk kepe rluan pe rtukaran antar ne -gara, m aka kultur in vitro dapat dipe rtim bangkan se bagai salah satu m e to de ko nse rvasi yang e fe ktif dan e fisie n. Kestabilan ge ne tik dari plasm a nutfah yang di-ko nse rvasi dapat dilakukan bertahap m ulai dari analisis m o rfo lo gi sam pai m o le kuler.
DAFTAR PUSTAKA
Acedo, V.Z. 1995. Meristem culture and in vitro maintenance of Philippines cassava. p. 202-209. In W.M. Roca dan A.M. Thro (eds.) Proceeding of the Second International Scientific Meeting. Cassava Biotechnology Network. Bogor, Indonesia, 22-26 Agustus 1994. Vol. 1. Working Document No. 150. CIAT, Columbia.
Aladele, S.E. and D.D. Kuta. 2008. Environmental and genotypic effects on the growth rate of in vitro cassava plantlet (Manihot esculenta). Afr. J. Biotechnol. 7(4):381-385.
Angel, F., V.E. Barney, J. Tohme, and W.M. Roca. 1996. Stability of cassava at the DNA level after retrieval from 10 years of in vitro storage. Euphytica 90:307-313. Arteca, R.N. 1996. Plant Growth Substances: Principles and
Applications. Chapman and Hall. New York, USA. 345 p.
Ashmore, S.E. 1997. Status report on the development and application of in vitro techniques for the conservation and use of the plant genetic resources. International Board for Plant Genetic Resouces, Rome. 67 p.
Benson, E.E., M. Wilkinson, A. Todd, U. Ekuere, and J. Lyon. 1996. Developmental competence and ploidy stability in plants regenerated from cryopreserved potato shoot-tips. CryoLetters 17:119-128.
Benson, E.E., K. Harding, D. Debouck, D. Dumet, R. Escobar, G. Mafia, B. Panis, A. Panta, D. Tay, I. Van den Huwe, and N. Roux. 2011. Global Public Goods Phase 2: Part I. Project landscape and general status of clonal crops in vitro conservation technologies. System-Wide Genetic Resources Program. Rome, Italy. 82 p. Bessembinder, J.J.E., G. Staritsky, and E.A. Zandvoort.
1993. Long-term in vitro storage of Colocasia esculenta under minimal growth conditions. Plant Cell Tiss. Org. 33(2):121-127.
Borges, M., W. Ceiro, S. Meness, N. Aguilera, J. Vazquez, Z. Infante, and M. Fonseca. 2004. Regeneration and multiplication of Dioscorea alata germplasm maintained in vitro. Plant Cell Tiss. Org. 76:87-90.
Cathey, H.M. 1975. Comparative plant growth-retarding activities of ancymidol with ACPC, phosfon, chlormequat, and SADH on ornamental plant species. Hort. Sci. 10(3):204-215.
Charoensub, R. and S. Phansiri. 2004. In vitro conservation of rosecolouredleadwort: Effect of mannitol on growth of plantlets. Kasetsart J. (Nat. Sci.) 38:97-102.
Charoensub, R., S. Phansiri, A. Sakai, and W. Yongmanitchai. 2000. Cryopreservation of in vitro-grown shoot tips of cassava cooled to -196°C by vitrification. p. 401-403. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy.
Danso, K.E. and B.V. Ford-Llyod. 2011. Cryopreservation of cassava micropagules using simple slow freezing and vitrification techniques. Biotechnol. 10(5):415-420. Deguchi, M., Y. Koshita, M. Gao, R. Tao, T. Tetsumura, S.
Yamaki, and Y. Kanayama. 2004. Engineered sorbitol accumulation induces dwarfism in Japanese persimmon. J. Plant Physiol. 161:1177-1184.
Dewi, N. 2002. Perbanyakan dan pelestarian plasma nutfah talas (Colocasia esculenta [L.] Schott) secara in vitro. Tesis S2, Program Studi Bioteknologi, Sekolah Pascasarjana Institut Pertanian Bogor. 56 hlm.
Dewitte, W. and J.A. Murray. 2003. The plant cell cycle. Anuu. Rev. Plant. Biol. 54:235-264.
Divakaran, M., K.N. Babu, and K.V. Peter. 2006. Conservation of vanilla species, in vitro. Sci. Hort. 110:175-180.
Dube, P., M. Gangopadhyay, S. Dewanjee, and M.N. Ali. 2011. Establishment of a rapid multiplication protocol for Coleus forskohlii Briq. and in vitro conservation by reduced growth. Indian J. Biotechnol. 10:228-231. Engelmann, F. 1991. In vitro conservation of tropical plant
germplasm-A review. Euphytica 7:227-243.
Engelmann, F. 1997. In vitro conservation methods. p. 119-162. In B.V. Ford-Lloyd, H.J. Newbury, and J.A. Callow (eds.) Biotechnology and Plant Genetic Conservation and Use. CABI Publishing. Wallingford, UK.
Engelmann, F. 2000. Importance of cryopreservation for the conservation of plant genetic resources. p. 8-20. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy. Escobar, R.H., G. Mafla, and G.M. Roca. 1997. A
methodology for recovering cassava plants from shoot tips maintained in liquid nitrogen. Plant Cell Rep.16:474-478.
Escobar, R.H., D. Debouck, and W.M. Roca. 2000. Development of cassava cryopreservation. p. 222-226. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI. Rome, Italy.
FAO. 2014. Genebank Standards for Plant Genetic Resources for Food and Agriculture. Commission Genetic Resources for Food and Agriculture, Food and Agriculture Organization. 166 p.
Flach, M. and F. Rumawas. 1996. Plant Resources of South-East Asia/no. 9, plant yielding non-seed carbohydrates. Prosea Foundation. Bogor, Indonesia. 237 p.
George, E.F. and P.D. Sherrington. 1984. Plant Propagation by Tissue Culture. Exegetic Ltd. Eversley, Basingtoke, Hans, England. p. 709.
Golmirzaie, A. and J. Toledo. 1999. In vitro conservation of potato and sweet potato germplasm. CIP Program Report 1997-98. International Potato Center. Lima, Peru. p. 351-356.
Gonzales-Benito M.E., I. Clavero-Ramirez, and J.M. Lopez-Aranda. 2004. The use of cryopreservation for germplasm conservation of vegetatively propagated crops. Span. J. Agric. Res. 2(3):341-351.
Hao,Y.J. and X.X. Deng. 2002. Occurrence of chromosomal variations and plant regeneration from long-term cultured Citrus callus. In Vitro Cell. Dev. Biol. Plant 38:472-476.
Harding, K. 1997. Molecular stability of the ribosomal RNA genes in Solanum tuberosum plants recovered from slow growth and cryopreservation. Euphytica 55(2):141-146.
Harding K., M. Marzalina, B. Krshnapillay, N.A. Nashatul Zaimah, M.N. Normah, and E.E. Benson. 2000. Molecular stability assessments of trees regenerated from cryopreserved mahogany (Swieteria macrophylla)
seed germplasm using non-radioactive techniques to examine the chromatin structure and DNA methyllation status of the ribosomal RNA genes. J. Trop. For. Sci. 12(1):149-163.
Harijono, T. Estiasih, M.W. Apriliyanti, A. Afriliana, and J. Kusnadi. 2013. Physicochemical and bioactives characteristics of purple and yellow water yam (Dioscorea alata) tubers. Int. J. Pharm. Tech. Res. 5(4):1691-1701.
Hassan, N.A., A.A. El-Halwagi, A. Gaber, M. El-Awady, and A. Khalaf. 2007. Slow growth in vitro conservation of garlic cultivars grown in Egypt: Chemical characterization and molecular evaluation. GJMS 2(2):67-75.
He, Y.K. and S.J. Li. 1999. Induction and characterization of in vitro corm of triploid taro. Plant Cell Tiss. Org. 57:173-178.
Hensaw, G.G. 1987. New technique for germplasm storage. p. 303-313. In A.J. Abbott and R.K. Atkin (eds.) Improving Vegetatively Propagated Crops. Academic Press. London, England.
Hirai, D. and A. Sakai. 2003. Simplified cryopreservation of sweetpotato (Ipomoea batatas [L.]) by optimizing conditions for osmoprotectan. Plant Cell Rep. 21:961-966.
Hofmannová, J., K. Schwarzerová, L. Havelková, P. Boríková, J. Petrásek, and Z. Opatrny. 2008. A novel, cellulose synthesis inhibitory action of ancymidol impairs plant cell expansion. J. Exp. Bot. 59(14):3963-3974. IITA. 2012. Yam in vitro gene banking. International Institute
of Tropical Agriculture. http://www.iita.org/c/- document_library/get_file?--uuid=a930e51c-6c47-4073-89d3-224900b1d72c&groupId=25357. [7 November 2012].
Kartha, K.K. and F. Engelmann. 1994. Cryopreservation and germplasm storage. p. 195-230. In I. Vasil and T. Thorpe (eds.) Plant Cell and Tissue Culture. Kluwer Academic Publisher. Netherland.
Keatmetha, W., M. Mekanawakul, and S. Te-Chato. 2006. In vitro germplasm conservation of Garcinia mangostana L. and Lansium domesticum Corr. Walailak J. Sci. Tech. 3(1):33-50.
Keller, E.R.J., A. Senula, S. Leunufna, and M. Grübe. 2006. Slow growth storage and cryopreservation-tools to facilitate germplasm maintenance of vegetatively propagated crops in living plant collections. Int. J. Refrig. 29:411-417.
Leunufna, S. 2007. Kriopreservasi untuk konservasi plasma nutfah tanaman: Peluang pemanfaatannya di Indonesia. J. AgroBiogen 3(2):80-88.
Lizzaraga, R., A. Panta, N. Espinoza, and J.H. Dodds. 1992. Tissue culture of Ipomoea batatas: Micropropagation and maintenance. CIP Research Guide 32. Sweet potato Germplasm Management. International Potato Center. Lima, Peru. 21 p.
Malaurie, B., O. Pungu, R. Dumont, and M.F. Trouslot. 1993. The creation of in vitro germplasm collection of yam (Dioscorea spp.) for genetic resources preservation. Euphytica 68:113-122.
Malaurie, B., M.F. Truslot, J. Berthaud, M. Bousalem, A. Pinel, and J. Dubern. 1998. Medium-term and long-term in vitro conservation and safe international exchange of yam (Dioscorea spp.) germplasm. Electron. J. Biotech. 1(3):103-117.
Mandal, B.B. 2000. Cryopreservation of yam apices: Acomparative study with three different techniques. p. 233-237. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy.
Mandal, B.B. and K.P.S. Chandel. 1996. Conservation of genetic diversity in sweet potato and yam using in vitro strategies. p. 49-54. In G.T. Kurup, M.S. Palaniswami, V.P. Potty, G. Padmaja, and S. Kabeerathumma (eds.) Tropical Tuber Crops: Problem, Prospect and Future Strategies. Science Publishers Inc. Lebanon, USA. Mandal, B.B., K.P.S. Chandel, and S. Diwvedi. 1996.
Cryopreservation of yam (Dioscorea spp.) shoot apices by encapsulation-dehydration. CryoLetters 17:165-174. Mandal, B.B., S.S. Ahuja-Ghosh, and P.S. Srvastava. 2008.
Cryopreservation of Dioscorea rotundata Poir: A comparative study with two cryogenic procedures and assessment of true-to-type regenerated by RAPD analysis. CryoLetters 29:399-408.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassys with tobacco tissue culture. Physiol. Plant. 15:473-397.
Ng, S.Y.C. and N.Q. Ng. 1997. Germplasm conservation in food yam (Dioscorea spp): Constraint, application and future prospects. p. 257-286. In M.K. Razdan and E.C. Cocking (eds.) Conservation of Plant Genetic Resources In Vitro. Vol. 1: General Aspects. Science Publishers Inc. Enfield, USA.
Ng, S.Y.C. and N.Q. Ng. 2000. Cryopreservation of cassava and yam shoot-tips by fast freezing. p. 418-420. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy. Nugraheni, M., U. Santoso, Suparmo, and H. Wuryastuti.
2011. In vitro antioxidant, antiproliferative and apoptosis effect of Coleus tuberosus L. Afr. J. Food Sci. 5(4):232-241.
Panis, B., B. Piette, and R. Swennen. 2005. Droplet vitrification of apical meristems: A cryopreservation protocol applicable to all Musaceae. Plant Sci. 168:45-55.
Panta, A., D. Tay, R. Gomez, B. Zea, E. Rojas, R. Simon, and W. Roca. 2009. Status and impact of the in vitro conservation of root and tubers at the International Potato Center (CIP). 15th Triennial of the Symposium of the International Society for Tropical Root Crops (ISTRC). International Potato Center. Lima, Peru, 2-6 November, 2009. 24 p.
Peredo, E.L., R. Arroyo-García, B.M. Reed, and M.Á. Revilla. 2008. Genetic and epigenetic stability of cryopreserved and cold-stored hops (Humulus lupulus L.). Cryobiology 57:234-241.
Pinchera, R.G. and K.A. Fletchev. 1994. Paclobutrazol and ancymidol protect corn seedling from high and low temperature stresses. Plant Growth Regul. 15:47-53. Pookmanee, T., R. Amphawan, N. Topoonyamont, and N.
Wichit. 2001. In vitro germplasm preservation of Amorphophallus oncophyllus Prain ex Hook. F. p. 145-155. Proceeding of the 3rd Maejo University Annual Conference. Maejo University, Chiang Mai, Thailand. Ramkrishna, N. Khawale, and S.K. Singh. 2005. In vitro
adventitive embryony in citrus: A technique for citrus germplasm exchange. Curr. Sci. 88(8):1309-1311. Reed, B.M. 2001. Implementing cryogenic storage of clonally
propagated plants. CryoLetters 22:98-104.
Roostika, I. dan N. Sunarlim. 2001. Penyimpanan in vitro tunas ubi jalar dengan penggunaan paclobutrazol dan ancymidol. J. Pen. Pert. Tan. Pangan 20(3):48-56. Roostika, I., I. Mariska, dan N. Sunarlim. 2004a.
Penyimpan-an ubi kayu (Manihot utilissima) secara kriopreservasi dengan teknik vitrifikasi. J. Bioteknologi Pertanian 9(1):8-13.
Roostika, I., I. Mariska, G. A. Wattimena, N. Sunarlim, dan M. Kosmiatri. 2004b. Kriopreservasi Ubi Jalar (Ipomoea batatas [L.] Lam.) secara enkapsulasi-vitrifikasi. J. Pen. Pert. Tan. Pangan 22(3):159-166.
Roostika, I., N. Sunarlim, dan A.V. Novianti. 2005. Penyimpanan kentang hitam (Coleus tuberosus) secara kultur in vitro. J. Pen. Pert. Tan. Pangan 24(1):46-52. Sakai, A. 2004. Plant cryopreservation. p. 329-245. In B.J.
Fuller, N. Lane, and E.E. Benson (eds.) Life in the Frozen State. CRC Press. London, UK.
Sakai, A. and F. Engelmann. 2007. Vitrification, encapsulation vitrification and droplet vitrification: A review. CryoLetters 28(3):151-172.
Sant, R., B. Panis, M. Taylor, and A. Tyagi. 2008a. Cryopreservation of shoot tips by droplet-vitrification applicable to all taro (Colocasia esculenta var. esculenta) accessions. Plant Cell Tiss. Org. 92:107-111. Sant, R.M., M.A. Taylor, and A. Tyagi. 2008b. Cryopreser-vation of in vitro-grown shoot-tips of tropical taro (Colocasia esculenta var. esculenta) by vitrification. CryoLetters 27(3):133-142.
Sarkar, D., S.K. Chakrabarti, and P.S. Naik. 2001. Slow-growth conservation of potato microplants: Efficacy of ancymidol for long-term storage in vitro. Euphytica 117:133-142.
Secretariat of the Pacific Community. 2002. Taro Genetic Resources: Conservation and Utilization. AusAID/SPC. Annual Report 2001/2002. Secretariat of the Pacific Community (SPC). Suva, Fiji. 90 p.
Shawky, B. and U.I. Aly. 2007. In vitro conservation of globe artichoke (Cynara scolymus L.) germplasm. Int. J. Agri. Biol. 9(3):404-407.
Shukla, N., N.S. Sangwan, O.H. Misra, and R.S. Sangwan. 2004. Characterization of Boerhavia diffusa L. mutant lines by RAPD and isozyme selected for agronomically valuable traits. J. Gen. Breed. 58:37-46.
Staritsky, G.A.J., Dekkers, N.P. Louwars, and E.A. Zandvoort. 1986. In vitro conservation of aroid germplams at reduced temperature and under osmotic stress. p. 277-280. In L.A. Withers and P.G. Anderson (eds.) Plant Tissue Culture and Its Agricultural Applications. Butterworths, London, England.
Sudarmonowati, E. 2000. Cryopreservation of tropical plants: Current research status in Indonesia. p. 291-296. In F. Engelmenn and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy. Sunarlim, N., A.V. Novianti, dan I. Rostika. 2004.
Penyim-panan in vitro gembili melalui pertumbuhan minimal. hlm. 267-275. Dalam A.K. Makarim et al. (eds.) Kinerja Penelitian Mendukung Agribisnis Kacang-kacangan dan Umbi-umbian. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor.
Sunarlim, N., Minantyorini, dan W.H. Adil. 1999. Penyim-panan ubi jalar secara in vitro dengan pertumbuhan minimal. Bul. Plasma Nutfah 5(1):1-5.
Takagi, H. 2000. Recent developments in cryopreservation of shoot apices of tropical species. p. 178-193. In F. Engelmann and H. Takagi (eds.) Cryopreservation of Tropical Plant Germplasm. Current Research Progress and Application. JIRCAS, Japan/IPGRI, Rome, Italy. Takagi, H., N. Tien-Thinh, O.M. Islam, and T. Senboku.
1997. Cryopreservation of in vitro grown shoot tip of taro (Colocasia esculenta [L.] Schott) by vitrification. 1. Investigation of basic condition of the vitrification. Plant Cell Rep. 16:594-599.
Tay, D. 2000. Model genebank concept: CIP genebank. 15th Triennial of the Symposium of the International Society for Tropical Root Crops (ISTRC). International Potato Center. Lima, Peru, 2-6 November 2009. 24 p.
Taylor, M. 1996. Taro tissue culture. JOSPA 3(1-2):1-9. Taylor, M.B. 2000. New regional gene bank in Fiji was
made-to-order for Pacific Island Nations: High-tech methods complement region’s germplasm, expedite access. Diversity 16(4):19-21.
Thro, A.M., W.M. Roca, and G. Henry. 1996. The cassava biotechnology network (CBN) and cassava biotech-nology research. p. 13-20. In G.T. Kurup, M.S. Palaniswami, V.P. Potty, G. Padmaja, and S. Kabeerathumma (eds.) Tropical Tuber Crops: Problem, Prospect and Future Strategies. Science Publishers Inc. Lebanon, USA.
Tyas, K.N., S. Susanto, I.S. Dewi, dan N. Khumaida. 2012. Konservasi pamelo (Citrus maxima [Burm.] Merr.) dengan penurunan konsentrasi medium dan sukrosa. Bul. Kebun Raya 15(2):103-113.
Tyas, K.N., S. Susanto, I.S. Dewi, dan N. Khumaida. 2013. Konservasi in vitro pamelo (Citrus maxima [Burm.] Merr.) melalui pertumbuhan lambat. J. Agron. Indonesia 41(1):32-39.
Towill, L.E. 2005. Germplasm preservation. p. 277-284. In R.N. Trigiano and D.J. Gray (eds.) Plant Development and Biotechnology. CRC Press. Boca Raton, USA. Towill, L.E. and R.L. Jarret. 1992. Cryopreservation of sweet
potato (Ipomoea batatas [L.] Lam.) shoot by vitrification. Plant Cell Rep. 11:175-178.
Unnikrishnan, M., N.G. Nair, and G.G. Nayar. 1992. Preliminary studies on conservation of germplasm of tuber crops through in vitro cultures. p. 51-55. In N.S.S. Rao, C. Balagopalan, and S.V. Ramakrishna (eds.) New Trends in Biotechnology. Oxford and IBH Publishing Co. Pvt. Ltd. New Delhi, India.
Withers, L.A. 1991. In vitro conservation. Biol. J. Linnean Soc. 43:31-42.
Xin, S.Y. 1988. Studies on in vitro storage of sweet potato germplasm. Crop Germplasm 2:24-26.
Zandvoort, E.A., M.J.H. Hulshof, and G. Staritsky. 1994. In vitro storage of Xanthosoma spp. under minimal growth condition. Plant Cell Tiss. Org. 36:309-316.