S K R I P S I
LILIK LESTYO BUDI UTOMO
P E N G A R U H P E M B E R I A N E K S TR A K B A W A N G P U TI H
( Allium sativum L . )
TE R H A O A P T O K S I S I T A S K A R B O N T E T R A K L O R I D A
P A D A H E P A TO S I T T I K U S TE R I S O L A S I
D E N G A N P A R A M E TE R E N Z I M G P T
f f
U / o
M 1 L I K
PERFUSI A k A A N ’UNIVERS1TAS A 1RJ.ANCCA"S U R A B A Y A
F A K U L T A S F A R M A S I
U N I V E R S I T A S A I R L A N G G A S U R A B A Y A
P EN GAR UH P EM B ER I AN EK S TR AK BAW AN G P U TI H
{Allium sativum L.)
TE R H A D A P T 0 K 3 I S I T A S KAR BON TE TR A K LO R I D A
P A D A H E P A TO S I T TI K U S TE R I S O L A S I
D EN GAN P A R A M E TE R EN Z I M G P T
SKRIPSI
DIBUAT UNTUK MEMENUHI SYARAT
MENCAPAI GELAR SARJANA FARMASI
PADA
FAKULTAS FARMASI
UNIVERSITAS AIRLANGGA
1 9 8 9
Oleh :
LILIK LESTYO BUDI UTOMO
050410655
Disetujui oleh Pembimbing
KATA PEN
aNTAR
Dengan mengucapkan puji syukur kepada Tahan Yang Maha
Esa atas Rahmat dan Karunianya, sehingga kami dapat menye-
lesaikan skripsi ini untuk memenuhi tugas akhir sebagai
salah satu syarat untuk mencapai gelar sarjana farmasi pa
da fakultas Farmasi Unuversitas Airlangga.
Terima kasih kami sampaikan kepada Almamater ter—
cinta, Fakultas Farmasi Universitas Airlangga yang telah
memberi kesempatan kepada kami untuk belajar selama ini.
Tidak lupa pad^ kesempatan ini kami sampaikan pula
rasa terima kasih yang setulus-tulusnya kepada :
- Bapak Drs. Ahmad Fuad, MS dari Laboratorium Fitokimia
Fakultas Farmasi Unair.
- Bapak Drs. Wahjo Dyatmiko Apt, dari Laboratorium Fi
tokimia Fakultas Farmasi Unair.
- Bapak DR. Mulya Hadi Santosa dari Laboratorium Bio-
teknologi Fakultas Farmasi Unair,
yang telah memberikan bimbingan, saran, pengarahan
dan semangat serta dorongan moral yang sangat berha'r—
ga dalam pelaksanaan hingga selesainya skripsi ini.
- Bapak DR. Gunawan Indrayanto sebagai Kepala Laborato
rium Bioteknologi Farmasi Universitas Airlangga.
- Bapak DR. Noor Cholies sebagai Ketua Jurusan Biologi
Farmasi Universitas Airlangga.
, ivi I L I iv
- Laboratorium Medis Selamat Sejahtera Jember yang te
lah memberikan fasilitas sehingga terse 1esainya tugas
ini .
- Bapak dan ibu dosen penguji yang telah berkenan mene-
rima dan memeriksa skripsi ini.
- Bapak dan ibu serta Saudara kami tercinta atas ban-
tuan baik moril maupun material sehingga tugas ini
dapat terselesaikan.
- Rekan-rekan mahasiswa dan semua pihak yang tidak da
pat kami sebutkan satu persatu yang telah memberikan
bantuan baik secara langsung maupun tidak langsung.
Semoga Tuhan Yang Maha Esa berkenan melimpahkan Rakh-
mat dan Hidayahnya kepada kita semua. Amin.
Akhirnya dengan segala kerendahan hati kami berharap
semoga skripsi yang kami buat ini dapat bermanfaat bagi
ilmu pengetahuan, khususnya dunia ke-farmasian.
Surabaya, Desember 1989
Penyusun
BAB IV. HASIL PENELITIAN ... ...43
1. Hasil preparasi hepatosit ... ...43
2. Hasil percobaan inkubasi sel dengan karbon tetra klorida ... ...44
3. Hasil percobaan inkubasi sel dengan ekstrak bawang putih ... ...46
4. Hasil percobaan inkubasi sel pada tikus 1 ... ...47
5. Hasil percobaan inkubasi sel pada tikus 2 ... ...50
6. Hasil percobaan inkubasi sel pada tikus 3 ... ...53
7. Hasil uji aktivitas enzimGPT oleh ekstrak bawang putih ... ... 56
BAB V. P E M B A H A S A N... ...58
BAB VI. KESIMPULAN ...61
BAB VII. SARAN-SARAN ...62
DAFTAR P U S T A K A ... ...63
D A F T A R G A M B A R sirkulasi media perfusi pada preparasi he— patosi t ... . ... 29
5. Skema situasi hewan dan alat perfusi untuk resirkulasi media perfusi pada preparasi hepatosit ... 30
6. Cara pensuspensian hepatosit ... 32
7.a. Penyaringan hepatosit ... . 33
7.b. Pemisahan hepatosit ... 34
8. Bidang-bidang dan garis dalam Neubauer .... 35
9. Hepatosit tikus secara mikroskopi dengan pewarnaan Trypan blue (perbesaran 75 kali). 43 10. Kurva selisih pelepasan GPT dalam medium suspensi hepatosit pada penambahan CCl^ 0,2 mM ... 44
11. Kurva selisih pelepasan GPT dalam medium suspensi hepatosit pada penambahan CCl 0,4 mM dan 0,8 mM ... 45
12. Kurva selisih pelepasan GPT dalam medium suspensi hepatosit pada penambahan ekstrak bawang putih ... 46
13. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada tikus 1 ... 48
14. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada ' penambahan CCl^
0,4 mM dan CCl^ 0,4 mM yang 1 jam
sebelum-nya diberi ekstrak bawang putih 0,1875pl/ml 49
15. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada tikus 2 ... 51
16. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada penambahan CCl^
0,4 mM dan CCl^ 0,4 mM yang 1 jam
sebelum-nya diberi ekstrak bawang putih 0,1875pl/ml 52
17. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada tikus 3 ... 54
18. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit pada penambahan CCl^
0,4 mM dan CCl 0,4 mM yang 1 jam sebelum-4
nya diberi ekstrak bawang putih 0,1875/jl/ml 55
19. Grafik prosentase hambatan aktivitas enzim
GPT pada berbagai konsentrasi ekstrak ba
wang putih ... 56
D A F T A R L A M P I R A N
lampiran halaman
1. Komposisi media perfusi hepar tanpa
pengi-68
2. Komposisi media perfusi hepar dengan
ikat ion kalsium ...
peng
-69
3. Komposisi larutan Seglen-3 ... 70
4. Komposisi kit GPT optimized UV -*
Boehringen Mannheim GmBh ...
test dari
7. Data hasil percobaan inkubasi
tikus 1 ...
se 1 pada
74
8. Data hasil percobaan inkubasi
tikus 2 ...
sel pada
76
9. Data hasil percobaan inkubasi se 1 pada
78
10. Data hasil uji hambatan aktivitas enzim
GPT oleh ekstrak bawang putih ... 80
11 . Spektrogram ekstrak bawang putih
konsen-81
BA B I
P E N D A H U L U A N
Pembangunan kesehatan yang merupakan bagian integral
dari pembangunan nasional dilaksanakan dengan tujuan ter—
capainya kemampuan untuk hidup sehat bagi penduduk agar
dapat mewujudkan derajat kesehatan yang optimal (1). Obat
tradisonal yang merupakan warisan nenek moyang atau obat
dari bahan alam saat ini tetap digunakan oleh masyarakat
secara luas. Oleh karena itu dalam upaya pembangunan di
bidang obat harus pula mencakup pembangunan obat di bidang
obat tradisional atau obat dari bahan alam.
Kenyataan menunjukkan bahwa pembangunan obat tradisi
onal atau obat dari bahan alam akhir— akhir ini mengalami
peningkatan. Sebagai contoh telah beredarnya Soft Capsul
dari ekstrak bawang putih {Allium sativum L).
Azizawati dkk (2) menyebutkan bahwa Bawang putih me-
ngandung senyawa-senyawa organik tidak jenuh yang mempu—
nyai gugus fungsional sulfhidril dan jembatan disulfida,
seperti dialil disulfida, propil alii disulfida, glutation
sistein, sistin dan asam tioktat. Sedang obat - obat yang
digunakan sebagai anti hepatotoksik adalah senyawa-senyawa
yang mempunyai gugus fungsional sulfhidril dan jembatan
disulfida, seperti sistein, metionin, homosistein dan glu
tation .
Ekstrak bawang putih (Alliun sativum L) mempunyai ke-
gunaan sebagai penurun kadar kolesterol dalam tubuh, di-
samping itu juga mempunyai kegunaan lain diantaranya, pe
nurun tekanan darah, penurun gula darah (2).
HD Reuter (3) menyebutkan bahwa bawang putih juga da
pat menghambat aktivitas enzim SGOT, SGPT, LDH, dan kolin—
esterase dalam tubuh dan juga mempengaruhi membran plasma.
Dengan latar belakang zat kandungan dan aktivitas
biologis yang telah dilakukan peneliti diatas, maka dila
kukan penelitian secara in vitro (tingkat seluler) terha-i
dap ekstrak bawang putih untuk mengetahui aktivitas biolo-
gisnya terhadap toksisitas CCl^ dengan menggunakan model
percobaan memakai suspensi hepatosit tikus terisolasi
Model percobaan memakai suspensi hepatosit tikus ter—
isolasi dipergunakan karena model percobaan ini mempunyai
keuntungan antara lain :
1. Lebih efektif dibanding percobaan in vivo jika di-
tinjau dari jumlah hewan yang diperlukan, yaitu
dengan satu organ hepar (satu hewan percobaan) da
pat diperoleh suspensi sel (hepatosit) dalam jum
lah yang cukup untuk satu rancangan percobaan (pe-
neli tian) .
2. Vitalitas dan kapasitas enzim pemetabolisme sus
pensi sel (hepatosit) dapat diukur setiap saat ji
ka dibanding percobaan tingkat organ atau potong-
3
Perfusi in situ organ hepar dengan cairan fisiologis
yang mengandung enzim kolagenase atau ion pengikat kalsium
akan dengan mudah mensuspensikan sel hepar dalam suatu me
dia dan sel tetap dipertahankan hidup untuk percobaan se-
bagai sistem suspensi atau kultur sel. Pada penelitian ini
digunakan model percobaan memakai suspensi hepatosit ti
kus terisolasi [5,6].
Penambahan karbon tetra klorida sebagai hepatotoksik
pada sistem suspensi atau kultur akan menyebabkao terjadi
peningkatan aktivitas enzim GOT dan GPT (enzyme leakage).
Pada kondisi percobaan yang sama peningkatan aktivitas
enzim GPT selalu lebih besar bila dibandingkan dengan ak
tivitas enzim GOT, sehingga dalam penelitian ini digunakan
parameter enzim GPT. C7]
Ekstrak bawang putih akan diuji pengaruhnya pada efek
rembesan (enzyme leakage) enzim GPT yang disebabkan oleh
CCl^. Aktivitas enzim GPT ditentukan dengan spektrofoto-
meter pada panjang gelombang 340 nm dengan menggunakan
suatu pereaksi baku (kit) GPT.
Dengan hasil penelitian ini akan diketahui lebih lan-
jut aktivitas biologis tingkat seluler bawang putih dan
dapat menambah informasi ilmiah bagi pemakaian tradisional
B A B U
TIN JA U A N P U S TA K A
2.1. Tinjauan tentang tanaman Allium sativum Linn.
C3,B,9,10,11,12,13,14 3.
bawang (Melayu), bawang putieh,
dasun (Minangkabau), bawang hendak
Kalimantan : Bawang basihong (Dayak ngaju),
uduh bawang (Kenya), Bawang puteh
(B u 1ungan), bawangpu1ak (Tarakan).
Jawa : Bawang bodas, bawang putih
(Sun-da), bhabang pote (Madura), bawang
(Jawa).
Nusa Tenggara : Kesuma (Bali), langsuma, lesune
(Sasak), neune (Bima), lansuna ma-
nura (Sangi), laisoma mabotiek
(Roti), balpeofoleae (Timor).
Sulawesi : Yantuna mapusi (Mongondo’w ) , lesuma
bado (Tonsoro), pia maputi (Goron-
talo), lasuma kebo (Makasar), le
suma pute (Bugis).
Maluku : Kasai bati (uru), bawa davare
(Halmahera), bawa babudo (Terna-
te), bawaiso (Tidore).
2.1.2. Morfologi tanaman.
Tanaman herba dengan tinggi 30 - 60 cm, banyak
ditanam diladang di daerah pegunungan yang cukup
mendapat sinar matahari. Tumbuhan berumpun dengan
umbi batang yang disebut bulbus. Tiap bulbus ter—
bungkus kulit tipis. Daunnya berbentuk pita dan
berakar serabut, bunganya berwarna putih. Kalau ba
wang putih itu diiris-iris, baunya sangat tajam dan
2.1.3. Kandungan tanaman.
- Minyak atsiri (allil disulfida, allil propil di
sulfida) 0,1-0,9 7..
- Allisin.
- A 1 1iin.
- Enzim alliinase, mirosinase.
- Karbohidrat 0,2 */..
- Menurunkan tekanan darah.
- Menurunkan kaar gula darah.
- Mempengaruhi aktivitas enzim SGOT, SGPT, LDH dan
kolin esterase.
- Antelmintik.
- Hemorrhoid.
2.1.5. Simplisia yang digunakan.
- Bulbus segar dan bulbus kering.
2.1.6. Toksisitas.
/" I
- Jika digunakan secara topikal dapat lenyebabkan
iritasi kulit.
- Jika digunakan secara oral dapat menyebabkan
iritasi lambung.
2.2. Tinjauan tentang karbon tetra klorida
Nama kimia : Karbon tetra klorida.
Rumus molekul : CC14.
Berat molekul : 1 5 3 ,8 .
2.2.1. Sifat fisika kimia karbon tetra klorida.[153
Karbon tetra klorida berupa cairan yang berat,
jernih, tidak berwarna, tidak mudah terbakar.
Berat jenis : 1,592 - 1,595.
Kelarutan : 1 : 1500 air, larut dalam lemak dan
minyak menguap, bercampur dengan klo-
roform, eter, dan light petro- levm..
2.2.2. Absorbsi dan nasibnya dalam tubuh.[15}
Karbon tetra klorida segera diabsorbsi setelah
inhalasi, dan juga diabsorbsi dari saluran pencer—
naan. Karbon tetra klorida diekskresi secara perla-
han-lahan melalui paru-paru, urin dan faeses.
2.2.3. Pengaruh karbon tetra klorida terhadap kultur ja-
ringan sel hepar.[73
Bahan yang bersifat sitotoksis sering mempu-
nyai efek yang tidak spesifik dalam meningkatkan
permeabi1itas membran sel terhadap komponen-kompo-
nen dari sel tersebut. Sebagai contoh meningkatnya
aktivitas enzim SGOT dan SGPT dalam peredaran darah
yang berasal dari hepar pada pemberian karbon tetra
klorida pada binatang percobaan seperti pada tikus
dan anjing.
Metode kultur j a n n g a n sel hepar, dapat di —
gunakan untuk mDnentukan e + ek dari karbon tetra
klorida dengan bertambahnya pengeluaran enzim yang
berasal dari sel hepar. Enzim GOT dan GPT akan di —
sekresi secara normal pada medium kultur, dimana
dengan penambahan karbon tetra klorida akan mening-
katkan sekresi kedua enzim tersebut yang berasal
dari sel hepar ke dalam medium kultur karena penga—
ruh karbon tetra klorida terhadap membran sel ter—
sebut.' Sebagai catatan bahwa peningkatan enzim GPT
selalu lebih besar dari pada enzim GOT pada kondisi
percobaan yang sama [73.
Pada percobaan dengan Hepatic Tissue Culture
Cell dengan penambahan sebanyak 0,2 mM karbon tetra
klorida dalam medium kultur selama tidak lebih dari
48 jam akan menyebabkan peningkatan enzim GOT dan
GPT yang berasal dari sel hepar.
Kawaguchi dkk. telah melaporkan bahwa adanya
penurunan enzim dalam hepar (GOT dan GPT) dan ada
nya peningkatan enzim GOT dan GPT dalam serum pada
pemberian karbon tetra klorida secara intra musku-
ler pada pengamatan selama 24 jam sampai 120 jam
pada tikus.
Sifat toksik dari karbon tetra klorida diduga
karena terbentuknya radikal bebas. Pada mulanya
terjadi pemisahan ikatan karbon — klorida yang akan
membentuk ion klorida dan trihlorometi1 radikal
( °CC1 ). Adanya 0 (oksigen) menyebabkan
te>rbentuk-3 2
9
nya triklorometil dioksida (triklorometi1 peroksi
radikal). Kemampuan bentuk radikal mengikat atom
hidrogen dari ikatan lerak tidak jenuh akan menye-
babkan integritas membran hilang sehingga sel hepar
mengalami mikrosis (mati) L16, 17}.
Disamping itu karbon tetra klorida juga mem-
pengaruhi membran dari mitokondria, dan membran da
ri retikulum endoplasma pada struktur lemaknya. Or—
gan sel lain yang dipengaruhi adalah lisosom yang
ditandai den'gan pelepasan enzim dalam medium sus
pensi karena adanya hambatan penggabungan leucin
membentuk protein (18).
Mekanisme kematian sel oleh karbon tetra klo
rida :
CCl
karbon tetra klorida
CCl °CC1 COO Cl CO
3 3 2
trikloro metil trikloro metyl
peroksi radikal
fosgen
radikal
dengan lemak peroksidasi
t o
2.3. Model percobaan in vitro pada hepar.[A,27]
2.3.1. Macam model percobaan in vitro pada hepar di dalam
praktek dan penelitian pengenbangan antara lain :
2.3.1.1. Model percobaan menggunakan fraksi mikrosoma
hepar.
Fraksi mikrosoma hepar adalah salah satu frak
si homogenitas jaringan hepar yang banyak mwngan-
dung enzim pemetabolisme. Untuk itu dilakukan
isolasi hepar dari tubuh hewan yang terbius, ke-
mudian hepar dipotong kecil-kecil lalu dihancur-
kan dengan homogenisator, sehingga akan didapat
suspensi fragmen sel (fraksi-fraksi subseluler).
Pemakaian fraksi mikrosoma ini mempunyai ko-
relasi dengan kondisi in vivo yang kuramg sekali.
tetapi sifatnya sederhana dan mudah dalam tahap
penyiapan dan perlakuan selanjutnya untuk pene-
1i tian.
2.3.1.2. Model percobaan menggunakan potongan jaringan
hepar.
Pemakaian potongan jaringan hepar sebagai
suatu model percobaan in vitro merupakan suatu
usaha pendekatan in vivo, yaitu masih adanya ko-
ordinasi dan kooperasi antar sel-sel,. Te*api mo
del ini mempunyai kekurangan yaitu mudah terjadi-
nya nekrosa sel pada bagian dalam potongan ja
Dapat diduga bahwa kualitas dan reproduksibi-
litas hasil dari percobaan memakai potongan jari
ngan hepar ini kurang baik dan sangat tergantung
pelaksana percobaan, sehingga model percobaan ini
jarang dipakai.
2.3.1.3. Model percobaan menggunakan organ hepar terper—
fusi.
Pada model percobaan ini dibuat suatu sistim
sirkulasi tertutup (resirkulasi) melalui organ
hepar yang dipisahkan dari tubuh hewan percobaan
(terisolasd). Korelasi dengan kondisi in vivo ba
ik sekali karena selama percobaan, keseluruhan
organ hepar masih intact, termasuk hepatosit be-
serta sistem kapiler hepar di dalamnya. Kekurang-
annya adalah bahwa dengan satu hepar (satu hewan
percobaan) hanya dapat dilakukan penelitian untuk
satu perlakuan, vitalitas preparat (hepar teriso-
lasi) selama percobaan sulit diperiksa dan dengan
satu preparat hanya dapat digunakan terbatas be-
berapa jam saja.
2.3.1.4. Model percobaan menggunakan hepatosit terisolasi.
Adalah suatu keberhasilan besar dalam ilmu
pengetahuan selama dekade terakhir bahwa dapat
dilakukan preparasi (isolasi) hepatosit (sel pa-
renkim hepar) yang masih intact dalam jumlah yang
cukup untuk tujuan penelitian jangka pendek serta
untuk kultur sel.
Ada banyak cara preparasi yang bervariasi pada
pada prinsip dan teknik isolasi sel dari jaringan
yang dapat dipakai sebagai metode preparasi/ iso
lasi hepatosit dari hepar.
Umumnya preparasi dilakukan dengan cara per—
fusi tertutup (resirkulasi) organ hepar secara in
situ dengan cairan fisiologis simulasi yang me
ngandung enzim proteolitik (kolagenase) atau se
nyawa pengikat ion kalsium (EDTA, Na sitrat).
Setelah perfusi selesai dan organ hepar nampak
telah terdisintegrasi, selanjutnya hepar diiso-
lasi dari hewan dan sel-sel hepar tanpa banyak
kesulitan dapat tersuspensi setelah kapsula hepar
dapat dirobek-robek. Vitalitas dan kapasitas he
patosit yang diperoleh dapat diukur setiap saat.
Dari satu organ hepar (satu hewan percobaan)
dapat diperoleh hepatosit dalam jumlah cukup be-
sar sesuai dengan besar hewan percobaan. Umumnya
yang sering dipakai hewan percobaan adalah tikus.
2.3.1.5. Model percobaan menggunakan kultur hepatosit.
Model percobaan memakai kultur sel merupakan
kelanjutan dari percobaan dengan suspensi hepa
tosit terisolasi.
Pemakaian kultur hepatosit dimaksudkan agar :
- dapat dilakukan percobaan yang lebih lama.
- setiap akan melakukan percobaan tidak perlu se
memakai/mengambi1 dari kultur sel yang ter—
sedia.
2.3.2. Prinsip cara preparasi hepatosit terisolasi.[4,5]
1. Prinsip disintegrasi mekanis.
2. Prinsip memakai zat pengikat ion kalsium
(chelator).
3. Prinsip memakai enzim proteolitik.
Disintegrasi mekanik adalam cara konvensional
yang sudah jarang dipakai. Jaringan hepar dipaksa-
kan (mekanik).melalui suatu kasa/filter dengan dia
meter 100 pm, baik terbuat dari logam atau nilon.
Dapat diduga bahwa kualitas hasil preparasi tidak
baik dan jumlah sel yang didapat sangat sedikit.
Pemakaian zat pengikat ion kalsium, misalnya
EDTA, dipakai atas dasar bahwa ion kalsium yang
bervalensi dua men-jadi jembatan ikatan antar sel
hepar. Dengan hilangnya ion kalsium maka sel — sel
hepar terdisintegrasi.
Enzim proteolitik, misalnya kolagenase akan
bekerja pada matrik antar sel didalam jaringan
hepar, sehingga sel-sel hepar terdisintegrasi.
2.3.3. Teknis pelaksanaan prinsip pemakaian chelator atau
enzim proteolitik.[4,5]
1. Cara dispersi inkubasi.
2.3.3.1. Dispersi inkubasi.
Dilakukan inkubasi terhadap potongan-potongan
kecil jaringan hepar dalam media enzim atau zat
pengikat ion kalsium pada kondisi dan selama wak
tu tertentu. Dengan demikian diperlukan pengaduk-
an dan media disentegrasi sering diganti yang
baru.
Cara dispersi inkubasi mulai ditinggalkan o-
rang karena cara disentegrasi perfusi lebih efek-
tif dalam arti lebih banyak diperoleh ' hepatosit
dengan vitalitas yang tinggi pula.
2.3.3.2. Disintegrasi perfusi.
Perfusi artinya suatu proses pemasukan cairan
ke dalam suatu sistem (hepar) secara kontinu de
ngan kecepatan yang teratur. Perfusi hepar dila
kukan dengan memasukkan cairan lewat vena porta
dan keluar melalui vena hepatica. Cara perfusi
memerlukan alat pen.ting yaitu pompa paristaltik.
Pompa ini mampu menyalurkan media dengan kecepat
an yang dapat diatur. Hal penting selama dilaku
kan preparasi hepatosit terisolasi adalah kondisi
simulasi fisologis untuk mempertahankan vitalitas
sel. Kondisi ini selain meliputi komposisi media
yang berkaitan dengan tonisitas dan pH, juga me
liputi faktor temperatur.
2.4. Uji hepatoprotektif L4,19,20,21,22,23,24]
Dengan bertambahny«: ia.poran adanya kasus efek
samping bahan obat dan bahan kimia berupa hepatotok-
sisitas (toksik terhadap hepar dan fungsinya), maka
penelitian uji hepatoprotektif menjadi makin intensif
mencari bahan alam atau senyawa yang mempunyai akti
vitas melindungi (protektif) hepar dari bahan hepato-
toksik. Hepatotoksisitas dapat disebabkan oleh fak-
tor— faktor antara lain:
1. Kondisi non fisiologis misalnya : konsentrasi yang
tinggi, perubahan pH atau tonisitas, yang merupa
kan awal dari kematian sel.
2. Sifar merusak terhadap plasma membran sel dari
hepatosit. Kerusakan membran merupakan penyebab
awal dari kematian s e l .
3. Sifat menghambat dan merusak terhadap reaksi intra
seluler beserta zat yang terlibat dalam reaksi
tersebut.
4. Sifat merusak terhadap inti sel.
Bahan hepatotoksik bekerja baik secara ekstra
seluler atau intra seluler, dapat berupa bahan exogen
atau metabolit dari bahan obat, antara lain :
1. Zat kimia exogen : karbon tetra klorida, galakto-
samin, phalloidine, TOX (tertiary-buty1 dydroper—
oxide).
2. Bahan obat atau metabolitnya : Hidrazin (metabolit
Untuk menguji aktivitas hepatoprotektif diper—
lukan pengetahuan tentang parameter pengukur hepato-
toksisitas. Parameter tersebut tercakup pada metode-
metode sebagai berikut :
1. Integritas membran plasma, yaitu uji vitalitas sel
dengan pewarnaan trypan blue, uji aktivitas enzim
LD H , GOT dan GPT.
2- Fungsi metabolisme, yaitu aktivitas sintetis albu
min atau gllserol, uji aktivitas enzim pemeta-
bolisme sitokrom P —450, uji kandungan GSH (reduced
gJutation).
3- Mutagenicity Testing, yaitu mengukur efek terhadap
kromosom/DNA dan manifestasi perubahannya.
Uji hepatoprotektif tidak lain adalah meneliti
pengaruh zat yang diuji terhaap aktivitas (toksisi—
tas) zat hepatotoksik tertentu meXalui parameter yang
sesuai. Jenis parameter ini menentukan jenis inter—
pretasi sifat hepatoprotektif. Apakah protektif ter—
hadap kerusakan membran plasma, atau protektif ter—
hadap fungsi— fungsi metabolisme hepar ataupun pro
tektif terhadap mutagenitas.
Uji hepatoprotektif dapat dilakukan melalui
uji in vivo atau in vitro. Uji in vitro memakai hepa
tosit terisolasi sebagai percobaan tingkat seluler
mempunyai kelebihan bahwa secara spontan dapat dike—
17
langsung mengukur parameter hepatoprotektif. Percoba
an uji hepatoprotektif menggunakan hepatosit dilaku
kan dengan melakukan inkubasi bahan uji bersama zat
hepatotoksik dalam sistein suspensi (untuk percobaan
jangka waktu 1—4 jam) atau dalam sistem kultur hepa-
tosit (untuk jangka waktu lebih dari 24 jam).
Telah banyak diketahui atau diketemukan pene-
liti bahan— bahan yang bersifat hepatoprotektif. Seba
gai contoh beberapa zat hepatoprotektif yang dibagi
dalam dua golongan :
1. Bahan sintetis, contoh : Asam amino, misalnya cis-
tein dan metionin (karena kandungan gugus SH) ;
senyawa dipeptida, misalnya : arginil-aspartat,
orniti1—aspartat, arginil— ketoglutarat (zat ini
sebagai aktifator siklus urea) ; senyawa tripep-
tida,misalnya : glisin-histidin-1isin (sebagai
liver growth faktor).
2. Bahan alam, yang merupakan metabolit sekunder ta
naman. Saat ini sedang banyak dilaporkan tentang
berkhasiatnya beberapa metabolit sekunder tanaman
sebagai hepatoprotektif. Misalnya tanaman Allium
sativum, Liquidambar formosana, Eliptica alba, Mu
sa acuminata9 Rehmania glutinosa, Casia tora9
Cap-paris spinosa.
Metode pendekatan pencarian tanaman berkhasiat
hepatoprotektif dapat melalui pendekatan etnofarma-
t s
traditional yang dapat dikaitkan dengan obat/jamu un-
tuk hati) atau pendekatan kemotaksonomi dan SAR (di-
cari tanaman yang mengandung metabolit sekunder seje-
nis atau mirip dengan zat yang telah diketahui mem-
punyai aktivitas).
Belum ada cara baku untuk rancangan uji hepa-
toprotektif. Yang umum dicoba peneliti adalah ran
cangan inkubasi bersama (zat hepatotoksik dan zat
yang diuji) atau rancangan penambahan zat yang diuji
sebelum dan sesudah inkubasi zat hepatotok&ik. Inku
basi dapat pada sistem suspensi hepatosit atau sistem
ku1tur.
2.5. Enzim GPT (25)
Dikenal dua jenis enzim transferase yang lazim
dipakai untuk menilai adanya gangguan fungsi sel hati
yaitu aspartat amino transferase dan alanin amino
transferase. Alanin amino transferase membawa gugus
amino alanin ke asam alfa ketoglutarat menghasilkan
asam glutamat dan asam piruvat, sehingga lebih dike-
nal dengan nama glutamat piruvat transferase (GPT).
Enzim GPT mengkatalis reaksi sebagai berikut :
Gp T terutama terdapat dalam hati dan sedikit
terdepat daiam ginjal dan otot bergaris, yang ter-
larut dalam sitoplasma. Oleh karena itu kenaikan
aktivitas enzim dalam serum lebih khas menunjukkan
adanya gangguan sel-sel hati.
Pada gangguan yang ringan pada membran sel ha
ti, enzim sitoplasma akan merembes ke dalam serum,
terutama GPT. Oleh karena itu GPT sangat cocok untuk
mengenal terjadinya gangguan sel hati walaupun de—
rajat gangguannya ringan.
2.6. Uji Alanin amino transferase (ALT/GPT) [263
Metode : Ultra violet, Kinetik, GSCC
Prinsip :
ALT/GPT
Alanin + 2-0xoglutarat --- . » Piruvat + Glutamat
+ l d h +
Piruvat + NADH + H --- =•♦ 1-Lactat + NAD
Kecepatan penurunan absorbansi pada 334, 340, atau
365 nm karena terbentuknya NAD yang berasal dari ter—
bentuknya piruvat dan ini digunakan sebagai pengukur—
BA B III
— Kit GPT dari Boehringer Mannhein. Komposisi kimia
nya tertera pada lampiran 4.
— Heparin 5000 IU/ml.
— Serum kontrol untuk u j 1 pereaksi kit GPT optimized—
UV test.
dapar ini diseimbangkan
5. Komposisi kimianya
%
dapar ini diseimbangkan
5. Komposisi kimianya
- Hewan percobaan :
Hewan : Tikus putih.
strain : Wistar.
berat badan : 150 - 300 gram,
jenis kelamin : jantan.
Umur : ± 5 bulan (dewasa).
Hewan diperoleh'dari Laboratorium Hewan Universitas
Indonesia.
3.2. Alat-alat vano digunakan
- Seperangkat alat operasi hewan.
- Pompa peristaltik.
- pH-meter.
- Behring Elisa Photometer.
- Hemasitometer : Improve Neubauer.
- Mikroskop.
- Seperangkat alat untuk perfusi hepar.
- Shaker Water Bath.
- Alat penghitung (counting clock).
- Alat suntik 'Terumo syringe disposable/steri 1 non
pyrogenic' ukuran 1,0 ml.
- Surflo IV catheter sterile, Terumo 16 G x 2.
- Surflo IV catheter sterile, Terumo 20 G x 2.
3.3. Metode Penelitian [5,6]
3.3.1. Persiapan alat
Disiapkan susunan peralatan perfusi seperti
-> r<
hepar sebelum digunakan dialiri dengan gas 0 : CO
2 2
- 95 s 5 v/v dan suhu media dibuat 37 °C.
Tikus dianestesi dengan ether. Selama melaku-
kan anestesi ketenangan tikus perlu dijaga, misal-
nya cara memegang tikus harus hati-hati (tidak
terlalu kasar) sehingga tidak terjadi stress pada
tikus. Stress pada tikus terlihat bila tikus
menjadi gelisah dan bahkan sampai terkencing-
kencing, karena stress pada tikus dapat menyebabkan
vasokonstriksi pada pembuluh darah khususnya pada
hepar. '
3.3.2. Persiaoan tikus
Tikus dipuasakan selama sehari (tidak diberi
makan tapi masih diberi minum), Hal ini dimaksudkan
agar pada hari isolasi, hepatosit tikus dalam
kondisi metabolisms nonhiperaktif. Kemudian tikus
tersebut ditimbang.
3.3.3. Pelaksanaan preoarasi
Tikus yang . telah teranestesi diletakkan
terlentang pada papan operasi hewan dengan keempat
kakinya diikatkan pada papan operasi tersebut. Pada
daerah ventral dilakukan sterilisasi lokal dengan
alkohol 70 Disuntikkan secara intravena 0,25 ml
larutan Heparin 5000 IU/ml pada ekornya. Hal ini
ditujukan untuk menghindari pembekuan darah.
Dilakukan pembukaan rongga peritonial, dibuat
penge-lupasan kulit, baru kemudian dilakukan irisan pada
dinding peritonial. Cara pembuatan irisan dapat
dilihat pada gambar 1.
Gambar 1. Irisan berbentuk huruf U pada dinding peritonial.
Irisan dinding peritonial diangkat ke atas dan
diikatkan pada tempat operasi. Maka seluruh organ
di dalam rongga peritonial akan nampak. Selanjutnya
dilakukan penyisihan organ usus dan lainnya ke arah
sebelah kiri, sehingga nampak jelas pembuluh darah
porta dan vena cava inferior.
Dibuat beberapa ligatur (simpul ikatan) yang
longgar {tampak pada gambar 2) yaitu :
- vena porta, dibuat dua buah dan berjarak 5 mm,
serta 10 mm dari hepar (pangkal vena porta pada
24
~ e.r t e n 8bflominahs untuk mencegah aliran darah
ciasuK ke usus.
- vena cava inferior, pada posisi sesudah (ke arah
jantung) vena renal is.
Ligatur dibuat dari benang berwarna putih setebal
0,5 mm dan sepanjang 20 cm.
Gambar 2. Masuknya sistem perfusi pada vena porta
Disiapkan aliran media perfusi dengan kecepat-
an pelan (10 ml/menit), kanula No. 20 disiapkan
sehingga dengan cepat dapat diletakkan pada posisi
stabii sedemikian sehingga dapat mencapai tepat
pada vena porta.
Telunjuk kiri diletakkan di bawah vena pcrta,
sedangkan ibL jari menjepit dua benang ligatur,
narrpak jelas vena porta di sebelah ibu jari. Dengan
posisi ini diharapkan pada waktu dilakukan peng-
ikatan ligatur pada vena porta setelah kanula dapat
dimasukkan, cukup dilakukan penarikan dua benang
ligatur lainnya dengan tangan kanan (memakai
pinset). Posisi tangan dan hewan seperti tampak
pada gambar 3 :
Tangan kanan dengan memakai gunting memotong
perlahan (robekan kecil) vena cava pada posisi
sebelum (ke arah jantung) vena renalis, selanjutnya
segera pula dilakukan pemotongan vena porta pada
posisi 2 mm sebelum (ke arah hepar) ligatur tef—
akhir, kemudian gunting segera dilepaskan, ambil
kanula, masukkan dengan benar pada vena porta me-
lalui posisi vena porta yang terpotong, sampai
kanula masuk sejauh 2 mm setelah ligatur pertama,
tetapi tidak sampai menembus hepar. Setelah jelas
26
pertama (hal ini dapat dilihat dengan adanya per-
ubahan warna hepar dari merah coklat menjadi coklat
muda yang menunjukkan telah terjadinya perfusi he
par walaupun belum dilakukan pengikatan kedua liga-
tur pada vena porta). Posisi kanula distabilkan
tanpa harus dipegang tangan kanan (kedudukan stabil
kanula beserta pipa saluran media perfusi sangat
penting), segera dilakukan pengikatan ligatur de
ngan tangan kanan dengan bantuan pinset. Setelah
ligatur diikat, barulah tangan kiri melepaskan pe-
gangan pada posisi dibawah vena porta. Pelepasan
ini harus hati-hati, yakin bahwa tidak akan menye
babkan keluarnya kembali kanula dari vena porta.
Lalu dilakukan ikatan kedua kalinya pada kedua li
gatur vena porta dan pangkal kanula (atau pipa sa
luran perfusi) difiksir pada hewan dan tempat ope
rasi untuk menstabilkan posisi kanula. Hal ini
untuk mencegah keluarnya kanula dari vena porta ka
rena pergerakan kanula. Sampai disini selesailah
tahap perfusi hepar dengan memasukkan cairan per
fusi melalui vena porta dan keluar melalui vena ca
va inferior.
Dilakukan pembukaan rongga dada. Mula-mula di
lakukan perobekan kulit ke arah leher, kemudian di
buat irisan dari arah ventral ke arah kranial sam
diafragma, sehingga nampak. semua organ di rongga
dada terutama jantung dan vena cava inferior.
Dibuat ligatur dengan ikatan longgar pada vena cava
inferior sejauh 10 mm dari pertemuan vena hepatica
dengan vena cava inferior, disiapkan kanula No 16
dengan pipa saluran sepanjang minimal 30 cm. Cari
posisi yang stabil sehingga nantinya dapat dengan
cepat dan mudah kanula masuk pada vena cava infe
rior di rongga dada dan kedudukannya mudah untuk
difiksir agar stabil.
Tangan kiri memegang satu benang ligatur,
tangan kanan mengambil gunting dan membuat robekan
k.ecil pada bilik kanan jantung, gunting dilepas,
ambil kanula, masukkan pada vena cava inferior me
lalui lubang robekan pada bilik kanan jantung.
Setelah yakin bahwa kanula masuk pada vena cava
inferior sampai mendekati hepar (atau pertemuan
vena cava inferior dan vena hepatica), benang liga
tur yang lain ditarik dengan tangan kanan untuk
membuat ikatan pada ligatur. Dibuat ikatan sekali
lagi, kemudian sisa benang difiksirkan pada pangkal
kanula. Hal ini untuk mencegah keluarnya kanula
dari vena cava inferior kalau terjadi pergerakan
pada kanula.
Dilakukan pengikatan erat ligatur pada posisi
vena cava inferior sesudah vena renalis (ke arah
2S
fusi melalui posisi tersebut. Kemudian dilakukan
penambahan kecepatan aliran perfusi sampai
50 ml/menit, maka akan tampak terjadi aliran keluar
perfusi dari hepar melalui kanula yang dipasang
pada vena cava inferior dalam rongga dada.
Aliran keluar perfusi dapat ditampung pada
labu erlenmeyer 50 ml dan dari sini dapat dihisap
disirkulasikan kembali masuk ke dalam labu perse-
diaan media perfusi dengan pompa peristaltik. De
ngan sistem perfusi resirkulasi ini cukup' disedia-
kan larutan perfusi 1 liter. Jika tidak memakai
sistem resirkulasi, maka dibutuhkan media perfusi
sejumlah 3 liter dengan perhitungan 50 ml/menit
dikalikan 60 menit perfusi.
Perfusi hepar dengan pengikatan ion kalsium
dilakukan sebagai berikut :
Mula-mula menggunakan media perfusi hepar yang ti
dak mengandung pengikat ion kalsium. Setelah pre-
parasi berhasil dengan baik baru dilakukan perfusi
dengan menggunakan media perfusi hepar yang mengan
dung pengikat ion kalsium (EDTA - Na sitrat
glisin). Perfusi hepar dengan menggunakan media
yang mengandung pengikat ion kalsium dilakukan 30 -
40 menit tergantung pengamatan apakah semua bagian
hepar telah terdesintegrasi. Hal ini nampak jika
dilakukan penekanan pada hepar dengan spatel, maka
ja-ringan hepar telah lunak, tidak kenyal lagi, dan
tampak j a n n g a n telah terdispersi di dalam selaput
hepar.
Situasi hewa'n serta alat perfusi untuk resir-
kulasi media perfusi dapat dilihat pada gambar 4
dan gambar 5 berikut.
30
Gambar 5. Skema situasi hewan dan alat perfusi untuk resirkulasi media perfusi pada preparasi hepatosi t .
Keterangan gambar 5 :
A. Media perfusi hepar dalam suatu labu yang berada
dalam inkubator air. Media disetimbangkan de
ngan gas □ :C0 = 95 : 5 v/v dan suhu media
y a 2 2
dibuat 37 °C.
B. Pompa peristaltik yang mampu mengalirkan media
dari bejana A ke arah hewan percobaan dengan
C. Posisi ligatur pada vena porta tempat masuknya
kanula dan media perfusi menuju hepar.
D. Posisi pemotongan vena cava inferior.
E. Posisi ligatur pada vena cava tempat masuknya
kanula dan keluarnya media perfusi.
F. Posisi ligatur pada vena cava untuk mencegah
T. Beker glass sebagai penampung media perfusi.
3.3.4. Pensuspensian dan pencucian hepatosit
Hepar yang telah didesintegrasikan secara pe
ngikatan ion kalsium dengan EDTA - Na sitrat - gli-
sin diisolasi dari tikus secepat mungkin. Dengan
menggunakan pinset di tangan kiri hepar dipegang
pada bagian vena porta ( bekas kanula 1 ), direndam
dalam media Seglen-3 sambil dirobek - robek selaput
(kapsula) heparnya memakai pisau (atau ujung gun
ting). Hepar digerakkan naik-turun dengan pinset di
dalam media untuk mencoba secara mekanis mensuspen-
sikan hepatosit (lihat gambar 6). Selama pelaksana-
an pensuspensian hepatosit ini temperatur media
Seglen-3 harus 0 - 4 °C, yang dapat dipersiapkan
Gambar 6. Cara pensuspensian hepatosit.
Setelah dirasa cukup mensuspensikan semua he
patosit yang artinya hanya tersisa sedikit saja
jaringan ikat yang terpegang pada pinset, maka sus-
pensi hepatosit kita lewatkan kasanilan 100 m, se-
perti dalam gambar 7.a. Penyaringan dapat diulang
lagi dengan kasanilon 50 m. Setelah tahap penyari
ngan ini selesai, maka dalam suspensi hepatosit
terdapat komponen sebagai berikut :
— Hepatosit yang vital.
— Sel non parenk.im.
— Sel—sel yang mati.
— Fragmen sel.
Semua komponen ini terdapat dalam suspensi
dengan berbagai ukuran dan masa jenis. Jumlah yang
terbesar adalah hepatosit yang vital. Hepatosit
yang vital ini kemudian dipisahkan dengan cara de-
Cara dekantasi adalah cara yang sederhana. Se
lama 10 menit hepatosit yang vital akan tersedimen-
tasi di dasar labu sehingga dengan penghisapan su-
pernatan akan dip’eroleh fraksi hepatosit vital di
dasar labu. Hal ini dapat dilakukan sebanyak tiga
kali untuk mencuci suspensi hepatosit.
PEN'.'ftR I N‘3AN ntF'ftTOi IT
----)
34
AIR ES
Gambar 7.b. Pemisahan hepatosit.
3.3.5. Penghitungan hepatosit dan tes vitalitas
- Dari 50 ml suspensi hepatosit, diambil -500 fjl dan
dipindahkan pada tabung reaksi kecil.
- Ditambahkan larutan trypan blue 0,4 */. dalam NaCl
fisiologis (0,9 V.) sebanyak 500 ^1 ke dalam ta
bung reaksi tersebut.
- Di pipet, diletakkan di at'as Neubauer Chamber
yang telah disiapkan, yaitu gelas penutup dile
takkan di atas kamar penghitung sehingga menutupi
kedua daerah penghitung.
Cara meletakkan pipet ditempatkan pada tepi gelas
penutup dan larutan dikeluarkan.
- Kamar penghitung diletakkan di bawah mikroskop
dan penghitungan dilakukan dengan menggunakan
3.3.5.1. Cara menahituna hepatosit.
-1 Bidang
Gambar 8, Bidang-bidang dan garis dalam Neubauer
1. Daerah penghitung tersebut mempunyai panjang
Z mm, lebar 3 mm dan dalam 0,1 mm.
Dihitung jumlah hepatosit yang terdapat dalam
16 bidang pada sudut Neubauer Chamber.
Luas satu bidang » 0,25 mm x 0,25 mm
= 0,0625
mm2-i *
Luas 16 bidang *= 16 x 0,0625 mm — 1 mm
2 9
Volume 16 bidang * 1 mm x 0,1 mm - 0,1 mm
2. Misalnya jumlah hepatosit yang terdapat dalam
dari terjadinya penghitungan ulang dari sel.
Cara menghitung sel-sel juga harus sistematik.
3.3.5.2. Tes vitalitas
3.3.6. Pembuatan ekstrak bawano outih
— Timbang lOO gram bawang putih.
— Gerus dalam mortir sedikit demi sedikit.
— Kumpulkan hasil gerusan dalam kasa penyaring, ke—
mudian diperas.
— Filtrat dikumpulkan dalam wadah (erlemeyer), ke-
mudian ditutup dan disimpan di tempat yang dingin.
3.3.6.1. Pembuatan ekstrak bawang putih 250 p 1/ml.
- pipet 500 p 1 ekstrak bawang putih.
- tambahkan 500 pi Seglen-3.
- diencerkan dengan supernatan hepatosit dengan
volume sama.
3.3.6.2. Pembuatan ekstrak bawang putih 63,3 pl/ml.
- pipet 500 pi ekstrak bawang putih.
- tambahkan 2.5 ml Seglen-3.
- diencerkan dengan supernatan hepatosit dengan
volume sama.
3.3.6.3. Pembuatan ekstrak bawang putih 45.55 pi/ml.
- pipet 500 pi ekstrak bawang putih.
- tambahkan 5 ml Seglen-3.
- diencerkan dengan supernatan hepatosit dengan
volume sama.
3.3.6.4. Pembuatan ekstrak bawang putih 31,8 pl/ml.
- pipet 700 pi ekstrak bawang putih pada konsen-
trasi 45,55 pl/ml.
- tambahkan 300 pi seglen-3.
3.3.6.5. Pembuatan ekstrak bawang putih 22,75 pl/ml.
- pipet 500 pi ekstrak bawang putih pada konsen-
trasi 45,55 pl/ml.
- tambahkan 500 pi Seglen-3.
3.3.6.6. Pembuatan ekstrak bawang putih 7,5 pl/ml.
- pipet 300 pi ekstrak bawang putih .
38
- diencerkan dengan supernatan hepatosit dengan
volume sama.
- Encerkan larutan ini dengan menambahkan larutan
Seglen-3 sampai volumenya 20 ml.
3.3.8. Model percobaan yang dilakukan
3.3.8.1. Dengan CCl 0,4 mM
untuk diperiksa aktifitas enzim GP.T-nya.
- Tentukan aktifitas enzim GPT-nya.
3.3.8.2. Dengan bawang putih 0,1875 pl/ml.
- Dipipet dari hasil pengenceran 0,03 ml ekstrak
bawang putih sebanyak 2,5 ml, kemudian masukkan
dalam erlemeyer 100 ml.
- Tambahkan hepatosit dari hasil preparasi seba
nyak 4,0 ml.
- Tambah serum darah tikus 0,2 ml dan larutan
Seglen-3 sampai volume total 20,0 ml.
- Kocok, d’ipipet 1,5 ml ke dalam tabung venoject
untuk diperiksa aktifitas enzim GPT-nya.
- Kemudian diinkubasi pada shaker water bath pada
- Tentukan aktifitas enzim GPT-nya.
3.3.8.3. Dengan bawang putih 0,1875 pl/ml dan CCl^ 0,4 mM
- Model percobaan ini dibagi dalam dua bagian.
- Bagian pertama, dilakukan percobaan dengan
bawang putih dan CCl^ sebagai berikut :
- Tambahkan larutan tersebut dengan hepatosit
40
- Tentukan aktifitas enzim GPT-nya.
- Bagian kedua dilakukan percobaan dengan ekstrak
yang diinkubasi selama satu jam.
- Dipipet 1,5 ml (pemipetan dilakukan pada me
nit ke-0 dan menit ke-60).
- Diperiksa aktifitas enzim GPT-nya.
- Inkubasi dilanjutkan dengan ditambah CCl^
0,4 mM.
- Pada menit ke-120, menit ke-180 dan menit ke-
240 dipipet 1,5 ml.
- Tentukan aktifitas enzim GPT-nya.
3.3.8.4. Dengan hepatosit
- Dipipet 4,0 ml hepatosit hasil preparasi.
- Ditambah serum darah tikus 0,2 ml dan larutan
Seglen-3 sampai volume total 20,0 ml.
- Dikocok, dipipet 1,5 ml dalam tabung venoject.
- Suspensi diinkubasi pada shaker water bath pada
suhu 37 °C dengan dialiri gas 0^ : CO^ = 95 : 5
- Dipipet sebanyak 1,5 ml dengan interval waktu
satu jam (60 menit) sebanyak tiga kali (menit
ke-60, menit ke-120 dan menit ke-180).
- Tentukan aktifitas enzim GPT-nya.
3.3.9. Uji hambatan aktivitas enzim GPT dengan ekstrak
bawang putih.
- sel hepatosit yang telah disimpan selama satu
ha-ri dalam alm^ha-ri pendingin disentha-rifuge
- supernatan dikumpulkan (aktivitas enzim GPT tinggi)
- dipipet 1 ml supernatan sel hepatosit
- dipipet 1 ml ekstrak bawang putih sesuai dengan
konsentrasi yang diinginkan
- tentukan aktivitas enzim GPT nya.
3.3.10. Pemeriksaan aktifitas enzim GPT. (26,28)
A l a t : Behring Elisa Photometer.
Panjang gelombang : 340 nm.
Faktor koreksi : 1905.
S u h u : 30 °C
Cara pemeriksaan :
- Hasil pemipetan 1,5 ml dalam tabung venoject di
sentrifuge selama lima menit.
- Ambil supernatannya dan pindahkan dalam tabung
venoject lain.
42
Dipipet ke dalam kuvet
Larutan Reagen 500
Sampel percobaan 50 Vl
Dicampur dan diinkubasi satu menit pada 30 °c
Larutan alfa-oksoglutarat 50 Vi
Dicampur kemudian dimasukkan ke dalam alat Behring
43
H A S I L P E N E L I T I A N
4 . 1 . H a sil p re p a ra s i h e p a t o s it .
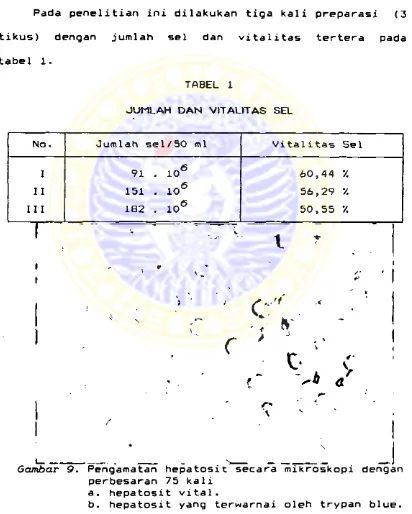
Pada penelitian ini dilakukan tiga kali preparasi (3
tikus) dengan jumlah sel dan vitalitas tertera pada
tabel 1.
TABEL 1
J U M L A H D A N VITALITAS SEL BAB IV
C
r
r* \
Gambar 9. Pengamatan hepatosit secara mikroskopi dengan perbesaran 75 kali
a. hepatosit vital.
4.2.Hasil percobaan inkubasi sel dengan karbon tetra suspensi hepatosit terisolasi pada penambahan CCl^ 0,2 mM.
Keterangan : A = Hepatosit tanpa penambahan zat lain {Kontrol)
B = Hepatosit + CCl^ 0,2 mM.
400
*
D
suspensi hepatosit terisolasi padapenambahan
4.3. Hasil percobaan inkubasi sel dengan ekstrak bawang
suspensi hepatosit terisolasi pada penambahan
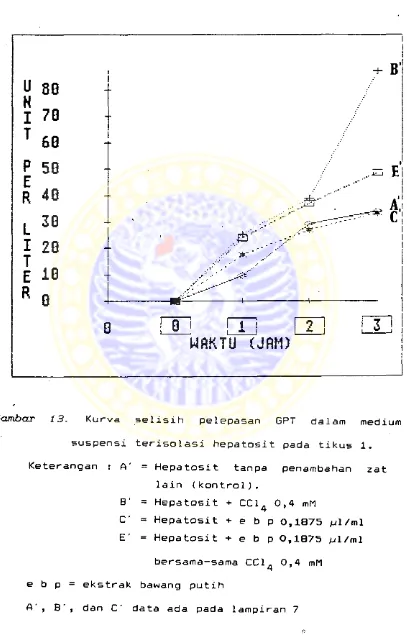
Aktivitas enzim GPT dari hasil inkubasi sel pada
tikus 1 dengan 4 macam perlakuan digambarkan pada
gambar 13.
Sedangkan aktivitas enzim GPT dari hasil
inkubasi sel pada tikus 1 pada penambahan CCl^ mM dan
CCl^ 0,4 mM yang satu jam sebelumnya diberi ekstrak
bawang putih 0,1875 pl/ml digambarkan pada gambar 14.
46
Gambar t3. Kurva selisih pelepasan GPT dalam medium
suspensi terisolasi hepatosit pada tikus 1.
4 9
> =
B
u 8B
1*N
1I 7 0
-T 60
1y
P 50
yE
/R 40
.£?r./L 30
D ‘
I 20
T
E 10
R
n * * 1i i— - — > ,--- --- ,---, i
0
!
a
1
i
7
WfiKTU (JflM)
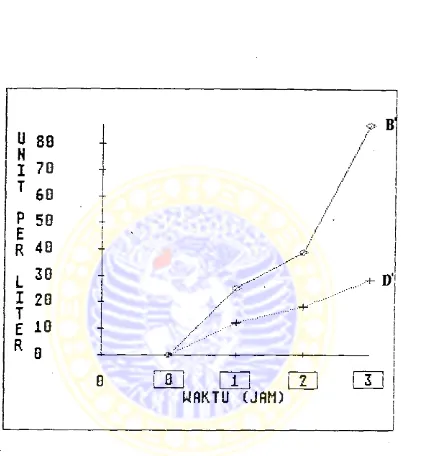
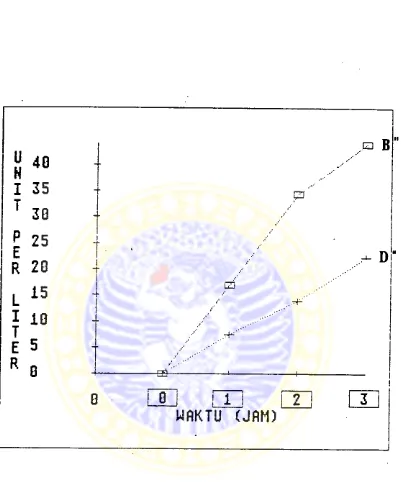
Gambar t4. Kurva selisih pelepasan GPT dalam -medium sus
pensi hepatosit terisolasi pada penambahan CCl^
0,4 mM C B ' ) dan CC14 0,4 mM yang 1 jam sebe-
lumnya diberi ekstrak bawang putih 0,1875 pl/ml
Aktivitas enzim GPT dari hasil inkubasi sel pada
tikus 2 dengan 4 macam perlakuan digambarkan pada
gambar 15.
Sedangkan aktivitas enzim GPT dari hasil inku
basi sel pada tikus 2 pada penambahan CCl^ mM dan
CCl^ 0,4 mM yang satu jam sebelumnya diberi ekstrak
bawang putih 0,1875 pl/ml digambarkan pada gambar 16. 50
5t
Gambar 15. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit terisolasi pada tikus 2.
52
W
f l KTU ( J AM)
Gambar t6. Kurva selisih pelepasan GPT dalam medium sus
pensi hepatosit terisolasi pada penambahan CCl^
0,4 mM (B") dan CCl^ 0,4 mM yang i jam sebe-
lumnya diberi ekstrak bawang putih 0,1875 fj1/ml
Aktivitas enzim 6PT dari hasil inkubasi sel pada
tikus 3 dengan 4 macam perlakuan digambarkan pada
gambar 17.
Sedangkan aktivitas enzim GPT dari hasil inku
basi sel pada tikus 3 pada penambahan CCl^ 0,4 mM dan
CCl^ 0,4 mM yang satu jam sebelumnya diberi ekstrak-
bawang putih 0,1875 fj1/ml digambarkan pada gambar 18. 55
54
Gambar 17. Kurva selisih pelepasan GPT dalam medium
sus-pensi hepatosit terisolasi pada tikus 3.
Keterangan : A"' = Hepatosit tanpa penambahan zat
lain (kontrol).
B"' = Hepatosit + CCl^ 0,4 mM
C"' = Hepatosit + e b p 0,1875 pi/ml
E"' = Hepatosit + e b p 0,1875 pl/ml
bersama-sama CCl^ 0,4 mM
e b p = ekstrak bawang putih
6 8
Gambarld. Kurva selisih pelepasan GPT dalam medium
suspensi hepatosit terisolasi pada penambahan
CCl^ 0,4 mM (B"') dan CCl^ 0,4 mM yang 1 jam
sebelumnya diberi ekstrak bawang putih 0,1875
4.7. Hasil uji hambatan aktivitas enzim GPT oleh
ekstrak bawang putih.
Karena adanya dugaan bahwa ekstrak bawang putih
mampu menghambat aktifitas enzim GPT, maka diper—
kan uji prosentase hambatan aktivitas enzim GPT se-
perti terlihat pada gambar 19.
56
l
100
9 0
8 0
7 0
6 0
H
A
H 5 0 B
0 4 0
3 0
20
10
0
fl I B ii C II D 11 E 11 F H fi I H
K O N S E N TR f i S I
Gambar t9. Grafik prosentase hambatan aktivitas
enzim GPT pada berbagai macam
Keterangan :
A - Hambatan 100 7,
B = Ekstrak bawang putih 250 p/l/ml
C = Ekstrak bawang putih 83,33 /^1/ml
D = Ekstrak bawang putih 45,55 pl/ml
E = Ekstrak bawang putih 31,8 fjl/ml
F = Ekstrak bawang putih 22,75 jjl/ml
G = Ekstrak bawang putih 7,5 /jl/ml
H = Ekstrak bawang putih 0,1875 pl/ml
BA B V
P E M B A H A S A N
Penambahan karbon tetra klorida dengan konsentrasi
0,2 mM (gambar 10) menunjukkan aktivitas enzim GPT yang
mempunyai profil kurva yang mirip dengan keadaan suspensi
hepatosit tanpa penambahan zat lain. Efek dari karbon te
tra klorida 0,2 mM pada suspensi hepatosit baru terlihat
pada menit ke-90.
Peningkatan konsentrasi karbon tetra klorida dari
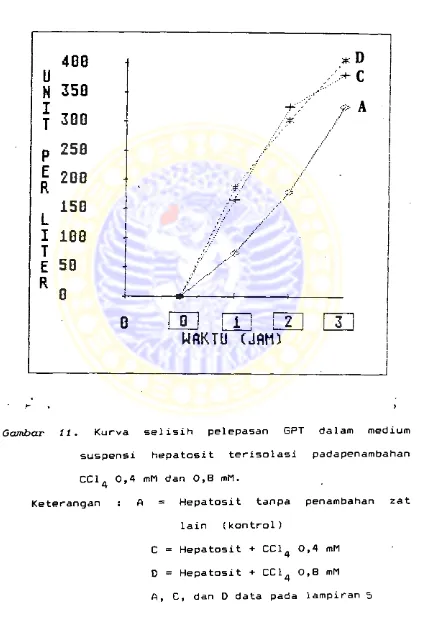
0,2 mM menjadi 0,4 mM dan 0,8 mM dengan tujuan agar dida-
pat perbedaan aktivitas enzim GPT dengan aktivitas enzim
GPT pada kontrol (A). Pada gambar 11 terlihat adanya perbe
daan profil kurva pada A (kontrol) dengan kurva C (CCl^
0,4 mM) dan D (CCl 0,8 m M ). 4
Pada keadaan C dan D terjadi pelepasan enzim GPT yang
lebih banyak dari pada keadaan A. Ini disebabkan karena
terbentuknya radikal bebas dar?i terlepasnya ikatan karbon-
klorida pada CCl^. Bentuk radikal ini akan mengadakan ika
tan kovalen dengan membran mikrosomal lemak dan protein,
disamping itu bentuk radikal ini dapat mengikat atom hi-
drogen dari ikatan lemak tidak jenuh. Organ sel yang dipe-
ngaruhi seperti lisosom akan melepaskan enzim dalam medium
suspensi (16, 17, 18).
Pelepasan enzim pada keadaan C dan D menunjukkan pro
fil kurva yang hampir sama, karena dengan penambahan
sentrasi CCl^ yang lebih tinggi akan menyebabkan peng-
hambatan sintesa protein pada jaringan sehingga akan me-
nurunkan aktivitas dari enzim GPT, dan pada penelitian ini
digunakan CCl^ dengan konsentrasi 0,4 mM 118).
Penambahan ekstrak bawang putih sejumlah 0,375 pl/ml
(F) dan 0,1875 pl/ml (G) pada suspensi hepatosit teriso-
lasi (gambar 12) menggambarkan bahwa pada aktivitas enzim
GPT pada kurva F lebih rendah daripada kurva G, sedang
kurva E sebagai kontrol (E).
Dengan demikian ekstrak bawang putih diduga mempunyai
kemampuan memberikah kondisi yang lebih baik melalui pe-
ngaruhnya pada membran sel atau ekstrak bawang putih aieng-
hambat aktivitas enzim GPT, sehingga pada kurva G mempu
nyai kondisi yang lebih baik untuk digunakan pada perco
baan ini.
Hasil percobaan preparasi hepatosit terisolasi dengan
menggunakan tikus 1, 2, 3 terlihat pada gambar 13 - 18.
Pada pemberian CCl^ 0,4 mM (kurva B gambar 13, 15, 17),
menunjukkan aktivitas enzim GPT yang paling tinggi. Pada
pemberian bersama-sama ekstrak bawang putih 0,1875 pl/ml
Hasil percobaan terakhir ini sekali lagi menunjukkan
bahwa pada pemberian ekstrak bawang putih ditemukan akti-
vitas enzim GPT dalam medium lebih rendah daripada yang
disebabkan oleh CCl^. Efek antihepatotoksik ini masih me-
merlukan pembuktian lebih lanjut, karena mungkin ekstrak
bawang putih dapat menghambat enzim GPT (enzim bloking)
sesuai yang dikutip H.D. Reuter (3). Untuk ini dilakukan
percobaan berikutnya yaitu uji pengaruh ekstrak bawang pu
tih pada aktivitas enzim GPT in vitro.
Hasil uji pengaruh bawang putih berbagai konsentrasi
pada aktivitas enzim GPT secara in vitro dapat dilihat pa
da gambar 19. Hambatan pada aktivitas enzim GPT mulai ter—
lihat pada konsentrasi 7.5 pl/ml (G), yaitu sebesar 3,55 ’/.
Sedangkan pada konsentrasi jauh lebih kecil, yaitu sebesar
0,1875 fj1/ml, tidak menunjukkan hambatan (hambatan sebesar
0,99 */.). Konsentrasi terakhir ini adalah konsentrasi yang
terpakai untuk uji pengaruhnya pada toksisitas CCl (kon-4
sentrasi ekstrak bawang putih 10 mg/ml sudah ada hambatan
[3] ) .
Dengan demikian, hasil percobaan yang menunjukkan
bahwa pada pemberian ekstrak bawang putih bersama CCl^
atau pada pemberian CCl^ 1 jam setelah pemberian ekstrak
bawang putih (lihat gambar 13-18), ditemukan aktivitas
enzim GPT yang lebih rendah daripada yang disebabkan oleh
CC 1 ^, tidak dapat ditelusuri atau dikaitkan sebabnya mela-
lui efek hambatan enzim GPT. Masih ada kemungkinan bahwa
ekstrak bawang putih mempengaruhi membran plasma hepato
sit. (3)
B A B V I
K E S 1 M P U L A N
Dari hasil penelitian yang telah dilakukan, maka da-
pat disimpulkan sebagai berikut :
1. Ekstrak bawang putih sejumlah 0,1875 pl/ml tidak
menghambat aktivitas enzim GPT pada percobaan se
cara in vitro.
2. Ekstrak bawang putih sejumlah 0,1875 pl/ml dapat me-
nekan rembesan enzim GPT yamg disebabkan oleh karbon
8A B V I I
S A R A N - S A R A N
Dari hasil penelitian yang telah dilakukan,
disaran-kan :
- Perlu diadakan penelitian lebih jauh dengan meng
gunakan kultur hepatosit.
- Digunakan zat hepatotoksik selain CCl^ dan parameter
selain S P T .
D A F T A R P U S T A K A
1. Departemen Kesehatan Republik Indonesia, 1985, Cara
Pembuatan Simplisia, hal. iii.
2. Azizawati, Chairul Anwar, Moh. Sadikin, 1989, Pengaruh
Bawang putih (Xi lilum. sativtun Linn.) terhadap Zat Hepa-
totoksik Karbon Tetra Klorida, Proceeding Kongres
Nasional XIII & Kongres IImiah VII ISFI.
3. Reuter, H.D., Knoblauch sativum.), 1986, Neue-
pharmacologesche Ergebnisse einer uralten Arzneip-
flanze, Zeitschrift fiir Phytotherapie 7, hal. 99-106.
4. Santosa, M.H., 1989, Hepatosit Isolasi dan Penggunaan-
nya, Laboratorium Bioteknologi, Fakultas Farmasi Uni-
versitas Airlangga, Surabaya.
5. Seglen P.O., 1976, Preparation of isolated Rat Liver
Cells, Mett. Cells Biol. vol. XIII, hal. 29 - 64.
6. Wang, S e_t al. , 1985, Isolation of Rat Hepatocytes
with EDTA and Their Metabolic Function in Primary
Culture, In Vitro Cellular and Developtment Biol., 21,
h a l . 526 - 527.
7. Watiinabe, A. et. al_. , 1977, Transaminases of Hepatic
Culture Cells and the Effect of Carbon Tetra Chloride
or Their Leakage, Chem. Pharm. Bull. 25, hal. 1089 -
1093
8. Departemen Kesehatan Republik Indonesia, 1981, Peman-
faatan Tanaman O b a t , Edisi II, hal. 56 & 77.
1 0 .
Departemen Kesehatan Republik Indonesia, Tanaman Obat
Indonesia, Jilid I.
Guierrez, Hermes, 1980, An Illustrated Manual of Phi
lippines Materia Medica, National Research Counsil of
Philippines, hal. 35 - 36.
Concha, S, 1982, Philippines National Formulary, Na
tional Science and Tecnology Authority, hal. 30.
British Herbal Pharmacopoeia, 1983, British Herbal
Medicine Assosiation, hal. 20.
Backer C.A. and R.C. Bakhuizen van Den Brink Jr., 1968,
Flora of Java, vol. IIIj Noordhaff NV - Groningen - The
Netherlands, hal. 130 - 132.
Reynold J.E.F., 1982, Martindale, The Extra Pharmaco
poeia, 28th Ed., The Pharmaceutical Press, London,
hal. 89.
Injury With Hepatotoxic Chemicals, Pharmacological
Reviews, 36(2), hal 71.S - 75S.
64
18. Gabriel L Plaa, 1980, Toxic Respons of The Liver,
Hidrazine in Isplated Rat Hepatocytes, Chem. Pharm.
Bull 35, hal 2538 - 2544.
22. Tanbouly N.E., e_t al_« j 1988, Antihepatotoxic Effect of
Aqueous Extract from Caparis spinosa, Planta Medica 65
hal 95.
23. Wong S.M., e_t al_* » 1988, Hepatoprotec ti ve Activities
of Coumestans Anthraquinones, Naphtopyrone Glycosides
and Iridoid Glycosides, Planta Medica, 54.
24. Konno Y., et a K , 1988, Anthepatotoxic Principles of
Liquidambar Farmosana Fruits, Planta Medica, 54, hal
417 - 419.
25. Yusetyani L., 1985, Pemberian Infus Daun Katu (Saura-
pus androgynus Merr.) Terhadap Aktifitas Enzim SGPT,
SG0T dan SGGT Tikus Putih (Rattus norvegicus) Betina,
Skripsi, Fakultas Farmasi Universitas Airlangga,
Surabaya, hal. 14 - 15.
26. Sigma Diagnostics, 1987, Catalog, Sigma Chemical Co.,
St. Louis.
66
27. Muller-Wellensiek A, 1987, Anwendung der Elektrisch
Induzierten Zell Fusion und Kryokan Servierung zur
Herstedlung Frendstoff metabolisierendrer in vitro
systeme, Dissertation, Universitaet Tuebingen, West
Germany, hal. 1 - 11, 23.
28. Boehringer Mannheim GmbH, Diagnostica, January, 1987,
R I N G K A S A N
Preparasi hepatosit terisolasi dari hepar tikus
strain Wistar dengan berat 150 - 300 gram dilakukan dengan
cara resirkulasi menggunakan media pengikat ion kalsium
yaitu campuran EDTA, Na Sitrat dan Glysin yang berfungsi
untuk disintegrasi jaringan. Kemudian dilakukan penghitu-
ngan sel dan uji vitalitas sel. Uji vitalitas dilakukan
dengan pewarnaan Trypan blue.
Untuk mengetahui efek dari ekstrak bawang putih ter-
hadap toksisitas karbon tetra klorida pada hepatosit ter—
isolasi, maka dari suspensi sel yang didapat diinkubasi
selama waktu 0 - 180 menit dengan penambahan ekstrak ba
wang putih dan CCl^. Untuk mengetahui hasilnya dilakukan
uji aktifitas dari enzim GPT yang dikeluarkan ke dalam me
dium oleh sel hepar yang diinkubasi tersebut dengan spek-
trofotometer pada panjang gelombang 340 nm.
Dari hasil penelitian dapat disimpulkan bahwa ekstrak
bawang putih dapat menahan pelepasan enzim GPT pada pembe
rian karbon tetra klorida.
Karena masih banyak kekurangan-kekurangan dalam pene
litian ini, maka perlu digunakan metode lain yang lebih
baik (kultur hepatosit) demi untuk perbaikan • dalam pene-
1 itian ini.