BAB 2
TINJAUAN PUSTAKA
2.1 Metabolid Sekunder Tumbuhan sebagai Obat Tradisional
Obat tradisional biasanya berupa ramuan yang berasal dari beberapa bagian
tumbuh-tumbuhan dari akar, kulit batang, kayu, daun, bunga maupun bijinya. Tumbuhan sendiri mengandung senyawa aktif dalam bentuk metabolit sekunder.
Metabolit sekunder merupakan senyawa kimia yang terbentuk dalam tanaman. Senyawa-senyawa yang tergolong ke dalam kelompok metabolit sekunder ini antara lain: alkaloid, flavonoid, kuinon, tanin dan minyak atsiri. Di dalam tanaman, setiap senyawa akan saling bersinergis sehingga menambah aktivitas atau efektivitasnya (Djauhariya & Hernani, 2004).
2.2. Minyak Atsiri
Minyak atsiri atau yang disebut juga dengan essential oils, etherial oils atau volatile oils adalah komoditi ekstrak alami dari jenis tumbuhan yang berasal dari daun, bunga, kayu, biji-bijian bahkan putik bunga. Meskipun banyak jenis minyak atsiri yang bisa diproduksi di Indonesia, baru sebagian kecil jenis minyak atsiri yang telah berkembang dan sedang dikembangkan di Indonesia (Gunawan, 2009).
Minyak atsiri atau dikenal juga sebagai minyak ateris (aetheric oil), minyak esensial, minyak terbang, serta minyak aromatik adalah kelompok minyak nabati yang berwujud cairan kental pada suhu ruang namun mudah menguap sehingga memberikan aroma yang khas. Minyak atsiri merupakan bahan dasar dari wangi-wangian atau minyak gosok (untuk pengobatan) alami. (Guenther, E, 1987).
Secara kimiawi, minyak atsiri tersusun dari campuran yang rumit berbagai senyawa, namun suatu senyawa tertentu biasanya bertanggung jawab atas suatu aroma
terpena dan terpenoid yang bersifat larut dalam air/lipofil. Senyawa terpena dan terpenoid merupakan penggabungan antara unit-unit isoprene dan isopentan dan terbentuk di dalam tumbuhan sebagai hasil proses biosintesis.
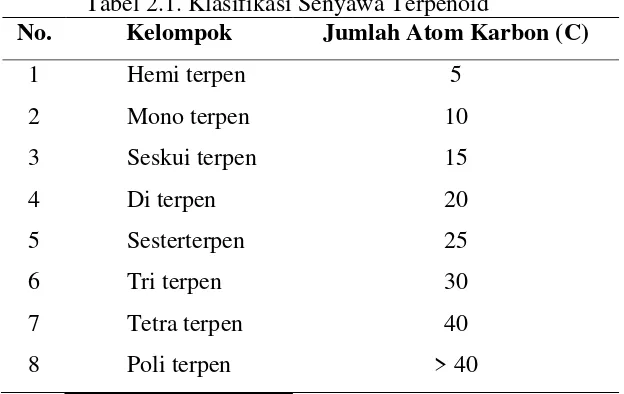
Berdasarkan jumlah atom karbon atau unit isopren yang membentuk senyawa terpen/ terpenoid dapat diklasifikasikan sebagai berikut (Fessenden & Fessenden, 1992):
Tabel 2.1. Klasifikasi Senyawa Terpenoid
No. Kelompok Jumlah Atom Karbon (C) 1 minyak atsiri. Monoterpen mempunyai sifat-sifat berupa cairan tidak berwarna, tidak larut dalam air, disuling dengan uap air, berinteraksi dengan lemak/minyak berbau harum. Minyak bunga dan biji banyak mengandung monoterpen (Robinson., 1995).
Geraniol Ocimene S)-(+)-Linalool (links) und (R)-(−)-Linalool (rechts)
Gambar 2.1 Beberapa Struktur Monoterpen. Seskui terpenoid adalah senyawa (C
15) yang tersusun dari tiga satuan isoprena. Seskuiterpen berperan penting dalam memberi aroma pada bunga dan buah. (Robinson., 1995). Struktur seskuiterpen dapat dilihat pada gambar
Minyak atsiri yang terdapat pada tumbuhan dan biasanya diperoleh dan bagian tertentu dari tumbuhan seperti bunga, buah, akar, daun, kulit kayu dan rimpang. Bahkan ada jenis tanaman yang seluruh bagiannya mengandung minyak atsiri. Kandungan minyak atsiri tidak akan selalu sama antara bagian yang satu dengan bagian yang lainnya, seperti contoh kandungan minyak atsiri yang terdapat pada kuntum bunga berbeda dengan yang terdapat pada bagian daunnya. Minyak atsiri merupakan salah satu hasil akhir proses metabolisme sekunder dalam tumbuhan.
Kegunaan minyak atsiri sangat banyak, tergantung dari jenis tumbuhan yang diambil hasil sulingannya. Minyak atsiri digunakan sebagai bahan baku dalam perisa maupun pewangi (flavour and fragrance ingredients). Industri kosmetik dan parfum menggunakan minyak atsiri kadang sebagai bahan pewangi pembuatan sabun, pasta gigi, samphoo, lotion dan parfum. Industri makanan menggunakan minyak atsiri setelah mengalami pengolahan sebagai perisa atau menambah cita rasa. Industri
farmasi menggunakannya sebagai obat anti nyeri, anti infeksi, pembunuh bakteri. Fungsi minyak atsiri sebagai fragrance juga digunakan untuk menutupi bau tak sedap bahan-bahan lain seperti obat pembasmi serangga yang diperlukan oleh industri bahan pengawet dan bahan insektisida.(Wien Gunawan, 2009)
2.3 Tumbuhan Sembung (B.balsamifera DC)
Gambar 2.3 Tumbuhan Sembung Klasifikasi Tumbuhan
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dycotiledonae
Sub kelas : Asteridae Bangsa : Asterales
Suku : Asteraceae (Compositae)
Marga : Blumeae
Jenis : Blumea balsamifera (L) DC Family : Asteraceae
Nama Populer Tumbuhan di Indonesia : Sembung/ sembung manis, sembung lagi, rumput tahi-babi Nama lokal : Sembung, sembung utan (Sunda), sembung gantung, sembung gula, sembung kuwuk, sembung mingsa, sembung langu, sembung lelet (Jawa), Kamandhin (Madura), capo (Sumatera), afoat (Timor), Ai na xiang (China), Wild heliotrope (English).
Senyawa utama dalam minyak atsiri mengandung 1-borneol berupa hablur yang bentuknya kadang-kadang kecil yaitu dengan titik lebur 203-204oC. Metabolit aktif dari daun sembung yaitu : seskuiterpen dalam bentuk ester, flavonoid, ichtyothereol asetat, cryptomeredio, lutein dan beta karoten. (Osaki dkk, 2005; Nessa dkk, 2005; Ragasa dkk, 2005).
masyarakat diantaranya untuk meredakan nyeri haid, flu, demam, asma, sariawan, diabetes, batuk, bronchitis dan diare (Dalimartha, 1999).
2.4 Isolasi Minyak Atsiri
2.4.1 Ekstraksi Komponen Bahan Alam
Prinsip metode ekstraksi ini adalah didasarkan pada distribusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur, seperti benzen, karbon tetraklorida atau kloroform. Batasannya adalah zat terlarut dapat ditransfer pada jumlah yang berbeda dalam kedua fase pelarut (Khopkar,1990).
Menurut Ahmad (2006), pemilihan pelarut untuk ekstraksi harus mempertimbangkan banyak faktor. Pelarut harus memenuhi syarat-syarat sebagai berikut: murah dan mudah diperoleh, stabil fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, selektif dan tidak mempengaruhi zat berkhasiat.
Dalam metode ekstraksi bahan alam, dikenal suatu metode maserasi. Maserasi merupakan suatu metode ekstraksi menggunakan lemak panas. Akan tetapi penggunaan lemak panas ini telah digantikan dengan pelarut-pelarut volatil. Penekanan utama pada maserasi adalah tersedianya waktu kontak yang cukup antara pelarut dan jaringan yang diekstraksi (Guether, 1987).
2.4.2 Metode Penyulingan ( Destilasi )
Perajangan, pelayuan atau pengeringan dan penyimpanan merupakan perlakuan yang sering dilakukan sebelum destilasi. Perajangan bertujuan agar kelenjar minyak dapat terbuka sebanyak mungkin, sehingga memudahkan penguapan minyak atsiri dalam herba saat destilasi berlangsung, karena minyak atsiri dikelilingi oleh kelenjar minyak, pembuluh-pembuluh dan kantung minyak.
menampung hasil kondensasi ke dalam suatu penampung (Kristanti, N.A., 2006). Metode destilasi minyak atsiri ada tiga macam yaitu:
a. Destilasi dengan Air
Prinsip metode destilasi dengan air (hidrodestilasi) adalah bahan yang akan didestilasi kontak langsung dengan air mendidih. Bahan tersebut mengapung di atas air atau terendam secara sempurna, tergantung dari berat jenis dan jumlah bahan yang didestilasi. Peristiwa pokok yang terjadi pada proses hidrodestilasi, yaitu: difusi minyak atsiri dan air panas melalui membran tanaman, hidrolisa terhadap beberapa komponen minyak atsiri dan dekomposisi yang disebabkan oleh panas. Proses hidrodestilasi bahan dan kecepatan penguapan minyak tidak hanya dipengaruhi oleh sifat menguapnya komponen-komponen minyak atsiri, melainkan juga dipengaruhi oleh derajat kelarutannya dalam air. Kelemahan metode destilasi dengan air adalah adanya air dalam jumlah besar dan pada suhu tinggi menyebabkan proses hidrolisa
relatif lebih ekstensif, akibatnya rendemen minyak atsiri yang dihasilkan akan berkurang sedangkan keuntungannya adalah metode destilasi dengan air baik untuk menyuling bunga-bunga atau bahan yang mudah menggumpal jika terkena panas (Ketaren, 1987).
Peralatan pada metode destilasi dengan air (hidrodestilasi) pada umumnya terdiri dari tiga bagian utama. Tiga bagian utama tersebut adalah alat penyulingan, pendingin dan penampung kondensat. Kondensat mengalir dari pendingin ke penampung kondensat dan akan terlihat minyak atsiri yang dihasilkan akan terpisah dari air dengan sendirinya, karena berat jenis minyak atsiri lebih ringan dari pada air (Sastrohamidjojo, 2004).
minyak atsiri yang dihasilkan dapat langsung diketahui jumlahnya karena alatnya dilengkapi dengan skala.
b. Destilasi dengan air dan uap
Prinsip destilasi dengan air dan uap adalah bahan diletakkan diatas saringan berlubang. Ketel suling diisi dengan air sampai permukaan air berada tidak jauh di bawah saringan. Air dapat dipanaskan dengan berbagai cara yaitu dengan uap jenuh yang basah dan bertekanan. Ciri khas metode ini adalah uap selalu dalam keadaan basah, jenuh dan tidak terlalu panas. Selain itu, bahan yang didestilasi hanya berhubungan dengan uap dan tidak berhubungan dengan air panas. Metode destilasi ini cocok digunakan untuk mengisolasi minyak dari daun atau rumput-rumputan. Keuntungan menggunakan sistem tersebut adalah uap dapat berpenetrasi secara merata ke dalam jaringan bahan dan suhu dapat dipertahankan sampai suhu 100ºC sehingga rendemen minyak lebih besar dan mutunya lebih baik jika dibandingkan dengan minyak hasil
penyulingan dengan air dan bahan yang disuling tidak dapat menjadi gosong. Kerugiannya adalah perpanjangan waktu penyulingan menyebabkan pembasahan bahan oleh kondensasi uap dan penggumpalan bahan dalam ketel menyebabkan minyak atsiri tidak dapat terisolasi dengan sempurna (Ketaren, 1987).
c. Destilasi dengan uap
2.5 Analisa Minyak Atsiri Menggunakan GC-MS
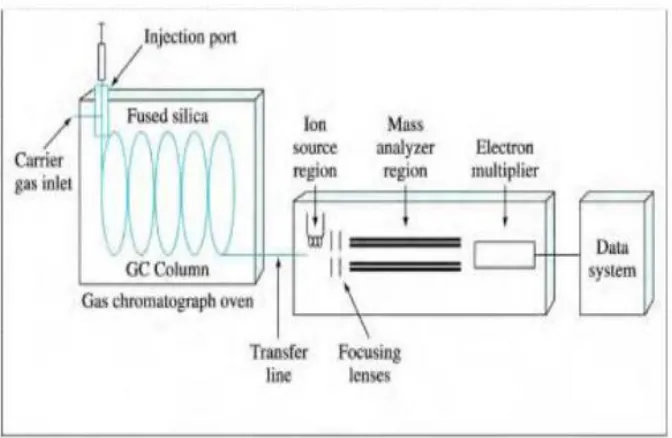
Perkembangan teknologi instrumentasi menghasilkan alat yang merupakan gabungan dari dua sistem dengan prinsip dasar yang berbeda satu sama lain tetapi dapat saling melengkapi, yaitu gabungan kromatografi gas dan spektrofotoskopi massa yang dapat memberikan informasi kualitatif dan kuantitatif tentang susunan atom dan molekul dalam zat organik. Kromatografi gas berfungsi sebagai alat pemisah berbagai komponen campuran dalam sampel, sedangkan spektrometer massa berfungsi untuk mendeteksi masing-masing komponen molekul yang telah dipisahkan pada sistem kromatografi gas. Skema alat GC-MS dapat dilihat pada Gambar
Gambar 2.4. Skema Alat GC-MS
2.5.1. Kromatografi Gas
titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya (Khopkar, 2003).
Dalam teknik kromatografi, semua pemisahan tergantung pada gerakan relatif dari masing-masing komponen di antara kedua fase tesebut. Senyawa atau komponen yang tertahan (terhambat) lebih lemah oleh fase diam akan bergerak lebih cepat daripada komponen yang tertahan lebih kuat. Perbedaan gerakan antara komponen yang satu dengan yang lainnya disebabkan oleh perbedaan dalam adsorbs, partisi, kelarutan atau penguapan diantara kedua fase. Jika perbedaan-perbedaaan ini cukup besar, maka akan terjadi pemisahan secara sempurna (Yazid, 2005).
a. Gas Pembawa
Gas pembawa yang paling sering dipakai adalah helium (He), argon (Ar), nitrogen
(N2), hidrogen (H2), dan karbondioksida (CO2).Keuntungannya adalah karena semua gas ini tidak reaktif dan dapat dibeli dalam keadaan murni dan kering yang dikemas dalam tangki tekanan tinggi.Pemilihan gas pembawa tergantung pada detektor yang dipakai.Gas pembawa harus memenuhi sejumlah persyaratan, antaralain, harus inert (tidak bereaksi dengan sampel, pelarut sampel, material dalam kolom), murni, dan mudah diperoleh (Agusta, 2000).
b. Sistem Injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efesien. Pada dasarnya, ada 4 jenis injector pada kromatografi gas, yaitu :
a.Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan diuapkan dalam injector yang panas dan 100% masuk menju kolom.
b.Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan dalam injector yang panas dan selanjutnya dilakukan pemecahan.
c.Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel diuapkan dalam injector yang panas dan dibawa ke dalam kolom karena katup pemecah ditutup; dan
c. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas (Rohman, 2009). Keberhasilan suatu proses pemisahan terutama ditentukan oleh pemilihan kolom. Kolom dapat terbuat dari tembaga, baja tahan karet, aluminium, atau gelas. Kolom dapat berbentuk lurus,melengkung,atau gulungan spiral sehingga lebih menghemat ruang (Agusta, 2000).
d. Fase Diam
Fase diam disapukan pada permukaan dalam medium, seperti tanah diatome dalam kolom atau dilapiskan pada dinding kapiler.Berdasarkan bentuk fisiknya, fase diam yang umum digunakan pada kolom adalah fase diam padat dan fase diam cair.
Berdasarkan sifatnya fase diam dibedakan berdasarkan kepolarannya, yaitu nonpolar,sedikit polar, setengah polar (semi polar), dan sangat polar. Berdasarkan sifat minyak atsiri yang non polar sampai sedikit polar, untuk keperluan analisis sebaiknya digunakan kolom dalam fase diam yang bersifat sedikit polar.Jika dalam analisis minyak atsiri digunakan kolom yang lebih polar, sejumlah puncak yang dihasilkan menjadi lebar (lebih tajam) dan sebagai puncak tersebut juga membentuk ekor.Begitu juga dengan garis dasarnya tidak rata dan terlihat bergelombang. Bahkan kemungkinan besar komponen yang bersifat nonpolar tidak akan terdeteksi sama sekali (Agusta, 2000).
e. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis kromatografi gas dan spektrometri massa. Umumnya yang sangat menentukan adalah pengaturan suhu injektor dan kolom. Kondisi analisis yang cocok sangat bergantung pada komponen minyak atsiri yang akan dianalisis. (Agusta, 2000).
f. Detektor
pembawa dan komponen-komponen di dalamnya menjadi sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak (Rohman, 2009).
2.5.2. Spektrofotometri Massa
Pemboman molekul oleh sebuah arus elektron pada energi mendekati 70 elektron volt dapat menghasilkan banyak perubahan pada struktur molekul. Salah satu proses yang terjadi yang disebabkan oleh pemboman dengan elektron adalah keluarnya sebuah elektron dari molekul sehingga terbentuklah kation molekul [M.]+. Ion berenergi tinggi ini serta hasil fragmentasinya merupakan dasar bagi cara analisis spektrometri massa (Pine, 1988).
Pada sistem GC-MS ini, yang berfungsi sebagai detektor adalah spektrometer massa
itu sendiri yang terdiri dari sistem analisis dan sistem ionisasi, dimana Electron Impact ionization (EI) adalah metode ionisasi yang umum digunakan (Agusta, 2000).
Spektrometer massa pada umumnya digunakan untuk : 1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresolusi Tinggi (High Resolution Mass Spectra)
3. Mengetahui informasi dari struktur dengan melihat pola frakmentasinya Ketika uap suatu senyawa dilewatkan dalam ruang ionisasi spektrometer massa, maka zat ini
dibombardir atau ditembak dengan elektron. Elektron ini mempunyai energi yang cukup untuk melemparkan elektron dalam senyawa sehingga akan memberikan ion positif, ion ini disebut dengan ion molekul (M+). Ion molekul cenderung tidak
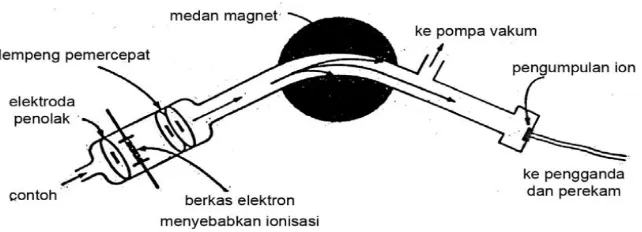
Gambar 2.5. Diagram sebuah spectrometer massa
Spektrometer mampu menganalisis cuplikan yang jumlahnya sangat kecil dan menghasilkan data yang berguna mengenai struktur dan indentitas senyawa organik. Jika efluen dari kromatofrafi gas diarahkan ke spektrometer massa, maka informasi mengenai struktur untuk masing-masing puncak pada kromatogram dapat diperoleh. Karena laju aliran yang rendah dan ukuran cuplikan yang kecil, cara ini paling mudah diterapkan pada kolom kromatografi gas kapiler. Cuplikan disuntikkan ke dalam kromatografi gas dan terkromatografi sehingga semua komponenya terpisah. Spektrum massa diukur secara otomatis pada selang waktu tertentu atau pada maksimum atau tengah-tengah puncak ketika keluar dari kolom. Kemudian data disimpan di dalam komputer, dan daripadanya dapat diperoleh hasil kromatogram disertai integrasi semua puncak. Disamping itu, kita dapat memperoleh spektrum massa masing-masing komponen. Spektrum ini dapat dipakai pada indentifikasi senyawa yang pernah diketahui dan sebagai sumber informasi struktur dan bobot molekul senyawa baru (Gritter, 1991).
a. Spektrum Massa
Spektrum massa biasa diambil pada energi berkas elektron sebesar 70 elektron volt. Kejadian tersederhana ialah tercampaknya satu elektron dari molekul dalam fasa gas oleh sebuah elektron dalam berkas elektron dan membentuk suatu ion molekul yang merupakan suatu kation radikal (M+).
dasar (base peak), dinyatakan dengan nilai 100% dan kekuatan (tinggi x faktor kepekaan) puncak-puncak lain, termasuk puncakion molekulnya, dinyatakan sebagai persentasi puncak dasar tersebut.
b. Penentuan Rumus Molekul
Penentuan rumus molekul yang mungkin dari kekuatan puncak isotop hanya dapat dilakukan jika puncak ion molekul dimaksud cukup kuat hingga puncak tersebut dapat diukur dengan cermat sekali.
Misalnya suatu senyawa mengandung 1 atom karbon. Maka untuk tiap 100 molekul yang mengandung satu atom C, sekitar 1,08% molekul mengandung satu atom C. karenanya molekul-molekul ini akan menghasilkan sebuah puncak M + 1 yang besarnya 1,08% kuat puncak ion molekulnya; sedangkan atom-atom H yang ada akan memberikan sumbangan tambahan yang amat lemah pada puncak M + 1 itu. Jika suatu senyawa mengandung sebuah atom sulfur, puncak M + 2 akan menjadi 4,4% puncak
induk.
c. Pengenalan Puncak Ion Molekul
Ada dua yang menyulitkan pengidentifikasian puncak ion molekul yaitu :
1. Ion molekul tidak nampak atau amat lemah. Cara penanggulangannya ialah mengambil spektrum pada kepekaan maksimum, jika belum diketahui dengan jelas dapat juga dilihat berdasarkan pola pecahnya.
2. Ion molekul nampak tetapi cukup membingungkan karena terdapatnya beberapa puncak yang sama atau lebih menonjol. Dalam keadaan demikian, pertama-tama soal kemurnian harus dipertanyakan.Jika senyawa memang sudah murni, masalah yang lazim ialah membedakan puncak ion molekul dari puncak M-1 yang lebih menonjol. Satu cara yang bagus ialah dengan mengurangi energi electron penembak mendekati puncak penampilan. Kuat puncak ion molekul pada kemantapan ion molekul.Ion-ion molekul paling mantap adalah dari sistem aromatik murni. Secara umum golongan senyawa-senyawa
nitril dan pada senyawa-senyawa bercabang.Puncak-puncak dalam arah M-3 sampai M-14 menunjukkan kemungkinan adanya kontaminasi.
d. Kaidah Umum Untuk Mengenali Puncak-Puncak Dalam Spektra
Sejumlah kaidah umum mengenali puncak-puncak dipahami dengan memakai konsep-konsep baku kimia organik fisik
1.Tinggi nisbi puncak ion molekul terbesar bagi senyawa rantai lurus dan akan menurun jika derajat percabangannya bertambah.
2.Tinggi nisbi puncak ion molekul biasanya makin kecil dengan bertambahnya bobot molekul deret homolog; kecuali untuk ester lemak.
3.Pemecahan/pemutusan cendrung terjadi pada karbon tergantu gugus alkil : makin terganti gugus, makin mudah terputus. Hal ini merupakan akibat lebih mantapnya karboksasi tersier daripada sekunder yang lebih mantap daripada yang primer.
4.Adanya ikatan rangkap, struktur lingkar dan terlebih-lebih cincin aromatik (atau
heteroatom) memantapkan ion molekul hingga meningkatkan pembentukannya. 5.Ikatan rangkap mendukung pemecahan adil dan menghasilkan ion karbonium alil. 6.Cincin jenuh cendrung melepas rantai, samping pada ikatan-α. Hal ini tidak lain
daripada kejadian khusus percabangan. Muatan positif cendrung menyertai sibir cincin.Cincin tak jenuh dapat mengalami reaksi retro Diels-Alder.
7.Dalam senyawa aromatik terganti gugus alkil, pemecahan paling mungkin terjadi pada ikatan berloka beta terhadap cincin menghasilkan ion benzil talunan termantapkan atau ion tropilium.
8.Ikatan C-C yang bersebelahan dengan netroatom cenderung terpecah, meninggalkan muatan pada sibiran yang mengandung heteroatom yang elektron tak-ikatannya menciptakan kemantapan talunan.
9.Pemecahan sering berkaitan dengan penyingkiran molekul netral mantap yang kecil, misalnya karbon monoksida, olefin, amonia, hidrogen sulfida, hidrogen sianida, merkaptan, ketena atau alkohol (Siverstein, dkk, 1981).
Antibakteri atau antimikroba adalah bahan yang dapat membunuh atau menghambat aktivitas mikroorganisme dengan bermacam-macam cara. Senyawa antimikroba terdiri atas beberapa kelompok berdasarkan mekanisme daya kerjanya atau tujuan penggunaannya. Bahan antimikroba dapat secara fisik atau kimia dan berdasarkan peruntukannya dapat berupa desinfektan, antiseptik, sterilizer, sanitizer dan sebagainya. (Lucia,W.M,1996)
Bahan kimia yang digunakan dalam pengobatan dalam pengobatan (kemoterapeutik) menjadi pilihan bila dapat mematikan dan bukan hanya menghambat pertumbuhan mikroorganisme. Bahan kimia yang mematikan bakteri disebut bakterisidal, sedangkan bahan kimia yang menghambat pertumbuhan disebut bakteriostatik. Bahan antimikrobial dapat bersifat bakteriostatik pada konsentrasi rendah, namun bersifat bakterisidal pada konsentrasi tinggi. (Lay,W.B,1994)
2.7 Mekanisme Antimikroba
Aktivitas antimikroba suatu senyawa kimia ditentukan oleh konsentrasi dan sifat dari bahan yang digunakan. Umumnya hampir semua senyawa kimia pada konsentrasi yang sangat tinggi dapat bersifat racun. Zat antimikroba melakukan aktivitasnya melalui beberapa mekanisme (Tjay & Rahardja, 2002) yaitu:
1. Mengganggu sintesis dinding sel
Sintesis dinding sel bakteri dapat diganggu zat antibakteri, sehingga dinding sel yang terbentuk menjadi kurang sempurna dan tidak tahan terhadap tekanan osmotis, sehingga menyebabkan pecahnya sel.
2. Mengganggu sintesis membran sel
Sintesis molekul lipoprotein membran sel bakteri dapat diganggu zat antibakteri, sehingga membran menjadi lebih permeabel yang menyebabkan keluarnya zat-zat penting dari sel.
3. Mengganggu sintesis protein sel
4. Mengganggu sintesis asam nukleat 5. Antagonisme saingan
Aktivitas anti mikroba yang dapat diamati secara langsung adalah perkembang biakannya. Oleh karena itu mikroba disebut mati jika tidak dapat berkembang biak.
2.8 Amoksisilin
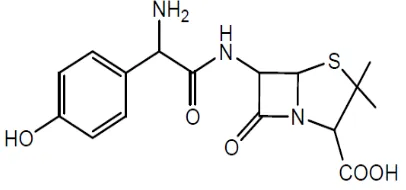
Amoksisilin merupakan salah satu antibiotik sintetik turunan penisilin yang memiliki spektrum luas dimana aktif terhadap bakteri gram positif maupun gram negatif. Stuktur kimia amoksisilin ditunjukkan pada gambar 2.4
Gambar 2.6 Stuktur kimia amoksisilin
Amoksisilin merupakan antibiotik yang tahan terhadap asam tetapi tidak tahan terhadap penisilinase. Beberapa keuntungan penggunaan amoksisilin dibanding ampisilin adalah absorpsi obat dalam saluran cerna lebih sempurna, sehingga kadar amoksisilin dalam darah lebih tinggi. Amoksisilin sering digunakan untuk pengobatan infeksi saluran pernafasan, saluran empedu, meningitis dan infeksi karena Salmonella
sp, seperti demam tipoid. Efek terhadap Bacillus dysentery lebih rendah dibanding ampisilin karena lebih banyak obat yang diabsorpsi oleh saluran cerna (Siswandono dan Soekardjo, 2000). Difusi amoksisilin ke jaringan-jaringan dan cairan-cairan tubuh lebih baik. Amoksisilin dapat pula menyebabkan gangguan-gangguan usus dan kulit tetapi lebih jarang daripada ampisilin (Tjay dan Rahardja, 2002).
sehingga mencegah pembentukan dinding sel bakteri (Siswandono dan Soekardjo, 2000).
2.9 Daya Kerja Antimikrobial
Ditemukan oleh Joseph Lister pada tahun 1817 dengan menggunakan disinfektan yang mengandung persenyawaan fenol, yaitu asam karbol untuk medisinfeksi peralatan bedahnya. Sampai sekarang pun, fenol digunakan sebagai larutan baku penentu keampuhan disinfektan.
Berbagai faktor yang mempengaruhi penghambatan mikroorganisme mencakup kepadatan populasi mikroorganisme, kepekaan terhadap bahan antimikrobial, volume bahan yang disterilkan, lamanya bahan antimikrobial diaplikasikan pada mikroorganisme, konsentrasi bahan antimikrobial, suhu dan kandungan komponen bahan organik. Protein akan mengurangi daya kerjadisinfektan; sedangkan panas
mempercepat daya kerjanya. Daya kerja disinfektan terhadap bakteri pembentuk spora dan Mycobacterium kurang baik.
Untuk membandingkan kekuatan disinfektan dalam menghambat pertumbuhan bakteri dapat digunakan kertas cakram . Pada cara ini kertas cakram dengan diameter tertentu dibasahi dengan disinfektan, kemudian diletakkan pada Lempengan agar yang telah di inokulasi selama 18 - 48 jam. Jika disinfektan menghambat pertumbuhan bakteri makaterlihat daerah jernih / bening disekitar kertas cakram (sumuran). Luas daerah terang ini menjadi ukuran kekutan daya kerja disinfektan.
Daya kerja antimikrobial bahan kimia seringkali disetarakan dengan fenol. Kemampuan bahan kimia dibandingkan dengan fenol disebut koefisien fenol. Nilai ini diperoleh dengan membagi pengenceran tertinggi bahan kimia yang mematikan mikroorganisme dalam waktu 10 menit, namun tidak mematikan dalam waktu 5 menit. Bahan kimia yang memiliki koefisien lebih dari 1 mempunyai daya kerja antimikrobial lebih baik dibandingkan fenol.
hambat yang dihasilkan oleh suatu senyawa yang dapat membunuh atau menghambat pertumbuhan mikroorganisme pada kosentrasi tertentu. Dapat digunakan rumus sebagai berikut :
Diameter Zona hambat (mm) – Diameter Cakram (mm) Indeks Antimikrobial =
Diameter Cakram (mm)
2.10 Jenis Bakteri yang diuji
Senyawa antimikroba terdiri atas beberapa kelompok berdasarkan mekanisme daya kerjanya atau tujuan penggunaannya. Bahan antimikroba dapat secara fisik atau kimia dan berdasarkan peruntukannya dapat berupa desinfektan, antiseptik, sterilizer, sanitizer dan sebagainya. (Lucia,W.M,1996)
Bakteri merupakan mikroba prokariotik uniseluler, berkembang biak secara aseksual dengan pembelahan sel. Semua bakteri memiliki struktur sel yang relatif
sederhana. Berdasarkan komposisi dan struktur dinding sel, maka bakteri dibagi ke dalam dua golongan yaitu bakteri gram positif dan bakteri gram negatif. Bakteri gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan yang tebal dan asam teikoat yang mengandung alkohol (gliserol atau ribitol). Ada dua asam teikoat, yaitu asam lipoteikoat yang merentang di lapisan peptidiglikon dan terikat pada membran plasma, dan asam teikoat dinding yang terikat pada lapisan peptidiglikon. Sedangkan dinding sel bakteri gram negatif mengandung satu atau beberapa lapis peptidoglikan dan membaran luar (outer membrane). Peptidoglikan terikat pada membran luar dan periplasma terdapat diantara membran plasma dan membran luar (Pratiwi, 2008).
Bakteri adalah mikroorganisme bersel satu dan berkembang biak dengan membelah diri. Ukuran bakteri bervariasi baik penampang maupun panjangnya, tetapi pada umumnya penampang bakteri adalah sekitar 0,7-1,5 μm dan panjangnya sekitar 1-6μm. Bentuk bakteri dibagi menjadi 3 yaitu:
Bakteri ada yang berbentuk sferis atau bulat, seperti ada yang ditemukan pada genus Staphylococcus, Streptococcus, Neisseria dan lain-lain
2. Batang (basil)
Bakteri yang berbentuk batang lurus seperti Escherichia coli, Salmonella typhi, Klebsiella pneumoniae maupun famili Bacillaceae seperti genus Clostridium dan genus Bacillus yaitu Bacillus anthracis penyebab penyakit anthraks. Selain bentuk batang lurus, dijumpai pula bentuk batang bengkok misalnya pada bakteri Vibrio cholera penyebab penyakit cholera.
3. Spiral
Bakteri berbentuk spiral dijumpai pada penyebab penyakit sifilis yaitu Treponema pallidum, bakteri penyebab demam bolak-balik yaitu Borelia reccurentis. (Tim Mikrobiologi, Fakultas Kedokteran Universitas Brawijaya,2003)
Bakteri dibagi dalam golongan gram positif dan gram negatif berdasarkan
reaksinya terhadap pewarnaan gram. Perbedaan antara bakteri gram positif dan gram negatif. diperlihatkan dari perbedaan dinding sel.
Perbedaan penyusun dinding sel antara bakteri gram positif dan gram negatif dapat dilihat pada tabel 2.5 dibawah ini :
Tabel 2.2 perbedaan Bakteri gram positif dan Bakteri gram Negatif
Gram positif Gram negatif
Ketebalan 15-23 nm 10-15 nm
Asam teikoat Ada Tidak ada
Sifat tahan asam Ada yang tahan Tidak ada yang tahan
Variasi asam amino Sedikit Beberapa
Gupta, 1990
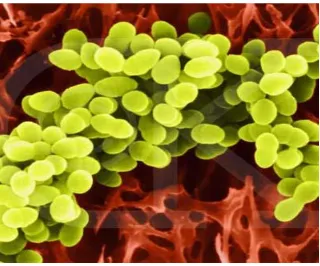
2.10.1 Stapylococcus aureus
S. aureus adalah bakteri gram positif, bersifat aerob atau anaerob fakultatif, serta tahan
Gambar 2.7 Bakteri S. aureus Klasifikasi Staphylococcus aureus : Divisio : Protophyta
Class : Schizomycetes Ordo : Eubacteriales Famili : Micrococcaceae Genus : Staphylococcus
Spesies : Stapylococcus aureus (Salle, 1961)
Untuk membiakkan Staphylococcus diperlukan suhu optimal antara 28-38oC atau
sekitar 350C. Apabila bakteri tersebut diisolasi dari seorang penderita, suhu optimal yang diperlukan adalah 370C. pH optimal untuk pertumbuhan dalah 7,4. Pada umumnya S.aureus dapat tumbuh pada medium yang biasa dipakai di Laboratorium bakteriologi (Tim Mikrobiologi Fakultas Kedokteran Universitas Brawijaya,2003)
Tes koagulase digunakan untuk membedakan S. aureus (koagulase positif) dengan Staphylococcus lainnya. Medium khusus, seperti agar garam manitol dapat digunakan untuk membiakkannya dan pada media ini akan membentuk koloni berwarna kuning.
2.10.2 Escherichia coli
E. coli merupakan bakteri gram negatif, bersifat aerobik dan anaerobik fakultatif, sering dijumpai didalam usus bagian bawah.(Pelczar,M,1988). E.coli bisa tumbuh dengan baik pada media yang lazim digunakan di Laboratorium Mikrobiologi. Memberikan hasil positif pada tes indol, lisin-dekarboksilase dan fermentasi manitol serta memproduksi gas dari glukosa
Gambar 2.8 Bakteri E. coli
Klasifikasi Escherichia coli : Divisio : Protophyta
Kelas : Shizomycetes Ordo : Eubacteriaceae Famili : Enterobacteriaceae Suku : Escherichiaeae Genus : Escherichia
Spesies : Escherichia coli (Salle, 1961)
elektrolit dalam membran mucus. Hal ini dapat menyebabkan penyerapan air pada dinding usus berkurang dan terjadi diare. (http://forum.upi.edu/)
2.10.3 Salmonela Typhi
S.typhi berbentuk batang lurus dengan ukuran 1-3,5 μm x 0,5-0,8 μm, merupakan bakteri garam negatif, tidak berspora, dan mempunyai flagel peritrikh. Bakteri ini tumbuh pada suasana aerob dan fakultatif anaerob, pada suhu 15-41oC (suhu pertumbuhan optimum 37,5oC) dan pH pertumbuhan 6-8. Dapat mati pada suhu 56 oC juga pada keadaan kering sedangkan dalam lingkungan air dapat bertahan selama 4 minggu (Syahruracman et al.,1994).
Gambar 2.9 S. typhi
Klasifikasi Salmonella typhi adalah sebagai berikut: Divisi : Protophyta
Kelas : Schizomycetes Ordo : Eubacteriales
Famili : Enterobacteriaceae Genus : Salmonellae
Spesies : Salmonella thypi (Salle, 1961)
S. typhi kerap kali patogen terhadap manusia atau binatang apabila masuk melalui mulut, ditularkan dari binatang dan produk binatang kepada manusia sehingga
yang lebih dari 7 hari, gangguan pada saluran pencernaan dengan atau tanpa gangguan kesadaran (Jawetz et al., 1986).
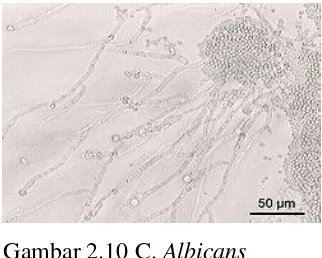
2.10.4 Candida Albicans
Gambar 2.10 C. Albicans
C. Albicans adalah spesies cendawan patogen dari golongan deuteromycota. Spesies cendawan ini merupakan penyebab infeksi oportunistik yang disebut kandidiasis pada kulit, mukosa, dan organ dalam manusia. Beberapa karakteristik dari spesies ini adalah berbentuk seperti telur (ovoid) atau sferis dengan diameter 3-5 µm
dan dapat memproduksi pseudohifa. Spesies C. albicans memiliki dua jenis morfologi, yaitu bentuk seperti khamir dan bentuk hifa. Selain itu, fenotipe atau penampakan mikroorganisme ini juga dapat berubah dari berwarna putih dan rata menjadi kerut tidak beraturan, berbentuk bintang, lingkaran, bentuk seperti topi, dan tidak tembus cahaya. Cendawan ini memiliki kemampuan untuk menempel pada sel inang dan melakukan kolonisasi.
berukuran mikroskopik, dan menyebabkan racun, partikel makanan yang tidak tercerna, serta bakteri dan khamir dapat masuk ke alam aliran darah.
Kondisi tersebut disebut sebagai sindrom kebocoran usus (leaky gut syndrome). Kebocoran pada dinding usus akan menyebabkan khamir seperti Candida dapat menyebar ke berbagai bagian tubuh, seperti mulut, sinus, tenggorokan, saluran reproduksi, jantung, dan kulit.
2.11 Antioksidan
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat diredam (Suhartono et al., 2002). Berdasarkan sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan alami dan antioksidan buatan (sintetik) (Dalimartha dan Soedibyo, 1999). Tubuh manusia tidak mempunyai cadangan antioksidan dalam jumlah berlebih,
sehingga jika terdapat radikal berlebih dalam tubuh maka tubuh membutuhkan antioksidan eksogen atau tambahan antioksidan dari luar tubuh. Adanya kekhawatiran akan kemungkinan efek samping yang belum diketahui dari antioksidan sintetik menyebabkan antioksidan alami menjadi alternatif yang sangat dibutuhkan (Rohdiana, 2001 dan Sunarni, 2005).
Protein lipida dan DNA dari sel manusia yang sehat merupakan sumber pasangan elektron yang baik. Kondisi oksidasi dapat menyebabkan kerusakan protein dan DNA, kanker, penuaan, dan penyakit lainnya. Komponen kimia yang berperan sebagai antioksidan adalah senyawa golongan fenolik dan polifenolik. Senyawa-senyawa golongan tersebut banyak terdapat dialam, terutama pada tumbuh-tumbuhan, dan memiliki kemampuan untuk menangkap radikal bebas. Antioksidan yang banyak ditemukan pada bahan pangan, antara lain vitamin E, vitamin C, dan karotenoid.
2.12 Sumber antioksidan
endogen tidak cukup mampu mengatasi stres oksidatif yang berlebihan. Stres oksidatif merupakan keadaan saat mekanisme antioksidan tidak cukup untuk memecah spesi oksigen reaktif. Oleh karena itu, diperlukan antioksidan dari luar (eksogen) untuk mengatasinya.
Ada dua macam antioksidan berdasarkan sumbernya, yaitu antioksidan alami dan antioksidan sintetik . Antioksidan alami biasanya lebih diminati, karena tingkat keamanan yang lebih baik dan manfaatnya yang lebih luas dibidang makanan, kesehatan dan kosmetik. Antioksidan alami dapat ditemukan pada sayuran, buah-buahan, dan tumbuhan berkayu. Metabolit sekunder dalam tumbuhan yang berasal dari golongan alkaloid, flavonoid, saponin, kuinon, tanin, steroid/ triterpenoid. Uji aktivitas antioksidan yang dilakukan pada daun “Ipomea pescaprae” menunjukkan keberadaan senyawa kuinon, kumarin, dan furanokumarin. Sementara itu, Iwalokum “et al”.(2007)menyatakan bahwa “Pleurotus ostreatus” yang mengandung triterpenoid, tanin, dan sterois glikosida dapat berperan sebagai antioksidan dan antimikroba.
Berdasarkan mekanisme kerjanya, antioksidan dibedakan antioksidan primer yang dapat bereaksi dengan radikal bebas atau mengubahnya menjadi produk yang stabil , dan antioksidan sekunder atau antioksidan preventif yang dapat mengurangi laju awal reaksi rantai serta antioksidan tersier. Mekanisme kerja antioksidan selular menurut Ong et al. (1995) antara lain, antioksidan yang berinteraksi langsung dengan oksidan, radikal bebas, atau oksigen tunggal; mencegah pembentukan jenis oksigen reaktif; mengubah jenis oksigen rekatif menjadi kurang toksik; mencegah kemampuan oksigen reaktif; dan memperbaiki kerusakan yang timbul.
Antioksidan primer berperan untuk mencegah pembentukan radikal bebas baru dengan memutus reaksi berantai dan mengubahnya menjadi produk yang lebih stabil. Contoh antioksidan primer, ialah enzim superoksida dimustase (SOD), katalase, dan glutation dimustase.
Antioksidan tersier berfungsi memperbaiki kerusakan sel dan jaringan yang disebabkan oleh radikal bebas. Contohnya yaitu enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksida reduktase.
Antioksidan menghambat pembentukan radikal bebas dengan bertindak sebagai donor H terhadap radikal bebas sehingga radikal bebas berubah menjadi bentuk yang lebih stabil (Aini, 2007). Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan radikal bebas, menghambat terjadinya penyakit degeneratif dan menghambat peroksidase lipid pada makanan. Meningkatnya minat untuk mendapatkan antioksidan alami terjadi beberapa tahun terakhir ini. Antioksidan alami umumnya mempunyai gugus hidroksi dalam struktur molekulnya (Sunarni, 2005). Struktur molekul senyawa radikal bebas DPPH (diphenylpicrylhidrazyl) sebelum dan sesudah berikatan dengan elektron dari senyawa lain dapat dilihat di Gambar :