SINTESIS FASE DIAM SELULOSA-g-AAM DENGAN BERBAGAI
KADAR PENAUT-SILANG SEBAGAI MEDIA SEPARATOR
XANTORIZOL DARI EKSTRAK TEMU LAWAK
RAISSA LARASATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2012
ABSTRAK
RAISSA LARASATI. Sintesis Fase Diam Selulosa-g-AAm dengan Berbagai
Kadar Penaut-silang sebagai Media Separator Xantorizol dari Ekstrak Temu
Lawak. Dibimbing oleh HENNY PURWANINGSIH dan MOHAMMAD
KHOTIB.
Potensi jerami di Indonesia sangat besar dan kandungan selulosanya dapat
dimodifikasi untuk mengubah sifat-sifatnya. Salah satu modifikasi ialah melalui
metode pencangkokan-penaut-silang. Produk yang dihasilkan akan memiliki
struktur makromolekul yang dapat diaplikasikan dalam teknologi pemisahan.
Penelitian ini dibagi menjadi 3 tahap. Tahap pertama adalah isolasi selulosa,
kedua adalah sintesis kopolimer dengan beragam penaut-silang (0.1, 0.5, dan 1.0
g), dan yang terakhir adalah aplikasi produk sebagai media separator.
Keberhasilan proses isolasi selulosa ditandai dengan sisa lignin sebesar 0.81% dan
kadar selulosa-α yang meningkat sebesar 31.22%. Proses
pencangkokan-penaut-silang dicirikan dengan kenaikan kadar N dan penurunan kapasitas absorpsi air
seiring dengan meningkatnya jumlah penaut-silang. Analisis gugus fungsi dengan
spektrum inframerah transformasi Fourier menunjukkan pita serapan khas C═O
amida pada bilangan gelombang 1674 cm
-1. Ketiga selulosa-g-AAm pada
kromatografi kolom digunakan untuk memisahkan xantorizol dari ekstrak kasar
temu lawak. Identifikasi hasil dengan kromatografi lapis tipis menunjukkan
bahwa xantorizol selalu berada pada fraksi heksana. Ketiga sampel kopolimer
menunjukkan kinerja pemisahan yang cenderung serupa. Ketiga sampel juga
dapat digunakan dua kali untuk proses pemisahan.
ABSTRACT
RAISSA LARASATI. Synthesis of Cellulose-g-AAm with Various Amount of
Cross-linker as Separator Media For Xanthorrhizol of Curcuma xanthorrhiza
Extract. Supervised by HENNY PURWANINGSIH and MOHAMMAD
KHOTIB.
Rice straw in Indonesia is abundant and its cellulose can be modified to alter its
characteristic. One of modification is by grafting-cross-linking method. The
products will have a molecular structure that can be applied in separation
technology. This research consists of three stages. The first stage was cellulose
isolation, followed by cellulose-g-acrylamide synthesis at various amount of
cross-linker (0.1, 0.5, and 1.0 g), and the last stage was application of the products
as stationary phase. The success of isolation process was indicated by 0.81%
residual lignin and increasing of alpha cellulose to 31.22%. Grafting-cross-linking
process was indicated by increase of N and decreases of water absorption capacity
in line with the increase of cross-linker amount. Functional group analysis showed
some the characteristic bands, especially in wave number of 1674 cm
-1, showing
C═O of amide. All products were then applied on the column chromatography as
stationary phase for separating xanthorrhizol. Based on thin layer chromatography
profile, xanthorrhizol was always found in hexane fraction. However, all of
copolymer tend to show similar performances. All samples can be reused twice
for separation process.
SINTESIS FASE DIAM SELULOSA-g-AAM DENGAN
BERBAGAI KADAR PENAUT-SILANG SEBAGAI MEDIA
SEPARATOR XANTORIZOL DARI EKSTRAK TEMU
LAWAK
RAISSA LARASATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2012
iii
Pembimbing I,
Dr Henny Purwaningsih Suyuti, MSi
NIP 19741201 200501 2 001
Pembimbing II,
Mohammad Khotib, MSi
NIP 19781018 200701 1 002
Ketua Departemen Kimia,
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Judul Skripsi
: Sintesis Fase Diam Selulosa-g-AAm dengan Berbagai Kadar
Penaut-silang sebagai Media Separator Xantorizol dari
Ekstrak Temu Lawak
Nama
: Raissa Larasati
NIM
: G44070025
Disetujui
Diketahui
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang senantiasa
memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan
karya ilmiah ini sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut
Pertanian Bogor. Shalawat serta salam semoga selalu tercurahkan kepada Nabi
Muhammad SAW dan keluarganya dan semoga kita semua menjadi pengikutnya
hingga akhir zaman.
Penulis mengucapkan terima kasih kepada yang terhormat Ibu Dr Henny
Purwaningsih, MSi selaku pembimbing pertama dan Bapak Mohammad Khotib,
MSi selaku pembimbing kedua atas saran, kritik, dorongan dan bimbingannya
selama penelitian serta dalam penyusunan karya ilmiah ini. Ucapan terima kasih
juga penulis sampaikan kepada Ibu Dr Irmanida Batubara, MSi dan Ibu Dr
Charlena, MSi selaku penguji sidang komprehensif yang telah memberi banyak
saran dan kritik dalam penyusunan karya ilmiah ini. Ucapan terima kasih juga
penulis sampaikan kepada Kepala Laboratorium Kimia Terpadu IPB Dr Zainal
Alim Mas’ud, DEA atas fasilitas yang diberikan kepada penulis selama penelitian.
Terima kasih kepada analis dan pegawai di Laboratorium Kimia Terpadu IPB
(Sarah, Baim, Indah, kak Uud, Pak Pui dan Budi) atas masukan serta bantuan
yang diberikan.
Ucapan terima kasih tak terhingga kepada Ayah dan Ibu, serta Adik-adik
(Annisa Ivanna M dan Annisa Ivanni M) dan keluarga (mama Julica W), serta
Reza Nursyamsi atas doa, kasih sayang, motivasi, dukungan dan bantuan materi.
Selain itu, penulis mengucapkan terima kasih kepada sahabat terbaik yang selalu
memberi semangat, Ika Yuni Andari dan Reisa Astri Kusuma, teman-teman
seperjuangan penelitian di Laboratorium Terpadu (Ujhe, Ria, Siti, Jali, Mia, Riris,
Ina, Karlina dan Bayu) atas kerja sama, kritik dan semangat selama penelitian
serta semua pihak yang telah membantu dalam penyelesaian karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Banyuwangi pada tanggal 26 November 1989 dari
ayah Achmad Adi Bastomi dan ibu Ira Novelia. Penulis merupakan putri Sulung
dari tiga bersaudara.
Tahun 2007 penulis lulus dari SMA Negeri 2 Bondowoso dan pada tahun
yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui Undangan
Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi staf Pengembangan Sumber
Daya Mahasiswa (PSDM) Ikatan Mahasiswa Kimia IPB (IMASIKA) masa
jabatan 2007/2008, penulis juga pernah menjadi asisten praktikum kimia biologis.
Bulan Juli–Agustus 2010 penulis melaksanakan Praktik Lapangan di Badan
Lingkungan Hidup Sumatera Utara dengan judul laporan Analisis COD dan TSS
Limbah Industri Sawit dan Karet.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
METODE ... 1
HASIL DAN PEMBAHASAN ... 4
Isolasi Selulosa Jerami ... 4
Sintesis Selulosa-g-Akrilamida ... 5
Uji Kinerja ... 9
SIMPULAN DAN SARAN ... 11
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 12
vii
DAFTAR GAMBAR
Halaman
1
Perubahan jumlah komponen serat kasar sebelum dan setelah isolasi ... 5
2
Tampilan bentuk dan warna jerami ... 5
3
Perubahan ukuran pori-pori selulosa-g-AAm ... 7
4
Spektrum FTIR jerami awal ... 8
5
Spektrum FTIR isolat selulosa jerami ... 8
6
Spektrum FTIR kopolimer selulosa-g-AAm jumlah penaut-silang 0.1 g.... 8
7
Data Uji daya tahan pelarut. ... 9
8
Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam
selulosa-g-AAm 0.1 g standar xantorizol ... 9
9
Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam
kolom selulosa-g-AAm 0.1 g, standar kurkuminoid. ... 10
10
Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam
kolom selulosa-g-AAm 0.1 g (reuse) standar xantorizol... 11
DAFTAR TABEL
Halaman
1
Data analisis proksimat jerami ... 4
2
Kadar N selulosa-g-Aam ... 7
3
Data Uji Kapasitas Absorpsi ... 7
DAFTAR LAMPIRAN
Halaman
1
Diagram Alir Penelitian ... 16
2
Reaktor pencangkokan-penaut-silang ... 17
3
Data uji kadar N ... 18
4
Hipotesis reaksi pencangkokan-penaut-silang ... 19
5
Data pengukuran kadar nitrogen, RP dan EP ... 21
6
Data indeks bias uji kapasitas tahan berbagai pelarut. ... 22
7
Gambar-gambar analisis FTIR Selulosa-g-AAm. ... 23
8
Gambar-gambar hasil identifikasi KLT dengan standar xantorizol. ... 24
9
Gambar-gambar hasil identifikasi KLT dengan standar kurkuminoid. ... 25
11
Data R
fKLT ... 27
PENDAHULUAN
Produksi padi menurut data Badan Pusat Statistika (BPS) tahun 2011 sekitar 65.39 juta ton per hektar. Nisbah jerami padi terhadap padi yang dipanen adalah 1.4 (Kim & Dale 2004), artinya total potensi jerami pada tahun 2011 adalah 91.55 juta ton per hektar. Jerami padi merupakan material yang memiliki lignoselulosa. Oleh karena itu jerami padi memiliki prospek yang baik digunakan sebagai bahan baku produk berbasis serat seperti pulp, kertas dan produksi panel. Namun di sejumlah besar daerah di Indonesia, jerami masih dianggap sebagai sampah dan akhirnya hanya dibakar tanpa ada pemanfaatan lebih lanjut.
Kandungan selulosa alfa di dalam jerami, yaitu 37.81% (Kartiwa et al. 2004) dan lignin sebesar 16.62% (Dewi 2002). Selulosa dapat dimanfaatkan oleh berbagai industri, di antaranya adalah industri kertas dan tekstil. Upaya penelitian dalam memanfaatkan selulosa terus dikembangkan. Selulosa dimanfaatkan menjadi etanol melalui hidrolisis dengan asam (H2SO4 atau HCl) dan
enzim (Samsuri et al. 2007), juga sebagai produk kompos (Cahaya & Nugroho 2007). Lignin dimanfaatkan sebagai bahan baku pembuatan surfaktan melalui reaksi sulfonasi lignin dengan bantuan larutan NaHSO3
(Iskandar et al. 2009).
Berbagai penelitian untuk meningkatkan nilai mutu selulosa terus dikembangkan. Salah satunya sebagai media separator (fase diam kromatografi). Mayer et al. (2000) menggunakan fase diam selulosa untuk memisahkan enantiomer dengan elektrokromatografi. Fase diam selulosa juga dapat digunakan untuk KLT, Irawan (2000) telah menggunakannya untuk pemisahan senyawa flavonoid dari ekstrak kulit buah Citrus aurantifolia.
Media separator juga dapat berasal dari polimer sintetis. Lozinsky (2004) menggunakan polimer cryogel polivinil alkohol untuk imobilisasi molekul dan sel. Trifenilmetil metakrilat juga dapat digunakan sebagai fase diam HPLC untuk memisahkan senyawa kiral (Nakano 2001).
Modifikasi selulosa juga dapat digunakan sebagai fase diam. Lestari (2010) dan Cahyani (2010) telah memodifikasi selulosa menjadi selulosa asetat dan menggunakannya sebagai media separator pada kromatografi kolom untuk memisahkan senyawa kurkuminoid dari ekstrak temu lawak.
Penelitian yang dilaksanakan di Laboratorium Kimia Terpadu Institut Pertanian Bogor ini bertujuan menggabungkan selulosa dan monomer akrilamida (AAm) dengan teknik pencangkokan-penaut-silang menggunakan inisiator amonium persulfat (APS) dan variasi kadar penaut-silang N,N’-metilena-bis-akrilamida (MBA) yang akan digunakan sebagai fase diam kromatografi kolom.
Temu lawak merupakan salah satu jenis tanaman obat yang potensial untuk dikembangkan.Bagian yang berkhasiat dari temu lawak adalah rimpangnya yang mengandung berbagai komponen kimia, di antaranya zat kuning kurkumin, protein, patidan minyak atsiri (Hadipoentyanti & Syahid 2007).
Kurkuminoid merupakan senyawa fenolik yang terdiri atas kurkumin, demetoksi kurkumin, dan bisdemetoksikurkumin (Paramasivam et al. 2008). Kurkuminoid adalah senyawa aktif utama yang bersifat inflamasi, mikroba, kanker, anti-tumor dan dapat menyembuhkan luka (Gupta et al. 1999).
Xantorizol yang merupakan komponen khas minyak atsiri esensial temu lawak termasuk ke dalam kelompok seskuiterpen (Aguilar et al. 2001). Xantorizol bermanfaat sebagai antiinflamasi dan antikarsinogenik pada kulit tikus (Chung et al. 2000), antibakteri (Hwang et al. 2000) dan inhibitor sel kanker payudara (Yew et al. 2009).
Senyawa xantorizol sangat sulit didapatkan, sehingga harganya sangat mahal.Kopolimer selulosa-g-AAm yang dihasilkan akan diaplikasikan sebagai media separasi senyawa aktif temu lawak (kurkuminoid dan xantorizol) dengan kromatografi kolom dan identifikasi hasil fraksinasi kolom dengan kromatografi lapis tipis.
METODE
Alat dan BahanAlat-alat yang digunakan adalah radas kromatografi kolom, radas kromatografi lapis tipis (KLT), spektrofotometer FTIR Prestige-21 Shimadzu (Lab. Terpadu, IPB) dan SEM (Puslitbang Hutan, Bogor).
Bahan-bahan yang digunakan adalah jerami padi Mageni (Dramaga, Bogor), temu lawak (Pusat Studi Biofarmaka, IPB), standar kurkuminoid dan xantorizol (Pusat Studi Biofarmaka, IPB) dan lempeng KLTsilika gel GF 254 (Merck). Pereaksi yang digunakan
adalah, Akrilamida, APS, MBA, HCl, asam asetat glasial, NaOH, H2O2, asam borat,
H2SO4 pekat, aseton, n-heksana, etil asetat,
kloroform, metanol, etanol dan toluena (semua berasal dari Merck).
Lingkup Kerja
Metode penelitian ini diringkaskan dalam diagram alir (Lampiran 1).
Preparasi Jerami
Jerami digiling di Balai Penelitian Tanaman Obat dan Aromatik (BALITRO) lalu diayak dengan saringan 40 mesh, hingga terpisah dari bagian berseratnya. Sampel ini dianalisis proksimat. Sebanyak 50 gram bagian tepung ditambahkan 1000 mL HCl 3%, kemudian dipanaskan pada suhu 65-70 °C dan diaduk dengan pengaduk magnet selama 1 jam. Campuran kemudian disaring dan dicuci hingga bebas asam. Residu kemudian dikeringkan pada suhu 50 °C hingga bobotnya konstan. Contoh tersebut bebas dari mineral-mineral dan polisakarida yang larut dalam asam (A1).
Isolasi Selulosa Jerami
Tahapan isolasi selulosa dari jerami ini meliputi 2 tahap, yaitu pulping dan delignifikasi.
Pulping Jerami (Modifikasi Guolin et al. 2007 dan Bhattacharya et al. 2008)
Sebanyak 50 gram A1 ditambahkan
dengan 1000mL NaOH 20%, kemudian campuran dipanaskan dan diaduk dengan pengaduk pada suhu 70-80°C selama 3 jam. Campuran kemudian disaring dan endapannya dicuci dengan akuades hingga bebas basa. Residu kemudian dikeringkan pada suhu 50°C hingga bobotnya konstan (A2).
Delignifikasi Jerami (Modifikasi Sun et al. 2004)
Sebanyak 20 gram A2 ditambahkan
dengan 500 mL H2O2 5% pH 12. Campuran
tersebut dipanaskan selama 2 jam dengan suhu 70-85 °C. Setelah itu diangkat dan dicuci hingga bebas basa. Pemanasan diulangi dua kali dengan waktu 2 jam dan 3 jam. Setelah dicuci dan bebas basa, residu dikeringkan pada suhu 50 °C hingga bobotnya konstan. Setelah kering, hasilnya digiling hingga didapatkan serbuk halus yang mirip kapas (A3). A3 disebut sebagai selulosa jerami.
Analisis FTIR dan analisis serat kasar dilakukan pada A3.
Analisis Komponen Serat Kasar
Komponen serat kasar meliputi holoselulosa, hemiselulosa, selulosa alfa, dan lignin. Analisis komposisi holoselulosa, selulosa alfa dan lignin dilakukan dengan uji laboratorium, sedangkan komposisi hemiselulosa dapat diketahui dengan perhitungan.
Komposisi hemiselulosa (%) adalah komposisi holoselulosa (%) dikurangi dengan komposisi selulosa alfa (%).
Analisis Komponen Holoselulosa Berdasarkan SNI 01-1303-1989 (BSN 1989)
Sebanyak 2 gram sampel yang telah dikeringkan di oven untuk menghilangkan bahan ekstraktif, diekstraksi dengan alkohol dan benzena. Setelah itu, sampel ditambahkan dengan 150 mL akuades, 0.2 mL asam asetat glasial dan 1 gram NaClO2. Labu kemudian
diletakkan di penangas air dan dipanaskan dengan suhu 70-80°C konstan selama 5 jam. Asam asetat glasial dingin dan 1 gram NaClO2
ditambahkan setiap jam sambil terus dikocok. Setelah 5 jam, labu diletakkan di penangas es hingga suhu turun menjadi 10 °C. Setelah itu, campuran di dalam labu disaring menggunakan vakum dan cawan berpori yang telah ditentukan bobot tetapnya. Residu kemudian dicuci hingga berwarna putih. Cawan berisi sampel dikeringkan di oven hingga bobot tetap.
Analisis Komponen Selulosa Alfa Berdasarkan Standar ASTM 1103-60-1997 (ASTM 1977)
Sebanyak 2 gram sampel holoselulosa yang telah kering dimasukkan ke dalam Erlenmeyer. Suhu dijaga konstan 20 °C dengan bantuan penangas. Sebanyak 50 mL NaOH 17.5% ditambahkan ke dalamnya.
Sampel diaduk selama 1 menit, kemudian didiamkan selama 20 menit. Setelah itu, air suling 50 mL ditambahkan ke dalamnya, kemudian dikocok selama 1 menit dan didiamkan selama 5 menit. Campuran ini kemudian disaring dengan cawan berpori yang sebelumnya telah ditentukan bobot tetapnya.
Residu dicuci dengan NaOH 8.3% dan akuades, setelah itu dengan 40 mL asam asetat glasial 10%. Residu dicuci kembali dengan akuades panas hingga bebas asam. Sampel ini kemudian dikeringkan di oven, dimasukkan ke dalam desikator dan ditimbang hingga diperoleh bobot konstannya.
3
Penetapan Uji Kadar Lignin Berdasarkan SNI 14-0492-1989 (BSN 1989)
Sebanyak 2 gram sampel jerami diekstraksi menggunakan metode soxhletasi dengan alkohol 95% selama 4 jam, setelah itu ekstrak diekstraksi kembali dengan alkohol:benzena (1:2) selama 6 jam. Setelah ekstraksi selesai, pelarut dibuang. Sampel dipindahkan ke gelas piala dan dipanaskan dengan 400 mL air pada suhu 100 °C selama 3 jam. Selanjutnya sampel disaring dan dicuci dengan 100 mL air panas dan dikeringudarakan. Serbuk yang telah kering dipindahkan ke gelas piala kecil dan ditambahkan dengan 72% asam sulfat dingin sebanyak 15 mL secara perlahan-lahan sambil diaduk. Suhu dijaga konstan12-15 °C. Pengadukan dilakukan selama 1 jam. Setelah itu, campuran didiamkan selama 2 jam dengan suhu konstan 18-20 °C. Sampel dipindahkan ke dalam Erlenmeyer dan diencerkan dengan akuades 560 mL, hingga konsentrasinya mencapai 3%. Larutan 3% ini dididihkan di bawah pendingin tegak selama 4 jam dan dijaga agar volume konstan dengan menambahkan air panas sewaktu-waktu. Setelah bahan yang tidak larut mengendap, kemudian disaring dengan cawan penyaring dan dicuci dengan air panas hingga bebas asam. Residu kemudian dikeringkan di oven, didinginkan di desikator dan ditimbang hingga bobot konstan.
Kadar Lignin =
Kopolimerisasi Selulosa dengan Teknik Pencangkokan-Penaut-silang (Modifikasi Nakason et al. 2010)
Sebanyak 15 gram A3 ditambahkan
dengan 150 mL akuades. Campuran dimasukkan ke dalam labu leher tiga yang dilengkapi dengan pengaduk, kondensor, termometer dan saluran nitrogen (Lampiran 2). Cerat kondensor ditutup, kemudian A3
dipanaskan hingga suhu mencapai 95 °C. Setelah mencapai suhu 95 °C, gas nitrogen dialirkan selama 30 menit. Kemudian, suhu diturunkan hingga mencapai 60-65 °C, inisiator APS sebanyak 250 mg yang telah dilarutkan dengan 12.5 mL akuades ditambahkan ke dalamnya. Setelah 15 menit, campuran 25 gram akrilamida, (0.1 g ; 0.5 g ; dan 1 g) MBAdan 200 mL akuades ditambahkan sedikit demi sedikit. Suhu dinaikkan menjadi 70±2 °C dan dijaga konstan selama 3 jam. Hasil sintesis ini berupa gel yang selanjutnya dicuci untuk menghilangkan pengotor.
Pencucian Gel (Modifikasi Liang et al. 2009)
Gel hasil pencangkokan-penaut-silang didinginkan.Setelah dingin, gel ditambahkan dengan 200 mL metanol p.a dan diaduk selama 30 menit. Selanjutnya, gel ditambahkan 200 mL etanol p.a dan diaduk cepat selama 5 menit, selanjutnya didiamkan selama 30 menit. Gel dan cairan alkohol dipisahkan. Gel yang telah mengeras dipotong kecil-kecil, lalu direfluks dengan 200 mL asetonp.a pada suhu 70 C selama 1 jam. Gel dikeringkan dalam oven pada suhu 60 C hingga mencapai bobot konstan kemudian dihaluskan hingga berukuran 100 mesh.
Pencirian Polimer Selulosa-g-AAm
Polimer selulosa-g-AAm dicirikan untuk mengetahui perubahan sifat fisik dan kimianya. Keberhasilan pencangkokan diketahui dengan menguji kadar N menggunakan metode Kjeldahl, mengetahui rasio serta efisiensi pencangkokan-penaut-silang (RP dan EP) serta dengan analisis gugus fungsi melalui spektrofotometer FTIR, Keberhasilan proses penautan-silang dibuktikan dengan uji Kapasitas absorpsi air dan morfologi permukaan melalui mikroskop elektron payaran(SEM).
Penentuan Kadar Nitrogen dengan Metode Kjeldahl (SNI 01-3751-2006)
Sebanyak 0.1 gram produk hasil modifikasi ditimbang dan dimasukkan ke dalam labu kjeldahl dan dimasukkan selenium sebanyak 2 sudip dan 10 mL H2SO4 pekat,
didestruksi hingga berwarna kehijauan. Setelah itu didestilasi dengan memasukkan sampel ke dalam labu kjeldahl, botol sampel dibilas dengan 150 mL akuades, diikuti dengan penambahan 50 mL NaOH 40%. Sebanyak 20 mL asam borat 2 % dimasukkan ke dalam Erlenmeyer 250 mL yang berisi distilat dan dititrasi dengan HCl 0.1 N. N (%) =( ) ( ) RG= ( ) ( ) ( ) ( ) EG=
Keterangan:
N= Kadar Nitrogen (%) Vs= Volume titran sampel (mL)
Vb= Volume titran blangko (mL)
RG= Rendemen pencangkokan EG= Efisiensi pencangkokan (%)
Pengujian Kapasitas Absorpsi Air (Nakason 2010)
Sebanyak 0.2 g produk hasil modifikasi dimasukkan ke dalam botol dan ditambahkan dengan 100 mL akuades, didiamkan selama 3 24 jam. Setelah itu, disaring hingga benar-benar kering dan ditimbang.
Adsorpsi = W1-W0 x 100%
W0
Keterangan:
W0 : bobot awal polimer (g)
W1 : bobot polimer yang mengembang (g) Ekstraksi Temu Lawak (Santi 2006)
Serbuk temu lawak yang telah halus kemudian dimaserasi menggunakan pelarut etanol dengan nisbah bahan dan pelarut 1:3 selama 3×24 jam. maserasi dihentikan dan selanjutnya maserat disaring menggunakan kertas saring dan dipekatkan dengan penguap putar (rotavapor) pada suhu 40 °C. Residu yang diperoleh merupakan ekstrak etanol temu lawak.
Uji Kapasitas Tahan Terhadap Pelarut
Sebanyak 0.5 g kopolimer selulosa-g-AAm dimasukkan dalam vial 15 mL, ditambahkan masing-masing 10 mL pelarut metanol, etanol, aseton, etil asetat, heksanadan toluena, kemudian didiamkan selama 3×24 jam sambil diaduk. Setelah 3 hari, indeks biasnya diukur menggunakan refraktometer Abbe.
Fraksinasi Ekstrak Temu lawak dengan Kromatografi Kolom
Kolom kromatografi yang berisi 8 g polimer selulosa-g-AAm disiapkan dengan tinggi fase diam di dalam setiap kolom dibuat seragam. Sebanyak 0.25 mL ekstrak kasar temu lawak dielusi eluen dengan laju alir ± 0.5 mL/menit hingga semua fraksi keluar dari kolom. Eluen yang digunakan adalah heksana, campuran heksana:etil asetat (90:10, 75:25, 50:50, 25:75dan 10:90) dan metanol yang selanjutnya disebut dengan eluen pertama, kedua, ketiga, keempat, kelima, keenamdan ketujuh secara berturut-turut. Fraksi yang keluar dari kolom ditampung sebanyak 5 mL di dalam vial.
Identifikasi dengan Kromatografi Lapis Tipis
Fraksi yang diperoleh dari kromatografi kolom, standar kurkuminoid dan standar xantorizol ditotolkan pada lempeng silika gel GF 254 dengan bantuan pipa kapiler lalu dielusi dengan fase gerakheksana:etil asetat (10:1) (xantorizol) dan kloroform:benzena: metanol (80:15:5) (kurkuminoid). Selanjutnya lempeng silika gel dikeringkan dan pola pemisahannya dapat dideteksi dengan sinar UV pada panjang gelombang 254 dan 366 nm.
HASIL DAN PEMBAHASAN
Isolasi Selulosa JeramiJerami memiliki kandungan mineral yang cukup besar. Hal ini dibuktikan dari kadar abu dalam jerami yang cukup tinggi, yaitu 26.92% (Tabel 1). Oleh karena itu, perebusan jerami awal dengan HCl 3% diharapkan dapat melarutkan sebagian besar mineral-mineral dan hemiselulosa di dalamnya (Achmadi 1990). Kandungan serat kasar di dalam jerami juga tinggi, yaitu 57.04%. Oleh karena itu, perlu dilakukan analisis serat kasar lebih lanjut di dalam jerami untuk mengetahui komposisi serat kasar yang ada di dalam jerami tersebut. Data analisis serat kasar jerami sebelum dan sesudah perlakuan disajikan pada Gambar 1.
Tabel 1 Data analisis proksimat jerami
Komponen Kadar (% bobot kering) Air 8.42 Abu 26.92 Lemak 0.58 Protein 9.47 Serat kasar 57.04
Sumber: Laboratorium Terpadu IPB (data yang tidak dipublikasi).
Jerami merupakan material yang mengandung lignoselulosa. Lignin merupakan komponen kimia kayu yang selalu bergabung dengan selulosa dan bukan merupakan karbohidrat, melainkan didominasi oleh gugus aromatis berupa fenilpropana (Wardhani et al. 2004). Kandungan lignin di dalam jerami kering sebesar 32.07% (Gambar 1). Lignin dapat menghambat pembentukan radikal yang diperlukan pada tahap awal pencangkokan selulosa, karena probabilitas lignin menjadi
5
radikal lebih tinggi dibandingkan dengan selulosa.
Sebelum delignifikasi, pulping jerami dilakukan agar delignifikasi berjalan lebih efektif. Pulping bertujuan melarutkan serat dalam jerami, mendegradasi dan melarutkan sebagian besar lignin yang terdapat di dalam dinding serat, serta meninggalkan sebagian besar selulosa dan holoselulosa dalam serat secara utuh. Terdapat 3 proses pulping secara kimia, yaitu proses kraft (sulfat), proses sulfit (asam) dan proses soda (basa). Di dalam penelitian ini, digunakan proses soda dengan larutan NaOH sebagai larutan pemasak. Larutan NaOH (alkali) sangat efektif melarutkan selulosa-β dan selulosa-γ, namun tidak melarutkan selulosa-α (Lumbanbatu 2008). Kemurnian selulosa sering dinyatakan melalui parameter selulosa-α, tetapi selulosa-α bukan selulosa murni, karena masih ada gula lain yang tahan alkali. Selulosa-α inilah yang merupakan target utama dalam proses isolasi selulosa jerami ini. Rendemen proses pulping sebesar 37%.
Umumnya bahan yang digunakan dalam proses delignifikasi adalah senyawa yang mengandung klorin. Bahan yang mengandung klorin ini merupakan bahan yang tidak ramah lingkungan. Oksidasi bahan organik oleh senyawa ini dapat menghasilkan senyawa yang berbahaya seperti kloroform yang bersifat karsinogenik (Fuadi 2008). Bahan lain yang dapat digunakan dalam proses delignifikasi yang lebih ramah lingkungan adalah hidrogen peroksida. Lignin yang terkandung dalam jerami dihilangkan dengan menggunakan larutan hidrogen peroksida (H2O2) 5% pH 12. Hidrogen peroksida
merupakan oksidator ringan yang memiliki efisiensi delignifikasi yang tinggi bila dilakukan pada kondisi basa. Saat kondisi asam, hidrogen peroksida sangat stabil, sedangkan pada kondisi basa, mudah terurai. Hidrogen peroksida akan terurai menjadi anion peroksida dan air. Reaksinya sebagai berikut:
H2O2 + HO- HOO- + H2O
Spesi aktif yang berperan penting dalam penghilangan gugus kromofor lignin adalah anion hidrogen peroksida ( ). Anion yang bersifat nukleofilik kuat ini akan menyerang gugus etilena dan karbonil pada molekul lignin dan mengubahnya menjadi spesi yang tidak mengandung kromofor (Fang et al. 2000). Proses delignifikasi sangat tergantung pada nilai pH. Tahap pertama delignifikasi, pulp jerami masih berwarna putih kekuningan yang artinya proses
delignifikasi belum sempurna. Jerami yang telah melewati tahap kedua memiliki warna yang lebih putih. Hal ini menandakan proses delignifikasi berjalan dengan baik.
Lignin yang tersisa dalam jerami setelah proses delignifikasi sebesar 0.81%,dengan kadar selulosa-α sebesar 65.52% (Gambar 1), Jerami hasil delignifikasi yang telah kering, berbentuk granula putih yang memiliki tekstur mirip kapas. Rendemen proses delignifikasi ini sebesar 50%. Perubahan bentuk visual jerami awal, hasil pulping dan delignifikasi dapat dilihat pada Gambar 2.
Gambar 1 Perubahan jumlah komponen serat kasar jerami sebelum isolasi (■) dan setelah isolasi (■).
1
(a) (b) (c) Gambar 2 Tampilan bentuk dan warna
jerami (jerami awal (a), hasil pulping (b) dan selulosa jerami (c).
Sintesis Selulosa-g-Akrilamida
Kopolimerisasi cangkok merupakan salah satu metode yang paling umum digunakan untuk memodifikasi sifat-sifat kimia dan fisika polimer alami dan sintetik(Chowdhury & Banaerjee 1998 dalam Silvianita et al. 2004).
Teknik cangkok yang paling umum digunakan adalah teknik cangkok secara kimia yang terdiri atas dua cara, yaitu pembentukan radikal bebas dan ionik. Monomer AAm dicangkokkan pada polimer tulang punggung selulosa dengan teknik pembentukan radikal bebas. Selulosa jerami dilarutkan dengan akuades dan dipanaskan dengan suhu 90-95°C agar struktur selulosa mengembang sehingga
memiliki kapasitas serap yang besar terhadap monomer dan inisiator. Setelah mencapai suhu tersebut, gas nitrogen mulai dialirkan, agar kondisi pencangkokan bebas oksigen. Oksigen dapat memicu pembentukan radikal peroksida yang dapat menghambat reaksi kopolimerisasi melalui pembentukan homopolimer (Kurniadi 2010). Inisiator yang digunakan adalah APS. Inisiator merupakan pembentuk radikal bebas yang memicu terjadinya proses polimerisasi (Silvianita et al. 2004). APS dilarutkan dalam air agar molekul APS terdistribusi secara seragam di sekitar substrat selulosa dan dengan adanya pemanasan maka ion persulfat akan terurai membentuk radikal:
S2O82-→2SO4-•
Radikal sulfat (SO4-•) dihasilkan dari
inisiator APS yang terdekomposisi saat pemanasan dengan suhu 60 C (Da Silva et al. 2007). Radikal inilah yang selanjutnya sebagai penginisiasi pembentukan radikal selulosa dengan menyerang atom H pada –OH di posisi C6 yang merupakan sisi paling reaktif
dari selulosa karena halangan sterik yang rendah (Achmadi 1990). Tahap inisiasi rantai polimer menghasilkan makroradikal selulosa. Makroradikal selulosa ini kemudian menyerang ikatan rangkap C=C pada akrilamida membentuk kopolimer selulosa-O-CH-CH•CONH2 yang pada makroradikal
kopolimer tersebut masih terbentuk C•. Radikal C• tersebut akan menyerang gugus C=C pada akrilamida lagi secara kontinyu hingga membentuk rantai cangkok yang panjang. Radikal C• juga dapat menyerang gugus C=C pada penaut-silang MBA hingga terjadi taut-silang diantara kopolimer-kopolimer tersebut. Tahapan propagasi meliputi pertumbuhan rantai polimer akrilamida yang telah tercangkok pada tulang punggung selulosa.
Penggabungan dua cabang yang sedang tumbuh pada dua rantai polimer yang berbeda akan menghasilkan taut-silang (Cowd 1991). Pembentukan taut-silang memerlukan suatu senyawa yang mempunyai minimal dua buah gugus fungsi. Penaut-silang yang digunakan dalam penelitian ini adalah MBA yang memiliki dua buah ikatan rangkap dalam molekulnya sehingga dapat bereaksi dengan rantai polimer akrilamida yang sedang tumbuh dalam tahap propagasi. Penambahan penaut-silang dilakukan dengan tiga variasi jumlah, yaitu 0.1, 0.5 dan 1.0 g. Proses pencangkokan-penaut-silang menghasilkan kopolimer selulosa-g-AAm yang secara visual berbentuk gel dan bersifat kaku. Gel yang dihasilkan
dicuci dengan metanol dan etanol untuk menghilangkan air, lalu direfluks selama 1 jam dengan aseton untuk menghilangkan homopolimer. Mekanisme reaksi kopolimerisasi selulosa-g-AAm dapat dilihat pada Lampiran 4.
Parameter keberhasilan sintesis kopolimer selulosa-g-AAm ini meliputi kadar nitrogen, uji kapasitas absorpsi air, analisis morfologi permukaan dengan SEM dan analisis gugus fungsi dengan FTIR.
Kadar Nitrogen
Kopolimer selulosa-g-akrilamida yang dihasilkan diukur kadar N nya untuk mengetahui efisiensi dan rasio pencangkokan-penaut-silang. Penentuan kadar N menggunakan metode Kjeldahl modifikasi Winkler dengan tahap destruksi, distilasi dan titrasi. Tahap destruksi menggunakan asam sulfat pekat yang berfungsi mendestruksi sampel menjadi unsur-unsurnya yaitu CO, CO2 dan H2O, sedangkan unsur nitrogen akan
berubah menjadi amonium sulfat yang selanjutnya dipecah menjadi NH3 pada tahap
distilasi. NH3 yang terbentuk selanjutnya
ditangkap oleh asam borat dan dititrasi dengan HCl.
Berdasarkan hasil uji kadar N, kadar N meningkat seiring dengan meningkatnya jumlah penaut-silang yang digunakan (Tabel 2). Penaut-silang yang digunakan ialah N,N-metilena-bis-akrilamida yang mengandung gugus N. Hal inilah yang menjadi faktor peningkatan kadar N seiring dengan kenaikan jumlah penaut-silang. Perbedaan kadar N pada ketiga sampel cenderung kecil (Tabel 2) dikarenakan adanya taut-silang antarrantai kopolimer oleh MBA yang juga mengandung atom nitrogen dalam struktur molekulnya. Perhitungan Kadar N sampel dengan penaut-silang 0.1, 0.5 dan 1.0 gram disajikan pada Lampiran 3. Dengan mengetahui kadar N, Rasio dan efisiensi pencangkokan-penaut-silang dapat diketahui.
Rasio Pencangkokan-penaut-silang (RP) adalah persen pencangkokan terhadap jumlah selulosa jerami awal. Efisiensi Pencangkokan-penaut-silang (EP) adalah jumlah monomer AAm yang mengalami pencangkokan terhadap jumlah AAm yang ditambahkan di awal reaksi. Perhitungan nilai RP dan EP (Lampiran 5) didasarkan pada perubahan kadar nitrogen pada sampel kopolimer yang berasal dari monomer AAm dan penaut-silang MBA yang mengandung atom nitrogen pada struktur molekulnya. Penaut-silang yang berjumlah 0.1, 0.5, 1.0 gram memiliki RP
7
berturut-turut sebesar 56.82%, 63.04% dan 69.79% dan EP berturut-turut sebesar 72.27%, 75.67%dan 79.96%.
Nilai RP dan EP yang meningkat menunjukkan bahwa monomer AAm cenderung membentuk kopolimer dengan selulosa jerami dibandingkan membentuk homopolimer poliakrilamida. Sehingga tautan silang semakin banyak. Nilai EP yang kurang dari 100% menunjukkan bahwa jumlah AAm yang digunakan tidak seluruhnya tercangkok pada tulang punggung selulosa. Adanya sejumlah kecil radikal SO4- ∙sisa yang tidak
menghasilkan makroradikal selulosa diduga dapat memengaruhi nilai EP yang kurang dari 100% (Lanthong et al. 2006).
Tabel 2 Kadar N selulosa-g-Aam
Sampel Bobot
penaut-silang (g) Kadar N(%)
1 0.1 7.14
2 0.5 7.56
3 1.0 8.10
Uji Kapasitas Absorpsi Air
Uji kapasitas absorpsi air berhubungan dengan keberhasilan proses penaut-silang dan jumlah penaut-silang yang digunakan. Kopolimer yang tertaut-silang akan menghasilkan polimer yang saling berikatan satu sama lain sehingga membentuk rongga dan dapat menyerap air. Oleh karena itu, dilakukan pengukuran kapasitas serap polimer selulosa-g-AAm terhadap air. Data Kapasitas absorpsi ditampilkan pada Tabel 3.
Penambahan jumlah penaut-silang yang bervariasi akan memengaruhi kapasitas absorpsi kopolimer. Semakin tinggi jumlah penautan-silang maka kapasitas absorpsinya akan menurun walaupun tidak signifikan. Hal ini dikarenakan penaut-silang akan meningkatkan ikatan silang sehingga halangan ruang dan kerapatan ikatan antar rantai kopolimer meningkat, sehingga ukuran porinya menurun (Chauhan & Lal 2003). Tabel 3 Data Uji Kapasitas Absorpsi
Analisis Morfologi Permukaan
Pembentukan rongga-rongga setelah proses pencangkokan dapat dilihat pada Gambar 3. Analisis morfologi permukaan dengan mikroskop elektron payaran (SEM), dapat dilihat bahwa saat jumlah penaut-silang berjumlah 0.1 gram, rongga yang terbentuk sangat lebar, sehingga dapat menyerap air dalam jumlah yang banyak dibandingkan dengan kopolimer selulosa-g-AAm dengan penaut-silang berjumlah 1.0 gram. Semakin banyak penaut-silang, matriks yang terbentuk semakin padat, rongga-rongga yang terbentuk akan semakin kecil dan halangan ruang semakin besar (Gambar 3).Hal tersebut menghambat masuknya air, sehingga terjadi penurunan kapasitas serap air.
Gambar 3 Perubahan ukuran pori-pori selulosa-g-AAm jumlah penaut-silang 0.1 dan 1 gram (perbesaran 500 ).
Analisis Gugus Fungsi dengan FTIR
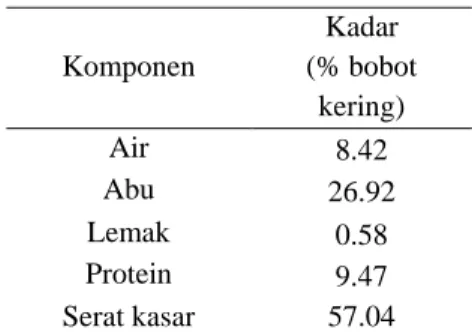
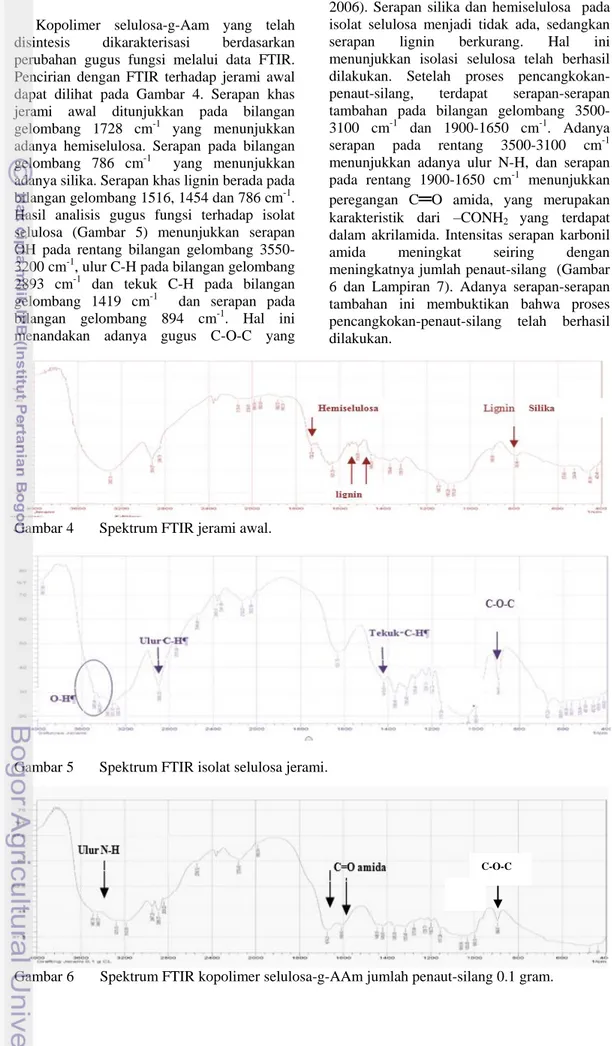
Kopolimer selulosa-g-Aam yang telah disintesis dikarakterisasi berdasarkan perubahan gugus fungsi melalui data FTIR. Pencirian dengan FTIR terhadap jerami awal dapat dilihat pada Gambar 4. Serapan khas jerami awal ditunjukkan pada bilangan gelombang 1728 cm-1 yang menunjukkan adanya hemiselulosa. Serapan pada bilangan gelombang 786 cm-1 yang menunjukkan adanya silika. Serapan khas lignin berada pada bilangan gelombang 1516, 1454 dan 786 cm-1. Hasil analisis gugus fungsi terhadap isolat selulosa (Gambar 5) menunjukkan serapan OH pada rentang bilangan gelombang 3550-3200 cm-1, ulur C-H pada bilangan gelombang 2893 cm-1 dan tekuk C-H pada bilangan gelombang 1419 cm-1 dan serapan pada bilangan gelombang 894 cm-1. Hal ini menandakan adanya gugus C-O-C yang
merupakan ciri dari selulosa (Lanthong et al. 2006). Serapan silika dan hemiselulosa pada isolat selulosa menjadi tidak ada, sedangkan serapan lignin berkurang. Hal ini menunjukkan isolasi selulosa telah berhasil dilakukan. Setelah proses pencangkokan-penaut-silang, terdapat serapan-serapan tambahan pada bilangan gelombang 3500-3100 cm-1 dan 1900-1650 cm-1. Adanya serapan pada rentang 3500-3100 cm-1 menunjukkan adanya ulur N-H, dan serapan pada rentang 1900-1650 cm-1 menunjukkan peregangan C
═
O amida, yang merupakan karakteristik dari –CONH2 yang terdapatdalam akrilamida. Intensitas serapan karbonil amida meningkat seiring dengan meningkatnya jumlah penaut-silang (Gambar 6 dan Lampiran 7). Adanya serapan-serapan tambahan ini membuktikan bahwa proses pencangkokan-penaut-silang telah berhasil dilakukan.
Gambar 4 Spektrum FTIR jerami awal.
Gambar 5 Spektrum FTIR isolat selulosa jerami.
Gambar 6 Spektrum FTIR kopolimer selulosa-g-AAm jumlah penaut-silang 0.1 gram.
9
Uji Kinerja Uji Daya Tahan Terhadap Pelarut
Setelah pencirian, kopolimer selulosa-g-akrilamida ini diuji performanya dengan mengaplikasikannya sebagai fase diam kromatografi kolom sebagai separator xantorizol dari ekstrak temu lawak. Pemisahan ini diawali dengan pemilihan eluen terbaik. Syarat eluen yang baik adalah tidak berinteraksi dengan fase diam yang digunakan. Penentuan ini dilakukan dengan menguji kelarutan kopolimer selulosa-g-AAm dalam beberapa pelarut organik dengan sifat kepolaran berbeda yang umum digunakan sebagai fase gerak pada teknik kromatografi. Eluen yang diujikan adalah metanol, etanol, aseton, etil asetat, heksana dan toluena. Pelarut yang akan digunakan sebagai eluen dalam kromatografi kolom ditentukan oleh perubahan indeks bias larutan dengan refraktometer. Jika indeks bias larutan berubah secara signifikan dibandingkan dengan indeks bias blangko (pelarut tanpa sampel), pelarut tersebut tidak dapat digunakan sebagai eluen karena perubahan indeks bias tersebut mengindikasikan bahwa sebagian kopolimer dapat larut di dalamnya. Hal ini akan mengganggu proses pemisahan di dalam kromatografi kolom. Hasil pengukuran (Lampiran 6) menunjukkan perubahan indeks bias n-heksana, metanol, etanol, toluena, aseton dan etil asetat yang tidak signifikan dibandingkan blangkonya (Gambar 5). Tujuan akhir dari penelitian ini ialah pemisahan xantorizol.
Xantorizol bersifat nonpolar, sehingga dipilih pelarut yang paling nonpolar, semipolar dan sangat polar. Pelarut terbaik yang dipilih ialah n-heksana, etil asetat dan metanol.
Gambar 7 Data Uji daya tahan pelarut. Blangko (■), sampel dan pelarut (■).
Kromatografi Kolom dan Lapis Tipis
Setelah uji daya tahan terhadap pelarut, kopolimer selulosa-g-Aam ini dikemas di dalam kolom. Tinggi kolom yang digunakan
kurang lebih 20 cm dengan pemakaian sekitar 8 g kopolimer selulosa-g-AAm. Kolom dikemas dengan cara basah menggunakan eluen heksana. Cara basah digunakan agar gelembung udara yang terperangkap di dalam fase diam dapat diminimalisir. Gelembung udara dapat menghambat proses pemisahan dan penurunan keseragaman fase diam kolom. Eluen yang digunakan adalah hasil terbaik dari uji daya tahan pelarut, yaitu heksana, etil asetat dan metanol. Gradien eluen digunakan agar diperoleh pemisahan yang baik. Eluen yang digunakan adalah heksana, heksana:etil asetat (90:10, 75:25, 50:50, 25:75, 10:90) dan metanol. Tiap-tiap eluat ditampung dalam vial sebanyak 5 mL.
Pelarut awal yang digunakan ialah pelarut yang bersifat paling nonpolar, yaitu heksana. Sampel ekstrak temu lawak dimasukkan ke dalam kolom, kemudian dielusi. Diharapkan komponen yang bersifat nonpolar di dalam ekstrak temu lawak dapat keluar dahulu mengikuti fase geraknya, sedangkan komponen-komponen yang bersifat polar lebih tertahan di dalam kolom. Sifat senyawa xantorizol yang nonpolar akan mengakibatkan kurangnya interaksi dengan fase diam sehingga elusi menggunakan eluen nonpolar seperti heksana diperkirakan xantorizol muncul di fraksi pertama heksana.
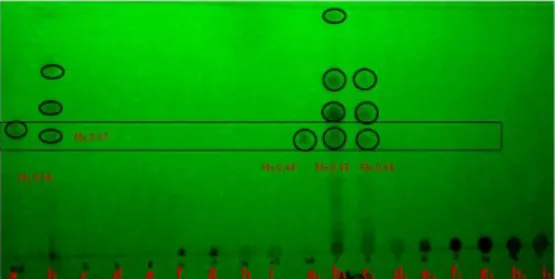
Semua fraksi dari masing-masing eluen pada kromatografi kolom diidentifikasi dengan kromatografi lapis tipis (KLT). Jumlah penotolan dilakukan sebanyak 10 kali pada tiap-tiap fraksi dan standar xantorizol 2.19% diatas pelat Silika Gel GF 254. Berdasarkan hasil elusi ketiga kolom dengan menggunakan eluen heksana:etil asetat (10:1) didapatkan bahwa xantorizol berada pada fraksi heksana, tidak pada fraksi-fraksi yang lain (Gambar 8 dan Lampiran 8).
Gambar 8 Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam kolom selulosa-g-AAm 0.1 g, standar xantorizol, eluen heksana:etil asetat (10:1) dengan sinar UV pada λ= 254 nm.
Keterangan: a: standar xantorizol b: fraksi n-heksana 1 c: fraksi n-heksana 2
d: fraksi n-heksana:etil asetat (90:10) e: fraksi n-heksana:etil asetat (75:25) f: fraksi n-heksana:etil asetat (50:50) g: fraksi n-heksana:etil asetat (25:75) h: fraksi n-heksana:etil asetat (10:90) i: fraksi metanol
a1: standar xantorizol
b1: fraksi n-heksana 1
c1: fraksi n-heksana 2
d1: fraksi n-heksana:etil asetat (90:10)
e1: fraksi n-heksana:etil asetat (75:25)
f1: fraksi n-heksana:etil asetat (50:50)
g1: fraksi n-heksana:etil asetat (25:75)
h1: fraksi n-heksana:etil asetat (10:90)
i1 : fraksi metanol
Hasil identifikasi dengan kromatografi lapis tipis menunjukkan bahwa ketiga kopolimer selulosa-g-AAm dengan jumlah penaut-silang berturut-turut 0.1 (sampel 1), 0.5 (sampel 2) dan 1.0 gram (sampel 3) berhasil memisahkan senyawa-senyawa nonpolar di dalam ekstrak temu lawak, yang salah satunya merupakan xantorizol. Fase diam dengan jumlah penaut-silang 0.1 gram memilki 3 noda pada fraksi pertama n-heksana yang tidak saling tumpuk dan terdapat satu noda yang memiliki Rf yang sama dengan Rf standarnya, yaitu noda pertama dengan nilai Rf 0.47. Sampel 2 juga menunjukkan kinerja yang mirip dengan sampel 1 (Lampiran 8). Elusi dengan pelarut n-heksana menunjukkan keberadaan xantorizol pada fraksi 1 dan 2. Fraksi 1 menghasilkan 4 noda yang tidak saling bertumpuk dan fraksi 2 menghasilkan 3 noda yang tidak begitu jelas. Nilai Rf noda 1 pada fraksi 1 dan 2 menunjukkan nilai yang mirip dengan Rf standar xantorizol, yaitu 0.45. Sampel 3 juga menunjukkan hasil pemisahan yang hampir sama dengan sampel 1 dan 2. Komponen xantorizol juga berada di fraksi 1 pelarut n-heksana, dengan nilai Rf yang mirip dengan standarnya, yaitu 0.56. pengamatan dilakukan di bawah sinar tampak dengan panjang gelombang 254 nm. Tanpa sinar UV noda-noda pada KLT sulit diamati (Lampiran 10).
Kurkuminoid yang terdapat di dalam fraksi yang diperoleh dari masing-masing eluen dianalisis secara kualitatif menggunakan KLT dengan menggunakan campuran eluen kloroform: benzena: metanol (80:15:5). Pengamatan kromatogram KLT dilakukan di
bawah sinar UV dengan panjang gelombang 366 nm. Pengamatan noda-noda yang teridentifikasi tanpa sinar UV disajikan pada Lampiran 10. Profil pemisahan kurkuminoid dari ekstrak temu lawak disajikan pada Gambar 9 dan Lampiran 9.
Gambar 9 Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam kolom selulosa-g-AAm 0.1 g, standar kurkuminoid, eluen kloroform: benzena: metanol (80:15:5) dengan sinar UV pada λ= 366 nm.
Keterangan
a: standar kurkuminoid b: fraksi 1 n-heksana
c: fraksi n-heksana:etil asetat (90:10) d: fraksi n-heksana:etil asetat (75:25) e: fraksi n-heksana:etil asetat (50:50) f: fraksi n-heksana:etil asetat (25:75) g: fraksi n-heksana:etil asetat (10:90) h: fraksi metanol
Identifikasi hasil fraksinasi kolom dengan KLT menunjukkan tidak adanya noda pada fraksi n-heksana (b). Hal ini menunjukkan pemisahan berjalan baik. Xantorizol telah terpisah dari ekstrak temu lawak. Standar kurkuminoid yang digunakan pada sampel 1 menghasilkan tiga buah noda dengan nilai Rf 0.11 (bisdemetoksikurkumin), 0.21 (demetoksikurkumin) dan 0.38 (kurkumin). Senyawa kurkumin dan demetoksikurkumin terdeteksi pada fraksi eluen kedua dan keenam yang ditandai dengan adanya noda dengan Rf 0.34 yang mirip dengan standar (Gambar 9), sedangkan ketiga senyawa kurkuminoid dapat teramati pada fraksi eluen ketiga, keempat dan kelima yang memiliki tiga buah noda dengan nilai Rf yang mendekati nilai Rf standar kurkuminoid. Fraksi eluen pertama dan ketujuh tidak menunjukkan adanya kandungan senyawa kurkuminoid (Gambar 9). Kromatogram eluat hasil sampel 2 (Lampiran 9) menunjukkan tiga buah noda dengan nilai Rf yang mendekati nilai Rf standar hanya pada fraksi eluen kedua. Kromatogram eluat
11
hasil kolom sampel 3 (Lampiran 9) tidak menunjukkan adanya salah satu atau ketiga senyawa kurkuminoid saat elusi dengan eluen pertama dan kedua. Ketiga senyawa kurkuminoid ditemukan pada fraksi eluen ketiga dan keempat.
Perbedaan kromatogram sampel 1, 2 dan 3 dikarenakan sampel 3 dapat menahan senyawa kurkuminoid pada saat elusi menggunakan eluen kedua sehingga pada fraksi eluen kedua tidak ditemukan adanya senyawa kurkuminoid. Tertahannya senyawa kurkuminoid yang bersifat semipolar ini dikarenakan sampel 3 memiliki nilai EP tertinggi. Semakin tinggi EP, polaritas pun akan meningkat pula. Sampel 3 juga memiliki jaringan kopolimer yang sangat rapat, sehingga memungkinkan senyawa kurkuminoid yang memiliki struktur cukup besar untuk tertahan pada kolom.
fase diam yang telah digunakan, dapat digunakan kembali dengan mencucinya menggunakan asam asetat:toluena (1:2) untuk menghilangkan kurkuminoid yang menempel pada fase diam. Setelah itu, metanol terus ditambahkan hingga bau asam asetat hilang. Pengemasan kolom dilakukan seperti awal penggunaan. Eluen pertama yang digunakan ialah heksana.
Saat fase diam kolom sampel 1, 2 dan 3 digunakan kembali, tidak ditemukan perbedaan performa yang signifikan dibandingkan dengan pemakaian fase diam awal. Profil pemisahannya ditampilkan pada Gambar 10 dan Lampiran 8
Gambar 10 Identifikasi hasil fraksinasi kromatografi kolom dengan fase diam kolom selulosa-g-AAm 0.1 g (reuse), standar xantorizol, eluen heksana:etil asetat (10:1) dengan sinar UV pada λ= 254 nm.
Keterangan: a: standar xantorizol b: fraksi 1 n-heksana
c: fraksi n-heksana:etil asetat (90:10) d: fraksi n-heksana:etil asetat (75:25) e: fraksi n-heksana:etil asetat (50:50) f: fraksi 1 n-heksana:etil asetat (25:75)
g: : fraksi 2 n-heksana:etil asetat (25:75) h: fraksi 1 n-heksana:etil asetat (10:90 i: fraksi 2 n-heksana:etil asetat (10:90 j: fraksi metanol
Ketiga sampel dapat memisahkan xantorizol di dalam ekstrak temu lawak. Perbedaan hanya terlihat pada sampel 1. Noda-noda fraksi eluen pertama terlihat menumpuk dan lebih banyak. Hal ini menandakan adanya sedikit penurunan ketahanan fase diam setelah digunakan kembali. Nilai Rf xantorizol hampir mirip dengan standar. Standar xantorizol sampel 1, 2 dan 3 berturut-turut adalah 0.64, 0.40 dan 0.62. xantorizol ditemukan pada fraksi 1 dengan eluen pertama. Nilai Rf xantorizol sampel 1, 2 dan 3 berturut-turut ialah 0.64, 0.38 dan 0.60. perhitungan nilai Rf ini ditampilkan pada Lampiran 11 dan 12.
SIMPULAN DAN SARAN
SimpulanSintesis dan aplikasi selulosa-g-akrilamida sebagai fase diam kromatografi kolom dari jerami telah berhasil dilakukan. Isolat selulosa yang didapatkan berhasil menghilangkan lignin hingga tersisa 0.81%. Sintesis dengan variasi jumlah penaut-silang menggunakan teknik pencangkokan-penaut-silang memberikan hasil kapasitas absorpsi air yang menurun seiring dengan peningkatan jumlahpenaut-silang yang digunakan. Aplikasi selulosa-g-akrilamida sebagai fase diam kromatografi kolom berhasil memisahkan xantorizol dari ekstrak temu lawak. Xantorizol berada pada fraksi heksana dari kromatografi kolom yang dibuktikan dengan kromatografi lapis tipis.
Saran
Perlu dilakukan analisis kuantitatif terhadap fraksi-fraksi hasil pemisahan yang dihasilkan dari masing-masing fase diam yang telah disintesis untuk mengetahui profil pemisahan terbaik dari masing-masing fase diam yang digunakan, selain itu perlu dicoba pula penggunaan ulang fase diam hasil sintesis lebih dari 2 kali untuk mengetahui katahanan fase diam tersebut.
DAFTAR PUSTAKA
[ASTM] American Society for Testing and Materials. 1977. Annual Book of ASTM Standards. Wood: Adhesives. Vol 22. Philadelphia: American Society for Testing and Materials.
[BPS] Badan Pusat Statistik. 2011. ARAM 1 Luas Areal Padi Indonesia. Jakarta: Badan Pusat Statistik.
[BSN] Badan Standardisasi Nasional. 1989. SNI 01-1303-1989. Jakarta: Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. 1989. SNI 14-0492-1989. Jakarta: Badan Standardisasi Nasional
[BSN] Badan Standardisasi Nasional. 2009. SNI 01-3751-2006. Jakarta: Badan Standardisasi Nasional.
Achmadi SS. 1990. Kimia Kayu. Bogor: IPB Press.
Aguilar MI, Guillermo D, Maria LV. 2001. New bioactive derivatives of xanthorrhizol. J Mex Chem Soc 45:56-59.
Bhattacharya D, Germinario LT, Winter WT. 2008. Isolation, preparation and characterization of cellulose microfibers obtained from bagasse. Carbohydr Polym 73:371-377.
Cahaya A, Nugroho DA. 2007. Pembuatan Kompos dengan Menggunakan Limbah Padat Organik (Sampah Sayuran dan Ampas Tebu) [skripsi]. Semarang, Fakultas Teknik, Universitas Diponegoro.
Cahyani RD. 2010. Asetilasi Selulosa Ampas Sagu dan Aplikasinya sebagai Fase Diam kromatografi Kolom [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Chauhan GS, Lal L. 2003. Novel grafted cellulose-based hydrogels for water technologies. Desalination 159:131-138.
Chung WY et al. 2007. Xanthorrhizol inhibits 12-O-tetra-decanoylphorbol-13-acetate-induced acute inflammation and two-stage mouse skin carcinogenesis by blocking the expression of ornithine decarboxylase, cyclo-oxygenase-2 and inducible nitric oxide synthase through mitogen-activated protein kinases and/or the nuclear factor-kB. Carcinogenesis 28(6):1224–1231.
Cowd. 1991. Kimia Polimer. Firman H, penerjemah. Bandung: ITB. Terjemahan dari: Polymer Chemistry.
Da Silva DA, de Paula RC, Fitosa J. 2007. Graft copolymerisation of acrylamide onto cashew gum. European Polymer Journal 43:2620-2629.
Dewi. 2002. Hidrolisis limbah pertanian secara enzimatik. Akta Agrosia 5(2): 67-71.
Fang JM, Sun Rj, Tomkinson J. 2000. Isolation and characterization of hemicelluloses and cellulose from rye straw by alkaline peroxide extraction. Cellulose 7:87–107.
Fuadi AM, Sulistya H. 2008. Pemutihan pulp dengan hidrogen peroksida. Reaktor 12(2):123-128.
Guolin H, Jeffrey XS, Tim AG Langrish. 2007. NH4OH-KOH pulping mechanism
and kinetics of rice straw. Bioresource Technology 98:1218-1223.
Gupta AP, Gupta MM, Kumar S. 1999. Simultaneous determination of curcuminoids in curcuma samples using high performance thin layer chromatography. J. liq. chrom. & rel. Technol 22(10):1561–1569.
13
Hadipoentyanti E, Syahid SF. 2007. Respon temu lawak (Curcuma xanthorrhiza roxb.) hasil rimpang kultur jaringan generasi kedua terhadap pemupukan. J littri 13(3):106-110.
Hwang JK, Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizolfrom Curcuma xanthorrhiza against oral pathogens. Fitoterapia 71:321-323.
Irawan R 2000. Pengaruh ekstrak kulit buah Citrus aurantifolia Swingle terhadap kontraksi trakea marmot terisolasi yang diinduksi histamin in vitro. Cermin Dunia Kedokteran 128:25-32.
Iskandar L, Heri AP, Enggar H. 2009. Studi awal mengenai pembuatan surfaktan dari ampas tebu [Skripsi]. Semarang: Fakultas Teknik, Universitas Diponegoro.
Kartiwa H, Wawan, Tugiyana dan Sugeng. 2004. Pulp kertas seni dari tanaman Serat bukan kayu. Berita Selulosa 39(1):29-35.
Kim S, Dale BE. 2004. Global potential bioethanol production from wasted crops and crop residues. Biomass and Bioenergy 26:361-375.
Kurniadi T. 2010. Kopolimerisasi grafting monomer asam akrilat pada onggok singkong dan karakterisasinya [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Lanthong P, Nuisin R, Kiatkamjornwon S. 2006. Graft copolymerization, characterization and degradation of cassava starch-g acrylamide/itaconic acid super-absorbents. Carbo Poly 66:229–245.
Lestari W. 2010. Modifikasi selulosa ampas tebu dengan asetilasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Liang R, Yuan H, Xi G, Zhou Q. 2009. Synthesis of wheat straw-g-poly(acrylic acid) superabsorbent composites and releae of urea from it. Carbohydr polym 77:181-187.
Lozinsky VI. 2004. What new opportunities the use of diverse polymeric cryogels opens for the immobilization of molecules and cells. Chem. Ind58(6a):111-115.
Lumbanbatu K. Pembuatan dan karakterisasi kertas eceng gondok [tesis]. Medan: Program Pascasarjana, Universitas Sumatera Utara.
Mayer S, Briand X, Francotte E. 2000. Separation of enantiomers by packed capillary electrochromatography on a cellulose-based stationary phase. J of Chromatography 875:331-339.
Nakano T. 2001. Optically active synthetic polymers as chiral stationary phases in HPLC. Journal of Chromatography 906:205-225.
Nakason et al. 2010. Preparation of cassava starch-graft-polyacrilamide super-absorbents and associated composites by reactive blending. Carbo Poly 81:348-357.
Paramasivam M, Poi R, Banerjee H. 2008. Quantitative determination of curcuminoids in turmeric powder by HPTLC technique. Current Science 95(11):1529-1531.
Samsuri et al. 2007. Pemanfaatan selulosa bagas untuk produksi etanol melalui sakarifikasi dan fermentasi serentak dengan enzim xylanase. Makara Teknologi 11:17-24.
Santi. 2006. Onggok sagu termodifikasi sebagai fase diam dalam kromatografi kolom [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Silvianita S, Nurmasari I, Sulistio A, Kurniawan F, Sumarno. 2004. Kopolimerisasi dari polyacrylamida pada starch dengan metode grafting. Di dalam: Sumarno, editor. Seminar Nasional Rekayasa Kimia dan Proses. Semarang, 14 Juli 2004. Surabaya: Institut Teknologi Sepuluh Nopember.
Sun JX et al. 2004. Isolation and characterization of cellulose from sugarcane bagasse. Polym Degrad Stability 84:331-339.
Wardhani IY, Surjokusumo S, Hadi YS, Nugroho N. 2004. Distribusi kandungan kimia kayu kelapa (Cocos nucifera L). J. Ilmu & Teknologi Kayu Tropis 2(1):2-15
Yew HC, Nordin FJ, Sarip R, Thiam TT, Azimahtol HLP, Sirat HM, Abd Rashid BA, Abdullah NR, Ismail Z. 2009. Combined xanthorrhizol-curcumin exhibits synergistic growthinhibitory activity via apoptosis induction in human breast cancer cells MDA-MB-231. Cancer Cell International 9:1-12.
Lampiran1
Diagram Alir Penelitian
Jerami pulping Delignifikasi Isolat selulosaIsolasi Selulosa
Analisis Proksimat dan analisis seratkasar
Analisis gugus fungsi (FTIR) dan analsis serat kasar
Pencangkokan-penaut-silang MBA 0.1, 0.5 dan 1.0 gram Pencucian gel Selulosa-g-AAm
Modifikasi
Selulosa
Kadar NDaya Absorpsi air SEM FTIR Uji Daya tahan pelarut Kromatografi Kolom Identifikasi fraksi kolom dengan KLT Fraksi kolom Pengamatan pada λ= 254 nm dan 366 nm
Evaluasi kinerja
fase diam hasil
sintesis
17
Lampiran 2
Reaktor pencangkokan-penaut-silang
Keterangan:
a. Labu leher tiga
b. Pengaduk magnetik
c. Termometer
d. Pipa penyaluran gas nitrogen
e. Tempat pemasukan campuran monomer dan penaut-silang
f. Penangas
Lampiran 3
Data uji kadar N
Penaut-silang
Bobot (g)
HCl terpakai
(mL)
%N
0.1 g
0.1020
5.10
7.14
0.5 g
0.1030
5.40
7.56
1.0 g
0.1606
9.10
8.10
Contoh perhitungan:
% N =
( ) ( )% N =
=7.14%
19
Lampiran 4
Hipotesis reaksi pencangkokan-penaut-silang selulosa dengan
monomer AAm dan penaut-silang MBA (Amroni 2011).
Tahap inisiasi
Lanjutan lampiran 4
Hipotesis reaksi pencangkokan-penaut-silang selulosa
dengan monomer AAm dan penaut-silang MBA
(Amroni 2011)
21
Lampiran 5
Data pembuatan kopolimer, pengukuran kadar nitrogen, RP dan
EP
(a) Data pembuatan kopolimer sampel 1, 2 dan 3
Sampel
selulosa
(g)
APS
(g)
AAm
(g)
MBA
(g)
Selulosa-g-AAm (g)
1
15.0020 0.2566 15.0173 0.1023
30.7448
2
15.0041 0.2503 15.0146 0.5092
31.8908
3
15.0060 0.2555 15.0414 1.0020
29.5470
(b) Data penentuan kadar nitrogen, RP dan EP
Sampel
Bobot
(mg)
% N
percobaan
% N
teoritis
RP
(%)
EP
(%)
1
102
7.14
9.88
56.82 72.27
2
103
7.56
9.99
63.04 75.67
3
160.6
8.10
10.13
69.79 79.96
Contoh perhitungan :
Kadar nitrogen teoritis
( )+( ) ( ) ( )
Rendemen Pencangkokkan-Penautan-silang (RP)
( ) ( ) ( ) ( ) ( ) ( ) 56.82%
Efisiensi Pencangkokkan-Penautan-silang (EP)
Lampiran 6
Data indeks bias uji kapasitas tahan berbagai pelarut.
Indeks bias
pelarut
Etil
asetat
Etanol
aseton
metanol
heksana
toluena
Blangko 1.3700
1.3599
1.3555
1.3290
1.3700
1.4898
sampel
1.3697
1.3603
1.3554
1.3295
1.3704
1.4898
23
Lampiran 7
Gambar-gambar analisis FTIR Selulosa-g-Aam MBA 0.5 dan 1.0
gram.
Lampiran 8
Gambar-gambar hasil identifikasi KLT dari fraksi-fraksi
hasil kromatografi kolom dengan fase diam kolom
selulosa-g-AAm 1.0 gram dan fase diam kolom selulosa 0.5 dan 1.0
gram yang digunakan kembali, menggunakan eluen
heksana:etil asetat (10:1), standar xantorizol, diamati pada
panjang gelombang 254 nm.
Keterangan: a: standar xantorizol b: fraksi 1 n-heksana c: fraksi 2 n-heksana
d: fraksi n-heksana:etil asetat (90:10) e: fraksi n-heksana:etil asetat (75:25) f: fraksi n-heksana:etil asetat (50:50) g: fraksi n-heksana:etil asetat (25:75) h:fraksi n-heksana:etil asetat (10:90) i: fraksi metanol
Keterangan: a: standar xantorizol b: fraksi 1 n-heksana
c: fraksi n-heksana:etil asetat (90:10) d: fraksi n-heksana:etil asetat (75:25) e: fraksi n-heksana:etil asetat (50:50) f: fraksi 1 n-heksana:etil asetat (25:75) g:fraksi 2 n-heksana:etil asetat (25:75) h:fraksi 1 n-heksana:etil asetat (10:90) i:fraksi 2 n-heksana:etil asetat (10:90) j: fraksi metanol
Keterangan : a: standar xantorizol b: fraksi n-heksana
c: fraksi n-heksana:etil asetat (90:10) d: fraksi n-heksana:etil asetat (75:25) e: fraksi n-heksana:etil asetat (50:50) f: fraksi 1 n-heksana:etil asetat (25:75) g: fraksi 2 n-heksana:etil asetat (10:90)
Cl 1.0 gram
Cl 0.5 gram reuse
Cl 1.o gram reuse
25
Lampiran 9
Gambar-gambar hasil identifikasi KLT dari fraksi-fraksi hasil
kromatografi kolom dengan fase diam kolom selulosa-g-AAm 1.0
gram, menggunakan eluen kloroform: benzena: metanol (80:15;5),
standar kurkuminoid, diamati pada panjang gelombang 366 nm.
Keterangan:
a: standar kurkuminoid b: fraksi 1 n-heksana c: fraksi 2 n-heksana
d: fraksi n-heksana:etil asetat (90:10) e: fraksi n-heksana:etil asetat (75:25) f: fraksi n-heksana:etil asetat (50:50) g: fraksi n-heksana:etil asetat (25:75) h: fraksi n-heksana:etil asetat (10:90)
Keterangan:
a: standar kurkuminoid b: fraksi n-heksana
c: fraksi n-heksana:etil asetat (90:10) d: fraksi n-heksana:etil asetat (75:25) e: fraksi n-heksana:etil asetat (50:50) f: fraksi n-heksana:etil asetat (25:75)
Lampiran 10
Gambar-gambar hasil identifikasi KLT dari fraksi-fraksi hasil
kromatografi kolom dengan fase diam kolom selulosa-g-AAm
penaut-silang 0.1 dan 0.5 gram, menggunakan eluen heksana:etil
asetat (10:1), standar xantorizol dan fase diam selulosa-g-AAm
penaut-silang 0.1 gram, standar kurkuminoid, fase gerak
kloroform:benzena;metanol (80:15;5) yang diamati tanpa sinar
UV.
Standar xantorizol
27