Identifikasi Molekuler Beberapa Lalat Forensik Penting Afrika Selatan dan Australia Identifikasi Molekuler Beberapa Lalat Forensik Penting Afrika Selatan dan Australia ML Harvey, MW Mansell, MH Villet dan IR Dadour
ML Harvey, MW Mansell, MH Villet dan IR Dadour
Pusat Ilmu Forensik, University of Western Australia, Australia Pusat Ilmu Forensik, University of Western Australia, Australia
Departemen Zoologi dan Entomologi, University of Pretoria, Afrika Selatan Departemen Zoologi dan Entomologi, University of Pretoria, Afrika Selatan Departemen Zoologi dan Entomologi, Rhodes University, Afrika Selata Departemen Zoologi dan Entomologi, Rhodes University, Afrika Selata nn Abstrak
Abstrak
Salah satu aspek utama penelitian di forensik entomologi adalah investigasi teknik Salah satu aspek utama penelitian di forensik entomologi adalah investigasi teknik molekuler untuk identifikasi akurat serangga. Studi sampai saat ini telah membahas fauna molekuler untuk identifikasi akurat serangga. Studi sampai saat ini telah membahas fauna mayat dari banyak wilayah geografis, tetapi umumnya diabaikan spesies calliphorid Afrika mayat dari banyak wilayah geografis, tetapi umumnya diabaikan spesies calliphorid Afrika bagian
bagian Selatan. Selatan. Dalam Dalam studi studi ini, ini, calliphorids calliphorids forensik forensik signifikan signifikan dari dari Afrika Afrika Selatan,Selatan, Swaziland, Botswana dan Zimbabwe dan Australia disekuensing melalui 1.167 pasangan Swaziland, Botswana dan Zimbabwe dan Australia disekuensing melalui 1.167 pasangan basa daerah gen COI. Analisis filogenetik dilakukan untuk menguji kemampu
basa daerah gen COI. Analisis filogenetik dilakukan untuk menguji kemampuan daerah untuk an daerah untuk men
menyelyelesaiesaikan kan ideidentintitas tas spespesies sies dan dan hubhubungungan an taktaksonsonomi omi antantara ara spespesiessies. . AnaAnalisilisis s oleolehh tet
tetangangga-bga-bergergabuabung, ng, kekkekikiikiran ran makmaksimsimum um dan dan metmetode ode kemkemunungkigkinan nan makmaksimsimum um semsemuaua menunjukkan potensi daerah ini untuk memberikan yang diperlukan identifikasi spesies-level menunjukkan potensi daerah ini untuk memberikan yang diperlukan identifikasi spesies-level untu
untuk k aplikaaplikasi si untuuntuk k post-mpost-mortem interval ortem interval (PMI) estimasi, (PMI) estimasi, namunamun, n, hubuhubungan taksonomngan taksonomii tingkat yang lebih tinggi memang bervariasi sesuai dengan metode analisis. Keragaman antar tingkat yang lebih tinggi memang bervariasi sesuai dengan metode analisis. Keragaman antar juga
juga dipertimbangkan dipertimbangkan dalam dalam kaitannya kaitannya dengan dengan menentukan menentukan tingkat tingkat maksimum maksimum yang yang sesuaisesuai variasi yang diharapka
variasi yang diharapkan n selama analisis. Individu dari beberapa spesies selama analisis. Individu dari beberapa spesies dalam penelitidalam penelitian an iniini diwakili populasi dari Afrika Selatan dan pantai timur Australia, namun keragaman antar diwakili populasi dari Afrika Selatan dan pantai timur Australia, namun keragaman antar maksimal atas wilayah gen ini dihitung sebesar 0,8%, dengan variasi antarspesies minimal maksimal atas wilayah gen ini dihitung sebesar 0,8%, dengan variasi antarspesies minimal sebesar 3%, menunjukkan rentang yang berbeda dari variasi yang diharapkan pada tingkat sebesar 3%, menunjukkan rentang yang berbeda dari variasi yang diharapkan pada tingkat int
intra ra dan dan intintersperspesifesifik. ik. WilWilayaayah h ini ini karkarena ena munmuncul cul untuntuk uk memmemberberikaikan n ahlahli i ententomoomologlogii forensik Afrika bagian selatan dengan teknik baru untuk menyediakan identifikasi akurat forensik Afrika bagian selatan dengan teknik baru untuk menyediakan identifikasi akurat untuk aplikasi untuk estimasi PMI.
untuk aplikasi untuk estimasi PMI. Pengantar
Pengantar
Forensik entomologi telah menjadi alat investigasi yang penting selama Forensik entomologi telah menjadi alat investigasi yang penting selama bertahun-tah
tahun, un, khukhusussusnya nya melmelalualui i penpengguggunaanaannynnya a daldalam am sidsidang ang penpengadgadilailan n daldalam am memmemberberikaikann esti
estimasmasi i pospost-mt-mortortem em intinterverval al (PM(PMI) I) daldalam am kaskasus-us-kasukasus s pempembunbunuhauhan. n. AplAplikaikasi si ini ini dardarii entomologi penyelidikan menuntut akurasi besar dalam estimasi PMI, sehingga penelitian entomologi penyelidikan menuntut akurasi besar dalam estimasi PMI, sehingga penelitian yang signifikan menangani masalah ini.
yang signifikan menangani masalah ini.
Identifikasi yang benar dari spesimen merupakan prasyarat penting dalam estimasi Identifikasi yang benar dari spesimen merupakan prasyarat penting dalam estimasi PMI
PMI menmengguggunaknakan an seraseranggngga, a, taptapi i ini ini munmungkigkin n sulsulit it menmengguggunaknakan an penpendekdekataatan n berberbasbasisis morfologi tradisional (Prins, 1982; Wallman, 2001). Beberapa studi telah membahas masalah morfologi tradisional (Prins, 1982; Wallman, 2001). Beberapa studi telah membahas masalah ini
ini dendengan gan menmengguggunaknakan an uruurutan tan DNA DNA untuntuk uk menmengidgidentientifikfikasi asi seraseranggngga, a, sebasebagiagian n bebesar sar memilih untuk menggunakan DNA mitokondria (mtDNA) sebagai dasar untuk sequencing memilih untuk menggunakan DNA mitokondria (mtDNA) sebagai dasar untuk sequencing (Sperling et al, 1994;. Malgorn & Coquoz, 1999; Wallman & Donnellan, 2001; Wells & (Sperling et al, 1994;. Malgorn & Coquoz, 1999; Wallman & Donnellan, 2001; Wells &
Sperling, 2001; Harvey et al, 2003). Studi-studi telah mengungkapkan potensi penggunaan mtDNA dalam memberikan identifikasi yang lebih akurat untuk perkiraan PMI.
Mayoritas literatur di bidang forensik entomologi telah membahas fauna mayat dari Amerika Serikat, Eropa, Inggris dan Australia, tetapi umumnya diabaikan Afrika. Di Afrika Selatan, forensik entomologi sedang semakin dimasukkan ke dalam investigasi kematian (M. Mansell, pers. Obs.). Sampai saat ini, penelitian Afrika Selatan telah difokuskan terutama pada suksesi serangga pada mayat (Louw & van der Linde, 1993) dan beberapa studi telah mempertimbangkan suksesi pada bangkai hewan yang dapat diterapkan untuk suksesi mayat manusia (Meskin, 1986; Braack & De Vos, 1987; Ellison, 1990). Meskipun meningkatnya minat dalam forensik entomologi, identifikasi DNA berbasis masih tetap rasa ingin tahu daripada aplikasi di Afrika Selatan. Ini sebagian besar merupakan hasil dari sejumlah kecil data genetik yang dikumpulkan pada spesies forensik dengan signifikan. Sebuah metode mengetik yang kuat membutuhkan banyak data untuk memastikan bahwa karakter yang digunakan untuk membedakan spesies terwakili di antara semua populasi spesies, dan akibatnya untuk mempertimbangkan keragaman antar yang dapat diamati di seluruh distribusi spesies. Kegunaan informasi tersebut menjadi jelas karena beberapa serangga Afrika terkait dengan bangkai kini telah diidentifikasi dari Amerika Selatan (Lawrence, 1986).
mtDNA diakui berguna untuk studi evolusi karena tingkat mutasi yang relatif lebih tinggi dibanding DNA inti (Hoy, 1994), dan juga kehadiran kedua segmen dilestarikan dan variabel. Studi evolusi Calliphoridae forensik penting menggunakan teknik filogenetik memungkinkan visualisasi hubungan antar spesies, berdasarkan tingkat kesamaan data sekuens. Hubungan seperti ini sangat berguna untuk menjelaskan, karena mereka sering mencerminkan perbedaan morfologi dan perilaku yang diamati di lapangan dan memberikan pemahaman yang lebih besar untuk ahli entomologi potensi perangkap dalam data. Ini
mungkin dalam penemuan spesies kompleks, atau hanya dalam konfirmasi filogenetik pemisahan genetik dua spesies yang sangat mirip di mana statusnya spesies dapat
dipertanyakan.
Potensi dari sitokrom oksidase I (COI) encoding wilayah mtDNA telah terbukti berguna untuk identifikasi dalam banyak studi (misalnya Sperling et al, 1994;. Malgorn & Coquoz, 1999). Berbagai segmen wilayah ini telah diurutkan dalam studi yang berbeda, mulai dari 278 pasangan basa ke seluruh gen COI. Penelitian ini mempertimbangkan penggunaan daerah 1167-bp dari gen COI untuk identifikasi forensik calliphorids penting di Afrika selatan. Wilayah ini meliputi segmen 278-bp yang digunakan oleh Harvey et al. (2003) dan 639 situs yang digunakan oleh Wallman & Donnellan (2001) untuk memberikan sukses perbedaan dengan fauna mayat Australia.
Lalat dari Botswana, Afrika Selatan, Swaziland, Zambia dan Zimbabwe disekuensing dan analisis filogenetik digunakan untuk membangun hubungan evolusi antara keduanya. Spesies sequencing adalah Chrysomya albiceps (Wiedemann), C. megacephala (Fabricius), C. putoria (Wiedemann), C. marginalis (Wiedemann), C. Inclinata Walker dan Lucilia sericata (Meigen). Spesies Australia forensik signifikan dari subfamilies Chrysomyinae dan Luciliinae dimasukkan untuk menguji keragaman antar untuk spesies juga ditemukan di
Afrika bagian selatan. Spesimen C. rufifacies (Macquart), C. varipes (Macquart) dan L. cuprina (Wiedemann) juga disertakan, bersama dengan muscid Hydrotaea rostrata (Robineau-Desvoidy). Hydrotaea rostrata disertakan terutama untuk relevansi forensik, tetapi juga sebagai outgroup. Meskipun spesies sarcophagid mungkin telah membentuk outgroup lebih cocok, tidak ada urutan yang tersedia cukup panjang dan dengan demikian muscid lebih jauh terkait terpilih. Calliphorinae, meskipun biasanya ditemukan pada mayat di Australia, hanya diwakili oleh Calliphora croceipalpis Jaennicke dan C. vicina Robineau-Desvoidy di Afrika Selatan dan tidak dimasukkan dalam analisis ini. Potensi daerah pengkodean COI untuk digunakan dalam identifikasi lalat untuk estimasi PMI berdasarkan serangga dibahas.
Bahan dan metode Sampel
Dewasa lalat yang digunakan dalam penelitian ini sebagai karakter morfologi dewasa diperbolehkan lebih cepat dan identifikasi akurat untuk tingkat spesies dari karakter larva. Spesimen diidentifikasi menggunakan kunci dan karakter di Zumpt (1965). Asal spesimen ditunjukkan pada Tabel 1. Lalat yang terjebak di Botswana, Afrika Selatan, Swaziland, Zambia dan Zimbabwe, dan spesimen Australia diambil dari koloni laboratorium atau terperangkap menggunakan hati-umpan perangkap. Spesimen yang diawetkan dalam etanol 70% dan didinginkan.
Ekstraksi DNA
Ekstraksi dilakukan dengan menggunakan Chelex 100 (Bio-Rad, Australia) teknik modifikasi dari berburu (1997). Sebuah sayatan dibuat di bawah sayap kiri dari setiap spesimen, dan otot terbang dihilangkan dan dimaserasi. Dalam beberapa spesimen otot terbang telah terdegradasi dan, akibatnya, satu sayap lalat itu digunakan untuk ekstraksi. Sisa dari spesimen tersebut kemudian disimpan dalam etanol dan didinginkan, sebagai spesimen voucher. Otot atau sayap kemudian dibekukan dengan menggunakan nitrogen cair dan tanah sampai menjadi bubuk halus menggunakan micropestles dalam 1,5 mL tabung Eppendorf. Seratus microlitres larutan 5% dari Chelex ditambahkan ke bahan dasar, vortexed dan diinkubasi selama 15 menit pada 95 ° C heatblock. Setelah inkubasi, sampel vortexed selama 5 detik, dan disentrifugasi selama 3 menit pada kecepatan maksimum. Supernatan dibuang dan disimpan pada suhu -20 ° C.
Kondisi PCR dan pemurnian produk PCR
Primer yang digunakan diperkuat wilayah sekitar 1270 bp. Primer adalah C1-J-1718 (5'-3 'GGAGGATTTGGAAATTGATTAGTTCC) dan TL2-N-3014 (5'-3' TCCAATGCACTAATCTGCCATATTA) (Simon et al., 1994).
Selanjutnya reaksi campuran terdiri dari: 1 × PCR penyangga (Biotools, Afrika Selatan), 200 M dNTP (Biotools), 1,5 mM MgCl2, 25 pM primer masing-masing dan 3 uL cetakan DNA, dan air ditambahkan ke total volume 50 uL. Sebuah Perkin Elmer GeneAmp PCR System 2400 thermocycler digunakan.
Program ini dimulai dengan 90-s 94 ° C periode denaturasi, diikuti oleh 36 siklus: 94 ° C selama 22 s, 48 ° C selama 30 detik dan 72 ° C selama 80 s. Sebuah periode perpanjangan akhir 60 s pada 72 ° C digunakan, diikuti oleh penyimpanan pada 4 ° C. Elektroforesis produk PCR menggunakan 1,5% agarosa gel dengan pewarnaan etidium bromida. Produk
dimurnikan menggunakan PCR Murni Tinggi Produk Pemurnian Kit (Roche), dengan elusi di 50 uL air sebagai lawan buffer elusi disediakan oleh produsen.
Sequencing
Sequencing reaksi dilakukan menggunakan ABI PRISM Big Dye Terminator 3,0 Sequencing Kit (Perkin Elmer) di bawah kondisi siklus yang dianjurkan, tetapi dengan suhu pendinginan diturunkan sampai 48 ° C. Primer eksternal adalah C1-J-1718 dan TL2-N-3014, dan internal adalah C1-J-2183 (5'-3 'CAACATTTATTTTGATTTTTTGG) dan C1-N-2329 (5'-3' ACTGTAAATATATGATGAGCTCA) (Simon et al., 1994). Urutan disusun menggunakan ABI 3100 dan ABI 377 sistem. Analisis dilakukan dengan menggunakan software Urutan
Navigator (v1.01, Terapan Biosystems), kroma v1.43
(http://www.trishul.sci.gu.edu.au/conor/chromas.html) dan DAPSA (University of Cape Town ). Analisis filogenetik dilakukan dengan menggunakan MEGA 2.0 (Kumar et al., 2001) dan PAUP * 4.0 (Swofford, 2002) paket perangkat lunak. Urutan diserahkan ke GenBank (lihat Tabel 1 untuk nomor aksesi).
Tabel 1. Individu termasuk dalam penelitian dengan lokalitas dan nomor aksesi.
Species Locality Accession no.
Chrysomya megacephala KwaZulu-Natal, South Africa AB112830 Pretoria, South Africa AB112848
Kitwe, Zambia AB112861
Kitwe, Zambia AB112856
Brisbane, Australia AB112841
Perth, Australia AB112846
Perth, Australia AB112847
Chrysomya inclinata KwaZulu-Natal, South Africa AB112857
Chrysomya putoria Kitwe, Zambia AB112831
Kitwe, Zambia AB112860
Snake Island, Botswana AB112835 Snake Island, Botswana AB112855 Chrysomya marginalis Pretoria, South Africa AB112832 Pretoria, South Africa AB112838 KwaZulu-Natal, South Africa AB112837 KwaZulu-Natal, South Africa AB112834 Karoo, South Africa AB112866 Karoo, South Africa AB112862 Chrysomya albiceps Pretoria, South Africa AB112839
Pretoria, South Africa AB112840 KwaZulu-Natal, South Africa AB112842 KwaZulu-Natal, South Africa AB112836 Manzini, Swaziland AB112865 Manzini, Swaziland AB112851 Manzini, Swaziland AB112854
Deka, Zimbabwe AB112858
Deka, Zimbabwe AB112849
Chrysomya rufifacies Perth, Australia AB112828
Perth, Australia AB112845
Chrysomya varipes Perth, Australia AB112869
Perth, Australia AB112867
Perth, Australia AB112868
Lucilia cuprina Perth, Australia AB112852
Perth, Australia AB112853
Perth, Australia AB112863
Lucilia sericata Graaf-Reinet, South Africa AB112850 Graaf-Reinet, South Africa AB112843 Pretoria, South Africa AB112859 Pretoria, South Africa AB112864
Harare, Zimbabwe AB112844
Perth, Australia AB112833
Hydrotaea rostrata (Muscidae) Perth, Australia AB112829
Analisa
Kedua tetangga-bergabung dan teknik kekikiran maksimum digunakan untuk analisis membandingkan hasil dari kedua jarak dan metode diskrit. Urutan diuji untuk memurnikan seleksi menggunakan pilihan Z-test di MEGA. Tetangga-bergabung analisis dilakukan dengan menggunakan model Tamura-Nei substitusi dan bootstrap (n = 500) dilakukan dengan menggunakan MEGA. Sebuah pencarian kekikiran maksimum heuristik dilakukan dan bootstrapped (50 ulangan). Analisis kemungkinan maksimum dilakukan dengan menggunakan HKY85 model substitusi dengan mulai pohon berasal dari penghematan, dan transisi / transversi rasio dan parameter bentuk gamma diperkirakan. Kekikiran dan kemungkinan analisis dilakukan di PAUP *. Hydrotaea rostrata adalah outgroup dalam semua analisis.
Hasil
Urutan Calliphorid dari 41 lalat berhasil mengurutkan dan selaras dengan satu orang muscid. Urutan berhubungan dengan posisi 1776-2942 Drosophila Yakuba (GenBank aksesi numberbNC_001322). Tidak ada sisipan atau penghapusan diidentifikasi dalam urutan
selaras. Dari 1167 bp dianalisis, 287 dari posisi ini adalah varian dan, ini, 211 adalah karakter kekikiran-informatif.
Komposisi nukleotida menunjukkan frekuensi yang lebih tinggi dari adenin (A) dan timin (T) pada 40% dan 30% dari total komposisi nukleotida dibandingkan dengan 15% sitosin (C) dan 15% guanin (G). Urutan juga diuji untuk memurnikan seleksi menggunakan Z-test, membandingkan kelimpahan relatif substitusi identik dan non-identik, yang menunjukkan bahwa seleksi pemurni umum tampaknya telah bertindak di urutan dengan perubahan identik jauh melebihi substitusi non-identik.
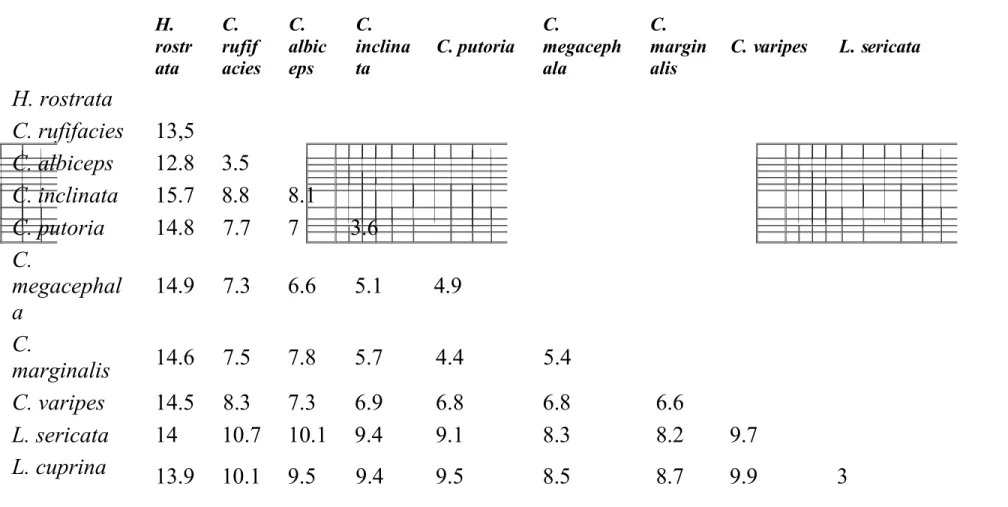
Tabel 2. Perbedaan berpasangan antara spesies dihitung dan dinyatakan sebagai persentase 1167 pasangan. H. rostr ata C. rufif acies C. albic eps C. inclina ta C. putoria C. megaceph ala C. margin alis C. varipes L. sericata H. rostrata C. rufifacies 13,5 C. albiceps 12.8 3.5 C. inclinata 15.7 8.8 8.1 C. putoria 14.8 7.7 7 3.6 C. megacephal a 14.9 7.3 6.6 5.1 4.9 C. marginalis 14.6 7.5 7.8 5.7 4.4 5.4 C. varipes 14.5 8.3 7.3 6.9 6.8 6.8 6.6 L. sericata 14 10.7 10.1 9.4 9.1 8.3 8.2 9.7 L. cuprina 13.9 10.1 9.5 9.4 9.5 8.5 8.7 9.9 3
Variasi dihitung berdasarkan rata-rata dihitung dari semua individu dari spesies. Hydrotaea rostrata, sebuah muscid dimasukkan sebagai outgroup, ditampilkan variasi 12,83-15,7% dari seluruh spesies calliphorid. Variasi interspesifik terendah adalah antara dua adik pasangan spesies L. sericata dan L. cuprina sebesar 3%, dan C. rufifacies dan C. albiceps sebesar 3,5%. Pada tingkat yang lebih tinggi, subfamilies Chrysomyinae dan Luciliinae ditampilkan variasi yang lebih besar dari 8% di seluruh spesies.
Gb. 1. Tetangga-bergabung pohon dengan panjang cabang dan dukungan bootstrap untuk spesies calliphorid kepentingan forensik.
Pohon yang dihasilkan dari tetangga-bergabung analisis ditunjukkan pada Gambar. 1. Analisis parsimoni Maksimum kembali 20 pohon mungkin, semua mencerminkan identik topologi. Pohon konsensus dihitung, dan versi dinyalakan menghasilkan pohon yang sama dengan yang diperoleh dengan menggunakan tetangga-bergabung. Analisis kemungkinan maksimum juga kembali pohon yang sama (data tidak ditampilkan). Analisis kemungkinan dilakukan dengan menggunakan model HKY85 di PAUP *, menggunakan frekuensi dasar yang tidak sama. Distribusi gamma bentuk-parameter dan transisi / transversi rasio diperkirakan dari data sebagai 0,11567 dan 2,42, masing-masing.
Pohon-pohon yang diproduksi menggunakan kedua jarak dan metode diskrit analisis yang dihasilkan sangat mirip topologi. Status subfamili baik didukung, dengan Luciliinae yang menampilkan dukungan 100% dalam semua analisis, dan spesies Chrysomyinae juga pengelompokan bersama, tetapi dengan dukungan yang lebih rendah. Di hampir semua analisis, individu masing-masing spesies mendapat dukungan bootstrap dari 100%, menunjukkan dasar yang kuat untuk perbedaan spesies. Perbedaan utama antara hasil datang dalam pengelompokan C. varipes dengan terkait erat C. rufifacies dan C. albiceps bawah kemungkinan, namun dengan spesies lain di bawah Chrysomya tetangga-bergabung dan
kekikiran maksimum. Namun, ketika pohon-pohon yang kemungkinan bootstrapped, C. varipes dikembalikan ke pengelompokan dengan spesies Chrysomya lainnya.
Chrysomya rufifacies dan C. albiceps membentuk pengelompokan tunggal dengan dukungan yang kuat, tetapi dipisahkan menjadi dua kelompok spesies yang berbeda. The morfologi serupa C. putoria dan C. Inclinata juga membentuk kelompok terpisah, dan C. varipes adalah kelompok yang relatif terisolasi dalam Chrysomyinae tersebut. Lucilia sericata dan L. cuprina juga dipisahkan untuk membentuk kelompok spesies dengan dukungan bootstrap penuh.
Tabel 3. Keragaman antar maksimum untuk setiap spesies dinyatakan sebagai persentase dari 1.167 pasangan basa (spesies diwakili oleh satu individu dihilangkan).
Species % variation within species
C. rufifacies 0.1 C. albiceps 0.2 C. putoria 0.6 C. megacephala 0.3 C. marginalis 0.3 C. varipes 0.8 L. sericata 0.1 L. cuprina 0
Keragaman antar relatif rendah. Nilai maksimum diamati antara individu dari setiap spesies yang ditampilkan dalam Tabel 3. Tingkat tertinggi terjadi di C. varipes sebesar 0,8%, pada individu yang dikumpulkan dari satu lokasi dan mungkin anggota satu populasi. Chrysomya putoria individu dari Botswana dan Zambia ditampilkan variasi 0,6%. Meskipun perwakilan dari beberapa negara di C. megacephala, C. albiceps dan sampel sericata L.,
sangat sedikit keragaman antar diamati.
Chrysomya marginalis menunjukkan pemisahan kecil antara Pretoria (perkotaan) dan spesimen lainnya. Divisi serupa ditunjukkan antara C. megacephala dari Brisbane (pantai timur), dan Perth (pantai barat) dan individu Afrika.
Diskusi
Adenin tinggi dan frekuensi timin diamati dalam urutan sering karakteristik serangga mtDNA, termasuk Diptera (Lewis et al, 1995;.. Bernasconi et al, 2000). Menimbang bahwa urutan yang coding protein, memurnikan seleksi untuk meminimalkan perubahan non-identik dalam urutan ini tidak mengherankan. Itu outgroup cukup jauh dari calliphorids, seperti yang diharapkan karena Muscidae dan Calliphoridae adalah keluarga perwakilan dari superfamilies berbeda.
Dalam mencari alat diagnostik yang mungkin untuk digunakan dalam penyelidikan forensik, metode yang dipilih harus kuat. Dalam identifikasi berbasis molekul, spesimen dapat diidentifikasi oleh kesamaan dan perbedaan dalam urutan bila dibandingkan dengan orang lain. Metode tersebut akan menjadi alat identifikasi yang berguna hanya jika sampel
referensi dari spesies yang sama hadir dalam database urutan, memerlukan pengetahuan yang menyeluruh dari semua spesies mungkin tertarik untuk pengurai bahan organik di daerah (Wells & Sperling, 2001). Dengan tidak adanya sampel referensi yang tepat, individu hanya akan mengelompokkan dengan sampel referensi dekat sama. Hal ini akibatnya berguna untuk memiliki indikasi tingkat interspesifik dan keragaman antar diharapkan dalam membuat identifikasi berdasarkan urutan data, sehingga jarak berpasangan dapat digunakan sebagai konfirmasi validitas untuk mendukung kedua morfologi dan analisis berbasis molekuler dilakukan . Tingkat didefinisikan intra dan variasi antarspesies yang dapat diharapkan dalam identifikasi akan memberikan konfirmasi tersebut.
Secara morfologi, calliphorids umumnya sederhana untuk mengidentifikasi tingkat subfamili, dan data molekuler di sini mendukung pemisahan Chrysomyinae dan Luciliinae. Chyrsomya rufifacies dan C. albiceps, dan L. cuprina dan L. sericata, diakui sebagai sulit untuk membedakan morfologi (Stevens & Wall, 1996; Wells & Sperling, 1999), dan di atas wilayah ini 1167-bp ditampilkan 3,5% dan 3 variasi%, masing-masing. Variasi intraspesifik maksimum adalah 0,8%, menunjukkan pemisahan yang tegas antara individu dari populasi yang berbeda dari spesies, dan spesies yang terpisah sama sekali. Ini mendukung temuan Wells & Sperling (2001) interspesifik perbedaan ≤ 3%, dan intraspecific perbedaan ≤ 1% di sejumlah spesies calliphorid forensik signifikan. Jadi perhitungan perbedaan berpasangan antara individu harus memberikan indikasi yang berguna dari validitas pengelompokan dalam analisis.
The filogenetik analisis oleh ketiga metode tersebut menghasilkan hasil yang sama, semua mendukung pemisahan subfamili dan clustering yang berbeda individu dengan individu sejenis. Dukungan bootstrap kuat melalui semua teknik menunjukkan sifat kuat daerah untuk digunakan dalam memberikan perbedaan antara spesies.
Perubahan posisi C. varipes dalam pohon, sesuai dengan teknik, melibatkan pengelompokan dengan baik C. rufifacies / C. Kelompok albiceps, atau spesies Chrysomya lainnya. Tetangga-bergabung dan filogeni kekikiran maksimum setuju pada posisi terakhir dari spesies, mungkin menunjukkan pengelompokan ini menjadi yang paling mungkin. Perubahan posisi spesies bawah analisis kemungkinan, ketika bootstrapped pada kesempatan terpisah, menunjukkan ketidakstabilan kemungkinan filogeni. Oleh karena itu, meskipun analisis kemungkinan mendukung topologi umum, dan mendukung dukungan bootstrap 100% untuk semua cluster spesies, filogeni telah dikecualikan. Sangat mungkin bahwa perbedaan dalam metode ini adalah produk sampling takson, dan bahwa spesies yang diperlukan untuk menempatkan C. varipes dalam filogeni dengan beberapa stabilitas menggunakan teknik ini telah dikeluarkan. The Chrysomya Spesies sequencing dipilih untuk signifikansi forensik mereka di daerah tertentu dan, akibatnya, spesies penting dalam membangun filogeni mungkin telah diabaikan. Sebuah posisi yang stabil untuk C. varipes dinyatakan mungkin akan ditemukan dengan memperluas wilayah sequencing untuk mendapatkan lebih banyak data atau dengan sekuensing gen lain.
Variasi intraspesifik rendah di beberapa negara dan dua benua untuk beberapa spesies menunjukkan nilai wilayah mtDNA untuk interspesifik perbedaan, dan kebutuhan untuk
wilayah variabilitas yang lebih besar untuk studi tingkat populasi. Ini akan menguntungkan untuk memiliki kemampuan untuk mengidentifikasi asal geografis lalat, terutama di lokasi tempat kematian ketika tubuh telah bergeser, berdasarkan perubahan DNA serangga dari lalat dari kedua tempat pembunuhan dan tempat pembuangan . Chrysomya megacephala dan L. sericata keduanya diurutkan dari Australia dan Afrika dan menunjukkan sedikit variasi antara populasi. Ironisnya, jumlah terbesar dari keragaman antar diamati pada C. varipes individu dari populasi yang sama. Sebuah daerah baru DNA jelas diperlukan untuk studi tingkat populasi, mungkin daerah kontrol hiper-variabel yang telah terbukti berguna dengan
Lessinger & Azeredo-Espin (2000) dalam lalat myiasis penyebab.
Dari perspektif Afrika Selatan, studi ini memberikan fondasi yang kuat untuk identifikasi berbasis molekul lalat forensik penting. Meskipun dibandingkan dengan individu Australia telah menunjukkan perlunya pekerjaan lebih lanjut untuk mempelajari keragaman, data telah menunjukkan sifat yang kuat di wilayah ini mtDNA untuk memberikan identifikasi spesies. Tingkat antar dan intraspecific divergensi muncul jelas. Studi tingkat populasi mungkin akan memungkinkan identifikasi asal geografis lalat dalam penyelidikan, serta setiap subspesies yang mungkin mempersulit identifikasi. Penelitian lebih lanjut juga akan perlu mempertimbangkan spesies forensik penting lainnya di Afrika bagian selatan, seperti Calliphora croceipalpis Jaennicke dan Chrysomya chloropyga (Weidemann). Urutan data COI muncul untuk memberikan dasar yang kuat untuk identifikasi spesies, dan akan membuktikan kontribusi yang tak ternilai forensik entomologi sebagai alat investigasi di Afrika Selatan.
Ucapan Terima Kasih
Penelitian ini didanai oleh Yayasan Rotary, Rotary International dalam bentuk Beasiswa Duta Besar untuk M.L.H. Terima kasih diperluas untuk Profesor Clarke Scholtz dan Jenny Edrich di University of Pretoria di Afrika Selatan untuk pengawasan, fasilitas dan bantuan teknis, Nicola Luntungan dari Departemen Zoologi dan Entomologi di Universitas Rhodes, Afrika Selatan, untuk bantuan teknis, dan Silvana Gaudieri dari Pusat Ilmu Forensik di University of Western Australia untuk membantu dalam analisis.
Referensi
Bernasconi, M.V., Valsangiacomo, C., Piffaretti, J.-C. & Ward, P.I. (2000) Phylogenetic relationships among Muscoidea (Diptera: Calyptratae) based on mitochondrial DNA sequences. Insect Molecular Biology, 9, 67–74.
Braack, L.E.O. & De Vos, V. (1987) Seasonal abundance of carrion-frequenting blow-flies (Diptera: Calliphoridae) in the Kruger National Park. Onderstepoort Journal of Veterinary Research, 54, 591–597.
Ellison, G.T.H. (1990) The effect of scavenger mutilation on insect succession at impala carcasses in southern Africa. Journal of Zoology, 220, 679–688.
Harvey, M.L., Dadour, I.R. & Gaudieri, S. (2003) Mitochondrial DNA cytochrome oxidase I gene: potential for distinction between immature stages of some forensically important fly species (Diptera) in western Australia. Forensic Science International , 131, 134–139.
Hoy, M.A. (1994) Insect Molecular Genetics. Academic Press, California.
Hunt, G.J. (1997) Insect DNA extraction protocol. Fingerprinting Methods Based on Arbitrarily Primed PCR (ed. by M. R. Micheliand R. Bova), pp. 21–24. Springer-Verlag,
Berlin.
Kumar, S., Tamura, K., Jakobsen, I.B. & Nei, M. (2001) MEGA2: Molecular Evolutionary Genetics Analysis software. Bioinformatics, 17, 1244–1245.
Laurence, B.R. (1986) Old World blowflies in the New World. Parasitology Today, 2, 77–79. Lessinger, A.C. & Azeredo-Espin, A.M.L. (2000) Evolution and structural organization of mitochondrial DNA control region of myiasis-causing flies. Medical and Veterinary Entomology, 14, 71–80.
Lewis, D.L., Farr, C.L. & Kaguni, L.S. (1995) Drosophila melanogaster mitochondrial DNA: completion of the nucleotide sequence and evolutionary comparisons. Insect Molecular Biology, 4, 263–278.
Louw, S.V.D.M. & van der Linde, T.C. (1993) Insects frequenting decomposing corpses in central South Africa. African Entomology, 1, 265–269.
Malgorn, Y. & Coquoz, R. (1999) DNA typing for identification of some species of Calliphoridae: an interest in forensic entomology. Forensic Science International , 102, 111– 119.
Meskin, I. (1986) Factors affecting the coexistence of blowflies (Diptera: Calliphoridae) on the Transvall Highveld, South Africa. South African Journal of Science, 82, 244–250.
Prins, A.J. (1982) Morphological and biological notes on six South African blow-flies (Diptera, Calliphoridae) and their immature stages. Annals of the South African Museum , 90, 201–217.
Simon, C., Frati, F., Beckenbach, A., Crespi, B., Liu, H. & Flook, P. (1994) Evolution, weighting, and phylogenetic utility of mitochondrial gene-sequences and a compilation of conserved polymerase chain-reaction primers. Annals of the Entomological Society of America, 87, 651–701.
Sperling, F.A.H. & Anderson, G.S. & Hickey, D.A. (1994) A DNA-based approach to the identification of insect species used for postmortem interval estimation. Journal of Forensic Sciences, 39, 418–427.
Stevens, J. & Wall, R. (1996) Species, sub-species and hybrid populations of the blowflies Lucilia cuprina and Lucilia sericata (Diptera: Calliphoridae). Proceedings of the Royal
Society of London Series B, 263, 1335–1341.
Swofford, D.L. (2002) Paup*. Phylogenetic Analysis Using Parsimony (*and Other Methods), Version 4. Sinauer Associates, Sunderland, MA.
Wallman, J.F. (2001) Third-instar larvae of common carrion-breeding blowflies of the genus Calliphora (Diptera: Calliphoridae) in South Australia. Invertebrate Taxonomy, 15, 37–51.
Wallman, J.F. & Donnellan, S.C. (2001) The utility of mitochondrial DNA sequences for the identification of forensically important blowflies (Diptera: Calliphoridae) in southeastern Australia. Forensic Science International , 120, 60–67.
Wells, J.D. & Sperling, F.A.H. (1999) Molecular phylogeny of Chrysomya albiceps and C. rufifacies (Diptera: Calliphoridae). Journal of Medical Entomology, 36, 222–226.
Wells, J.D. & Sperling, F.A.H. (2001) DNA-based identification of forensically important Chrysomyinae (Diptera: Calliphoridae). Forensic Science International , 120, 110–115.