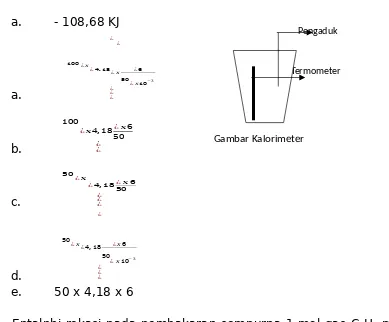
Pengaduk
Termometer
Gambar Kalorimeter SKL 5 :
MEMAHAMI PERUBAHAN ENERGI, CARA PENGUKURAN DAN PENERAPANNYA
26. Reaksi berikut yang merupakan reaksi eksoterm adalah….
a. SO2 S + O2 , H = 70,96 kJ
b. SO3 S + 3
2 O2, H = 94, 45 kJ.
c. C + O2 CO2 + 394,1 kJ
d. H2O + 242 kJ H2 + 02
e. CO2 + H2O CH4 + O2, H = 802,0 kJ
27. Dalam suatu kalorimeter sebanyak 50 ml larutan HCl 1 M pada suhu 27oC dicampur dengan 50 ml larutan NaOH 1M yang suhunya 27oC.
Setelah dicampur suhunya naik menjadi 33 oC, maka perubahan entalpi
rekasi adalah .... kJ (ῤ = 1, c = 4,18 J/g K)
a. - 108,68 KJ
a.
¿
100
¿
¿x¿4, 18
¿x ¿6
50
¿x10−3 ¿
¿ ¿
b.
100
¿x4, 18¿x6 50 ¿ ¿ c. 50 ¿x
¿4, 18¿x6 50 ¿ ¿ ¿ d. ¿ 50
¿x¿4, 18 ¿x6 50
¿x10−3
¿ ¿ ¿
e. 50 x 4,18 x 6
28. Entalphi rekasi pada pembakaran sempurna 1 mol gas C3H8 menurut
reaksi :
C3H8 (g) + 502 (g) 3 CO2 (g) + 4 H2O (
ℓ
) adalah – 2228,6 KJ/mol.Entalphi pembentukan gas propana, C3H8 adalah ....
(Hf0 H
2O (g) = -286,8 KJ / mol Hf0 CO2 (g) = -395,2 KJ/mol)
c. - 100,8 KJ / mol d. 104,2 KJ / mol e. 108,6 KJ / mol
2. Perhatikan gambar percobaan berikut:
Jika diketahui kalor jenis larutan 4,2 J g–1 ºC–1 dan massa jenis larutan 1
g mL–1, maka perubahan entalpi reaksi penetralan NaOH oleh HCl,
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆H = . . . .
adalah . . . .
a. –25,2 kJ
b. +25,2 kJ
c. –50,4 kJ
d. +50,4 kJ
e. +54,0 kJ
3. Perhatikan bagan percobaan berikut:
Dari percobaan tersebut dapat disimpulkan . . . .
a. terjadi reaksi endoterm, entalpi sistem bertambah
b. terjadi reaksi endoterm, entalpi sistem berkurang
c. terjadi reaksi endoterm, entalpi sistem tetap
d. terjadi reaksi eksoterm, entalpi sistem berkurang
e. terjadi reaksi eksoterm, entalpi sistem bertambah
4. Reaksi pembakaran sempurna C2H2 sebagi berikut:
2C2H2 (g) + 5 O2 (g) → 4CO2 (g) +2H2O(g)
Jika diketahui, ∆Ho
f H2O(g) : –242 kJ/mol
∆Ho
f CO2 (g) : –394 kJ/mol
∆Ho
f C2H2 (g) : +52 kJ/mol
Maka jumlah kalor yang dihasilkan pada pembakaran sempurna 52 gram C2H2 adalah . . . .
a. 391,2 kJ b. 432,8 kJ c. 1082 kJ d. 2164 kJ e. 4328 kJ
5. Data energi ikatan :
C–C : 347 kJ/mol
C=C : 611 kJ/mol
C–H : 414 kJ/mol
C–Cl : 339 kJ/mol
H–Cl : 431 kJ/mol
Berdasarkan data di atas, maka perubahan entalpi reaksi C2H4 (g) + HCl(g) → C2H5Cl(g)
adalah…. a. + 46 kJ b. – 46 kJ c. – 58 kJ d. – 92 kJ e. – 138 kJ
6. Perhatikan data percobaan berikut:
No. Pereaksi Suhu (ºC) Waktu
(det)
CaCO3 HCl
1 1 gram
serbuk 1 M 50 48
2 1 gram
serbuk 2 M 50 10
3 1 gram
serbuk 2 M 40 14
4 1 gram
butiran 2 M 40 18
5 1 gram
butiran 2 M 30 50
6 1 gram
butiran 1 M 30 60
Maka faktor yang mempengaruhi reaksi tersebut adalah . . . .
a. massa, konsentasi, suhu
b. suhu, konsentrasi, waktu
c. konsentrasi, massa, suhu
d. konsentrasi, suhu, luas permukaan
e. massa, luas permukaan, konsentrasi
7. Perhatikan data percobaan berikut:
P(aq) + Q(aq) → R(aq)
1 0,1 0,1 20
2 0,2 0,1 40
3 0,3 0,1 60
4 0,1 0,3 180
Berdasarkan data di atas, maka rumus persamaan laju dan orde reaksinya adalah . . . .
a. v = k [P]; 2 b. v = k [P][Q]; 2 c. v = k [B][Q]2 ; 3
d. v = k [P]2[Q]; 3
e. v = k [P]2[Q]2; 4
8. Perhatikan reaksi kesetimbangan berikut:
A(g) + B(g) 2C(g) ∆H = + a kJ
Jika pada volume tetap, suhu dinaikkan maka kesetimbangan . . . .
a. tidak bergeser, konsentrasi C tetap
b. bergeser ke kiri, konsentrasi A bertambah
c. bergeser ke kiri, konsnetrasi B bertambah
d. bergeser ke kanan, konsentrasi C bertambah
e. bergeser ke kanan, konsentrasi A dan B tetap
9. Pembuatan amonia dengan proses Haber-Bosch berdasarkan reaksi
N2(g) + 3H2(g) 2NH3(g) ∆H = –92 kJ
Untuk memperoleh gas amonia optimal digunakan suhu yang relatif tinggi. Alasan penggunaan suhu tinggi tersebut adalah . . . .
a. reaksi pembentukan amonia bersifat eksoterm
b. reaksi pembentukan amonia bersifat endoterm
c. katalis bekerja optimal pada suhu tinggi
d. pada suhu tinggi kesetimbangan bergeser ke kanan
e. pada suhu rendah reaksi berlangsung lambat
26. Berikut ini beberapa sifat yang menunjukkan reaksi eksoterm atau endoterm:
(1). Menyerap kalor dari lingkungan (2). Menyerap kalor dari sistem (3). Suhu lingkungan bertambah (4). Suhu lingkungan berkurang
Pasangan sifat yang menunjukkan reaksi endoterm adalah .... a. 1 dan 2
b. 1 dan 3 c. 1 dan 4 d. 2 dan 3 e. 2 dan 4
Termometer
Gelas stereoform
Bila 2,2 gram (Mr = 40) dilarutkan dalam 50 gram air dapat meningkatkan suhu menjadi 28 0C . Kalor jenis air 4,2 J .
Besarnya perubahan entalpi ( Δ H)dari reaksi ini adalah ....
a.
¿
50¿x
¿4,2
¿x¿28
2,2
¿ ¿ ¿
b.
¿
50¿
x¿4,2
¿x¿2,228
40
¿ ¿ ¿
c.
¿
50¿x
¿4,2
¿x¿28
40 22
¿ ¿ ¿
d.
¿
2,2
¿x¿4,2
¿x¿5028
40
¿ ¿ ¿
e.
¿
2,2¿x
¿4,2¿x¿28 40 50
¿ ¿ ¿
28. Perhatikan diagram tingkat energi pembakaran C menghasilkan CO2.
entalpi
C (grafit) + O2 (g)
313,5 kJ
CO2 (g)
Besarnya perubahan entalpi (ΔH) untuk penguraian 88 gram gas CO2
a. – 627,0 kJ b. – 313,5 kJ c. – 156,7 kJ d. + 313,5 kJ e. + 627,0 kJ
29. Perhatikan data eksperimen penentuan laju reaksi dengan persamaan reaksi berikut:
A + B → C
(1).Jika konsentrasi zat A tetap, konsentrasi zat B dinaikkan dua kali dari semula, maka laju reaksi empat kali lebih cepat dari semula.
(2).Jika konsentrasi zat B di buat tetap, konsentrasi zat A dinaikkan dua kali dari semula, maka laju reaksi dua kali lebih cepat dari semula Jika laju reaksi mula – mula adalah X mol L-1 s-1 , konsentrasi zat A = 2
mol/L dan konsentrasi zat B = 3 mol/L, maka besarnya laju reaksi adalah ....
a. 6 b. 9 c. 12 d. 18 e. 36
30. Seorang siswa mengamati banyaknya gas yang dihasilkan dari reaksi : CaCO3 + HCl → CaCl2 + CO2 + H2O
Faktor yang berpengaruh terhadap banyaknya gas yang dihasilkan dari reaksi tersebut adalah ....
a. luas permukaan CaCO3
b. alat penampung gas yang dihasilkan c. ukuran wadah yang digunakan
d. Volume HCl yang digunakan e. Suhu sistem
31. Pada suhu tertentu belerang trioksida yang merupakan bahan baku pembuat asam sulfat terurai membentuk belerang dioksida dan oksigen dengan reaksi kesetimbangan 2 SO3 (g) ⇌ 2 SO2 (g) + 3 O2 (g)
Untuk memperoleh molekul SO3 sebanyak mungkin, maka perlakuan
yang harus diberikan pada sistem ini adalah .... a. tekanan diperbesar
b. volume diperbesar c. gas SO2 dipisahkan
d. gas O2 dipisahkan
32. Perhatikan persamaan reaksi kesetimbangan: 4NH3(g) + 3 O2(g) ⇌ 2N2(g) + 6 H2O(g)
Bila pada keadaan awal terdapat 1 mol NH3 dan 1 mol O2 dan pada
keadaaan akhir jumlah mol O2 berkurang menjadi 0,7 mol. Maka Harga
Kc dari reaksi tersebut adalah ....
a.
(
0,2
)
2(
0,6
)
2(
0,7
)
3b.
(
0,2
)(
0,6
)
(
0,7
)
c.
(
0,2
)
2(
0,6
)
6(
0,4
)
4(
0,3
)
3d.
(
0,7
)
3(
0,2
)
2(
0,6
)
4e.
(
0,3
)
3(
0,2
)
2(
0,6
)
628. Perhatikan gambar berikut ini :
Kristal urea air
Logam Mg bubuk detergen
HCl(aq) air sitrun(s) air air 2 M ••••
Logam larut urea larut sitrun larut deterjen larut Dinding tabung Dinding tabung Dinding tabung Dinding tabung Terasa panas terasa dingin terasa dingin Terasa panas
(1) (2) (3) (4)
Gambar yang termasuk reaksi endoterm adalah … . A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D.2 dan 3 E. 3 dan 4
29. Diketahui data sebagai berikut : ∆Hof C
2H5OH = -278 kJ/mol
∆Hof CO
2 = -394 kJ/mol
∆Hof H
Jika 100 ml C2H5OH 2 M dibakar sempurna menurut persamaan reaksi :
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(l)
Perubahan entalpi untuk reaksi tersebut adalah ... . A. -2738 kJ
B. -1648 kJ C. -1368 kJ D.-273,6 kJ E. -136,8 kJ
30. Perhatikan harga energi ikatan :
C-C 348 kJ/mol C-H 413 kJ/mol
C=C 614 kJ/mol H-Cl 431 kJ/mol
C≡C 839 kJ/mol C-Cl 328 kJ/mol
Perubahan entalpi untuk reaksi :
H H H H Cl
H-C – C- C≡C-H + H-Cl H- C-C-C=C-H adalah... .
H H H H H A. 1966 kJ
B. 1638 kJ C. 1270 kJ D.- 942 kJ E. - 85 kJ
31. Pada reaksi 2P + Q 2R, diperoleh data laju reaksi sebagai berikut:
Bila harga k = 1 x 10-5
Persamaan laju reaksi yang sesuai dengan data tersebut adalah....
A. V = 2,0 x 10-5
B. V = 2,1 x 10-6
C. V = 1,2 x 10-7
D.V = 7,2 x 10-8
E. V = 8,6 x 10-8
32.Reaksi kesetimbangan di bawah ini yang menghasilkan lebih banyak produk reaksi jika volumenya diperkecil adalah....
A.2 NO(g) + O2(g) 2 NO2 (g)
B.C (s) + O2(g) CO2(g)
No [P] [Q] Waktu(d
etik)
1 0,02 0,6 16
2 0,04 0,6 8
3 0,02 0,1
2
C.CaCO3 (s) CaO (s) + CO2 (g)
D.2 N2O4(g) 2 NO2 (g)
E.2 HI (g) H2(g) + I2 (g)
33.Data percobaan reaksi kesetimbangan 2SO2(g) + O2(g) 2 SO3 sebagai
berikut:
senyawa volume Konsentrasi pada
kesetimbangan
SO2 1L 0,4
O2 1L 0,7
SO3 1L 0,6
Besarnya tetapan kesetimbangan (Kc) pada suhu 250C (Mol L-1)
A. (0,4)2
(0,6)2 (0,7)
B. (0,6)2
(0,4)2 (0,7)
C. 0,6 (0,4)2 (0,7)2
D. (0,7)2
(0,6)2 (0,4)
E. (0,7)2
(0,6) (0,4)
34.Perhatikan bagan percobaan pelarutan urea berikut ini:
Sebanyak 5 gram urea masing masing dilarutkan dalam 5 wadah yang berbeda
25 0 C 50 0 C 50 0 C 50 0 C
25 0 C
1 2 3 4 5
Dari bagan tersebut, proses pelarutan yang paling cepat berlangsung adalah....
1. Reaksi gas nitrogen monoksida dengan gas oksigen menghasilkan gas dinitrogen tetraoksida melepas kalor sebesar a kJ. Persamaan termokimia reaksi yang tepat adalah….
A. NO + O2 --- NO2, ∆H = a kJ B. N + O2 --- NO, ∆H = a kJ C. NO + O2 --- N2O2, ∆H = a kJ D.N + O2 --- N2O3, ∆H = a kJ E. NO + O2 --- N2O4, ∆H = a kJ
2. Diketahui perubahan entalpi reaksi berikut :
2Fe + 3/2 O2 --- Fe2O3 ∆H = -822 kJ/mol
C + ½ O2 --- CO ∆H = -110 kJ/mol
Perubahan entalpi untuk reaksi :
3C + Fe2O3 → 2Fe + 3CO, adalah….
A. -932 kJ/mol B. -712 kJ/mol C. -492 kJ/mol D.+492 kJ/mol E. +712 kJ/mol
3. Diketahui data energi ikatan rata-rata sebagai berikut :
H-H = 436 kJ/mol N-H = 391 kJ/mol N≡≡N = 941 kJ/mol
Kalor yang diperlukan untuk menguraikan 34 gram NH3 (Mr = 17)
menjadi unsure-unsurnya adalah…. A. 48,5 kJ/mol
B. 97 kJ/mol C. 145,5 kJ/mol D.194 kJ/mol E. 242,5 kJ/mol
4. Faktor berikut yang tidak mempengaruhi laju reaksi adalah….
A. suhu B. valum C. katalis D.konsentrasi E. luas permukaan
5. Pada reaksi : 2SO2 + O2 ↔ 2SO3 + 45 kkal
Jika suhu diturunkan, yang terjadi adalah…. A. jumlah O2 bertambah
B. jumlah SO2 bertambah C. jumlah SO3 bertambah
6. Larutan jenuh dari L(OH)2 mempunyai pH 10, Ksp dari L(OH)2
adalah…. A. 5 x 10-13 B. 2 x 10-12 C. 5 x 10-10 D.2 x 10-10 E. 2 x 10-8
1. Diketahui kurva reaksi sebagai berikut : 2.
Berdasarkan kurva tersebut, harga H2 adalah ...
A. H1 - H2 - H3
B. H1 + H2 - H4
C. H1 - H3 - H4
D. H1 - H3 + H4
E. H1 + H3 + H4
3. Di antara data kondisi reaksi berikut :
Manakah laju reaksinya paling rendah ... A. 1
B. 2 C. 3 D. 4 E. 5
1. Gas asetilena dapat dihasilkan dari reaksi : CaC2(s) + 2H2O(l) Ca(OH)2(aq) + C2H2(g)
Kalor pembakaran gas asetilen 320 kJ/mol. Jika dalam suatu proses
digunakan 320 gram Kalsium Karbida dengan asumsi hanya 60% CaC2
yang bereaksi, akan dihasilkan kalor sebanyak ... A. 320 kJ
2. H2O(l) H2(g) + O2(g) H = +68,3 kkal
H2(g) + O2(g) H2O(g) H = -57,8 kkal
H2O(l) H2O(s) H = -1,4 kkal
Perubahan entalpi dari es menjadi uap adalah ... A. -11,9 kkal
B. +11,9 kkal C. -91,0 kkal D. +9,1 kkal E. +12,47 kkal
3. Dalam suatu percobaan penentuan laju reaksi P + Q hasil, diperoleh data sebagai berikut:
Dari percobaan di atas dapat disimpulkan bahwa orde reaksi totalnya adalah ...
A. 1 B. 2 C. 3 D. 4 E. 5
4. Diketahui reaksi kesetimbangan pada suhu 725°C
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(l) H = -1169,5 kJ
Kesetimbangan dapat terganggu jika:
1. suhu dinaikkan 3. volume diperbesar 2. tekanan diperbesar 4. hasil reaksi dikeluarkan
Untuk memperoleh gas NO lebih banyak yang dapat dilakukan adalah ...
A. 2 dan 4 B. 2 dan 3 C. 1 dan 4 D. 1 dan 3 E. 1 dan 2
5. Reaksi : 2 CO(g) + O2(g) 2 CO2(g)
Pada suhu tertentu 4 mol CO direaksikan dengan O2, ternyata dalam
kesetimbangan terdapat 2 mol CO. Jika volume ruangan 10 liter dan
harga tetapan kesetimbangan sama dengan 4, maka O2 yang
B. 0,25 mol C. 2,5 mol D. 3,5 mol E. 4 mol
6. Logam Fe (Ar Fe = 56) jika dilarutkan di dalam asam dan direaksikan
dengan KMnO4 akan terjadi reaksi sebagai berikut:
Fe2+
(aq) + Mn2+(aq) + Fe3+(aq)
Jika berat Fe yang dilarutkan 11,2 gram, maka volume KMnO4 0,1 M
yang dibutuhkan untuk reaksi tersebut adalah ... A. 120 ml
B. 160 ml C. 250 ml D. 320 ml E. 400 ml
1. Diketahui : H 0f H
2O(l) = -285,5 kj/mol
H 0f CO
2(g) = -393,5 kj/mol
H 0f C
3H8(g) = -103,0 kj/mol
Perubahan entalpi dari reaksi :
C3H8(g) +5O2(g) 3 CO2(g) + 4 H2O(l) adalah ...
A. -1180,5 kJ B. +1180,5 kJ C. +2219,5 kJ D. -2219,5 kJ E. -2426,5 kJ
2. Diketahui energi ikatan rata-rata : C = C : 146 kkal/mol
C - C : 83 kkal/mol C - H : 99 kkal/mol C - Cl : 79 kkal/mol H - Cl : 103 kkal/mol
Maka perubahan entalpi pada reaksi : C2H4(g) + HCl(g) C2H5Cl(g) adalah ...
A. -510 kkal B. +510 kkal C. +721kkal D. -42 kkal E. -12 kkal
1. Persamaan reaksi pembentuk gas asetilena adalah sebagai berikut:
2C (s) + H2 (g) C2H2 (g) ΔH0
f=−220,7 kJ.mol-1
Energi
C2H2(g)
2C(s) + H (g)
H = 226,7 kJ/mol
Energi
C2H2(g)
C(s) + H(g)
H = 226,7 kJ/mol
Energi
C2H2(g)
C2(s) + H2(g)
H = 226,7 kJ/mol
Energi
C2H2(g)
2C(s) + H2(g)
H = 226,7 kJ/mol
Energi
C2H2(g)
2C2(s) + H(g)
H = 226,7 kJ/mol
A.
B.
C.
D.
E.
2. Entalpi pembakaran suatu bahan bakar besarnya –5,460 kJ/mol. Jika 5,7 gram bahan bakar (mr = 114) tersebut dibakar, maka entalpi pembakaran yang dihasilkan adalah ...
A. 5.460 x
114 5,7 kJ
B.
114
5,7
x 5.460 kJC. 5.460 x 114 kJ D. 5.460 x 5,7 kJ
E.
5,7
x
114
5.460
kJC = C : 839 kJ/mol C – C : 343kJ/mol H – H : 436 kJ/mol C – H : 410 kJ/mol
Perubahan entalpi yang terjadi pada reaksi :
CH3 – C = CH + 2 H2 CH3 – CH2 – CH3 sebesar ...
A. +272 kJ/mol B. – 272 kJ/mol C. –272 kJ/mol D. –272 kJ/mol E. –272 kJ/mol
1. Untuk menentukan perubahan entalpi pelarutan dari urea, kedalam kalorimeter styrofoam yang berisi 50 gram air dimasukkan 12 gram urea (Mr 60) suhunya turun dari 25oC menjadi 18,5 oC, bila kalor jenis
air 4,2 j g-1 K-1 maka perubahan entalpi pelarutan adalah ....
A. 6,825 Kj/mol B. 8,463 Kj/mol C. 68,25 Kj/mol D. 293,475 Kj/mol E. 363,909 Kj/mol
2. Bahan bakar untuk rumah tangga sekarang sudah beralih pada bahan bakar gas. Bila tabung gas yang digunakan LPG komersial butan
(sebagian besar terdiri dari gas butan), Besar energi yang dihasilkan pada pembakaran 1 kg gas LPG adalah ....
(H0f C4H10 = 551,5 Kj/mol, H0f CO2 = 393 Kj/mol, H0f H2O =
242 Kj/mol, dan
tabung gas LPG dianggap hanya berisi gas butan. C = 12, H = 1)
A. 2230,5 Kj B. 3333,5 Kj C. 3845,382 Kj D. 38453,82 Kj E. 57469,54 Kj
3. Gas asetilen (gas karbid) dapat dihasilkan dari Calsium Carbida (CaC2) dalam air. Pada pembakaran gas asetilen dihasilkan energi sebesar 4878 kj dengan reaksi :
C2H2(g) +2½ O2 (g)à2CO2(g) +H2O(g), bila diketahui energi ikatan
rata-rata : C-H 413 kj O=O 495 kj O-H 4 63 kj C-C 839 kj C=O 799 kj
A. 8,96 L B. 15,56 L C. 23,33 L D. 89,6 L E. 300,3 L
4. Perhatikan diagram berikut :
Harga ∆ H3 adalah .... A. (a – b) Kj
B. ( – a – b ) Kj C. (a – b ) Kj D. (a + b ) Kj E. (a + b) Kj
1. Sebanyak 6 g urea dilarutkan dalam 100 g air sehingga suhu berubah dari 28oC menjadi 23oC, maka besarnya entalpi pelarutan dari urea
tersebut adalah .... ( Mr urea : 60, Cp : 4,2 J/gK) (massa urea diabaikan) A. 95,1 kJ/mol
B. 90,3 kJ/mol C. 33,60 kJ/mol D. 22,12 kJ/mol E. 21,00 kJ/mol
2. Diketahui data energi ikatan : C – C : 348 kJ/mol
C = C : 614 kJ/mol C – H : 413 kJ/mol C – Br : 276 kJ/mol H – Br : 366 kJ/mol
adalah ....
E. 57 kJ/mol
1. Jika urea dimasukkan ke dalam gelas berisi beberapa saat serasa dingin, ini menandakan bahwa reaksi antara urea dan air....
A. melepas panas B. energinya berkurang C. eksoterm
D. endoterm
E. membuang energi
2. Reaksi:
C6H12O6 + 6O2 → 6CO2 + 6H2O ; AH = -2820kJ
C6H5OH + 3O2 → 2CO2 + 3H2O ; AH = -1380kJ
Perubahan entalpi fermentasi glukosa (C6HI2O6 → 2C2H5OH + 2CO2) adalah ...
A. +60kJ B. -1440kJ C. -60kJ D. +2880kJ E. +1440kJ
3. Larutan NaOH 1 M sebanyak 100 cm3 direaksikan dengan 100 cm3
larutan HCl 1M dalam sebuah bejana. Tercatat suhu naik dari 29oC
menjadi 37,5oC. Jika larutan dianggap sama dengan air. Kalor jenis air =
4,2 J g–1K–1, massa jenis air = 1 g cm–3, maka perubahan entalpi reaksi
(∆H) netralisasi adalah …
A. +82,3 kJ mol–1
B. –54,6 kJ mol–1
C. +71,4 kJ mol–1
D. –45,9 kJ mol–1
E. –71,4 kJ mol–1
4. Diketahui energi ikatan rata-rata: C-H : 413kJ/mol
C-C : 348kJ/mol H-H : 436kJ/mol C –C : 614kJ/mol
Besarnya perubahan entalpi reaksi: C2H4 + H2 → C2H6 adalah ...
A. –826 kJ/mol B. –124 kJ/mol C. –738 kJ/mol D. –122 kJ/mol E. –560 kJ/mol
1) Serbuk NH4Cl + serbuk Ca(OH)2, timbul gas berbau tidak sedap
disertai penurunan suhu
2) Pita magnesium + larutan H2SO4, pita magnesium larut disertai
kenaikkan suhu
3) Pita tembaga + serbuk belerang, tidak terjadi perubahan, tetapi berubah menjadi zat padat hitam setelah dipanaskan; reaksi berlanjut ketika pemanasan dihentikan
4) Gas N2O4 yang tidak berwarna berubah menjadi coklat jika
dipanaskan; jika pemanasan dihentikan, perlahan-lahan kembali tidak berwarna.
Proses yang tergolong reaksi endoterm adalah .... A. 1 dan 3
B. 3 dan 4 C. 2 dan 4 D. 1 dan 4 E. 2 dan 3
2. Di antara persamaan termokimia berikut yang perubahan entalpinya dapat dikatakan sebagai entalpi pembentukan adalah ....
A. 2H(g) + O(g) H2O(l) ∆H = - 926 kJ
B. H+(aq) + OH(aq) H
2O(l) ∆H = - 926 kJ
C. C2(s) + 2H2(g) C2H4(g) ∆H = + 54 kJ
D. 2H2(g) + O2(g) H2O(g) ∆H = - 484 kJ
E. 2C(s) + 3H2O(g) + ½O2(g) C2H6O(l) ∆H = - 277,7 kJ
3. Jika C(s) + O2(g) → CO2(g) ∆H = –395,2 kJ
CO(s) + ½O2(g) → CO2(g) ∆H = –284,3 kJ
maka ∆H pembentukan 1 mol CO adalah … A. –679,5
B. +284,3 kJ C. –110,9 kJ D. +679,5 kJ E. +110,9 kJ
4. Diketahui energi ikatan dari O – H = 464 kJ
O = O = 500 kJ H – H = 436 kJ
Kalor yang diperlukan untuk menguraikan 9 gram air (Mr = 18) adalah ...…
26. Jika urea dimasukkan ke dalam gelas berisi beberapa saat serasa dingin, ini menandakan bahwa reaksi antara urea dan air....
A. melepas panas D. energinya berkurang
B. eksoterm E. endoterm
C. membuang energi
27. Reaksi:
C6H12O6 + 6O2 → 6CO2 + 6H2O ; AH = -2820kJ
C6H5OH + 3O2 → 2CO2 + 3H2O ; AH = -1380kJ
Perubahan entalpi fermentasi glukosa (C6HI2O6 → 2C2H5OH + 2CO2)
adalah ...
A. +60kJ D. -1440kJ
B. -60kJ E. +2880kJ
C. +1440kJ
28. Larutan NaOH 1 M sebanyak 100 cm3 direaksikan dengan 100 cm3
larutan HCl 1M dalam sebuah bejana. Tercatat suhu naik dari 29oC
menjadi 37,5oC. Jika larutan dianggap sama dengan air. Kalor jenis
air = 4,2 J g–1K–1, massa jenis air = 1 g cm–3, maka perubahan entalpi
reaksi (∆H) netralisasi adalah …
A. +82,3 kJ mol–1 D. –54,6 kJ mol–1
B. +71,4 kJ mol–1 E. –45,9 kJ mol–1
C. –71,4 kJ mol–1
29. Diketahui energi ikatan rata-rata:
C-H : 413kJ/mol
C-C : 348kJ/mol
H-H : 436kJ/mol
C -C : 614kJ/mol
Besarnya perubahan entalpi reaksi: C2H4 + H2 → C2H6 adalah ...
A. –826 kJ/mol D. –124 kJ/mol
B. –738 kJ/mol E. –122 kJ/mol
C. –560 kJ/mol
26. Sebuah kristal KNO3 dimasukkan ke dalam tabung reaksi, kemudian
ditetesi dengan air. Pada dasar tebung reaksi terasa dingin. Reaksi ini dapat diigolongkan ....
D. endotrm, energi berpindah dari lingkungan ke sistem E. endotrm, energi tidak berpindah
27. Perhatikan doagram tingkat energi sebagai berikut:
Berdasarkan diagram di atas, hubungan antara ∆H1, ∆H2 dan ∆H3
yang benar adalah …
A. ∆H2 = ∆H1 – ∆H3 D. ∆H3 = ∆H1 + ∆H2
B. ∆H2 = ∆H3 + ∆H1 E. ∆H3 = ∆H2 – ∆H1
C. ∆H3 = ∆H1 – ∆H2
28. Larutan NaOH 1 M sebanyak 100 cm3 direaksikan dengan 100 cm3
larutan HCl 1M dalam sebuah bejana. Tercatat suhu naik dari 29oC
menjadi 37,5oC. Jika larutan dianggap sama dengan air. Kalor jenis air
= 4,2 J g–1K–1, massa jenis air = 1 g cm–3, maka perubahan entalpi
reaksi (∆H) netralisasi adalah …
A. +82,3 kJ mol–1 D. –54,6 kJ mol–1
B. +71,4 kJ mol–1 E. –45,9 kJ mol–1
C. –71,4 kJ mol–1
29. Diketahui energi ikatan rata-rata dari:
C=C = 607 kJ/mol O–H = 460 kJ/mol
C–C = 343 kJ/mol C–O = 351 kJ/mol
C–H = 410 kJ/mol
Perubahan entalpi dari reaksi : CH2=CH2 + H2O → CH3–CH2–OH
adalah …
A. +313 kJ/mol D. – 37 kJ/mol
B. +111 kJ/mol E. – 74 kJ/mol
C. + 37 kJ/mol
26. Perhatikan berbagai hasil percobaan berikut:
1. Serbuk NH4Cl + serbuk Ca(OH)2, timbul gas berbau tidak sedap
disertai penurunan suhu
2. Pita magnesium + larutan H2SO4, pita magnesium larut disertai
kenaikkan suhu
C(g)+2H2(g)+O2(g)
CH4(g)+O2(g)
CO2(g)+2H2O
∆H1
∆H2
3. Pita tembaga + serbuk belerang, tidak terjadi perubahan, tetapi berubah menjadi zat padat hitam setelah dipanaskan; reaksi berlanjut ketika pemanasan dihentikan
4. Gas N2O4 yang tidak berwarna berubah menjadi coklat jika
dipanaskan; jika pemanasan dihentikan, perlahan-lahan kembali tidak berwarna.
Proses yang tergolong reaksi endoterm adalah ....
A. 1 dan 3 D. 3 dan 4
B. 2 dan 4 E. 1 dan 4
C. 2 dan 3
27. Di antara persamaan termokimia berikut yang perubahan entalpinya
dapat dikatakan sebagai entalpi pembentukan adalah ....
A. 2H(g) + O(g) H2O(l) ∆H = - 926 kJ
B. H+(aq) + OH(aq) H
2O(l) ∆H = - 926 kJ
C. C2(s) + 2H2(g) C2H4(g) ∆H = + 54 kJ
D. 2H2(g) + O2(g) H2O(g) ∆H = - 484 kJ
E. 2C(s) + 3H2O(g) + ½O2(g) C2H6O(l) ∆H = - 277,7
kJ
28. Jika C(s) + O2(g) → CO2(g) ∆H = –395,2 kJ
CO(s) + ½O2(g) → CO2(g) ∆H = –284,3 kJ
maka ∆H pembentukan 1 mol CO adalah …
A. –679,5 kJ D. +284,3 kJ
B. –110,9 kJ E. +679,5 kJ
C. +110,9 kJ
29. Diketahui energi ikatan dari
O – H = 464 kJ O = O = 500 kJ H – H = 436 kJ
Kalor yang diperlukan untuk menguraikan 9 gram air (Mr = 18) adalah …
A. 8 kJ D. 242 kJ
B. 121 kJ E. 472 kJ
C. 222 kJ
26. Berikut ini :
1. alkohol 95% jika dioleskan pada kulit akan teasa dingin.
2. kristal Ba(OH)2 dicampur NH4Cl ditambah sedikit air, jika tempatnya
dipegang akan terasa dingin
ΔH3 = +33,85 kJ/mol
5. jika menghidupkan kendaraan bermotor beberpa saat maka mesinnya akan terasa panas.
Yang tergolong reaksi endoterm adalah ….
A. 1, 2, 3 D. 3, 5
B. 1, 2, 4 E. 1, 2, 3, 5
C. 2, 3
27. Diketahui perubahan entalpi reaksi-reaksi berikut ini:
C (s) + 2H2 (g) → CH4 (g) ∆H = -74,9 kJ
C (s) + O2 (g) → CO2 (g) ∆H = -393,7 kJ
H2 (g) + ½ O2 (g) → H2O (g) ∆H = -285,9 kJ
Perubahan entalpi untuk reaksi:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g) adalah....
A. - 604,7 kJ D. -1284,3 kJ
B. -1040,3 kJ E. - 998,4 kJ
C. - 890,6 kJ
28. Diberikan diagram tingkat energi sebagai berikut
Perubahan entalpi pembentukan gas NO dalam kJ/mol adalah …
A. -33,85 D. +56,52
B. -22,67 E. +90,37
C. +22,67
29. Bila data entalpi pembentukan standar:
C3H8 (g) = – 104 kJ mol–1
CO2 (g) = – 394 kJ mol–1
NO(g)+½O2(g)
NO2
½N2(g)+O2(g)
H2O (g) = – 286 kJ mol–1
maka harga ΔH reaksi :
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l) adalah …
A. –1.024 kJ D. –2.222 kJ
B. –1.121 kJ E. –2.232 kJ
C. –1.134 kJ
1. Pada percapuran 50 mL larutan NaOH M dengan 50 mL larutan HCl
1M terjadi kenaikan suhu 6ºC. Jika diketahui kalor jenis larutan 4,2 J g–1
K–1, maka perubahan entalpi reaksi
NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l)
adalah . . . . A. –1,26 kJ B. –2,52 kJ C. –25,2 kJ D.–50,4 kJ E. –100,8 kJ
2. Di antara persamaan termokimia berikut yang perubahan entalpinya
dapat dikatakan sebagai entalpi pembentukan adalah . . . . A. 2H(g) + O(g) H2O(l) H = 926 kJ
B. H+(aq) + OH–(aq) H
2O(l) H = 54 kJ
C. C2(s) + 2H2(g) C2H4(g) H = +54 kJ
D. H2(g) + ½ O2(g) H2O(g) H = 242 kJ
E. 2H2(g) + O2(g) 2H2O(g) H = 484 kJ
3. Diketahui persamaan termokimia sebagai berikut:
H2(g) + F2(g) 2HF(g) H = 540 kJ
C(s) + 2F2(g) CF4(g) H = 680 kJ
2C(s) + 2H2(g) C2H4(g) H = +50 kJ
Berdasarkan data tersebut, maka perubahan entalpi reaksi berikut adalah . . . .
C2H4(g) + 6F2(g) 2CF4(g) + 4HF(g)
E. 2630 kJ
4. Diketahui:
2H2(g) + O2(g) → 2H2O(g) ∆H = – 480 kJ
Energi ikatan O=O : 500 kJ mol–1
H – H : 430 kJ mol–1
Dapat ditentukan energi ikatan O – H dalam air adalah . . . . A. 220 kJmol–1
B. 440 kJ mol –1
C. 460 kJ mol–1
D.960 kJ mol–1
E. 1840 kJ mol–1
5. Propil energi suatu reaksi sebagai berikut:
Energi pengaktifan reaksi tersebut adalah . . . . A. E1