UJI SITOTOKSISITAS EKSTRAK KLOROFORM DAUN PACAR AIR (Impatiens balsamina L.) TERHADAP KULTUR SEL SiHa
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh : Widya Adhitama NIM : 058114069
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2009
UJI SITOTOKSISITAS EKSTRAK KLOROFORM DAUN PACAR AIR (Impatiens balsamina L.) TERHADAP KULTUR SEL SiHa
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh : Widya Adhitama NIM : 058114069
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2009
Bersukacitalah dalam pengharapan, sabarlah dalam
kesesakan, dan bertekunlah dalam doa
(Roma 12 : 12)
Karena
Ia membuat segala sesuatu indah pada waktunya,
bahkan Ia memberikan kekekalan dalam hati
mereka
(Pengkhotbah 3 : 11a)
Kupersembahkan karya kecilku ini untuk: Tuhan Yesus Kristus pemilik hidupku Papa dan mama Kakak-kakak ku dan keponakanku Sahabat-sahabatku Almamaterku…
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya
sehingga penulis dapat menyelesaikan skripsi yang berjudul: “Uji Sitotoksisitas
Ektrak Kloroform Daun Pacar Air Terhadap Kultur Sel SiHa”, sebagai salah satu
syarat untuk memperoleh gelar kesarjanaan Strata satu (S-1).
Dalam proses penyusunan skripsi ini, penulis banyak mendapat bantuan
berupa bimbingan, dorongan, sarana, dari berbagai pihak. Oleh karena itu, penulis
mengucapkan terima kasih kepada:
1. Ibu Rita Suhadi, M. Si., Apt., selaku Dekan Fakultas Farmasi, Universitas
Sanata Dharma, Yogyakarta.
2. Bapak Drs. A. Yuswanto S.U., Ph.D., selaku Dosen Pembimbing, atas
bimbingan, pengarahan, dan dukungan selama penelitian sampai penyusunan
skripsi ini.
3. Bapak Ign. Y. Kristio Budiasmoro M.Si., Romo Sunu, serta Bapak Aris
Dwiatmaka yang telah banyak membantu dalam penyelesaian skripsi ini.
4. Ibu Tri Yuliani dan segenap karyawan LPPT Universitas Gadjah Mada yang
telah banyak membantu dalam pelaksanaan penelitian.
5. Papa dan Mamaku tercinta, Mbak Vivi, Mas Silo, Mas Ary, keponakan ku
Vio dan Eren atas segala dukungan, kasih sayang dan keceriaan yang
diberikan.
6. Sahabat - sahabat setiaku Ika, Nia, Sukma, Dewi,Yesi, dek Lulu, dek Jati, dek
Oline, Adith, Rafi, Mbak Eva, Wahyu, Eka, atas dukungan, semangatnya
selama ini dan buat persahabatan kita.
7. PMK Apostolos keluarga kedua ku, terima kasih karena aku boleh bertumbuh
bersama kalian. Aku percaya bahwa bukan suatu kebetulan aku berada di
tengah – tengah kalian dan menjadi bagian dari keluarga Apostolos.
8. Anni dan Lise buat suka duka selama dalam penelitian ini makasih buat
semangat dan pengertian kalian.
9. Temen – temen farmasi angkatan 2005 kelas B dan FKK 2005 makasih buat
semangatnya dan kebersamaan selama ini.
10. Mas Wagiran, dan Mas Sigit yang telah membantu dalam penelitian.
11. Semua pihak yang telah membantu penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh
karena itu, penulis mengharapkan adanya saran dan kritik yang membangun demi
kesempurnaan skripsi ini. Namun, penulis berharap semoga skripsi ini dapat
bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
Yogyakarta, Mei 2009
Penulis
INTISARI
Kanker merupakan penyakit yang dapat menyebabkan kematian. Banyak penelitian yang telah dilakukan untuk mendapatkan senyawa baru yang dapat mengobati kanker. Secara empiris tanaman pacar air (Impatiens balsamina) telah digunakan untuk melancarkan persalinan, peluruh haid, dan untuk kanker saluran pencernaan bagian atas. Penelitian ini bertujuan untuk mengetahui apakah ekstrak kloroform daun pacar air mempunyai efek sitotoksik terhadap kultur sel SiHa dan sel Vero.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan lengkap pola satu arah. Konsentrasi ekstrak kloroform daun pacar air yang digunakan adalah 30; 40; 50; 60; 70; 80; 90; dan 100 µg/ml. Uji sitotoksik dilakukan menggunakan metode direct counting. Hasil perhitungan merupakan prosentase kematian sel yang kemudian dianalisis z-test dan analisis probit untuk menentukan nilai LC50.
Melalui uji sitotoksisitas ini dapat diketahui bahwa ekstrak kloroform daun pacar air mempunyai efek sitotoksik terhadap kultur sel SiHa maupun sel Vero dengan LC50 sebesar 52,5 µg/ml dan 275,4 µg/ml.
Kata kunci: sitotoksisitas, kanker, daun pacar air, sel SiHa, sel Vero, LC50
ABSTRACT
Cancer is a kind of disease that might cause death. Many researches have been done to obtain new compounds for cancer treatment. Empiricaly, Impatiens balsamina has been used for partufasien, emenagog, and antitumor. This study aimed to determine whether the chloroform extract of Impatiens balsamina leaves has a cytotoxic effect against SiHa and Vero cell cultures.
This research was a pure experimental with one way completely randomized design. Chloroform extract of Impatiens balsamina was made in concentrations that were 30; 40; 50; 60; 70; 80; 90; dan 100 µg/ml. Cytotoxicity test was conducted against SiHa cell using direct counting method. Percentage of death cell data were analyzed by z-test and probit analysis to determine the LC50
values.
Through this cytotoxicity test, it can be noted that the chloroform extract of Impatiens balsamina leaves have cytotoxicity effect against both SiHa cell and Vero cells with LC50 of 52,5 µg/ml and 275,4 µg/ml, respectively.
Keyword: cytotoxicity, cancer, Impatiens balsamina leaves, SiHa cell, Vero cell, LC50
DAFTAR ISI
Halaman
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ...v
PRAKATA... vi
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI... ix
ABSTRACT...x
DAFTAR ISI... xi
DAFTAR TABEL... xiv
DAFTAR GAMBAR ...xv
DAFTAR LAMPIRAN... xvii
BAB I. PENGANTAR ...1
A. Latar Belakang ...1
1. Permasalahan ...3
2. Keaslian penelitian ...3
3. Manfaat penelitian ...3
B. Tujuan Penelitian ...4
1. Tujuan umum...4
2. Tujuan khusus...4
BAB II. PENELAAHAN PUSTAKA...5
A. Tanaman Pacar Air ...5
1. Keterangan botani...5
2. Kandungan kimia ...5
3. Khasiat dan penggunaan...5
4. Penelitian tanaman pacar air...6
B. Naftokuinon ...6
C. Teknik Penyarian ...7
D. Kanker ...8
E. Kultur Sel ...9
1. Sel Vero...9
2. Sel SiHa...9
F. Uji Sitotoksisitas ...9
G. Landasan Teori ...10
H. Hipotesis ...11
BAB III. METODE PENELITIAN ...12
A. Jenis dan Rancangan Penelitian...12
B. Variabel Penelitian dan Definisi Operasional...12
1. Variabel penelitian...12
2. Definisi operasional ...13
C. Alat dan Bahan ...13
1. Alat ...13
2. Bahan ... ….14
D. Tata Cara Penelitian ...14
1. Determinasi tanaman ...14
2. Pengumpulan daun pacar air...15
3. Ekstraksi ...15
4. Sterilisasi alat...15
5. Pembuatan medium pencuci dan penumbuh ...16
6. Propagasi dan panen sel SiHa dan sel Vero ...16
7. Pembuatan larutan uji ...17
8. Uji sitotoksisitas ekstrak kloroform daun pacar air dengan menggunakan metode direct counting...18
9. Analisis hasil...18
BAB IV. PEMBAHASAN...20
A. Determinasi Tanaman... 20
B. Pengumpulan Daun Pacar Air ... 20
C. Pembuatan Ekstrak Kloroform Daun Pacar Air ... 21
D. Sterilisasi Alat ... 22
E. Pembuatan Medium Penumbuh dan Pencuci... 22
F. Preparasi Kultur Sel SiHa ... 23
G. Uji Sitotoksisitas Ekstrak Kloroform Daun Pacar Air ... 24
BAB V. KESIMPULAN DAN SARAN ...35
A. Kesimpulan...35
B. Saran ...35
DAFTAR PUSTAKA ...36
LAMPIRAN...39
BIOGRAFI PENULIS ...63
DAFTAR TABEL
Tabel I. Hasil Perhitungan Prosentase Kematian Sel SiHa Setelah Inkubasi 24
Jam ...26
Tabel II. Hasil Perhitungan Prosentase Kematian Sel Vero Setelah Inkubasi 24
Jam ...27
Tabel III. Data Perhitungan Jumlah Kultur Sel SiHa Dengan Metode Direct
Counting...41
Tabel IV. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel SiHa Pada
Replikasi 1...43
Tabel V. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel SiHa Pada
Replikasi 2...46
Tabel VI. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel SiHa Pada
Replikasi 3...48
Tabel VII. Data Perhitungan Jumlah Kultur Sel Vero Dengan Metode Direct
Counting...49
Tabel VIII. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel Vero Pada
Replikasi 1...51
Tabel IX. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel Vero Pada
Replikasi 2...54
Tabel X. Data % Kematian, Harga Probit, dan Log Konsentrasi Sel Vero Pada
Replikasi 3...56
Tabel XI. Nilai r (koefisien korelasi) pada level signifikansi 5% dan 1% ...57
DAFTAR GAMBAR
Gambar 1. Struktur 2-metoksi-1,4-naftokuinon...6
Gambar 2. Morfologi sel setelah pemberian trypan blue, pada bilik
haemocytometer dengan perbesaran 100x ...25
Gambar 3. Morfologi sel yang hidup pada kontrol sel SiHa dilihat dengan
perbesaran 100x ...28
Gambar 4. Morfologi sel yang hidup pada kontrol sel Vero dilihat dengan
perbesaran 100x ...28
Gambar 5. Sel SiHa pada konsentrasi ekstrak 60 µg/ml dilihat dengan
perbesaran 100x ...28
Gambar 6. Sel Vero pada konsentrasi ekstrak 100 µg/ml dilihat dengan
perbesaran 100x ...29
Gambar 7. Grafik pengaruh kadar ekstrak kloroform daun pacar air terhadap
prosentase kematian sel SiHa...29
Gambar 8. Grafik pengaruh kadar ekstrak kloroform daun pacar air terhadap
prosentase kematian sel Vero...29
Gambar 9. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel SiHa replikasi 1 ...30
Gambar 10. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel SiHa replikasi 2 ...31
Gambar 11. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel SiHa replikasi 3 ...31
Gambar 12. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel Vero replikasi 1...32
Gambar 13. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel Vero replikasi 2...32
Gambar 14. Grafik hubungan log konsentrasi ekstrak terhadap harga probit pada
sel Vero replikasi 3...33
Gambar 15. Tanaman pacar air ...41
Gambar 16. Daun pacar air ...41
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi... ...40
Lampiran 2. Tanaman Pacar Air yang digunakan dalam penelitian... ...41
Lampiran 3. Perhitungan LC50 ekstrak kloroform daun pacar air terhadap sel
Siha menggunakan analisis probit... ...42
Lampiran 4. Perhitungan LC50 ekstrak kloroform daun pacar air terhadap sel
Vero menggunakan analisis probit... ...50
Lampiran 5. Perhitungan uji linearitas untuk analisis regresi... ….58
Lampiran 6. Analisis statistik uji z antara kelompok kontrol dan perlakuan ….59
Lampiran 7. Uji t terhadap log LC50 sel SiHa dan Sel Vero... ...63
BAB I PENGANTAR
A. Latar Belakang
Timbulnya penyakit kanker di Indonesia erat kaitannya dengan peralihan
Indonesia dari negara pertanian menjadi negara industri yang mengubah perilaku
atau gaya hidup dan kebiasaan masyarakat (Anonim, 2008a). Kanker leher rahim
merupakan tumor ganas yang paling sering menyerang wanita, terutama yang
disertai dengan predisposisi tertentu seperti wanita yang sering berganti-ganti
pasangan, kawin muda, berhubungan seksual pertama kali pada umur < 20 tahun.
Di negara yang telah maju dan berhasil membasmi penyakit infeksi,
kanker merupakan penyebab kematian kedua setelah penyakit kardiovaskuler.
Pada saat ini dari metode pengobatan yang telah dilakukan, 1/3 jumlah pasien
tertolong melalui pembedahan dan terapi radiasi. Kesembuhan hampir seluruhnya
terjadi pada pasien yang penyakitnya belum menyebar pada saat pembedahan
(Ganiswara dan Nafrialdi, 1995). Menurut WHO, setiap tahun jumlah penderita
kanker di dunia bertambah 6,25 juta orang. Di Indonesia diperkirakan setiap
tahunnya terdapat 100 penderita kanker yang baru dari setiap 100.000 penduduk
(Anonim, 2008a). Mahalnya biaya pengobatan membuat banyak kalangan
masyarakat mulai beralih pada pengobatan tradisional menggunakan berbagai
macam tanaman obat alami (Soedibyo, 1998).
Antikanker diharapkan memiliki toksisitas selektif artinya
menghancurkan sel kanker tanpa merusak sel jaringan normal. Pada umumnya
antineoplastik menekan pertumbuhan atau proliferasi sel dan menimbulkan
toksisitas. Terapi hanya dapat dikatakan berhasil baik, bila dosis yang digunakan
dapat mematikan sel tumor yang ganas dan tidak terlalu mengganggu sel normal
(Ganiswara dan Nafrialdi, 1995).
Khasiat dari tanaman pacar air (Impatiens balsamina) secara empiris
untuk melancarkan peredaran darah, peluruh haid, melancarkan persalinan.
Tanaman ini juga diindikasikan untuk mengobati kanker saluran cerna bagian atas
(Dalimartha, 2007).
Penelitian tentang ekstrak kloroform daun pacar air yang dilakukan di
China menunjukkan bahwa ekstrak tersebut memiliki aktivitas anti tumor
terhadap hepatocelular carcinoma cell line Hep-G2. Senyawa aktif yang
diidentifikasi sebagai anti tumor tersebut adalah 2-metoksi 1,4-naftokuinon
(Zhi-Shan et al., 2008).
Perlu dilakukannya penelitian ekstrak tersebut terhadap sel kanker.
Penelitian ini dilakukan dengan menggunakan sel SiHa untuk mengetahui apakah
ekstrak kloroform daun pacar air ini mempunyai efek sitotoksik terhadap sel
kanker. Digunakan sel SiHa karena mempunyai persamaan dengan hepatocelular
carcinoma cell line Hep-G2 yaitu keduanya diambil dari jaringan epitel dan
merupakan kanker yang disebabkan karena virus (Anonim, 2008c). Berdasarkan
hasil, sitotoksisitas ekstrak kloroform daun pacar air ini selanjutnya dapat
digunakan sebagai dasar untuk mengembangkan suatu senyawa antikanker
1. Permasalahan
Berdasarkan latar belakang tersebut maka dapat ditarik suatu
permasalahan sebagai berikut:
a. Apakah ekstrak kloroform daun pacar air mempunyai efek sitotoksik
terhadap sel SiHa ?
b. Seberapa besar nilai LC50 dari ekstrak kloroform daun pacar air terhadap
sel SiHa ?
2. Keaslian penelitian
Penelitian mengenai Uji Sitotoksisitas Ekstrak Kloroform Daun Pacar
Air Terhadap Sel Kultur SiHa sejauh penelusuran penulis belum pernah
dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi mengenai
khasiat, penggunaan dan efek sitotoksisitas ekstrak kloroform daun pacar
air terhadap kultur sel SiHa yang dapat menambah kemajuan ilmu
pengetahuan khususnya dibidang kefarmasian.
b. Manfaat praktis
Penelitian ini diharapkan dapat membuktikan khasiat daun pacar
B. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui apakah ekstrak kloroform
daun pacar air ini memiliki potensi yang dapat dikembangkan sebagai
senyawa anti kanker.
2. Tujuan khusus
a. Untuk mengetahui potensi sitotoksisitas ekstrak kloroform daun pacar air
terhadap kultur sel SiHa.
b. Untuk mengetahui seberapa besar nilai LC50 dari ekstrak kloroform daun
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Pacar Air 1. Keterangan botani
Tanaman Pacar Air (Impatiens balsamina) merupakan anggota familia
Balsaminaceae (Backer dan Brink, 1986). Tanaman ini berupa terna semusim
yang biasa ditanam di halaman sebagai tanaman hias atau tumbuhan liar di
tempat yang cukup mendapat air dan sinar matahari. Mempunyai daun
tunggal, bertangkai dan berbentuk lanset memanjang, tepi bergerigi tajam,
ujung dan pangkal menyirip, warna hijau (Dalimatha, 2007). Nama lain dari
tanaman ini adalah Lahine (Nias), Paru inai (Minangkabau) (Dalimartha,
2003).
2. Kandungan kimia
Daun: 2-metoksi 1,4-naftokuinon (Thongnopnua et al., 1991).
Biji: saponin, balsaminasterol, kuersetin, naftokuinon (Dalimartha, 2003).
Bunga: sianidin, delphinidin, malvidin, kaempherol, kuersetin (Dalimartha,
2003).
3. Khasiat dan penggunaan
Melancarkan peredaran darah, peluruh haid, melancarkan persalinan,
dan diindikasikan untuk mengobati kanker saluran cerna bagian atas
(Dalimartha, 2007).
4. Penelitian tanaman pacar air
Penelitian - penelitian yang telah dilakukan sebelumnya menunjukkan
bahwa tanaman pacar air dapat digunakan untuk obat topikal yang mempunyai
efek antipruritik yang dapat mengobati beberapa tipe dari dermatitis. Telah
dilaporkan juga tanaman tersebut digunakan sebagai antianafilaksis,
antihistamin, antiplatelet. Senyawa aktif utama dari tanaman pacar air adalah
1,4-naftokuinon (balsakuinon) (Oku dan Kyoko, 2002). Pada penelitian yang
lain, balsakuinon yang merupakan senyawa aktif dari daun pacar air memiliki
aktivitas antifungal (Thongnopnua et al., 1991).
B. Naftokuinon
O
O
OCH3
Gambar 1. Struktur 2-metoksi-1,4-naftokuinon
Senyawa naftokuinon merupakan senyawa aromatik alami yang mempunyai ciri mengandung satu rantai samping alifatik yang terikat pada cincin aromatik. Semua senyawa kuinon berupa minyak atau hablur yang mempunyai rentang warna mulai dari kuning sampai merah dan sangat mudah larut dalam pelarut organik seperti benzena, eter dan kloroform (Robinson, 1995).
anti tumor yang kuat (Anonim, 2008b). Senyawa
5-hidroksi-2-metil-1,4-naftokuinon mampu secara efektif melawan kanker payudara dengan menghambat
pertumbuhan sel kanker payudara dengan tidak memberikan efek terhadap sel
epitelial payudara normal (Ahmad et al., 2008). Suatu penelitian tentang senyawa
2-metoksi-1,4 naftokuinon dalam ekstrak daun pacar air identifikasi sebagai
senyawa yang mempunyai aktivitas terhadap human hepatocellular carcinoma
cell line HepG2 (Zhi-Shan et al., 2008).
C. Teknik Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan
yang tidak dapat larut dengan pelarut cair. Simplisia yang disari, mengandung zat
aktif yang dapat larut dan zat yang tidak larut seperti serat, karbohidrat, protein
dan lain – lain. Faktor yang mempengaruhi kecepatan penyarian adalah kecepatan
difusi zat yang larut melalui lapisan-lapisan batas antara cairan penyari dengan
bahan yang mengandung zat tersebut (Anonim, 1986). Ekstrak adalah sediaan
pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau
simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir
semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan
sedemikian hingga memenuhi baku yang telah ditetapkan (Anonim, 1995).
Pelarut merupakan cairan penyari untuk ekstrak sebaiknya sesuai dengan
zat aktif yang berkhasiat, dalam arti dapat memisahkan zat aktif tersebut dari
senyawa lainnya dalam bahan sehingga ekstrak mengandung sebagian besar
Maserasi merupakan cara penyarian yang sederhana dan digunakan
simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari.
Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari.
Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan
konsentrasi antara larutan zat aktif di dalam sel dengan di luar sel, maka larutan
yang pekat akan keluar (Anonim, 1986).
D. Kanker
Kanker adalah kelainan genetik yang merupakan akibat dari peristiwa
-peristiwa mutasi. Mutasi tersebut mengubah fungsi normal suatu sel itu menjadi
memiliki ciri – ciri berikut: (1) sel menjadi immortal, yaitu mampu melakukan
pembelahan sel secara tak terbatas, (2) sel menjadi independen dari kontrol –
kontrol selular normal yang membatasi pertumbuhan dan pembelahan, dan (3) sel
itu menjadi invasif dengan menyebar ke jaringan – jaringan lain, dalam sebuah
proses yang disebut metatasis (Elrod dan William, 2002).
Tumor dapat dibedakan menjadi 2 yaitu tumor jinak (benigna) dan tumor
ganas (malignan). Tumor benigna bukanlah kanker. Tumor benigna tumbuh di
dalam suatu kapsul yang dikemas dengan baik dimana membatasi ukuran dan
memelihara karakteristik sel asal, serta jarang menyebabkan kematian. Sel dari
tumor benigna tidak menyebar ke bagian lain pada tubuh. Kebalikkannya tumor
malignan merupakan kanker, biasanya lebih serius dan dapat mengancam hidup.
Sel kanker dapat menyerang dan merusak organ dan jaringan didekatnya (Dipiro,
E. Kultur Sel 1. Sel Vero
Kultur sel Vero dimulai pertama kalinya pada tahun 1962 yang diambil
dari ginjal kera (jenis African Green Monkey) yang sehat sehingga sering
digunakan sebagai contoh dari sel normal (Doyle dan Griffiths, 2000).
2. Sel SiHa
Infeksi HPV (Human Papilomavirus) merupakan faktor tertinggi
penyebab kanker leher rahim. Sel SiHa diambil dari suatu karsinoma serviks yang
banyak digunakan sebagai model dari sel karsinoma serviks (Ishibashi et al.,
2008).
Serviks atau leher rahim merupakan bagian ujung bawah rahim yang
menonjol ke vagina. Kanker leher rahim berkembang secara bertahap, tetapi
progresif. Proses terjadinya kanker ini dimulai dengan sel yang mengalami mutasi
lalu berkembang sehingga terjadi kelainan epitel yang disebut displasia
(Dalimartha, 2007). Human Papilomavirus (HPV) 16 mempunyai peran dalam
terjadinya karsinoma serviks (Arjono, 1999).
F. Uji Sitotoksisitas
Sitotoksisitas ialah sifat toksis atau beracun suatu senyawa terhadap sel
hidup. Uji sitotoksisitas ialah suatu uji yang secara in vitro menggunakan kultur
sel dalam mengevaluasi keamanan obat, makanan, kosmetik, maupun
bahan-bahan kimia lainnya (Freshney, 2000).
Metode direct counting merupakan uji yang umum dan sering digunakan
untuk penghitungan sel yang akurat dan efisien yaitu dengan haemocytometer.
untuk mempermudah penghitungan. Pada saat suspensi sel dimasukkan ke dalam
bilik, dapat langsung dilakukan pengamatan di bawah mikroskop dan sel dihitung
pada sejumlah bilik pada haemocytometer. Trypan blue berguna untuk
memastikan analisis kuantitatif dari kondisi kultur sel. Trypan blue merupakan zat
warna yang hanya akan dapat menembus membran sel yang mati. Ketika suspensi
sel diberi trypan blue, sel yang hidup akan tetap berbentuk bulat dan bersinar
sedangkan sel yang mati mengalami perubahan menjadi berwarna biru tua. Hal
yang perlu diperhatikan pada saat pengisian suspensi sel ke dalam bilik pada
haemocytometer yaitu agar tidak ada gelembung yang dapat menyebabkan
terjadinya kesalahan dalam penghitungan sel. Kondisi lain yang menentukan
keakuratan dalam penghitungan sel adalah kebersihan bilik hitung dan ketepatan
dalam pengisian suspensi sel ke dalam bilik (Doyle dan Griffiths, 2000).
Pada penelitian dengan Brine Shrimp Test menyatakan bahwa suatu
ekstrak atau bahan dikatakan mempunyai efek sitotoksik jika memiliki LC50 <
1000 µg/ml dan mempunyai efek toksik yang berpotensi sebagai anti kanker jika
memiliki LC50 < 30 µg/ml (Meyer et al., 1982).
G. Landasan Teori
Sel SiHa merupakan model dari sel karsinoma serviks. Terjadinya
karsinoma serviks diperantarai oleh Human Papilomavirus (HPV) 16. Dewasa ini
produk herbal sangat berkembang. Banyak tanaman diteliti untuk digunakan
sebagai obat kanker, salah satunya adalah pacar air. Dalam suatu penelitian daun
terhadap human hepatoscellular carcinoma cell line HepG2. Senyawa tersebut
adalah 2-metoksi-1,4 naftokuinon (Zhi-Shan et al., 2008).
Berdasarkan penelitian tersebut, maka perlu dilakukan penelitian apakah
ekstrak kloroform daun pacar air mempunyai efek sitotoksik terhadap kultur sel
SiHa.
H. Hipotesis
Ekstrak kloroform daun pacar air memiliki efek sitotoksik terhadap
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan penelitian
Penelitian tentang uji sitotoksisitas ekstrak kloroform daun pacar air
(Impatiens balsamina) terhadap kultur sel SiHa ini termasuk penelitian
eksperimental murni yang mengikuti rancangan acak lengkap pola satu arah.
Penelitian ini dilakukan di Laboratorium Penelitian dan Pengujian Terpadu
(LPPT) Universitas Gadjah Mada, Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas
Kadar ekstrak kloroform daun pacar air untuk perlakuan terhadap sel
SiHa yaitu 30 µg/ml; 40 µg/ml; 50 µg/ml; 60 µg/ml; 70 µg/ml; 80 µg/ml; 90
µg/ml; 100 µg/ml. Untuk perlakuan terhadap sel Vero yaitu 100 µg/ml; 200
µg/ml; 300 µg/ml; 400 µg/ml; 500 µg/ml; 600 µg/ml; 700 µg/ml; 800 µg/ml
b. Variabel tergantung
Persentase kematian sel SiHa dan sel Vero
c. Variabel pengacau terkendali
i. Medium tumbuh sel SiHa dikendalikan dengan menggunakan medium
RPMI 1640-serum dan untuk sel Vero dengan medium M199.
ii. Umur dan tempat tumbuh tanaman pacar air.
Daun pacar air yang digunakan untuk penelitian ini diperoleh dari tempat
yang sama dan umur yang sama.
2. Definisi operasional
1. Sitotoksisitas adalah sifat toksik atau beracun dari ekstrak kloroform daun
pacar air terhadap kultur sel SiHa.
2. Sel SiHa adalah sel yang di ambil dari kanker serviks yang disebabkan
oleh HPV 16.
3. Sel Vero adalah sel yang diambil dari ginjal kera jenis African Green
Monkey, digunakan sebagai contoh sel normal.
4. Ekstrak kloroform daun pacar air adalah ekstrak yang diperoleh dengan
cara mengekstraksi daun pacar air secara maserasi menggunakan larutan
penyari kloroform.
5. LC50 adalah konsentrasi ekstrak kloroform daun pacar air yang mampu
membunuh atau dapat menyebabkan kematian sejumlah 50 % sel uji dan
dinyatakan dalam µg/ml.
C. Alat dan Bahan 1. Alat
Peralatan yang digunakan dalam penelitian ini antara lain: alat-alat gelas,
timbangan analitik (Mettler toledo), alumunium foil, tabung conical (Nunc),
autoklaf, tissue culture flask (Nunc), swing rotor sentrifuge (PLC), inkubator
(Memerd), mikropipet, lemari pendingin (Sharp), cell counter (Nunc), 96-well
plate (Nunc), laminar air flow (Labconco), mikroskop (Olympus IMT-2),
haemocytometer (Nebauer), tissue, glove, waterbath, yellow tip, blue tip,
2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini ialah :
a. Daun pacar air segar.
b. Kultur sel SiHa dan kultur sel Vero yang diambil dari stok dari
Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Universitas
Gadjah Mada, Yogyakarta.
c. Kloroform untuk preparasi ekstrak daun pacar air.
d. Pereaksi - pereaksi untuk uji sitotoksisitas
i. Media pencuci: RPMI 1640 (Sigma), natrium bikarbonat, HEPES
ii. Media penumbuh: RPMI 1640, FBS (Fetal Bovine Serum) 10%,
Penisilin - Streptomisin 1% (Gibco), dan Fungison 0,5% (Gibco),
M199, natrium bikarbonat, HEPES {4-(2-hidroxyethyl)-1-piperazine
etane sulphonic acid}.
iii. Pelarut : DMSO (dimethylsulfoxide) 0,25 %
e. Bahan untuk melepas sel SiHa: tripsin 0,25 %
f. Trypan blue
D. Tata Cara Penelitian 1. Determinasi tanaman
Bahan utama yang akan digunakan dalam penelitian yaitu daun pacar air
segar, telah dideterminasi terlebih dahulu di laboratorium
Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta dan
dipastikan juga kebenarannya menggunakan acuan baku ( Backer dan Van den
2. Pengumpulan daun pacar air
Bahan yang digunakan berupa daun pacar air, diambil dari tanaman pacar
air di daerah Tajem, Sleman. Daun tersebut dicuci dengan air mengalir untuk
menghilangkan kotoran kotoran yang melekat, kemudian ditiriskan sampai sisa
-sisa air menghilang. Daun dijemur di bawah sinar matahari, dengan ditutup kain
hitam supaya tidak merusak kandungan dalam daun, kemudian dikeringkan dalam
oven dengan suhu 45˚ C. Setelah kering, lalu diserbuk dengan menggunakan
mesin sampai halus. Ukuran patikel serbuk sebesar 65 mesh yang telah di set pada
mesin.
3. Ekstraksi
Serbuk kering daun pacar air ditimbang kemudian dimaserasi
menggunakan larutan penyari kloroform selama 24 jam dan dilakukan
penyaringan menggunakan pompa vakum. Setelah itu dilakukan pengupan dengan
menggunakan vacumrotaryevaporator sampai didapatkan ekstrak kental. Ekstrak
kental yang didapat dilanjutkan dengan penguapan di atas penangas air hingga
kloroform menguap semua. Ekstrak kental kemudian dimasukkan dalam oven dan
setiap 2 jam ditimbang sampai didapatkan bobot konstan.
4. Sterilisasi alat
Alat-alat tersebut dicuci bersih dengan sabun dan dikeringkan, setelah itu
dibungkus dengan alumunium foil dan disterilkan dalam autoklaf selama 20 menit
5. Pembuatan medium pencuci dan medium penumbuh
a. Pembuatan medium pencuci
RPMI 1640 dilarutkan dalam aquabidest kurang lebih 80 ml,
ditambah 2,3 g natrium bikarbonat, 2 g Hepes, diencerkan sampai 100 ml,
pH dibuat 7,2 lalu disterilkan dengan filter berdiameter 0,22 µm. Medium
disimpan dalam almari es pada suhu 4oC (Freshney, 1986; Jacoby dan
Pastan, 1979).
b. Pembuatan medium kultur (RPMI 1640-serum)
Untuk medium RPMI 1640-serum dilarutkan dalam aquabidest
kurang lebih 80 ml, ditambah 2,3 g natrium bikarbonat, 2 g Hepes,
diencerkan sampai 100 ml, pH dibuat 7,2 kemudian ditambahkan FBS
(Fetal Bovine Serum) 10%, penisilin-streptomisin 1% dan fungison 0,5%
dalam medium RPMI 1640 dan disterilkan dengan filter berdiameter 0,22
µm. Media disimpan dalam almari es pada suhu 4oC (Freshney, 1986;
Jacoby dan Pastan, 1979).
6. Propagasi dan panen sel SiHa dan sel Vero
a. Propagasi sel SiHa
Sel diambil dari tangki nitrogen cair, kemudian segera dicairkan
dalam penangas air 37oC, kemudian ampul disemprotkan dengan etanol
70%. Ampul dibuka dan sel SiHa dipindahkan dalam tabung conical steril
yang berisi medium RPMI 1640. Suspensi sel disentrifugasi selama 5
menit, supernatan dibuang, diganti dengan medium RPMI yang baru,
1 ml medium penumbuh yang mengandung 10% FBS. Resuspensikan
secara perlahan sampai homogen, kemudian sel ditumbuhkan dalam tissue
culture flask kecil dan diinkubasikan dalam inkubator dengan suhu 37oC
dengan aliran 5% CO2 (Freshney, 1986; Jacoby dan Pastan, 1979).
b. Panen sel SiHa
Setelah jumlah sel cukup (kurang lebih setelah berumur 7 hari),
media diganti dengan RPMI 1640 baru sebanyak 5 ml kemudian sel
dilepaskan dari dinding flask dengan diberi tripsin 0,25%. Sel dipindahkan
dalam tabung conical steril dan ditambahkan medium RPMI sampai
volume 10 ml dan disentrifugasi 3000 rpm selama 5 menit. Supernatan
dibuang dan pelet sel diresuspensikan perlahan dengan 1 ml medium. Sel
kemudian dihitung menggunakan haemocytometer. Suspensi sel ditambah
sejumlah medium sehingga memperoleh konsentrasi sel sebesar
2,5x104/100 µl dan siap dipakai untuk penelitian (Freshney, 1986; Jacoby
dan Pastan, 1979).
c. Propagasi dan panen sel Vero
Propagasi dan panen sel Vero menggunakan langkah yang sama
dengan propagasi dan panen sel SiHa. Perbedaannya hanya terletak pada
medium yang digunakan. Sel Vero menggunakan medium M199.
7. Pembuatan larutan uji
Ekstrak kental ditimbang sebanyak 0,01 g, dilarutkan dengan pelarut
DMSO 0,25 % dan diaduk untuk mendapatkan sediaan ekstrak induk dengan
dengan konsentrasi ekstrak kloroform daun pacar air 30 - 100 µg/ml untuk
perlakuan terhadap sel SiHa dan 100 – 800 µg/ml untuk perlakuan terhadap sel
Vero.
8. Uji sitotoksisitas ekstrak kloroform daun pacar air dengan menggunakan metode direct counting
Pada uji sitotoksisitas, sebanyak 100 µl suspensi sel SiHa dengan
kepadatan 2x104/100 µl dimasukkan dalam sumuran-sumuran 96-well plate yang
telah berisi 100 µl ekstrak kloroform daun pacar air dengan kadar 30 µg/ml; 40 µg/ml;
50 µg/ml; 60 µg/ml; 70 µg/ml; 80 µg/ml; 90 µg/ml; 100 µg/ml. Sebagai kontrol,
100 µl suspensi sel SiHa ditambahkan ke dalam sumuran yang berisi medium
RPMI 1640 – serum. Selanjutnya 96-well plate diinkubasi selama 24 jam pada
suhu 37°C, dalam inkubator dengan aliran CO2 5%. Pada akhir masa inkubasi,
tiap sumuran sel diresuspensi bersama trypan blue, dimasukkan dalam
haemocytometer kemudian dihitung jumlah sel dengan mikroskop.
Uji sitotoksisitas terhadap sel Vero dilakukan dengan cara yang sama,
yang membedakan adalah konsentrasi ekstrak kloroform daun pacar air yaitu 100
µg/ml; 200 µg/ml; 300 µg/ml; 400 µg/ml; 500 µg/ml; 600 µg/ml; 700 µg/ml; 800
µg/ml dan medium yang digunakan adalah M-199.
9. Analisis Hasil
Persentase kematian sel dihitung dengan persamaan berikut:
− ×100%
∑
∑
∑
kontrol kelompok hidup
sel
perlakuan kelompok
hidup sel kontrol
kelompok hidup
sel
Untuk menghitung harga LC50 dilakukan perhitungan data menggunakan analisis
dilakukan pengolahan data dengan statistik uji z dan untuk mengetahui adanya
perbedaan antara perlakuan terhadap sel SiHa maupun sel Vero digunakan
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Dalam penelitian ini, digunakan daun pacar air untuk uji sitotoksisitas
terhadap kultur sel SiHa. Tanaman pacar air yang akan digunakan perlu
diidentifikasi terlebih dahulu untuk memastikan kebenaran bahwa bahan yang
digunakan adalah benar tanaman pacar air.
Determinasi tanaman ini dilakukan di Laboratorium
Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta, dengan
menggunakan buku acuan (Backer dan Brink, 1986). Dari hasil determinasi,
diperoleh bahwa tanaman tersebut merupakan tanaman pacar air (Impatiens
balsamina ) (lampiran 1).
B. Pengumpulan Daun Pacar Air
Daun pacar air yang digunakan untuk penelitian ini diambil dari daerah
Tajem, Maguwoharjo, Sleman, Yogyakarta, pada bulan Agustus 2008. Daun
dipanen dari tanaman yang sama dan pada waktu yang sama, hal ini bertujuan
untuk menyeragamkan kualitas daun dan kandungan kimianya.
Daun pacar air yang telah dipanen kemudian dicuci dengan air yang
mengalir. Tujuannya agar dapat membersihkan daun dari pengotor - pengotor,
misalnya mikroba, debu, bagian lain dari tanaman tersebut, atau bagian tanaman
lain yang ikut terambil sewaktu pengumpulan bahan. Setelah dicuci daun
ditiriskan, dijemur di bawah sinar matahari kemudian dikeringkan dengan
menggunakan oven pada suhu 45o C sehingga kandungan airnya berkurang dan
kualitas daun masih tetap baik. Simplisia kering kemudian diserbuk untuk
memperkecil ukuran partikel karena akan mempunyai luas permukaan yang besar
sehingga kandungan senyawa dapat tersari dengan maksimal. Jika ukuran serbuk
terlalu besar maka akan memperkecil luas permukaan dari partikel serbuk yang
kontak dengan penyari. Sedangkan jika ukuran partikel terlalu kecil maka dapat
mengakibatkan partikel serbuk akan menggumpal sehingga sulit untuk kontak
dengan penyari.
C. Pembuatan Ekstrak Kloroform Daun Pacar Air
Pembuatan ekstrak daun pacar air dilakukan dengan metode maserasi.
Metode ini dipilih karena prosesnya yang sederhana sehingga mudah untuk
dilakukan. Sebagai cairan penyari digunakan kloroform, pemilihan cairan penyari
ini didasarkan dari kandungan senyawa di dalam daun pacar air yaitu naftokuinon
yang dapat larut dalam kloroform.
Pada metode maserasi tidak menggunakan pemanasan, sehingga dapat
mencegah adanya kerusakan senyawa yang tidak tahan terhadap panas. Maserasi
ini dilakukan dengan menggunakan bejana tertutup yang bertujuan untuk
mencegah terjadinya penguapan senyawa maupun cairan penyarinya. Pada saat
perendaman simplisia, cairan penyari akan menembus dinding sel dan masuk ke
dalam rongga sel yang mengandung zat aktif. Oleh karena adanya perbedaan
konsentrasi larutan zat aktif di dalam sel maupun yang di luar sel, mampu
mendesak larutan zat aktif keluar. Pada proses maserasi ini juga dilakukan
D. Sterilisasi Alat
Sterilisasi dilakukan untuk membebaskan alat - alat dari segala macam
bentuk kontaminan terutama mikroorganisme, karena jika terdapat kontaminan
maka akan berpengaruh terhadap kematian sel yang digunakan dalam penelitian
ini, sehingga dengan menjaga sterilitas dapat memperoleh hasil yang maksimum.
Sterilisasi alat menggunakan autoklaf yang merupakan sterilisasi dengan uap air
panas. Mekanisme penghancuran mikroba oleh uap air panas adalah uap panas
akan melakukan penetrasi ke dalam sel mikroorganisme sehingga terjadi
denaturasi dan koagulasi beberapa protein esensial organisme tersebut yang akan
mengakibatkan kematian mikroorganisme. Alat-alat yang akan disterilisasi
terlebih dahulu dicuci, dikeringkan lalu dibungkus dengan alumunium foil.
Kemudian disterilisasi dengan autoklaf selama kurang lebih 20 menit dengan suhu
121o C.
E. Pembuatan Medium Penumbuh dan Pencuci
Medium penumbuh sel SiHa yang digunakan dalam penelitian ini yaitu
RPMI-1640 atau juga disebut complete medium. Medium ini mengandung FBS
(Fetal Bovine Serum) 10 % yang berisi kandungan nutrisi untuk pertumbuhan sel,
penstrep (penisilin - streptomisin) yang merupakan antibiotik antimikotik
spektrum luas yang berfungsi untuk mencegah tumbuhnya bakteri baik gram
positif maupun negatif, selain itu RPMI 1640 juga mengandung fungison yang
berfungsi sebagai antifungi untuk mencegah adanya pertumbuhan jamur. Selain
itu medium RPMI 1640 mengandung natrium bikarbonat dan HEPES. Medium
Suatu kultur sel memerlukan perawatan rutin yaitu penggantian medium
secara periodik. Waktu penggantian medium dan subkultur tiap sel berbeda, hal
ini bergantung pada kecepatan pertumbuhan sel dan metabolisme dari sel tersebut.
Untuk sel yang pertumbuhannya cepat, subkultur dilakukan sekali seminggu dan
penggantian medium dilakukan tiap 4 hari sekali. Sedangkan untuk sel yang
pertumbuhannya lambat, subkultur dilakukan setiap 2, 3, atau 4 minggu sekali dan
penggantian medium dilakukan bersamaan dengan waktu subkultur.
Medium pencuci yang digunakan adalah RPMI 1640 yang ditambah bahan
buffer yaitu natrium bikarbonat dan hepes. Pada saat pembuatan medium pencuci
dan medium penumbuh, kedua medium tersebut difiltrasi menggunakan membran
filter dengan diameter pori – pori 0,22 µm. Hal ini bertujuan untuk menyaring
virus, bakteri, dan fungi yang dapat mengkontaminasi selama proses pembuatan
medium berlangsung. Karena jika terkontaminasi akan berpengaruh terhadap
pertumbuhan sel yang memungkinkan terjadinya kematian sel. Sehingga
kontaminasi ini seharusnya dapat dihindari.
F. Preparasi Kultur Sel SiHa
Pada proses propagasi, sel diambil dari tanki nitrogen cair dalam
keadaan beku sehingga tidak merubah bentuk sel dari aslinya. Setelah cair, ampul
dibersihkan dengan etanol untuk mencegah adanya kontaminasi dari luar.
Kemudian dilakukan pencucian sel dengan memindahkan sel ke dalam medium
penumbuh yaitu RPMI-1640 lalu kemudian disentrifugasi, proses ini dilakukan
Selanjutnya diinkubator pada suhu 37o C supaya mengkondisikan sel dalam tubuh
manusia.
Panen sel dilakukan pada saat keadaan konfluen tercapai, suatu kondisi
dimana populasi sel menempati seluruh permukaan dinding flask. Diberi tripsin
agar sel lepas dari dinding. Sel kemudian ditempatkan dalam medium RPMI yang
baru, lalu disentrifugasi untuk membantu proses pemisahan sel dangan
mediumnya. Pelet sel yang diperoleh disuspensi kembali dengan RPMI untuk
dihitung konsentrasi sel. Perhitungan ini menggunakan haemocytometer.
G. Uji Sitotoksisitas Ekstrak Kloroform Daun Pacar Air
Uji sitotoksisitas ini dilakukan untuk mengetahui efek sitotoksik ekstrak
kloroform daun pacar air terhadap kultur sel SiHa dan sel Vero. Sel Vero
digunakan untuk mengetahui apakah ekstrak kloroform daun pacar air
memberikan efek sitotoksik terhadap sel normal. Uji ini bersifat kuantitatif karena
parameter yang digunakan untuk mengetahui seberapa besar potensi ketoksikan
dari ekstrak yaitu LC50. Lethal Concentration - 50 (LC50) dalam penelitian ini
merupakan besarnya kadar ekstrak kloroform daun pacar air yang mampu
mengakibatkan terbunuhnya 50% jumlah sel SiHa dan sel Vero. Nilai LC50 ini
biasanya ditentukan setelah 24 jam perlakuan.
Dalam penelitian ini untuk uji sitotoksisitas tidak menggunakan metode
MTT karena ekstrak kloroform daun pacar air yang didapat berwarna hijau
kehitaman sehingga akan dapat memberikan serapan dan mempengaruhi hasil
pengukuran absorbansinya. Oleh karena itu metode yang digunakan adalah
bawah mikroskop menggunakan bantuan haemocytometer dan juga metode ini
tidak dipengaruhi oleh warna dari ekstrak.
Sebelum dilakukan penghitungan, terlebih dahulu kultur sel diberi reagen
trypan blue. Reagen ini berfungsi sebagai penanda untuk membedakan sel yang
hidup dan yang mati. Sel yang hidup akan berwarna terang (bersinar) karena
masih mempunyai sitoplasma yang utuh. Sedangkan pada sel yang mati, reagen
ini akan menembus masuk membran sel yang mati sehingga warnanya menjadi
lebih gelap (biru tua). Namun metode ini mempunyai kelemahan yaitu waktu yang
dibutuhkan untuk penghitungan sel sangat lama dan subyektivitasnya tinggi.
Untuk mengatasi hal tersebut maka dalam penghitungan sel dilakukan oleh satu
orang saja dan dilakukan replikasi sebanyak tiga kali.
b
a
Gambar 2. Morfologi sel setelah pemberian trypan blue, pada bilik haemocytometer dengan perbesaran 100x (a) Sel hidup; (b) Sel mati
Dalam uji ini digunakan kontrol yang berisi suspensi sel SiHa dan
RPMI-1640, dan tanpa diberi ekstrak. Kontrol ini berfungsi untuk membandingkan
antara sel yang diberi perlakuan dengan sel yang tidak diberi perlakuan. Pada
kondisi perlakuan seri kadar yang digunakan yaitu 30 µg/ml; 40 µg/ml; 50 µg/ml;
60 µg/ml; 70 µg/ml; 80 µg/ml; 90 µg/ml; dan 100 µg/ml. Untuk sel Vero
yaitu M-199. Kemudian kadar ekstrak yang digunakan untuk perlakuan adalah
100 µg/ml; 200 µg/ml; 300 µg/ml; 400 µg/ml; 500 µg/ml; 600 µg/ml; 700 µg/ml;
dan 800 µg/ml. Seri kadar ini dibuat untuk melihat adanya respon yang diberikan
oleh ekstrak terhadap kematian dari sel SiHa maupun sel Vero.
Dari hasil perhitungan sel didapatkan rata-rata konsentrasi sel pada kontrol
sel SiHa yaitu 38.333 sel/200µlsedangkan kontrol pada sel Vero yaitu 37.000
sel/200µl. Hasil perhitungan prosentase kematian sel SiHa (tabel 1) dan sel Vero
(tabel 2) menunjukkan bahwa semakin besar kadar ekstrak kloroform daun pacar
air, jumlah kematian sel SiHa maupun sel Vero juga semakin besar.
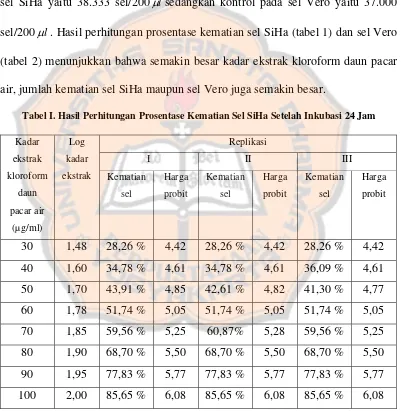
Tabel I. Hasil Perhitungan Prosentase Kematian Sel SiHa Setelah Inkubasi 24 Jam
Replikasi
I II III Kadar
ekstrak kloroform
daun pacar air
(µg/ml)
Log kadar
ekstrak Kematian sel
Harga probit
Kematian sel
Harga probit
Kematian sel
Harga probit
30 1,48 28,26 % 4,42 28,26 % 4,42 28,26 % 4,42
40 1,60 34,78 % 4,61 34,78 % 4,61 36,09 % 4,61
50 1,70 43,91 % 4,85 42,61 % 4,82 41,30 % 4,77
60 1,78 51,74 % 5,05 51,74 % 5,05 51,74 % 5,05
70 1,85 59,56 % 5,25 60,87% 5,28 59,56 % 5,25
80 1,90 68,70 % 5,50 68,70 % 5,50 68,70 % 5,50
90 1,95 77,83 % 5,77 77,83 % 5,77 77,83 % 5,77
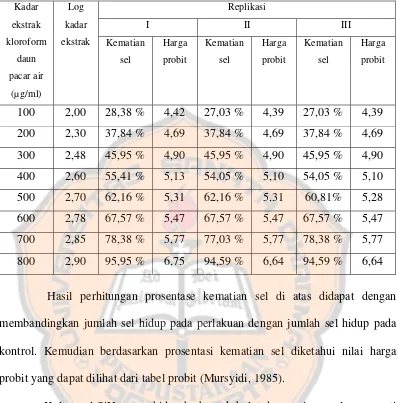
Tabel II. Hasil Perhitungan Prosentase Kematian Sel Vero Setelah Inkubasi 24 Jam
Replikasi
I II III Kadar
ekstrak kloroform
daun pacar air
(µg/ml)
Log kadar
ekstrak Kematian sel
Harga probit
Kematian sel
Harga probit
Kematian sel
Harga probit
100 2,00 28,38 % 4,42 27,03 % 4,39 27,03 % 4,39
200 2,30 37,84 % 4,69 37,84 % 4,69 37,84 % 4,69
300 2,48 45,95 % 4,90 45,95 % 4,90 45,95 % 4,90
400 2,60 55,41 % 5,13 54,05 % 5,10 54,05 % 5,10
500 2,70 62,16 % 5,31 62,16 % 5,31 60,81% 5,28
600 2,78 67,57 % 5,47 67,57 % 5,47 67,57 % 5,47
700 2,85 78,38 % 5,77 77,03 % 5,77 78,38 % 5,77
800 2,90 95,95 % 6,75 94,59 % 6,64 94,59 % 6,64
Hasil perhitungan prosentase kematian sel di atas didapat dengan
membandingkan jumlah sel hidup pada perlakuan dengan jumlah sel hidup pada
kontrol. Kemudian berdasarkan prosentasi kematian sel diketahui nilai harga
probit yang dapat dilihat dari tabel probit (Mursyidi, 1985).
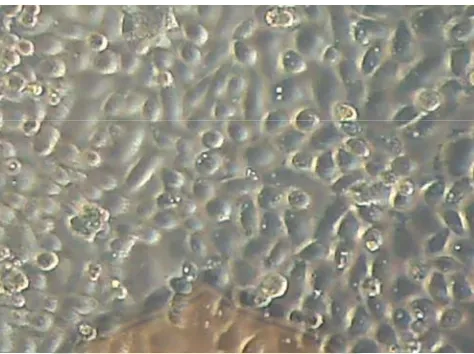
Kultur sel SiHa yang hidup berbentuk bulat dan panjang, sel yang mati
bentuknya terlihat bulat kusam. Sedangkan untuk sel vero yang hidup bentuknya
panjang dan yang mati berbentuk bulat.
Gambar 3. Morfologi sel yang hidup pada kontrol sel SiHa dilihat dengan perbesaran 100x
Gambar 4. Morfologi sel yang hidup pada kontrol sel Vero dilihat dengan perbesaran 100x
i
ii
i
ii
Gambar 6. Sel Vero pada konsentrasi ekstrak 100 µg/ml (i. sel hidup; ii. Sel mati)
0 10 20 30 40 50 60 70 80 90
0 10 20 30 40 50 60 70 80 90 100
kadar ekstrak kloroform daun pacar air (µg/ml)
kem at ian sel ( % ) replikasi 1 replikasi 2 replikasi 3
Gambar 7. Grafik pengaruh kadar ekstrak kloroform daun pacar air terhadap prosentase kematian sel SiHa
0 20 40 60 80 100 120
0 200 400 600 800 1000
kadar ekstrak kloroform daun pacar air (µg/ml)
ke m a tia n s e l (% ) replikasi 1 replikasi 2 replikasi 3
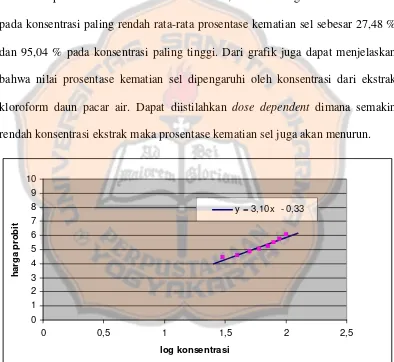
Pada gambar 6 dan 7 dapat dijelaskan bahwa semakin tinggi konsentrasi
dari ekstrak kloroform daun pacar air maka semakin besar pula prosentase
kematian dari sel SiHa maupun sel Vero. Hal ini dapat ditunjukkan pada gambar,
untuk sel SiHa pada konsentrasi paling rendah memiliki rata-rata prosentase
kematian sel sebesar 28,26 % kemudian pada konsentrasi paling tinggi memiliki
rata - rata prosentase kematian sel sebesar 85,65 %. Sedangkan untuk sel Vero
pada konsentrasi paling rendah rata-rata prosentase kematian sel sebesar 27,48 %
dan 95,04 % pada konsentrasi paling tinggi. Dari grafik juga dapat menjelaskan
bahwa nilai prosentase kematian sel dipengaruhi oleh konsentrasi dari ekstrak
kloroform daun pacar air. Dapat diistilahkan dose dependent dimana semakin
rendah konsentrasi ekstrak maka prosentase kematian sel juga akan menurun.
0 1 2 3 4 5 6 7 8 9 10
0 0,5 1 1,5 2 2,5
log konsentrasi
ha
rga
pr
obi
t
y = 3,10x - 0,33
Gambar 9. Grafik hubungan log kadar ekstrak terhadap harga probit pada sel SiHa replikasi 1
0 1 2 3 4 5 6 7
0 0,5 1 1,5 2 2,5
log konsentrasi
ha
rga
pr
obi
t y = 3,12x - 0,37
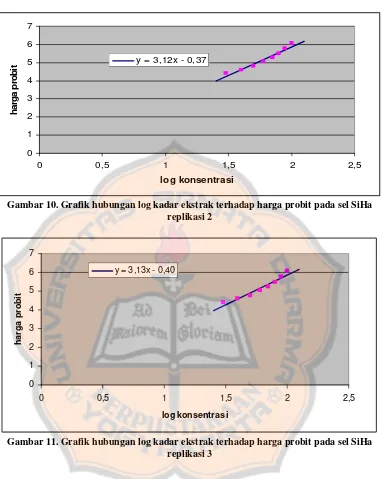
Gambar 10. Grafik hubungan log kadar ekstrak terhadap harga probit pada sel SiHa replikasi 2
0 1 2 3 4 5 6 7
0 0,5 1 1,5 2 2,5
log konsentrasi
ha
rg
a
pr
ob
it
y = 3,13x - 0,40
Gambar 11. Grafik hubungan log kadar ekstrak terhadap harga probit pada sel SiHa replikasi 3
Pada grafik hubungan antara log kadar ekstrak dengan harga probit dari
prosentase kematian sel SiHa replikasi 1, 2, dan 3 diperoleh hubungan yang
linear. Dari gambar 9,10 dan 11 menunjukkan bahwa grafik replikasi 1, 2, dan 3
0 1 2 3 4 5 6 7 8
0 0,5 1 1,5 2 2,5 3 3,5
log konsentrasi
h
a
rga
pr
obi
t
y = 2,05x + 0,02
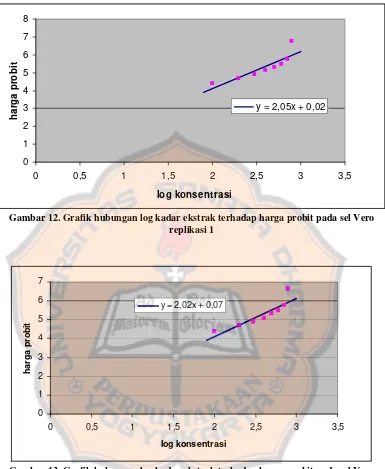
Gambar 12. Grafik hubungan log kadar ekstrak terhadap harga probit pada sel Vero replikasi 1
0 1 2 3 4 5 6 7
0 0,5 1 1,5 2 2,5 3 3,5
log konsentrasi
h
a
rg
a
pr
ob
it
y = 2,02x + 0,07
0 1 2 3 4 5 6 7
0 0,5 1 1,5 2 2,5 3 3,5
log konsentrasi
ha
rga
pr
obi
t
y = 2,02x + 0,08
Gambar 14. Grafik hubungan log kadar ekstrak terhadap harga probit pada sel Vero replikasi 3
Pada grafik hubungan antara log kadar ekstrak dengan harga probit dari
prosentase kematian sel vero replikasi 1, 2, dan 3 diperoleh hubungan yang
linear. Dari gambar 12,13 dan 14 menunjukkan bahwa grafik replikasi 1, 2, dan 3
linear terhadap persamaan garis yang didapat.
Parameter sitotoksisitas ditentukan oleh LC50. Nilai LC50 didapatkan dari
analisis probit, dengan regresi linear dari log konsentrasi ekstrak dengan harga
probit prosentase kematian sel pada perlakuan. Uji linearitas untuk memenuhi
analisis regresi linear yang mensyaratkan adanya hubungan antara variabel bebas
dan variabel terikat yang saling membentuk kurva linear. Hasil dari uji linearitas
diperoleh nilai r hitung > r tabel, sehingga menunjukkan bahwa tidak terjadi
penyimpangan signifikan terhadap linearitas. Kemudian hasil yang diperoleh
untuk LC50 sel SiHa yaitu 52,5 µg/ml dan LC50 sel Vero sebesar 275,4 µg/ml.
Menurut Meyer (1982) suatu ekstrak atau bahan dikatakan mempunyai efek
anti kanker jika memiliki LC50 < 30 µg/ml. Sehingga ekstrak kloroform daun
pacar air mempunyai efek sitotoksik terhadap sel SiHa maupun sel Vero. Tetapi
belum bisa dikatakan mempunyai efek toksik sebagai anti kanker terhadap sel
SiHa. Namun hal ini menunjukkan bahwa ekstrak kloroform daun pacar air
mempunyai kemampuan untuk membunuh sel kanker. Untuk dapat memperoleh
harga LC50 yang lebih kecil dapat dilakukan dengan melakukan fraksinasi
terhadap ekstrak daun pacar air sehingga didapatkan fraksi ekstrak yang lebih
spesifik terhadap sel kanker.Ekstrak kloroform daun pacar air juga memberikan
efek sitotoksik terhadap sel kanker lainnya, pada sel Hela dengan LC50 53,7 µg/ml
(Natalia, 2009) dan pada sel T47D dengan LC50 34,9 µg/ml (Anni, 2009).
Untuk mengetahui apakah ada perbedaan antara kontrol dengan perlakuan pada
masing-masing kadar dilakukan analisis dengan uji z, menggunakan taraf
kepercayaan 95 %. Hasil yang diperoleh dari perhitungan secara manual
memperoleh nilai z hitung lebih besar dari nilai z tabel yang artinya terdapat
perbedaan yang signifikan antara hasil perlakuan ekstrak kloroform daun pacar air
dengan kontrol. Untuk mengetahui adakah perbedaan antara LC50 sel SiHa dan sel
Vero digunakan uji t. Hasilnya menunjukkan bahwa ada perbedaan yang
bermakna antara LC50 sel SiHa dan LC50 sel Vero. Sehingga dapat disimpulkan
bahwa ekstrak kloroform daun pacar air memiliki efek sitotoksik terhadap sel
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Ekstrak kloroform daun pacar air mempunyai efek sitotoksik terhadap
sel SiHa dan sel vero dengan LC50 masing-masing yaitu 52,5 µg/ml dan 275,4
µg/ml. Oleh karena itu mempunyai kemungkinan ekstrak ini dapat dikembangkan
sebagai agen antikanker karena memiliki efek sitotoksik yang lebih dominan
terhadap sel SiHa.
B. Saran
Saran yang dapat dikemukakan dari penelitian ini adalah perlu dilakukannya
pengujian sitotoksisitas terhadap fraksi dari ekstrak kloroform daun pacar air
terhadap sel SiHa.
DAFTAR PUSTAKA
Anni, 2009, Uji Sitotoksisitas Ekstrak Kloroform Daun Pacar Air (Impatiens balsamina L.) Terhadap Kultur Sel T47D, Skripsi, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta
Anonim, 1986, Sediaan Galenik, 1-2, 10, Departemen Republik Indonesia, Jakarta
Anonim, 1995, Farmakope Indonesia, edisi IV, 7, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, cetakan I, 9-11, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2008a, Kanker, http://www.dinkes-diy.org/?x =berita&id_berita= 10032009115425, diakses pada tanggal 17 Maret 2009
Anonim, 2008b, Medicine and Quinone, http://www.quinone.com/ver1_0/ e/appli_e/appli_health01_e.html, diakses pada tanggal 24 Maret 2009
Anonim, 2008c, Cell Biology, www.atcc.org/atccadvancecatalogsearch/ product/details/tabid/452/default.aspx?atccnum=crl10741&template=cell biology, diakses pada tanggal 8 Mei 2009
Ahmad, A., Sanjeev B., Zhiwei W., Dejuan K., dan Fazlul H. S., 2008, Plumbagi-Induced Apoptosis of Human Breast Cancer Cells Is Mediated by Inactivation of NF-KB and Bcl-2, Journal of Cellular Biochemistry,
1058:1461-1471
Arjono, 1999, Onkologi, Edisi 5, 494-498, UGM Press, Yogyakarta
Backer, C. A., dan Backuizen van den Brink, R. C.,1965, Flora of Java, Volume I dan II, N. V. Noordhoff, Graningen
Dalimartha, S., 2003, Atlas Tumbuhan Obat Indonesia, Jilid 3, 84-86, Puspa Swara, Jakarta
Dalimartha, S., 2007, Ramuan Tradisional Untuk Pengobatan Kanker, cetakan 8, 72-73, Penerbit Swadaya, Jakarta
Dipiro, J.T., 2005, Pharmacotherapy A Pathophysiologic Approach, 6th Edition, 2285-2286, McGraw-Hill, New York
Elrod, S., dan William S., 2002, Genetika, Edisi 4, 261, Erlangga, Jakarta
Freshney, R.I., 1986, Animal Cell Culture A Practical Approach, 1st Edition, 71-73, IRL Press, Washington DC
Freshney, R.I., 2000, Culture of Animal Cells, A manual of Basic Technique, 4th Edition, 329-330, A John Wiley & Sons, inc, New York
Ganiswara, S.G dan Nafrialdi, 1995, Antikanker dan Immunosupresan dalam
Farmakologi dan Terapi, Edisi 4, editor Sulistia G. Ganiswara dkk, 686-687, Bagian Farmakologi, Fakultas Kedokteran Universitas Indonesia, Jakarta
Hagman, D.E., 2005, Remington The Science and Practice of Pharmacy, 21st edition, 776-781, Lippincott Williams & Wilkins, Philadelphia
Ishibashi, M., 2008, A Review of Papillomaviral Tumors: Human Papillomavirus Type 47 and the SiHa cell, Two Material Contributions to the Research
World from this Institute,
http://www.cmj.org/periodical/XMLList.asp?id=LW8524, diakses pada tanggal 25 juni 2008
Jacoby, W.B., and Pastan, I.H., 1979, Methods in Enzymology Cell Culture, Volume VIII, Academia Press Inc, New York
Kimball, J.W., 1983, Biology, Edisi 5, Jilid 2, diterjemahkan oleh Siti Soemarmi T, 418-419, Erlangga, Jakarta
Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nochols, D.E., Mc Laughlin, J.L., 1982, Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents, Planta Medica, 45, 32-34
Natalia, L., 2009, Uji Sitotoksisitas Ekstrak Kloroform Daun Pacar Air (Impatiens balsamina L.) Terhadap Kultur Sel HeLa, Skripsi, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta
Oku, H., dan Kyoko I., 2002, Cyclooxygenase-2 Inhibitory 1,4-Naphtoquinones from Impatiens balsamina L., Biol. Pharm. Bull. 25, 658-660
Robinson, T., 1995, Kandungan Organik Tumbuhan Tinggi, Edisi Keenam, 57;61, Penerbit ITB, Bandung
Thongnopnua, P., Jutima B., Vilai C., dan Wallee V., 1991, Quantitative Determination of 2-Methoxy-1,4-Naphthoquinone in Plasma by High-Perfomance Liquid Chromothography, Analytical Sciences, 7, 1529-1534
Lampiran 2. Tanaman Pacar Air yang digunakan dalam penelitian
Gambar 15. Tanaman pacar air
Lampiran 3. Perhitungan LC50 ekstrak kloroform daun pacar air terhadap
sel Siha menggunakan analisis probit.
Tabel III. Data perhitungan jumlah kultur sel SiHa dengan metode direct counting
Replikasi
I II III
No. Konsentrasi
(µg/ml) Hidup Mati Hidup Mati Hidup Mati
1 Kontrol 77 0 76 0 77 0
2 30 55 9 55 9 55 9
3 40 50 11 50 13 49 13
4 50 43 14 44 14 45 14
5 60 37 17 37 18 37 18
6 70 31 20 30 20 31 20
7 80 24 24 24 24 24 24
8 90 17 28 17 28 17 28
9 100 11 31 11 32 11 31
Jumlah sel = 10 200
4 × ×
x
Keterangan: x = jumlah sel hasil perhitungan langsung pada haemocytometer
4 = jumlah bilik dalam haemocytometer
10 = jumlah volume yang masuk dalam bilik haemocytometer(µl)
200 = jumlah volume total (µl)
Jumlah sel pada kontrol:
Replikasi I = 10 200 4
77 × ×
= 38.500
Replikasi II = 10 200 4
76 × ×
Replikasi III = 10 200 4
77 × ×
= 38.500
Rata-rata kontrol =
3 500 . 38 000 . 38 500 .
38 + +
= 38.333
Jumlah sel pada kontrol adalah 38.333 sel/ 200µl
REPLIKASI I
Jumlah sel SiHa yang hidup:
Konsentrasi 30 µg/ml = 10 200 4
55 × ×
= 27.500 sel/sumuran
Konsentrasi 40 µg/ml = 10 200 4
50 × ×
= 25.000 sel/sumuran
Konsentrasi 50 µg/ml = 10 200 4
43× ×
= 21.500 sel/sumuran
Konsentrasi 60 µg/ml = 10 200 4
37 × ×
= 18.500 sel/sumuran
Konsentrasi 70 µg/ml = 10 200 4
31× ×
= 15.500 sel/sumuran
Konsentrasi 80 µg/ml = 10 200 4
24 × ×
= 12.000 sel/sumuran
Konsentrasi 90 µg/ml = 10 200 4
17 × ×
= 8.500 sel/sumuran
Konsentrasi 100 µg/ml = 10 200 4
11× ×
= 5.500 sel/sumuran
Persen kematian sel SiHa = − × B
B A
100 %
Keterangan: A = jumlah sel hidup pada sumuran kontrol
Konsentrasi 30 µg/ml = − × 333 . 38 500 . 27 333 . 38
100% = 28,26 %
Konsentrasi 40 µg/ml = − ×
333 . 38 000 . 25 333 . 38
100% = 34,78 %
Konsentrasi 50 µg/ml = − ×
333 . 38 500 . 21 333 . 38
100% = 43,91 %
Konsentrasi 60 µg/ml = − ×
333 . 38 500 . 18 333 . 38
100% = 51,74 %
Konsentrasi 70 µg/ml = − ×
333 . 38 500 . 15 333 . 38
100% = 59,56 %
Konsentrasi 80 µg/ml = − ×
333 . 38 000 . 12 333 . 38
100% = 68,70 %
Konsentrasi 90 µg/ml = − ×
333 . 38 500 . 8 333 . 38
100% = 77,83 %
Konsentrasi 100 µg/ml = − ×
333 . 38 5500 333 . 38
100% = 85,65 %
Tabel IV. Data % kematian, harga probit, dan log konsentrasi sel SiHa pada replikasi 1
No.
Konsentrasi Ekstrak Kloroform Daun
Pacar air (µg/ml)
Presentase kematian sel
Siha
Harga probit Log konsentrasi
1 30 28,26 % 4,42 1,48
2 40 34,78 % 4,61 1,60
3 50 43,91 % 4,85 1,70
4 60 51,74 % 5,05 1,78
5 70 59,56 % 5,25 1,85
6 80 68,70 % 5,50 1,90
7 90 77,83 % 5,77 1,95
Regresi linear dari log konsentrasi vs harga probit:
a = - 0,33
b = 3,10
r = 0,97
Y = bx + a
= 3,10x – 0,33
Y = nilai probit 50 maka 5 = 3,10x – 0,33
x = 1,72
REPLIKASI II
Jumlah sel SiHa yang hidup:
Konsentrasi 30 µg/ml = 10 200 4
55 × ×
= 27.500 sel/sumuran
Konsentrasi 40 µg/ml = 10 200 4
50 × ×
= 25.000 sel/sumuran
Konsentrasi 50 µg/ml = 10 200 4
44 × ×
= 22.000 sel/sumuran
Konsentrasi 60 µg/ml = 10 200 4
37 × ×
= 18.500 sel/sumuran
Konsentrasi 70 µg/ml = 10 200 4
30 × ×
= 15.000 sel/sumuran
Konsentrasi 80 µg/ml = 10 200 4
24 × ×
= 12.000 sel/sumuran
Konsentrasi 90 µg/ml = 10 200 4
17 × ×
= 8.500 sel/sumuran
Konsentrasi 100 µg/ml = 10 200 4
11× ×
Persen kematian sel SiHa = − × B
B A
100 %
Keterangan: A = jumlah sel hidup pada sumuran kontrol
B = jumlah sel hidup pada sumuran yang telah diberi perlakuan
Konsentrasi 30 µg/ml = − ×
333 . 38 500 . 27 333 . 38
100% = 28,26 %
Konsentrasi 40 µg/ml = − ×
333 . 38 000 . 25 333 . 38
100% = 34,78 %
Konsentrasi 50 µg/ml = − ×
333 . 38 000 . 22 333 . 38
100% = 42,61 %
Konsentrasi 60 µg/ml = − ×
333 . 38 500 . 18 333 . 38
100% = 51,74 %
Konsentrasi 70 µg/ml = − ×
333 . 38 000 . 15 333 . 38
100% = 60,87 %
Konsentrasi 80 µg/ml = − ×
333 . 38 000 . 12 333 . 38
100% = 68,70 %
Konsentrasi 90 µg/ml = − ×
333 . 38 500 . 8 333 . 38
100% = 77,83 %
Konsentrasi 100 µg/ml = − ×
333 . 38 5500 333 . 38
Tabel V. Data % kematian, harga probit, dan log konsentrasi sel SiHa pada replikasi 2
No.
Konsentrasi Ekstrak Kloroform Daun
Pacar air (µg/ml)
Presentase kematian sel
Siha
Harga probit Log konsentrasi
1 30 28,26 % 4,42 1,48
2 40 34,78 % 4,61 1,60
3 50 42,61 % 4,82 1,70
4 60 51,74 % 5,05 1,78
5 70 60,87% 5,28 1,85
6 80 68,70 % 5,50 1,90
7 90 77,83 % 5,77 1,95
8 100 85,65 % 6,08 2,00
Regresi linear dari log konsentrasi vs harga probit:
a = - 0,37
b = 3,12
r = 0,97
Y = bx + a
= 3,12x – 0,37
Y = nilai probit 50 maka 5 = 3,12x – 0,37
x = 1,72
REPLIKASI III
Jumlah sel SiHa yang hidup:
Konsentrasi 30 µg/ml = 10 200 4
55 × ×
= 27.500 sel/sumuran
Konsentrasi 40 µg/ml = 10 200 4
49 × ×
Konsentrasi 50 µg/ml = 10 200 4
45 × ×
= 22.500 sel/sumuran
Konsentrasi 60 µg/ml = 10 200 4
37 × ×
= 18.500 sel/sumuran
Konsentrasi 70 µg/ml = 10 200 4
31× ×
= 15.500 sel/sumuran
Konsentrasi 80 µg/ml = 10 200 4
24 × ×
= 12.000 sel/sumuran
Konsentrasi 90 µg/ml = 10 200 4
17 × ×
= 8.500 sel/sumuran
Konsentrasi 100 µg/ml = 10 200 4
11× ×
= 5.500 sel/sumuran
Persen kematian sel SiHa = − × B
B A
100 %
Keterangan: A = jumlah sel hidup pada sumuran kontrol
B = jumlah sel hidup pada sumuran yang telah diberi perlakuan
Konsentrasi 30 µg/ml = − ×
333 . 38 500 . 27 333 . 38
100% = 28,26 %
Konsentrasi 40 µg/ml = − ×
333 . 38 500 . 24 333 . 38
100% = 36,09 %
Konsentrasi 50 µg/ml = − ×
333 . 38 500 . 22 333 . 38
100% = 41,30 %
Konsentrasi 60 µg/ml = − ×
333 . 38 500 . 18 333 . 38
100% = 51,74 %
Konsentrasi 70 µg/ml = − ×
333 . 38 500 . 15 333 . 38
100% = 59,56 %
Konsentrasi 80 µg/ml = − ×
333 . 38 000 . 12 333 . 38
Konsentrasi 90 µg/ml = − × 333 . 38 500 . 8 333 . 38
100% = 77,83 %
Konsentrasi 100 µg/ml = − ×
333 . 38 5500 333 . 38
100% = 85,65 %
Tabel VI. Data % kematian, harga probit, dan log konsentrasi sel SiHa pada replikasi 3
No.
Konsentrasi Ekstrak Kloroform Daun
Pacar air (µg/ml)
Presentase kematian sel
Siha
Harga probit Log konsentrasi
1 30 28,26 % 4,42 1,48
2 40 36,09 % 4,61 1,60
3 50 41,30 % 4,77 1,70
4 60 51,74 % 5,05 1,78
5 70 59,56 % 5,25 1,85
6 80 68,70 % 5,50 1,90
7 90 77,83 % 5,77 1,95
8 100 85,65 % 6,08 2,00
Regresi linear dari log konsentrasi vs harga probit:
a = - 0,40
b = 3,13
r = 0,97
Y = bx + a
= 3,13x – 0,40
Y = nilai probit 50 maka 5 = 3,13x – 0,40
x = 1,73
Nilai xrata-rata = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + + 3 73 , 1 72 , 1 72 , 1 = 1,72
Lampiran 4. Perhitungan LC50 ekstrak kloroform daun pacar air terhadap
sel Vero menggunakan analisis probit.
Tabel VII. Data perhitungan jumlah kultur sel Vero dengan metode direct counting
Replikasi
I II III
No. Konsentrasi
(µg/ml) Hidup Mati Hidup Mati Hidup Mati
1 Kontrol 74 0 74 0 74 0
2 100 53 10 54 10 54 9
3 200 46 13 46 12 46 3
4 300 40 16 40 16 40 6
5 400 33 18 34 18 34 16
6 500 28 21 28 21 29 20
7 600 24 24 24 24 24 24