BAB I
PENDAHULUAN
1.1 Tujuan percobaan
Memahami prinsip analisa dengan menggunakan AAS Mampu mengoprasikan alat AAS
Membuat kurva standar
Menentuka konsentrasi atau kadar logam tertentu yang terdapat dalam sampel 1.2 Dasar teori
1.2.1 Pengertian spektrofotometri
Spektrofotometri merupakan suatu metode analisis kuantitatif yang pengukurannya berdasarkan banyaknya radiasi yang dihasilkan atau yang diserap oleh spesi atom atau molekul analit. Salah satu bagian dari spektrometri ialah Spektrometri Serapan Atom (SSA), merupakan metode analisis unsur secara kuantitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombang tertentu oleh atom logam dalam keadaan bebas (Skoog et. al., 2000 di materi ajar panitian penyelenggara pelatihan instrumentasi analisa kimia Universitas Padjajaran, 2005)
Sejarah SSA berkaitan erat dengan observasi sinar matahari. Pada tahun 1802 Wollaston menemukan garis hitam pada spektrum cahaya matahari yang kemudian diselidiki lebih lanjut oleh Fraunhofer pada tahun 1820. Brewster mengemukakan pandangan bahwa garis Fraunhofer ini diakibatkan oleh proses absorpsi pada atmoser matahari. Prinsip absorpsi ini kemudian mendasari Kirchhoff dan Bunsen untuk melakukan penelitian yang sistematis mengenai spektrum dari logam alkali dan alkali tanah. Kemudian Planck mengemukakan hukum kuantum dari absorpsi dan emisi suatu cahaya. Menurutnya, suatu atom hanya akan menyerap cahaya dengan panjang gelombang tertentu (frekwensi), atau dengan kata lain ia hanya akan mengambil dan melepas suatu jumlah energi tertentu, (ε = hv = hc/λ). Kelahiran SSA sendiri pada tahun 1955, ketika publikasi yang ditulis oleh Walsh dan Alkemade & Milatz muncul. Dalam publikasi ini SSA direkomendasikan sebagai metode analisis yang dapat diaplikasikan secara umum (Weltz, 1976 di materi ajar panitian penyelenggara pelatihan instrumentasi analisa kimia Universitas Padjajaran, 2005)
Apabila cahaya dengan panjang gelombang tertentu dilewatkan pada suatu sel yang mengandung atom-atom bebas yang bersangkutan maka sebagian cahaya tersebut akan diserap dan intensitas penyerapan akan berbanding lurus dengan banyaknya atom bebas logam yang berada dalam sel. Hubungan antara absorbansi dengan konsentrasi diturunkan dari:
1. Hukum Lambert : bila suatu sumber sinar monokromatik melewati medium transparan, maka intensitas sinar yang diteruskan berkurang dengan bertambahnya ketebalan mediun yang mengasorbsi.
2. Hukum Beer : intensitas sinar yang diteruskan berkurang eksponensial dengan bertambahnya konsentrasi spesi yang menyerap sinar.
Dari kedua hukum tersebut diperoleh suatu persamaan: It = Io.e-(εbc), atau
A = - Log It/Io = εbc Dimana : Io = Intensitas sumber sinar
It = Intensitas sinar yang diteruskan ε = Absortivitas molar
b = Panjang medium
c = Konsentrasi atom-atom yang menyerap sinar A = Absorbans.
Dari persamaan di atas, dapat disimpulkan bahwa absorbansi cahaya berbanding lurus dengan konsentrasi atom (Day & Underwood, 1989 di materi ajar panitian penyelenggara pelatihan instrumentasi analisa kimia Universitas Padjajaran, 2005).
1.2.2 Instrumentasi Spektrofotometri Serapan Atom
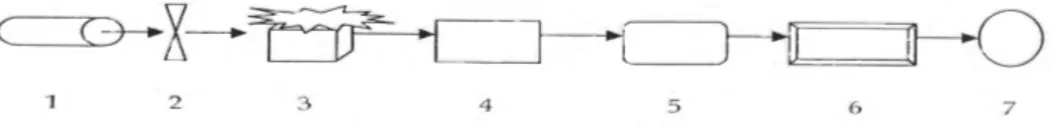
Alat spektrofotometer serapan atom terdiri dari rangkaian dalam diagram skematik berikut:
Socket
Anode
Hollow Cathode Lamp
Fill Gas Ne or Ar (1-5 torr)
Glass Envelope
Keterangan : 1. Sumber sinar 2. Pemilah (Chopper)
3. Sumber Atomisasi 4. Monokromator 5. Detektor 6. Amplifier
7. Meter atau recorder Sumber cahaya
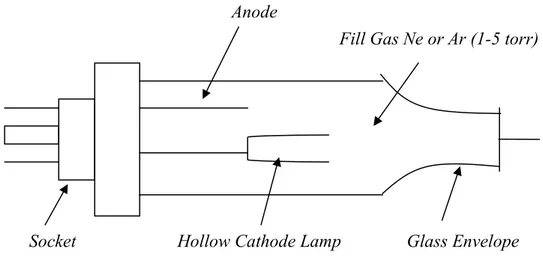
Sumber cahaya yang digunakan dalam AAS ialah lampu katoda berongga (Hollow Cathode Lamp). Lampu ini terdiri dari suatu katoda dan anoda yang terletak dalam suatu silinder gelas berongga yang terbuat dari kwarsa. (Jamaludin Al.A, 2005).
Gambar 3.Diagram skematik lampu katoda cekung (Khopkar, 1990). Pemilah (Chopper)
Dimuka lampu katoda rongga terdapat komponen yang disebut baling– baling (chopper), yang berfungsi mengatur frekuensi radiasi resonansi yang
dipancarkan dari lampu, sehingga energi radiasi ini oleh “photomultiplier” diubah menjadi energi listrik.
Atomizer
Dalam metode SSA, sebagaimana dalam metode spektrometri atomik yang lain, contoh harus diubah ke dalam bentuk uap atom. Proses pengubahan ini dikenal dengan istilah atomisasi, pada proses ini contoh diuapkan dan didekomposisi untuk membentuk atom dalam bentuk uap.
Secara umum pembentukan atom bebas dalam keadaan gas melalui tahapan-tahapan sebagai berikut :
a. Pengisatan pelarut, pada tahap ini pelarut akan teruapkan dan meninggalkan residu padat.
b. Penguapan zat padat, zat padat ini terdisosiasi menjadi atom-atom penyusunnya yang mula-mula akan berada dalam keadaan dasar.
c. Beberapa atom akan mengalami eksitasi ke tingkatan energi yang lebih tinggi dan akan mencapai kondisi dimana atom-atom tersebut mampu memancarkan energi.
Terdapat 2 tahap utama yang terjadi dalam sel atom pada alat AAS dengan sistem atomisasi nyala, yaitu nebulisasi untuk menghasilkan suatu bentuk aerosol yang halus dari larutan contoh, dan disosiasi analit menjadi atom-atom bebas dalam keadaan gas
Berdasarkan sumber panas yang digunakan maka terdapat 2 metode atomisasi yang dapat digunakan dalam spektrometri serapan atom, yaitu: 1) Atomisasi menggunakan nyala, digunakan gas pembakar untuk
memperoleh energi kalor sehingga didapatkan atom bebas dalam keadaan gas.
2) Atomisasi tanpa nyala, digunakan energi listrik pada atomisasi tungku grafit.
Untuk AAS dengan sistem atomisasi nyala digunakan campuran gas asetilen-N2O. (Materi ajar panitia penyelenggara pelatihan instrumentasi
analisa kimia Universitas Padjajaran, 2005). Monokromator dan sistem optik
Berkas cahaya dari lampu katoda berongga akan dilewatkan melalui cahaya sempit dan difokuskan menggunakan cermin menuju monokromator. Monokromator dalam alat AAS akan memisahkan, mengisolasi dan
mengontrol intensitas energi yang diteruskan ke detektor. Monokromator yang biasa digunakan ialah monokromator difraksi grating (Jamaludin Al.A, 2005).
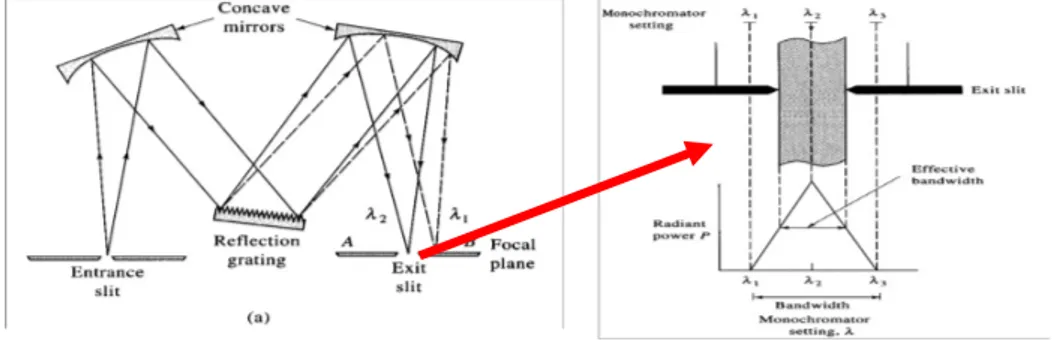
1. Czerny-Turner monochromator (Grating Monochromator)
Cahaya polikromatis masuk melalui entrance slit menuju collimating mirror dipantulkan sejajar kearah grating. Ketika berada di grating, sinar diuraikan sesuai panjang gelombang kemudian diteruskan oleh focusing mirror. Sinar kemudian keluar sebagai cahaya monokromatis melalui exit slit (Mulja, 1995).
Gambar 4. Grating Monochromator
Detekor
Gambar 5. Phototube Detector
Energi yang diteruskan dari sel atom harus diubah dalam bentuk sinyal listrik kemudian diperkuat dan diukur oleh suatu sistem pemproses data. Proses pengubahan ini dalam alat AAS dilakukan oleh detektor. Energi yang diteruskan dari sel atom harus diubah ke dalam bentuk sinyal listrik untuk kemudian diperkuat dan diukur oleh suatu sistem pemproses data. Proses pengubahan ini dalam alat SSA dilakukan oleh detektor. Detektor yang
biasa digunakan ialah tabung pengganda foton (photomultiplier tube), terdiri dari katoda yang dilapisi senyawa yang bersifat peka cahaya dan suatu anoda yang mampu mengumpulkan elektron. Ketika foton menumbuk katoda maka elektron akan dipancarkan, dan bergerak menuju anoda. Antara katoda dan anoda terdapat dinoda-dinoda yang mampu menggandakan elektron. Sehingga intensitas elektron yang sampai menuju anoda besar dan akhirnya dapat dibaca sebagai sinyal listrik. Untuk menambah kinerja alat maka digunakan suatu mikroprosesor, baik pada instrumen utama maupun pada alat bantu lain seperti autosampler (Jamaludin Al.A, 2005).
Amplifier
Sistem pengolah berfungsi untuk mengolah kuat arus dari detektor menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi data dalam sistem pembacaan.
Pembacaan
Sistem pembacaan merupakan bagian yang menampilkan suatu angka atau gambar yang dapat dibaca oleh mata.
1.2.3 Diagram tingkat energi elektron pada atom
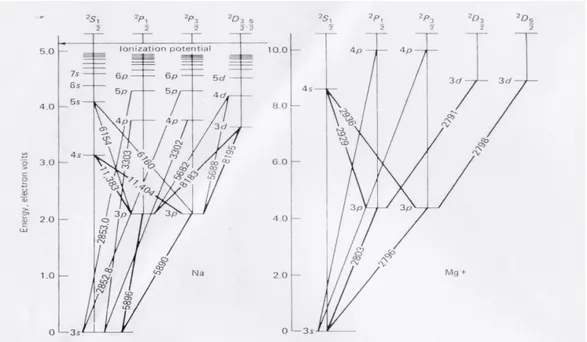
Diagram energi level atom dapat berguna untuk memvisualisasikan struktur tingkat atom kompleks. Pada diagram energi level dapat dilihat jumlah energi yang harus dimiliki elektron pada suatu atom agar dapat berpindah dari tingkat energi yang satu ketingkat energi yang lain.
Gambar 1.1 Diagram energi level untuk Na dan Mg+
Pada diagram energi atom dapat terlihat jumlah energi yang harus dimiliki elektron pada suatu atom agar dapat berpindah dari tingkat energi yang satu ke tingkat energi yang lain. Diagram ini terdiri dari angka yang tersusun vertical. Angka ini menunjukan energi dalam electron volt. Angka yang berada pada garis miring yang menunjukan panjang gelombang cahaya yang diserap atom. Nilai 0 ev merupakan energi yang dimiliki atom pada keadaan ground state. Letak ground state tiap atom berbeda-beda. Hal ini dapat diketahui dari konfigurasi elektron pada ground state. Misalkan ion Mg+ yang memiliki nomor
atom 12, elektronnya 11 sehingga konfigurasi elektronnya menjadi 1s2, 2s2, 2s6,
3s1, sama dengan konfigurasi pada atom Na. Dari konfigurasi ini dapat diketahui
bahwa ground state pada atom Mg yaitu terletak pada sub kulit 3s karena elektron yang dapat tereksitasi hanya elektron pada sub kulit 3s saja. Untuk subkulit 3p, energi levelnya terpecah menjadi dua karena momen anguler momentumnya yang berbeda yaitu 2P
1/2 dan 2P3/2. Jika dilihat dari diagram energi
level antara Na dan Mg+, diagram energi levelnya dimulai dari 3s, karena 3s
merupakan ground state dari Na dan Mg+. Berpindahnya elektron ke exited state
yatitu contohnya 3p, Na dan Mg+ mempunyai selisih tingkat energi yang berbeda. Untuk Na berpindahnya elektron dari 3s ke 3p, selisih tingkat energinya sebesar 2 eV, sedangkan untuk Mg+ berpindahnya elektron dari 3s ke 3p, selisih
tingkat energinya sebesar 4 eV, sehingga panjang gelombangnya juga berbeda. Perbedaan inilah yang menyebabkan suatu unsur dapat dianalisa dengan Spektrometri Serapan Atom.
1.2.4 Gangguan dalam Spektrofotometri Serapan Atom
Berbagai faktor dapat mempengaruhi pancaran nyala suatu unsur tertentu dan menyebabkan gangguan pada penetapan konsentrasi unsur.
1. Gangguan akibat pembentukan senyawa refraktori
Gangguan ini dapat diakibatkan oleh reaksi antara analit dengan senyawa kimia, biasanya anion, yang ada dalam larutan sampel sehingga terbentuk senyawa yang tahan panas (refractory). Sebagai contoh fospat akan bereaksi dengan kalsium dalam nyala menghasilkan pirofospat (Ca2P2O7).
menjadi berkurang. Gangguan ini dapat diatasi dengan menambahkan stronsium klorida atau lanthanum nitrat ke dalam larutan. Kedua logam ini mudah bereaksi dengan fospat dibanding dengan kalsium sehingga reaksi antara kalsium dengan fospat dapat dicegah atau diminimalkan. Gangguan ini dapat juga dihindari dengan menambahkan EDTA berlebih. EDTA akan membentuk senyawa kompleks dengan kalsium, sehingga pembentukan senyawa refraktori dengan fospat dapat dihindari. Selanjutnya kompleks Ca-EDTA akan terdisosiasi dalam nyala menjadi atom netral Ca yang menyerap sinar. Gangguan yang lebih serius terjadi apabila unsur-unsur seperti: Al, Ti, Mo, V dan lain-lain bereaksi dengan O dan OH dalam nyala menghasilkan logam oksida dan hidroksida yang tahan panas. Gangguan ini hanya dapat diatasi dengan menaikkan temperatur nyala, sehingga nyala yang umum digunakan dalam kasus semacam ini adalah nitrous oksida-asetilen.
2. Gangguan ionisasi
Gangguan ionisasi ini biasa terjadi pada unsur-unsur alkali tanah dan beberapa unsur yang lain. Karena unsur-unsur tersebut mudah terionisasi dalam nyala. Dalam analisis dengan SSA yang diukur adalah emisi dan serapan atom yang tak terionisasi. Oleh sebab itu dengan adanya atom-atom yang terionisasi dalam nyala akan mengakibatkan sinyal yang ditangkap detektor menjadi berkurang. Namun gangguan ini bukan gangguan yang sifatnya serius, karena hanya sensitivitas dan linearitasnya saja yang terganggu. Gangguan ini dapat diatasi dengan menambahkan unsur-unsur yang mudah terionisasi ke dalam sampel sehingga akan menahan proses ionisasi dari unsur yang dianalisa.
3. Gangguan fisik alat
Gangguan fisik adalah semua parameter yang dapat mempengaruhi kecepatan sampel sampai ke nyala dan sempurnanya atomisasi. Parameter tersebut adalah kecepatan alir gas, berubahnya viskositas sampel akibat temperatur nyala. Gangguan ini biasanya diatasi dengan cara lebih sering membuat kalibrasi atau standarisasi (Mulja. M, 1995).
BAB II
METODOLOGI
2.1 Alat dan bahan
2.1.1 Alat yang digunakan 1. AAS Spectra AA-220 2. Labu ukur 100 mL 3. Gelas kimia 4. Botol semprot
2.1.2 Bahan yang digunakan
1. Sampel 2. Larutan HNO3 3. Aquadest
2.2.1 Pebuatan larutan blanko
1. Memipet 10 mL HNO3 kedalam labu ukur 100 mL
2. Mengencerkan dengan aquadest hingga tanda batas, kemudian mengocoknya hingga homogen
2.2.2 Pembuatan larutan standar (0,5 ; 4 ; 8 ; 16 ; 22 ; 28) ppm 1. Memasukkan larutan Fe 100 ppm kedalam buret
2. Memasukkan 0,5 mL larutan Fe 100 ppm kedalam labu ukur 100 mL dengan menggunakan buret
3. Menambahkan aquadest hingga tanda batas
4. Mengulangi langkah ke-2 dan ke-3 dengan volume larutan Fe sebnyak 4 mL, 8ml, 16 mL, 22 mL dan 28 mL
5. Memasukkan masing-masing larutan standar kedalam botol dan beri label 2.2.3 Pengoprasian AAS Spektra AA-220
1. Membuka kran tabung gas asytilen (C2H2) berlawanan dengan arah jarum jam
2. Menyambung semua aliran listrik
3. Membuka dan mengecek aliran udara dengan melihat tekanan 50 psig pada kompresor, tekanan asetylen 11 psig dan tekanan N2O 50 psig
4. Mengecek blower
5. Memasang lampu Hollow Katoda
6. Menghidupkan komputer dan spektrometer 7. Mengklik logo spektra AA
8. Mengklik work sheet 9. Mengklik New
10. Mengklik work sheet details, dengan mengisi form berikut ini Name : kelompok 2 III A
Analyst : all of kelompok 2
Comment :
Sampel : 3
11. Mengklik ok
12. Mengklik Add methode dan memilih elemen Fe (elemen yang akan dianalisa)
13. Mengklik edit methode, dan mengisi form berikut Type/mode
o Sampling mode : manual o Instrumen mode : absorban o Flame type and gas flow : air/acetylen
o Air flow : 13,5 mL/menit
o Acetylen flow : 2,00 mL/menit Measurement
o Measurement mode : integration o Measurement time : 3 s
o Read delay : 5 s
o Calibration mode : concentration o Replication standart : 3
Optical
o Lamp position : 3
o Lamp current : 4,0 mA
o Wave length :
o Slit : 0,5 nm
o Background concentration : BC Off Standart o Standart 1 : 0,5 ppm o Standart 2 : 4,0 ppm o Standart 3 : 8,0 ppm o Standart 4 : 16,0 ppm o Standart 5 : 22,0 ppm o Standart 6 : 28,0 ppm Mengklik ok
Mengklik label dan mengisi nama sampel berikut o Larutan blanko rabu
o 3 ppm rabu o 17 pmm rabu 14. Mengklik analyst
15. Mengklik optimize, akan muncul beberapa kotak Kotak unsur pilahan Fe yang diuji, mengklik ok Selanjutnya kolom dialog box (wr...), mengklik ok
Selanjutnya muncul kolom analyst checklist, mengklik ok
16. Mengklik optimize lamp. Selanjutnya mencari % gain terendah untuk elemen Fe (kurang lebih 65) dengan memutar kedua tombol putaran yang terdapat dibagian belakang lampu
17. Mengklik rescale setiap indikator cahaya mencapai puncak atau batas tertinggi. Lakukan berulang-ulang hingga dapat % gain terendah
18. Mengklik optimize signal, kemudian menyalakan flame, dan mengecek selang
19. Mengklik instrument zero ketika selang terhubung dengan aquadest 20. Memindahkan selang kestandart terbesar, menggeser-geser burner head
sampai diperoeh nilai absorbansi tertinggi
21. Mengembalikan selang ke aquadest, tunggu sinyal absorbansi turun, mengklik ok
22. Kemudian muncul kolom uji Fe, kemudian klik cancel (tidak melanjutkan optimize)
23. Mengklik start
24. Kemudian mengikuti perintah yang muncul, untuk dianalisa o Present insrtument zero (aquadest), mengklik ok
o Present call zero (blanko), mengklik ok o Present standart 1-6, mengklik ok
o Present sampel 1,2, dan 3, mengklik ok
o Setelah proses selesai, timbul bunyi dan kolom autorun complete, lalu mengklik ok
BAB III
3.1 Data pengamatan
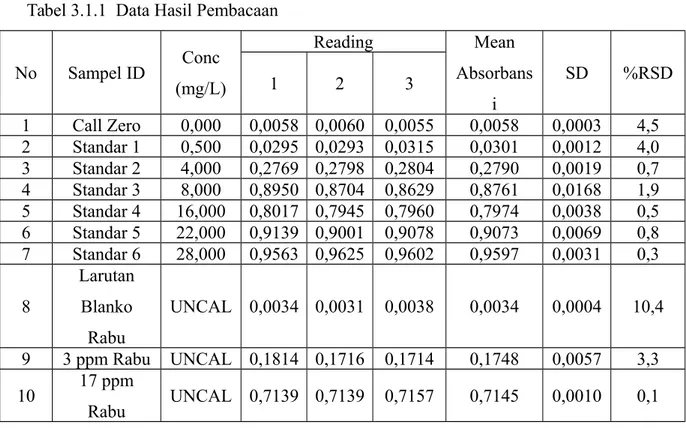
Tabel 3.1.1 Data Hasil Pembacaan No Sampel ID Conc (mg/L) Reading Mean Absorbans i SD %RSD 1 2 3 1 Call Zero 0,000 0,0058 0,0060 0,0055 0,0058 0,0003 4,5 2 Standar 1 0,500 0,0295 0,0293 0,0315 0,0301 0,0012 4,0 3 Standar 2 4,000 0,2769 0,2798 0,2804 0,2790 0,0019 0,7 4 Standar 3 8,000 0,8950 0,8704 0,8629 0,8761 0,0168 1,9 5 Standar 4 16,000 0,8017 0,7945 0,7960 0,7974 0,0038 0,5 6 Standar 5 22,000 0,9139 0,9001 0,9078 0,9073 0,0069 0,8 7 Standar 6 28,000 0,9563 0,9625 0,9602 0,9597 0,0031 0,3 8 Larutan Blanko Rabu UNCAL 0,0034 0,0031 0,0038 0,0034 0,0004 10,4 9 3 ppm Rabu UNCAL 0,1814 0,1716 0,1714 0,1748 0,0057 3,3 10 17 ppm Rabu UNCAL 0,7139 0,7139 0,7157 0,7145 0,0010 0,1 3.2 Pembahasan
Pada praktikum instrumentasi dengan alat analitiknya berupa AAS, memiliki beberapa tujuan yang harus dicapai, yaitu memahami prinsip analisa dengan menggunakan AAS, mampu mengoperasikan alat AAS, mampu mengoprasikan alat AAS, membuat kurva standar dan menentukan konsentrasi atau kadar logam tertentu yang terdapat dalam sampel.
Tujuan pertama dalam praktikum AAS adalah memahami prinsip analisa dengan menggunakan AAS. Prinsip analisis dengan menggunakan AAS adalah penyerapan radiasi cahaya oleh atom. Oleh karena itu, sampel yang pada mulanya berbentuk cairan harus diatomkan terlebih dulu dengan mengg unakan suatu atomizer atau alat pengatoman ( pembuat atom) unsur pada sampel. Dalam hal ini digunakan nyala api dari pembakaran acetylene dan udara tekan N2O. Penyerapan energi radiasi oleh atom -atom yang berada pada tingkat energi dasar (ground state). Penyerapan energi tersebut menyebabkan tereksitasinya elektron dalam kulit atom ke tingkat energi yang lebih tinggi (excited state ). Pengurangan intensitas radiasi yang diberikan sebanding dengan jumlah atom pada tingkat energi dasar yang menyerap energi radiasi tersebut. Dengan mengukur intensitas radiasi yang diteruskan (transmitasi) atau mengukur intensitas
radiasi yang diserap (absorbansi) maka konsentrasi unsur di dalam cuplikan dapat ditentukan, dalam hal ini adalah unsur Fe.
Sebagai sumber radiasi digunakan lampu katoda berongga (Hollow Catode Lamp). Dalam hal ini lampu yang digunakan harus sesuai dengan unsur yang akan dianalisis dalam sampel yaitu Fe. Penggunaan hollow catode lamp harus disesuaikan karena radiasi resonansi ini mempunyai panjang gelombang atau frekuensi yang karakteristik untuk setiap unsur. Sebelum hollow catode lamp digunakan untuk proses serapan maka harus disesuaikan terlebih dahulu atau cahaya atau sinar dari hollow catode lamp, dengan menggunakan kertas untuk ketepatan datangnya cahaya agar dalam berlangsungnya penyerapan lebih baik.
Tujuan kedua adalah mampu mengoperasikan alat AAS, hal ini dapat dibuktikan pada bab 2 pada prosedur percobaan pengoperasiaan Spectra AA-220.
Pada tujuan praktikum selanjutnya, yaitu membuat kurva standar. Kurva standar dibuat berdasarkan pada konsentrasi larutan standar melawan absorbansi (penyerapan cahaya oleh atom – atom dari larutan standar yang diatomkan). Namun dalam hal ini titik pada standat 3 jauh dari titik-titik standar lainnya, jadi untuk titik standar 3 dihapuskan dari kurva standar. Dari kurva standar diperoleh persamaan y = -0,0013x2 + 0,0699x + 0,006
Untuk tujuan praktikum yang terakhir adalah menentukan konsentrasi sampel. Metode pengukuran konsentrasi (analisa kuantitatif) yang digunakan dalam praktikum AAS ini adalah metode kurva kalibrasi standar. Dalam metode ini harus menggunakan larutan blangko. Dan larutan standar yang dibuat minimal 3. Kemudian dibuat grafik antara absorbansi melawan konsentrasi. Dari grafik tersebut, praktikan dapat menentukan konsentrasi sampel yang sudah diketahui absorbansinya dengan cara intrapolasi (regresi linier).
Konsentrasi sampel tidak boleh lebih kecil dari detection limit, yaitu konsentrasi terkecil yang masih dapat di ukur oleh alat dimana toleransinya adalah %RSD yang tidak boleh lebih besar dari 10%. Dan juga tidak boleh lebih besar dari larutan standar tertinggi yang dibuat. Dari hasil percobaan, didapatkan konsentrasi :
Sampel 3 ppm Rabu = Uncal Sampel 17 ppm Rabu = Uncal
Hal ini mungkin dikarenakan salah satu sampel yaitu larutan blanko rabu memiliki nilai absorbansi lebih kecil dibanding dengan call zero. Dan mungkin juga itu yang menyebabkan sampel yang lain juga tidak terbaca.
Sedangkan metode kedua adalah dengan cara memplotkan antara nilai absorbansi dengan nilai konsentrasi. Dari cara kedua didapatkan konsentrasi :
Sampel larutan blanko Rabu = Uncal Sampel 3 ppm Rabu = 2,6 mg/L Sampel 17 ppm Rabu = 14,8 mg/L
BAB IV
PENUTUP
4.1 Kesimpulan
Berdasarkan percobaan yang telah dilakukan dapat disimpulkan bahwa :
1. Pada prinsipnya alat AAS didasarkan pada banyaknya cahaya yang diserap oleh atom-atom logam yang ada dalam sampel dimana banyaknya cahaya yang diserap sebanding dengan banyaknya konsentrasi logam tersebut dalam sampel.
2. Pembuatan kurva standar merupakan grafik yang dibuat dari Absorbansi Vs Konsentrasi dari larutan standard dimana memperoleh p ersamaan garis yaitu, y = -0,0013x2 + 0,0699x + 0,006
3. Dari praktikum didapatk an konsentrasi Fe dengan 2 metode. Yang pertama diperoleh dari pembacaan langsung oleh alat, yaitu :
o Sampel Larutan Blanko Rabu = UNCAL
o Sampel 3 ppm Rabu = UNCAL
o Sampel 17 ppm Rabu = UNCAL
Dan metode kedua dari perhitungan pada persamaaaan garis dimana x adalah konsentrasi dan y adalah absorbansi, yaitu :
o Sampel Larutan Blanko Rabu = UNCAL
o Sampel 3 ppm Rabu = 2,6 mg/L
o Sampel 17 ppm Rabu = 14,8 mg/L
4.2 Saran
Sebaiknya dalam praktikum, mahasiswa harus lebih teliti dalam hal: a. Kondisi alat yang digunakan harus benar-benar kering dan bersih.
b. Memperhatikan dan melakukan prosedur percobaan sesuai dengan petunjuk praktikum.
DAFTAR PUSTAKA
http://pustaka.unpad.ac.id/wp-content/uploads/2009/12/spektrometri_serapan_atom.pdf Khopkar, S.M., 1990, “Konsep Dasar Kimia Analitik”. Jakarta: UI-Press
Mulja, M., 1995, “Analisis Instrumental”. Surabaya: Airlangga University Press.
Tim Penyusun Penuntun Praktikum Instrumen, 2014. “Penuntun Praktikum Instrumen”. Samarinda: Polnes.