PENGARUH SUHU OPERASI TERHADAP KONVERSI, NILAI
KONSTANTA KECEPATAN REAKSI (k), dan ARAH
KESETIMBANGAN REAKSI (K) PADA HIDROLISA MINYAK JARAK
Badar Ilham Anggawijaya*), Christine Indira Rinai Pangesti, Fariha Hundagi
Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Jl. Prof. Soedarto, SH, Kampus Undip Tembalang, Semarang, Indonesia 50275
Abstrak
Lemak dan minyak adalah trigliserida atau triester dari gliserol. Zat ini berada pada minyak jarak. Untuk mendapatkan asam lemak bebas dari trigliserida minya k jarak, dilakukan hidrolisa dengan katalis asam. Hidrolisa dilakukan untuk mengetahui pengaruh variabel mol pereaktan terhadap konversi dan konstanta kecepatan reaksi pada proses hidrolisa. Bahan yang digunakan saat hidrolisa antara lain minyak jarak, aquadest, HCl, NaOH, PP, alkohol, dan surfaktan (sunlight). Langkah pertama percobaan adalah menentukan densitas dari minyak jarak dan katalis (HCl). Kemudian dilanjutkan dengan analisis kadar asam lemak awal yang ada dalam minyak jarak. Setelah itu, dilakukan proses hidrolisa yang diikuti dengan analisa kadar asam lemak hasil hidrolisa setiap 5 menit dengan variabel bebas suhu operasi yaitu 55°C, 65°C, dan 75°C. Pada percobaan dapat disimpulkan bahwa kenaikan suhu operasi mengakibatkan energi kinetik reaktan meningkat dan mampu mengatasi energi aktivasinya, sehingga dapat meningkatkan konstanta kecepatan reaksi dan nilai konversi. Selain itu juga ada hubungan berbanding lurus antara konversi dan konstanta kecepatan reaksi. Saran pada percobaan ini adalah pada proses hidrolisa dijaga agar suhu konstan setiap variabel dan titrasi tidak dilakukan pada suhu yang sama dengan kondisi operasi karena hidrolisa pada minya k akan terus berlanjut menyebabkan data yang didapat tidak sesuai, serta teliti dalam mengamati TAT.
Kata kunci : Hidrolisa , minyak jarak, suhu, konversi.
Abstract
[Effect of Temperature on Conversion, Value of Reactions Constant (k), and Equilibrium Constant (K) in Hydrolysis of Castor Oil ] Fat and oil is triglyceride or triester from glycerol. For obtained free fatty acid (FFA) from triglyceride jarak oil must do hydrolysis with catalyst. The purpose of this experiment is learning influence variable mole ratio of reactants to moles of water mole of jarak oil to conversion and reaction rate constant for hydrolysis process. Materials are used on hydrolysis are: jarak oil, aquadest, HCl (catalyst), NaOH, PP, alcohol and surfactant. First, determine density of oil jarak and catalyst. Then, analyzed the percentage of initial fatty acid on jarak oil. After that, the process of hydrolysis followed by analysis of fatty acid hydrolysis results every 5 minutes with a free variable operating temperature of 55 ° C, 65°C and 75°C. In experiments it can be concluded that the increase in operating temperature resulted in increased kinetic energy of the reactants and able to overcome the activation energy, so as to increase the reaction rate constants and conversion value. There was also a proportional relationship between the conversion and the reaction rate constants. Suggestions in this experiment is the hydrolysis process are kept to a constant temperature of each variable and titration is not carried out at the sa me temperature as the operating conditions for hydrolysis on oil will continue to cause the data obtained is not appropriate, as well as meticulous in observing the TAT.
Keywords: hydrolysis, castor oil , temperature, conversion.
1. Pendahuluan
Minyak dan lemak adalah trigliserida yang berarti triester (dari) gliserol. Pohon jarak (Ricinus communis) merupakan salah satu jenis tanaman penghasil nonedible oil. Hasil utama dari pohon
jarak adalah bijinya, apabila dikeringkan biji jarak akan menghasilkan minyak jarak. Hidrolisa minyak jarak menjadi asam lemak dan gliserol dilakukan dengan cara memanaskan campuran minyak jarak dan sedikit asam sulfat. Asam lemak yang diperoleh dari hidrolisis suatu minyak atau lemak umumnya mempunyai : rantai karbon panjang dan tidak bercabang.
Penggunaan langsung minyak jarak terbatas pada industri genteng, obat-obatan, minyak rem, *) Penulis Korespondensi
dan minyak lincir. Manfaat hidrolisis minyak jarak adalah untuk menghasilkan asam lemak dan gliserol untuk produksi oleokimia.
Tujuan dilakukan percobaan hidrolisa minyak jarak adalah mengetahui pengaruh variabel suhu operasi terhadap konversi hidrolisa minyak jarak, pengaruh variabel suhu operasi terhadap nilai konstanta kecepatan reaksi hidrolisa minyak jarak ( k ), dan mengetahui pengaruh variabel suhu operasi terhadap arah kesetimbangan reaksi hidrolisa minyak jarak ( K ).
2. Landasan Teori
Hidrolisa Minyak Jarak secara Umum
Hidrolisa merupakan pengikatan gugus hidroksil (-OH) oleh suatu senyawa. Gugus –OH dapat diperoleh dari air. Hidrolisis dapat digolongkan menjadi hidrolisis murni, hidrolisis katalis asam, hidrolisis katalis basa, gabungan alkali dengan air dan hidrolisis dengan katalis enzim. Berdasarkan fase reaksi hidrolisis dikelompokkan menjadi hidrolisis fase cair dan fase uap.
Minyak jarak merupakan minyak nabati yang diperoleh dengan cara pemerasan dari tanaman Ricinus Communis, kegunaan langsung minyak jarak terbatas pada industry genteng, obat – obatan , minyak rem, minyak lincir
Hidrolisa minyak jarak menjadi asam– asam lemak dan gliserol dilakukan dengan cara memanaskan campuran minyak jarak dan sedikit asam sulfat di dalam sebuah labu leher tiga. Pemanasan dilangsungkan sampai suhu yang diinginkan sebelum air panas dimasukkan. Contoh diambil setiap waktu tertentu (10 menit) untuk dianalisa asam bebasnya, kecepatan hidrolisis terutama ditentukan oleh kecepatan reaksi antara air dan trigliserida di fase minyak. Penggunaan air yang berlebihan memungkinkan fase minyak selalu jenuh dengan air sehingga reaksi hidrolisis bertingkat satu semu terhadap konsentrasi gliserida.
Pada reaksi dengan air reaksi dimungkinkan terjadi pada fase cair dan fase minyak, akan tetapi menurut Lascaray (1949) reaksi pada fase minyaklah yang dominan sehingga kinetika reaksi ditentukan oleh kecepatan difusi air ke dalam fase minyak dan reaksi antara air dan minyak di fase minyak yang dapat disajikan ke dalam persamaan matematik sebagai berikut
Kecepatan difusi air ke fase minyak:
-−�� = � �∗− � . � � � � . �
Kecepatan reaksi di fase minyak:
� = � = � �
Untuk mencari langkah yang mengontrol pada kinetika reaksi, disusun neraca massa air dan neraca massa minyak di fase minyak sebagai berikut :
Neraca massa air dalam fase minyak: �
� = �∗− � − � � Asumsi : dengan adanya pengadukan, kecepatan transfer massa pada persamaan di atas [k1a (CA* - CA1)] dianggap jauh lebih besar daripada kecepatan reaksi kimia [kr CA1 CB] maka dianggap hanya kecepatan reaksi kimia saja yang menentukan kecepatan reaksi keseluruhan.
Neraca massa minyak dalam fase minyak :
�
� = − � � … … 4
Bila jumlah air berlebihan dan transfer massa air ke fase minyak sangat cepat, maka fase minyak dianggap selalu jenuh dengan air, maka CA1 = CA*
CB = banyaknya trigliserida suatu saat
k = konstanta kecepatan reaksi tingkat satu, j-1
= � −���
Minyak jarak merupakan minyak nabati yang diperoleh dengan cara pemerasan dari tanaman Ricinus communis, kegunaan langsung minyak jarak terbatas pada industry genteng, obat – obatan , minyak rem, minyak lincir.
Sifat fisik dari minyak jarak adalah cairan tidak berwarna atau berwarna kuning pucat, bau lemak, rasa sedikit menggigit, viscositas tinggi dan bilangan asam akan tinggi sesuai dengan waktu yang ditandai dengan biji rusak dan cara pemerasan yang tidak baik.
Sifat kimia dari minyak jarak adalah mengandung 46 – 53% minyak. Minyak jarak mengandung 80% gliserida, asam asinolat, stearat isoresinolat, dihidroksi stearat dan palmiat. Minyak jarak juga mengandung 20% protein, 0,2 alkaloid piridin beracun, risinin serta enzim lipase minyak jarak mengandungzat toksin risin.
4. Hidrolisa Minyak Jarak
Hidrolisa minyak jarak menjadi asam – asam lemak dan gliserol dilakukan dengan cara memanaskan campuran minyak jarak dan sedikit asam sulfat di dalam sebuah labu leher tiga. Pemanasan dilangsungkan sampai suhu yang diinginkan sebelum air panas dimasukkan. Contoh diambil setiap waktu tertentu (10 menit) untuk dianalisa asam bebasnya, kecepatan hidrolisis terutama ditentukan oleh kecepatan reaksi antara air dan trigliserida di fase minyak. Penggunaan air yang berlebihan memungkinkan fase minyak selalu jenuh dengan air sehingga reaksi hidrolisis bertingkat satu semu terhadap konsentrasi gliserida.
5. Metode Percobaan
Gambar 1 rangkaian alat percobaan
Keterangan:
Prosedur percobaan yang dilakukan dalam percobaan hidrolis minyak jarak ini adalah:
A. Menghitung densitas
Densitas Minyak Jarak
Timbang picnometer kosong (m1), masukkan minyak jarak kedalam picnometer yang telah diketahui volumenya (V), timbang beratnya (m2). Hitung densitas minyak jarak.
Densitas Katalis
Timbang picnometer kosong (m1), masukkan HCl teknis dilaboratorium kedalam picnometer yang telah diketahui volumenya (V), timbang beratnya (m2). Hitung densitas katalis HCl. Lakukan hal yang sama untuk H2SO4
B. Analisa Kadar Asam Lemak dalam Bahan Baku
1. Masukkan 10 mL minyak jarak ke dalam Erlenmeyer.
2. Menambahkan 15 mL etanol 96% dan memanaskannya sambil diaduk pada suhu 60oC.
3. Menambahkan 3 tetes indicator PP dan menitrasi dengan NaOH sampai warna berubah menjadi merah muda.
4. Mencatat kebutuhan titran.
C. Hidrolisa Minyak Jarak
1. Memasukkan minyak jarak ke dalam labu leher tiga
2. Memasukkan katalis N ke dalam labu leher tiga
3. Mengalirkan air pendingin selama proses hidrolisa
4. Memanaskan campuran tersebut sampai suhu oC kemudian menambahkan aquadest yang telah dipanaskan ke dalam labu leher tiga,dan emulsifier (sabun)
ml
5. Mengambil sampel dalam selang waktu 5 menit untuk dianalisa asam lemak dan asam total selama menit.
D. Penentuan Kadar Asam Lemak Bebas
1. Memasukkan 10 mL minyak jarak yang telah dihidrolisa ke dalam Erlenmeyer 2. Menambahkan etanol 96% 15 mL dan
dipanaskan sambil diaduk pada suhu 60oC 3. Menitrasi dengan NaOH : penambahan 3
4. Mencatat kebutuhan titran.
5. Ulangi langkah hidrolisa dan kadar asam lemak bebas hasil hidrolisa dengan jenis katalis
6. Pengaruh suhu terhadap konversi hidrolisa minyak jarak
Gambar 2 pengaruh suhu terhadap konversi
Berdasarkan gambar 4.1 konversi pada variabel 3 dengan suhu hidrolisa 75°C menghasilkan konversi yang lebih besar daripada variabel 1 dan 2. Hal ini disebabkan karena suhu yang semakin tinggi akan mempengaruhi kecepatan reaksi sesuai dengan persamaan Arhennius dimana semakin tinggi suhu maka nilai dari kecepatan reaksi juga akan semakin besar (Levenspiel, 1999). Selain nilai kecepatan reaksi kenaikan suhu juga mempengaruhi viskositas suatu zat. Semakin tinggi suhu akan menghasilkan viskositas yang semakin rendah (Ustra, 2012).
Konversi dalam hal ini merupakan nilai dari pembagian asam lemak yang terbentuk hasil dari hidrolisis gliserol dengan kadar gliserol awal pada minyak jarak. Apabila kecepatan reaksi semakin besar maka hidrolisa akan berjalan lebih cepat sehingga menghasilkan nilai konversi yang lebih besar pula. Viskositas akan mempengaruhi kekentalan suatu zat, semakin kecil nilai dari viskositas akan mempermudah suatu zat untuk bereaksi sehingga menyebabkan nilai dari konversi meningkat pada reaktan dengan viskositas lebih rendah pada suhu yang lebih tinggi.
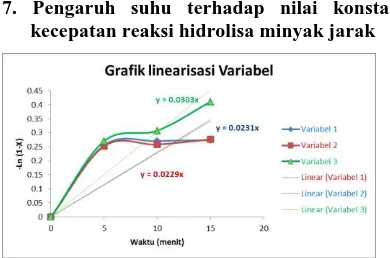
7. Pengaruh suhu terhadap nilai konstanta kecepatan reaksi hidrolisa minyak jarak
Gambar 3 linerisasi kecepatans reaksi
Tabel 1 nilai konstanta kecepetan reaksi pada setiap variabel
Nilai dari kecepatan reaksi dapat dihitung dengan pendekatan, dalam perhitungan kali ini digunakan pendekatan least square yaitu dengan melinearisasi data yang didapat. Persamaan linearisasi yang digunakan dalam perhitungan ini iyalah
− � 1 − � = . �
dalam persamaan ini maka nilai k dapat dihitung dengan menhitung nilai dari gradien pada data yang didapat. Berdasarkan tabel 4.1 nilai dari kecepatan reaksi akan meningkat seiring dengan kenaikan suhu. Hal ini diakibatkan karena nilai dari konstanta kecepatan reaksi dipengaruhi oleh suhu sesuai dengan persamaan Arrhennius (Levenspiel, 1999) :
= � −���
sehingga dengan naiknya suhu maka nilai dari k juga akan semakin meningkat.
8. Pengaruh suhu terhadap Arah kesetimbangan hidrolisa minyak jarak
Gambar 4 pengaruh suhu pada kesetimbangan reaksi
Dari grafik yang terdapat pada gambar 4, didapatkn fenomena bahwa dengan kenaikan suhu akan mengakibatkan konstanta kesetimbangan reaksi (K) semakin besar pula. Perhitungan untuk konstanta kesetimbangan reaksi (K) sangat dipengaruhi oleh jumlah konsentrasi produk dan reaktan pada kondisi setimbang. Tetapan kesetimbanggan (K) adalah hasil kali produk dipangkatkan koefisien reaksinya dibagi hasil kali rekatan dipangkatkan koefisien reaksinya. Adapun mekanisme perhitungan sebagai berikut:
Kc = [A][B][D][C]33
mengakibatkan terjadinya pergeseran reaksi kesetimbangan. Faktor-faktor yang dapat mempengaruhi reaksi kesetimbangan salah satunya adalah suhu. Kenaikan suhu tidak akan menggeser reaksi kesetimbangan karena kenaikan suhu hanya berfungsi mempercepat laju reaksi. Laju reaksi yang semakin cepat akan meningkatkan jumlah produk dan menurunkan jumlah reaktan. Dari rumus umum Kc, ada hubungan antara konstanta kesetimbangan dengan jumlah produk dan rekatan. Untuk produk berbanding lurus dengan nilai Kc, sehingga semakin besar produk maka Kc semakin besar. Sedangkan hubungan Kc dengan reaktan berbanding terbalik, jika jumlah reaktan kecil , maka nilai Kc akan besar. Semakin banyak reaktan maka jumlah produk yang dihasilkan pun semakin besar (Aziz dkk., 2013). Dari percobaan Kc variable 1 < Kc variable 2 < Kc variable 3.
9. Kesimpulan
Semakin besar suhu hidrolisa yang digunakan maka konversi yangdihasilkan akan semakin besar pula hal ini disebabkan suhu akan mempengaruhi viskositas dan kecepatan reaksi. Nilai konstanta laju reaksi bertambah besar seiring kenaikan suhu sesuai dengan persamaan Arrhenius dikarenakan energi kinetik yang semakin besar menyebabkan nilai dari factor frekuensi tumbukan partikel air dengan minyak meningkat. Suhu semakin besar menghasilkan konstanta keseimbangan (K) yang semakin besar pula.
DAFTAR PUSTAKA
Agra, S. B. dan Warnijati S. 1972. Hidrolisis Minyak Kelapa dengan Katalisator Asam.Forum Teknik.2(1): 31 - 40.
Fessenden, R.J., dan Fessenden, J.S.1999. Kimia Organik.jilid 2. Ed.3. hal 83. Jakarta: Erlangga,
Groggins, P.H. 1958.Unit Processes in Organic Synthesis. pp.699. New York : McGraw Hill.Inc.
Kirk, R. E. dan Othmer, D. F. 1953. Encyclopedia of Chemical Technology 6, pp. 231 – 236. New York : The Interscience Encyclopedia. Inc.,
Lascaray, L. 1949.Mechanism of fat splitting. Industrial & Engineering Chemistry 41(4), 786-790.
Levenspiel, O. 1999. Chemical Reaction Engineering, Third Edition. New York. John Wiley & Sons, Inc.
Lewkowitsch, J. 1903. J. Soc. Chem. Indust., 22, 67.
Rahayu, S. 1999. Hidrolisis Minyak Jarak dengan Katalisator Asam Sulfat. Prosiding Seminar
Nasional Rekayasa Dan Proses.
Ustra, Mara K, et.al. 2012. Effect of temperature and composition on density, viscosity and thermal conductivity of fatty acid methyl esters from soybean, castor and Jatropha curcas oils, J. Chem. Thermodynamics 58 (2013) 460–466. Florianópolis. Elsevier.