PERNYATAAN
Yang bertanda tangan di bawah ini:
Nama Mahasiswa : Anis Anya Habibah NIM : 13308141035
Jurusan/ Prodi : Pendidikan Biologi/Biologi Fakultas : MIPA
Judul TAS : Pengaruh Ekstrak Biji pepaya (Carica papaya, L.) terhadap Jumlah Kelenjar Endometrium, Jumlah Eritrosit dan Lekosit Tikus Putih (Rattus norvegicus, L.) Betina. Dengan ini saya menyatakan bahwa skripsi ini benar-benar karya saya sendiri. Sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau diterbitkan orang lain kecuali sebagai acuan atau kutipan dengan mengikuti tata penulisan karya ilmiah.
Yogyakarta, ... 2017 Yang menyatakan,
MOTTO
“Sesungguhnya sesudah kesulitan pasti ada kemudahan (QS. Al Insyirah: 6)”
“Doa dari Ibu dan ayah serta taat ku pada ALLAH adalah kunci
keberhasilanku (penulis)”
“Berbagilah dan mendoakannlah kebaikan kepada orang lain, niscaya
kebaikan itu akan berbalik pada diri kita kembali, sesuai janji ALLAH
(penulis)”
PERSEMBAHAN
Kupersembahkan karyaku ini untuk:
1. Bapakku “Djoko Hadi Winarso”, engkaulah pahlawanku, terimakasih atas segala yang telah kau berikan doa, cinta, kasih dan sayang yang selama ini mendorongku untuk menjadi insan yang berguna dan bisa berpikir dewasa serta telah membiayaiku dari aku lahir hingga saat ini tanpa kurang suatu apapun.
2. Ibuku “Aulia Saribanon” terimakasih atas saran, do,a, nasehat dan semangat yang telah engkau berikan untuk mewujudkan mimpi-mimpi menjadi nyata.
3. Saudara-saudaraku tercinta Luthfi, Ghina, Begita dan Idham untuk semua kasih sayang yang telah diberikan.
4. Harley Darmawan teman terbaik dalam hidup saya yang juga telah membantu dan menemani selama menuntut ilmu dan dalam proses penyelesaian skripsi ini.
5. Umi yang selalu memberi spirit dan motivasi untukku
6. Almarhumah nenekku tercinta R.Siti Fatimah, terimakasih atas doa yang selalu engkau berikan semasa hidupmu.
7. Sahabat-sahabatku, terima kasih atas cinta, doa serta bantuan kalian di saat aku sedih maupun senang.
ABSTRAK
PENGARUH EKSTRAK BIJI PEPAYA (Carica papaya, L.) TERHADAP JUMLAH KELENJAR ENDOMETRIUM, JUMLAH ERITROSIT DAN
LEKOSIT PADA TIKUS PUTIH (Rattus norvegicus) BETINA Oleh
Anis Anya Habibah NIM. 13308141035
Penelitian ini bertujuan untuk mengetahui pengaruh ekstrak biji pepaya (Carica papaya, L.) terhadap jumlah kelenjar endometrium, jumlah eritrosit dan lekosit pada tikus putih (Rattus norvegicus) betina.
Jenis penelitian ini adalah eksperimen menggunakan pola penelitian Rancangan Acak Lengkap (RAL). Obyek yang digunakan dalam penelitian ini adalah tikus putih betina yang berumur ± 2 bulan dengan berat 150-250 gram yang belum pernah bunting. Tikus tersebut dibagi menjadi 4 kelompok perlakuan, yaitu kontrol (tanpa pemberian ekstrak biji pepaya), perlakuan 1 (300 gr/tikus/hari), perlakuan 2 (350 gr/tikus/hari), dan perlakuan 3 (400 gr/tikus/hari).Variabel tergayut dalam penelitian ini adalah jumlah kelenjar endometrium, jumlah eritrosit dan lekosit tikus putih betina. Perlakuan dilakukan selama 21 hari. Uji Kruskal Wallis digunakan untuk menganalisi pengaruh perlakuan terhadap jumlah kelenjar endometrium, sedangkan untuk menganalisis pengaruh perlakuan terhadap jumlah eritrosit dan lekosit dilakukan uji One Way Annova.
Hasil penelitian menunjukkan bahwa pemberian ekstrak biji pepaya tidak memberikan pengaruh secara nyata terhadap jumlah kelenjar endometrium, dan jumlah eritrosit dengan (P>0,05), tetapi berpengaruh nyata pada jumlah lekosit tikus putih betina dengan (P<0,05).
KATA PENGANTAR
Puji syukur Alhamdulillah kami panjatkan ke hadirat Allah SWT, atas anugerah kesehatan sehingga dapat menyelesaikan penulisan Tugas Akhir dengan judul “Pengaruh Ekstrak Biji pepaya (Carica papaya, L.) Terhadap Jumlah Kelenjar Endometrium, Jumlah Eritrosit Dan Lekosit Tikus Putih (Rattus norvegicus, L.) Betina” dengan baik.
Dalam pelaksaan Tugas Akhir ini penulis menyadari banyak menerima bantuan dari berbagai pihak baik secara moril maupun materiil. Untuk itu perkenankan penulis menyampaikan ucapan terima kasih yang banyak kepada :
1. Dr. Hartono, M.Si, selaku Dekan FMIPA Universitas Negeri Yogyakarta yang telah memebrikan izin penelitian di Animal House Jurusan Biologi. 2. Bapak Dr. Paidi, M.Si, selaku Ketua Jurusan Pendidikan Biologi Matematika
dan Ilmu Pengetahuan Alam Uiversitas Negeri Yogyakarta, beserta jajarannya.
3. Dr. Tien Aminatun, M.Si, selaku Kaprodi Biologi FMIPA UNY yang telah memberikan persetujuan dalam menetapkan dosen pembimbing Tugas Akhir Skripsi.
4. Bapak drh. Tri harjana, M.P, selaku pembimbing I yang telah memberikan waktu dan dengan penuh kesabaran telah membimbing, memberikan arahan, masukan serta motivasi sehingga penulisan skripsi ini dapat diselesaikan dengan baik .
5. Bapak Ir. Ciptono, M.Si, selaku dosen pembimbing II yang telah memebrikan waktu dan saran serta memberikan pengetahuan dan kemudahan dalam menyelesaikan penulisan skripsi ini dengan baik.
6. Pak supriadi, pak Budi serta pengelola Green House Biologi yang selalu memberikan izin sampai selesainya Tugas Akhir Skripsi ini.
8. Ibunda dan ayahanda yang tersayang yang telah mendukung dengan doa dan materi selama ini.
9. Terimakasih kepada keluarga tercinta yang selalu sabar dan selalu memberikan doa serta support.
10. Teman-teman Biologi B 2013 yang tidak bisa disebutkan satu persatu atas kerja samanya dan telah memberikan kenangan yang tidak mungkin terlupakan.
11. Semua pihak yang telah membantu dalam pelaksanaan dan penyususnan skripsi.
Penulis menyadari bahwa Laporan Skripsi ini tentunya masih banyak kesalahan dan kekurangan. Saran dan kritik yang membangun sangat diharapkan guna kesempurnaan laporan ini. Penulis berharap semoga penyususunan skripsi dapat bermanfaat bagi penulis dan pembaca.
Yoyakarta, ...
HALAMAN BAB III METODE PENELITIAN
A.Jenis Penelitian ... 35
B.Objek, Waktu dan Tempat ... 35
C.Teknik Penempatan Sample ... 36
1. Penempatan Sample Uji Pendahuluan ... 36
2. Penentuan Dosis Uji pendahuluan ... 36
D.Variabel Penelitian Uji Pendahuluan ... 37
E. Hasil Data Uji Pendahuluan ... 38
F. Penempatan Sample Uji Definitif ... 39
G.Variabel Penelitian Uji Definitif ... 40
H.Populasi dan Sample Penelitian ... 41
BAB IV HASIL DAN PEMBAHASAN A.Hasil Penelitian ... 53
1. Hasil Uji Definitif Pengaruh Pemberian Ekstrak Biji pepaya Terhadap Jumlah Kelenjar Endometrium Tikus Putih Betina ... 53
2. Hasil Uji Definitif Jumlah Eritrosit dan Lekosit Tikus Putih Betina (1ml/Tikus) ... ... 56
3. Hasil Ulas Vagina ... ... 62
4. Gambaran Struktur Histologi Uterus Tikus Putih Betina ... 63
B. Pembahasan ... 65
BAB V PENUTUP A. Simpulan ... 72
B. Saran ... 72
DAFTAR TABEL
HALAMAN
Tabel 1. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sesudah Pemberian Ekstrak Biji Pepaya ... 38
Tabel 2. Rata-Rata Jumlah Eritrosit Dan Lekosit Tikus Putih Betina Sesudah Pemberian Ekstrak Biji Pepaya. ... 38
Tabel 3. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sebelah Kanan Sesudah Pemberian Ekstrak Biji Pepaya . ... 53
Tabel 4. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sebelah Kiri Sesudah Pemberian Ekstrak Biji Pepaya . ... 54
Tabel 5. Hasil Uji Kruskal wallis Pengaruh Pemberian Ekstrak Biji Pepaya terhadap Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sebelah Kanan... 55
Tabel 6. Hasil Uji Kruskal wallis Pengaruh Pemberian Ekstrak Biji Pepaya terhadap Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sebelah Kiri... 55
Tabel 7. Rata-Rata Jumlah Eritrosit Dan Lekosit Tikus Putih Betina per (1ml) Sesudah Pemberian Ekstrak Biji Pepaya ... 57
Tabel 8. Data Hasil Analisis Jumlah Eritrosit Tikus Putih Dengan Analisis One Way Anova ... 57
HALAMAN
DAFTAR GAMBAR
HALAMAN
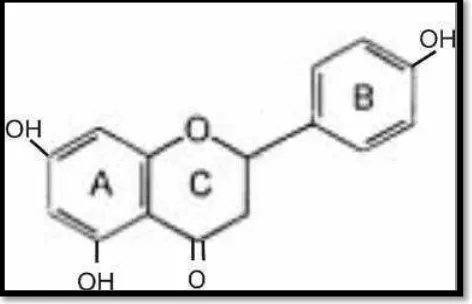
Gambar 1. Kerangka C6-C3-C6 Flavonoid ... 12
Gambar 2. Struktur Histologi Endometrium ... 17
Gambar 3. Struktur Kimia Estrogen... 19
Gambar 4. Tikus Putih Betina ... 27
Gambar 5. Fase proestrus ... 28
Gambar 6. Fase Estrus... 30
Gambar 7. Fase Metestrus ... 31
Gambar 8. Fase Diestrus ... 31
Gambar 9. Kerangka Berfikir Pengaruh Ekstrak Biji Pepaya Terhadap Jumlah Kelenjar Endometrium Tikus Putih ... 33
Gambar 10. Kerangka Berfikir Pengaruh Ekstrak Biji Pepaya Terhadap Jumlah Eritrosit Dan Lekosit Tikus Putih Betina ... 34
Gambar 11. Grafik Pengaruh Pemberian Ekstrak Biji Pepaya Terhadap Jumlah Eritrosit Tikus Putih ... 58
Gambar 12. Grafik Pengaruh Pemberian Ekstrak Biji Pepaya Terhadap Jumlah Lekosit Tikus Putih ... 61
Gambar 13. Ulas Vagina (fase estrus)... 63
HALAMAN Gambar 15. Grafik Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sesudah Mendapat Perlakuan Ekstrak
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Estrogen adalah salah satu hormon yang berperan dalam reproduksi hewan betina. Menurut Shabib (1989: 51-53), bentuk aktif estrogen terpenting adalah estradiol (E2). Estrogen adalah suatu hormon yang diproduksi oleh ovarium (sel techa folikel) estrogen ini diperlukan untuk beberapa hal, misalnya manifestasi fisiologik dari uterus, mempengaruhi pertumbuhan endometrium uterus, perubahan-perubahan histologis pada ephitelium vagina selama siklus estrus, mengontrol pelepasan hormon pituitary (FSH dan LH), serta mempengaruhi pertumbuhan kelenjar mammae atau kelenjar susu pada hewan mammalia (Suhandoyo dan Ciptono, 2009: 34).
Efek estrogen pada uterus yaitu mempengaruhi perubahan pada endometrium, estrogen menyebabkan terjadinya proliferasi pada stroma endometrium dan meningkatkan perkembangan pada kelenjar endometrium, yang nantinya akan membantu memberi nutrisi pada ovum yang berimplantasi (Guyton dan Hall, 2007: 1070).
Isoflavon termasuk dalam golongan flavonoid yang merupakan senyawa polifenolik (Schmidl, 2000: 145).
Senyawa aktif dari biji pepaya ternyata banyak di antaranya mengandung alkaloid, steroid, tanin dan minyak atsiri (Satriasa dan Pangkahila, 2010: 37-39). Hasil uji fitokimia terhadap ekstrak kental etanol biji pepaya diketahui mengandung senyawa metabolit sekunder golongan triterpenoid, flavonoid, alkaloid, dan saponin (Tika pangesti, dkk., 2013: 158).
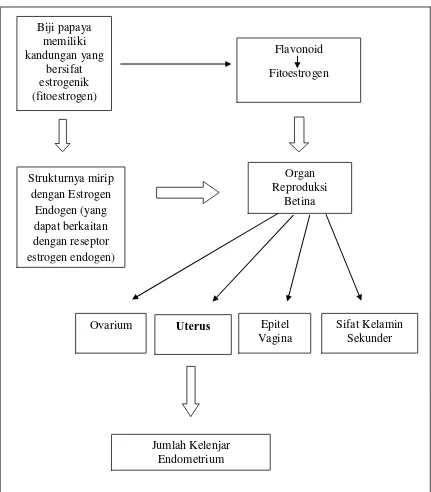
Fitoestrogen adalah senyawa yang terdapat pada kelompok tanaman biji-bijian, kacang-kacangan, sayuran, dan buah-buahan yang memiliki khasiat hampir sama dengan hormon estrogen endogen atau dapat juga berinteraksi reseptor estrogen endogen. Fitoestrogen memiliki dua gugus hidroksil (OH), sama persis dengan estrogen. Gugus OH inilah yang menjadi struktur pokok suatu substrat agar mempunyai efek estrogenik, sehingga mampu berikatan dengan reseptor estrogen (Achadiat, 2003). Adanya estrogen endogen ini dapat menyebabkan proliferasi ditandai dengan kenaikan ukuran tebal sekaligus pertambahan jumlah kelenjar endometrium uterus tikus putih betina. Zat-zat aktif yang terkandung dalam biji pepaya tersebut bisa berefek estrogenik (Lohiya, dkk., 2002: 17-26).
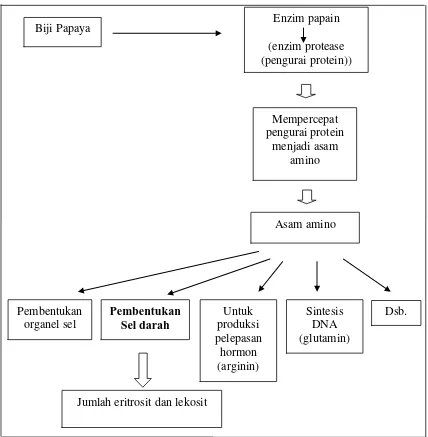
protein–protein tunggal. Papain akan mempercepat penguraian protein dari makanan yang dicerna di dalam sistem pencernaan menjadi asam amino, asam amino diperlukan untuk pembentukan sel termasuk sel darah (Dongoran dan Daniel S, 2004: 31).
Eritrosit atau sel darah merah merupakan salah satu komponen sel yang terdapat dalam darah, fungsi utamanya adalah sebagai pengangkut hemoglobin yang akan membawa oksigen dari paru-paru ke jaringan. Eritrosit merupakan suatu sel yang kompleks, membrannya terdiri dari lipid dan protein (Muhamad, 2008: 7-8).
Lekosit mempunyai peranan dalam pertahanan seluler dan humoral organisme terhadap zat-zat asing. Lekosit dan turunannya merupakan sel dan struktur dalam tubuh manusia yang didistribusikan keseluruh tubuh dengan fungsi utamanya melindungi organisme terhadap invasi dan pengrusakan oleh mikro organisme dan benda asing lainnya (Effendi, 2003: 1&7).
menentukan jumlah kelenjar endometrium akibat pengaruh adanya estrogen. Biji pepaya juga mengandung enzim papain yang dapat mempercepat pemecahan protein menjadi asam amino, dan di antara jenis asam amino tersebut digunakan untuk pembentukan sel darah maka pengaruh pemberian ekstrak biji pepaya (Carica papaya, L.) pada jumlah eritrosit dan lekosit (1ml/tikus) juga akan diamati.
Berdasarkan latar belakang yang telah dijelaskan tersebut, penelitian ini dilakukan untuk mengetahui efek fitoestrogen yang ada di dalam biji pepaya terhadap jumlah kelenjar endometrium, dan mengetahui efek enzim papain yang terdapat pada biji pepaya terhadap jumlah eritrosit dan lekosit pada tikus putih (Rattus norvegicus) betina strain Wistar yang belum pernah bunting.
B. Identifikasi Masalah
Hal-hal yang telah dijelaskan di atas, maka peneliti mengidentifikasi masalah dalam penelitian ini yaitu:
1. Fitoestrogen yang berasal dari ekstrak biji pepaya belum diketahui pengaruhnya terhadap jumlah kelenjar endometrium tikus putih betina.
2. Enzim papain yang berasal dari ekstrak biji pepaya belum diketahui pengaruhnya terhadap jumlah eritrosit dan lekosit pada tikus putih.
4. Efek positif dan negatif dari pemberian ekstrak biji pepaya yang mengandung enzim papain belum diketahui pengaruhnya terhadap jumlah eritrosit dan lekosit pada tikus putih betina maka ini memerlukan penelitian yang lebih lanjut.
C. Batasan Masalah
Batasan masalah dalam penelitian ini adalah :
Penelitian ini dibatasi pada pengaruh ekstrak biji pepaya (Carica papaya, L.) terhadap jumlah kelenjar endometrium, jumlah eritrosit dan lekosit pada tikus putih (Rattus norvegicus) betina.
D. Rumusan Masalah
a. Apakah ekstrak biji pepaya (Carica papaya, L.) berpengaruh terhadap jumlah kelenjar endometrium tikus putih (Rattus norvegicus) betina?
b. Apakah ekstrak biji pepaya (Carica papaya, L.) berpengaruh terhadap jumlah eritrosit dan lekosit tikus putih (Rattus norvegicus) betina?
E. Tujuan Penelitian
a. Untuk mengetahui pengaruh ekstrak biji pepaya (Carica papaya, L.) terhadap jumlah kelenjar endometrium tikus putih (Rattus norvegicus) betina.
F. Manfaat
Manfaat dari hasil penelitian ini adalah untuk berbagai pihak yang menjadi sasaran, antara lain sebagai berikut :
1. Bidang Penelitian
Hasil penelitian dapat dimanfaatkan sebagai data awal bagi penelitian selanjutnya yang akan dilaksanakan. Data hasil penelitian ini juga dapat dimanfaatkan sebagai data pendukung bagi penelitian lainnya yang sebidang ataupun dapat dipakai sebagai ide bagi penelitian lainnya.
2. Masyarakat Umum
Masyarakat dapat menyikapi dengan baik akan kandungan fitoestrogen di berbagai tanaman dan dapat memberikan batas toleransi pengonsumsian tanaman tersebut, Setelah mengetahui pengaruh fitoestrogen ini baik dari media dan lain-lain.
3. Peneliti
G. Batasan Operasional 1. Biji pepaya
Biji pepaya yang digunakan merupakan jenis biji dengan nama spesies Carica papaya, L. didapat dari pedagang papaya di depan pasar Demangan
sebanyak 7,5 kg basah. 2. Tikus Putih
Tikus yang dipakai dalam penelitian yaitu tikus putih Rattus norvegicus yang belum pernah bunting, galur Wistar berusia 8-10 minggu, berat 150-250 gram. Tikus ini didapatkan di (LPPT) UGM.
3. Kelenjar Endometrium
Kelenjar endometrium yang diamati adalah uterus tikus bagian kiri dan kanan yang dibuat preparat menggunakan metode paraffin, dan dicat menggunakan Haematoxylin-eosin (HE). Kelenjar endometrium dihitung dengan cara sampling, yaitu menghitung kelenjar yang terdapat pada seluruh lapang pandang pada struktur penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) dengan menggunakan mikroskop.
4. Sel darah
BAB II
KAJIAN PUSTAKA
A. Dasar Teori 1. Pepaya
Pepaya (Carica papaya, L.) Tanaman pepaya merupakan herba menahun dan tingginya mencapai 8 m. Batang tak berkayu, bulat, berongga, bergetah dan terdapat bekas pangkal daun. Dapat hidup pada ketinggian tempat 1m-1.000m dari permukaan laut dan pada suhu udara 22°C- 26°C. Pada umumnya semua bagian dari tanaman baik akar, batang, daun, biji dan buah dapat dimanfaatkan (Dwi, 2009: 7-8).
Menurut Tjitrosoepomo (2004), sistematika tumbuhan pepaya (Carica papaya, L.) berdasarkan taksonominya adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Cistales
Famili : Caricaceae Genus : Carica
Spesies : Carica papaya, L. Nama lokal : Pepaya
Buah pepaya tergolong buah yang popular dan digemari hampir seluruh penduduk di bumi ini (Amir, 1992: 9). Pepaya (Carica papaya, L.) merupakan tanaman yang cukup banyak dibudidayakan di Indonesia. Di Indonesia, tanaman pepaya dapat tumbuh dari dataran rendah sampai daerah pegunungan 1000 m dpl. Negara penghasil pepaya antara lain kosta Rika, Republik Dominika, Puerto Rika, dan lain-lain. Brazil, India, dan Indonesia merupakan penghasil pepaya yang cukup besar (Dwi, 2009: 7-8).
a. Kandungan biji pepaya
Senyawa aktif dari tanaman pepaya ternyata banyak diantaranya mengandung alkaloid, steroid, tanin dan minyak atsiri. Biji pepaya mengandung senyawa-senyawa steroid. Kandungan biji dalam buah pepaya kira-kira 14,3 % dari keseluruhan buah pepaya (Satriasa dan Pangkahila, 2010: 37-39). Biji pepaya memiliki kandungan berupa asam lemak tak jenuh yang tinggi, yaitu asam oleat dan palmitat (Yuniwati dan Purwanti, 2008: 78-84). Biji pepaya diketahui mengandung senyawa kimia lain seperti golongan fenol, alkaloid, terpenoid dan saponin (Niken N. Paramesti, 2014: 7). Zat-zat aktif yang terkandung dalam biji pepaya tersebut bisa berefek estrogenik (Lohiya, dkk, 2002 dalam Purwoistri, R. F, 2010: 69-70).
kandungan senyawa metabolit sekunder golongan triterpenoid merupakan komponen utama biji pepaya (Tika pangesti, dkk., 2013: 158).
Niken N. Paramesti (2014: 5) mengatakan bahwa papain dapat ditemukan pada hampir seluruh bagian dari pepaya kecuali akarnya. Enzim protease (pengurai protein) yaitu papain dan kimopapain. Papain merupakan satu dari enzim paling kuat yang dihasilkan oleh seluruh bagian tanaman pepaya. Enzim proteolitik merupakan kelompok hidrolase yang berperan pada hidrolisa sekelompok protein menjadi protein – protein tunggal (Dongoran dan Daniel S, 2004: 31).
2. Fitoestrogen
Struktur kimia berupa 2 penilnaptalen yang terdapat pada fitoestrogen menyerupai rumus bangun hormon estrogen endogen. Fitoestrogen, estradiol, dan dietilstilbesrol memiliki gugus OH yang merupakan salah satu persyaratan untuk terjadinya aktivitas estrogenik (Biben, 2012: 2). Fitoestrogen yang terdapat di dalam biji pepaya salah satunya adalah flavonoid, oleh karena itu fitoestrogen tersebut memiliki fungsi estrogenik.
Biji pepaya juga terdapat salah satu bentuk fitoestrogen, yaitu flavonoid. Flavonoid merupakan salah satu kelompok senyawa metabolit sekunder yang paling banyak ditemukan di dalam jaringan tanaman. Flavonoid termasuk dalam golongan senyawa phenolik dengan struktur kimia C6-C3-C6. Kerangka flavonoid terdiri atas satu cincin aromatik A, satu cincin aromatik B, dan cincin tengah berupa heterosiklik yang mengandung oksigen dan bentuk teroksidasi cincin ini dijadikan dasar pembagian flavonoid ke dalam sub-sub kelompoknya. Sistem penomoran digunakan untuk membedakan posisi karbon di sekitar molekulnya (Redha, 2010: 197).
3. Asam Amino
Niken N. Paramesti (2014: 5) mengatakan bahwa papain dapat ditemukan pada hampir seluruh bagian dari pepaya kecuali akarnya. Enzim protease (pengurai protein) yaitu papain dan kimopapain. Papain merupakan satu dari enzim paling kuat yang dihasilkan oleh seluruh bagian tanaman pepaya. Enzim proteolitik merupakan kelompok hidrolase yang berperan pada hidrolisa sekelompok protein menjadi protein – protein tunggal (Dongoran dan Daniel S, 2004: 31).
Asam amino dapat diperoleh dari protein yang kita makan atau dari hasil degradasi protein di dalam tubuh kita. Protein yang terdapat dalam makanan di cerna dalam lambung dan usus menjadi asam-asam amino yang diabsorpsi dan di bawa oleh darah ke hati. Asam amino yang terdapat dalam darah berasal dari tiga sumber yaitu absorpsi melalui dinding usus, hasil penguraian protein dalam sel dan hasil sintesis asam amino dalam sel (Tedy Mulyadi, 2015: 1).
4. Transport Dan Penyimpanan Asam Amino a. Asam Amino Darah
Konsentrasi normal asam amino di dalam darah antara 35 dan 65 mg/dl. Konsentrasi ini adalah rata-rata dari sekitar 2 mg/dl untuk setiap 20 asam amino, walaupun pada beberapa orang ditemukan konsentrasi yang lebih besar dari pada orang lain. Karena asam amino adalah asam yang relatif kuat, asam amino terdapat dalam darah terutama dalam bentuk ionisasi dan menambah 2 sampai 3 miliekuivalen ion negatif dalam darah. Distribusi sebenarnya dari berbagai asam amino dalam darah sampai batas tertentu bergantung pada tipe protein yang dicerna, tetapi sedikitnya konsentrasi asam amino tunggal diatur oleh sintesis selektif dalam berbagai sel (Guyton dan Hall, 2007: 1095).
1) Asam Amino Yang Diabsorbsi Dari Saluran Pencernaan
amino yang tingi berkumpul dalam darah. Namun, kecepatan penggantian asam amino begitu cepat sehingga banyak gram protein dapat dibawa dari satu bagian tubuh ke tempat lain dalam bentuk asam amino tiap jam (Guyton dan Hall, 2007: 1095).
2) Transport Aktif Asam Amino ke Dalam Sel
Pada dasarnya semua molekul asam amino terlalu besar untuk berdifusi melalui pori-pori membran sel. Oleh karena itu jumlah asam amino yang bermakna dapat ditransport melalui membran hanya dengan transpor pasif atau transpor aktif yang menggunakan mekanisme carrier. Namun sifat asli beberapa mekanisme carrier masih sangat sediki yang diketahui (Guyton dan Hall, 2007: 1095).
5. Uterus
Uterus merupakan tempat implantasi konseptus (zigot yang telah berkembang menjadi embrio). Uterus selanjutnya mengalami serangkaian perubahan selama birahi (estrus) dan daur reproduksi (Dellmann dan Brown, 1992: 491-496).
a. Struktur Anatomi
siklus estrus dan dapat dijadikan indikator terjadinya fluktuasi hormon yang sedang terjadi pada hewan tersebut (Sitasiwi, 2008: 40).
Uterus tikus memiliki tiga bagian yang melebar disebut korpus bikormal, di bagian atas berbentuk bulat yang melintang di atas tuba uterina disebut fundus, servik atau leher rahim merupakan bagian bawah yang silindris dan bermuara ke dalam vagina (Soewolo, dkk., 2015: 341- 342). b. Struktur Histologi
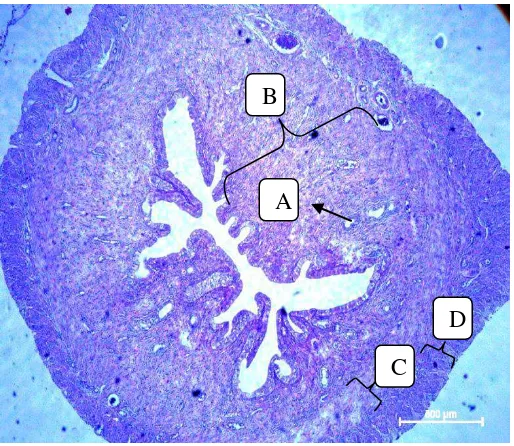
Dinding uterus terdiri dari tiga lapis, yaitu mukosa-submukosa atau endometrium, tunika muskularis atau miometrium, dan tunika serosa atau perimetrium (Sugiyanto, 1996: 10).
Endometrium adalah suatu struktur glandular yang terdiri dari lapisan epitel yang membatasi rongga uterus, lapisan glandular, dan jaringan ikat. Variasi tebal dan vaskularis endometrium tergantung pada perubahan-perubahan hormonal ovarial dan kebuntingan (Feradis, 2010: 51).
kelenjar yang tersusun atas epitel kolumnar dengan nuklei di bagian bawah. Sel kolumner mengelilingi seluruh permukaan endometrium yang membatasi antara lumen uterus, lapisan kelenjar, dan jaringan ikat longgar (Sugiyanto, 1996: 7). Kelenjar ini melebar dan terbuka pada permukaan endometrium. Terdapat dua pembuluh darah dalam endometrium, yaitu spiral dan lurus. Sepanjang siklus estrus kelenjar dan pembuluh darah mengalami perubahan struktur. Peningkatan hormon estrogen yang terjadi dari fase proestrus sampai fase estrus menyebabkan pertumbuhan serta percabangan kelenjar, sedangkan kenaikan progesteron setelah fase estrus menyebabkan peningkatan aktivitas sekresi kelenjar endometrium. Perkembangan struktur kelenjar sepanjang siklus estrus berjalan seiring dengan pertambahan tebal endometrium uterus.
Peningkatan kandungan estrogen dapat merangsang pertumbuhan serta percabangan kelenjar endometrium, tetapi uliran serta ekskresi kelenjar tersebut tidak dapat terjadi sebelum ada rangsangan dari progesteron (Dellmann dan Brown, 1992: 514).
jaringan otot yang terdapat pada dinding uterus bertambah banyak karena pembesaran sel dan penambahan jumlah sel (Feradis, 2010: 51).
Perimetrium atau tunika serosa, terdiri dari jaringan ikat yang longgar yang dibalut dengan mesotel atau peritoneum. Sel-sel otot polos terdapat pada perimetrium. Pada lapisan ini banyak terdapat pembuluh darah, pembuluh limfe, dan saraf (Dellmann dan Brown, 1992: 515).
Gambar 2. Struktur Histologi Endometrium,A: kelenjar endometrium; B:edometrium; C: miometrium; D: perimetrium. (Dokumen penelitian: 2017).
c. Pengaruh Hormon Pada Endometrium
Perubahan secara siklik pada endometrium diatur oleh hormon-hormon hipotalamus-hipofisis-gonad. Aktifitas dari hipotalamus tersebut dipengaruhi oleh kadar estrogen di dalam sirkulasi darah dan rangsangan lingkungan luar.
Skala 100µm B
Ovarium adalah tempat produksi utama hormon betina. Pada seksualitas betina hormon yang bekerja adalah progesteron dan estrogen. Estrogen bekerja dalam merangsang pertumbuhan miometrium dan endometrium. Peningkatan dalam sintesis reseptor progesteron didalam endometrium dipengaruhi oleh hormon estrogen sehingga progesteron mampu merangsang endometrium tetapi setelah endometrium tersebut dirangsang oleh estrogen. Adanya rangsangan hormon yang disekresikan oleh hipotalamus sehinngga dalam proses tersebut menghasilkan hormon-hormon, yaitu FSH-RF dan LH-RF. FSH-RF (Follicle Stimulating Hormone-Releasing Factor) bertugas untuk merangsang hipofisa dalam mensekresi FSH (Follicle
Stimulating Hormon), sedangkan LH-RF (Luteinizing Hormone-Releasing
Factor) bertugas untuk merangsang pengeluaran dari LH (Luteinizing
Hormon) (Irianto, 2014: 129).
Gambar 3. Struktur Kimia Estrogen (Junqueira, 2007: 4)
Estrogen terbentuk oleh sel-sel granulosa dalam folikel ovarium melalui serangkaian reaksi enzimatis. Substrat utama sebagai pembentuk estrogen adalah kolesterol. Kolesterol mengalami perubahan secara berurutan menjadi pregnenolon, progesteron, 17α-hidroksi progesteron, androstenedion dan testoteron. Peningkatan sintesis hormon estrogen seiring dengan perkembangan folikel dalam ovarium (Dellman dan Brown, 1992: 486).
korpus luteum. Saat seperti ini ovum akan keluar dari folikel dan ovarium menuju uterus (terjadi ovulasi). Korpus luteum yang terbentuk segera menyekresikan hormon progesteron. Progesteron berfungsi menjaga pertumbuhan endometrium seperti pembesaran pembuluh darah dan pertumbuhan kelenjar endometrium yang akan menyekresikan cairan bernutrisi bagi janin. Namun apabila ovum pada uterus tidak dibuahi, hormon estrogen akan berhenti. Berikutnya skresi hormon LH oleh kelenjar pituitari juga berhenti. Akibatnya korpus luteum tidak bisa melangsungkan sekresi hormon progesteron. Karena hormon progesteron tidak ada, maka dinding rahim sedikit demi sedikit meluruh bersama darah (Irianto, 2014: 129).
d. Mekanisme Intrasel Dasar Dari Kerja Estrogen
Efek estrogen pada uterus yaitu mempengaruhi perubahan pada endometrium, estrogen menyebabkan terjadinya poliferasi yang nyata pada stroma endometrium dan sangat meningkatkan perkembangan yang nyata pada kelenjar endometrium, yang nantinya akan membantu memberi nutrisu pada ovum yang berimplantasi (Guyton dan Hall, 2007: 1070). Mekanisme intrasel dasar dari kerja estrogen diawali dari kelenjar ovarium, estrogen memasuki sel ovarium dalam waktu beberapa menit setelah disekresikan. Kemudian kebanyakan estrogen ini seringkali diubah dibawah pengaruh enzim intrasel 5-α-reduktase menjadi estradiol, dan zat ini lalu berikatan dengan sebuah “protein reseptor” di sitoplasma. Kemudian penggabungan ini
RNA-polimerase telah menjadi aktif dan konsentrasi RNA mulai meningkat di sel ovarium, keadaan ini akan diikuti oleh penambahan yang progresif dari protein sel. Setelah beberapa hari, jumlah DNA dikelenjar ovarium juga meningkat dan bersama dengan itu juga terdapat peningkatan jumkah sel-sel ovarium (Guyton dan Hall, 2007: 1058).
6. Komposisi Darah
Darah terdiri atas komponen cairan (plasma) dan komponen seluler (sel-sel darah). Sel-sel darah terdiri dari eritrosit (sel darah merah), Lekosit (sel darah putih) dan trombosit (keping darah), yang diedarkan ke seluruh tubuh melalui sistem sirkulasi tertutup (Muhamad, 2008: 7-8). Sel dan plasma darah mempunyai peranan fisiologis yang sangat penting.
a. Plasma Darah
Plasma darah adalah suatu cairan jernih yang mengandung mineral terlarut, hasil absorpsi dari pencernaan makanan, buangan hasil metabolisme, serta gas terlarut (Muhamad, 2008: 7-8).
b. Sel Darah Merah (Eritrosit)
mengangkut karbondioksida dari jaringan ke paru-paru (Murray, dkk., 2003: 254). Fungsi ini berlangsung karena adanya kandungan hemoglobin di dalam eritrosit.
Eritrosit atau sel darah merah merupakan salah satu komponen sel yang terdapat dalam darah, fungsi utamanya adalah sebagai pengangkut hemoglobin yang akan membawa oksigen dari paru-paru ke jaringan. Eritrosit merupakan suatu sel yang kompleks, membrannya terdiri dari lipid dan protein, sedangkan bagian dalam sel merupakan mekanisme yang mempertahankan sel selama 120 hari masa hidupnya serta menjaga fungsi hemoglobin selama masa hidup sel tersebut (Muhamad, 2008: 7-8).
c. Sel Darah Putih (Lekosit)
Lekosit adalah sel darah yang mengandung inti, disebut juga sel darah putih. Rata-rata jumlah lekosit dalam darah manusia normal adalah
5000-9000/mm3, bila jumlahnya lebih dari 10.000/mm3, keadaan ini disebut
Terdapat 3 jenis lekosit granular yaitu neutrofil, basofil, dan asidofil (eosinofil) (Effendi, 2003: 1).
Lekosit mempunyai peranan dalam pertahanan seluler dan humoral organisme terhadap zat-zat asingan. Lekosit dapat melakukan gerakan amuboid dan melalui proses diapedesis lekosit dapat meninggalkan kapiler dengan menerobos antara sel-sel endotel dan menembus kedalam jaringan penyambung. Lekosit dan turunannya merupakan sel dan struktur dalam tubuh manusia yang didistribusikan keseluruh tubuh dengan fungsi utamanya melindungi organisme terhadap invasi dan pengrusakan oleh mikro organisme dan benda asing lainnya (Effendi, 2003: 1).
Jumlah lekosit per mikroliter darah, pada orang dewasa normal adalah
5000-9000/mm3, waktu lahir 15000-25000/mm3, dan menjelang hari ke empat turun sampai 12000, pada usia 4 tahun sesuai jumlah normal (Effendi, 2003: 1).
1). Jenis-Jenis Sel Darah Putih a). Bergranula
(1). Neutrofil
dari lisosom, yang primer mengandung mieloperoksidase, fosfatase asam dan hidrolase asam lain, yang sekunder mengandung fosfatase lindi dan lisosom (Hoffbrand dan Pettit, 1996 dalam Effendi, 2003: 2).
(2). Eosinofil
Sel ini serupa dengan neutrofil kecuali granula sitoplasmanya lebih kasar dan berwarna lebih merah gelap (karena mengandung protein basa) dan jarang terdapat lebih dari tiga lobus inti. Mielosit eosinofil dapat dikenali tetapi stadium sebelumnya tidak dapat dibedakan dari prekursor neutrofil. Waktu perjalanan dalam darah untuk eosinofil lebih lama daripada untuk neutropil. Eosinofil memasuki eksudat peradangan dan nyata memainkan peranan istimewa pada respon alergi, pada pertahanan melawan parasit dan dalam pengeluaran fibrin yang terbentuk selama peradangan (Hoffbrand dan Pettit, 1996 dalam Effendi, 2003: 2).
(3). Basofil
Basofil hanya terlihat kadang-kadang dalam darah tepi normal. Diameter basofil lebih kecil dari neutrofil yaitu sekitar 9-10 μm. Jumlahnya 1% dari total sel darah putih. Basofil memiliki banyak granula sitoplasma yang menutupi inti dan mengandung heparin dan histamin. Dalam jaringan, basofil menjadi “mast cells”. Basofil memiliki tempat-tempat perlekatan IgG
b). Tidak Bergranula (1). Monosit
Rupa monosit bermacam-macam, dimana ia biasanya lebih besar daripada lekosit darah tepi yaitu diameter 16-20 μm dan memiliki inti besar di tengah oval atau berlekuk dengan kromatin mengelompok. Sitoplasma yang melimpah berwarna biru pucat dan mengandung banyak vakuola halus sehingga memberi rupa seperti kaca. Granula sitoplasma juga sering ada. Prekursor monosit dalam sumsum tulang (monoblas dan promonosit) sukar dibedakan dari mieloblas dan monosit (Hoffbrand dan Pettit, 1996 dalam Effendi, 2003: 3).
(2). Limfosit
Sebagian besar limfosit yang terdapat dalam darah tepi merupakan sel kecil yang berdiameter kecil dari 10μm. Intinya yang gelap berbentuk bundar
atau agak berlekuk dengan kelompok kromatin kasar dan tidak berbatas tegas. Nukleoli normal terlihat. Sitoplasmanya berwarna biru-langit dan dalam kebanyakan sel, terlihat seperti bingkai halus sekitar inti. Kira-kira 10% limfosit yang beredar merupakan sel yang lebih besar dengan diameter 12-16μm dengan sitoplasma yang banyak yang mengandung sedikit granula
azuropilik. Bentuk yang lebih besar ini dipercaya telah dirangsang oleh antigen, misalnya virus atau protein asing (Hoffbrand dan Pettit, 1996 dalam Effendi, 2003: 3).
misalnya bakteri, virus, jamur, protozoa, parasit dan radikal bebas yang dapat menyebabkan infeksi pada manusia (Effendi, 2003: 4).
Sistem imun terpapar zat yang dianggap asing, maka ada dua jenis respon imun, yaitu respon imun non-spesifik dan respon imun spesifik. Respon imun non-spesifik merupakan imunitas alamiah atau bawaan, sedangkan respon imun spesifik merupakan mekanisme pertahanan utama dan pertama pada invasi mikroorganisme. Pada respon imun non-spesifik, mekanisme yang terjadi adalah proses fagositosis mikroorganisme oleh sel fagosit seperti neutrofil, eusinofil, basofil, monosit dan makrofag (Effendi, 2003: 4).
Makrofag adalah sel fagosit terpenting dalam sistem imun yang berasal dari sel monosit dewasa yang menetap di jaringan. Makrofag memliki dua fungsi utama yaitu menghancurkan antigen dan menyajikannya kepada limfosit (Effendi, 2003: 5).
7. Tikus Putih (Rattus Norvegicus)
Tikus merupakan hewan mamalia yang paling umum digunakan sebagai hewan percobaan pada laboratorium, dikarenakan banyak keunggulan yang dimiliki oleh tikus sebagai hewan percobaan, yaitu memiliki kesamaan fisiologis dengan manusia, siklus hidup yang relatif pendek, jumlah anak per kelahiran banyak, variasi sifat-sifatnya tinggi dan mudah dalam penanganan (Priyambodo, 1995: 55). Tikus (Rattus norvegicus) memiliki beberapa galur yang merupakan hasil persilangan sesama jenis, namun galur yang akan digunakan untuk penelitian ini adalah Wistar.
Rattus norvegicus merupakan salah satu jenis hewan yang biasa
digunakan untuk keperluan uji laboratorium. Rattus norvegicus mudah ditemukan secara liar maupun ditangkar.
Gambar 4. Tikus Putih Betina (Dokumen Penelitian, 2017). Klasifikasi tikus putih menurut (Priyambodo, 1995: 55) : Kingdom : Animalia
Sub Kelas : Theria Ordo : Rodentia Sub Ordo : Myomorpha Family : Muridae Genus : Rattus
Spesies : Rattus norvegicus
8. Siklus Reproduksi Mamalia Betina a. Siklus Estrus
Periode birahi atau estrus adalah suatu periode yang secara psikologis maupun fisologis bersedia menerima pejantan untuk melakukan perkawinan. Siklus estrus adalah suatu periode (masa) dari permulaan periode birahi ke permulaan perode berikutnya sampai akhir periode (Nalbandov, 1990: 140).
Tikus dan mencit siklus estrusnya termasuk poliestrus, hanya saja ketika hewan tersebut menyusui maka aktivitas seksual seolah-olah juga berhenti dan pada waktu itu disebut lactational diestrus (Sugiyanto, 1996: 22).
Menurut Sugiyanto (1996:22) siklus estrus dapat dibedakan menjadi 4 fase, yaitu :
1) Proestrus : terdapat sel epitel biasa
2) Estrus : terdapat banyak sel epitel menanduk 3) Diestrus : terdapat sel epitel biasa dan banyak lekosit
Perubahan-perubahan yang terjadi dalam ovarium dan vagina ditunjukkan oleh preparat vaginal smear menurut (Priyambodo,1995: 55) adalah sebagi berikut:
1) Proestrus
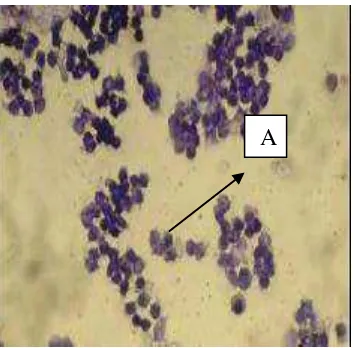
Proestrus adalah fase persiapan dan biasanya berlangsung dalam waktu yang relatif pendek. Pada fase ini juga mulai terlihat perubahan pada alat kelamin betina.
Gambar 5. Fase proestrus. A; eritrosit. B; epitel (Dellman dan Brown, 1992: 524). 2) Estrus
Estrus merupakan fase yang terpenting dalam siklus estrus, karena dalam fase ini hewan betina menunjukkan perilaku mau menerima hewan jantan untuk melakukan kopulasi. Gambaran preparat vaginal smear pada fase ini ditandai dengan ditemukannya banyak sel-sel superfisial.
Fase estrus merupakan periode birahi dan kopulasi hanya dimungkinkan padasaat ini. Keadaan ini pada tikus berakhir 9 sampai 15 jam dan ditandai dengan aktifitas berlari-lari yang sangat tinggi.
Gambar 6. Fase Estrus. A; epitel bertanduk. B; lekosit heterofil (Dellman dan Brown, 1992: 524).
3) Metestrus
Metestrus adalah fase dalam siklus estrus yang terjadi segera setelah estrus berakhir.
Gambar 7. Fase Metestrus. A; epitel. B; lekosit (terdapat banyak lekosit) (Dellman dan Brown, 1992: 524).
4) Diestrus
Diestrus adalah fase dalam siklus estrus yang ditandai tidak adanya kebuntingan, tidak adanya aktivitas kelamin dan hewan menjadi tenang.
B A
A
Gambar 8. Fase Diestrus. A; leksit (terdapat banyak lekosit) (Dellman dan Brown, 1992: 524).
9. Kerangka Berfikir
Estrogen alami tidak hanya ditemukan pada hewan maupun manusia, akan tetapi senyawa yang mirip dengan estrogen juga ditemukan pada tanaman salah satunya tanaman pepaya. Biji dari tanaman pepaya ini mengndung senyawa yang disebut flavonoid yang termasuk dalam salah satu jenis fitoestrogen. Estrogen merupakan salah satu hormon yang berperan dalam reproduksi hewan betina, dan organ yang dipengaruhi yaitu uterus dan ovarium. Fitoestrogen di dalam tubuh dapat berikatan dengan reseptor hormon estrogen endogen meskipun memiliki efek yang lebih rendah daripada estrogen endogen.
Pemberian fitoestrogen yang memiliki struktur yang mirip dengan estrogen diharapkan mampu memberikan efek yang berbeda pada lapisan endometrium pada organ betina tikus putih. Pengaruh fitoestrogen dapat dilihat pada uterus, karena pada uterus terdapat reseptor estrogen. Efek dari
keberadaan fitoestrogen ini dapat dilihat pada jumlah kelenjar yang terdapat di dalam lapisan tersebut.
Gambar 9. Skema Kerangka Berfikir Pengaruh Ekstrak Biji Pepaya Terhadap Jumlah Kelenjar Endometrium Tikus Putih
Gambar 10. Skema Kerangka Berfikir Pengaruh Ekstrak Biji Pepaya Terhadap Jumlah Eritrosit Dan Lekosit Tikus Putih Betina.
10. Hipotesis
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian ini adalah eksperimen satu faktor yang menggunakan pola acak lengkap.
B. Obyek, Waktu dan Tempat Penelitian 1. Obyek Penelitian
Tikus putih (Rattus norvegicvus) sebanyak 20 ekor galur Wistar yang berjenis kelamin betina, usia 8-10 minggu dengan berat 150-250 gram dan belum pernah bunting.
2. Waktu
Penelitian ini dilaksanakan pada tanggal 1 November 2016 uji pendahuluan. dan pada tanggal 1 Januari 2017 dilakukannya uji definitif . 3. Tempat
a. Pembuatan ekstrak biji pepaya (Carica papaya, L.) dilakukan di Farmasi Biologi UGM Unit II.
b. Pemeliharaan tikus dilakukan di Unit Pengelolaan Hewan Laboratorium Biologi FMIPA UNY.
d. Pengamatan preparat histologi jumlah kelenjar endometrium, jumlah eritrosit dan lekosit dilakukan di Laboratorium Anatomi dan Zoologi Jurdik BIOLOGI FMIPA UNY.
C. Teknik Penempatan Sample
1. Penempatan sampel uji pendahuluan
Metode pengambilan sampel yang digunakan yaitu metode acak lengkap. Dengan mengambil tikus dari keranjang secara acak sebanyak 2 tikus dan diletakkan pada kotak/wadah pertama (perlakuan 1) kemudian diberi tanda yaitu merah dan biru, selanjutnya dilakukan sama untuk wadah selajutnya hingga wadah ke 4 (sampai perlakuan ke 3 dan kontrol).
Ulagan
2. Penentuan dosis uji pendahuluan
Dosis yang akan digunakan yaitu 0, 100, 200, dan 300 mg/tikus/hari. Uji pendahuluan dilakukan agar diketahui pasti apakah dosis yang ditentukan tersebut sudah cukup berpengaruh terhadap jumlah kelenjar endometrium, jumlah eritrosit dan lekosit tikus putih betina.
10% (ekstrak)
Membuat 50 ml ekstrak cair
10 gram + 40 ml aquadesh = 50 ml ekstrak cair 10.000 mg ekstrak kental = 50 ml ekstrak cair Berarti :
100 mg = ½ ml ekstrak cair (dalam 100 mg ekstrak kental dilarutkan dengan aquadesh hingga volume 0,5 ml)
200 mg = 1 ml ekstrak cair (dalam 200 mg ekstrak kental dilarutkan dengan aquadesh hingga volume 1 ml)
300 mg = 1 ½ ml ekstrak cair (dalam 300 mg ekstrak kental dilarutkan dengan aquadesh hingga volume 1,5 ml)
D. Variabel Penelitian uji pendahuluan 1. Variabel Bebas uji pendahuluan
Pemberian ekstrak biji pepaya dalam konsentrasi yang bervariasi pada tiap kelompok perlakuan, kelompok kontrol (tanpa pemberuan ekstrak biji pepaya), perlakuan 1 (100 mg/tikus/hari), perlakuan 2 (200 mg/tikus/hari), dan perlakuan 3 (300 mg/tikus/hari).
2. Variabel Tergayut :
3. Perlakuan standart :
a. Pakan dan minum untuk tikus selalu tersedia setiap saat b. Waktu pemberian ekstrak biji pepaya pukul 13:00 c. Jenis tikus galur Wistar
d. Ukuran kandang
E. Hasil Data Uji Pendahuluan
1. Hasil uji pendahuluan Pengaruh Pemberian Ekstrak Biji pepaya Terhadap Jumlah Kelenjar Endometrium
Dilakukannya uji pendahuluan untuk mengetahui konsentrasi yang tepat untuk digunakan pada saat uji definitif.
Tabel 1. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina per satuan lapang pandang dengan perbesaran lensa objektif 10x (dilihat pada layar monitor) Sesudah Pemberian Ekstrak Biji Pepaya
Uterus Ulangan K P1 P2 P3
Kanan Rata-rata 39,5 23,5 24 27,5 Kiri Rata-rata 29,5 15,5 11 23
2. Hasil Uji Pendahuluan Pengaruh Pemberian Ekstrak Biji Pepaya Terhadap Jumlah Eritrosit Dan Lekosit Tikus Putih Betina
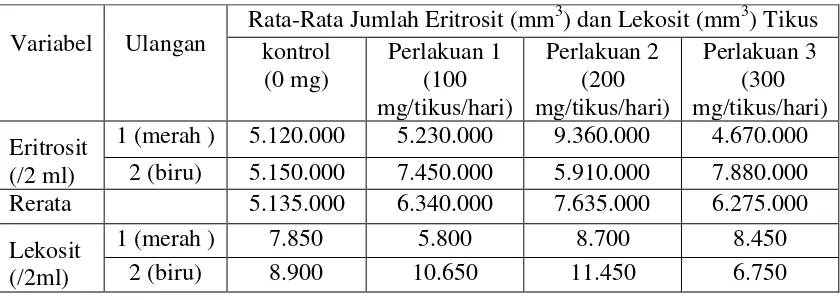
Tabel 2. Rata-Rata Jumlah Eritrosit Dan Lekosit Tikus Putih Betina Sesudah Pemberian Ekstrak Biji Pepaya
Variabel Ulangan
Rata-Rata Jumlah Eritrosit (mm3) dan Lekosit (mm3) Tikus kontrol 2 (biru) 5.150.000 7.450.000 5.910.000 7.880.000 Rerata 5.135.000 6.340.000 7.635.000 6.275.000 Lekosit
(/2ml)
Hasil data uji pendahuluan dari pengaruh ekstrak biji pepaya terhadap jumlah kelenjar endometrium, jumlah eritrosit dan lekosit tikus putih betina tidak berpengaruh nyata, dengan hasil signifikasi dari uji Kruskal wallis jumlah kelenjar endometrium sebelah kanan yaitu 0,238 dan jumlah kelenjar endometrium sebelah kiri yaitu 0,100 angka ini lebih besar dari taraf uji 0,05. Artinya Ha ditolak. Hasil uji One Way Anova angka signifikasi jumlah eritrosit yaitu sebesar 0,640 dan lekosit sebesar 0,696 artinya angka ini juga lebih besar dari pada taraf uji 0,05. maka dilakukannya pertambahan dosis untuk uji definitif yaitu sebesar 300, 350, dan 400 mg/ 150 BB tikus/hari.
F. Penempatan Sampel uji definitif
Ulagan
Merah-merah Merah-merah Merah-merah Merah-merah
Ulangan 4
Hijau-hijau Hijau-hijau Hijau-hijau Hijau-hijau
Ulangan 5
Merah-hijau Merah-hijau Merah-hijau Merah-hijau
G. Variabel Penelitian uji definitif 1. Variabel Bebas
Pemberian ekstrak biji pepaya dalam konsentrasi yang bervariasi pada tiap kelompok perlakuan, kelompok kontrol (tanpa pemberuan ekstrak biji pepaya), perlakuan 1 (300 mg/tikus/hari), perlakuan 2 (350 mg/tikus/hari), dan perlakuan 3 (400 mg/tikus/hari).
2. Variabel Tergayut :
Jumlah kelenjar endometrium per satuan lapang pandang pada struktur penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat pada layar monitor), jumlah eritrosit dan lekosit tikus putih (Rattus norvegicvus) betina (1 ml /tikus/hari).
3. Perlakuan Standart :
a. Pakan dan minum untuk tikus selalu tersedia setiap saat
c. Jenis tikus galur Wistar d. Ukuran kandang
H. Populasi dan Sampel Penelitian 1. Populasi
Tikus putih (Rattus norvegicus) betina galur Wistar yang belum pernah bunting.
2. Sampel
Sampel dalam penelitian ini adalah 8 ekor tikus untuk uji pendahuluan pada bulan November 2016, dan 20 ekor untuk uji definitif pada bulan Januari 2017 tikus putih (Rattus norvegicus) galur Wistar betina usia 8-10 minggu dengan berat 150-250 gram dan belum pernah bunting yang diberi perlakuan ekstrak biji pepaya. Tikus ini didapatkan / dibeli di (LPPT) UGM.
I. Alat dan Bahan Penelitian 1. Alat yang digunakan
2. Bahan yang digunakan
Bahan yang digunakan dalam penelitian ini berupa: alkohol, tikus putih betina, pakan dan minum tikus, ekstrak biji pepaya, sabun / antiseptik, aquades, etanol 96%, NaCl, latutan hayem, larutan turk, formalin, methanol, kloroform, xylol, larutan hematoxylin, larutan eosin, garam fisiologi, gliserin.
J. Prosedur Kerja 1. Tahap Persiapan
a. Menyiapkan tikus putih sebanyak 8 ekor untuk uji pendahuluan dan 20 ekor tikus putih untuk pengambilan data dengan bobot dan umur yang sama (berat badan rata-rata 150-250 gr dan umur 2 bulan).
b. Menyiapkan kandang tikus sebanyak 4 kandang.
c. Melakukan ektraksi biji pepaya di Farmasi UGM unit II. d. Menyiapkan ekstrak bij pepaya
2. Pembuatan Ekstrak Biji Pepaya Dengan Teknik Maserasi
menggunakan alat evaporator sehingga di dapat ekstrak kental yang terpisah dari pelarut etanolnya.
3. Aklimatisasi
a. Menyiapkan sekitar 8 ekor untuk uji pendahuluan dan 20 ekor tikus putih untuk pegambilan data galur Wistar dengan umur sekitar 2 bulan dan berat ±150-250 gram.
b. Menyiapkan 4 kandang tikus, dan mengambil tikus secara acak sehingga masing-masing kandang terisi 2 ekor tikus untuk uji pendahuluan dan 5 ekor tikus untuk uji definitif.
c. Pemberian pakan dan minum tikus dilakukan 1 hari sekali.
d. Setiap 3 hari sekali dilakukan pergantian alas dengan mengganti serbuk gergaji lama dengan yang baru.
e. Proses aklimatisasi dilakukan selama 7 hari di Unit Pengelolaan Hewan Biologi UNY.
4. Penentuan Dosis
Hasil uji pendahuluan dosis tersebut tidak memberikan pengaruh yang nyata, maka pada uji definitif dilakukannya penambahan dosis sebesar 300, 350, dan 400 mg/tikus/hari. Hasil pelarutan ekstrak biji pepaya sebagai berikut:
10.000 mg ekstrak kental = 50 ml ekstrak cair Berarti :
5. Tahap Pelaksanaan
a. Pemberian ekstrak biji pepaya
Ekstrak biji pepaya diberikan secara oral pada tikus perlakuan sesuai dosisnya masing-masing dan diberikan setiap 1 hari sekali sebelum makan pada pagi menjelang siang hari selama 21 hari.
b. Pemeliharaan dengan pemberian pakan pellet AD 1 secara rutin. c. Ulas vagina
d. Pengamatan jumlah sel darah merah dan putih
pengambilan sel darah dari tikus tersebut dengan meggunakan pipa hematokrit, di bagian vena orbitalis sebanyak 1 ml, dan meletakkan di atas
hemositometer kemudian meneteskan dengan dengan Hayem untuk mengecek
jumlah eritrosit dan meneteskan dengan Turk untuk mengecek jumlah lekosit tikus putih.
1) Penghitungan Jumlah Eritrosit dan Lekosit
Cara penghitungan jumlah eritrosit dan lekosit dengan cara sampling sebagai berikut (Nurcahyo, 2003: 31,38).
a) Mengambil darah yang ada dalam mikrotube dengan pipet khusus sampai tanda 0,5 kemudian membersihkan ujung pipet dengan kertas tissue. Hisap reagent hayem sampai tanda 101 (jangan sampai ada gelembung udara), kemudian pipet digoyangkan perlahan sampai homogen.
b) Menyiapkan bilik hitung (haemacytometer).
c) Dua tetes pertama larutan darah dalam pipet tersebut dibuang terlebih dahulu, lalu meneteskan dalam pipet ke haemacytometer yang telah diletakkan gelas penutup di atasnya lewat tepi sampai merata.
d) Darah yang sudah ada dalam haemacytometer diamati menggunakan mikroskop dengan perbesaran lensa objektif 100x (dilihat pada layar monitor).
Keterangan:
Angka 10 berasal dari dalamnya pipet 0,1 mm dijadikan 1 mm (10 kali) Angka 5 berasal dari 1/5 dari 1 mm3 (25 kotak)
Angka 200 berasal dari pengenceran 200 kali (0,5 menjadi 101)
Penghitungan sel darah putih, sama halnya dengan langkah kerja pada penghitungan sel darah merah. Reagent yang digunakan adalah reagent turk dan pipet khusus yang digunakan bertanda khusus 11. Perhitungan dilakukan pada 5 kotak besar haemocytometer dan jumlahnya dihitung denganrumus:
Keterangan: Jumah SDP (a)
Jumlah rata-rata kotak (b)
Angka 20 berasal dari pengenceran 0,5 menjadi 11 (20 kali) Angka 10 berasal dari kedalaman parit 0,1 mm (menjadi 1 mm) Angka 4 berasal dari kotakan (mestinya hanya 1 kamar)
e. Melakukan pembedahan dan pembuatan preparat
Pembedahan dan pembuatan preparat organ uterus yang di dalamnya mencakup kelenjar endometrium, dan pembuatan preparat eritrosit dan lekosit.
f. Pembuatan preparat histologi.
Pembedahan dilakukan terhadap tikus pada hari ke 22 pada saat fase estrus kemudian pengambilan organ uterus, kemudian direndam dalam
Jumlah SDM = (SDM yang dihitung x 10 x 5 x 200) mm3
formalin 10 %. Pembuatan preparat dilakukan di Fakultas Kedokteran UGM dengan cara kerja sebagai berikut:
1) Fixation
yang telah dilabeli dimasukkan kedalam fixative, yaitu formalin 10%. 2) Trimming
Triming adalah tahapan yang dilakukan setelah proses fiksasi dengan melakukan pemotongan tipis jaringan setebal kurang lebih 4 mm.
3) Dehydration (Pengeringan)
Dehidrasi jaringan dimaksudkan untuk mengeluarkan air yang terkandung dalam jaringan, dengan meggunakan cairan dehidran yaitu alkohol secara bertingkat dengan waktu yang tertentu yaitu
a) Alkohol 80%, dilakukan 2 jam perendaman b) Alkohol 96%, dilakukan 2 jam perendaman c) Alkohol 96%, dilakukan 1 jam perendaman d) Alkohol absolut, dilakukan 1 jam perendaman e) Alkohol absolut, dilakukan 1 jam perendaman f) Alkohol absolut, dilakukan 1 jam perendaman 4) Clearing (Penjernihan)
Proses ini bertujuan untuk menghilangkan alkohol, agar parafin dapat masuk ke dalam jaringan. Agen penjernihan adalah Xylol dengan cara bertahap yaitu :
c) Xylol, dilakukan 1 jam perendaman 5) Parafination
Proses infiltrasi dilakukan didalam oven (incubactor) dengan perbandingan xilol : paraffin = 1:1 selama 120 menit pada suhu 600C. Pemberian paraffin murni dilakukan selanjutnya pada suhu 600C selama 120 menit kemudian dilanjutkan pemberian paraffin murni pada suhu 600C selama 120 menit.
6) Embeddingi (Penanaman)
Jaringan berada pada parafin kemudian dilekatkan pada balok kayu ukuran 3x3 cm atau embedding cassette. Fungsi dari balok kayu atau embedding cassette adalah untuk pemegang pada saat blok dipotong dengan
mikrotom.
7) Sectioning (pemotongan menggunakan mikrotom)
a) Blok parafin yang telah berisi jaringan, diiris menggunakan scalpelsehingga bagian yang akan diiris dengan pisau mikrotom
berbentuk segiempat teratur. Preparat diletak ditengah, kira-kira 3-5 mm dari tepinya.
b) Meletakkan blok parafin pada holder kayu.
c) Memasang holder dengan blok paraffin pada rotary mikrotom yang direkatkan.
e) Mengatur tebal tipisnya coupes dengan mengatur pada pengaturan di mikrotom.
f) Memasukkan preparat ke dalam nampan yang berisi air hangat. Hal tersebut dilakukan agar coupes dapat merentang dan jaringan tidak melipat.
g) Menempelkan coupes pada gelas benda (pada proses affixing) yang sebelumnya telah diolesi oleh putih telur atau albumin.
8) Affixing
a) Meletakkan sejumlah coupes (irisan tengah pita preparat) pada kaca benda yang telah diberi perekat dengan gliserin dan albumin.
b) Memindahkan kaca-kaca gelas benda yang berisi coupes tersebut keatas hot plate dengan suhu (40-45°C), adanya kelebihan air dihisap dengan menggunakan pipet/kertas saring, dan mengarur letak coupes dengan parafinnya direntangkan.
9) Pewarnaan menggunakan Hematoxylin-Eosin
a) Mencelupkan kaca benda yang telah ditempeli coupes ke dalam xylol secara berulang yaitu :
Xylol (I) selama 5 menit
Xylol (II) selama 5 menit
Xylol (III) selama 5 menit
c) Mencelupkan coupes kedalam aquadest selama 1 menit d) Mencelupkan kedalam Harris-Hematoxyilin selama 20 menit e) Mencelupkan coupes kedalam aquadest selama 1 menit
f) Mencelupkan coupes kedalam acid alkohol sebanyak 2-3 celupan g) Mencelupkan coupes kedalam aquadest selama 1 menit
h) Mencelupkan coupes kedalam aquadest selama 15 menit i) Kemudian mencelupkan kedalam Eosin selama 2 menit j) Melakukan dehidrasi berulang lagi yakni:
Alkohol 96% (I) selama 3 menit Alkohol 96% (I) selama 3 menit Alkohol absolut (III) selama 3 menit Alkohol absolut (IV) selama 3 menit k) Mecelupkan kedalam Xylol yaitu :
Xylol (IV) selama 5 menit
Xylol (V) selama 5 menit
l) Memounting dengan permount. g. Pengamatan struktur histologik
K. Metode Pengumpulan Data
L. Desain Penelitian
Desain pada penelitian ini merupakan eksperimen satu faktor pola acak lengkap. Jenis data dari hasil penelitian ini merupakan eksperimen.
M. Teknik Analisis Data
Data yang diperoleh merupakan data kuantitatif dari hasil pengamatan dan penghitungan jumlah kelenjar endometrium per satuan lapang pandang pada struktur penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat pada layar monitor), jumlah eritrosit dan lekosit tikus putih yang telah diberi perlakuan, yaitu pemberian ekstrak biji pepaya. Analisis data menggunakan program SPSS 16 dengan analisis nonparametrik Kruskal-Wallis untuk mengetahui ada tidaknya pengaruh pemeberian ekstrak biji
pepaya terhadap jumlah kelenjar endometrium tikus putih tikus putih. dan Data jumlah eritrosit dan lekosit pada tikus putih dianalisis menggunakan analisis kontrol One Way Anova dengan taraf signifikan p<0,05. Analisis tersebut dilakukan untuk mengetahui ada tidaknya pengaruh ekstrak biji pepaya terhadap jumlah eritrosit dan lekosit tikus putih betina. Apabila hasil berpengaruh yang nyata, dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) untuk membandingkan antara kelompok kontrol dengan
BAB IV
HASIL DAN PEMBAHASAN A. HASIL
Hasil penelitian tentang pengaruh pemberian ekstrak biji pepaya (Carica papaya, L.) terhadap jumlah kelenjar endometrium, jumlah eritrosit dan lekosit tikus putih (Rattus norvegicus) betina adalah sebagai berikut : 1. Hasil Uji Definitif Pengaruh Pemberian Ekstrak Biji pepaya Terhadap
Jumlah Kelenjar Endometrium Tikus Putih Betina
Parameter pertama yang dihitung adalah jumlah kelenjar endometrium dengan membandingan kelompok kontrol dan 3 kelompok perlakuan yaitu pada perlakuan 1 (300 mg/tikus/hari ekstrak biji pepaya), perlakuan 2 (350 mg/tikus/hari esktrak biji pepya), perlakuan 3 (400 mg/tikus/hari ekstrak biji pepaya). Data hasil jumlah kelenjar endometrium di amati di Laboratorium Mikroskopi FMIPA UNY. Data ini diambil dengan cara mengamati preparat per satuan lapang pandang pada struktur penampang melintang uterus dengan perbesaran lensa objektif 10x (dilihat pada layar monitor), dan menghitung semua jumlah kelenjar endometrium di lapisan endometrium, menggunakan counter sebagai alat bantu hitung. Hasil perhitungan uji definitif dari jumlah
kelenjar endometrium ini dapat dilihat pada tabel dibawah ini, yaitu:
Tabel 3. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina Per Satuan Lapang Pandang dengan Perbesaran Lensa Objektif 10x (Dilihat pada Layar Monitor) Sebelah Kanan Sesudah Pemberian Ekstrak Biji Pepaya.
Ulangan K P1 P2 P3
Tabel di atas menunjukkan bahwa kelompok kontrol memiliki rata-rata sebesar 18, lalu terjadi kenaikan jumlah rata-rata-rata-rata sebesar 24,2 pada P1. Pada P2 mengalami penurunan jumlah kelenjar endometrium menjadi 18,8. Terjadi peningkatan jumlah kelenjar endometrium pada kelompok P3 sebesar 24,6. Dari hasil data tersebut menunjukkan bahwa rata-rata jumlah kelenjar endometrium sebelah kanan paling besar ditunjukkan pada kelompok perlakuan 3 (P3).
Tabel 4. Rata-Rata Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina Per Satuan Lapang Pandang dengan Perbesaran Lensa Objektif 10x (Dilihat pada Layar Monitor) Sebelah Kiri Sesudah Pemberian Ekstrak Biji Pepaya.
Ulangan K P1 P2 P3
Rata-rata 13,6 13 23,6 18,4
jumlah kelenjar endometrium uterus sebelah kiri terjadi penurunan jumlah pada P1 yaitu 13 dari pada perlakuan kontrol yaitu 13,6, pada P2 terjadi peningkatan yaitu 23,6, dan terjadi penurunan pada P3 dengan jumlah 18,4. Hasil data tersebut menunjukkan bahwa rata-rata jumlah kelenjar endometrium sebelah kiri paling besar ditunjukkan pada kelompok perlakuan 2 (P2).
Tabel 5. Hasil Uji Kruskal wallis Pengaruh Pemberian Ekstrak Biji Pepaya terhadap Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina Per Satuan Lapang Pandang dengan Perbesaran Lensa Objektif 10x (Dilihat pada Layar Monitor) Sebelah Kanan.
Jumlah kelenjar kanan terhadap Jumlah Kelenjar Endometrium Uterus Tikus Putih Betina Per Satuan Lapang Pandang dengan Perbesaran Lensa Objektif 10x (Dilihat pada Layar Monitor) Sebelah Kiri.
pengaruh yang nyata terhadap jumlah kelenjar endometrium tikus putih betina.
2. Hasil Uji Definitif Jumlah Eritrosit dan Lekosit Tikus Putih Betina (1ml/ Tikus)
Tabel 7. Rata-Rata Jumlah Eritrosit Dan Lekosit Tikus Putih Betina (1ml/tikus) Sesudah Pemberian Ekstrak Biji Pepaya.
Variabel Ulangan
Rata-Rata Jumlah Eritrosit (mm3) Dan Lekosit (mm3) Tikus Putih
1(merah) 6.710.000 5.580.000 5.930.000 5.740.000 2 (hijau) 5.300.000 5.520.000 5.930.000 6.560.000 3 (merah2) 3.870.000 5.860.000 5.930.000 5.900.000 4(hijau2) 6.430.000 5.810.000 5.930.000 6.420.000 5 (M-H) 5.080.000 5.590.000 5.930.000 6.330.000 Rerata 5.478.000 5.672.000 6.050.000 6.190.000 Lekosit
Jumlah eritrosit merupakan salah satu parameter yang penting untuk menilai kesehatan, karena perannya yang sangat besar untuk mengangkut O2 ke seluruh tubuh. Sirkulasi darah menggambarkan mekanisme dasar dibawanya zat kimia ke seluruh tubuh. (Muhamad, 2008: 6).
Dari hasil analis One Way Anova di atas, dapat dibaca bahwa tidak terdapat pengaruh yang nyata dari pemberian berbagai dosis ekstrak biji pepaya yang diberikan kepada tikus putih terhadap jumlah eritrosit, (Ha ditolak) dengan nilai signifikan 0,319. Nilai ini lebih besar bila dibandingkan dengan batas nilai kritis yaitu 0,05.
Meskipun hasil uji One Way Anova menyatakan demikian, tetapi jika dilihat dari diagram, rata-rata jumlah eritrosit menunjukkan hasil yang berbeda. Jumlah eritrosit cenderung mengalami kenaikan dari tiap-tiap perlakuan. Diagram tersebut dapat dilihat pada tabel berikut:
Keterangan :
0 mg : kelompok kontrol tanpa diberi ekstrak biji pepaya 300 mg : kelompok 1 dengan di berikan ekstrak bijii pepaya
sebanyak 300 mg / 1,5 ml ekstrak encer biji pepaya 200 mg : kelompok 2 dengan di berikan ekstrak bijii pepaya sebanyak 350 mg / 1,75 ml ekstrak encer biji pepaya
300 mg : kelompok 3 dengan di berikan ekstrak bijii pepaya sebanyak 400 mg / 2 ml ekstrak encer biji pepaya
Pengambilan sampel darah dilakukan setelah tikus putih mendapat perlakuan selama 21 hari. Darah diambil melalui mata tikus dengan alat pipa Hematokrit. Tikus dibagi dalam 4 kandang, di mana kandang kontrol, yaitu
a. Lekosit
Tabel 9. Data Hasil Analisis Jumlah Lekosit Tikus Putih Dengan Analisis One Way Anova.
Within Groups 4.943E7 16 3089437.500
Total 1.182E8 19
Tabel di atas menunjukkan hasil analisis One Way Anova terhadap jumlah lekosit tikus putih yang diberi ekstrak biji pepaya dengan dosis (0, 300, 350 dan 400 (mg/150BB tikus/hari), Ha diterima dengan nilai signifikan yang tertera adalah 0,002 yang artinya lebih rendah/lebih kecil dari nilai standar signifikan yaitu 0,05. Hal tersebut terdapat pengaruh yang nyata dari pemberian ekstrak biji pepaya terhadap jumlah lekosit tikus putih. Oleh karena adanya pengaruh yang nyata dari pemberian ekstrak biji pepaya, maka perlu dilakukan uji lanjut Duncan’s Multiple Range Test (DMRT) untuk mengetahui nilai beda nyata dari perlakuan.
Tabel 10. Hasil uji lanjut Duncan’s Multiple Range Test (DMRT) Lekosit Tikus Putih Dengan Pemberian Ekstrak Biji Pepaya.
Keterangan : Notasi huruf yang bertaunan berarti signifikan.
Perlakuan/Dosis N Subset for alpha = 0.05 Notasi
Tabel 10 merupakan analisis uji lanjut analisis Duncan’s Multiple Range Test (DMRT) setelah dilakukan analisis One Way Anova yang terdapat
beda nyata (p≤0,05). Nilai signifikan kelompok perlakuan menunjukkan ≤0,05, yaitu dengan nilai signifikasi 0,002 maka dapat disimpulkan bahwa
pada tingkat kepercayaan 95% pemberian ekstrak biji pepaya dengan dosis yang berbeda memberikan efek yang signifikan terhadap jumlah lekosit tikus putih dengan dosis yang berbeda. Dapat dilihat bahwa kelompok perlakuan 3 (400 mg/tikus/hari) signifikan dengan semua perlakuan (kontrol, perlakuan 1, dan perlakuan 2). Antara kelompok kontrol, perlakuan 1 dan perlakuan 2 tidak saling signifikan.
Gambar 12. Grafik Pengaruh Pemberian Ekstrak Biji Pepaya Terhadap Jumlah Lekosit Tikus Putih.
Keterangan :
0 mg : kelompok kontrol tanpa diberi ekstrak biji pepaya 100 mg : kelompok 1 dengan di berikan ekstrak bijii pepaya
sebanyak 300 mg /0,5 ml ekstrak encer biji pepaya 200 mg : kelompok 2 dengan di berikan ekstrak bijii pepaya
sebanyak 350 mg /1 ml ekstrak encer biji pepaya 300 mg : kelompok 3 dengan di berikan ekstrak bijii pepaya
sebanyak 400 mg /1 ½ ml ekstrak encer biji pepaya
Gambar di atas, dapat disimpulkan bahwa ekstrak biji pepaya yang diberikan selama 21 hari kepada tikus putih memberikan respon yang berbeda-beda terhadap jumlah lekositnya. Kelompok (kontrol) jumlah lekosit mencapai rerata 8.720/mm3. Perlakuan 1 (tikus diberi ekstrak biji pepaya dengan dosis 300 mg/tikus/hari), jumlah lekosit tikus mengalami kenaikan hingga 8.870/mm3. Pemberian dosis ekstrak biji pepaya dengan dosis 350 mg/tikus/hari (perlakuan 2) mengalami peningkatan/kenaikan yaitu mencapai rerata 9.450/mm3 dan dosis 400 mg/tikus/hari (perlakuan 3) mengalami peningkatan yang cukup tinggi dari pada perlakuan sebelumnya, yaitu menjadi 13.250/mm3. Kelompok perlakuan 3 ini termasuk jumlah lekosit yang tertinggi diantara kelompok lainnya.
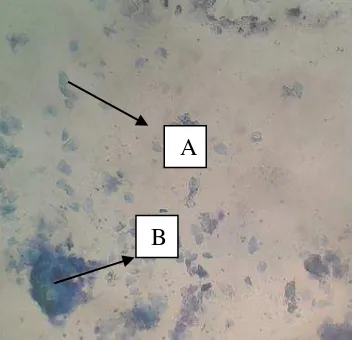
3. Hasil Ulas Vagina
vagina dengan melakukan pengamatan menggunakan mikroskop, pada fase ini ditandai dengan ditemukannya banyak sel-sel epitel yang menanduk.
Gambar 13. Ulas Vagina (Fase Estrus). A; epitel bertanduk (Dellman dan Brown, 1992: 524).
4. Gambaran Struktur Histologik Uterus Tikus Putih Betina
Hasil gambaran histologik dari uterus tikus putih betina dengan melakukan pengamatan menggunakan mikroskop dengan perbesaran lensa objektif 4x. Struktur histologik uterus tikus putih betina dapat dilihat pada gambar dibawah ini, sebagai berikut: