Oleh :
IR. I NYOMAN SUTEDJA. MS.
NIP.195511131983031002
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS UDAYANA DENPASAR
2018
dalam program perluasan dan peremajaan tanaman dibatasai oleh ketersediaan jumlah bibit panili yang berkualitas baik. Penelitian dilaksanakan dengan tujuan untuk mendapatkan karakteristika pertumbuhan setek panili
Penelitian ini dilakukan di Kebun petani Kabupaten Tabanan.
Pada percobaan ini digunakan percobaan tersarang dengan menggunakan Rancangan Acak Kelompok (RAK), yang di ulang sebanyak tiga kali. Jumlah perlakuan yang diperbandingkanadalah 4 + 4 + 4 = 12, yaitu tiga jenis zat pengatur tumbuh dan empat taraf kosentrasi.
Konsentrasi rootone F 590 mg/L, dharmasri 5 EC 0,100 ml/L dan atonik 0,175 ml/L menyebabkan paling tingginya laju asimilasi bersih rata-rata (LAB) , kecuali nisbah luas daun rata-rata (NLD) dan laju tumbuh relative rata-rata (LTR).
Penurunan nilai NLD dan LTR seara perlahan sejalan dengan penambahan umur bibit panili, oleh karena perlakuan atonik, dahrmasri 5 EC dan rootone F menyebabkan pertumbuhan setek panili lebih cepat dan lebih awal, sedangkan media tumbuh terbatas
dihasilkan semakin berkurang pula.
Usaha dalam penyediaan bibit dalam menunjang program perluasan areal dan peremajaan tanaman panili untuk sementara disarankan mempergunakan zat pengatur tumbuh rootone F 590 mg/L, dharmasri 5 EC 0,10 ml/L dan atonik 0,1750 ml/L.
Untuk memperoleh informasi lebih lengkap, penelitian ini perlu dilanjutkan terhadap berbagai jenis sumber bahan setek panili, berbagai taraf dosis pada konsentrasi optimal jenis zat pengatur tumbuh di atas, dan pemupukan.
BAB ISI Halaman
JUDUL ... i
RINGKASAN ... ii
DAFTAR ISI ... iii
I. PENDAHULUAN ... 1
II. TINJAUAN PUSTAKA ... 9
2.1. Pembiakan dengan dengan Setek ... 9
2.2. Penggunaan Zat Pengatur Tumbuh Pada Setek... 11
2.2.1.Rootone F ... 11
2..2.2. Dharmasri 5 EC ... 16
2.2.3. Atonik ... 17
2.3. Faktor Lingkungan Pertumbuhan Setek ... 19
III. METODE PENELITIAN ... 23
IV. HASIL DAN PEMBAHASAN ... 29
V. KESIMPULAN DAN SARAN ... 45
5.1. Kesimpulan ... 45
5.2. Saran... 45
DAFTAR PUSTAKA………..47
I.PENDAHULUAN
1.1 Latar Belakang
Tanaman panili (Vanilla planifolia Andrews) merupakan salah satu komoditas ekspor yang bernilai ekonomi yang tinggi. Buah tanaman vanili digunakan untuk bahan pengharum makanan, gula- gula, ice cream, minuman dan obat-obatan. Bentuk produk yang dijual petani pada umumnya berbentuk polong basah, sedangkan yang dijual oleh eksportir ke pasaran internasional berbentuk polong kering.
Masyarakat dunia akhir-akhir ini terjadi perubahan dari mengkonsumsi panili sintetis ke panili alam yang oleh karenanya peningkatan konsumsi panili alam diperkirakan 2% pertahun.
Produksi panili alam dunia 75% berasal dari Madagaskar, 10%
masing masing dari Indonesia dan Komoro, sedangkan 5% sisanya dari berbagai Negara produsen lainnya (Sen,1985).Tanaman panili dapat diperbanyak secara generatif dengan biji dan vegetatif dengan setek, karena perbanyakan dengan biji memerlukan waktu untuk berbunga lebih lama, maka perbanyakan panili untuk komersial dilakukan dengan cara setek. Kebutuhan bibit/setek panili per tahun
sekitar 16 juta bibit, sehingga diperlukan kebun induk yang sangat luas (Sukarman, 2011).
Harahap (1987) menyatakan hanya sejumlah kecil dari sekian banyak Negara di dunia yang kondisi lahan dan lingkungannya sesuai bagi pertumbuhan yang baik dan hasil yang memuaskan dari pertanaman panili. Oleh karena itu kurang pada tempatnya bila hal ini kita sia-siakan.
Permasalahan yang dihadapi dalam perluasan tanaman panili di Indonesia adalah terbatasnya ketersediaan bahan setek sebagai sumber bibit dalam waktu yang cepat menjadi faktor penghambat dalam perluasan lahan. Keterbatasan tersebut disebabkan karena perbanyakan tanaman panili pada umumnya masih menggunakan setek panjang. Rosman dan Tasma (1988) menyatakan, petani umumnya menanam bibit sepanjang 1 meter yang terdiri dari 8 – 10 buku tanpa melalui pembibitan. Hal ini dianggap kurang ekonomis dalam penggunaan bahan tanaman terutama untuk daerah pengembangan dengan bahan tanaman yangterbatas.
Dalam hal ini, penggunaan setek pendek satu buku diharapkan dapat mengatasi masalah tersebut. Setek pendek 1-3 buku dapat digunakan untuk perbanyakan tanaman secara vegetative .
Setiap buku dari setek panili mempunyai potensi mengeluarkan akar dan tunas, sehingga dengan potensi tersebut memungkinkan panili dapat diperbanyak dengan setek satu buku. Namun dalam penggunaan setek pendek panili masalah yang dihadapi adalah pertumbuhan bibit akan lebih lambat.
Rochiman dan Haryadi (1973) menyatakan bahan stek pada awal pertumbuhannya, terutama pada saat pembentukan akar, tidak memerlukan unsur hara dari dalam tanah, melainkan dari jarimgam- jaringan bahan setek.
Pada dasaranya perlakuan dengan zat pengatur tumbuh adalah untuk mempercepat proses fisiologi yang memungkinkan tersedianya bahan pembentuk akar dengan segera. Faktor dalam yang berpengaruh adalah tersrdianya senyawa karbohidrat, auksin, nitrogen, dan kofaktor enzim bagi pertumbuhan perakaran yang terdapat dalam bahan setek (Pandey dan Pathak, 1978); dalam Prawoto dan saleh, 1983). Tersedianya semua bahan tersebut berhubungan dengan panjang segtek, jumlah daun yang terkandung, dan waktu pengambilan bahan setek. Menurut Rochiman dan Haryadi (1973) kadar N yang paling tinggi pada setek bagian ujung (0,45%) dapat menekan akar, disamping konsentrasi gula total
sebagai energi siap pakai dalam proses perombakan pada bagain setek tersebut yang rendah.
Alternatif yang perlu dilakukan untuk mengatasi hal tersebut salah satunya adalah dengan pemberian zat pengatur tumbuh rootone F, dharmasri 5 EC, dan Atonik, yang diharapkan akan mampu meningkatkan kecepatan tumbuh setek pendek panili sehingga waktu pindah bibit ke lapangan bisa lebih cepat. Keefektipan zat pengatur tumbuh bergantung pada jenis dan konsentrasinya yang digunakannya serta jenis tanamannya. Konsentras yang berlebihan dapat menghambat pertumbuhan akar, tunas, dan proses fisiologi tanaman, sedangkan kosentrasi yang terlalu rendah tidak efektif.
Pembentukan dan pertumbuhan tunas umumnya akan terjadi jika akar terbentuk dengan baik (Hartman dan Kester, 1978). Upaya untuk merangsang inisiasi akar yang lebih cepat pada setek pendek sangat penting untuk memulai pertumbuhan setek. Terangsangnya pembentukan akar yang lebih cepat dan seragam akan dapat meningkatkan serapan unsur hara dan air dari dalam tanah. Periode kritis penyemaian setek adalah saat setek belum berakar dan pembentukan tunas tampaknya memerlukan adanya pertumbuhan aktif dari akar (Leapold dan Kriedeman, 1975).
Konsentrasi IBA dan NAA antara 500 ppm sampai 2000 ppm dapat mempercepat tumbuhnya akar pada setek tanaman nilam (Selvarajan dan Rao, 1982). Konsentrasi IBA 3000 sampai 6000 ppm yang diaplikasikan terhadap 60 jenis tanaman hias tropika menghasilkan perakaran setek yang rata-rata baik (Bose dan Mandol, 1973). Konsentrasi 4000 ppm memberikan hasil terbaik pada setek kakao (Anwar dan Hutomo, 1980). Dosis rootone F 50mg tiap setek untuk setek panjang panili menghasilkan bobot kering akar yang paling tinggi (Sujindro dan Rachmadiono, 1983). Konsentrai rootone F 590 ppm dapat menghasilkan bobot kering oven total perbibit paling tinggi dari pertumbuhan setek lada.
Pemberian triakontanol pada sayuran tomat,kubis, terong, dan petsai dapat meningkatkan hasil dibandimgkan dengan control. Hasil paling tinggi per hektar yang diperoleh karena perlakuan tersebut pada tanaman tomat dengan konsentrsai 0,5 mg/L, pada tanaman terong dan petsai dengan konsentrasi 1,0 mg/L , serta pada tanaman kubis pada konsentrasi 0,1 mg/L (Ries dan Houtz, 1983).
Hasil penelitian Siswanto dkk (1986) menunjukkan pemberian dharmasri 5 EC pada tanaman padi gogo dengan konsentrasi 0,100 ml/L, 0,125 ml/L, dan 0,150 ml/L dapat meningkatkan hasil gabah
keringmasing-masing sebesar 20,19%, 37,68%, 38,26% disbanding dengan konrol.
Atonik dengan konsentrasi 500 ppm pada setek kopi robusta menghasilakn panjang akar, jumlah akar, panjang tunas, bobot kering akar, persentase setek yang hidup, dan persentase setek yang bertunas dan berakar, lebih baik daripada pemberian 333 ppm dan 1000 ppm (Dachmansyah dan Wachjar, 1984). Atonik dengan konsentrasi 175 ppm sangat efektif dalam meningkatkan kadar gula, pati, dan khlorofil total tanaman stevia (Wargadipura dan Solahudin, 1983).
Berbagai jenis zat pengatur tumbuh tersebut mempunyai bahan aktif yang berbeda. Zat pengatur tumbuh yang telah banyak digunakan dalam pembiakan vegetative tanaman , kecuali pada tanaman panili adalah rootone F, dharmasri 5 EC, dan atonik.
Konsentrasi zat pengatur tumbuh yang diaplikasikan bervariasi, bergantung pada jenis tanaman dan zat pengatur tumbuhnya. Untuk itu perlu dicari jenis zat pengatur tumbuh dan konsentrasinya yang optimal dalam meningkatkan pertumbuhan setek pendek panili. Zat pengatur tumbuh itu dicari dari dari jenis zat pengatur tumbuh yang telah sering digunakan pada tanaman lain dengan berbagai taraf konsentrasi untuk masing-masing jenis zat pengatur tumbuh, yaitu
tanpa zat pengatur tumbuh, separoh dari anjuran, sama dengan anjuran dan satu setengah dari anjuran yang menurut produsennya telah dipakai pada tanaman lainnya.
1.2 Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk mengetahui karakteristika pertumbuhan bibit tanaman panili dengan pemberian zat pengatur tumbuh rootone F, dharmasri 5EC dan atonik yang telah beredar di pasar dan pada konsentrasi berapa yang optimal dari masing-masing zat pengatur tumbuh tersebut untuk memberikan nilai rata-rata LTR, LAB dan NLD yang paling tinggi.
1.3 Rumusan Masalah
Karakteristika pertumbuhan bibit panili nilai LTR, LAB dan NLD dapat ditingkatkan dengan perlakuan zat pengatur tumbuh tanaman diharapkan lebih cepat bila zat pengatur tumbuh diberikan dengan jenis yang tepat dan pada konsentrasi optimal. Oleh karena itu efektifitasnya masih perlu diteliti . Masalah itu dirumuskan sebagai berikut : Pada konsenrasi berapakah dari masing-masing zat pengatur tumbuh atonik, dharmasri 5 EC dan atonik yang optimal untuk memperoleh nilai LTR, LAB dan NLD yang paling tinggi.
1.4 Hipotesis
Hipotesis dirumuskan sebagai berikut : Nilai rata-rata LTR, LAB dan NLD yang paling tinggi diperoleh pada zat pengatur tumbuh rootone F konsentrasi 590 mg/L, dharmasri konsentrasi 0,100 ml/L dan atonik konsentrasi 0,175 ml/L.
II. TINJAUANPUSTAKA
2.1 Pembiakan dengan Setek
Pembiakan tanaman dengan setek merupakan cara pembiakan menggunakan potongan bagian vegetative yang apabila ditempatkan pada keadaan yang sesuai dapat tumbuh dan berkembang menjadi individu baru yang serupa dengan induknya. Setek juga dapat mempersingkat waktu penyediaan bahan tanaman dan waktu masa tidak produktif. Jenis tanaman yang berbeda mempunyai kemampuan berakar yang berbeda.
Perbanyakan tanaman dengan cara setek merupakan salah satu cara pembiakan vegetatif yang sekarang ini sering dilakukan. Setek merupakan pemisahan atau pemotongan beberapa bagian tanaman (akar, batang, daun, dan tunas) dengan tujuan agar bagian-bagian itu membentuk suatu tanaman yang utuh yang memiliki akar, batang, daun, dan bunga (Wudianti,2004).
Perbanyakan dengan cara setek banyak dipilih orang karena memiliki banyak keuntungan seperti penggunaan bahan yang hanya sedikit tetapi dapat menghasilkan bibit dalam jumlah yang banyak dan dalam waktu yang singkat. Selain itu, perbanyakan dengan
setek mempunyai sifat dan mutu yang sama dengan induknya (ketahanan terhadap serangan hama dan penyakit, rasa buah, warna dan keindahan bunga, dan sebagainya).
Bahan tanaman yang akan digunakan sebagai bibit, diambil dari pohon induk terpilih (produksi tinggi dan bebas hama penyakit).
Pada tanaman panili, sulur yang dijadikan setek adalah sulur yang belum pernah berbunga dan berbuah, sehat dan kuat, serta mempunyai ruas yang relatif pendek .
Persyaratan bahan setek panili yang baik diambil dari batang muda, sehat, kuat, dan belum pernah berbunga atau berbuah , pucuknya sepanjang 20 cm dihilangkan (Dirdjopranoto, 1970), warna kehiau-hijauan menandakan mengandung karbohidrat dan nitrogen yang cukup untuk memproduksi akar dan tunas (Rochiman dan Haryadi, 1973), mempunyai akar udara baru keluar dari mata pangkal batang (Direktorat Jendral Perkebunan, 1986), dan daunnya tidak perlu dibuang kecuali pada batang yang akan ditanam.
Menurut Bowman (1950) pengambilan bahan setek dari pohon induk dianjurkan pagi hari, agar persediaan nutrisi dan auksin sedang banyak. Mengambil setek siang hari saat panas sedang terik harus dihindarkan agar setek tidak cepat layu.Hartman dan Kester
(1978) menyatakan untuk tanaman yang mudah dibiakkan secara vegetative dengan setek , umur bahan setek tidak berpengaruh terhadap keberhasilan pembentukan akar. Umumnya setek yang berasal dari bahan tanaman lebih muda lebih mudah membentuk akar dibandingkan bahan tanaman yang lebih tua karena kegiatan pembelahan, pemanjangan , dan defrensiasi sel lebih aktif.
2.2 Penggunaan Zat Pengatur Tumbuh
Zat Pengatur tumbuh adalah senyawa organic selain hara yang memiliki sifat-sifat seperti hormone tanaman yang dala jumlah yang kecil dapat mendorong atau menghambat atau memodifikasi pertumbuhan dan perkembangan tanaman (Moore, 1979). Secara fisiologi zat pengatur tumbuh dapat bertindak sebagao ko-enzim yang mendukung beberapa enzim dalam tanaman itu sendiri untuk mengaktifkan plasma sel dengan membentuk semacam jembatan yang menghubungkan protein enzim dengan plasma sel (Suseno, 1974).
2.2.1 Rootone F
Senyawa yang terkandung dalam rootone F meliputi : 1- Naftaline asetamida (N-AD), 2 – Methil-1-Naftalen asetamida (Me-
NAd), asam 2 2-Metil-1-Naftalen asetat(Me-NAA), asam Indole-3- asetat (IBA), Thiram dan Talc (Direktorat Perlindungan Tanaman Pangan, 1987).
Hasil penelitian tentang pengaruh auksin terhadap perkembangan sel menunjukkan bahwa auksin dapat meningkatkan tekanan osmotik dan permeabelitas sel terhadap air. Akibatnya terjadi pengurangan tekanan pada dinding sel, meningkatkan sintesis protein dan plastisitas serta pengembangan diding sel (Moore, 1979).
Setelah volume sel meningkat dan dicapai keseimbngan baru, didin sel dijalin kembali di bawah kendali IAA, yaitu melalui peningkatan aktivitas enzim selulase sintetasa (Goodwin dan Mercer,1983)
Senyawa auksin merangsang biosintesa m-RNA khususnya dalam sel yang memanjang, yang selanjutnya mempercepat sintesis baru, enzim pembentuk diding sel akhirnya menyebabkan pemanjangan sel (Patel et al .,1978) RNA yang terbentuk terlibat dalam inisiasi primordial akar (Hartman dan Kester, 1978). Auksin juga dikatakan oleh Audus (1963) merangsang pembentukan, pemunculan,dan deferensiasi primordial akar dan pengaturan sel-sel akar.
IBA bersifat lebih baik dan efektif karena kandungan kimia IBA lebih stabil, daya kerjanya lebih lama dan kemungkinan berhasil lebih besar dalam pembentukan akar. IBA yang diberikan pada setek akan tetap ada pada tempat pemberian sehingga dapat diharapkan respon yang baiak terhadap pembentukan akar. NAA mempunyai sifat memperkecil batas konsentrasi optimal perakaran (Rochiman dan Haryadi,1973). NAA juga diketahui oleh Audus (1963) bersifat merangsang pembentukan akardengan stabilitas kimia yang lebih besar dan mobilitas rendah. Tetapi batas konsentrasi optimalnya sangat kecil sehingga dapat menimbulkan kerugian besar bila belum diketahui konsentrasi yang sebenarnya bagi suatu tanaman.
Menrut Audus (1963) IBA atau auksin dapat menyebabakan pembentukan akar lebih panjang, lebih cepat, dan membentuk system perakaran yang lebih kompak, kuat, serta menyerabut. IBA juga dikatakan oleh Patel et al (1978) dapat mempercepat penggunaan karbohidrat akibat peningkatan kegiatan enzim amylase. Pada minggu ketiga, setek yang diberi IBA terbukti telah berakar, sedangkan control masih berkalus.
Zat pengatur tumbuh IBA dan NAA merupakan auksin sintetis yang efektif sehingga lazim dipergunakan untuk mendorong
perakaran setek. Campurab zat pengatur tumbuh IBA dan NAA atau IAA dengan NAA untuk tujuan tertentu sering digunakan.
Ada tiga cara yang sering digunakan dalam pengaplikasikan ZPT yaitu : 1.) Commercial Powder Preparation (pasta); 2.) Dilute Solution Soaking Method (perendaman); 3.) Concentrated Solution Dip Method (pencelupan cepat). Pada pencelupan cepat konsentrasi yag digunakan adalah 500-10000 ppm, pangkal batang dicelupkan dalan larutan ZPT selama lima detik. Cara perendaman menggunakan konsentrasi 20-200 ppm, pangkal batang direndam dalam larutan selama 24 jam. Kedua cara ini menggunakan bahan pelarut alkohol.
Bila menggunakan cara serbuk, konsentrasi yang digunakan adalah 200-1000 ppm untuk setek berbatang lunak sedangkan setek berbatang keras membutuhkan konsentrasi lima kali lebih tinggi (Weaver, 1972). Metode perendaman adalah metode praktis yang paling awal ditemukan dan sampai saat ini masih dipandang paling efektif. Pada setek yang berkayu lembut (sotwood, herbaceus) jumlah larutan yang diabsorbsi akan tergantung pada jumlah air yang diabsorbsi, karena itu metode perendaman sangat sesuai digunakan untuk tanaman herbaceus guna mencegah terjadinya keracunan pada tanaman (Audus, 1963). Menurut Leopold (1963), biasanya
konsentrasi auksin yang digunakan berkisar antara 25-100 ppm, kemudian Hartmann dan Kester (1978), menambahkan pada umumnya konsentrasi auksin yang digunakan berkisar antara 20 ppm untuk spesies yang mudah berakar dan 200 ppm untuk spesies yang sulit berakar.
Penggunaan metode tepung atau bubuk merupakan metode yang paling sederhana, tidak memerlukan perendaman dan jumlah auksin yang diaplikasikan relatif konstan tetapi sifat fisik zat pembawa (carrier) berpengaruh besar terhadap bahan aktif dan zat pembawa yang berbeda dapat menyebabakan respon tanamanyang sangat berbeda walaupun pada konsentrasi yang sama (Audus, 1963).
Disamping itu, hasil yang seragam sulit diperoleh mengingat adanya keragaman dalam jumlah tepung atau bubuk yang dilekatkan pada setek (Weaver, 1972). Penggunaan metode celup cepat memungkinkan aplikasi auksin dalam jumlah yang konstan, kurang dipengaruhi kondisi lingkungan dan larutan yang sama dapat digunakan berulang kali, namun karena metode celup cepat menggunakan konsentrasi tinggi, sehingga apabila konsentrasinya tidak tepat maka akan menimbulkan penghambatan tunas, daun menguning dan jatuh ataupun kematian setek (Weaver,1972).
2.2.2 Dharmasri 5 EC
Dharmasri 5 EC mengandung bahan aktif triokontanol (Direktorat Perlindungan Tanaman Pangan, 1987). Triakontanol merupakan suatu senyawa alcohol rantai panjang yang jenuh beratom C 30, dapat memacu kerja enzim yang berhubungan dengan metabolism karbohidrat. Enzim yang dapat diaktifkan oleh triakontanol adalah polifenol oksidase, glukonat 6p dehidrogenase, isositrat dehidrogemnase, starch fosforilase, dan fosfoenol piruvat karboksilase (Ries dan Houtz, 1983). Penelitian di Bogor menunjukan hasil yang beragam sekali. Suatu hasil yang sangat konstan dari pemberian triokaontanol adalah kenaikan kandungan khlorofil daun (Wattimena, 1990). Triokontanol dikatakan juga oleh Ries dan Wert (1977) dapat memacu reaksi fiksasi CO2 udara, meningkatkan luas daun, dan bobot kering tanaman padi.
Satler dan Thiman (1980) menyatakan bahwa alkohol alifatik dapat mempengaruhi membukanya stomata, meningkatkan jumlah khlorofil, mengurangi proteolisis, mengurangi laju fotorespirasi, dan meningkatkan bobot kering. Pembukaan stomata akan dapat mambantu penundaan senessens.
Menurut Parodi dan Leloir (1979) dalam Menon dan
Srivastava (1984) senyawa alcohol rantai panjang dapat memberikan fasilitas transport gula dari ekstraseluler ke dalam sel. Hustad (dalam Ries, 1985) menyatakan pemberian triokantanol dapat meningkatkan laju fotosintesis dan mobilisasi fotosintat pada tanaman padi, laju fotosintesis tanaman dapat meningkat karena meningkatnya jumlah ribulose difosfat sebagai akibat perlakuan triokontanol.
Lasniak et al. (1986) menyatakan pemberian triokontanol dapat meningkatkan aktivitas ATPase pada membrane plasma pada akar tanaman barley. Menurut Dharma Niaga (1986) pemberian triokontanol pada tanaman akan mempengaruhi proses fisiologi tanaman sehingga dapat memperbaiki system perakaran, meningkatkan penyerapan air dan unsure hara, menambah aktivitas enzim dan hormone tersedia dalam tanaman, menambah jumlah khlorofil, meningkatkan nfotosintesis dan sintesis protein.
2.2.3 Atonik
Atonik adalah zat pengatur tumbuh yang terdiri atas senyawa yang bergugus nitro aromatik. Senyawa yang terkandung dalam atonik meliputi Natrium-orto-nitrofenol, Natrium-para-nitrofenol, Natrium - 5-nitroguaiakolat, Natrium - 2.4 dinitrofenolat (Direktorat Perlindungan Tanaman Pangan, 1987).
Atonik sebagai salah satu senyawa dengan bahan aktif fenol.
Menurut Kefli dan Kutacek (1973) beberapa dari senyawa fenol sekarang telah diketahui mempunyai sifat merangsang pertumbuhan , tidak ikut bereaksi, dan sebagai penghambat pertumbuhan.
Senyawa fenol dalam tanaman berkaitan dengan aktivitas enzim IAA oksidase (Leopold dan Kriedemann, 1975; Moore, 1979).
Pengaruh difenol menghambat aktivitas enzim IAA oksidase sehingga meningkatkan pertumbuha tanaman (Nitisch, 1962 dalam Leopold dan Kriedmann, 1975).
Menurut Kefeli dan Kadyrov (1971) bentuk para- dan ortho- difenol memperlihatkan penghambatannya hanya setelah berubah menjadi para- dan orto-kuinon. Kuinon menekan pertumbuhan bagian koleoptil dan pemanjangan akar lebih kuat dari pada fenol. Tetapi penghambatan alami yang lainnya yang tidak berubah menjadi kuinon tetap tidak jelas. Fenol sebagai penghambat pertumbuhan tanaman memulai aksinya dalam jaringan setelah terakumulasi dalam jumalh besar. Asam absisaat akan mengatur proses ini dengan mengaktifkan biosintesis dari asam fenolat. Perbedaan aktivitas penghambatan antara ABA dengan senyawa fenol diduga bahwa ABA terutama menekan sintesis dari enzim, sedangkan senyawa fenol menekan
aktivitas dari enzim. Hartman dan Kester (1978) menyatakan senyawa fenol dengan auksin akan membentuk rhizocaline
Yang merangsang perakaran setek.
Atonik mudah diserap dalam jaringan tanaman, mempercepat aliran protoplasma di dalam sel, dan merangsang perakaran sehingga mampu memberikan kekutan seluruh bagi sel tanaman (Ursulum, 1979). Unsur natrium dalam atonik mempunyai peran dalam katabolisme tanaman. Walaupun belum sepenuhnya diterima sebagai unsure esensial, natrium dapat menggantikan sebagian peran K atau bekerjasama dengan unsure K, perannya dalam pembukaan stomata, pengaturan dalam aktivitasnitrat reduktase, dan memelihara keseimbangan air (Lehr, 1961).
Atonik pada taraf konsentrasi optimal disemprotkan melaui daun, proses sintesis protein pada tanaman menjadi meningkat, yang digunakan sebagai bahan penyusun organ tanaman (Salisbury dan Ross, 1977).
2.3 Faktor-Faktor Lingkungan Pembibitan
Faktor lingkungan merupakan hal yang mutlak harus diperhatikan dalam menunjang pertumbuhan dan hasil panili. Curah
hujan, suhu udara dan sinar matahari menjadi bagian dari faktor iklim yang menentukan. Dari sekian factor iklim tersebut untuk daerah tropika pada daerah yang sudah mengembangkan panili, distribusi curah hujan dalam setahun merupakan factor paling menentukan tingkat produksi panili. Ketinggian tempat di Indonesia yang ideal untuk penanaman panili adalah < 600 m dari permukaan laut. Tingkat kesesuaian
Pengaruh suhu terhadap panili erat kaitannya dengan ketersedian air, sinar matahari dan kelembaban. Faktor tersebut dapat dikelola melalui penataan tanaman pelindung dan irigasi. Rosmeillisa dkk (1987) menyatakan suhu optimal untuk pertumbuhan panili 25o C, suhu minimal 9o C dan suhu maksimal 38o C. Pertumbuhan merupakan ekspresi dari reaksi enzimatis dalam setek . Agar reaksi enzimatis berjalan optimal, diperlukan suhu optimal pula, yaitu antara 20o C sampai 30o C dan suhu optimal untuk translokasi asimilat 25o C (Whittle, 1964., dalam Prawoto dan Saleh, 1983). Bowman (1950) menganjurkan untuk mengatur suhu udara dalam bedeng penyetekan anatara 20o C sampai 30o C
Radiasi matahari merupakan sumber energy penting untuk proses sintesis karbohidrat. Menurut Hurd (1959) intensitas radiasi
sebesar 10% selama dua minggu pertam setelah tanam setek, kemudian ditinggikan menjadi 25% pad minggu berikutnya kan meningkatkan daya perakaran dan kondisi pertumbuhan setek.
Kartono dan Isdijoso (1973) menyatakan untuk pertumbuhan tanaman panili, intensitas radiasi yang diperlukan 30% sampai 50%.
Pertumbuhan panili membutuhkan naungan untuk mengurangi pencahayaan penuh. Cahaya matahari yang terlalu banyak akan mengakibatkan lilit batang kecil, daun sempit, dan batang relatif pendek.
Angin dapat mempengaruhi transpirasi. Laju transpirasi menjadi meningkat sejalan dengan kecepatan angin memindahkan uap air di sekitar permukaan daun. Angin mudah mengubah kadar C02 tersedia di dekat zone daun (Kozlowski, 1976).
Kelembaban relative udara antara 85% sampai 95% sangat diperlukan agar daun setek tetap segar, laju transpirasi berlebihan dihambat, dan suplai air dalam keadaan cukup. Daun setek yang banyak kehilangan air akan membentuk lapisan absisi pada tangkainya, kemudian menguning dan akhirnya gugur (Bowman,1950). Karena tranpirasi yang berlebihan maka absorbsi CO2 berkurang karena stomata tertutup. Kelembaban relative udara
untuk pertumbuhan tanaman panili antara60 sampai 80 % (rosman dkk., 1986).
Faktor fisik dan kimia tanah yang erat kaitannya dengan daya tembus dan kemampuan akar menyerap hara. Tanaman panili membutuhkan tanah yang memiliki sifat fisik yang baik seperti drainase yang baik, bertekstur yang ringan dan kaya bahan organik . Oleh karena sistem perakaran panili yang dangkal maka tanah dengan bahan organic yang tinggi sangat diperlukan dan akan peka terhadap kemarau panjang. Dirdjoparanoto (1970) mengemukakan tanah yang ringan , berpori dan gembur ditambah dengan kompos baik sekali untuk pertumbuhan panili. Kartono dan Isdijoso (1973) juga mengemukakan tanah yang terbaik untuk pertumbuhan panili adalah yang berasal dari bahan induk kapur dengan pH 6,0 sampai 7,0.
III. METODE PENELITIAN
3.1 Tempat dan Waktu
Percobaan pot ditempatkan di lapangan dilaksanakan di kebun petani Kabupaten Tabanan selama dua bulan (60 hari), yang terletak pada ketinggian 600 meter di atas permukaan laut.
3.2 Bahan dan Alat
Bahan yang digunakan dalam percobaan ini mencakup bahan setek pendek yang diambil dari tanaman pohon induk yang telah dipersiapkan agar diperoleh setek yang sehat dan sergam. Zat yang digunakan adalah Rootone F, dharmasri 5 EC, dan atonik. Untuk pengendalian penyakit digunakan fungisida Dhitane M-45. Pelarut zat pengatur tumbuh digunakan aquades dan alcohol . Pupuk yang digunakan urea dan pupuk Kcl. Sebagai medium tumbuh digunakan jenis tanah latosol yang ada di kebun petani, yang dicampur dengan pasir dengan perbandingan 2 : 1. Hasil analisis tanah menunjukkan bahwa tanah tersebut tanah dengan tekstur lempung berliat.
Alat yang digunakan mencakup kantong pelastik, gembor, jangka sorong, gunting potong, timbangan, cangkul, ember, ayakan, bamboo, gunting potong .
3.3 Rancangan Percobaan
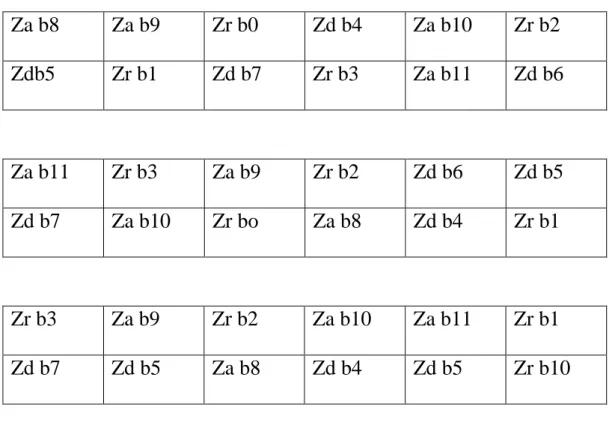
Percobaan menggunakan percobaan tersarang dengan menggunakan rancangan acak kelompok (RAK) yang diulang tiga kali. Jumlah perlakuan yang diperbandingkan adalah 4 + 4 + 4 = 12, yaitu tiga jenis zat pengatur tumbuh dan empat taraf konsentrasi.
Jenis dan taraf konsentrasi zat pengatur tumbuh yang dipergunakan adalah : (1) rootone F deangan taraf konsentrasi 0,00 mg/L (bo), 295 mg/L (b1), 590 mg/L (b2) 885 mg/L (b3); (2) dharmasri 5 EC, dengan taraf konsentrasi 0,00 ml/L (b4), 0,050 ml/L (b5), 0,100 ml/L (b6), 0,150 ml/L (b7); dan atonik , dengan taraf konsentrasi 0,00 ml/L (b8), 0,0875 ml/L (b9), 0,175 ml/L (b10) 0,2625 ml/L.
Setiap unit percobaan terdiri atas 2 kantong pelastik. Selama percobaan berlangsung dilakukan pemeliharaan mengendalikan gulma dan mencegah serangan dari hama dan penyakit. Denah percobaan disajikan pada Tabel 1.
Tabel 1.
Denah Percobaan
Za b8 Za b9 Zr b0 Zd b4 Za b10 Zr b2
Zdb5 Zr b1 Zd b7 Zr b3 Za b11 Zd b6
Za b11 Zr b3 Za b9 Zr b2 Zd b6 Zd b5
Zd b7 Za b10 Zr bo Za b8 Zd b4 Zr b1
Zr b3 Za b9 Zr b2 Za b10 Za b11 Zr b1 Zd b7 Zd b5 Za b8 Zd b4 Zd b5 Zr b10
Keterangan :
I, II, III = Ulangan
Zr = Zat pengatur tumbuh rootone F
Zd = Zat pengatur tumbuh dharmasri 5 EC Za = Zat pengatur tumbuh atonik
b = Taraf konsentrasi zat pengatur tumbuh 3.4 Metode Pelaksanaan
Sebelum percobaan dilaksanakan , setek panili dibuat seragam atas dasar nomor ruas tiga dari pucuk, jumlah 2 ruas, jumlah 3 buku, jumalah 2 daun dan bobot basah dengan penyimpangan 15 %, yaitu antara 25,5 g sampai 29,3 g. Dosis per setek pada tiga taraf konsentrasi dari masing-masing zat pengatur tumbuh diberikan sama,
yaitu rootone F =1,3275 mg/setek; dharmasri 5 EC = 0,0002 ml/setek;
dan atonik = 0,0005 ml/setek.
Tiga hari sebelum penanaman setek pada masing-masing kantong pelastik, dilakukan penyiraman larutan dithane M 45 dengan konsentrasi 0,02% sebanyak 1,5 L larutan yang berfungsi sebagai desinfektan.
Setek-setek itu kemudian ditanam dengan posisi tegak pada kantong pelastikyang berisi mediumtanah kemudian diletakkan pada unit percobaan yang telah ditentukan.
Pemeliharaan tanaman selama percobaan berlangsung meliputi penyiraman, penyiangan,pengaturan radiasi matahari,pemupukan, dan prencegahan serangan hama serta penyakit. Penyiraman dilakukan setiap hari untuk menjaga medium tumbuh supaya tetap lembab.
Apabila medium tumbuh masih cukup lembab, penyiraman tidak dilakukan. Penyiangan dilakukan setiap waktu dengan cara mencabut gulma yang tumbuh disekitar bibit. Pengaturan radiasi matahari dilakukan dengan memberikan naungan atap pada setiap bedengan.
Pemupukan Kcl diberikan pada saat tanam dan pupuk urea 21 hari setelah tanam setek. Dosis pupuk yang digunakan untuk setiap kantong pelastik adalah 1,5 g N berbentuk urea (45 % N) atau 3,33 g
urea dan 3 g K20 berbentuk KCl (60 % K20) atau 5 g KCl.
Pencegahan serangan hama dan penyakit dilakukan berupa penyemprotan dengan basudin 60 EC dan dithane M 45 setiap 2 minggu sekali.
3.5 Metode Pengamatan
Pengamatan karakteristika pertumbuhan dihitung untuk mengkaji pertumbuhan tanaman yang mencakup laju asimilasi bersih rat-rata (LAB), laju tumbuh relative rata-rata (LTR) dan nisbah luas daun rata-rata (NLD). Perhitungan untuk mendapatkan nilai –nilai LAB, LTR, dan NLD dihampiri melalui fomulasi yang diberikan Kvet et al. (1971) dan Gardener et al. (1985) sebagai berikut:
(1) Laju asimilasi bersih rata-rata (LAB) menunjukkan laju akumulasi bahan kering persatuan luas daun untuk periode tertentu dengan rumus :
____ W2-W1 Ln A2 – Ln A1
LAB = x (mg cm -2hari -1) T2-T1 A2-A1
(2) Laju tumbuh relative rata-rata (LTR) menunjukkan penambahan bobot kering tanaman persatuan bobot kering sebelumnya untuk periode tertentu dengan rumus:
____ Ln W2 - ln W1
LTR = ( g g-1).
T2 – T1
(3) Nisabah luas daun rata-rata (NLD) menunjukkan perbandingan luas daun dengan total bobot kering tanaman dengan rumus:
____ A2/W2 + A1/W1
NLD = (Cm 2 g-1) 2
Keterangan untuk rumus (1), (2), dan (3):
A1 = luas daun pada waktu T1 A2 = luas daun pada waktu T2
W1 = bobot kering tanaman pada waktu T1 W2 = bobot kering tanaman pada waktu T2.
3.6 Analisis Data.
Karakteristika pertumbuhan seperti LAB, LTR, dan NLD diregresikan dengan waktu . Bobot kering total tanaman diregresikan dengan taraf konsentrasi untuk masing-masing konsentrasi pada setiap jenis zat pengatur tumbuh. Kurva yang diperoleh diperbandingkan dengan menggunakan uji beda garis (Draper dan Smith, 1981).
IV.HASIL DAN PEMBAHASAN
4.1 Karakteristika Pertumbuhan Tanaman
Untuk mengkaji sifat pertumbuhan tanaman, dilakukan analisis tumbuh dengan menghitung karakteristika pertumbuhan, yaitu laju tumbuh relative rata-rata, laju asimilasi bersih rata-rata, dan nisbah luas daun rata-rata.
4.1.1 Laju Tumbuh Relatif Rata-Rata (LTR)
Laju tumbuh relative rata-rata (LTR) pembibitan panili selama fase pertumbuhan vegetative umur 84 sampai 124 hari setelah tanam dengan perlakuan zat pengatur tumbuh rootone F, dharmasri 5 EC, dan atonik untuk masing-masing taraf konsentrasi sama-sama menunjukkan penurunan. Kurca LTR menurun mengikuti kurva kuadratik pada empat taraf konsentrasi dari masing-masing jenis zat pengatur tumbuh tersebut.
Laju tumbuh relatif rata-rata (LTR) yang dirangsang oleh rootone F dengan berbagai taraf konsentrasi, keempat kurva sejajar dan berimpit berdasarkan uji beda garis.
Tabel 1.
Uji kurva regresi LTR dari rootone F
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 295 Fh=0.07 ns Fh=0.25 ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 590 Fh=3.31 ns Fh=3.26* Kurva sejajar dan Tidak berimpit.
Kedua kurva Berbeda.
0.00 vs 885 Fh=0.19 ns Fh=0.34 ns Kurva sejajar dan berimpit.
Kedua kurva sama.
295 vs 590 Fh=1.01 ns Fh=0.67 ns Kurva sejajar dan berimpit. Kedua kurva sama.
295 vs 885 Fh=0.75 ns Fh=0.53 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
590 vs 885 Fh=1.21 ns Fh=1.09 ns Kurva sejajar dan Berimpit. Kedua kurva Sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 2.
Uji kurva regresi LTR dari dharmasri 5 EC
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.05 Fh=0.04 ns Fh=0.30 ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 0.10 Fh=1.84 ns Fh=2.94 ns Kurva sejajar dan berimpit. Kedua kurva sama.
0.00 vs 0.15 Fh=0.46 ns Fh=2.72 ns Kurva sejajar dan berimpit.
Kedua kurva sama.
0.05vs 0.10 Fh=1.66 ns Fh=2.66 ns Kurva sejajar dan berimpit. Kedua kurva sama.
0.05 vs 0.15 Fh=1.21 ns Fh=1.65 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
0.10vs 0.15 Fh=1.95 ns Fh=1.63 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 3
Uji kurva regresi LTR dari atonik
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.0875 Fh=0.19 ns Fh=0.27 ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 0.175 Fh=0.24 ns Fh=0.31ns Kurva sejajar dan berimpit. Kedua kurva sama.
0.00 vs 2625 Fh=0.73 ns Fh=0.84 ns Kurva sejajar dan berimpit.
Kedua kurva sama.
0.0875 vs 0.175 Fh=0.40 ns Fh=0.50 ns Kurva sejajar dan berimpit. Kedua kurva sama.
0.0875vs 0.2625 Fh=0.03 ns Fh=0.40 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
0.175 vs 0.2625 Fh=0.41 ns Fh=0.45 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Nilai LTR rootone F pada bibit panili umur 84 sampai 124 hari
setelah tanam, penurunan kelihatan sejak 94 hari setelah tanam dan nilai antra taraf konsentrasinya sama. Nilai LTR dharmasri 5 EC dan atonik pada umur 84 sampai 124 hari setelah tanam, penurunan baru mulai kelihatan setelah umur 104 hari setelah tanam dan nilai antara taraf konsentrasi dari masing-masing dharmasri 5 Ec dan atonik juga sama.
Penurunan nilai LTR tersebut secara perlahan-lahan sejalan dengan penambahan umur tanaman . Hal demikian dapat terjadi karena zat pengatur tumbuh rootone F, dharmasri 5EC dan atonik dapat mempercepat pertumbuhan vegetative setek panili. Hal tersebut sejalan dengan pendapat Salisbury dan Ross (1977) bahwa zat pengatur tumbuh dapat memperbaiki pertumbuhan tanaman, karena akan mengaktifkan aliran plasma sel secara biokimia sehingga mengaktifkan proses metabolism tanaman. Weaver (1972) ; Hartman dan Kester (1978) juga mengatakan pemberian auksin dapat mempercepat pemunculan akar, meningkatkan kualitasperakaran dan menyeragamkan munculnya akar. Triakontanol dapat meningkatkan aktivitas ATPase pada membrane plasma sel (Lesniak et al. 1988).
Atonik dengan auksin membentuk rhizokalin yang dapat merangsang perakaran setek (Hartman dan Kester, 1978) . Akar mempunyai peran
yang sangat enting dalam pertumbuhan tanaman.Tetapi, media tumbuh terbatas, sehingga unsure hara yang tersedia pada media tersebut semakin berkurang sejalan dengan penambahan umur tanaman, 84 sampai 124 hari setelah tanam. Dengan demikian fotosintat yang dihasilkan akan semakin berkurang pula, sehingga pertumbuhan pupus baru akan tertunda, tetapi perkembanga sel untuk menjadi sel-sel dewasa pada bagian vegetative seperti akar, batang dan daun terus berlangsung yang mengakibatkan pertambahan fotosintat yang diakumulasi akan terus meningkat, yang ditunjukakan oleh bobot kering total tanaman terus meningkat sejalan dengan penambanahan umur tanaman.
Hal tersebut sejalan dengan pendapat Gardner et al. (1985) yang menyatakan bahwa pada fase pertumbuhan vegetative, fotosintat fotosintat ditranslokasikan dari sumber ke limbung vegetative dan untuk pembentukan akar, batang, dan daun disamping untuk mengganti sel-sel tanaman yang telah rusak.
4.1.2. Laju Asimilasi Bersih Rata-Rata (LAB).
Laju asimilasi bersih rata-rata (LAB) pembibitan panili selama fase pertumbuhan vegetative umur 84 sampai 124 hari setelah tanam denga perlakuan zat pengatur tumbuh rootone F, dharmasri 5 EC dan
atonik untuk masing-masing taraf konsrntrasi sama-sama menunjukkan penurunan.Kurva LAB menurun mengikuti garis kuadratik pada empat taraf konsentrasi dari masing-masing jenis zat pengatur tumbuh tersebut.
Nilai LAB rootone F taraf konsentrasi 590 mg/L dan 885 mg/L selalu lebih tinggi dibandingkan dengan taraf konsentrasi 295 mg/L dan 0,00 mg/L. Nilai LAB dharmasri 5 EC taraf konsentrasi 0.100 ml/L selalu lebih tinggi dibandingkan dengan taraf konsentrasi 0.150 ml/L, 0.05 ml/L dan 0.00 ml/L. Nilai LAB atonik taraf konsentrasi 0.175 ml/L selalu lebih tinggi di bandingkan dengan taraf konsentrasi 0.265 ml/L, 0.0875 ml/L dan 0.00ml/L.
Penurunan nilai LAB tersebut sejalan dengan penambahan umur tanaman. Hal demikian terjadio karena pertumbuhan setek panili dengan pemberian zat pengatur tumbuh rootone F, dharmasri 5 EC dan atonik berlangsung lebih cepat. Tetapi media tumbuh terbatas, akhirnya tidak dapat mengimbangi kecepatan pertumbuhan vegetative tersebut. Faktor media yaitu unsure hara semakin tidak seimbang dengan factor lainnya seperti radiasi matahari, suhu, air, dan udara sejalan penambahan umur tanaman. Oleh karena pemupukan dilakukan hanya sekali pada umur 21 hari setelah tanam dan kantong
pelastik sebagai media tumbuh dibikin berlubang.
Tabel 4
Uji kurva regresi LAB dari rootone F
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 295 Fh=3.35 ns Fh=5.24* Kurva sejajar dan
tidakberimpit .Kedua kurva berbeda.
0.00 vs 590 Fh=3.07 ns Fh=17.47* Kurva sejajar dan tidak berimpit.
Kedua kurva berbeda.
0.00 vs 885 Fh=3.12 ns Fh=9.28* Kurva sejajar
dan tidak berimpit.
Kedua kurva berbeda.
295 vs 590 Fh=0.21 ns Fh=8.13 * Kurva sejajar dan Tidak berimpit. Kedua kurva berbeda.
295 vs 885 Fh=0.39 ns Fh=3.27 * Kurva sejajar dan Tidak berimpit. Kedua Kurva berbeda.
590 vs 885 Fh=0.09 ns Fh=1.27 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 5.
Uji kurva regresi LAB dari dharmasri 5 EC
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.05 Fh=0.65 ns Fh=0.58 * Kurva sejajar dan
Tidak berimpit . Kedua kurva berbeda 0.00 vs 0.10 Fh=0.46 ns Fh=13.21* Kurva sejajar dan
tidak berimpit.
Kedua kurva berbeda 0.00 vs 0.15 Fh=1.27 ns Fh=5.55* Kurva sejajar
dan tidak berimpit.
Kedua kurva berbeda 0.05vs 0.10 Fh=1.87ns Fh=9.50 * Kurva sejajar dan
Tidak berimpit. Kedua kurva berbeda.
0.05 vs 0.15 Fh=0.33 ns Fh=4.23* Kurva sejajar dan Tidak berimpit. Kedua Berbeda.
0.10vs 0.15 Fh=3.12 ns Fh=5.65* Kurva sejajar dan
Tidak berimpit. Kedua berbeda
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 6
Uji kurva regresi LAB dari atonik
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.0875 Fh=3.53 ns Fh=2.35 ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 0.175 Fh=2.08 ns Fh=6.87* Kurva sejajar dan tidak berimpit.
Kedua kurva Berbeda.
0.00 vs 2625 Fh=0.37 ns Fh=3.68* Kurva sejajar dan tidak berimpit.
Kedua kurva berbeda 0.0875 vs 0.175 Fh=0.39ns Fh=4.58* Kurva sejajar dan
Tidak berimpit. Kedua kurva berbeda.
0.0875vs 0.2625 Fh=0.04 ns Fh=1.23ns Kurva sejajar dan berimpit. Kedua kurva Sama.
0.175 vs 0.2625 Fh=1.60 ns Fh=3.85* Kurva sejajar dan tidak berimpit. Kedua kurva berbeda.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Thompson dan Troeh (1975) menyatakan bahwa pertumbuhan tanaman akan lambat apabila kekurangan nitrogen. Kekurangan nitrogen akan membatasi proses pembentukan proteindan unsure
esensial lain untuk pembentukan sel baru. Harkat pertumbuahn menjadi seimbang bila nitrogen dalam keadaan tersedia. Goeswono Soepardi (1983) menyatakan bahwa dari tiga unsure yang biasanya diberikan sebagai pupuk, nitrogen memberikan efek yang yang paling mencolok dan cepat. Nitrogen terutama menstimulir pertumbuhan di atas tanah dan memberikan warna hijau pada daun. Hampir pada semua tanaman nitrogen merupakan pengatur dari penggunaan kalium, fosfat, dan penyusun lainnya. Cibes et al. (1947) menyatakan kekurangan unsure N pada pertumbuhan tanaman panili menyebabkan luas daun kecil, batang kecil, warna daun hijau kekuningan, dan pertumbuhan pupus lambat.
Nilai LAB pada taraf konsentrasi rootone F 590 mg/L, dharmasri 5 EC 0.100 ml/L dan atonok 0.175 ml/L selalu lebih tingggi dari perlakuan taraf konsentrasi lainnya dari masing-masing jenis zat pengatur tumbuh tersebut. Hal ini dapat dijelaskan berdasarkan respons tanaman terhadap konsentrasi yang paling mendekati optimal dari pemberian zat penagtur tumbuh tersebut. Maka dari nitunpertumbuhan tanaman yang paling baik, sehingga parat fotosintesis , yaitu daun jumlahnya paling banyak dan memberikan luas daun paling tinggi, yang ditunjukkan oleh berat daun per bibit
paling tinggi. Tetapi belum memberikan efek negative dari penaungan antra daun bibit tersebut. Oleh karena pertumbuhan panili yang baik memerlukan naungan.
4.1.3 Nisbah Luas Daun (NLD).
Nisbah luas daun rata-rata (NLD) pembibitan panili selama fase pertumbuhan vegetative umur 84 sampai 124 hari setelah tanam dengan perlakuan jenis zat pengatur tumbuh rootone F, dharmasri 5 EC, dan atonik untuk masing0masing taraf konsentrasi sama-sama menunjukkan penurunan. Kurva NLD menurun mengikuti kurva linier pada empat taraf konsentrasi dari masing-0masing jenis zat pengatur tumbuh tersebut.
Nilai NLD rootone F taraf konsentrasi 590 mg/L dan 885 mg/L selalu lebih rendah dibandingkan dengan konsentrasi 295 mg/L dan 0.00 mg/L. Nilai NLD dharmasri 5 EC taraf konsentrasi 0.10 ml/L selalu lebih rendah dibandingkan taraf konsentrasi 0.05 ml/L dan 0.00 ml/L. Nilai NLD atonik taraf konsentrasi 0.175 ml/L dan 0.2625 ml/L dan 0.00 ml/L.
Penurunan nilai NLD secara perelahan-lahan sejalan dengan penambahan umur tanaman. Hal ini berarti pembentangan luas daun dengan pertumbuhan tidak berjalan seimbang, oleh karena pemberian
zat pengatur tumbuh rootone F, dharmasri 5 EC, dan atonik menyebabkan pertumbuhan setek panili lebih cepat dan lebih awal, sedangkan media tumbuh terbatas menyebabkan suplai unsure hara semakin berkurang, maka terjadi penghambatan pembentukan daun- saun baru. Fotosintat yang dihasilkan di daun disamping ditranslokasikan ke bagian bagian tanaman lainnya, juga akan digunakan untuk pertumbuhan daun untuk menjadi lebih tebal, karena pada umur 84 sampai 124 hari setelah tanam , bibit panili ukuran daunnya sebagian besar telah mencapai luas daun maksimal dan pada daun yang belum mencapai luas daun maksimal,pembentangan daunya akan terhambat.
Hal tersebut sejalan dengan pendapat Cibes et al,(1947) bahwa pertumbuhan tanaman panili luas daunnya akan kecil apabila media tumbuhnya dalam keadaan kekurangan unsure N.Demikian juga karena tanaman panili yang tergolong beradaptasi dengan naungan, maka kondisi salah satu factor lingkungan sebagai factor pembatas, maka perubahan luas daun akan lebih mudah terjadi.
Nilai NLD yang lebih rendah pada taraf konsentrasi yang paling mendekati optimal dari masing-masing jenis zat pengatur tumbuh tersebut, disebabkan karena perlakuan itu mampu memberikan
pertumbuhan yang lebih cepat, tetapi tidak diimabngai dengan media tumbuh yang terus optimal.
Tabel 7.
Uji kurva regresi NLD dari rootone F
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 295 Fh=0.01ns Fh=0.15ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 590 Fh=0.05ns Fh=98.53* Kurva sejajar dan tidak berimpit.
Kedua kurva berbeda.
0.00 vs 885 Fh=2.45 ns Fh=23.76* Kurva sejajar dan tidak berimpit.
Kedua kurva berbeda.
295 vs 590 Fh=0.59 ns Fh=8.68 * Kurva sejajar dan Tidak berimpit. Kedua kurva berbeda.
295 vs 885 Fh=0.56 ns Fh=4.44 * Kurva sejajar dan Tidak berimpit. Kedua Kurva berbeda.
590 vs 885 Fh=0.01 ns Fh=1.53 ns Kurva sejajar dan berimpit. Kedua kurva Sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 8.
Uji kurva regresi NLD dari dharmasri 5 EC
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.05 Fh=3.96 ns Fh=10.97 * Kurva sejajar dan
Tidak berimpit . Kedua kurva berbeda 0.00 vs 0.10 Fh=2.78 ns Fh=15.81* Kurva sejajar dan
tidak berimpit.
Kedua kurva berbeda 0.00 vs 0.15 Fh=0.20ns Fh=13.86* Kurva sejajar
dan tidak berimpit.
Kedua kurva berbeda 0.05vs 0.10 Fh=2.89ns Fh=6.72 * Kurva sejajar dan
Tidak berimpit. Kedua kurva berbeda.
0.05 vs 0.15 Fh=0.05 ns Fh=5.92* Kurva sejajar dan Tidak berimpit. Kedua Berbeda.
0.10vs 0.15 Fh=5.05 ns Fh=4.55* Kurva sejajar dan
Tidak berimpit. Kedua berbeda
F0.05=3.35 F0.05=3.16
_____________________________________________________
Tabel 9.
Uji kurva regresi NLD dari atonik
______________________________________________________
Konsentrasi
(mg/ L) Sejajar Berimpit Kesimpulan 0.00 vs 0.0875 Fh=0.76 ns Fh=0.71 ns Kurva sejajar dan
berimpit .Kedua kurva sama.
0.00 vs 0.175 Fh=0.49 ns Fh=23.02* Kurva sejajar dan tidak berimpit.
Kedua kurva Berbeda.
0.00 vs 2625 Fh=1.03 ns Fh=22.32* Kurva sejajar dan tidak berimpit.
Kedua kurva berbeda 0.0875 vs 0.175 Fh=0.02ns Fh=7.01* Kurva sejajar dan
Tidak berimpit. Kedua kurva berbeda.
0.0875vs 0.2625 Fh=0.01 ns Fh=4.86* Kurva sejajar dan tidak berimpit. Kedua kurva berbeda
0.175 vs 0.2625 Fh=0.03 ns Fh=0.42ns Kurva sejajar dan berimpit. Kedua kurva sama.
F0.05=3.35 F0.05=3.16
_____________________________________________________
V.KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang diuraikan di muka ternyata : (1). Konsentrasi rootone F 590 mg/L, dharmasri 5 EC 0,100 ml/L dan atonik 0,175 ml/L menyebabkan laju asimilasi bersih rata-rata paling tinggi tetapi nisbah luas daun rata-rata (NLD) dan laju tumbuh relatife rata-rata (LTR) turun.
(2). Penurunan nilai NLD dan LTR seara perlahan sejalan dengan penambhan umur bibit panili, oleh karena perlakuan atonik, dahrmasri 5 EC dan rootone F menyebabkan pertumbuhan setek panili lebih cepat dan lebih awal, sedangkan media tumbuh terbatas menyebabkan suplai unsur hara semakin berkurang, maka terjadi penghambatan pembentukan daun-daun baru dan fotosintat yang dihasilkan semakin berkurang pula.
5.2 Saran
Usaha dalam penyediaan bibit dalam menunjang program perluasan areal dan peremajaan tanaman panili untuk sementara disarankan mempergunakan zat pengatur tumbuh rootone F 590
mg/L, dharmasri 5 EC 0,10 ml/L dan atonik 0,1750 ml/L.
Untuk memperoleh informasi lebih lengkap, terutama dalam usaha penyediaan bahan tanaman yang lebih banyak dan bibit yang lebih baik, penelitian ini perlu dilanjutkan terhadap berbagai jenis sumber bahan setek panili, berbagai taraf dosis pada konsentrasi optimal jenis zat pengatur tumbuh di atas, dan pemupukan.
DAFTAR PUSTAKA
Anwar,S; T. Hutomo. 1980. Pembiakan vegetative pada tanaman cokelat (Theobroma cacao L).Bull. Balai Penelitian
Perkebunan Medan 11(1): 39-44.
Audus, L.J. 1963. Plant growth substance. Interscience publ; Inc.
New York. 553 p.
Bowman, G.F. 1950. Propagation of cacao by softwood cutting.
Cacao (Inter-American cacao center) 2 (9):1-6.
Dachmansyah,D dan A.Wachar. 1984. Pengaruh stimulant atonik dan warna polybag terhadap pertumbuhan setek kopi robusta (Coffea canepora Pierre ex Frochner) Bull. Agronomi IPB 15 (/2): 71-81.
Direktonat Jenderal Perkebunan. 1986. Pedoman bercocok tanam panili. Direktorat Jenderal Perkebunan bekerjasama dengan Balai Penelitian Tanaman Rempah danObat.
Dharma Niaga. 1986. Dharmasri zat pengatur tumbuh tanaman.
Brosur. 2 hal
Dirdjopranoto, S. 1970. Penyakit busuk batang panili dan pencegahannya. Komisi Teknis Perkebunan II. Paper Sidang : 16-25.
Direktorat Perlindungan Tanaman Pangan .1987. Pestisida untuk pertanian dan Kehutanan. 206 hal.
Draper, N. and H. Smith.1981. Applied regression analysis, Second edition. John Wiley and Sons, Inc. New York, Chichester, Brisbane, Toronto.709 p.
Gatut Supridjadji, 1985. Pengaruh ZPT Rootone F Terhadap Pertumbuhan Stek Tanaman Kopi. Fakultas Pertanian IPB, Bogor.
Goodwin ,T.W. and E.I. Mercer. 1983. Introduction to Plant Biochemestry. Pergamon Press, Ofxford: 677 p.
Gardner,F.P., R.B. Pearce and R.L. Mitchel. 1985. Physiology of Crop plant,.The Iowa State Uuniversity Press. Ames, Iowa.
Harahap,H. 1987. Potensi Pengembangan Panili di Indonesia.
Seminar Pengembangan PaniliMelalui Pola PIR di Denpasar, Bali. Paper.14 hal.
Hartman ,H.T., and D.E. Kester. 1978. Plant Propogation: Principel and Practice. Prentice Hall of India Private, Ltd.New Delhi. 662 p.
Hurd, R.G.1959. Vegetative propagation . Rooting under polythene sheet. Annual report of WACRI 1957-12958 : 7-53.
Kartono , G., dan S.H.Isdijoso. 1973. Panili. Lembaga Penelitian Tanaman Industri Cabanag Wilayah II Malang.
Kefeli ,V.I. and C.S.Kadyrov. 1971. Natural growth inhibitor, their chemical and phyisiological properties. Ann. Rev. Plant.
Physiol.22: 185-196.
Kefeli ,V.I., and M. Kuthacek. 1973. Phenolic substabces and their possible role and plant growth regulation. Biol. Plant. 12 : 181- 188.
Kozlowski, T.T. 1976. Water deficits and plant growth soil water measurement. Plant responses and breeding for drought
resistance. Academic Press. New York, saqn Fransisco, London 4,pp 154-191
Kvet, J., J.P.Ondok, J. Necas, and P.G.Jarvis. 1971. Methods of growth analysis. Plant photosynthetic production: Manual of Method. Pp 343-380.
Leopold,A.C.and P.E.Kriedmann .1975. Plant Growth and
Development.MC Graw Hill, Inc.New York.545 p.
Lasniak, A.P.,A.Hang , and S.K.Ries. 1986. Stimulation of ATPase activity in barley (Hordium vulgare) toot plasma membrane after treatment of intact tissues and cell free extracts with triacontanolo.Physiol.Plant.68: 20-26
Lehr, J.J. 1961. New light in importance of sodium for palnt life..
Agric.Vet.Chem. 2 (4) : 154-156
Manurung S. O., 1987. Status dan Potensi ZPT serta Prospek Penggunaan Rootone F dalam Perbanyakan Tanaman. Dirjen Reboisasi dan Rehabilitasi Lahan, Departemen Kehutanan, Jakarta.
Moore,T.C. 1979. Biochemestry and Physiology of Plant Hormone.
Springer-Verlag. Berlin, Heidelberg, New York. 274 p.
Patel, K.R.; C.K.Shoh, and A.C.Dhar. 1978. Effect of IAA on endogenous RNA Content and cell elongation. Indian J.Plant Physiol. 21 (2): 133-141.
Prawoto, A.A; dan M. Saleh.1083. Pengaruh nmadu lebah, IBA dan bentuk setek terhadap perakaran setek kakao. Menara Perkebunan 51 (1):7-16.
Ries, S.K; and R. Houtz. 1983. Triacontanol as a plant growth regulator. Hort. Science 15 (1) : 97-98.
Ries, S.K., and V.Wert. 1977. Growtg responses of rice seedling to triakontanol in light and dark. Planta 135 : 77-82.
Rochiman, K. Dan S. S. Harjadi. 1973. Pembiakan Vegetatif.
Departemen Agronomi, Fakultas Pertanian Institut Pertanian Bogor. hal 1 -8.
Rosmeilisa,P..,m J.T.Yuhono dan R. Rosman. 1987. Kemungkinan pengengbangan tanaman panili di KP Citayam, Bogor Jawa Barat. Edisi Khusus penelitian Tanaman Rembapah dan Obat
3(2): 79-83.
Salisbury, F.B., and C. Ross. 1977. Plant Physiology. Prentice Hall of India, Private Ltd.New delhi.673 p.
Satler, O.S., and V.Thiman .1980. The influence of aliphatic alcohol on leaf senescene .J.Plant Physiol.66 :395-399.
Selvarajan ,M., and V.H.M Rao.1982. Studies on rooting of patchouli cutting under different environments. South Indian Horticultures (India) 30(70) :107-111.
Suseno,H. 1974. Fisiologi tumbuhan: metabolism dasar dan beberapa aspeknya. Departemen Botani Fakultas Pertanian IPB. Bogor.
277 hal.
Ursulum, F.T. 1979. Test of growth stimulant (atonik) on the yield and quality of rice . Rice research Institute. Kala Shahy Kaku, India. 17 p.
Weaver, R.J. (1972). Planth Growth Substances in Agricultural. Wh.
Freeman and Co. San Francisco.
Wiraatmaja, I Wayan. 1998. Pengaruh Konsentrasi Rootone F terhadap Pertumbuhan Setek Pangkal Panili (Vanilla planifolia Andrews) Majalah Ilmiah Fakultas Pertanian Unud. Vol No 32 tahun 1998. Hal 1-6
Zaubin, R. dan P. Wahid.1995 Kesesuaian lingkungan tanaman panili. Prosiding Temu Tugas Pemantapan Budidaya dan Pengolahan Panili di Lampung. Bogor. Balai penelitian Tanaman Rempah dan Obat & Departemen Perdagangan RI.