i
Disusun untuk Memenuhi Sebagian Persyaratan Mencapai Derajat Dokter Spesialis
Program Studi Patologi Klinik
Oleh Sri Hadiati S971302002
PROGRAM PENDIDIKAN DOKTER SPESIALIS PATOLOGI KLINIK
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET SURAKARTA
v 2
Pasien Talasemia Beta Mayor. Penelitian ini dibuat untuk memenuhi persyaratan mencapai derajat Dokter Spesialis Patologi Klinik pada Universitas Negeri Sebelas Maret (UNS) Surakarta.
Pada kesempatan ini penulis ingin mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada:
1. Prof. Dr. R. Kasidi, MS selaku Rektor UNS Surakarta
2. Prof. Dr. Hartono dr., M.Si selaku Dekan Fakultas Kedokteran UNS Surakarta
3. Dr. Endang Agustinar, M.Kes selaku Direktur Rumah Sakit Umum Dokter Moewardi (RSDM) di Surakarta, yang telah mendukung dan menyediakan sarana penelitian Program Pendidikan Dokter Spesialis Patologi Klinik Universitas Sebelas Maret
4. MI Diah P, dr., Sp.PK(K), MSc., selaku Kepala Kelompok Satuan Medik Patologi Klinik RSDM di Surakarta
5. B. Rina A. Sidharta, dr., Sp.PK(K), selaku Kepala Program Studi Patologi Klinik FK UNS dan Kepala Instalasi Patologi Klinik RSDM di Surakarta serta selaku pembimbing I. Terima kasih atas bimbingan, masukan saran, koreksi dan kesabaran dalam membimbing penulisan karya akhir ini
6. Dian Ariningrum, dr., Sp.PK, M.Kes selaku Kepala Bagian Patologi Klinik FK UNS Surakarta dan selaku pembimbing II. Terima kasih atas bimbingan, masukan saran, koreksi dan kesabaran dalam membimbing penulisan karya akhir ini
vi
9. Seluruh subjek penelitian, yang telah berkenan dan ikhlas memberikan pengorbanan demi kemajuan ilmu pengetahuan
10. Seluruh teman-teman PPDS Patologi Klinik Fakultas Kedokteran UNS/RSDM di Surakarta atas segala bantuan dan dukungan yang telah diberikan selama penelitian ini berlangsung.
11. Kedua orang tuaku Bapak Banani (alm), Ibu Suratmi yang telah membesarkan, mendidik, dan menanamkan rasa tanggung jawab dan disiplin serta memberikan dorongan dan dukungan penuh, sehingga penulis dapat mencapai jenjang pendidikan spesialisasi ini
12. Suami tercinta Firnawan Hendrayanto, ST. MT, terima kasih atas doa, dukungan dan kesabaran selama penulis menjalani pendidikan ini
13. Ananda putri tersayang, Jilan Nabila Firdy dan Hilwa Farhata Imany, terima kasih atas doa, dukungan, kesabaran, pengertian dan jiwa besarnya selama penulis menjalani pendidikan ini. Tak lupa pula terima kasih untuk kakak dan adik tersayang atas doa dan dukungannya
Penulis menyadari bahwa karya akhir ini masih jauh dari sempurna, oleh karena itu dengan penuh rendah hati penulis mengharapkan masukan, koreksi dan saran demi perbaikan sehingga bermanfaat bagi perkembangan keilmuan di bidang Patologi Klinik.
Akhir kata, penulis berharap semoga karya akhir ini dapat memberikan manfaat yang bagi perkembangan ilmu pengetahuan di bidang Patologi Klinik dan semua pihak yang membutuhkan.
Surakarta, 19 Juli 2016
vii
Prakata... Daftar Isi………..……... Daftar Gambar ………..…... Daftar Tabel………..……... Daftar Lampiran... Daftar Singkatan ………... Intisari... Abstract... BAB I. PENDAHULUAN ………..………...
A. Latar Belakang ……….………... B. Perumusan Masalah ………... C. Tujuan Penelitian ………... D. Manfaat Penelitian ………... E. Keaslian Penelitian ………... BAB II. TINJAUAN PUSTAKA ………..………... A. Kajian Teori ………...…... 1. Talasemia Beta Mayor………....…... 2. Stres Oksidatif ………...……... 3. F2-Isoprostan ………...………... 4. Mekanisme Gangguan Fungsi Ginjal pada TBM... 5. Pemeriksaan Laboratorium Fungsi Ginjal... a. Kreatinin... b. Laju Filtrasi Glomerulus... B. Kerangka Pikir ……….………... C. Hipotesis ………...………...…... BAB III. METODE DAN CARA PENELITIAN ………...…... A. Rancangan Penelitian ………...…... B. Tempat dan Waktu Penelitian ………....…... C. Subjek Penelitian ………....……... D. Bahan dan Alat ………...…………....………... E. Cara, Prosedur dan Skema Alur Penelitian …..……...……... 1. Cara Penelitian... 2. Prosedur Penelitian... a.F2-Isoprostan……….….………... b.Kreatinin Serum dan Kreatinin Urin...………... c.Pengukuran Tinggi Badan... 3. Skema Alur Penelitian ………...………... F. Identifikasi Variabel Penelitian ………....………... G. Definisi operasional Variabel Penelitian …....………... H. Kontrol Kualitas Internal ………..………... I. AnalisisStatistik ………...………...………….……... J. Pertimbangan Etik ………...………....…………... BAB IV. HASIL DAN PEMBAHASAN... A. Validitas Uji Analitik...
viii
Ringkasan... Daftar Pustaka...……….……….…... Lampiran...
ix
Gambar 4. Mekanisme Gangguan Fungsi Ginjal pada TBM.……….…... Gambar 5. Perbandingan Formula Schwartz dan Inulin Clearance... Gambar 6. Bagan Kerangka Pikir... ..………... Gambar 7. Skema Pemeriksaan 8-IsoPs secara EIA…………...………... Gambar 8. Preparasi Larutan-larutan Standar Pemeriksaan 8-IsoPs .……..…... Gambar 9. Format Plate Pemeriksaan 8-IsoPs……..………... Gambar 10. Skema Alur Penelitian...….……...………….………..… Gambar 11. Grafik Korelasi F2-IsoPs urin dan eLFG... Gambar 12. Hubungan antara nilai LFG dengan AER...
x Tabel 5.
Tabel 6 Tabel 7. Tabel 8. Tabel 9. Tabel 10.
Spesifitas 8-IsoPG EIA... Hasil uji presisi pemeriksaan kreatinin serum dan F2-IsoPs urin... Hasil uji akurasi untuk pemeriksaan kreatinin serum... Deskripsi karakteristik subjek penelitian... Hasil uji komparasi... Korelasi Spearman F2-IsoPs urin dengan beberapa variabel penelitian pada pasien TBM...
xi
Lampiran 5. Penjelasan penelitian... Lampiran 6. Surat pernyataan bersedia menjasi subjek penelitian... Lampiran 7. Data isian responden... Lampiran 8. Kelaikan etik ... Lampiran 9. Dokumentasi proses pemeriksaan F2-IsoPs...
xii
BHT Butylated hydroxytoluene
Blk Blank
BM Bone marrow
BTM Beta talasemia mayor
CCl4 Carbon tetrachloride
CKD Chronic kidney disease
COX Cyclooxygenase
DM Diabetes mellitus
DNA Deoxyribonucleic acid
eLFG Estimasi laju filtrasi glomerulus
EIA Enzyme immunoassay
F2-IsoPs F2-isoprostan
Fe2+ Ferrous iron
Fe3+ Ferric iron
GC-MS Gas chromatography-mass spectrometry
GPx Glutathione peroxidase
H2O2 hidrogen peroksida
KV Koefisien variasi
L∙ carbon-centered lipid radical
LOO∙ peroxy lipid radical
LOOH hidroperoksida lipid
MDA Malondialdehyde
mg miligram
mL mililiter
µL mikroliter
NADH Nicotinamide adenine dinucleotide tereduksi
NAD Nicotinamide adenine dinucleotide teroksidasi
NSB Non-specific binding
O2
-superoxide
OH∙ Hydroxyl radical
PFOA Perfluorooctanoic acid
PG Prostaglandin
ng Nanogram
PRC Packed red blood cell
PUFA Polyunsaturated fatty acid
ROS Reactive oxygen species
S Standard
SB Simpang baku
SOD Sarkosin oxidase
TA Total activity
TBARS Thiobarbituric acid-reacting substances
TGF-β Transforming growth factor beta
xiii 1
Program Pendidikan Dokter Spesialis Patologi Klinik Fakultas Kedokteran Universitas Sebelas Maret/Rumah Sakit Umum Daerah Dr. Moewardi di Surakarta
2
Bagian Patologi Klinik Fakultas Kedokteran Universitas Sebelas Maret/ Rumah Sakit Umum Daerah Dr. Moewardi di Surakarta
Pemberian transfusi darah kronik pada pasien talasemia beta mayor (TBM) dapat menyebabkan kelebihan kadar besi dalam tubuh yang memicu timbulnya reactive oxygen
species (ROS) yang diukur dalam bentuk F2-IsoPs urin dan gangguan ginjal yang diukur dengan estimasi laju filtrasi glomerulus (eLFG). Penelitian ini bertujuan untuk mengetahui korelasi kadar F2-IsoPs urin dengan eLFG pada pasien TBM.
Penelitian secara potong lintang pada bulan Mei-Juni 2016. Subjek sebanyak 30 pasien TBM yang datang ke Instalasi rawat jalan Bagian Ilmu Kesehatan Anak (IKA) dan Bangsal Talasemia yang dilakukan pemeriksaan di Instalasi Patologi Klinik RSDM di Surakarta. Analisis statistik menggunakan uji korelasi Spearman, kemaknaan statistik ditujukkan dengan nilai p < 0,05 dan interval kepercayaan 95%.
Hasil penelitian didapatkan rerata usia 12,2 ± 3,57 tahun, laki-laki 15 orang (50%) dan wanita 15 orang (50%). Rerata kadar F2-IsoPs urin adalah 2,36 ± 1,11 ng/mg kreatinin urin. Hasil eLFG berada pada median 271,3 dengan nilai minimum 199,8 dan nilai maksimum 476,0 mL/menit/1,73m2. Hasil korelasi F2-IsoPs urin dengan eLFG r = 0,740; p = 0,001.
Terdapat korelasi positif kuat dan bermakna antara F2-IsoPs urin dengan eLFG menunjukkan bahwa terjadi peningkatan nilai eLFG seiring dengan peningkatan F2-IsoPs urin. Penelitian ini didapatkan nilai eLFG yang lebih tinggi dari normal/cenderung hiperfiltrasi yang merupakan tahap awal penyakit ginjal kronik. eLFG dapat digunakan untuk meramalkan tingkat stres oksidatif pada pasien TBM. Perlu penelitian lanjutan dengan desain yang berbeda untuk mengevaluasi korelasi peningkatan F2-IsoPs urin dan eLFG dengan menentukan marker yang dapat membedakan kerusakan oksidatif pada glomerulus/tubulus ginjal.
xiv
Sri Hadiati1, B. Rina A. Sidharta2, Dian Ariningrum2 1
Clinical Pathology Educational Programme, Faculty of Medicine Sebelas Maret University/dr. Moewardi Hospital in Surakarta
2
Departement of Clinical Pathology Faculty of Medicine, Sebelas Maret University/ dr. Moewardi hospital in Surakarta
Beta thalassaemia mayor (BTM) characterised by progressive anaemia necessitating regular blood transfusions to sustain life. The advent of effective chelating agents can reduce iron burden and extend patients’survival, renal disease has become more prevalent. Free iron catalyzes formation of highly reactive oxygen species (ROS),
measured asUrinary F2-IsoPs and estimated glomerular filtration rate (eGFR). The aim
of this study was to determine the correlation between urinary F2-IsoPs and eGFR in
BTM patients.
This cross sectional study was conducted during May-June 2016. Thirthty patients BTM admitted to departement of Pediatrics Hematology Dr. Moewardi hospital in Surakarta. Spearman’s correlation was used to analyze the data, considered significant when p value < 0.05 with 95% confidence interval.
The result showed a mean of age were 12.2 ± 3.57 years, consist of 15 men (50%) and 15 women (50%). The mean of urinary F2-IsoPs was 2.36 ± 1.11 ng/mg creatinine
urine. Estimated GFR at median 271.3 mL/min/1,73 m2 with minimum value 199,8 mL/min/1,73 m2 and maximum value 476.0 mL/min/1,73 m2. The correlation between urinary F2-IsoPs and eGFR r = 0.740; p = 0.001.
There was a significant strong positive correlation between urinary F2-IsoPs and
eGFR indicated the increased of eGFR followed by the increased of urinary F2-IsoPs.
Glomerular hiperfiltration was considered as early stage of chronic kidney disease. We concluded that eGFR can be used to predict oxidative stress in BTM patients. Further research is needed to evaluate the correlation between urinary F2-IsoPs and eGFR to
determine oxidative damage in glomerulus or tubulus renal.
1
Talasemia merupakan kelainan genetik yang hingga saat ini menjadi masalah kesehatan dunia termasuk Indonesia. World Health Organization (WHO) pada tahun 1994 menyatakan bahwa ± 4,5% dari 250 juta penduduk dunia adalah talasemia karier (bentuk heterozigot), 80‒ 90 juta sebagai karier talasemia beta, sisanya adalah talasemia alfa dan jenis Hb varian seperti Hb E, Hb S, Hb O dan sebagainya (Atmakusumah et al., 2010). Penyebaran penyakit talasemia mulai dari Mediterrania, Timur Tengah, India, Burma, serta daerah sabuk talasemia (Cina bagian selatan, Thailand, Semenanjung Malaysia, Kepulauan pasifik dan Indonesia). Daerah‒ daerah tersebut lazim disebut dengan daerah sabuk talasemia oleh karena prevalensi talasemia sebesar 2,5‒ 15% (Langlois et al., 2008).
Diagnosis penyakit ini sangat penting karena berkaitan dengan tata laksana, diantaranya adalah transfusi darah yang terus menerus dengan segala akibatnya. Talasemia beta mayor (TBM) membutuhkan transfusi darah secara rutin disertai pemberian khelasi besi yang optimal untuk mempertahankan kualitas hidupnya. Namun, pemberian transfusi berulang mempunyai dampak yang kurang baik bagi penderita yaitu dapat terjadi penimbunan besi (iron overload) pada berbagai organ tubuh, seperti hati, jantung, ginjal, pankreas,
dan lain lain. Adanya besi bebas dalam bentuk ferrous (Fe2+) akan memicu timbulnya reactive oxygene species (ROS) untuk menghasilkan radikal superoksida yang akan mengoksidasi lipid membran sel dan protein sehingga menyebabkan kerusakan sel dan kematian (Rund dan Rachmilewitz, 2005).
oksidatif yang akan menyebabkan peroksidasi lipid menghasilkan pembentukan radikal bebas yang berakibat pada kerusakan sel, membran sel, dan jaringan. Peningkatan lipid peroksidasi tersebut dapat diukur dengan berbagai metode pengukuran lipid peroksidasi dalam darah, urin, liquor cerebrospinalis, dan cairan biokimia lainnya salah satunya menggunakan
marker F2-IsoPs. Beberapa produk hasil peroksidasi lipid lainnya adalah malondialdehyde (MDA), 4–hydroxynonenal (HNE), thiobarbituric
acid-reacting substances (TBARS) dan lain-lain (Vinita et al., 2015).
Saat ini F2-IsoPs merupakan marker stres oksidatif atau lipid peroksidasi in vivo yang tergolong baru, paling baik, sangat stabil, dan secara signifikan lebih akurat daripada marker lainnya. F2-IsoProstan telah ditemukan hampir di seluruh cairan biologis, namun darah (plasma ataupun serum) dan urin merupakan sampel penelitian yang paling umum digunakan karena paling mudah didapatkan, paling tidak invasif, dan memberikan hasil yang sama akurat dan presisi dari indeks stres oksidatif. Isomer 8-isoprostan dari F2-IsoPs merupakan isomer F2-IsoPs yang paling banyak dihasilkan dan paling sering diteliti. Dan penelitian menunjukkan bahwa kadar total F2-IsoPs (bebas dan yang terikat dengan fosfolipid) dapat menggambarkan keadaan stres oksidatif yang sebenarnya (Dalle-Donne, 2006; Janicka et al., 2010).
Manusia tidak memiliki mekanisme untuk mengekskresi kelebihan besi, sehingga diperlukan terapi khelasi besi. Terapi khelasi besi terbukti sangat efektif menurunkan kandungan besi pada pasien TBM yang mendapat transfusi (Rund dan Rachmilewitz, 2005). Khelasi besi adalah suatu agen yang dapat mengikat kelebihan besi dalam tubuh. Masalah yang timbul pada penggunaan terapi khelasi besi dalam jangka waktu yang lama adalah efek sampingnya berupa toksisitas pada ginjal (Beutler et al., 2003). Penelitian jangka pendek yang melibatkan 11 pasien TBM yang diterapi deferasirox 30 mg/kg/hari
hingga 24 minggu, menunjukkan penurunan nilai rerata estimasi laju filtrasi
glomerulus (eLFG) hingga 9,2 (9,5%) dan penurunan renal plasma flow (RPF)
105,7 mL/min (17,8%), sedangkan penelitian jangka panjang yang diikuti
dan penurunan RPF hingga 155,6 mL/min (26,1%). Penurunan terjadi mulai
pada minggu ke 52 (Piga et al., 2015).
Keberhasilan terapi penyakit talasemia ternyata menimbulkan masalah baru yaitu munculnya berbagai komplikasi, diantaranya adalah abnormalitas fungsi ginjal. Saat ini dilaporkan sekitar 8% dari 6 juta pasien talasemia di UK (United Kingdom) terjadi komplikasi chronic kidney disease (CKD). Bakr et al., 2014 mengatakan adanya disfungsi tubulus ginjal dan penurunan laju
filtrasi glomerulus (LFG) pada pasien TBM yang diterapi khelasi besi. Dari 330 jumlah pasien yang mendapatkan terapi deferoxamine sebagai khelasi besi,
224 (68%) dilaporkan mengalami komplikasi berupa gangguan fungsi ginjal
berupa proteinuria dan penurunan LFG (Cunningham et al., 2004).
Data di atas menunjukkan bahwa pada pasien talasemia dapat terjadi gangguan fungsi ginjal hingga jatuh ke arah PGK. Kidney Disease Improving Global Outcome (KDIGO) pada tahun 2013 membuat klasifikasi stadium PGK berdasarkan penurunan fungsi ginjal yang diukur dengan LFG. Tahap awal PGK (G1) adalah kerusakan ginjal dengan fungsi ginjal normal atau meningkat dengan nilai LFG ≥ 90 mL/menit/1,73 m²; tahap 2 (G2) kerusakan ginjal dengan penurunan fungsi ginjal ringan dengan LFG 60-89 mL/menit/1,73 m²; tahap 3 (G3) Penurunan fungsi ginjal ringan-sedang dengan LFG 45-59 mL/menit/1,73 m²; tahap IV merupakan penurunan fungsi ginjal berat dengan LFG 15-29 mL/menit/1,73 m²; dan tahap akhir adalah gagal ginjal dengan LFG < 15 mL/menit/1,7 m².
paling baik (Janicka et al., 2010), namun peran F2-IsoPs pada TBM belum banyak diketahui. Penelitian pada TBM yang mengunakan F2-IsoPs urin sebagai marker peroksidasi lipid pun masih terbilang baru dan sedikit dibandingkan marker lainnya. Dengan kemampuan F2-IsoPs sebagai penanda kerusakan jaringan akibat stres oksidatif diduga dapat dipergunakan untuk memprediksi terjadinya penurunan fungsi ginjal lebih awal pada pasien TBM sehingga penanggulangan penyakit akan lebih baik. Pada penelitian ini akan menilai korelasi antara F2-IsoPs urin dengan eLFG dalam mendeteksi kerusakan ginjal. Penelitian ini perlu dilakukan dengan harapan dapat menjawab hasil penelitian yang selama ini masih kontradiktif.
B. Rumusan Masalah
Apakah terdapat korelasi antara kadar F2-IsoPs urin dengan eLFG pada pasien TBM ?
C. Tujuan Penelitian
Mengetahui korelasi antara kadar F2-IsoPs urin dengan eLFG pada pasien TBM.
D. Manfaat Penelitian
1. Manfaat bagi perkembangan ilmu pengetahuan: Dapat diketahui mengenai korelasi kadar F2-IsoPs urin dengan eLFG pada pasien TBM. Hasil penelitian ini juga dapat digunakan sebagai dasar untuk penelitian selanjutnya.
2. Manfaat praktis: penilaian fungsi ginjal dengan eLFG dapat digunakan untuk menilai stres oksidatif pada pasien TBM .
E. Keaslian Penelitian
Beberapa penelitian sebelumnya telah meneliti marker stres oksidatif dan marker fungsi ginjal pada pasien TBM. Namun belum ada yang meneliti kadar
Tabel 1. Keaslian Penelitian
No. Peneliti dan Judul Penelitian Jumlah Kasus Hasil Penelitian 1.
2.
3.
Matayatsuk et al.
Elevated F2-isoprostanes in
thalassemic patients
Free Radic Biol Med. 2007.
43:1649-1655.
Hamed E dan Nagla T
Renal functions in pediatric
patients with
beta-thalassemia major: relation to chelation therapy: original prospective study
Italian Journal of Pediatrics.
2010. 36:1-10. Majid et al.
A Prospective study of tubular disfunction in pediatric patient with Beta thalassemia mayor receiving deserafirox
Pediatric Haematology and Oncology. 2013. 30:748-754
17 pasien TBM serta 9 kontrol sehat
69 pasien TBM dan 15 kontrol sehat
30 pasien TBM
Kadar F2-IsoPs urin pada pasien talasemia lebih tinggi dibandingkan kontrol dengan rerata 3,38 ± 2,15 ng/mg kreatinin urin vs 0,86 ± 0,55 ng/mg kreatinin urin (p = 0,002). Kadar F2-IsoPs plasma total pada pasien
TBM lebih tinggi
dibandingkan kontrol dengan rerata 0,39 ± 0,15 ng/mL vs 0,18 ± 0,03 ng/mL (p = 0,0003).
Terdapat peningkatan serum kreatinin dan penurunan LFG pada pasien TBM yang mendapat deferoxamine
(0,55 ± 0,08 vs 0,75 ± 0,18, p < 0,001 dan 119,08 ± 11,13 mL/menit/1,73 m2vs 92,67 ± 25,16 mL/menit/1,73 m2; p < 0,001).
Terdapat peningkatan serum kreatinin (0,54 ± 0,08 vs 0,67 ± 0,16) dan penurunan LFG (104,36 mL/menit/1,73 m2 ±
19,62 vs 86,00
mL/menit/1,73 m2 ± 16,92) 6 bulan setelah mendapat terapi deserafirox (p<0,01) .
4. Milo et al.
Glomerulofiltration rate in pasien with thalassemia Beta mayor
Acta Haematol. 2015.
123:148-152.
9 pasien TBM yang di terapi
deferasirox.
Laju filtrasi glomerulus pada
pasien TBM 76,6
Tabel 1. Keaslian Penelitian (lanjutan) 5. Wirawan et al.
Renal impairment in β
thalassemic major patient receiving repeated blood transfusion.
Med J Indones. 2003.
12:215-223.
75 pasien TBM
7 1. Talasemia Beta Mayor
Talasemia beta mayor merupakan kelainan genetik dengan kegagalan sintesis globin beta (β 0) atau penurunan sintesis globin beta (β +) yang merupakan komponen penting penyusun hemoglobin. Penurunan sintesis hemoglobin ini menyebabkan produksi hemoglobin tidak efektif, dan kerusakan eritrosit atau prekursornya oleh karena ekses akumulasi rantai globin yang tidak mengalami gangguan sintesis. Distribusi talasemia terkonsentrasi pada “thalassemia belt”, yaitu daerah yang mencakup dari mediterania ke timur sampai Asia Tenggara dan ke selatan sampai Afrika Utara (Rodak et al., 2012).
Pada TBM, ekses rantai alfa yang tidak berpasangan akan berpresipitasi pada eritrosit yang sedang berkembang dan merusak permukaan eritrosit tersebut. Eritrosit yang rusak ini kemudian akan dihancurkan oleh makrofag pada sumsum tulang atau pada sirkulasi. Kematian prematur dari eritrosit di sumsum tulang ini menyebabkan eritropoisis menjadi tidak efektif. Sebagian sel dapat melewati sumsum tulang, tetapi kemudian mengalami hemolisis ekstravaskuler di lien. Maka pada talasemia beta, anemia disebabkan oleh eritropoisis yang inefektif dan peningkatan destruksi eritrosit (Rahman et al., 2012; Rodak et al., 2012).
carrier, terdapat pada individu dengan perubahan genetik pada satu atau dua
gen tanpa abnormalitas hematologis (Rodak et al., 2012).
Transfusi darah adalah pilihan terapi utama pada pasien TBM yang dimulai pada tahun pertama kehidupan untuk mempertahankan kadar hemoglobin diatas 9 g/dL. Transfusi berulang adalah pemberian whole blood (WB)/packed red cell (PRC) yang diberikan berulang kali dalam
Komplikasi transfusi lain yang terjadi adalah gangguan pertumbuhan, gangguan endokrin dan infeksi virus Hepatitis B, C, dan infeksi human immunodeficiency syndrome (HIV). Iron overload akumulasi dapat terjadi sekunder karena terapi anemia kronik, dan yang disebabkan oleh transfusi disebut dengan transfusion-related hemosiderosis. Pada talasemia juga terjadi pelepasan besi dari hemolisis intravaskuler yang menambah iron overload (Rodak et al., 2012; Rubin dan Strayer, 2012). Iron overload berkorelasi dengan banyaknya transfusi PRC pada pasien
talasemia beta, bahkan pada pasien dengan terapi khelasi besi (Chiou et al., 2006). Komplikasi paling serius dari iron overload adalah kardiotoksisitas, dan gangguan jantung karena iron overload adalah penyebab kematian utama pada pasien TBM (Hosen et al., 2015).
Zat besi dikeluarkan dari tubuh dalam jumlah yang relatif sangat rendah, melalui urin (0,1 mg/hari); feses 0,3‒ 0,5 mg/kg BB; keringat
0,5‒ 1,0 mg/hari dan deskuamasi kulit (Rodak et al., 2012). Besi sangat
penting untuk kehidupan, sebagai komponen penting dari enzim seperti sitokrom oksidase, dan kompleks seperti hemoglobin, myoglobin dan feritin.
Namun, jika besi dilepaskan dari kompleks-kompleks ini sebagai bentuk bebas (Fe2+/Fe3+), dapat bereaksi dengan ROS dan membentuk oxyradical melalui reaksi Fenton (Comporti et al., 2008). Iron overload yang terjadi sekunder karena terapi anemia kronik, yang disebabkan oleh transfusi disebut dengan transfusion-related hemosiderosis (Rodak et al., 2012; Rubin dan Strayer, 2012).
adalah hepsidin, sebuah hormon yang diproduksi di hepar dan mengatur kadar besi dengan mengikat feroportin, yaitu protein transport transmembran pada enterosit duodenum, sel hepar dan makrofag. Feroportin memindahkan besi dari dalam sel ke cairan ekstraseluler, dan saat berikatan dengan hepsidin, feroportin dan besi akan tetap berada di dalam sel. Kadar hepsidin dapat ditingkatkan oleh besi dan keadaan inflamatorik, serta menurun pada defisiensi besi dan hipoksia (Goswami et al., 2005; Chiou et al., 2006; Rodak et al., 2012; Rubin dan Strayer, 2012).
Saat kemampuan sel untuk menyimpan besi dalam bentuk hemosiderin sudah tidak mencukupi, dapat terjadi akumulasi besi dalam bentuk bebas (ferrous iron/Fe2+) intraseluler. Dengan adanya oksigen, Fe2+ ini akan menginisiasi pembentukan superoksida dan radikal bebas lainnya, yang menyebabkan peroksidasi membran lipid yang akan merusak tidak hanya membran sel, tetapi juga membran mitokondria, nukleus dan lisosom. Respirasi sel menjadi terganggu dan enzim lisosom menjadi terlepas secara intraseluler, dan berakhir dengan kematian sel karena kerusakan membran ireversibel (Chiou et al., Rodak et al., 2012).
Adapun intervensi medis yang diberikan terkait dengan dampak transfusi berulang pada pasien TBM adalah berupa tindakan pengontrolan besi pada pasien talasemia yang rutin mendapatkan transfusi darah yaitu pemberian terapi pengikat besi/khelasi besi. Penggunaan agen khelasi besi bersama antioksidan dapat membantu regulasi status antioksidan pada pasien tersebut (Rahman et al., 2012). Pemberian khelasi besi terbukti dapat memperbaiki survival pasien TBM. Sebuah penelitian di Italia tentang survival pasien talasemia setelah mendapatkan terapi transfusi dan khelasi
besi, didapatkan 68% pasien hidup hingga umur 35 tahun, 67% kematian disebabkan oleh penyakit jantung. Infeksi adalah penyebab kematian kedua terbanyak (15%), diikuti oleh penyakit hepar (4%) dan gangguan tromboembolik (4%) (Greer et al., 2014).
diekskresikan lewat urin, mencegah akumulasi besi serta komplikasi dari iron overload, sehingga membantu memperpanjang harapan hidup pasien
TBM hingga usia tiga puluhan (Rodak et al., 2012). Terapi khelasi besi biasanya dimulai pada saat kadar feritin serum mencapai 1000 mg/dL. Praktisnya, level feritin ini dicapai setelah transfusi ke 10‒ 15 kali (Piga et al., 2015). Pemberian khelasi besi perlu monitoring fungsi ginjal yang ketat
karena efek nefrotoksiknya. Penelitian tentang adanya disfungsi tubulus ginjal dan penurunan LFG pada pasien TBM yang diterapi khelasi besi telah banyak dilaporkan.Dari 330 pasien yang mendapatkan terapi deferoxamine, 224 (68%) dilaporkan mengalami komplikasi berupa gangguan fungsi ginjal
berupa proteinuria dan penurunan LFG (Bakr et al., 2014).
2. Stres Oksidatif
Stres oksidatif terjadi saat pembentukan radikal bebas, seperti ROS dan intermediat aktifnya melebihi kemampuan tubuh untuk menetralisir dan mengeliminasi radikal bebas tersebut. Radikal bebas terbentuk secara fisiologis dalam jumlah tertentu dari metabolisme aerobik, dan untuk menanganinya, tubuh memiliki sistem antioksidan yang terdiri dari superokside dismutase (SOD), katalase, glutathione peroxidase (GPx),
seperti lipid dan protein, dan mengganggu fungsi normal sel (Montuschi et al., 2004; Rahman et al., 2012).
Gambar 1. Pembentukan hidroksi radikal pada reaksi Haber-Weiss dan reaksi Fenton (Srichairatanakool dan Fucharoen, 2014).
Kerusakan oksidatif, terutama karena iron overload dan deplesi antioksidan, berperan penting pada patogenesis TBM, adanya rantai alfa yang berlebihan adalah sebab utama kerusakan oksidatif seluler pada TBM. Iron overload juga meningkatkan pembentukan ROS dan stres oksidatif,
karena besi yang berlebih mengkatalisasi produksi ROS seperti O2-dan OH melalui reaksi Haber-Weiss dan reaksi Fenton. Stres oksidatif ini akan memicu peroksidasi lipid pada eritrosit dan akhirnya menyebabkan hemolisis (Simsek et al., 2005, Matayatsuk et al., 2007; Srichairatanakool dan Fucharoen, 2014.).
Lipid dapat bereaksi dengan radikal bebas, sehingga lipid tersebut mengalami peroksidasi dan membentuk peroksida-peroksida lipid (Rahman et al., 2012). Peroksidasi yang dimediasi radikal bebas pada polyunsaturated fatty acid (PUFA) terjadi dengan lima reaksi: (1) transfer
atom hidrogen dari PUFA ke rantai radikal, (2) reaksi lipid radikal dengan molekul oksigen sehingga membentuk lipid peroxyl radical, (3) fragmentasi lipid peroxyl radical sehingga membentuk oksigen dan radikal lipid
normal. Pengukur menilai stres oksi et al., 2008). Bi
dilihat pada tabe Tabel 2. Biomark
Setiap diperlukan lebih (Niki dan Yoshi
3. F2-isoprostan F2-isoprost noncyclooxigenase
(AA) (Milatovi biomarker peroksi
F2-isoprostan a esterifikasi asam bebas in vivo. Nugteren, Vonke kepentingan biol beberapa keungg stabil secara kim in vivo, (4) dapa
sehingga dapat signifikan pada
Biomarker
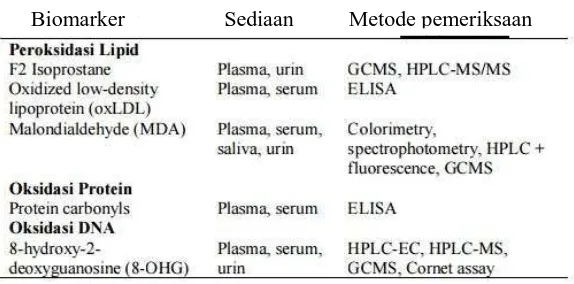
ukuran produk peroksidasi lipid adalah cara ya s oksidatif (Montuschi et al., 2004; Chiou et al., Biomarker untuk menilai stres oksidatif di dal
abel 2.
arker untuk kerusakan oksidatif(Niki dan Yoshida
biomarker memiliki keterbatasan, sehingga bih dari satu biomarker untuk memastikan kada oshida, 2005).
soprostan terbentuk dari mekanisme katalisis enase yang melibatkan peroksidasi PUFA dan a
ovic dan Aschener, 2009). F2-isoprostan dig roksidasi lipid pada manusia (Cracowski dan
adalah prostaglandin like compound yang sam AA di jaringan oleh reaksi katalis non enz o. Pertama kali, isoprostan ditemukan pada ta
onkeman dan Vandrop, 20 tahun kemudian direa biologis (Milne et al., 2005). Pengukuran F2-IsoP unggulan dibandingkan marker stres oksidatif la
kimia, (2) merupakan produk spesifik peroksida dapat diukur pada semua jaringan dan cairan bi
pat ditetapkan nilai normalnya, (5) kadar da model hewan dengan kerusakan oksidatif
r Sediaan Metode pemeriksaan
yang umum untuk al., 2006; Comporti
dalam tubuh dapat
oshida, 2005)
hingga terkadang kadar stres oksidatif
terpengaruh kandungan lipid pada diet (Montuschi et al., 2004; Matayatsuk et al., 2007; Comporti et al., 2008). Sifat dari molekul F2-IsoPs lebih stabil, kuat, dan dapat dideteksi melalui berbagai cairan tubuh seperti urin, plasma, atau cairan serebrospinal (Milatovic dan Aschener, 2009). Akan tetapi banyak penelitian menggunakan sampel dari urin karena metode pengambilan sampel sederhana dan non invasif (Cracowski dan Baguet, 2003). Metabolit F2-IsoPs di urin merupakan indikator stres oksidatif yang banyak digunakan karena merupakan parameter non-invasif yang merefleksikan produksi F2-IsoPs dalam satu kurun waktu, dan merupakan penilaian yang tepat untuk menentukan produksi F2-IsoPs endogen total (Montuschi et al., 2004). Pada kelompok kontrol manusia sehat didapatkan mean kadar 8-IsoPs plasma adalah 33 ± 3,3 pg/mL, sedangkan kadar 8-IsoPs urin 1,6 ± 0,6 ng/mg kreatinin (Basu et al., 2001; Milne et al, 2005). Sumber lain mengatakan bahwa kadar 8-IsoPs pada orang normal pada rentang 504 ± 404 pg/mg kreatinin (Vigor et al, 2014).
F2-Isoprostan dapat diperiksa menggunakan beberapa metode. Saat ini telah dikembangkan beberapa jenis metode untuk mengukur kadar F2 -IsoPs seperti metode gas chromatographic/negative ion chemical ionization mass spectrometric (GC/NICI-MS), yang memiliki sensitivitas
dan spesifisitas yang tinggi (90% dan 50%) dan dipertimbangkan sebagai
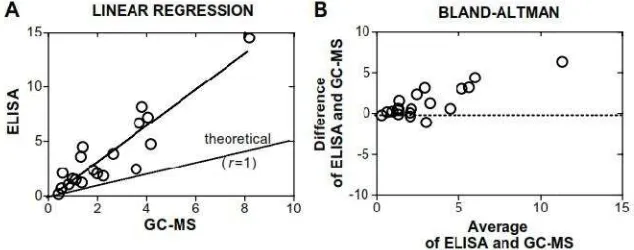
-nya metode spe digunakan dala yang sangat ba biayanya yang pemeriksaan F2 -MS dan didapat IsoPs dengan EI dikembangkan (Milne et al., 2005; perbandingan k GCMS dengan E
Gambar 2. Kor
Pengukur memberikan ha mungkin karena metabolit isoprost IsoPs didapatka pemeriksaan F2 -dengan isoprosta Pengukur menggambarkan mempelajari pe
manusia. Dalam ±
spektrofotometri massa, namun immunoassay alam berbagai penelitian karena keakuratan h
baik, sensitivitasnya 80%, relatif mudah g lebih rendah. Menurut Carraro et al. (2010 F2-IsoPs menggunakan EIA didapatkan sebandi patkan korelasi yang tinggi (r = 0,99) antara pe n EIA dan GC-MS. Immunoassay untuk penguku
n dan tersedia secara komersial dengan nam ., 2005; Dalle-Donne et al., 2006). Gambar 2
kesesuaian hasil pemeriksaan F2-IsoPs urin n ELISA (Tsikas et al., 2003).
orelasi keakuratan hasil pemeriksaan F2-IsoPs urin m dan ELISA (Tsikas et al., 2003).
ukuran secara immunoassay lebih mudah, hasil yang lebih tinggi dibandingkan dengan ena reaksi silang dari antibodi poliklonal denga soprostan lain (Smith et al., 2011). Reaksi silang a
tkan < 1% untuk semua isoprostan yang F2-IsoPs secara EIA menunjukkan reaksi silang ostan lain dan prostaglandin (Schwedhelm dan B ukuran F2-IsoPs adalah cara paling r kan status stres oksidatif in vivo, dan sangat
peran stres oksidatif pada patogenesis pe lam tubuh manusia, F2-IsoPs mempunyai half ±
say lebih banyak
hasil korelasinya h digunakan dan 2010), sensitivitas nding dengan GC-a pemeriksGC-aGC-an F2 -ukuran IsoPs telah nama 8‒ IsoPGF2α
r 2 menunjukkan urin antara metode
rin metode GCMS
udah, tetapi dapat ngan GC-MS, yang dengan metabolit-ng antibodi anti F2 -g diuji, sehin-g-ga silang yang rendah
karena dikeluarkan secara cepat dari sirkulasi melalui ekskresi dalam urin (Matayatsuk et al., 2007; Kaviarasan et al., 2009).
Efek biologis dari F2-IsoPs didapatkan pada 15-F2t-IsoPs, yang dapat menyebabkan vasokonstriksi pada ginjal, arteri pulmonal dan koroner, pembuluh retina dan vena porta, serta diduga bekerja melalui aktivasi reseptor yang analog atau identik dengan reseptor thromboxane A2.15-F2t -IsoPs juga didapatkan merangsang sintesis DNA dan proliferasi sel pada endotel dan sel otot vaskuler (Montuschi et al., 2004; Comporti et al., 2008). Penelitian pada dekade terakhir ini menyatakan bahwa senyawa F2 -IsoPs akurat dalam mengukur peroksidasi lipid dan memiliki peran dalam mengukur kerusakan akibat oksidan pada penyakit seperti aterosklerosis, penyakit alzeimer dan paru–paru (Pilacik et al., 2002). Peningkatan kadar F2-IsoPs dalam plasma dan urin telah dilaporkan pada alcoholic liver disease, diabetes mellitus (DM), arthritis rheumatoid, aterosklerosis,
obesitas, asma, alergi, alzheimer, perokok, dan berbagai kerusakan hepar yang diinduksi karbon tetraklorida (CCl4) dan asetaminofen. Kadar F2-IsoPs yang tinggi juga didapatkan pada kondisi iron overload (Comporti et al., 2008; Matayatsuk et al., 2007). Namun kadarnya menurun pada pasien yang diberi suplemen antioksidan, pengobatan DM, penurunan berat badan, serta berhenti merokok, dan obat golongan inhibitor cyclooxygenase (Cadenas dan Packer, 2002).
individu sehat ( ± ± kadar F2-IsoPs ur
kreatinin urin(Ma F2-isoprost dengan prostagl al., 2007; Com
radikal arakidoni regioisomer PG kemudian masi masing-masing dapat tereduksi
IsoPs kebanyaka -
-epiPGF2α ,, yang
F2t-isoprostan (Mont
Gambar 3. Pembent
Pada pene
-atau 8-epiPGF2
-manusia dan die diteliti, dan di dug 2014).
t (0,39±0,15 pg/mL vs 0,18±0,03 ng/mL). S - s urin3,38 ± 2215 ng/mg kreatinin urin vs 0,86
(Matayatsuk et al., 2007).
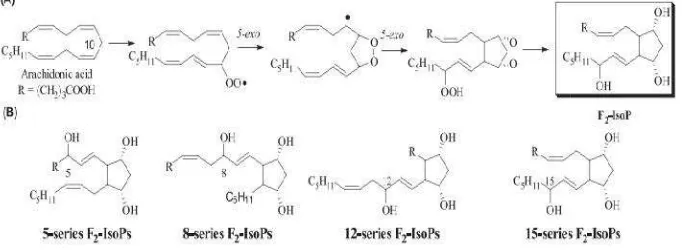
soprostan terdiri dari 64 zat yang mempunyai aglandin F2α (PGF2α ) (Montuschi et al., 2004;
omporti et al., 2008). Setelah peroksidasi AA kidonil yang akan mengalami endosiklisasi
PGH2-like bycyclic endoperoxidase intermedi asing-masing tereduksi menjadi regiosiomer ng terdiri dari 8 diastereoisomer racemic. H2 -duksi menjadi E2 dan D2-IsoPs. Kelanjutan m
akan tidak diketahui, kecuali 15-F2t-IsoPs da - -ng metabolit urin utamanya adalah
2,3-Dinor-n (Mo2,3-Dinor-ntuschi et al., 2004; Comporti et al., 2008
bentukan radikal bebas yang diinduksi oleh oksidas 2007).
penelitian ini yang akan diperiksa adalah isom -- F2α ,, salah satu isomer dari F2-IsoPs yang di
diekskresi melalui urin. Isomer ini telah banya di duga dapat mewakili isomer isoprostan lainny
± ± . Sedangkan rerata
- 0,86 ± 0,55 ng/mg
ai struktur isomer 2004; Matayatsuk et AA terbentuk tiga si menjadi empat ediate (H2-IsoPs), er cincin F, yang H2-Isoprostan juga metabolisme dari dan 8 F2-IsoPs/8 - nor-5,6-dihydro-15-., 2008).
dasi AA (Yan et al.,
isomer 8 F2-IsoPs
- - g diproduksi pada
4. Mekanisme Gangguan Fungsi Ginjal Pada TBM
Gangguan fungsi ginjal pada TBM disebabkan oleh multifaktorial,
tetapi iron overload dan anemia kronik serta efek terapi khelasi besi
merupakan faktor penyebab utama. Penelitian eksperimental pada tikus
yang diberikan besi dalam jumlah tinggi (iron-loaded rats) memperlihatkan
proteinuria dengan deposit besi secara jelas tampak pada glomerulus,
tubulus proksimal dan interstisial dengan adanya gejala glomerulosklerosis,
atrofi tubulus, dan fibrosis intertisial (Bakr et al., 2014).
Ginjal merupakan organ tubuh dengan perfusi paling baik, namun tekanan oksigen jaringan pada parenkim ginjal jauh lebih rendah dibandingkan organ lain dan tekanan terendah ada pada vena ginjal. Medula ginjal merupakan salah satu bagian tubuh dengan tekanan oksigen terendah. Perbedaan ini dijelaskan oleh adanya asupan oksigen yang tinggi dan tekanan oksigen jaringan yang rendah serta arsitektur unik vaskuler ginjal. Pada korteks dan medula ginjal, cabang-cabang arteri dan vena ginjal berjalan secara pararel dan kontak erat antara satu dengan yang lain dalam jarak yang panjang. Hal ini memberikan kesempatan difusi oksigen dari sistem arteri menuju sistem vena sebelum masuk menuju kapiler. Mekanisme ini menjelaskan rendahnya tekanan oksigen di medula dan korteks ginjal (Eckardt et al., 2005).
membuktikan peranan iskemia kronik akibat kapiler derangement sebagai mediator PGK (Nangaku, 2006).
Hipoksia pada ginjal juga dapat menyebabkan peningkatan aktivasi protein kinase C (PKC) pada sel mesangial ginjal yang merupakan molekul
penting untuk pertumbuhan dan diferensiasi sel. Hipoksia ginjal juga akan meningkatkan kadar kalsium (Ca) intraseluler sel mesangial. Sementara stres oksidatif pada ginjal dapat menyebabkan penurunan kadar nitrit oxide (NO), dan peningkatan endotelin (ET) yang menyebabkan vasokontriksi arteri ginjal, peningkatan transforming growth factor β 1 (TGF β 1) yang dapat memacu sintesis matriks ekstraseluler dan menekan degradasinya sehingga dapat menyebabkan fibrosis glomerulus dan apoptosis sel epitel tubulus ginjal (Tanaka et al., 2004).
Kelebihan zat besi pada ginjal dapat dikurangi dengan terapi khelasi besi yang diberikan secara oral maupun lewat infus. Obat khelasi besi selain bermanfaat namun juga berbahaya karena mengandung bahan kimia. Sebagian besar zat besi diekskresikan melalui feses dan < 10 % lewat urin, dengan cara mengeliminasi atau mengurangi ikatan serum non transferin besi. Obat khelasi besi ini diabsorbsi dan bersirkulasi selama beberapa jam. Dalam jangka waktu yang lama maka beban ekskresi ginjal akan bertambah dan mengakibatkan kerusakan ginjal. Ginjal juga berfungsi sebagai pengatur produksi sel darah merah, dengan mensekresikan eritropoitin yang merangsang pembentukan sel darah merah. Hampir 90% dari seluruh eritropoetin dibentuk dalam ginjal. Pembentukan sel darah merah pada TBM lebih cepat sehingga ginjal akan lebih sering mensekresikan eritropoitin untuk pembentukan sel darah merah baru, yang dapat mengakibatkan kerusakan fungsi ginjal (Qodariah, 2006; Fathoni, 2008).
Penelitian di Italia yang dilakukan lebih dari 10 tahun lalu dengan
melibatkan jumlah sampel penderitatalasemiasebanyak 7731 (thalassaemia
carriers) dan di Canada yang melibatkan jumlah sampel 216 terdiri dari 188
pasien talasemia beta minor dan 27 pasien talasemia beta Hb H/E,
3,1% (n=240) da
terbaru menunj
terjadi gangguan
(Bhandari dan
fungsi ginjal pad
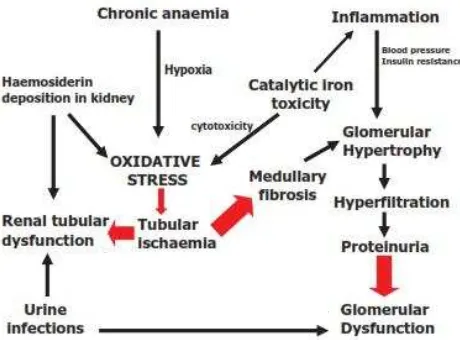
Gambar 4. Meka
Hasil pe korelasi antara pada penderita kelebihan besi da berdisosiasi (da memproduksi R membran tubulus berikatan denga memasuki sitopl memproduksi R
Anemia peroksidasi lipi dilakukan oleh korelasi antara TBM yang dit
) dari pasien menjalani terapi dialisis. Studi
nunjukkan bahwa pada semua grup talasemia uan fungsi ginjal 7,8% dan albuminuria hingga
dan Galanello, 2012). Secara ringkas, mekani pada pasien TBM dapat dilihat pada gambar 4.
kanisme gangguan fungsi tubulus dan glomerulus g TBM (Bhandari dan Galanello, 2012).
penelitian Michaelakakis et al. (1997) menunj ra kadar feritin serum dan penanda kerusakan ta TBM. Hal tersebut juga membuktikan adany si dan toksisitas pada tubulus ginjal. Besi yang
(dari transferin) dalam suasana asam di tubul oduksi ROS dengan akibat terjadinya kerusakan pada
ubulus ginjal. Apabila besi memasuki sel tubul ngan transferin, pelepasan besi terjadi dalam sitoplasma dalam bentuk besi bebas yang oduksi ROS dan jejas sel (Nangaku, 2006).
ia kronik berkaitan dengan stres oksidatif yang lipid dan abnormalitas fungsi sel tubulus. P oleh Sumboonnanonda et al. (1998) menunj ra abnormalitas tubulus dengan derajat anem diterapi deferasirox dan deferipron. Mekani
udi cross sectional
ia termasuk TBM ngga 59% dari kasus
kanisme gangguan 4.
us ginjal pada pasien
nunjukkan adanya kan tubulus ginjal danya kaitan antara ng berlebihan akan ubulus proksimal, pada brush border ubulus ginjal masih lam lisosom dan ng reaktif, dapat
terjadinya gangguan fungsi ginjal yang berkaitan dengan pemberian deferasirox masih belum diketahui dengan pasti. Beberapa hipotesis
mengemukakan hal tersebut berkaitan dengan reaksi alergi berlebihan (hyperergic reaction) dan adanya overkhelasi akibat deferasirox yang menurunkan besi dalam tubuh secara mendadak sehingga mempengaruhi LFG (Maxwell, 2003).
Hipoksia pada sel ginjal mengakibatkan penekanan pada penyimpanan energi, perubahan gradien elektrolit, disrupsi dari actin cytoskeleton, aktivasi fosfolipase dan perubahan ekspresi gen. Hipoksia
ginjal menginduksi hilangnya polaritas epitel tubulus proksimal dan induksi selektif fragmentasi dioxyribonucleic acid (DNA) pada gen growth-response yang memicu apoptosis medula ginjal. Jejas iskemi pada vaskular
ginjal mengakibatkan peningkatan aktifitas renovaskular dan menginduksi antigen histokompatibilitas pada sel tubulus ginjal dan intercellular adhesion molecules (ICAM) pada sel endotel menyebabkan agregasi
trombosit dan netrofil (Kelly et al., 1994).
Kerusakan ginjal yang sudah mencapai batas adaptasinya akan berlanjut secara konsisten dan tidak dapat diperbaiki kembali hingga berlanjut ke arah PGK dengan tahapan sebagai berikut:
Tabel 3. Klasifikasi PGK berdasarkan kategori LFG (KDIGO, 2013) Kategori
LFG
Keterangan LFG(mL/menit/1,73 m²)
G1 Kerusakan ginjal dengan fungsi ginjal normal atau meningkat
≥ 90
G2 Kerusakan ginjal dengan penurunan fungsi ginjal ringan
60-89 G3a Penurunan fungsi ginjal ringan-sedang 45-59 G3b Penurunan fungsi ginjal sedang-berat 30-44
IV Penurunan fungsi ginjal berat 15-29
V Gagal ginjal <15
berbagai cara sehingga terjadi gangguan aliran darah dan mengakibatkan jejas iskemi pada nefron (Nangaku, 2006).
Penelitian tentang gangguan fungsi ginjal pada TBM khususnya yang membahas eLFG telah banyak dilakukan meskipun hasilnya masih kontradiktif. Sebagian besar hasil penelitian terdahulu menyebutkan adanya hiperfiltrasi glomerulus (HG), namun sebagian menunjukkan adanya penurunan eLFG atau normal. Hiperfiltrasi glomerulus diduga sangat berperan penting sebagai penanda awal kerusakan ginjal. Hingga saat ini penyebab HG masih belum diketahui secara jelas mekanismenya, namun adanya tubuloglomerular feedback dan aktivasi mediator vasoaktif seperti nitric oxide (NO), Cox-2 derived prostanoid, sistem renin angiotensin,
protein kinase-C (PKC) dan endothelin (ET) terkait dengan HG melalui
mekanisme peningkatan tekanan glomerulus, akan menyebabkan peningkatan LFG yang dikenal dengan HG (Sasson dan Cherney, 2012). Patofisiologi penyakit ginjal kronik pada awalnya tergantung pada penyakit yang mendasarinya, tapi dalam perkembangan selanjutnya proses yang terjadi kurang lebih sama. Pengurangan massa ginjal mengakibatkan hipertrofi struktural dan fungsional nefron yang masih tersisa (surviving nephron) sebagai upaya kompensasi, yang diperantarai oleh molekul
vasoaktif seperti sitokin dan growth faktor. Hal ini mengakibatkan terjadinya hiperfiltrasi, yang diikuti oleh peningkatan tekanan kapiler dan aliran darah glomerulus. Proses adaptasi ini berlangsung singkat, akhirnya diikuti dengan penurunan fungsi nefron yang progresif, walaupun penyakit dasarnya sudah tidak aktif lagi. Adanya peningkatan aktivitas aksis renin-angiotensin aldosteron intrarenal, ikut memberikan kontribusi terhadap terjadinya hiperfiltrasi, sklerosis dan progresifitas tersebut. Aktivasi jangka panjang aksis renin-angiotensin-aldosteron, sebagian diperantarai oleh growth factor seperti transforming growth factor β (TGF-β ). Terdapat
Hiperfiltrasi glomerulus telah dilaporkan dapat terjadi pada pasien DM, sickle cell disease, talasemia, hipertensi, hiperaldosteronisme, kehamilan, dan obesitas/sindrom metabolik. Meski HG berperan penting pada tahap awal PGK, ini hanya merupakan satu dari beberapa mekanisme yang menyebabkan insufisiensi ginjal (Raes et al., 2007). Teori yang paling dapat diterima adalah bahwa hiperfiltrasi pada nefron ginjal yang tersisa setelah terjadi kehilangan nefron akibat lesi. Peningkatan tekanan glomerular menyebabkan hiperfiltrasi ini. Hiperfiltrasi terjadi sebagai konsekuensi adaptif untuk mempertahankan LFG, namun kemudian akan menyebabkan cedera pada glomerulus. Permeabilitas glomerulus yang abnormal umum terjadi pada gangguan glomerular, dengan proteinuria sebagai tanda klinis (Conchol, 2005).
Brenner et al. (1996) mengatakan bahwa insufisiensi ginjal pada manusia dapat berkembang ke arah PGK, sebagai kompensasi gangguan hemodinamik glomerulus. Adapun faktor yang berperan utama adalah gangguan hemodinamik pada glomerulus yang berakibat HG. Hiperfiltrasi glomerulus merupakan gangguan hemodinamik yang dapat di monitor sebagai penanda awal gangguan fungsi ginjal lebih lanjut. Prognosis dari hiperfiltrasi terkait dengan penyakit yang mendasarinya serta tata laksana serta kepatuhan pasien dalam menjalani terapi. Dalam kurun waktu 3 dekade, hiperfiltrasi dapat berkembang ke arah proteinuria dan glomerulosklerosis. Hiperfiltrasi yang berlangsung lama akan menyebabkan renal injury. Hiperfiltrasi dapat terjadi pada kondisi patologi meskipun saat
massa renal intact seperti pada DM yang dapat mengakibatkan nefropati.
Hiperfiltrasi glomerulus dianggap sebagai awal dari mekanisme patogenik dalam laju kerusakan ginjal. Hal ini terjadi pada saat jumlah nefron mengalami pengurangan progresif, glomerulus akan melakukan kompensasi dengan meningkatkan filtrasi nefron yang masih sehat dan pada akhirnya nefron yang sehat menjadi sklerosis. Peningkatan LFG pada TBM kemungkinan disebabkan oleh dilatasi arteriol aferen karena stres oksidatif, yang diperantarai hormon vasoaktif, insulin growth factor-1 (IGF-1), nitric oxide (NO), dan PG. Hiperfiltrasi akan menyebabkan terjadinya filtrasi protein, yang pada keadaan normal tidak terjadi. Bila terjadi reabsorbsi tubulus terhadap protein meningkat, maka akan terjadi akumulasi protein dalam sel epitel tubulus dan menyebabkan pelepasan sitokin inflamasi seperti ET-1, osteopontin, dan monocyte chemoatractant protein-1 (MCP-1). Faktor tersebut akan mengubah ekspresi sitokin pro inflamasi dan infiltrasi sel mononukleus, menyebabkan kerusakan tubulo-interstitial dan terjadi renal scaring/renal injury (Ziyadeh et al., 2012).
5. Pemeriksaan Laboratorium Fungsi Ginjal a. Kreatinin Serum
Kreatinin serum hingga saat ini dikenal sebagai penanda awal
Metode pemeriksaan kreatinin yang sering digunakan adalah metode Jaffe, namun metode ini memiliki banyak kelemahan terkait dengan efek kromogenik sehingga dikembangkan pemeriksaan enzimatik. Mazzachi et al. (2000) melaporkan bahwa teknik secara enzimatik memberikan hasil yang lebih akurat dan lebih spesifik dibandingkan metode Jaffe sehinggga teknik enzimatik sering digunakan untuk praktek klinis dalam rangka menghasilkan estimasi yang layak. Penggunaan serangkaian enzim meningkatkan selektifitas untuk mendeteksi kreatinin, walaupun membutuhkan biaya yang mahal. Metode enzimatik yang telah dimodifikasi adalah metode yang presisi dan akurat, menggunakan sedikit sampel, dan mampu memeriksa sampel pasien dengan cepat (± 20 menit). Mereka menyimpulkan bahwa metode enzimatik cocok sebagai diagnostik laboratorium rutin untuk memeriksa kreatinin plasma, partikel keton pasien diabetes, neonatus, dan pasien yang mendapat terapi sefalosporin (Cirillo, 2010). Tabel berikut adalah kadar normal kreatinin serum menurut usia (Pagana dan Pagana, 2014). Tabel 4. Nilai rujukan kreatinin serum (Pagana dan Pagana, 2014).
Usia (tahun) Kadar kreatinin (mg/dl)
< 2 0,1−0,4
2− <6 0,2–0,5
6− < 10 0,3–0,6
10− < 18 0,4–1,0
18− < 41(laki−laki) 18− < 41(perempuan)
0,5–1,0 0,6− 1,2
klirens kreatinin dengan variabel yang mudah didapatkan, yaitu kreatinin serum, jenis kelamin, umur dan berat badan (Cirillo, 2010).
b. Laju Filtrasi Glomerulus
Laju filtrasi glomerulus merupakan laju filtrasi dari semua nefron yang berfungsi. Glomerulus ginjal sebagai unit filtrasi ginjal menyaring kira kira 180 L/hari (125 mL/menit) dari plasma. Laju filtrasi glomerulus mengukur klirens urin/plasma terhadap marker filtrasi ideal, misalnya inulin, atau marker eksogen seperti iothalamate, diethylene triamine penta acetic acid & iohexol. Pengukuran LFG memerlukan proses yang
invasif dan waktu yang lama, sehingga tidak dianjurkan untuk dilakukan dalam praktek klinik (Stevens et al., 2006). Cara terbaik dan teliti untuk mengukur LFG adalah dengan klirens inulin. Namun uji ini jarang dilakukan dalam klinik karena melibatkan proses intravena dengan kecepatan yang konstan, pengumpulan urin pada saat saat tertentu dengan kateter, dan invasif (Price dan Wilson, 2005).
Laju filtrasi glomerulus telah diterima secara luas sebagai indeks terbaik untuk menilai fungsi ginjal. Pengukuran LFG merupakan hal yang penting dalam pengelolaan pasien dengan penyakit ginjal. Selain untuk menilai fungsi ginjal secara umum, pengukuran LFG juga untuk mengetahui dosis obat yang tepat yang dapat dibersihkan oleh ginjal, untuk mendeteksi secara dini adanya gangguan ginjal, mencegah gangguan ginjal lebih lanjut, mengelola pasien dengan transplantasi ginjal, dan dalam penggunaan kontras media radiografik yang berpotensi nefrotoksik. Karena itu diperlukan pemeriksaan LFG yang mempunyai nilai akurasi yang tinggi (Stevens dan Levey, 2009).
besar serta tidak praktis, dan kurang ideal untuk aplikasi rutin atau penggunaan klinik dalam jumlah yang banyak. Saat ini penanda endogen yang paling sering digunakan adalah kreatinin serum, baik secara tunggal maupun dikombinasikan dengan urin tampung 24 jam untuk menentukan bersihan kreatinin. Beberapa faktor dapat berpengaruh terhadap ketepatan penggunaan kreatinin untuk uji fungsi ginjal, seperti ketelitian dalam mengukur jumlah urine 24 jam, pengaruh massa otot terhadap produksi kreatinin endogen, asupan daging, aktivitas fisik, adanya sekresi kreatinin di tubulus ginjal, pengaruh obat-obatan, dan masalah analitik metode pemeriksaan kreatinin (Lamb et al., 2006). Klirens kreatinin sering dipergunakan untuk menentukan besarnya LFG. Pemeriksaan klirens kreatinin dilakukan dengan mengumpulkan urin selama 24 jam, namun kelemahan pemeriksaan klirens kreatinin adalah senantiasa ada bias dalam penampungan urin 24 jam (Martakusumah, 2012).
Metode rujukan untuk menentukan nilai LFG pada anak adalah inulin clearance, namun marker eksogen sangatlah mahal dan tidak
mudah diterapkan dalam praktek klinik sehingga Pierrat et al. (2003) mencoba membandingkan beberapa metode pengukuran eLFG pada anak menggunakan Cockcroft-Gault, Schwartz, dan Modification of Diet in Renal Disease (MDRD), yang akhirnya pada satu simpulan bahwa
Cockcroft-Gault dapat digunakan pada anak usia 12 tahun dan dewasa,
pada anak usia < 12 tahun, dan tidak ada formula yang memuaskan untuk menilai eLFG. Sementara Delanghe (2009) merekomendasikan formula Schwartz dan Counahan Barrat untuk menilai eLFG pada anak. Selistre
et al. (2012) merekomendasikan formula Schwartz untuk menilai eLFG
pada anak-anak (usia < 18 tahun) berdasarkan penelitiannya yang menunjukkan adanya kesesuaian/korelasi yang baik antara formula Schwartz dengan inulin clearance sebagai metode baku emas pengukuran
Gambar 5. Perbandingan antara formula Schwartz dan inulin clearance (Selistre et al., 2012).
Penelitian ini menggunakan formula Schwartz untuk menilai eLFG sebagai salah satu parameter penanda fungsi ginjal pada pasien TBM. Rumus perhitungan eLFG berdasarkan formula Schwartz adalah sebagai berikut(Filler et al., 2002):
eLFG = k x L/Scr
keterangan : eLFG : estimated LFG (mL/menit/1,73 m2) L : tinggi badan (cm)
Scr : serum kreatinin (mg/dL)
K : konstanta (bayi aterm: 0,45; anak dan remaja putri 0,55; remaja putra: 0,7)
B. Kerangka Pikir
Gambar 6. Bagan kerangka pikir
C. Hipotesis Penelitian
Terdapat korelasi antara kadar F2-IsoPs urin dan eLFG pada pasien TBM. Talasemia beta mayor (mutasi rantai globin β )
Anemia kronik Iron overload Terapi khelasi besi
Stres oksidatif Nefrotoksik
Peroksidasi lipid membran sel
glomerulus dan tubulus ginjal Gangguan fungsi ginjal
Glomerulus ginjal Tubulus ginjal
↑ endotelial injury
↑ ROS, ↓ NO
Iskemia tubulus
Apoptosis sel epitel tubulus
↑ Ca sitosolik pada
arteriol aferen
↑ mediator inflamasi
(TNF α , IL 18)
↑ sensitivitas terhadap
vasokonstriksi ↓ NO, ↓ ET
ICAM 1, P selectin endotel
↑ adhesi netrofil ↑ radikal bebas
kreatinin serum eLFG
Pembentukan F2‒ IsoPs
urin
↑ F2‒ IsoPsurin
Korelasi? Gangguan fungsi
tubulus
Keterangan:
: Mempengaruhi proses selanjutnya
30
Penelitian ini merupakan penelitian analitik observasional dengan pendekatan cross sectional untuk menilai korelasi kadar F2-IsoPs urin dengan eLFG pada pasien TBM.
B. Tempat dan Waktu Penelitian
Penelitian dilakukan di Instalasi Patologi Klinik Rumah Sakit Umum Daerah Dr Moewardi (RSDM) di Surakarta. Waktu penelitian mulai bulan Mei-Juni 2016.
C. Subjek Penelitian
1. Populasi dan Sampel Penelitian
Populasi pada penelitian ini adalah pasien anak‒ anak dengan diagnosis TBM yang datang ke Instalasi rawat jalan Bagian Ilmu Kesehatan Anak (IKA) dan Bangsal Talasemia yang dilakukan pemeriksaan laboratorium ke Instalasi Patologi Klinik RSDM. Pemilihan subjek penelitian dilakukan secara consecutive sampling (berurutan), subjek dipilih berdasarkan kriteria inklusi dan eksklusi. Besar sampel yang digunakan untuk penelitian ini berdasarkan rumus untuk besar sampel pada penelitian analitik korelatif (Dahlan, 2010). Perkiraan besar sampel memakai rumus besar sampel untuk penelitian analitik korelatif, yaitu (Dahlan, 2010):
Z+ Z 2
N = + 3
0,5 ln [(1+r)/(1-r)]
Kesalahan tipe I 5 %, Zα (deviat baku alfa) 1,64 dengan tingkat keyakinan 95%, dan Zβ (deviat baku beta) 1,28. Penelitian Ilyasofa et al. (2012) yang mengkaji korelasi F2‒ IsoPs urin dengan tingkat keparahan pasien diabetes mellitus (DM) tipe 2 dengan jumlah subjek penelitian 138,
Keterangan :
Zα : deviat baku alfa
didapatkan korelasi dengan nilai r (koefisien korelasi) = 0,6, sehingga didapatkan jumlah sampel minimal untuk penelitian ini 24 sampel. Untuk mengantisipasi adanya kemungkinan ekslusi maka ditambahkan 10% dari hasil perhitungan sehingga pada penelitian ini didapatkan besar sampel 30.
2. Kriteria Inklusi dan Eksklusi
Subjek penelitian adalah populasi terjangkau yang memenuhi kriteria penelitian. Kriteria inklusi dan ekslusi subjek penelitian adalah sebagai berikut:
Kriteria inklusi:
a. Umur 18 tahun (Kishore dan Tabor, 2010).
b. Diagnosis TBM oleh klinisi berdasarkan hasil laboratorium (pemeriksaan Hb elektroforesis).
c. Riwayat transfusi berulang 10‒ 15 kali (lebih dari 1 tahun), dinilai dari anamnesis dan rekam medis mengenai adanya terapi transfusi rutin. d. Riwayat terapi khelasi besi dari klinisi, data didapatkan dari anamnesis
dan rekam medik.
e. Pasien-pasien tanpa gejala dan tanda infeksi saluran kencing (ISK), diketahui dari anamnesis, pemeriksaan fisik, data hasil pemeriksaan laboratorium, rekam medik dan inspeksi urin secara visual dari warna dan kekeruhan urin.
Kriteria eksklusi:
a. Riwayat penyakit hepar dan ginjal (selain akibat dari terapi TBM), dinilai dari anamnesis, pemeriksaan fisik, data hasil pemeriksaan laboratorium dan rekam medis.
b. Pasien infeksi, dinilai dari anamnesis, pemeriksaan fisik, data hasil pemeriksaan laboratorium dan rekam medis.
d. Pasien TBM yang mendapat terapi anti inflamasi non steroid (AINS) golongan inhibitor cyclooxygenase dinilai dari anamnesis dan rekam medis.
D. Bahan dan Alat Penelitian 1. Bahan
a. Kit reagen 8-IsoPs EIA, Cayman Chemical. Sudah termasuk sebuah plate 96 sumuran.
b. Sampel darah untuk pemeriksaan kreatinin serum c. Sampel urin untuk pemeriksaan F2‒ IsoPs
d. Kit pemeriksaan dan reagen (Insert Kit ILab 650, 2010). 1) Konteiner/cup sampel
2) Larutan sistem
3) Kalibrator dan kontrol 4) Reagent container adapters
Reagen yang digunakan terdiri dari reagen Creatinin E R1, yang mengandung Creatinase >12 IU/mL, TOOS > 0,07mg/mL, Sarcosine Oxidase (SOD)>4I U/mL dan reagen Creatinin E R2 yang
mengandung Creatinase >135 IU/mL, 4-AA > 0,3mg/mL, Peroxidase (POD) >2 U/mL. Semua reagen sudah dalam sediaan siap pakai, namun harus di homogenisasi sebelum digunakan dan pastikan tidak ada gelembung udara.
2. Alat
a. Plate reader dengan kemampuan membaca absorbance 405-420 nm b. Bio-Rad 680 Microplate Reader
c. ILab 650
d. Micropipette multichannel e. Pipet adjustable
f. ‘Ultra Pure’ water (air yang sudah dideionisasi dan bebas kontaminan organik)
h. Tabung kaca i. Orbital shaker
j. Tissue
k. Cuvette
l. Spuit 5 cc
m. Tabung sampel dengan clot activator n. Tabung urin/pot urin
o. Tabung aliquot
E. Cara, Prosedur dan Skema Alur Penelitian 1. Cara penelitian
Penelitian dilakukan pada subjek yang memenuhi kriteria inklusi dan eksklusi, pada pasien TBM yang datang ke Instalasi poliklinik rawat jalan bagian IKA dan Bangsal Talasemia yang dilakukan pemeriksaan laboratorium di Instalasi Patologi Klinik RSDM di Surakarta. Subjek dipilih secara konsekutif, pendataan identitas, anamnesis dan pemberian informed consent dilakukan di tempat.
Pada subjek dilakukan pengambilan darah vena secara closed system, ke dalam dua tabung dengan clot activator. Kemudian sampel
tersebut disentrifugasi selama 10–15 menit dengan kecepatan 6000 rotations per minute untuk diambil serumnya. Serum tersebut kemudian
dipindahkan pada tabung aliquote untuk disimpan pada suhu -20oC hingga dianalisis untuk pemeriksaan kreatinin serum.
Pada subjek juga dilakukan pengambilan sampel urin sewaktu untuk pemeriksaan kreatinin urin dan F2‒ IsoPs urin sebanyak 6 ml. Pisahkan 1 mL urin ke dalam tabung yang telah diberi identitas untuk diperiksa kreatinin urin. Sampel urin untuk pemeriksaan F2‒ IsoPs urin dipindahkan padah 2 tabung khusus polypropilene 5 ml yang telah diberi
20 μ l butylated hydroxytoluene (BHT) dan 20 μ l indometasin
2014). Penyimpanan sampel untuk pemeriksaan F2-IsoPs urin dilakukan di laboratorium yang sudah terstandar internasional di Surakarta. Sampel yang akan dianalisis/diperiksa kadar F2-IsoPs urin dikirim ke laboratorium pusat terstandar internasional di Jakarta. Sampel dikemas dalam aliquote dimasukkan ke dalam wadah styrofoam yang telah diberi gel icepack untuk dikirim ke Jakarta. Setiba di laboratorium pusat sampel disimpan pada suhu-20oC sampai saat akan analisis.
2. Prosedur Penelitian
a. Metode Pemeriksaan F2-IsoPs urin
Pemeriksaan F2-IsoPs urin dengan metode EIA menggunakan Kit reagen 8-IsoPs EIA (Cayman Chemical). Prinsip pemeriksaan ini adalah kompetisi antara F2-IsoPs sampel dengan konjugat F2-IsoPs acetylcholinesterase (AChE) (8-IsoPs tracer) untuk menempati
binding site spesifik 8-IsoPs dari antiserum kelinci. Jumlah 8-IsoPs
tracer yang dapat mengikat antiserum kelinci akan berbanding
terbalik dengan konsentrasi F2-IsoPs pada sampel. Kompleks antiserum kelinci dengan F2-IsoPs akan mengikat antibodi monoklonal anti kelinci dari tikus yang sudah ditempatkan di permukaan sumuran. Kemudian plate dicuci untuk membuang reagen yang tidak terikat, dan reagen Ellman (yang mengandung substrat yang dapat bereaksi dengan AChE) ditambahkan. Produk reaksi enzimatik ini memberikan warna kuning dan mempunyai absorbance kuat pada panjang gelombang 412 nm. Intensitas warna yang diukur secara spektrofotometris, adalah proporsional dengan jumlah 8-IsoPs tracer yang terikat dengan sumuran, dan berbanding terbalik dengan
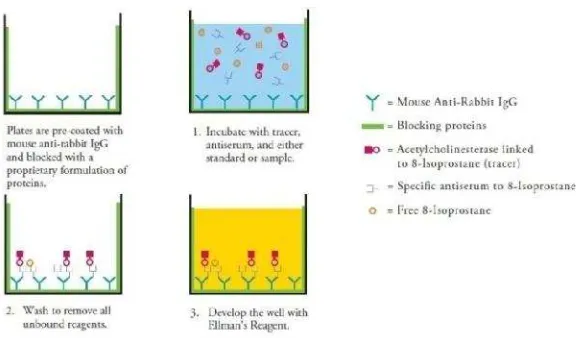
Gambar 7. Skema pemeriksaan F2-IsoPs secara EIA (Anonim, 2014).
Komponen reagent kit pemeriksaan 8-IsoPs yang tersedia terdiri dari (Anonim, 2014):
1) 8-IsoPs EIA antiserum
2) 8-IsoPs AChE tracer
3) 8-IsoPs EIA standard
4) EIA buffer concentrate (10x) 5) Wash buffer concentrate (400x) 6) Polysorbate 20
7) Mouse anti-rabbit imunoglobulin G (IgG) coated plate
8) 96-well cover sheet
9) Ellman’s reagent
10) EIA tracer dye 11) EIA antiserum dye
1. Mempersiapkan larutan standar F2-IsoPs dan reagen. a. Mempersiapkan larutan-larutan standar F2-IsoPs
Gambar 8. Preparasi larutan-larutan standar F2-IsoPs (Anonim, 2014). b. Rekonstitusi 8-IsoPs AChE tracer dengan cara menambahkan 6
ml EIA buffer dengan satu vial tracer.
c. Rekonstitusi 8-IsoPs EIA Antiserum dengan cara menambahkan 6 ml EIA buffer dengan satu vial antiserum.
Gambar 9. Format plate sampel (Anonim, 2014). 2. Memasukkan reagen dan sampel.
a. Masukkan 100 L EIA buffer ke sumuran-sumuran NSB, dan 50L EIA buffer ke sumuran-sumuran B0.
b. Masukkan 50 L dari tabung standar #8 ke sumuran-sumuran S8. Lalu masukkan 50 L dari tabung standar #7 ke sumuran-sumuran S7. Lakukan hal serupa pada semua tabung dan sumuran standar.
c. Masukkan masing-masing 50 L sampel ke sumuran masing-masing sampel.
d. Tambahkan 50 L 8-IsoPs AChE tracer ke semua sumuran kecuali sumuran-sumuran TA dan Blk.
e. Tambahkan 50 L 8-IsoPs EIA antiserum ke semua sumuran kecuali sumuran-sumuran TA, NSB, dan Blk.
3. Inkubasi plate: tutup plate dengan 96-well cover sheet kemudian inkubasi selama 18 jam pada suhu 4oC.
4. Plate development
a. Lakukan rekonstitusi Ellman’s reagent sesaat sebelum digunakan, dengan cara menambahkan 20 ml air ultra pure dengan tiga vial reagen.
b. Kosongkan sumuran-sumuran dan bilas sebanyak lima kali dengan wash buffer.
c. Masukkan 200LEllman’sreagent ke semua sumuran. d. Tambahkan 5L EIA tracer dye ke sumuran-sumuran TA. e. Tutup plate dengan film plastik. Development optimal dicapai
dengan menggunakan orbital shaker dan plate berada di daerah gelap dengan suhu ruang. Ditunggu selama 90 sampai 120 menit.
5. Pembacaan plate
a. Seka bagian bawah plate dengan tissue bersih untuk menghapus sidik jari dan kotoran.
b. Buka tutup plate dengan hati-hati sehingga tidak ada Ellman’sreagent yang tumpah/terambil.
c. Baca plate dengan panjang gelombang antara 405 sampai 420 nm. Plate dibaca saat absorbansi sumuran-sumuran B0berada dalam range 0,3–1,0 absorbance unit (AU).
d. Deteksi limit : 0,027−5ng/ml.
Tabel 5. Spesifisitas 8-IsoPs EIA antiserum (Anonim, 2014).
Zat Cross
reactivity Zat
Cross reactivity
8-IsoPs 100% 2,3-dinor-6-keto PG F1 0,09%
8-iso PG F2
ethanolamide
100% 8-iso PG F1 0,08%
8-iso PG F3 20,6% thromboxane B2 0,08%
2,3-dinor-8-iso PG F2 4,00% 11-dehydro
thromboxane B2
0,07%
8-iso PG E2 1,84% 11- PG F2 0,03%
2,3-dinor-8-iso PG F1 1,70% PG E2 0,02%
8-iso PG E1 1,56% 8-iso-15(R)- PG F2 0,02%
PG F1 0,71% 8,12 epi iPF2-III 0,01%
PG F3 0,66% iPF2-VI <0,01%
PG E1 0,39% 8,12 epi iPF2-VI <0,01%
PG F2 0,14% 13,14-dihydro-15-keto
PG F2
<0,01%
b. Metode Pemeriksaan kreatinin serum dan kreatinin urin 1. Prinsip pemeriksaan
Pemeriksaan kreatinin serum dan kreatinin urin pada penelitian ini menggunakan metoda enzimatik. Metode pemeriksaan kadar kreatinin secara enzimatik dilakukan dengan mencampur kreatinin dalam sampel dengan enzim creatinine amidohidrolase (CRTNase) membentuk sarkosin dan urea. Sarcosine kemudian akan dikatalisis oleh sarcosine oksidase
(SOD) membentuk hydrogen peroksida kemudian hydrogen peroksida oleh enzim peroksidase (POD) dioksidasi dan dengan
2. Prinsip reaksi :
Creatinine + H2O creatininase Creatinin Creatin + H2O creatinase Sarcosine + Urea
Sarcosine +H2O + O2 SOD Formaldehyde + Glycine + 2H2O2 2H2O2+ 4 AA + Toos POD 2H2O + Quinone dye + H2O2 3. Cara Kerja
Hasil konsentrasinya dihitung secara otomatis oleh alat kemudian dibandingkan dengan kalibrator. Untuk mengkonversi mg/dL menjadi satuan SI (µmol/L) kalikan dengan 88,4 (Anonim, 2010).
c. Pengukuran Tinggi Badan
Tinggi badan adalah hasil pengukuran maksimum panjang tulang-tulang secara paralel yang membentuk poros tubuh (body axis) yang diukur dari titik tertinggi di kepala (vertex), ke titik
terendah dari tulang kalkaneus yang disebut heel. Tinggi badan merupakan salah satu parameter antropometri yang sangat penting (Barasi, 2009).
3. Skema Alur Penelitian
Gambar 10. Skema alur penelitian F. Identifikasi Variabel Penelitian
Variabel bebas : Kadar F2-IsoPs urin Variabel terikat : eLFG
G. Definisi Operasional Variabel Penelitian
1. Kadar F2‒ IsoPs urin adalah peningkatan kadar F2‒ IsoPs urin, yaitu tanda kerusakan stres oksidatif pada membran sel yang merupakan hasil peroksidasi lipid AA yang disebabkan oleh radikal bebas, yang diperiksa menggunakan 8‒ Iso‒ PGF2α EIA kit dari Cayman Chemical. Pemeriksaan dilakukan di laboratorium riset terstandarisasi di Jakarta. Hasil dinyatakan dalam ng/mg kreatinin urin. Skala pengukuran : rasio. Kadar F2‒ IsoPs urin normal < 2 ng/mg kreatinin urin.
Pasien pediatri dengan diagnosis TBM di bangsal khusus talasemia RSUD Dr Moewardi dan wilayah Surakarta dan
Sekitarnya
Kriteria inklusi - Umur 5-18 tahun - Diagnosis TBM
- Riwayat transfusi berulang - Riwayat terapi khelasi besi - Pasien tanpa gejala ISK
dan kelainanwarna urin secara visual
Kriteri