III.
METODE PENELITIAN
A. Materi, Lokasi dan Waktu Penelitian
1. Materi Penelitian
a. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah mencit, daun pare, air, etanol 96%, etanol 70%, NaCl 0,9%, larutan methylene blue
1%, akuades, pakan mencit, sekam padi, larutan Phospate Buffer Saline
(PBS), larutan Neutral Buffer Formalin (NBF), etanol 80%, 90% dan 100%, xylol, parafin, gelatin 1%, pewarna haematoxylin dan eosin 1% serta entelan new. Spesifikasi bahan dapat dilihat pada Lampiran 1 (Halaman 36).
b. Alat
Alat-alat yang digunakan dalam penelitian ini adalah kandang, timbangan analitik merek CHQ dengan tingkat ketelitian 0,01 g, baskom, saringan, loyang, oven inkubator, blender, tissue, beaker glass ukuran 1 liter, alumunium foil, batang pengaduk, labu Erlenmeyer, corong, kertas saring Whatman nomor 41, cawan petri, plastik, pisau plastik, spidol, lemari es, spuit ukuran 1 ml, sonde, baki preparat, kapas, cotton bud,
object glass,cover glass, pipet tetes, mikroskop cahaya, mikroskop stereo, gunting, pinset, surgical blade, jangka sorong dengan tingkat ketelitian 0,01 mm, botol sampel, cetakan dari kertas karton, blok kayu sebagai
holder, mikrotom rotari, kuas, mangkuk air hangat, kamera digital, pensil dan kertas label. Spesifikasi alat dapat dilihat pada Lampiran 1 (Halaman 36).
2. Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di animal house dan Laboratorium Struktur dan Perkembangan Hewan, Fakultas Biologi, Universitas Jenderal Soedirman selama sepuluh bulan, yakni pada Februari 2014 hingga November 2014.
B. Metode Penelitian
1. Rancangan Percobaan
Penelitian dilaksanakan secara eksperimental, menggunakan rancangan dasar yaitu Rancangan Acak Lengkap (RAL) dengan empat perlakuan dan sembilan ulangan. Keempat perlakuan tersebut adalah pemberian ekstrak etanol daun pare dengan dosis 0 mg.kg-1 berat tubuh (D0), 750 mg.kg-1 berat
tubuh (D1), 1000 mg.kg-1 berat tubuh (D2) dan 1250 mg.kg-1berat tubuh (D3).
Waktu pengamatan terdiri dari pengamatan pada umur perkembangan 6-6,5
dpc (T1), umur perkembangan 12-12,5 dpc (T2) dan umur perkembangan
18-18,5dpc(T3).
2. Variabel dan Parameter Penelitian
Variabel yang diamati dalam penelitian ini adalah perkembangan fetus mencit. Parameter perkembangan yang diukur adalah morfologi (kenormalan bentuk, panjang dan berat tubuh) fetus mencit. Sebagai data pendukung untuk mengetahui laju implantasi dan laju resorpsi, dihitung jumlah fetus, jumlah spot implantasi dan jumlah korpus luteum.
C. Cara Kerja
1. Persiapan Kandang dan Persiapan Mencit
Kandang untuk pengawinan dan pemeliharaan terbuat dari plastik dengan tutup terbuat dari kawat. Ukuran kandang 34,5 cm x 27 cm x 15 cm. Alas kandang diberi sekam padi. Mencit jantan dan mencit betina strain Balb-C dengan berat 28-30 g disiapkan. Seluruh mencit diperoleh dari animal house
Fakultas Biologi, Universitas Jenderal Soedirman.
2. Pembuatan Ekstrak Etanol Daun Pare
Pembuatan ekstrak etanol daun pare dilakukan menurut Badan Pengawas Obat dan Makanan Republik Indonesia (2004), dan dimodifikasi di Laboratorium Struktur dan Perkembangan Hewan, Fakultas Biologi, Universitas Jenderal Soedirman. Daun pare segar dicuci dengan air mengalir dan ditiriskan menggunakan saringan. Daun pare segar yang digunakan adalah daun yang terletak pada bagianintermediate, yakni daun ke-4 hingga daun ke-6
dari sulur, untuk mengoptimalkan perolehan zat aktif. Daun pare yang digunakan diperoleh dari perkebunan di Kelurahan Arcawinangun, Purwokerto. Setelah ditiriskan, daun pare disusun di atas loyang, kemudian dikeringkan menggunakan oven inkubator, selama 2 hari pada suhu 60 oC. Daun pare yang
sudah kering ditimbang berat keringnya, lalu diblender (dihaluskan). Serbuk daun pare dimasukkan ke dalam beaker glass bervolume 1 liter, kemudian ditambahkan etanol 96% dengan perbandingan 100 ml etanol 96 % / 20 g berat kering daun pare. Campuran dihomogenkan dengan pengadukan. Beaker glass
ditutup menggunakanalumunium foildan didiamkan selama 4 hari.
Ekstrak disaring menggunakan corong yang sudah diberi kertas saring Whatman no. 41 berukuran 14 cm x 14 cm. Sisa daun hasil saringan, diekstrak kembali menggunakan etanol 96% dengan perbandingan yang sama seperti sebelumnya. Filtrat ditampung dalam labu Erlenmeyer. Filtrat yang diperoleh dituang ke cawan petri tanpa tutup, dan dikeringkan menggunakan oven inkubator pada suhu 60oC selama 1 hari, hingga didapatkan ekstrak berbentuk
gel. Ekstrak berbentuk gel tersebut diambil dengan cara dikerok secara perlahan menggunakan pisau plastik, dimasukkan ke dalam plastik, ditimbang dan disimpan di dalam lemari es hingga digunakan.
3. Pengamatan Siklus Estrus dan Pengawinan
Fase siklus estrus ditentukan berdasarkan perbandingan antara tiga macam sel pada hasil apus vagina (vaginal smear). Ketiga macam sel tersebut adalah sel leukosit, sel epitel berinti dan sel epitel terkornifikasi. Hasil smear
pada fase proestrus ditunjukkan dengan keberadaan sel-sel epitel berinti secara dominan. Hasil smear pada fase estrus ditunjukkan dengan adanya dominansi sel-sel epitel terkornifikasi(Marcondes et al., 2002).
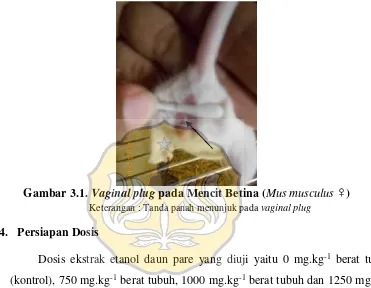
Pengawinan dilakukan dengan cara mengelompokkan 10 ekor mencit jantan dan 40 ekor mencit betina dengan berat 28-30 g yang sedang berada dalam fase proestrus maupun estrus. Tiap kandang berisi 1 ekor mencit jantan dan 4 ekor mencit betina. Evaluasi keberhasilan perkawinan adalah terbentuknyavaginal plug(Gambar 3.1.) pada mencit betina.
Hari terbentuknyavaginal plugpada mencit betina dianggap sebagai hari ke-0 kehamilan atau umur perkembangan 0 dpc. Mencit betina yang telah membentukvaginal plug dipisahkan ke dalam kandang eksperimen dan ditulis
tanggal terbentuknya vaginal plug. Setiap kandang eksperimen diisi dengan 5 ekor mencit betina.
Gambar 3.1.Vaginal plugpada Mencit Betina (Mus musculus♀) Keterangan : Tanda panah menunjuk padavaginal plug
4. Persiapan Dosis
Dosis ekstrak etanol daun pare yang diuji yaitu 0 mg.kg-1 berat tubuh (kontrol), 750 mg.kg-1berat tubuh, 1000 mg.kg-1berat tubuh dan 1250 mg.kg-1 berat tubuh. Berat mencit yang digunakan yaitu 28-30 g, maka dosis perlakuan ditentukan berdasarkan perhitungan sebagai berikut :
a) Perlakuan dengan dosis 0 mg.kg-1berat tubuh
30 mg x 0 = 0 mg ekstrak etanol daun pare 1000
b) Perlakuan dengan dosis 750 mg.kg-1berat tubuh
30 mg x 750 = 22,5 mg ekstrak etanol daun pare 1000
c) Perlakuan dengan dosis 1000 mg.kg-1berat tubuh 30 mg x 1000 = 30 mg ekstrak etanol daun pare 1000
d) Perlakuan dengan dosis 1250 mg.kg-1berat tubuh 30 mg x 1250 = 37,5 mg ekstrak etanol daun pare 1000
5. Perlakuan dan Pemeliharaan
Ekstrak etanol daun pare diencerkan dengan melarutkan masing-masing 22,5 mg, 30 mg dan 37,5 mg ekstrak etanol daun pare dengan akuades sebanyak 0,5 ml. Larutan ekstrak etanol daun pare tersebut diberikan per oral menggunakan sonde sebanyak 0,3 ml tiap mencit. Pemberian ekstrak etanol daun pare dilakukan pada pagi hari setiap hari sekali, dimulai sejak umur perkembangan 1dpc.
Pemeliharaan mencit dilakukan di animal house Fakultas Biologi, Universitas Jenderal Soedirman, dengan kondisi yang terkontrol dan konstan. Selama periode pemeliharaan mencit diberi pakan dan minum secara ad libitum. Pakan mencit berupa pelet komersial dan air yang digunakan untuk minum mencit berasal dari air sumur Fakultas Biologi, Unsoed. Kandang dibersihkan dengan cara mengganti sekam setiap 3 hari sekali. Kondisi fisik dan aktivitas mencit uji diamati setiap hari untuk memonitor kesehatannya. Mencit yang sehat diketahui berdasarkan hasil pengamatan visual, yakni bulu tampak bersih, halus dan mengkilat; bola mata tampak merah muda dan jernih; hidung dan mulut tidak mengeluarkan lendir serta aktif (Anfiandi, 2013).
6. Pengumpulan Data
6.1. Morfologi Fetus
6.1.1. Deskripsi Kenormalan Bentuk
Pada hari pengambilan data, yakni umur perkembangan 6-6,5 dpc, umur perkembangan 12-12,5 dpc dan umur perkembangan 18-18,5 dpc, mencit dimatikan dengan dislokasi servikal, dinding abdomennya dibedah, organ viscera diangkat sehingga organ reproduksi dapat terlihat dengan jelas. Organ reproduksi yang meliputi uterus, oviduk dan ovarium diangkat kemudian diletakan dalam cawan petri yang berisi larutanPhospate Buffer Saline (PBS). Uterus digunting sepanjang garis medialnya sehingga lumennya terbuka dan fetus terlihat, selanjutnya fetus diisolasi.
Fetus yang telah diisolasi dari uterus diamati morfologinya dengan menggunakan mikroskop stereo. Aspek kenormalan morfologi meliputi kenormalan bentuk dan ukuran (panjang dan berat) fetus. Kenormalan bentuk dievaluasi atau dijustifikasi dengan cara membandingkan fetus
hasil penelitian dengan The Atlas of Mouse Development (Kaufman, 1992).
6.1.2. Panjang Tubuh
Panjang fetus diukur dengan orientasi crown to rump (Gambar 3.2.) menggunakan jangka sorong.
Gambar 3.2. OrientasiCrown to Rumppada Fetus Tikus. Sumber: Adnan, 2007.
6.1.3. Berat Tubuh
Fetus yang telah diukur panjangnya, ditimbang menggunakan timbangan analitik.
6.2. Jumlah Fetus
Jumlah fetus yang masih hidup pada kedua sisi uterus dihitung dengan mata telanjang (tanpa menggunakan mikroskop).
6.3. Keberhasilan Implantasi
Keberhasilan implantasi dievaluasi berdasarkan jumlah induk yang memiliki fetus atau spot implantasi dan jumlah korpus luteum. Korpus luteum diamati menggunakan mikroskop stereo.
6.3.1. Laju Implantasi
Laju implantasi (LI) adalah persentase jumlah implantasi (jumlah fetus dan jumlah spot implantasi) terhadap jumlah korpus luteum pada setiap induk. Laju implantasi dihitung dengan rumus berikut (Satyaningtijas et al., 2014):
LI = fetus dan spot implantasi
korpus luteum X 100%
(3-1)
Jumlah korpus luteum ditentukan dengan menghitung struktur berwarna merah muda pada ovarium. Korpus luteum adalah badan hormonal pada ovarium yang terbentuk setelah terjadi ovulasi. Korpus luteum menghasilkan hormon progesteron yang berfungsi untuk mempersiapkan uterus menerima kebuntingan (Samosir, 2001).
6.3.2. Laju Resorpsi
Laju resorpsi (LR) adalah persentase jumlah spot implantasi terhadap jumlah fetus dan spot implantasi, dihitung menurut Fishman et al. (1993) dengan rumus:
LR = spot implantasi
jumlah fetus dan spot implantasi x 100%
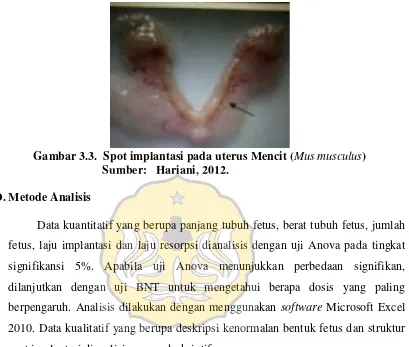
(3-2) Pada induk yang uterusnya tidak mengandung fetus, dihitung keberadaan spot implantasi. Menurut Benson et al. (1996), spot implantasi adalah ketidaknormalan pada titik implantasi atau pada lumen uterus yang berdekatan dengan titik implantasi, ditunjukkan dengan adanya peningkatan vaskularisasi darah. Spot implantasi menunjukkan terjadinya resorpsi fetus setelah implantasi. Hariani (2012) dalam penelitiannya menyatakan spot-spot (gumpalan) darah pada endometrium uterus dengan jarak tertentu sebagai spot implantasi (Gambar 3.3.). Konfirmasi spot implantasi dilakukan dengan pembuatan sediaan histologis menggunakan metode parafin menurut Suntoro (1983) yang telah dimodifikasi oleh Laboratorium Struktur dan Perkembangan Hewan, Fakultas Biologi, Unsoed (Lampiran 2; Halaman 39).
Gambar 3.3. Spot implantasi pada uterus Mencit (Mus musculus) Sumber: Hariani, 2012.
D. Metode Analisis
Data kuantitatif yang berupa panjang tubuh fetus, berat tubuh fetus, jumlah fetus, laju implantasi dan laju resorpsi dianalisis dengan uji Anova pada tingkat signifikansi 5%. Apabila uji Anova menunjukkan perbedaan signifikan, dilanjutkan dengan uji BNT untuk mengetahui berapa dosis yang paling berpengaruh. Analisis dilakukan dengan menggunakan software Microsoft Excel 2010. Data kualitatif yang berupa deskripsi kenormalan bentuk fetus dan struktur spot implantasi dianalisis secara deskriptif.