Oseana, Volume XXIX, Nomor 3, Tahun 2004 : 1 - 7 ISSN 0216-1877
METODE PENGUJIAN ANTIJAMUR MENGGUNAKAN "CONIDIA" DALAM PENERAPANNYA PADA METABOLIT SEKUNDER DARI LAUT
Oleh Tutik Murniasih 1)
ABSTRACT
ANTIFUNGAL ASSAY METHOD USING' “CONIDIA” IN APPLICATION ON
MA-RINE SECONDARY METABOLITES. Commonly, the screening method of antifun-gal secondary metabolite have been applied by detecting of morphological changes of fungal mycelia grown on agar plates and test sample were applied by paper disks. However, this method was limited to qualitative treatment. Recently, the cheap, quick and easy bioassay method for antimitotic and antifungal has been developed by Hisayoshi Kobayashi from Tokyo group. The antifungal agents such as ansamitocin P-3 showed the inhibition or characteristic curling effect on mycelia of pathogenic filamentous fungus, by germinated this fungus's conidia in 0.02% yeast extract solu-tion. This paper reviewed the details of method including the modification of quan-titative estimation.
PENDAHULUAN
Kemajuan ilmu pengetahuan dan teknologi yang menghasilkan obat baru dan peralatan kedokteran, mempermudah timbulnya penyakitjamur (SUPRIHATIN, 1982). Selanjut-nya disebutkan bahwa beberapa peneliti bidang kedokteran menyimpulkan adanya kecenderungan pergeseran penyebab penyakit dari kuman ke jamur, khususnya penyakit yang disebabkan oleh jamur-jamur patogen yang berfilamen diantaranya adalah infeksi kulit (dermatophyte infection), infeksi saluran pernafasan, alergi dan keracunan. Meningkatnya penderita penyakit akibat jamur tersebut merupakan tantangan bagi penelitian bidang biomedis, terutama dalam upaya untuk mencari obat antijamur baru (SUPRIHATIN, 1982).
Sebagaimana telah dilaporkan oleh beberapa peneliti yang mendalami bahan alam, bahwa metabolit sekunder yang dihasilkan oleh makro/mikroorganisme laut merupakan sumber baru bahan biomedika. Hal ini berhubungan dengan keunikan struktur kimia substansi aktif yang diisolasi dari organisme laut berbeda dengan organisme darat (FUSETANI, 2000). Kespesifikan tipe struktur kimia dari metabolit yang dihasilkan biota laut tersebut merupakan peluang besar dalam upaya untuk menemukan obat baru.
Upaya untuk memperoleh obat antijamur baru dari metabolit sekunder laut, memerlukan metode skrining yang efektif dan akurat. Umumnya metode yang dipakai untuk pengujian antimikroba adalah dengan cara
membiakkan bioindikator pada media agar dan meneteskan sampel uji pada kertas cakram yang diletakkan di atas media agar. Daya hambat pertumbuhan mikroorganisme ditentukan dengan mengukur diameter hambat yang ditunjukkan oleh lingkaran bening pada permukaan media. Cara pengujian bioaktifitas dengan metode difusi agar tersebut sangat cocok untuk antibakteri dan anti"yeast". Sedangkan secara kuantitatif, metode tersebut tidak sesuai untuk pengujian jamur tingkat tinggi klas Phycomycetes, Ascomycetes dan Basidiomycetes, karena bentuk koloni dari jamur-jamur yang berfilamen tersebut tidak beraturan, sehingga sangat sulit menentukan diameter hambat pertumbuhannya.
Bertolak dari fenomena tersebut, Hisayoshi Kobayashi group dari Tokyo mencoba mengembangkan metode baru yang lebih cepat, mudah dan ekonomis yaitu dengan menggunakan conidia. Conidia adalah spora aseksual eksogen yang terbentuk di luar hyfa yang dimiliki oleh jamur-jamur tingkat tinggi (MYRVIK et al., 1974). Terkait dengan pemaparan di atas, maka makalah ini bertujuan menguraikan secara terperinci dari metode pengujian anti-jamur dengan "conidia", termasuk modifikasi pengujian secara kuantitatif.
CARA PENGUJIAN ANTI JAMUR MENGGUNAKAN CONIDIA
Pengujian antijamur yang berfilamen dikembangkan oleh Hisayoshi KOBAYASHI group yang merupakan kerjasama penelitian antara Tokyo University dengan National In-stitute of Bioscience and Human-Technology, Tsukuba Japan. Pertama kali metode pengujian anti-jamur dengan "conidia "ini diterapkan untuk pengujian terhadap daya hambat pertumbuhan jamur Pyricularia oryzae yang bersifat patogen terhadap tanaman padi. Namun demikian metode ini dapat diterapkan
untuk jenis jamur patogen lain yang mempunyai conidia (KOBAYASHI et al, 1996). Adapun media yang digunakan untuk germinasi conidia dapat disesuaikan dengan jenis jamur yang diuji. Sebagai model, di bawah ini diuraikan cara pengujian antijamur Pyricularia oryzae, yang meliputi beberapa tahap, antara lain adalah sebagai berikut:
1. Penyiapan Ekstrak Sampel
Ekstraksi sampel makro/ mikroorganisme laut pada prinsipnya dapat dilakukan dengan berbagai pelarut, sesuai dengan senyawa target yang kita inginkan. Berdasarkan pelarut yang digunakan, sampel dibagi menjadi dua macam yaitu, sampel yang larut dalam air dan sampel hidrofobik (larut dalam methanol, asetonitril atau pelarut organik yang lain).
Sampel biota direndam dalam pelarut selama 2 hari, kemudian disaring dengan maksud untuk memisahkan filtrat dengan residu. Filtrat selanjutnya dievaporasi sampai dengan konsentrasi yang kita inginkan. Jika pengujian antijamur tidak dilakukan dengan segera, maka sampel dapat disimpan pada almari pendingin 4°C.
2. Penyiapan larutan prakultur conidia Jamur Pyricularia oryzae diinokulasi terlebih dahulu pada media agar yang mengandung 0,2% ekstrak yeast, 1% amilum terlarut dan 2% agar. Inkubasi dilakukan pada suhu 27°C selama 12-14 hari, selanjutnya setelah mycelium tumbuh, dilakukan pengambilan conidia yaitu dengan cara melarutkan koloni jamur ke dalam air steril. Larutan jamur kemudian disaring, hal ini dimaksudkan untuk memisahkan conidia dengan mycelia. Filtrat yang mengandung conidia kemudian ditambahkan 2% larutan yeast hingga konsentrasi 0,02%. Selanjutnya, untuk pengujian kuantitatif digunakan konsentrasi suspensi 4 x 104conidia/ml.
3. Pengujian Antijamur
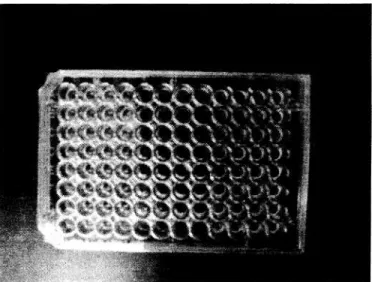
Pengujian dengan metode "germinasi conidia" ini dilakukan dengan menggunakan petri penguji yang disebut dengan "96-well flat-bottomed assay plate". Tiap petri mempunyai 96 tabung, yang terdiri dari 8 tabung/kolom dan 12 tabung/lajur. Dalam setiap pengujian, minimal duakolom tabung dalam petri penguji digunakan untuk kontrol positif dan negatif. Kontrol negatif umumnya menggunakan aquades steril, sedangkan untuk kontrol positif menggunakan senyawa antijamur (ansamitocin P-3, Rhizoxin, Amphotericin B dan Iain-lain). Satu kolom (8 tabung) biasanya digunakan untuk satu jenis sampel dengan 8 macam konsentrasi, dan besarnya konsentrasi dapat dimodifikasi, sesuai dengan kekuatan jenis antijamur yang digunakan. Sebagai contoh variasi konsentrasi untuk kontrol positif rhizoxin adalah: l μM, 0,5pμM, 0,25μM, 0,125μM, 60nM, 30nM, 16nM dan 8nM. Sesudah penambahan conidia dan sampel, petri kemudian diinkubasi selama 2x16 jam pada suhu 27°C.
Terkait dengan pengujian sampel ekstrak biota berdasarkan pelarut yang digunakan, maka berikut ini akan dijelaskan secara rinci tentang beberapa perbedaan cara pengujian sampel, yaitu sebagai berikut: 3.1. Pengujian Sampel yang larut dalam air
Untuk pengujian sampel yang larut dalam air, hendaknya konsentrasi sampel yang larut dalam air dibuat variasi menjadi 8 macam, lOjLil larutan sampel tersebut diteteskan pada masing-masing tabung dalam petri, kemudian ditambahkan dengan larutan conidia sebanyak 50 JLLI/tabung dan diaduk. Satu kolom (8 tabung)
disisakan untuk negatip control dengan menggunakan air steril sebanyak 10 jil/tabung dan 50 jil/tabung larutan conidia. Konsentrasi conidia menjadi 2xlO3 conidia/60il/tabung,
selanjutnya petri diinkubasi selama 2 x 16 jam, pada suhu 27°C. (KOBAYASHI etal, 1996) 3.2. Pengujian sampel yang larut dalam
pelarut organik (senyawa hidrofobik)
Pada pengujian ini, perlu diperhatikan bahwa pelarut-pelarut semi polar (kloroform, aseton, etil asetat dan Iain-lain) sering merusak petri yang terbuat dari plastik, oleh karena itu sedapat mungkin dihindari penggunaan pelarut tersebut. Untuk sampel yang hanya dapat larut dalam kloroform, aseton, maupun etil asetat, sebaiknya dikombinasi dengan metanol, acetonitril maupun air. Selain kendala tersebut, pelarut-pelarut organik seperti aseton, dimetil sulfoksida, etanol, metanol dan asetonitril juga mempunyai efek menghambat pertumbuhan mycelia pada jenis jamur tertentu (KOBAYASHI et al., 1996). Oleh karena itu sampel yang mengandung pelarut organik hendaknya menggunakan prosedur seperti di bawah ini: Sampel yang mengandung pelarut organik dengan 8 jenis konsentrasi diteteskan pada tabung petri, kemudian diuapkan dalam "clean bench". Sampel yang bebas dari pelarut organik, selanjutnya ditambah dengan larutan conidia sebanyak 50 μl /tabung hingga bercampur dengan sampel. Konsentrasi larutan conidia menjadi 2xl03conidia/50μl/tabung.
Kemudian petri siap diinkubasi sesuai dengan kondisi yang diinginkan.
Selain cara tersebut, untuk menghindari efek pelarut terhadap pertumbuhan mycelia, dapat juga dilakukan dengan cara mencampur pelarut organik dengan air steril (konsentrasi dari pelarut tidak boleh melebihi 5%). Sebanyak 10 μl dari larutan tersebut kemudian ditambahkan pada tabung, selanjutnya prosedur mengikuti cara pengujian sampel yang larut dalam air. Prosedur yang sama dilakukan untuk control negatip dengan menggunakan air steril.
3.3. Prosedur pengujian untuk skreening antijamur
Untuk pengujian skreening antijamur, terlebih dahulu ditambahkan 50 μl conidia ke dalam tiap tabung. Kemudian masing-masing sampel ditambahkan sebanyak 50 μl pada tabung pertama petri, dan diaduk hingga
bercampur. Sebanyak 50 μl larutan dari tabung pertama selanjutnya diambil dengan pipet dan ditambahkan kedalam tabung kedua sambil dicampur, demikian seterusnyahingga tabung terakhir (tabung ke-8). Konsentrasi conidia berturut-turut menjadi l x l03/50 μl/tabung,
l,5xl03/50 μl/tabung, 1,75x103/50 μl/tabung,
1,87xl03/50μl/tabung, 1,94 x 103/50 μl/tabung,
1,97xl03/50 μl/tabung, 1,98 x l03/50 μl/tabung,
1,99xl03/50 μl/tabung. Untuk negatip kontrol,
50 μl air steril ditambahkan pada tabung pertama, kemudian dengan prosedur yang sama dilakukan seperti pada sampel uji di atas (KOBAYASHI et al., 1996).
CARA PENGAMATAN EFEK PENGHAMBATAN PADA HYFA JAMUR
Untuk mengetahui efek penghambatan pertumbuhan hyfa jamur oleh sampel uji, dapat dilakukan dengan mengamati deformasi morfologi mycelia menggunakan mikroskop. Berikut di bawah ini adalah contoh efek penghambatan pertumbuhan jamur Pyricularia oryzae oleh senyawa rhizoxin .
Efek penghambatan hyfa jamur atau sering disebut dengan "curling effect" dapat dilihat pada Gambar 1. Pada negatip kontrol (air), perkembangan hyfa jamur (Gambar A),
Gambar 1. Efek penghambatan hyfa jamur Pyricularia oryzae oleh rhizoxin (KOBAYASHI et al., 1996).
dengan penambahan konsentrasi rhizoxin (substansi antijamur), terlihat adanya perkembangan hyfa yang semakin terhambat, bahkan pada konsentrasi 50ng/ml hyfa tidak berkembang, namun masih terlihat adanya pertumbuhan. Jika tampilan pada mikroskop berupa titik, sebagaimana bentuk conidia, maka dapat disimpulkan bahwa terjadi efek penghambatan 100%. Konsentrasi sampel uji dimana terjadi penghambatan total terhadap pertumbuhan hyfa jamur disebut dengan "In-hibition Concentration" (IC100) (KOBAYASHI
et al 1996).
pengujian ini tidak cocok untuk diterapkan pada jamur yang berfilamen, misalnya jamur Pyricularia oryzae.
Terkait dengan adanya kelemahan pada metode difusi agar, maka metode pengujian yang cocok adalah dengan conidia. Di bawah ini adalah contoh hasil pengujian dengan menggunakan conidia.
Gambar 3 merupakan salah satu hasil pengujian menggunakan cara germinasi conidia, dengan cara tersebut efek penghambatan ("curling effect") pertumbuhan
Gambar 2. Efek penghambatan pertumbuhan Pyricularia oryzae oleh ekstrak "marine fungi"dengan metode difusi agar (MURNIASIH, 2003).
Gambar 2 merupakan salah satu pengujian anti-jamur Pyricularia oryzae dengan metode difusi agar. Pada gambar tersebut, dapat dilihat adanya efek penghambatan pertumbuhan jamur Pyricularia oryzae oleh ekstrak jamur yang diisolasi dari spons. Namun demikian, cara tersebut terdapat kelemahan dalam menentukan diameter penghambatan, karena koloni jamur yang tidak beraturan. Hal ini menunjukkan bahwa metode
hyfa jamur dapat diamati dengan menggunakan mikroskop. Pada Gambar 3, dengan penga-matan langsung, dapat dilihat adanya efek penghambatan yang ditunjukkan oleh larutan bening pada kolom ke-5,6,7 dan 8, sedangkan pada Gambar 1, adalah contoh tampilan efek penghambatan ("curling effect") menggunakan mikroskop dengan diafragma 16-80 nM. Sebagai contoh data hasil pengujian anti Pyricularia oryzae, dapat dilihat pada Tabel 1.
Gambar 3. Hasil pengujian antijamur Pyricularia oryzae oleh ekstrak "marine fungi" menggunakan conidia (MURNIASIH, 2003)
Tabel 1: Skreening day a hambat jamur Pyricularia oryzae oleh beberapa ekstrak bakteri laut (MURNIASIH, 2003)
Tabel di atas merupakan data hasil skreening antijamur Pyricularia oryzae dari beberapa ekstrak bakteri laut yang strainnya diperoleh dari koleksi MBI, Kamaishi Lab. Ja-pan. Dari data di atas dapat disimpulkan bahwa strain Q 629 KS, HJK-9B, Q 664 KS dapat menghambat pertumbuhan hyfa Pyricularia
oryzae hingga pengenceran sampel 15(il/16. Beberapa contoh data pengujian tersebut di atas membuktikan bahwa pengujian antijamur untuk jamur yang berfilamen, lebih akurat menggunakan metode germinasi conidia dari pada metode difusi agar.
DAFTAR PUSTAKA
KOBAYASHI, EL, M. NAMIKOSHL, T. YOSHIMOTO and T. YOKOCHI. 1996. A Screening Method for Antimitotic and Antifungal Substances Using Conidia of Pyricularia oryzae, Modifi-cation and AppliModifi-cation to Tropical Ma-rine Fungi. The Journal of Antibiotics 49 (9): 873-878.
FUSETANI, N. 2000. Drugs from The Sea. S. Karger Basel Switzerland, pp. 1-5
MYRVIK, Q.N., N.NANCY P. and R. WEISER. 1974. Fundamentals of Medical Bacte-riology and Mycology. Lea & Febiger Philadelphia, pp. 437-446.
MURNIASIH, T. 2003. Investigation ofAnti-Pyricularia oryzae Compounds from Marine Fungus. Training Report of Conservation and Sustainable Use of Tropical Marine Biological Diversity, sponsored by JICA. (tidak diterbitkan) SUPRIHATIN, S.D. 1982. Candida dan
Kandidiasis pada Manusia. Fakultas
Kedokteran Universitas Indonesia, hal. 1-8.