495
CDK-195/ vol. 39 no. 7, th. 2012
PENDAHULUAN
Menurut data WHO, penyakit kardiovaskular diperkirakan secara global telah menyebab-kan kematian 17 juta jiwa setiap tahunnya; di Indonesia, penyakit kardiovaskular menyum-bang 25% total angka kematian. Tiga penyakit kardiovaskular yang menjadi penyebab ke-matian terbesar di antaranya penyakit jantung koroner, stroke, dan hipertensi.
Penyakit kardiovaskular adalah semua penya-kit yang berhubungan dengan terganggunya fungsi jantung terutama yang berhubungan
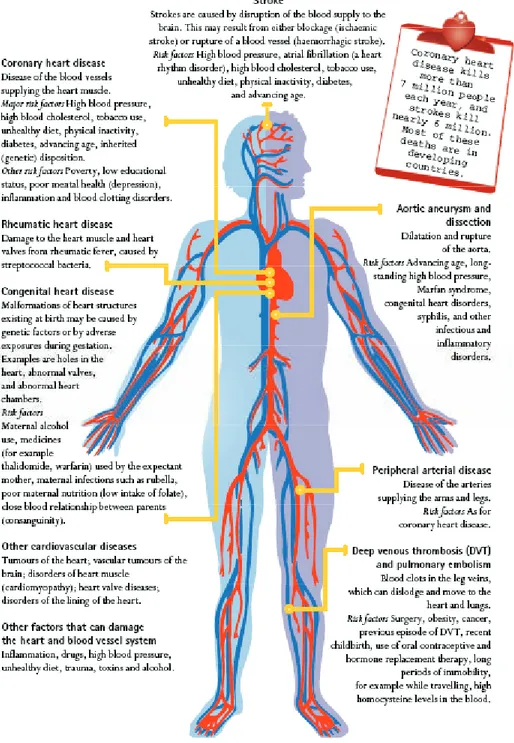
dengan terganggunya aliran darah sistemik di pembuluh darah arteri maupun vena. Penya-kit kardiovaskular dapat digolongkan menjadi beberapa tipe yang menjadi penyebab utama kematian yaitu: penyakit jantung koroner, pe-nyakit jantung iskemik, stroke, tekanan darah tinggi, gagal jantung, gangguan irama jantung, dan penyakit jantung reumatik (Gambar 1).1 Tingginya angka kematian yang disebabkan penyakit kardiovaskular menuntut metode prediksi yang akurat sehingga dapat dicegah sedini mungkin, selain metode penanganan
yang tepat. Metode prediksi yang menjadi standar untuk memprediksi risiko penya-kit kardiovaskular adalah sistem penskoran Framingham (Framingham Risk Score). Metode ini merupakan metode sudah tervalidasi yang mengombinasikan sejumlah faktor, seperti umur, jenis kelamin, kolesterol total, kadar ko-lesterol HDL, tekanan darah sistolik, riwayat diabetes, dan kebiasan merokok dalam for-mula matematis. Sejak dipublikasikan tahun 1998, Framingham Risk Score sudah menjadi standar umum yang banyak dipakai oleh kli-nisi dan institusi kesehatan2 Pada
perkemban-Pemanfaatan Sel Punca Progenitor Endothelial
(
Endothelial Progenitor Cells
)
sebagai
Biomarker
Risiko Penyakit Kardiovaskular
Camy Febrero Surjadi
Stem Cell and Cancer Institute, Jakarta, Indonesia
ABSTRAK
Data WHO menunjukkan bahwa dari total kematian global, 30% di antaranya disebabkan oleh penyakit kardiovaskular, 80% dari umlah itu ter-jadi di negara miskin dan berkembang, termasuk Indonesia. Keberadaan suatu biomarker yang dapat memprediksi risiko penyakit kardiovasku-lar sangat diperlukan untuk pencegahan awal maupun lanjutan. Penemuan sel punca progenitor (endothelial progenitor cell, EPC) memberikan terobosan penting bagi terapi angiogenik. EPC adalah sel punca yang memiliki kemampuan membentuk pembuluh darah baru pada orang dewasa. Berdasarkan kemampuan dan karakteristik EPC diperoleh fakta bahwa tingkat frekuensi EPC yang beredar dalam pembuluh darah da-pat dipakai sebagai biomarker untuk melihat fungsi vaskular sekaligus menentukan risiko penyakit kardiovaskular. Hasil penelitian menunjukkan jumlah koloni EPC-colony forming unit (EPC-CFU) terkait erat dengan fungsi kardiovaskular. Jumlah koloni EPC-CFU yang menurun menandakan kemungkinan terjadinya penyakit kardiovaskular di masa mendatang karena penurunan tersebut menandakan kemampuan self-repair pem-buluh darah telah menurun. Jumlah koloni EPC-CFU diketahui pula memiliki korelasi dengan skor Framingham Cardiovascular Risk yang biasa dipakai untuk menentukan tingkat kesehatan dan risiko terserang penyakit kardiovaskular seseorang.
Kata kunci: kardiovaskular, biomarker, endothelial progenitor cell, skor Framingham
ABSTRACT
Data from WHO showed that 30% of global death are caused by cardiovascular disease, 80% occur in poor and developing countries including Indonesia. Three cardiovascular diseases which contribute to leading cause of death are coronary heart disease, stroke, and hypertension. The availability of a biomarker that could predict the risk is necessary for disease prevention in initial and follow-up stage. The discovery of endothe-lial progenitor cell (EPC) provides an important breakthrough for angiogenic therapy. EPC is stem cell that has the ability to form new blood vessels in adults. Based on the capabilities and characteristics of EPC, scientists has discovered important fact that level of circulating EPC can be used as a biomarker of vascular function as well as to determine the risk of cardiovascular disease. Decrease in EPC-CFU lower the ability to self-repair blood vessels, thus may indicate the likelihood of cardiovascular disease. The number of EPC-CFU colony are known to have a correla-tion with the Framingham Cardiovascular Risk score that was used to determine the level of health and a person’s risk of cardiovascular disease. Camy Febrero Surjadi. Endothelial Progenitor Cells as Cardiovascular Risk Biomarker.
Key words: cardiovascular, biomarker, endothelial progenitor cell, Framingham score
CDK-195_vol39_no7_th2012 ok.indd 495
CDK-195/ vol. 39 no. 7, th. 2012
496
gannya cara ini ternyata memiliki keterbatasan jika digunakan di beberapa populasi ras ter-tentu. Mengingat penyebab penyakit kardio-vaskular itu multifaktor maka hasil Framing-ham Risk Score perlu dianalisis lebih lanjut sesuai kondisi dan riwayat kesehatan pasien. Hal ini mendorong para ahli dan peneliti untuk me-nemukan biomarker atau metode analisis yang lebih akurat agar penyakit kardiovaskular dapat dicegah dan diatasi sedini mungkin se-hingga angka kematian penyakit kardiovasku-lar dapat ditekan.
Hasil studi menunjukkan bahwa EPC, yang merupakan faktor penting untuk perbaikan pembuluh vaskular saat terjadi kerusakan, ternyata memiliki asosiasi positif terhadap beberapa faktor risiko penyakit kardiovaskular. Studi dilakukan dengan menguji kemampuan EPC untuk membentuk koloni (EPC-CFU) se-bagai refl eksi atas kemampuannya untuk re-generasi dan mengembalikan fungsi angioge-nik. Hasil penelitian juga memperlihatkan bahwa jumlah koloni EPC-CFU memiliki korelasi ter-hadap Framingham Risk Score dan mungkin digunakan untuk memprediksi penyakit kar-diovaskular.3
Faktor-Faktor Penyebab Penyakit Kardiovaskular
Kerusakan sel-sel endotelial akan menggang-gu fungsi pembuluh darah. Gangmenggang-guan fungsi pembuluh darah merupakan awal penyakit kardiovaskular. Beberapa penyakit kardio-vaskular yang dapat timbul akibat gangguan fungsi pembuluh darah, yaitu infark miokard,
critical limb ischemia, stroke, gagal ginjal, ate-rosklerosis, dan penyakit degeneratif lainnya. Faktor-faktor penyebab gangguan kardio-vaskular di antaranya infl amasi, konsumsi obat-obatan yang berlebihan, konsumsi alko-hol, tekanan darah tinggi, kolesterol, trauma, dan pola diet yang tidak sehat.4
Dari sekitar 300 risiko penyakit kardiovaskular, tiga penyebab utama penyakit kardiovaskular adalah tekanan darah tinggi, kebiasaan me-rokok, dan tingginya kadar kolesterol darah. Selain faktor kesehatan, faktor penyebab lain meliputi rendahnya status sosial-ekonomi, kesehatan mental, stres, penggunaan obat-obat terapi kehamilan, pertambahan umur (risiko penyakit kardiovaskular meningkat dua kali lipat sesudah umur 55 tahun), gender de-ngan tingkat risiko pada pria lebih tinggi, fak-tor keturunan, dan etnik. Riset terbaru
menun-jukkan faktor-faktor baru yang ternyata juga menyebabkan gangguan kardiovaskular, yaitu tingginya kadar homosistein dalam darah, in-fl amasi yang parah, abnormalitas pembekuan darah.5 Selain faktor-faktor tersebut ada studi yang menyimpulkan terdapat korelasi antara infeksi bakteri Mycobacterium tuberculosis (TB) dengan penyakit kardiovaskular karena in-dikator penyakit kardiovaskular seperti level
C-Reactive Protein (CRP), interleukin-6, dan ho-mosistein juga meningkat pada penyakit TB.6
Selain faktor fi sik, faktor psikologis yang turut menyebabkan meningkatnya risiko penyakit kardiovaskular ialah stres dan depresi. Stres dan depresi memiliki pengaruh terhadap gangguan irama jantung, tingginya tekanan darah, dan gangguan pembekuan darah. Jika tidak diatasi segera, stres dan depresi akan mengakibatkan penyakit kardiovaskular menyerang lebih cepat dan, pada pengidap penyakit kardiovaskular, dapat memperparah penyakit.7
Gambar 1 Penyakit-penyakit kardiovaskular dan penyebabnya8
CDK-195_vol39_no7_th2012 ok.indd 496
497
CDK-195/ vol. 39 no. 7, th. 2012 EPC dan Peranannya dalam Terapi Berbagai Penyakit Angiogenik
Pada tahun 1997, Asahara dkk. mengidenti-fi kasi sebagian kecil sel dari populasi sel ber-inti tunggal pada peredaran darah perifer ma-nusia yang berpotensi berdiferensiasi menjadi sel endotel dalam percobaan in vitro.9 Setelah dipelajari lebih dalam, diketahui bahwa sel tersebut mempunyai molekul penanda ( mark-er) CD34 merupakan sel punca yang berperan sebagai salah satu molekul penanda. Selan-jutnya, populasi sel ini dinamai endothelial progenitor cells (EPC) sesuai keistimewaannya dalam membentuk sel endotel dan berperan dalam pembentukan pembuluh darah baru.10 Semenjak laporan tersebut, banyak studi telah dilakukan dengan tujuan mengisolasi, mem-perbanyak, dan mengetahui karakteristik, fungsi, dan peran EPC.
EPC merupakan sel dengan karakteristik sel punca, namun dapat berproliferasi dan ber-diferensiasi secara terbatas. Sel ini bersifat uni-poten, yaitu dapat berdiferensiasi menjadi sel endotel matang. EPC berperan penting dalam pembentukan pembuluh darah dan remodel-ing sel endotelial yang rusak.11,12 EPC didefi nisi-kan sebagai sel berinti tunggal (mononuclear cell, MNC) yang memiliki molekul penanda sel induk hematopoietik, yaitu CD34, suatu gliko-protein yang memediasi pelekatan sel induk pada matriks ekstraseluler sumsum tulang dan CD133, suatu glikoprotein yang dilapor-kan merupadilapor-kan molekul penanda untuk sel induk yang lebih primitif dibandingkan CD34, sampai saat ini fungsi molekul CD 133 masih belum diketahui.13 EPC yang telah mengalami diferensiasi menjadi sel yang lebih matang tidak mengekspresikan CD34. EPC juga di-laporkan memiliki molekul penanda sel endo-telial, yaitu KDR (kinase insert domain receptor), suatu protein yang berperan menstimulasi proliferasi, perkembangan pembuluh darah baru (sprouting), dan angiogenesis. EPC juga berperan dalam pelekatan dan interaksi antar sel14,15. Beberapa molekul penandalain yang dimiliki EPC adalah CD31 (platelet endothelial cell adhesion molecule-1), untuk pelekatan sel endotel dan berperan dalam proses migrasi leukosit melalui jaringan interseluler sel-sel endotel; CD146 (P1H12) berperan memediasi pelekatan antar sel endotel16; von Willebrand
factor (vWF), berperan dalam proses koagu-lasi darah; Tie-2 untuk pematangan jaringan sel endotel selama vaskulogenesis atau an-giogenesis; dan endothelial nitric oxide
syn-thase (NOS) yang mengatur fungsi pembuluh darah.17
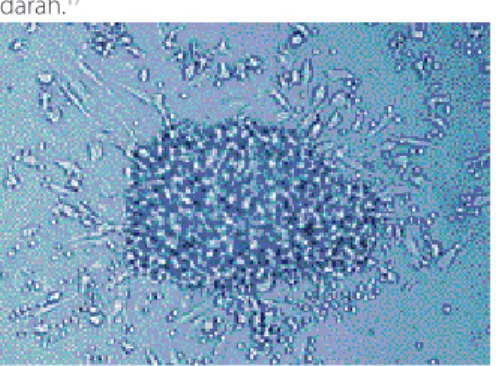
Gambar 2 Koloni EPC yang memiliki karakteristik bagian tengah bulat dikelilingi sel-sel berbentuk spindel (perbesa-ran 200x, dengan mikroskop fase kontras)18
Dari beberapa studi, diketahui ada dua macam populasi EPC, yaitu early EPC dan late EPC (atau disebut juga endothelial outgrowth cells [EOC]). Pemberian nama EOC berdasarkan waktu kemunculan dalam kultur (10-20 hari dalam kultur) dan kemampuan proliferasinya yang le-bih tinggi dibandingkan early EPC.19 Perbedaan
antara early EPCs dan EOCs juga ditemukan pada ekspresi molekul penandanya (Tabel 1). Perbedaan karakteristik Early EPC dan EOC pada studi in vitro dan in vivo diduga dapat memberi kontribusi sinergis dalam terapi penyakit kar-diovaskular. Early EPC diketahui dapat mening-katkan proliferasi, migrasi, dan pembentukan struktur vaskular melalui sistem parakrin, yang akan memediasi sel-sel endotel di sekitarnya untuk pembentukan pembuluh darah baru. Di lain pihak, EOC akan berinkorporasi dengan sel sesamanya untuk membentuk pembuluh da-rah.20 Jika ditransplantasikan secara bersamaan, EPC dan EOC akan lebih efektif bekerja mem-perbaiki saluran endotelial dan kerusakan–ke-rusakan yang melibatkan sel endotelial. Sumber EPC dapat berasal dari EPC yang di-mobilisasi dari sumsum tulang atau di daerah-daerah tertentu, seperti jantung, saluran cerna, otot, dan darah tepi dalam jumlah kecil.22 Pe-ningkatan jumlahEPC dapat dideteksi segera setelah 6 jam sejak terjadinya luka dalam
pe-Tabel 1 Perbandingan early EPC dan EOC21
Karakteristik Early EPC EOC
Waktu ditemukannya dalam kultur 4-7 hari 10-20 hari Morfologi sel Spindle Cobblestone Kecepatan proliferasi setelah waktu optimal tercapai
Rendah Tinggi
Jumlah mediator yang disekresi (VEGF dan IL-8)
Tinggi Rendah Molekul penanda CD34, CD14, CD11b, CD11c, CD45, KDR, VE-cadherin, CD31, Tie-2, vWF KDR, VE-cadherin, CD31, Tie-2, vWF, eNOS Pembentukan struktur vaskular dalam matriks dimensi
Tidak terbentuk Terbentuk
VEGF : Vascular endothelial growth factor, IL-8 : Interleukin-8; CD : Cluster of diff enentitation, KDR : Kinase domain receptor, Tie-2 : reseptor protein tirosin kinase, spesifi k epitel, vWF : von Willebrand factor, eNOS : endothelial nitric oxide synthase
CDK-195_vol39_no7_th2012 ok.indd 497
CDK-195/ vol. 39 no. 7, th. 2012
498
redaran darah. EPC akan berespon terhadap stimulasi sitokin dan keadaan iskemik (defi sit oksigen) dengan cara mobilisasi dari sumsum tulang menuju tempat yang mengalami kondi-si iskemik dan melakukan proses neovaskulari-sasi dan angiogenesis.23 EPC akan menjalankan perannya dalam memelihara integritas pem-buluh darah dan memperbaiki sel-sel endotel yang rusak.24 Karena itu, penurunan jumlah EPC disinyalir akan mengakibatkan terjadinya aterosklerosis dan gangguan angiogenesis yang lebih lanjut akan mengakibatkan penya-kit kardiovaskular.25 Jumlah dan aktivitas EPC dipengaruhi oleh berbagai faktor antara lain. 1. Faktor fi siologis, seperti rutinitas olahraga dan aktivitas yang melibatkan gerak tubuh, dapat meningkatkan jumlah EPC.26,27 Pertambah-an usia juga berpengaruh terhadap turunnya jumlah EPC.28,29
2. Faktor patologis, seperti pada pasien in-fark miokard akut dan trauma vaskular, seperti luka bakar atau operasi pintasarteri koroner menginduksi mobilisasi EPC sehingga me-ningkatkan jumlah EPC yang bersifat semen-tara.30 Sebaliknya faktor-faktor risiko penyakit kardiovaskular seperti penyakit jantung ko-roner, diabetes melitus, hiperkolesterolemia diketahui berkorelasi terbalik dengan jumlah dan fungsi EPC.31,32
3. Obat-obatan yang dapat memobilisasi EPC dari sumsum tulang ke sirkulasi darah sehingga jumlah EPC dalam peredaran darah naik.33 Obat-obatan seperti statin dan puer-arin (ekstrak tanaman tradisional Cina untuk mengobati penyakit jantung koroner) dapat meningkatkan jumlah, proliferasi, migrasi, dan pembentukan pembuluh darah baru secara in vitro yang diperantarai oleh EPC.34
4. Mediator pertumbuhan, hormon, dan ba-han kimia lainnya.35
Metode Prediksi Risiko Penyakit Kardiovaskular
Prediksi awal yang efektif dan tepercaya da-lam mengukur risiko penyakit kardiovaskular semakin penting agar kejadian kardiovaskular bisa diperkecil dan dapat diatasi sedini mung-kin. Metode prediksi yang berkembang saat ini terus dipacu agar dapat menghasilkan metode prediksi yang makin akurat. Suatu metode baru yang akan digunakan sebagai metode prediksi harus bersifat independen dan mampu meng-hasilkan data yang saling terkait lebih dari yang dapat diketahui melalui faktor-faktor risiko dan metode prediksi tradisional.
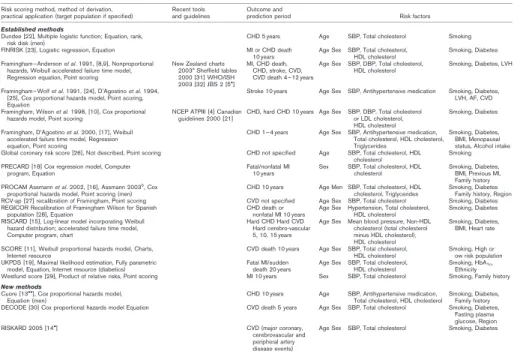
Langkah preventif terhadap penyakit kardio-vaskular dibagi menjadi langkah preventif primer dan langkah preventif sekunder. Lang-kah preventif primer ditujukan pada kelompok usia muda yang belum pernah terkena penya-kit kardiovaskular dengan menggunakan faktor risiko klasik seperti usia, jenis kelamin, tekanan darah, kadar kolesterol total dan LDL, status merokok, status diabetes, dan hasil elektrokar-diogram ventrikel kiri36 sedangkan langkah preventif sekunder ditujukan bagi kelompok yang pernah terkena penyakit kardiovaskular. Di antara berbagai metode penskoran (Tabel 2), yang umum digunakan untuk prediksi awal penyakit kardiovaskular ialah Framingham Risk Score (FRS) yang melingkupi semua faktor risiko klasik tersebut37. FRS dimulai dari studi epide-miologi oleh National Heart, Lung, and Blood Institute (NHLBI) terhadap populasi usia 30-60 tahun di Boston pada tahun 1948.38 Ketika itu, para peneliti mengumpulkan fakta dan meru-muskan faktor-faktor yang berperan dalam pe-nyakit kardiovaskular. Metode ini mulai diguna-kan secara luas di kalangan medis sejak tahun 1998 setelah rumusan baku mengenai sistem penskorannya selesai disepakati. Secara singkat langkah menghitung skor menurut metode penskoran FRS adalah sebagai berikut:
1. Tentukan skor menurut faktor jenis kelamin, usia, kolesterol total, kolesterol HDL, tekanan darah, status diabetes, dan status merokok. 2. Gunakan total skor untuk menghitung persentase prediksi terhadap penyakit kardio-vaskular selama 10 tahun.
3. Gunakan total skor prediksi 10 tahun yang sudah didapat dan bandingkan dengan tabel penskoran standar skor prediksi 10 tahun un-tuk mendapatkan skor prediksi relatif. Sistem penskoran FRS tidak luput dari kelemah-an karena divalidasi hkelemah-anya untuk populasi usia sampai dengan 75 tahun. Seiring bertambahnya usia, faktor-faktor risiko klasik makin kurang akurat. Studi terhadap populasi usia di atas 85 tahun menunjukkan faktor-faktor risiko ini tidak berlaku dan bahkan ada yang bertentangan. Hal ini menjadi bahan perdebatan di kalangan dunia medis yang menyatakan bahwa metode penskoran FRS tidak efektif untuk kelompok populasi yang lebih tua dan untuk kisaran populasi usia tersebut perlu dikaji lebih mendalam39. Hasil studi terbaru menunjukkan bahwa metode penskoran FRS tidak dapat memprediksi secara baik pada kelompok populasi usia muda yang mengidap infark miokard dan pasien muda baru pengidap diabetes mellitus40. Selain itu metode penskoran FRS memiliki banyak ke-terbatasan dalam segi etnis dan sosio-geografi karena dikembangkan berdasarkan populasi satu kota kecil di Amerika sehingga belum tentu mewakili populasi dunia.
Kenyataan ini mendorong ditemukannya bio-marker-biomarker baru yang dapat memban-tu memprediksi risiko penyakit kardiovaskular. Beberapa biomarker baru yang sudah diteliti sebagai indikator di antaranya yaitu: protein
C-reactive42, troponin I, kenaikan konsentrasi
Tabel 2 Deskripsi beberapa sistem penskoran penyakit kardiovaskular (Risk Assessment)41
Copyright © Lippincott Williams & Wilkins. Unauthorized reproduction of this article is prohibited.
Risk scoring method, method of derivation, practical application (target population if specified)
Recent tools and guidelines
Outcome and
prediction period Risk factors Established methods
Dundee [22], Multiple logistic function; Equation, rank, risk disk (men)
CHD 5 years Age SBP, Total cholesterol Smoking FINRISK [23], Logistic regression, Equation MI or CHD death
10 years
Age Sex SBP, Total cholesterol, HDL cholesterol
Smoking, Diabetes Framingham–Andersonet al. 1991, [8,9], Nonproportional
hazards, Weibull accelerated failure time model, Regression equation, Point scoring
New Zealand charts 2003aSheffield tables 2000 [31] WHO/ISH 2003 [32] JBS 2 [5] MI, CHD death, CHD, stroke, CVD, CVD death 4–12 years
Age Sex SBP, DBP, Total cholesterol,
HDL cholesterol Smoking, Diabetes, LVH
Framingham–Wolfet al. 1991, [24], D’Agostinoet al. 1994, [25], Cox proportional hazards model, Point scoring, Equation
Stroke 10 years Age Sex SBP, Antihypertensive medication Smoking, Diabetes, LVH, AF, CVD Framingham, Wilsonet al. 1998, [10], Cox proportional
hazards model, Point scoring
NCEP ATPIII [4] Canadian guidelines 2000 [21]
CHD, hard CHD 10 years Age Sex SBP, DBP, Total cholesterol or LDL cholesterol, HDL cholesterol
Smoking, Diabetes
Framingham, D’Agostinoet al. 2000, [17], Weibull accelerated failure time model, Regression equation, Point scoring
CHD 1–4 years Age Sex SBP, Antihypertensive medication, Total cholesterol, HDL cholesterol, Triglycerides
Smoking, Diabetes, BMI, Menopausal status, Alcohol intake Global coronary risk score [26], Not described, Point scoring CHD not specified Age SBP, Total cholesterol, HDL
cholesterol
Smoking PRECARD [18] Cox regression model, Computer
program, Equation Fatal/nonfatal MI10 years Sex SBP, Total cholesterol, HDLcholesterol Smoking, Diabetes,BMI, Previous MI, Family history PROCAM Assmannet al. 2002, [16], Assmann 2003b, Cox
proportional hazards model, Point scoring (men)
CHD 10 years Age Men SBP, Total cholesterol, HDL cholesterol, Triglycerides
Smoking, Diabetes Family history, Region RCV-ap [27] recalibration of Framingham, Point scoring CVD not specified Age Sex SBP, Total cholesterol Smoking, Diabetes REGICOR Recalibration of Framingham Wilson for Spanish
population [28], Equation CHD death ornonfatal MI 10 years Age Sex Hypertension, Total cholesterol,HDL cholesterol Smoking, Diabetes RISCARD [15], Log-linear model incorporating Weibull
hazard distribution; accelerated failure time model, Computer program, chart
Hard CHD Hard CVD Hard cerebro-vascular 5, 10, 15 years
Age Sex Mean blood pressure, Non-HDL cholesterol (total cholesterol minus HDL cholesterol), HDL cholesterol
Smoking, Diabetes, BMI, Heart rate
SCORE [11], Weibull proportional hazards model, Charts, Internet resource
CVD death 10 years Age Sex SBP, Total cholesterol, HDL cholesterol
Smoking, High or ow risk population UKPDS [19], Maximal likelihood estimation, Fully parametric
model, Equation, Internet resource (diabetics)
Fatal MI/sudden death 20 years
Age Sex SBP, Total cholesterol, HDL cholesterol
Smoking, HbA1c, Ethnicity Westlund score [29], Product of relative risks, Point scoring MI 10 years Sex SBP, Total cholesterol Smoking, Family history New methods
Cuore [13], Cox proportional hazards model, Equation (men)
CHD 10 years Age SBP, Antihypertensive medication, Total cholesterol, HDL cholesterol
Smoking, Diabetes, Family history DECODE [30] Cox proportional hazards model Equation CVD death 5 years Age Sex SBP, Total cholesterol Smoking, Diabetes,
Fasting plasma glucose, Region RISKARD 2005 [14] CVD (major coronary,
cerebrovascular and peripheral artery disease events)
Age Sex SBP, Total cholesterol Smoking, Diabetes
CDK-195_vol39_no7_th2012 ok.indd 498
499
CDK-195/ vol. 39 no. 7, th. 2012
homosistein, Lp(A), fi brinogen, hsCRP, bebe-rapa lipoprotein dan apolipoprotein, dan pep-tida natriuretic43. Beberapa studi mengkombi-nasikan biomarker-biomarker baru dengan FRS tersebut untuk menghasilkan metode prediksi yang lebih akurat dan ada pula studi yang membandingkan secara terpisah antara
biomarker-biomarker baru dengan faktor risiko klasik dalam FRS. Para peneliti NHLBI juga terus berusaha menyempurnakan metode penskoran FRS setelah meneliti 6 populasi etnis secara terpisah dan menemukan bahwa metode penskoran FRS dapat menyebabkan kelebihan perhitungan prediksi di beberapa populasi etnis 44.
Jumlah Koloni Sel Progenitor
Endotelial (Epc-Cfu) sebagai Biomarker
untuk Penentuan Risiko Penyakit Kardiovaskular
Berdasarkan hipotesis bahwa kerusakan sel endotelial merepresentasikan kinerja EPC dan tingkat keparahan penyakit kardiovaskular, Hill melakukan studi korelasi FRS dengan kadar EPC subjek yang memiliki risiko kardiovaskular tetapi belum pernah menderita penyakit kar-diovaskular; disimpulkan terdapat hubungan erat antara FRS subjek dengan kadar EPC. Selain itu, pada subjek yang dikategorikan memiliki risiko penyakit kardiovaskular tinggi, jumlah EPC yang dimiliki lebih sedikit dan subjek le-bih cepat mengalami kematian dibandingkan dengan subjek dengan risiko penyakit kardio-vaskular rendah. Bahkan kadar EPC merupa-kan alat ukur yang lebih baik untuk memantau reaktivitas fungsi vaskular dibandingkan FRS.18 Dalam hal ini, EPC-CFU berkorelasi negatif terhadap FRS; tingkat EPC-CFU yang rendah menandakan risiko kardiovaskular yang tinggi dan sebaliknya (Gambar 3).
Gambar 3 Hubungan antara FRS dengan jumlah EPC-CFU
Selanjutnya, Faulkes mempelajari pengaruh umur dan jenis kelamin terhadap EPC-CFU pada populasi untuk menetapkan standar
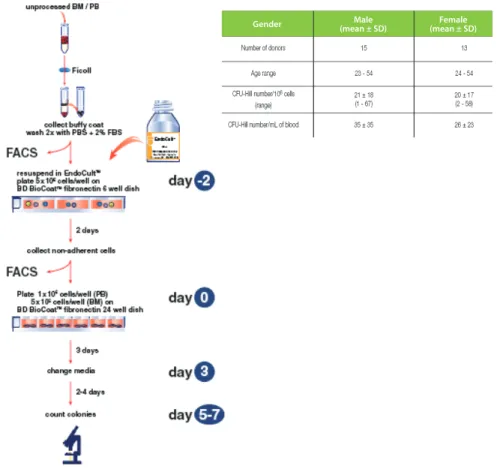
dan kategori risiko kardiovaskular berdasar-kan EPC-CFU. Hasilnya umur dan jenis kelamin tidak mempengaruhi jumlah EPC-CFU. Selain itu juga ditetapkan standar jumlah EPC-CFU yang dikategorikan sehat untuk tiap jenis ke-lamin (Tabel 3). Pada studi selanjutnya Faulkes juga menyusun standardisasi metode pengu-kuran jumlah EPC-CFU dari darah dan sum-sum tulang mulai dari mengkultur, karakteri-sasi EPC, dan penentuan jumlah EPC-CFU.45 Langkah-langkah penentuan koloni EPC-CFU dapat dilihat pada Gambar 4. Darah perifer dari subjek atau pasien diambil lalu diisolasi bagian buff y coat-nya (bagian yang berisi sel darah putih, monosit, makrofag, limfosit) lalu dibagi dua, sebagian dikarakterisasi dengan
Flowcytometry Automated Cell Sorter (FACS) dan sebagian lagi dikultur di cawan khusus se-lama 2 hari dengan media EndoCult®. Setelah 2 hari, sel yang tidak melekat pada cawan di-angkat dan dikumpulkan (sebagian dicirikan kembali dengan FACS). Sel-sel yang tidak me-lekat tersebut dikultur kembali pada cawan khusus selama 5 hari dengan penggantian
medium pada hari ketiga. Saat hari kelima, dilakukan penghitungan koloni EPC-CFU dan dicocokkan hasilnya dengan tabel. Simpulan sementara ialah jumlah EPC-CFU normal untuk pria usia 23-54 tahun berkisar 21±18 koloni se-dangkan untuk wanita berkisar 20±17 koloni. Jika hasil penghitungan koloni EPC-CFU sub-jek tidak masuk dalam kisaran, bisa dikategori-kan rentan terhadap penyakit kardiovaskular. Jumlah populasi yang lebih besar dan faktor-faktor lain selain penskoran FRS seperti peng-gunaan obat, kadar hormon, dan pengaruh sitokin (VEGF, GCSF, MMP9, dan SDF-1).3 Salah satu keunggulan pengukuran jumlah EPC-CFU ialah metodenya yang mudah dan su-dah terstandardisasi. Akan tetapi, metode ini masih memiliki kelemahan dalam hal penen-tuan kisaran baku untuk masing-masing ting-kat risiko (rendah, sedang, tinggi). Hal tersebut masih terus diupayakan melalui penyempur-naan metode penghitungan EPC-CFU sehing-ga bisa tervalidasi untuk menentukan risiko kardiovaskular dan lebih lanjut dapat saling mendukung dengan metode penskoran FRS.
Gambar 4 Metode kultur EPC dan kriteria penentuan nilai EPC-CFU untuk prediksi penyakit kardiovaskular45
Studi-studi berikutnya mencoba melibatkan
Male (mean ± SD) Female (mean ± SD) Gender CDK-195_vol39_no7_th2012 ok.indd 499 CDK-195_vol39_no7_th2012 ok.indd 499 7/8/2012 12:17:03 PM7/8/2012 12:17:03 PM
CDK-195/ vol. 39 no. 7, th. 2012
500
DAFTAR PUSTAKA
1. Ahmed A. American College of Cardiology/American Heart Association Chronic Heart Failure Evaluation and Management guidelines: relevance to the geriatric practice. J Am Geriatr Soc. 2003; 51:123-6.
2. Wilson PWF, et al. Prediction of Coronary Heart Disease Using Risk Factor Categories. 1998; Vol.97:1837-47.
3. Xiao Q. Endothelial progenitor cells, cardiovascular risk factors, cytokine levels and atherosclerosis: results from a large population-based study. PLoS One. 2007; 2:e975. 4. Nabel EG. Cardiovascular disease. N Engl J Med. 2003;349:60-72.
5. WHO. Cardiovascular Disease Prevention and Control: Translating Evidence into Action. 2005. 6. Broxmeyer L. Heart disease: the greatest ‘risk’ factor of them all. Med Hypotheses. 2004;62:773-9. 7. NIH. Depression and Heart Disease. 2002.
8. WHO. Cardiovascular Disease Atlas. 2009; p. 19-20.
9. Asahara T. Isolation of putative progenitor endothelial cells for angiogenesis. Science.1997;275:964-7.
10. Asahara T, Isner JM. Endothelial progenitor cells for vascular regeneration. J Hematother Stem Cell Res. 2002;11:171-8. 11. Iwami Y, Masuda H, Asahara T. Endothelial progenitor cells: past, state of the art, and future. J Cell Mol Med. 2004;8:488-97. 12. Asahara T. Endothelial progenitor cells for neovascularization. Ernst Schering Res Found Workshop. 2003;p211-6.
13. He T. Transplantation of circulating endothelial progenitor cells restores endothelial function of denuded rabbit carotid arteries. Stroke. 2004;35:2378-84. 14. Bahlmann FH, Fliser D. The plasticity of progenitor cells--why is it of interest to the nephrologists? Nephrol Dial Transplant. 2009;24:2018-20.
15. Koyanagi M, Brandes RP, Haendeler J, Zeiher AM, Dimmeler S. Cell-to-cell connection of endothelial progenitor cells with cardiac myocytes by nanotubes: a novel mechanism for cell fate changes? Circ Res. 2005;96:1039-41.
16. Ingram DA. Identifi cation of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood. Blood. 2004;104:2752-60. 17. Blann AD. Circulating endothelial cells. Biomarker of vascular disease. Thromb Haemost. 2005;93:228-35.
18. Hill JM. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 2003;348:593-600.
19. Smadja DM, Cornet A, Emmerich J, Aiach M, Gaussem P. Endothelial progenitor cells: characterization, in vitro expansion, and prospects for autologous cell therapy. Cell Biol Toxicol. 2007;23:223-39.
20. Chen JZ. Number and activity of endothelial progenitor cells from peripheral blood in patients with hypercholesterolaemia. Clin Sci (Lond). 2004;107:273-80. 21. Frisca, Sardjono CT, Sandra F. Berbagai paradigma pendefi nisian endothelial progenitor cells. Jurnal Kedokteran Maranatha. 2009;8:78-86.
22. Doyle B, Metharom P, Caplice NM. Endothelial progenitor cells. Endothelium. 2006;13:403-10.
23. Choi JH et al. Decreased number and impaired angiogenic function of endothelial progenitor cells in patients with chronic renal failure. Arterioscler Thromb Vasc Biol. 2004;24:1246-52. 24. Milkiewicz M, Ispanovic E, Doyle JL, Haas TL. Regulators of angiogenesis and strategies for their therapeutic manipulation. Int J Biochem Cell Biol. 2006;38:333-57.
25. Fuchs S, Hermanns MI, Kirkpatrick CJ. Retention of a diff erentiated endothelial phenotype by outgrowth endothelial cells isolated from human peripheral blood and expanded in long-term cultures. Cell Tissue Res. 2006;326:79-92.
26. Laufs U. Physical inactivity increases oxidative stress, endothelial dysfunction, and atherosclerosis. Arterioscler Thromb Vasc Biol. 2005;25:809-14. 27. Laufs U. Physical training increases endothelial progenitor cells, inhibits neointima formation, and enhances angiogenesis. Circulation. 2004;109:220-6. 28. Navarrete SA. Evidences for age-related modulation of human hematopoietic progenitor cell proliferation. Exp Gerontol. 2008:43:1033-8.
29. Scheubel RJ. Age-dependent depression in circulating endothelial progenitor cells in patients undergoing coronary artery bypass grafting. J Am Coll Cardiol. 2003;42:2073-80. 30. Zisch AH. Tissue engineering of angiogenesis with autologous endothelial progenitor cells. Curr Opin Biotechnol. 2004;15:424-9.
31. Hristov M, Erl W, Weber PC. Endothelial progenitor cells: isolation and characterization. Trends Cardiovasc Med. 2003;13:201-6. 32. Hristov M, Weber C. Endothelial progenitor cells in vascular repair and remodeling. Pharmacol Res. 2008;58:148-51.
33. De Falco E. SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells. Blood. 2004;104:3472-82. 34. Bahlmann FH. Endothelial progenitor cell proliferation and diff erentiation is regulated by erythropoietin. Kidney Int. 2003;64:1648-52.
35. Bahlmann FH. Stimulation of endothelial progenitor cells: a new putative therapeutic eff ect of angiotensin II receptor antagonists. Hypertension. 2005;45:526-9.
36. de Ruijter W. Use of Framingham risk score and new biomarkers to predict cardiovascular mortality in older people: population based observational cohort study. 2009;Vol. 338. 37. Wilson PW. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97:1837-47.
38. Cholestex Corporation. Framingham Risk Assessment. 2003.
39. Tzoulaki I, Liberopoulos G, Ioannidis J. Assessment of claims of improved prediction beyond the Framingham risk score. JAMA. 2009;302:2345-52.
40. Lee GKM. Framingham risk score inadequately predicts cardiac risk in young patients presenting with a fi rst myocardial infarction. Ann Acad Med Singapore. 2010;39:163-7. 41. Beswick A, Brindle P. Risk Scoring in The assessment of cardiovascular risk. Curr Opin Lipidol. 2006;17:375-386.
42. Ruijter W. Use of Framingham risk score and new biomarkers to predict cardiovascular mortality in older people: population based observational cohort study. BMJ. 2009;337:3083-91. 43. Govindaraju HRBV, Manjunath CN. Risk predicition- homocysteine in coronary heart disease. Ind Journal of Clin Biochem. 2007;22:18-21.
44. Cholestech. The Framingham Heart Study and Risk Assessment Tech Bul. 2003: p108.
45. Faulkes S, Prereira C, Thomas TE, Eaves AC, Clarke E. Standardization of a colony assay to further characterize endothelial precursor cells in blood and bone marrow. (StemCell Techologies, Vancouver, 2007).
SIMPULAN
EPC-CFU sebagai koloni yang terbentuk dari sel mononuklear darah perifer memiliki potensi sebagai indikator diagnostik untuk memeriksa
fungsi vaskular yang erat kaitannya dengan pe-nyakit kardiovaskular. Sel EPC sudah diketahui sebagai sel punca yang berperan penting dalam pembentukan pembuluh darah dan sel
endote-lial untuk pembentukan kembali sel-sel pembuluh darah yang rusak. Oleh karena itu, enumerasi EPC-CFU dapat dipertimbangkan sebagai biomarker
untuk diagnostik risiko kardiovaskular di Indonesia.
CDK-195_vol39_no7_th2012 ok.indd 500