125
Beberapa Oligomer Stilbenoid dari Tumbuhan Shorea multiflora Burck
Noviany1), Euis Holisotan Hakim1), Sjamsul Arifin Achmad1), Yana Maolana Syah1), Lia Dewi Juliawaty1),Norio Aimi2), Emilio L. Ghisalberti 3), dan Iqbal M. Choudhary4)
1)Kelompok Penelitian Kimia Organik Bahan Alam, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung, Jalan Ganesa 10, Bandung 40132, Indonesia 2)
Research Center of Medicinal Resources, Faculty of Pharmaceutical Sciences, Chiba University, 1-33, Yayoi-cho, Inage-ku, Chiba 263-8522, Japan
3)Department of Chemistry, The University of Western Australia, Crawley, WA 6009, Australia 4)H.E.J. Research Institute of Chemistry, University of Karachi-75270, Pakistan
Diterima Oktober 2002, disetujui untuk dipublikasikan Juni 2003
Abstrak
Dua dimer stilbenoid, (-)-balanokarpol (4), dan (-)-ampelopsin A (5), telah diisolasi bersama-sama dengan satu tetramer (-)-hopeafenol (6) dari ekstrak aseton kulit kayu Shorea multiflora Burck (Dipterocarpaceae), yang dikenal dengan nama Meranti. Struktur molekul ketiga senyawa tersebut ditetapkan berdasarkan data fisika dan spektroskopi UV, IR, 1H-NMR, dan 13C-NMR.
Kata kunci : (-)-ampelopsin A, (-)-balanokarpol, Dipterocarpaceae, (-)-hopeafenol, Meranti, Shorea multiflora
Burck.
Abstract
Two dimers of stilbenoids, (-)-balanocarpol (4), and (-)-ampelopsin A (5), along with a tetramer (-)-hopeaphenol (6) were isolated from the stem bark of Shorea multiflora Burck (Dipterocarpaceae), locally known as Meranti. Their structures were determined by physical and UV, IR, 1H-NMR, and 13C-NMR spectroscopic data.
Keywords : (-)-ampelopsin A, (-)-balanocarpol, Dipterocarpaceae, (-)-hopeaphenol, Meranti, Shorea multiflora
Burck.
1. Pendahuluan
Dipterocarpaceae merupakan salah satu famili dari keanekaragaman hayati hutan tropika Indonesia yang sangat berpotensi untuk dikembangkan, karena selain memiliki nilai ekonomi yang tinggi, tumbuhan ini juga menghasilkan berbagai jenis senyawa kimia, sebagian diantaranya memiliki aktivitas biologis yang menarik. Salah satu genus terbesar dalam famili Dipterocarpaceae adalah Shorea yang juga dikenal sebagai Meranti. Daerah tropis merupakan tempat penyebaran tumbuhan genus Shorea dan pusat distribusinya adalah Semenanjung Malaysia, Sumatera, dan Kalimantan. Di Indonesia sebagian besar dari tumbuhan ini terdapat di Kalimantan, 140 spesies, dan Sumatera, 53 spesies. Buah dari beberapa spesies yang termasuk genus ini merupakan komoditas ekspor, sedangkan getah damar yang dihasilkannya digunakan untuk berbagai keperluan, seperti dalam industri makanan, sabun, obat-obatan, dan kosmetika. Selain itu kayunya juga dikenal bermutu tinggi, sehingga sering digunakan sebagai bahan bangunan dan bahan untuk pembuatan perahu1).
Dari beberapa penelitian fitokimia yang telah dilakukan terhadap genus Shorea, dilaporkan adanya senyawa-senyawa golongan flavonoid, fenilpropanoid, asam fenolik2), serta terpenoid3).
Sejak satu dasawarsa terakhir ini, banyak penelitian dilakukan untuk mempelajari senyawa-senyawa polifenol khususnya golongan stilbenoid. Senyawa-senyawa ini banyak diminati karena memperlihatkan berbagai aktivitas biologis dan efek farmakologi yang menarik, seperti anti-bakteri4), anti-HIV5),
anti-inflamasi6), fitoaleksin, dan anti-jamur7).
Beberapa senyawa turunan fenol telah ditemukan sebelumnya pada tumbuhan Shorea multiflora Burck, seperti leukosianidin (1), kaemferol
(2), dan asam elagat (3)8). Namun, belum pernah
dilaporkan mengenai turunan stilbenoid dari spesies ini. Makalah ini membahas penemuan senyawa oligoresveratrol, yaitu balanokarpol (4), ampelopsin A (5), dan hopeafenol (6) dari ekstrak aseton kulit kayu Shorea multiflora Burck. Struktur senyawa (4) ditetapkan berdasarkan data spektroskopi UV, IR,
1H-NMR, dan MS, senyawa (5) ditetapkan
berdasarkan data spektroskopi UV, IR, 1H-NMR, 13C-NMR (1D dan 2D), sedangkan untuk senyawa
(6) ditetapkan berdasarkan pembandingan data fisika,
seperti titik leleh, putaran optik, dan perbandingan KLT dengan data senyawa standar.
JMS Vol. 8 No. 3, September 2003 126
2. Percobaan
Umum. Titik leleh ditentukan dengan
menggunakan alat penetapan titik leleh mikro. Spektrum UV dan IR diukur masing-masing dengan spektrofotometer Varian Cary 100 Conc. dan ONE Perkin Elmer. Spektrum 1H dan 13C-NMR diukur
menggunakan spektrometer Bruker AM 300 yang bekerja pada 500,13 MHz (1H) dan 125,8 MHz (13C),
menggunakan TMS sebagai standar internal. Kromatografi cair vakum (KCV) dilakukan menggunakan Si gel Merck 60 GF254, kromatografi
tekan dengan Si gel Merck 60 (230-400 mesh), dan
analisis kromatografi lapis tipis (KLT) pada pelat aluminium berlapis Si gel Merck Kieselgel 60 F254,
0,25 mm.
Pengumpulan Bahan Tumbuhan. Bahan
tumbuhan berupa kulit kayu Shorea multiflora Burck., dikumpulkan pada bulan Juni 2001 dari Kebun Percobaan Darmaga, Bogor. Spesimen tumbuhan ini diidentifikasi oleh Herbarium Bogoriense, Lembaga Penelitian dan Pengembangan Biologi, LIPI, Bogor, dan spesimennya tersimpan di herbarium tersebut.
Gambar 1. Struktur senyawa kimia yang diisolasi
O HO OH OH OH OH O O HO OH OH OH (1) (2) OH OH HO OH (3) HO O O O O OH O H H H H OH OH HO HO OH HO (4) (5) (6) O H H H H OH HO HO OH OH O HO HO OH OH HO H H H H A1 A2 B2 B1 1a 7a 8a 4a 1b 4b 12a 14a 7b 8b 12b 14b O HO HO OH OH H H OH H H B1 B2 A1 A2 1a 4a 7a8a 8b 7b 1b 4b 12a 14a OH 12b 14bEkstraksi dan Isolasi. Kulit batang yang
telah dikeringkan dan digiling (7 kg), dimaserasi dengan aseton. Setelah pelarut diuapkan pada tekanan rendah, diperoleh ekstrak aseton berupa residu berwarna coklat (180 g). Ekstrak aseton dilarutkan dalam metanol kemudian dipartisi dengan n-heksana. Setelah pelarut diuapkan pada tekanan rendah diperoleh ekstrak metanol berupa residu berwarna coklat (60 g). Ekstrak metanol dilarutkan kembali dalam aseton kemudian difraksinasi tiga kali berturut-turut dengan kromatografi cair vakum (200 g, 7 cm x 10 cm) menggunakan eluen n-heksana, campuran n-heksana-etil asetat (75:25), etil asetat, dan metanol dengan kepolaran yang terus ditingkatkan, menghasilkan 28 fraksi. Penggabungan fraksi-fraksi tersebut berdasarkan analisis KLT menghasilkan tujuh fraksi utama. Fraksi utama kedua yang merupakan penggabungan fraksi 12-20 (14 g), difraksinasi lebih lanjut dengan kromatografi cair vakum (140 g, 7 cm x 10 cm), menggunakan berturut-turut eluen n-heksana, campuran CH2Cl2
-MeOH (9:1), CH2Cl2, dan metanol dengan kepolaran
yang terus meningkat, menghasilkan sembilan fraksi gabungan utama.
Selanjutnya fraksi gabungan ketujuh (1,2 g) difraksinasi kembali menggunakan kromatografi radial dengan eluen campuran n-heksana-etil asetat-metilen klorida (8:1:1), dan metanol menghasilkan 11 fraksi. Gabungan fraksi ketiga (435 mg) kemudian difraksinasi berulang kali menggunakan kromatografi radial dengan campuran eluen kloroform-MeOH (9:1) menghasilkan sejumlah fraksi yang digabung menjadi dua fraksi utama. Selanjutnya pada fraksi utama pertama yang merupakan gabungan fraksi 1-9 (240 mg), difraksinasi lebih lanjut menghasilkan sejumlah fraksi utama. Pada penggabungan fraksi 9-13 (35 mg), diperoleh padatan berwarna kuning yang pada kristalisasi dari campuran kloroform-MeOH (8:2) menghasilkan ampelopsin A (5) (20 mg) berupa padatan berwarna kuning pucat yang homogen pada KLT dengan tiga sistem eluen. Dengan menggunakan cara yang sama, dari gabungan fraksi utama ketiga, diperoleh senyawa balanokarpol (4) (30 mg). Sedangkan dari gabungan fraksi utama kedua, diperoleh hopeafenol (6) (20 mg) berupa padatan berwarna kuning muda yang homogen pada KLT menggunakan tiga sistem eluen.
Balanokarpol (4) diperoleh sebagai padatan berwarna kuning pucat, titik leleh 224o C (terurai);
[α]D20 : -16o (c. 0,1 MeOH); IR (KBr) νmaks 3400 cm -1(OH), 1614, 1513, 1453, 1347, 1242, 1174, 1133, 835 cm-1 (aromatik); UV (MeOH) λ maks (log ε): 204 (1,03), 227 (0,64), 284 (0,17) nm; (MeOH + NaOH): 206 (1,81), 250 (0,41), 287 (0,19) nm; EIMS m/z : 470 (20), 452 (55), 348 (90), 254 (25), 107 (65), 94 (100); 1H-NMR (MeOD, 400,13 MHz) δ 7,44 (2H, dd, J = 8,5 dan 2,8 Hz, H-2(6)b), 6,89 (2H, dd, J = 8,6 dan 2,3 Hz, H-2(6)a), 6,66 (2H, dd, J = 8,6 dan 2,3 Hz, H-3(5)a), 6,39 (2H, dd, J = 8,5 dan 2,8 Hz,
H-3(5)b), 6,14 (2H, s, H-12b, H-14b), 5,97 (1H, d, J = 2,0 Hz, H-14a), 5,93 (1H, d, J = 2,0 Hz, H-12a), 5,67 (1H, d, J = 9,3 Hz, H-7b), 5,35 (1H, d, J = 2,2 Hz, H-8a), 5,11 (1H, d, J = 9,3 Hz, H-8b).
Ampelopsin A (5) diperoleh sebagai padatan berwarna kuning pucat, titik leleh 236o C (terurai);
[α]D20 : -159o (c. 0,1 MeOH); IR (KBr) νmaks 3342 cm -1(OH), 1614, 1515, 1489, 1451, 1339, 1233, 1175, 1134, 835 cm-1 (aromatik); UV (MeOH) λ maks (log ε): 208 (2,48), 232 (1,26), 283 (0,31) nm; (MeOH + NaOH): 209 (2,04), 250 (1,14), 288 (0,35) nm; 1 H-NMR (aseton-d6, 500,13 MHz) δ 8,44 (1H, br s, OH-4b), 8,30 (1H, br s, OH-4a), 8,24 (1H, br s, OH-13b), 8,12 (1H, br s, OH-11b), 8,06 (1H, br s, OH-4a), 7,10 (2H, dd, J = 8,1 dan 2,0 Hz, H-2(6)b), 6,88 (2H, d, J = 8,7 Hz, H-2(6)a), 6,76 (2H, dd, J = 8,1 dan 2,0 Hz, H-3(5)b), 6,61 (2H, dd, J = 8, 7 dan 2,1 Hz, H-3(5)a), 6,59 (1H, d, J = 2,2, H-14a), 6,42 (1H, d, J = 2,3 Hz, H-12b), 6,22 (1H, br s, H-14b), 6,14 (1H, d, J = 2,2 Hz, H-12a), 5,75 (1H, d, J = 11,4 Hz, H-7b), 5,44 (1H, d, J = 4,9 Hz, H-7a), 5,40 (1H, dd, J = 7,6 dan 4,9 Hz, H-8a), 4,15 (1H, d, J = 11,4 Hz, H-8b), 3,44 (1H, d, J = 7,6 Hz, OH-8a); 13C-NMR (aseton-d 6,
125,8 MHz) δ 160,2 (11a), 159,0 (13a dan C-13b), 158,6 (C-4b), 157,4 (C-11b), 156,1 (C-4a), 143,1 9b), 140,3 9a), 132,8 1a), 131,2 1b), 130,0 2(6)b), 128,8 2(6)a), 116,0 3(5)b), 115,5 3(5)a), 119,1 10a), 118,3 (C-10b), 110,6 (C-14a), 105,6 (C-14b), 101,6 (C-12b), 97,1 (C-12a), 88,5 (C-7b), 71,2 (C-8a), 49,6 (C-8b), 44,0 (C-7a).
Hopeafenol (6) : diperoleh sebagai padatan berwarna putih, titik leleh 274o C (terurai); [α]
D20 :
-313o (c. 0,1 MeOH); IR (KBr) ν
maks 3335 cm-1 (OH),
2910 (CH-alifatik), 1615, 1600, 1516, 1456 cm-1
(aromatik); UV (MeOH) λmaks (log ε): 203 (1,17), 231
(0,49), 280 (0,23) nm; (MeOH + NaOH) 205 (2,12), 251 (0,49), 281 (0,36) nm.
3. Pembahasan
Pada ekstraksi kulit batang S. multiflora Burck, telah diisolasi dua dimer stilbenoid, yaitu balanokarpol (4), dan ampelopsin A (5), serta satu tetramer, hopeafenol (6). Ketiga senyawa tersebut diperoleh melalui beberapa tahap fraksinasi, diikuti oleh pemilihan fraksi utama berdasarkan analisis kromatografi lapis tipis (KLT) dan kromatografi partisi. Senyawa dimer stilbenoid pertama, yaitu balanokarpol (4), diperoleh sebagai padatan yang berwarna kuning pucat, dengan titik leleh 224o C
(terurai). Spektrum UV senyawa 4 memperlihatkan λmaks (MeOH) pada 204, 227, dan 284 nm, sedangkan
spektrum IR menunjukkan pita-pita serapan untuk gugus hidroksil pada νmaks 3400 cm-1, cincin benzena
pada 1614, 1513, 1453, dan cincin benzena tersubstitusi para pada 835 cm-1 yang menyarankan
suatu stilbenoid. Spektrum massa (EIMS) senyawa 4 memberikan ion molekul pada m/z 470 yang sesuai untuk dimer resveratrol dengan rumus molekul
JMS Vol. 8 No. 3, September 2003 128
C28H22O7. Selanjutnya fragmen ion pada m/z 452
(M+- H
2O) mengindikasikan suatu turunan fenol yang
mengandung enam gugus fenol, dan suatu gugus hidroksil alifatik. Spektrum 1H-NMR senyawa 4
memperlihatkan pula sejumlah sinyal, diantaranya empat sinyal proton untuk dua set proton yang saling kopling orto dari dua unit 4-hidroksifenil pada δ 7,44 (2H, dd, J = 8,5 dan 2,8 Hz, H-2b, 6b), 6,89 (2H, dd, J = 8,6 dan 2,3 Hz, H-2a, 6a), 6,66 (2H, dd, J = 8,6 dan 2,3 Hz, H-3a, 5a), 6,39 (2H, dd, J = 8,5 dan 2,8 Hz, H-3b, 5b). Disamping itu terdapat dua sinyal proton untuk proton yang saling kopling meta pada 5,97 (1H, d, J = 2,0 Hz, H-14a), dan 5,93 (1H, d, J = 2,0 Hz, H-12a), serta adanya satu sinyal proton yang mewakili dua proton dengan orientasi meta pada 6,14 (2H, s, H-12b, 14b). Kedua proton ini tidak kopling satu sama lain, kemungkinan disebabkan adanya efek anisotropi dari unit 4-hidroksifenil pada cincin B.
Selain itu spektrum 1H-NMR juga menunjukkan
adanya dua proton metil alifatik yang lazim bagi suatu cincin dihidrofuran pada δ 5,67 (1H, d, J = 9,3 Hz, H-7b), 5,11 (1H, d, J = 9,3 Hz, H-8b). Kemudian sinyal lainnya adalah suatu doblet pada δ 5,35 (1H, d, J = 2,2 Hz, H-8a) yang mengindikasikan adanya proton dari karbon metin yang terikat gugus hidroksi, sedangkan sinyal proton metil alifatik yang terikat pada C-7a tidak tampak pada spektrum 1
H-NMR, kemungkinan disebabkan karena tertutupi oleh sinyal lain yang dapat berasal dari pelarut maupun pengotor di daerah 4,8-4,9 ppm. Data tersebut di atas mengindikasikan bahwa senyawa 4 adalah balanokarpol. Kesimpulan ini didukung oleh pembandingan data tersebut dengan data yang dilaporkan untuk balanokarpol (Tabel 1) yang telah diisolasi sebelumnya dari Balanocarpus zeylanicus dan Hopea jucunda9).
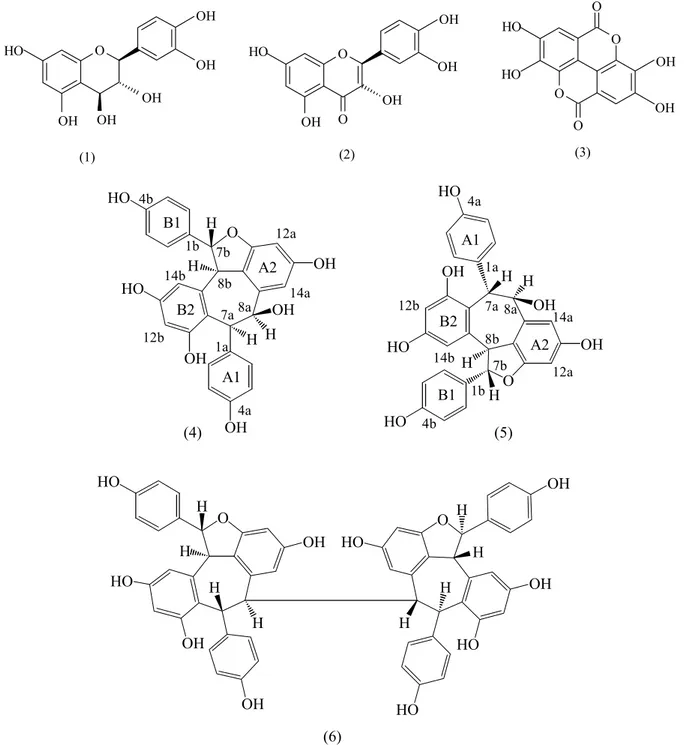
Tabel 1. Perbandingan data 1H-NMR balanokarpol (4) dengan beberapa dimer stilbenoid
No Balanokarpol (4) δH (m, J. Hz) ppm (400 MHz, MeOD) Data literatur (-)-Balanokarpol 9 δH (m, J. Hz) ppm (250 MHz, CD3OD) Data literatur (-)-Hemsleyanol A 10 δH (m, J. Hz) ppm (400 MHz, aseton-d6) 1a 2(6)a 3(5)a 4a 7a 8a 9a 10a 11a 12a 13a 14a 1b 2(6)b 3(5)b 4b 7b 8b 9b 10b 11b 12b 13b 14b 6,89 (dd, 2,3 ; 8,6) 6,66 (dd, 2.3 ; 8,6) 5,35 (d, 2,2) 5,93 (d, 2,1) 5,97 (d, 2,1) 7,44 (dd, 2,8 ; 8,5) 6,39 (dd, 2,8 ; 8,5) 5,67 (d, 9,3) 5,11 (d, 9,3) 6,14 (s) 6,14 (s) 6,92 (d, 8,5) 6,69 (d, 8,5) 5,39 (d, 2,0) 5,98 (s) 5,98 (s) 7,46 (d, 8,4) 6,41 (d, 8,4) 5,72 (d, 9,2) 5,14 (d, 9,2) 6,17 (s) 6,17 (s) 6,72 (d, 8,3) 6,48 (d, 8,3) 5,07 (d, 5,9) 4,76 (br s) 6,04 (d, 2,0) 5,70 (d, 2,0) 7,48 (d, 8,3) 6,94 (d, 8,3) 5,75 (d, 9,8) 5,41 (d, 9,8) 6,24 (br s) 6,23 (br s) Senyawa (5) hasil isolasi ditetapkan
strukturnya dengan cara yang sama seperti penetapan struktur senyawa balanokarpol. Spektrum 1H dan 13
C-NMR senyawa 5 dapat dinyatakan secara rinci dengan bantuan spektrum NMR dua dimensi (2D), yaitu spektrum korelasi heteronuklir 1H -13C COSY
kuantum rangkap (HMQC), spektrum korelasi jarak jauh (HMBC), dan spektrum NOESY11). Korelasi
HMBC senyawa 5 ditunjukkan pada Gambar 2, sedangkan percobaan NOE dari spektrum NOESY
tercantum pada gambar 3. Pada percobaan NOE dari spektrum NOESY, memperlihatkan adanya interaksi antara H-2a(6a)/H-8a, H-7a/C-8a-OH, H-7b/H-14b, H-8b/H2b(6b) mengindikasikan bahwa cincin A1
/H-8a dan cincin B1/H-8b berorientasi cis satu sama lain.
Kemudian adanya interaksi antara H-8b/H-2a(6a) menunjukkan bahwa cincin A1 dan H-8b juga
berorientasi sama yaitu cis. Dengan demikian dari data percobaan, NOE dapat disimpulkan bahwa stereokimia relatif senyawa 5 sama seperti senyawa
ampelopsin A12,13). Bukti selanjutnya mengenai
struktur senyawa 5 diperoleh dari perbandingan data
1H-NMR dan 13C-NMR senyawa 5 dengan yang telah
dilaporkan sebelumnya untuk ampelopsin A (Tabel 2)13). Berdasarkan data seperti dikemukakan di atas,
dapat disimpulkan bahwa senyawa 5 adalah ampelopsin A. Ampelopsin A (5) merupakan stereoisomer dari senyawa balanokarpol (4), yaitu pada posisi C-7a, dimana stereokimia relatif untuk ampelopsin A adalah trans, sedangkan untuk balanokarpol adalah cis13).
Hopeafenol (6) diperoleh sebagai serbuk berwarna kuning muda, dengan titik leleh 274oC
(terurai), dan putaran optik : -313o (c.0,1 MeOH).
Spektrum UV senyawa 6 memperlihatkan λmaks
(MeOH) pada 203 (1,17), 231 (0,49), 280 (0,23) nm, yang mengindikasikan adanya kromofor fenolik yang tidak mengalami pergeseran batokromik pada penambahan NaOH. Sedangkan spektrum IR memperlihatkan adanya pita-pita serapan untuk gugus hidroksil pada νmaks 3335 cm-1, adanya pita
serapan untuk metil-alifatik pada 2910 cm-1, dan
cincin benzena tersubstitusi para pada 1615, 1600, 1516, 1456 cm-1. Data UV dan IR di atas
memperlihatkan pola serapan yang khas dan karakteristik untuk suatu senyawa turunan fenol khususnya oligomer stilbenoid.
Tabel 2. Perbandingan nilai pergeseran kimia (δ) 1H-NMR dan 13C-NMR senyawa hasil isolasi dengan senyawa
ampelopsin A (literatur)13
Senyawa hasil isolasi kedua Ampelopsin A (literatur) No δH (m, J. Hz) ppm δC ppm δH (m, J. Hz) ppm δC ppm
(500 MHz, (125 MHz, (400 MHz, (100 MHz,
aseton-d6) aseton-d6) aseton-d6) aseton-d6)
1a 132,8 130,9 2(6)a 6,88 (d, 8,7) 128,8 6,88 (d, 8,3) 128,7 3(5)a 6,61 (dd, 8,7 ; 2,1) 115,5 6,62 (d, 8,3) 115,4 4a 156,1 156,0 7a 5,44 (d, 4,9) 43,9 5,45 (d, 4,9) 43,8 8a 5,40 (dd, 7,6 ; 4.9) 71,2 5,42 (brd, 4,9) 71,2 9a 140,3 140,2 10a 119,1 118,9 11a 160,2 160,1 12a 6,14 (d, 2,2) 97,1 6,14 (d, 1,9) 97,1 13a 158,9 158,8 14a 6,59 (d, 2,2) 110,6 6,64 (d, 1,9) 110,5 1b 131,2 132,5 2b 7,10 (dd, 8,6 ; 2,0) 130,0 7,09 (d, 8,8) 129,9 3b 6,76 (dd, 8,7 ; 2,1) 116,0 6,75 (d, 8,8) 116,0 4b 158,6 158,4 5b 6,76 (dd, 8,7 ; 2,1) 116,0 6,75 (d, 8,8) 116,0 6b 7,10 (dd, 8,6 ; 2,0) 130,0 7,09 (d, 8,8) 129,9 7b 5,75 (d, 11,4) 88,5 5,42 (d, 11,3) 88,3 8b 4,15 (d, 11,4) 49,6 4,15 (d, 11,3) 49,5 9b 143,1 143,1 10b 118,3 118,2 11b 157,4 157,2 12b 6,42 (d, 2,3) 101,6 6,42 (d, 2,5) 101,6 13b 158,9 158,8 14b 6,22 brs 105,6 6,21 brs 105,5 OH 3,44 (d, 7,6), C-8a 3,57 brs (C-8a) 8,06 brs 8,08 brs 8,12 brs 8,17 brs 8,24 brs 8,26 brs 8,30 brs 8,32 brs 8,44 brs 8,40 brs
JMS Vol. 8 No. 3, September 2003 2
Gambar 2. Korelasi HMBC yang utama senyawa 5
Gambar 3. Interaksi NOE dari spektrum NOESY senyawa 5 Senyawa hasil isolasi ketiga ini sudah
dikenal sebelumnya, dan ditemukan pada sebagian besar genus Shorea, sehingga penetapan strukturnya dilakukan dengan pembandingan data spektrum UV dan IR serta perbandingan data fisika, seperti sifat fisik, titik leleh, putaran optik, dan KLT dengan menggunakan tiga sistem eluen antara senyawa hasil isolasi dengan hopeafenol standar yang berhasil diisolasi dari Shorea selanica Blume, dan telah berhasil ditetapkan strukturnya dengan bantuan spektroskopi massa, 1H-NMR, 13C-NMR, dan NMR dua dimensi (2D)14). Pada pembandingan KLT kedua
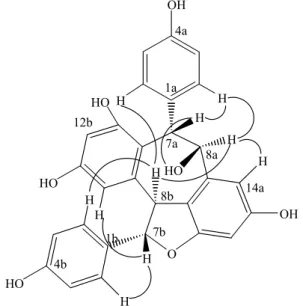
senyawa dengan menggunakan eluen n-heksana : aseton (1:1, Rf: 0,3), kloroform : metanol (75:25, Rf: 0,4), dan metilen klorida : aseton (1:1, Rf: 0,5) memberikan nilai Rf yang sama dan noda yang homogen. Demikian pula dengan perbandingan data spektrum UV (Gambar 4) dan IR (Gambar 5) antara senyawa hasil isolasi dengan hopeafenol standar, memperlihatkan pola-pola serapan yang sama dan identik dengan derajat kesesuaian sebesar 98%. Berdasarkan uraian di atas, dapat disimpulkan bahwa senyawa hasil isolasi adalah senyawa hopeafenol11).
4a 1a 7a 8a 7b 1b 14a 8b 4b 12b O H H HO H H OH OH HO HO OH H H H H H 4a 1a 7a 8a 7b 1b 14a 8b 4b 12b O H H HO H H OH OH HO HO HO H H H H H H
Gambar 4. Perbandingan spektrum UV antara senyawa hasil isolasi (1A) dengan hopeafenol standar (1B)
Gambar 5. Perbandingan spektrum IR antara senyawa hasil isolasi (2A) dengan hopeafenol standar (2B) (1B)
Panjang Gelombang Panjang Gelombang
Panjang Gelombang Panjang Gelombang
(1A)
(2A)
3 JMS Vol. 8 No. 3, September 2003
Ditemukannya ketiga senyawa tersebut merupakan data baru bagi tumbuhan Shorea multiflora Burck, dan mendukung biogenesis yang telah disarankan sebelumnya9). Uji aktivitas biologis
senyawa hasil isolasi terhadap Artemia salina dengan menggunakan metode brine shrimp lethality test15),
memperlihatkan aktivitas sitotoksik dengan harga LC50= 191,6 µg/ml untuk hopeafenol, sedangkan
ampelopsin A dan balanokarpol bersifat tidak aktif dengan harga LC50>500 µg/ml16). Namun, telah
dilaporkan bahwa ketiga senyawa tersebut masing-masing memperlihatkan aktivitas sebagai anti-HIV5),
sitotoksik terhadap sel KB karsinoma epidermoid16),
dan sitotoksik terhadap sel murine leukimia P-38814).
Kesimpulan
Tumbuhan S. multiflora Burck mengandung dua dimer stilbenoid, yaitu balanokarpol (4), dan ampelopsin A (5), serta satu tetramer stilbenoid, hopeafenol (6).
Ucapan Terimakasih
Terimakasih disampaikan kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional, atas bantuan dana BPPS. Terimakasih disampaikan pula kepada Kebun Percobaan Darmaga Bogor dan Herbarium Bogoriense, Bogor, yang telah membantu mengidentifikasi spesimen tumbuhan.
Daftar Pustaka
1. Heyne, K., “Tumbuhan Berguna Indonesia”. Vol. II. Balai Kehutanan Indonesia, 1432 (1987). 2. Saha, P.K., & Ganguly, S.N., “Shorbic Acid, A
New Phenolic from Seeds of Shorea robusta” Fitoterapia, 50(1), 7-9 (1979).
3. Zheng, Zhebin, Zhao, S. Deng, J., Zhao, H., Ye, W., & Wang, M., “Triterpenes from Root Bark of Shorea wangianshuea”. Zhongguo Yaoke Daxue Xuebao, 25(5), 262-264 (1994).
4. Sultanbawa, M.U.S., Surendrakumar, S., & Bladon, P., “Distichol, An Antibacterial Polyphenol from Shorea disticha”. Phytochemistry, 26(3), 799-801 (1987).
5. Dai, J.R., Hallock, Y.F., Cardellina, J.H.H., & Boyd, M.R., “HIV-Inhibitory and Cytotoxicity Oligostilbenes from the Leaves of Hopea malibato”, J. Nat. Prod., 61, 351-353 (1998). 6. Huang, K., Mao Lin, & Gui-Fang Cheng. “
Anti-inflammatory Tetramers of Resveratrol from the Roots of Vitis amurensis and the Conformations of the Seven Membered Ring in Some Oligostilbenes.” Phytochemistry, 58, 357-362 (2001).
7. Bokel, M., Diyasena, M.N.C., Leslie, A.A., Gunatilaha, & Sotheeswaran, S., “Canaliculatol, An Antifungal Resveratrol Trimer from
Stemonoporous canaliculatus”. Phytochemistry,
27(2), 377-380 (1988).
8. Hegnaeur, R. “Chemotaxonomic Der Planzen II”. Birkauser Band 4, Verlag Basel und Stuttgart. 31-39 (1967).
9. Diyasena, M.N.C., Sotheeswaran, S., Surendrakumar, S., Balasubramaniam, S., Bokel, M., & Kraus, W., “Balanocarpol, a New Polyphenol from Balanocarpus zeylanicus (Trimen) and Hopea jucunda (Thw.) (Dipterocarpaceae)”, J. Chem. Soc. Perkin Trans I, 8, 1807-1809 (1985).
10. Ito, T., Tanaka, T., Ido, Y., Nakaya, K-I., Iinuma, M., & Riswan, R., “Stilbenoids Isolated from Stem Bark of Shorea hemsleyana”, Chem. Pharm. Bull., 48(7), 1001-1005 (2000).
11. Noviany, Hakim, E.H., Achmad, S.A., Aimi, N., Syah, Y.M., Juliawaty, L.D., Ghisalberti E. L., & Choudhary I. M., “Senyawa Oligomer Stilbenoid dari Tumbuhan Shorea multiflora Burck”, Prosiding Seminar Nasional Kimia ‘Kimia dan Mutu Kehidupan’, FPMIPA UPI Bandung, 186-193 (2002).
12. Oshima, Y., Yuji Ueno, Hiroshi Hikino, Ling-Ling Yang & Kun-Ying Yen. “Ampelopsins A, B, and C, New Oligostilbenes of Ampelopsis brevipedundulata var. Hancei”. Tetrahedron,
46(15), 5121-5126 (1990).
13. Tanaka, T., T. Ito, Y. Ido, T.K. Son, K. Nakaya, M. Iinuma, M. Ohyama, & V. Chelladurai. “Stilbenoids in Stem Bark of Hopea parviflora”. Phytochemistry, 53, 1015-1019 (2000).
14. Tukiran, Achmad, S.A., Hakim, E.H., Syah, Y.M., Makmur, L., Mujahidin, D., & Takeya, K., “Hopeaphenol, a Dehydroresveratrol Tetramer from Indonesian Shorea selanica Blume (Dipterocarpaceae)”, International Seminar on Natural Products Chemistry and Utilization of Natural Resources, Jakarta, Indonesia, Abstr., OP12A, 40 (2001).
15. Meyer, B.N., Mc Laughlin, J.L & Ferrigni, N.R., “Brine Shrimp: a Convenient General Bioassay for Active Natural Plant Compounds”, Planta Medica, 45, 31-34 (1982)
16. Ohyama, M., Tanaka, T., Ito, T., Iinuma, M., Bastow, K.F., & Lee, K-H., “Antitumor Agents 200.1 Cytotoxicity of Naturally Occuring Resveratrol Oligomer and Their Acetate Derivatives”, Bioorg. Med. Chem. Lett., 9, 3057-3060 (1999).
17. Aminah, N.S., Achmad, S.A., Aimi, N., Hakim, E.H., Syah, Y.M., Makmur, L., Juliawaty, L.D., Kitajima, M., Mujahidin, D., & Takayama, H., “Oligomer Stilbenoids: α-Viniferin, Hopeaphenol, and Related Compounds from Shorea seminis V.Sl. (Dipterocarpaceae)”, Padang, Indonesia, Abstr. P A06, 77 (2001).