PRODUKSI BIOHIDROGEN MELALUI FERMENTASI BAKTERI
FOTOSINTETIK Rhodobium marinum DAN ISOLAT SANUR
MUHAMMAD SIDIQ HABIBI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
MUHAMMAD SIDIQ HABIBI. Produksi Biohidrogen melalui Fermentasi Bakteri
Fotosintetik Rhodobium marinum dan Isolat Sanur. Dibimbing oleh DJAROT
SASONGKO HAMI SENO dan DWI SUSILANINGSIH.
Bioenergi merupakan energi terbarukan dan prospektif untuk dikembangkan.
Pengembangan bioenergi ini tidak hanya dapat mengurangi ketergantungan terhadap
bahan bakar minyak, tetapi juga dapat meningkatkan keamanan pasokan energi
nasional. Biohidrogen merupakan salah satu bentuk bioenergi yang dapat dimanfaatkan
sebagai sumber bahan bakar, kaperluan industri, dan nuklir. Penelitian ini bertujuan
memproduksi gas hidrogen melalui fotofermentasi bakteri Rhodobium marinum dan
konsorsium bakteri isolat Sanur dengan memanfaatkan glukosa 1% sebagai substrat.
Fotofermentasi ini dilakukan dengan cara kultur bakteri R. marinum dan isolat Sanur
(OD = 1) disentrifugasi pada 6000 rpm selama 20 menit. Kemudian masing-masing
peletnya diresuspensi dengan 75 ml media produksi yang mengandung glukosa 1%
dalam botol serum 100 ml dan dipasang pada bioreaktor (120 rpm, 30ºC, cahaya lampu
TL 60 watt). Hasil penelitian menunjukkan bahwa bakteri R. marinum mampu
memanfaatkan glukosa 1% untuk memproduksi gas hidrogen sebanyak 127.311 ml dari
205.25 ml total gas yang dihasilkan (62%) dengan kecepatan produksi 3.81
mmolH
2jam
-1L
-1medium. Konsorsium bakteri isolat Sanur juga mampu memproduksi
103.61 ml gas hidrogen dari 165.25 ml total gas yang dihasilkan (63%) dengan
kecepatan produksi 2.8 mmol H
2jam
-1L
-1medium.
ABSTRACT
MUHAMMAD SIDIQ HABIBI. Biohydrogen Production by Fermentation of
Photosynthetic Bacteria Rhodobium marinum and Sanur Isolate. Under the direction of
DJAROT SASONGKO HAMI SENO and DWI SUSILANINGSIH.
Bioenergy is renewable energy and prospective to be developed. It is not only can
reduce our dependence of fueloil, but also can increase safety of national stock energy.
Biohydroen is a type of bioenergy which used as fuel cell, industry necessity, and
nuclear. This research have focus on production of hydrogen gas by photofermentation
of Rhodobium marinum and bacteria consortium of Sanur isolate using glucose 1% as a
substrate. This photofermentation was done with R. marinum and Sanur isolate were
centrifuged (6000 rpm, 20 minutes). Then each pellet was resuspented in 75 ml
production medium which containing glucose 1% on 100 ml serum bottles and be seted
on bioreactor (120 rpm, 30ºC , TL light 60 watts). The result shown that R. marinum
ability to used glucose 1% to produce 127.311 ml hydrogen gas of 205.25 gas completly
that produced (62%) with production rate is 3.81 mmolH
2h
-1L
-1medium. Bacteria
consortium of Sanur isolate also can produce 103.61 ml hydrogen gas of 165.25 ml gas
PRODUKSI BIOHIDROGEN MELALUI FERMENTASI BAKTERI
FOTOSINTETIK Rhodobium marinum DAN ISOLAT SANUR
MUHAMMAD SIDIQ HABIBI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
5
Judul Skripsi
: Produksi Biohidrogen melalui Fermentasi Bakteri Fotosintetik
Rhodobium marinum dan Isolat Sanur
Nama
: Muhammad Sidiq Habibi
NIM
: G44104003
Disetujui
Komisi Pembimbing
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Tanggal Lulus:
Anggota
Dr. Dwi Susilaningsih, M. Pharm
Drs. Djarot Sasongko Hami Seno, M.S
6
PRAKATA
Alhamdulillah penulis panjatkan atas karunia yang diberikan oleh Allah
SWT sehingga penulis dapat menyelesaikan karya ilmiah ini yang berjudul
Produksi Biohidrogen melalui Fermentasi Bakteri Fotosintetik Rhodobium
marinum dan Isolat Sanur. Penelitian dilaksanakan pada bulan Maret 2008 sampai
September 2008 di Laboratorium Bioproses, Pusat Penelitian Bioteknologi,
Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong; Jalan Raya Bogor Km 46
Cibinong, Bogor.
Terima kasih penulis sampaikan kepada Bapak Drs. Djarot Sasongko Hami
Seno, MS dan Dr. Dwi Susilaningsih, M. Pharm selaku pembimbing atas segala
arahan, bimbingan, dan fasilitas selama penelitian, serta kepada Lembaga Ilmu
Pengetahuan Indonesia (LIPI) yang telah mendanai penelitian ini. Di samping itu,
penghargaan penulis sampaikan kepada Bu Mega, Mas Anam, Mas Swastika, Mas
Asep, Mas Diki, Mbak Umi, Mbak Dian, Mbak Lina, Mbak Lia, Mbak Riesa,
Yestyani Ana Anggraeny, dan seluruh staf di Laboratorium Bioproses, Pusat
Penelitian Bioteknologi LIPI, serta teman-teman PS Biokimia khususnya
angkatan 41 atas segala bantuan dan kerjasamanya. Ucapan terma kasih yang tak
terhingga kepada Ayah, Ibu, serta seluruh keluarga atas segala doa dan kasih
sayangnya.
Semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Maret 2009
7
RIWAYAT HIDUP
Penulis dilahirkan di Bumiayu pada tanggal 21 September 1984 sebagai
anak keenam dari pasangan Bapak Mahmuri dan Ibu Tarsem. Tahun 2004 penulis
lulus dari SMUN 1 Bumiayu dan pada tahun yang sama penulis diterima masuk di
Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjadi mahasiswa aktif di IPB, penulis menjadi staf Departemen
Biokimia Tumbuhan Community of Research and Education in Biochemistry
(CREB’s) pada periode 2005-2006, dan Koordinator Dewan Pengawas CREB’s
bidang keilmuan pada periode 2006-2007. Penulis juga pernah menjadi wakil
ketua Tim Ekonomi DKM Al-Ghifari IPB pada periode 2006-2007. Penulis aktif
berpartisipasi dalam perlombaan Program Kreatifitas Mahasiswa (PKM) yang
didanai DIKTI, diantaranya PKM-Teknologi dengan judul Pemanfaatan Zeolit
dan Khitosan dalam Pengolahan Bahan Baku Air Minum (2007), PKM-Penelitian
degan judul Khitosan sebagai Bahan Antibakteri (2008), PKM-Teknologi dengan
judul Kertas Antibakteri Berbasis Khitosan (2008), dan PKM-Teknologi dengan
judul Teknologi Desalinisasi Air Laut Menggunakan Campuran Khitosan, Zeolit,
dan Arang Aktif (2008). Penulis juga menjadi finalis Pemilihan Peneliti Remaja
Indonesia VII yang diselenggarakan oleh Lembaga Ilmu pengetahuan Indonesia
(LIPI) pada tahun 2008 dan pada tahun yang sama penulis berhasil menjadi
peserta program Iptek Remaja yang diselenggarakan oleh Kementrian Negara
Riset dan Teknologi, Republik Indonesia. Penulis juga pernah melaksanakan
Praktik Lapangan (PL) di Laboratorium Bioproses, Pusat Penelitian
Bioteknologi-LIPI Cibinong selama periode Juli sampai Agustus 2007, dan menulis karya
ilmiah yang berjudul Produksi Biohidrogen melalui Fermentasi Bakteri
Fotosintetik Rhodobium marinum dan Isolat Sanur.
8
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Biohidrogen ... 1
Mikroorganisme Penghasl Gas hidrogen ... 2
Proses Produksi Biohidrogen ... 3
Fermentasi ... 3
Kromatografi Gas ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode Percobaan ... 5
HASIL DAN PEMBAHASAN
Pertumbuhan Bakteri Fotosintetik R. marinum dan Isolat Sanur ... 6
Kandungan Gula Total ... 7
Gas Hasil Fermentasi ... 8
Analisis Gas Hasil Fermentasi dengan Kromatografi Gas ... 8
SIMPULAN DAN SARAN
Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 9
9
DAFTAR GAMBAR
Halaman
1 Fotofermentasi bakteri fotosintetik ... 3
2 Pertumbuhan bakteri R. marinum dan isolat Sanur ... 7
3 Kadar gula media produksi selama proses fermentasi... ... 7
4 Hubungan kadar gula medium dan OD bakteri R. marinum dan isolat Sanur 7
5 Gas total yang dihasikan selama fotofermentasi ... 8
6 Jumlah gas hasil fermentasi ... 8
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian ... 12
2 Kuantifikasi media lenglap dengan fungsinya ... 13
3 Fotobioreaktor sederhana produksi hidrogen ... 13
4 Hubungan OD bakteri dan pH medium terhadap waktu ... 14
5 Kurva standar gula total ... 14
6 Data hasil pengukuran gula total sampel ... 14
7 Data hasil pengamatan gas produk fotofermentasi ... 15
8 Data hasil pengukuran gas H
2produk fotofermentasi dengan GC ... 16
9 Gas hidrogen yang dihasilkan selama fotofermentasi ... 17
10 Korelasi kadar gula total dan jumlah gas H
2terhadap waktu fermentasi ... 19
11 Kromatogram hasil analisis gas hidrogen sampel produk fermentasi dengan
menggunakan GC ... 20
1
PENDAHULUAN
Laju pertumbuhan penduduk dan tingkat ekonomi yang semakin meningkat, serta perkembangan teknologi yang semakin pesat dari waktu ke waktu mengakibatkan dunia (termasuk Indonesia) membutuhkan energi yang sangat besar. Bahan bakar fosil seperti minyak bumi dan batu bara merupakan sumber energi utama. Permintaan akan bahan bakar tersebut yang semakin meningkat menyebabkan terjadinya eksplorasi dan eksploitasi sumber energi berbahan bakar fosil secara besar-besaran. Eksploitasi energi yang berlebihan dari sumber daya alam terutama minyak bumi selama ini menyebabkan menipisnya kandungan minyak bumi tersebut, menimbulkan kerusakan lingkungan, perubahan iklim global, dan krisis energi di seluruh dunia (Bockris 2002).
Krisis energi dan kerusakan lingkungan ini memerlukan penanganan serius. Usaha mengurangi dampak negatif terhadap lingkungan dan pengembangan sumber energi alternatif termasuk bioenergi terus diupayakan dan dilakukan. Bioenergi merupakan energi terbarukan yang berasal dari biomassa (Liu & Shen 2004). Bioenergi ini adalah salah satu bentuk energi alternatif yang prospektif untuk dikembangkan. Pengembangan bioenergi ini tidak hanya dapat mengurangi ketergantungan terhadap bahan bakar minyak yang harganya terus melambung, tetapi juga dapat meningkatkan keamanan pasokan energi nasional. Perhatian masyarakat dunia yang semakin meningkat pada penggunaan bahan bakar yang ramah lingkungan menjadikan pengembangan bioenergi sangat strategis dan perlu direalisasikan (Sirait 2007). Oleh karena itu, energi alternatif yang dapat diperbaharui (renewable energy) dan aman lingkungan (green energy) sangat dibutuhkan dan sangat penting untuk diupayakan serta dioptimalkan pengolahan dan penggunaannya.
Hidrogen merupakan salah satu pilihan energi alternatif karena mudah dikonversi dan tidak merusak lingkungan baik dalam proses pembuatan maupun penggunaannya. Hidrogen adalah unsur paling ringan, sangat mudah terbakar, dan paling banyak terdapat di alam semesta. Unsur ini dikandung oleh air dan semua senyawa organik serta makhluk hidup (Mohsin 2007).
Biohidrogen adalah hidrogen yang diproduksi melalui proses biologis atau dari biomassa. Biohidrogen dapat dikembangkan di Indonesia karena bahan bakunya cukup tersedia. Biohidrogen diproduksi dengan memanfaatkan organisme bakteri melalui
proses fermentasi atau fotoproduksi untuk merombak substrat organik (limbah atau nonlimbah) menjadi energi hidrogen (Sirait 2007).
Salah satu mikroorganisme yang mampu memproduksi hidrogen adalah bakteri fotosintetik, seperti Rhodobium marinum dan
Rhodobacter sphaeroides (Kawaguchi 2005).
Bakteri fotosintetik mampu mengubah senyawa organik menjadi gas hidrogen dengan adanya energi cahaya.
Banyak tantangan teknis yang dihadapkan pada masa transisi dari bahan bakar berbasis fosil ke bahan bakar berbasis biohidrogen ini, mulai dari produksi dengan kuantitas memadai, penyimpanan, transmisi, dan distribusinya (Dunn 2002). Oleh karena itu, penelitian ini menjadi salah satu bagian dari transisi menuju penggunaan bahan bakar berbasis biohidrogen.
Penelitian ini bertujuan memproduksi biohidrogen dengan menggunakan glukosa 1% sebagai bahan baku substrat fermentasi oleh bakteri fotosintetik Rhodobium marinum dan isolat Sanur (koleksi Biotechnology
culture collection (BTCC)). Hipotesisnya
adalah fermentasi bakteri fotosintetik
Rhodobium marinum dan isolat Sanur (koleksi
BTCC) dengan substrat glukosa 1% dapat menghasilkan biohidrogen.
TINJAUAN PUSTAKA
BiohidrogenHidrogen dikenal luas sebagai sumber energi yang bersih dan efisien. Gas ini memiliki kandungan energi tertinggi (143 Gjton-1) per unitnya dan merupakan bahan bakar yang tidak terikat secara kimia dengan karbon (Purwanto 2005). Dengan demikian,
pembakaran hidrogen tidak akan
menimbulkan efek rumah kaca, penipisan lapisan ozon, atau hujan asam. Hal tersebut dikarenakan proses pembakarannya di udara hanya menghasilkan uap air dan energi panas (Nath & Das 2004).
Hidrogen merupakan sumber energi alternatif yang bisa diproduksi dari sumber yang terbarukan, seperti biomassa. Biohidrogen adalah hidrogen yang diproduksi melalui proses biologis atau dari biomassa (Zaborsky et al. 1998). Selain sumber penghasilnya melimpah, biohidrogen juga ramah lingkungan. Hidrogen dapat diproduksi oleh mikroba melalui dua cara, yaitu perubahan secara fotobiologis dan melalui teknik fermentasi (Sirait 2007). Teknik yang
2
pertama hanya dapat dilakukan pada siang hari, yaitu ketika adanya matahari. Hal ini
dikarenakan mikroba fotosintetik
menggunakan energi dari sinar matahari sebagai sumber energi mereka. Akan tetapi, teknik yang kedua dapat berlangsung pada siang maupun malam hari (dalam keadaan gelap). Hal ini tergantung pada tipe mikroba yang digunakan dalam fermentasi. Sebagian besar bakteri aerob dan anaerob memproduksi biohidrogen dengan pendekatan fotosintesis dan fermentasi (fotofermentasi) (Rahman et
al. 1997).
Beberapa keunggulan dari Biohidrogen antara lain: dapat diperbarui (renewable
energy) dan ramah lingkungan (green energy)
(Zaborsky et al. 1998), hasil samping pembakarannya berupa uap air sehingga tidak menimbulkan efek rumah kaca, hujan asam, dan penipisan lapisan ozon (Nath & Das 2004), proses produksi dapat berlangsung pada tekanan dan suhu normal (Purwanto 2005), biaya produksi lebih rendah dibandingkan dengan cara fisik dan kimia
(Nakashimada 2004), dan dapat
memanfaatkan limbah dan sampah organik sebagai substrat fermentasi (Liu & Shen 2004). Adapun kendala yang dihadapi untuk energi alternatif ini adalah persetujuan publik, penanaman modal yang besar dan harga hidrogen saat ini yang masih jauh lebih mahal dibandingkan bahan bakar lainnya. Namun demikian, hidrogen dapat diproduksi dengan teknologi yang lebih murah dan mudah, yaitu dengan memanfaatkan organisme bakteri melalui proses fermentasi atau fotoproduksi, untuk merombak substrat organik (limbah dan nonlimbah) menjadi energi hidrogen (Sirait 2007).
Mikroorganisme Penghasil Gas Hidrogen Hidrogen yang diproduksi oleh mikroalga dan bakteri disebut biohidrogen. Bakteri dan mikroalga yang sering digunakan untuk penelitian tersebut adalah bakteri anaerob dan mikroorganisme fotosintetik seperti bakteri fotosintetik dan sianobakteria. Sianobakteria dapat menguraikan air menjadi hidrogen dan oksigen dengan bantuan energi cahaya (Sirait 2007). Keuntungan organisme ini dalam memproduksi hidrogen adalah tidak menggunakan senyawa organik sebagai substrat tetapi menggunakan sinar matahari. Kelemahannya adalah produksi hidrogennya lambat, sistem reaksinya membutuhkan energi yang besar, dan pemisahan gas hidrogen dan oksigen membutuhkan penanganan yang
khusus. Reaksi biofotolisis dari organisme ini adalah sebagai berikut (Zaborsky et al. 1998):
Cahaya
H2O 0.5 O2 + H2 ?G = - 242 kJ Bakteri anaerob tidak menggunakan air sebagai senyawa penghasil biohidrogen namun menggunakan senyawa organik. Keuntungan dari bakteri ini adalah reaksi pembentukan hidrogen yang cepat dan tidak memerlukan energi matahari. Kelemahan dari bakteri ini dalam memproduksi gas hidrogen adalah hasil dekomposisi/penguraian senyawa organik tersebut meninggalkan asam-asam organik seperti asam asetat, asam butirat, dan lain-lain. Asam organik tersebut menjadi masalah baru jika tujuan dari produksi adalah untuk menanggulangi limbah (Zaborsky et al. 1998).
Bakteri fotosintetik membutuhkan senyawa organik untuk memproduksi hidrogen dan energi cahaya untuk membantu reaksi energi yang terlibat dalam produksi hidrogen. Keuntungan bakteri ini dibandingkan pada sianobakteri yaitu energi yang dibutuhkan untuk produksi hidrogen lebih kecil karena adanya peran senyawa organik. Senyawa organik yang dapat digunakan oleh bakteri ini sebagai substrat untuk produksi hidrogen adalah asam lemak, gula, tepung, selulosa, dan lainnya (Sirait 2007). Bakteri fotosintetik dalam memproduksi hidrogen melibatkan substrat senyawa organik, fotosistem I, feridoksin, dan enzim nitrogenase. Reaksi produksi hidrogen dari substrat glukosa oleh bakteri fotosintetik adalah sebagai berikut (Zaborsky et al. 1998):
Glukosa + 2H2O 6CO2 +12H2 ?G=-33.8 kJ
Ada berbagai macam mikroorganisme yang dapat menghasilkan biohdrogen (Miyake 1998, diacu dalam Zaborsky et al. 1998), baik
yang fotosintetik maupun yang
nonfotosintetik. Bakteri yang termasuk fotosintetik antara lain Rhodopseudomonas
Rhodobacter, Anabaena, Chlamydomonas, Chromatium, dan Thiocapsa. Sedangkan yang
termasuk nonfotosintetik antar lain Klebsiella,
Clostridium, Enterobacter, Azotobacter, Metanobacteria, dan Eschericia coli. (Miyake
1998, diacu dalam Zaborsky et al. 1998). Salah satu contoh bakteri fotosintetik adalah Rhodopseudomonas marina atau yang lebih dikenal dengan nama Rhodobium
marinum. Bakteri ini termasuk bakteri gram
negatif, berbentuk batang, bergerak, fotoheterotrop anaerob fakultatif, dan
3
memproduksi warna merah (Hirashi et al. 1995). Rhodobium marinum (R. Marinum) diisolasi dari laut pada tahun 1995 (Sirait 2007). Enzim yang terlibat pada fotosintetik produksi hidrogen oleh bakteri ini adalah enzim nitrogenase. Isolat Sanur merupakan konsorsium bakteri fotosintetik yang diisolasi dari air laut pantai Sanur, Bali. Bakteri dominan yang ada dalam isolat ini adalah R.
marinum sehingga isolat tersebut berwarna
merah.
Telah dilaporkan beberapa penelitian
mengenai produksi gas hidrogen
menggunakan bakteri fotosintetik, di antaranya: Rhodobium Marinum A-150 pada substrat asam laktat (Kawaguchi 2001),
Rhodobacter sphaeroides pada limbah cair
pabrik susu (Turkaslan 1998, diacu dalam Sirait 2007), dan Rhodobacter sphaeroides pada limbah cair tahu (Zhu 1999). Penelitian-penelitian yang telah dilakukan tersebut merupakan acuan dari penelitian ini, sehingga dapat disimpulkan bahwa bakteri fotosintetik merupakan pilihan utama di dalam pemanfaatan limbah hasil perkebunan yang mengandung asam-asam organik.
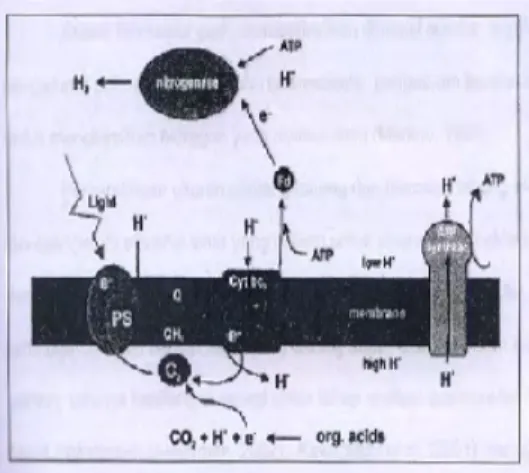
Proses Produksi Biohidrogen Gas hidrogen yang diproduksi oleh bakteri fotosintetik dihasilkan melalui proses fotofermentasi. Fotosistem pada bakteri fotosintetik hanya melibatkan satu fotosistem (PS1). Fotosistem terjadi dalam membran intraseluler. Fotosistem pada bakteri ini tidak cukup kuat untuk memecah air. Pada kondisi anaerob, bakteri fotosintetik dapat dengan baik menggunakan asam organik sederhana seperti asam asetat sebagai donor elektron (Sirait 2007).
Elektron yang dilepaskan dari senyawa organik akan dipompakan oleh sejumlah besar pembawa elektron (diantara kuinon dan plastosianin). Selama transport elektron, proton dipompakan melewati membran (dalam kompleks protein sitokrom bc1) sehingga terjadi gradien proton. Gradien proton yang terjadi digunakan oleh enzin ATP sintase untuk menghasilkan ATP. Energi ATP yang terbentuk dapat digunakan untuk transport lebih jauh elektron ke elektron akseptor feridoksin (Fd) (Chen et al. 2005).
Jika molekul nitrogen tidak ada, maka enzim nitrogenase dapat mereduksi proton menjadi gas hidrogen (H2) dibantu dengan energi dalam bentuk ATP dan elektron yang diperoleh dari feridoksin (Fd) (Chen et al.. 2005). Secara keseluruhan fotosistem bakteri fotosintetik ini mengubah komponen utama
dari asam organik menjadi gas hidrogen (H2) dan karbon dioksia (CO2) (Gambar 1). Fotosistem bakteri ini tidak menghasilkan oksigen (O2) sehingga tidak menghambat kerja enzim nitrogenase, mengingat enzim nitrogenase sensitif terhadap oksigen (Akkerman 2002).
Gambar 1 Fotofermentasi bakteri fotosintetik (Akkerman 2002). Keterangan: PS = fotosistem, C = plastosianin, Q = kuinon, dan Cyt = sitokrom.
Fermentasi
Fermentasi merupakan proses penting dalam kehidupan sehari-hari manusia. Fermentasi berasal dari bahasa latin ferfere yang artinya mendidihkan. Hal ini berdasarkan pengamatan sehari-hari bahwa dalam proses fermentasi minuman beralkohol akan menghasilkan buih yang kemudian satu komponennya diketahui sebagai gas karbondioksida. Fermentasi secara umum dapat dinyatakan sebagai proses katabolisme, suatu pemecahan senyawa organik yang kompleks menjadi bentuk yang lebih sederhana. Aplikasi proses ini dapat dilihat pada produksi minuman beralkohol atau produk yang bersifat asam (seperti asam asetat atau cuka) (Hidayat 2006). Pengetahuan mengenai proses ini berkembang pesat sejak penelitian Louis Pasteur mengenai proses fermentasi yang terjadi dalam pembuatan wine (anggur). Penelitian mengenai proses ini berkembang pesat semenjak tumbuhnya industri minuman beralkohol dan industri antibiotik.
Aplikasi metode ini diawali dengan pembuatan bir sekitar 6.000 tahun sebelum Masehi. Pembuatan roti dengan bantuan khamir atau ragi diperkirakan sudah terjadi sejak 4.000 tahun sebelum Masehi (Pelczar & Chan 1986). Pembuatan produk fermentasi
4
kecap dan tauco di Cina telah dilakukan sejak 722 SM. Fermentasi anggur mulai berkembang kira-kira abad ke-17 dengan
menggunakan bakteri Acetobacter
menghasilkan asam asetat (asam cuka) (Hidayat 2006). Kemudian pada tahun 1817 mulai diproduksi enzim dari tumbuhan dan jaringan hewan yang dapat memecah zat pati menjadi maltosa. Begitu juga enzim dari khamir yang dapat memecahkan sukrosa menjadi glukosa dan fruktosa ditemukan pada tahun 1817.
Fermentasi terbagi menjadi dua berdasarkan kebutuhan akan oksigen, yaitu fermentasi aerobik dan anaerobik. Fermentasi aerobik adalah fermentasi yang prosesnya memerlukan oksigen. Keberadaan oksigen membuat mikroorganisme dapat mencerna glukosa menghasilkan air, karbondioksida dan sejumlah besar energi. Fermentasi dalam proses anaerobik tidak memerlukan oksigen. Ada berbagai produk (metabolit) yang bisa dihasilkan dalam proses fermentasi, antara lain berbagai jenis asam (asam laktat, asetat, asam butirat), alkohol, etanol, protein, dan ester (Dunn 1959). Produk suatu hasil fermentasi dapat diubah lebih lanjut melalui proses fermentasi lain untuk menghasilkan produk akhir yang lain, seperti gas hidrogen.
Ada tiga jenis sistem fermentasi yang dioperasikan dalam proses bioteknologi, yaitu sistem diskontinu (batch), kontinu, Dan semikontinu (fed-batch) (Smith 1985). Pada sistem diskontinu, pemberian medium, nutrisi, dan bakteri dilakukan hanya di awal fermentasi (tidak ada penambahan medium, nutrisi, dan bakteri selama fermentasi berlangsung). Sedangkan pada sistem kontinu, pemberian medium dan nutrisi serta pengeluaran sejumlah fraksi dari volume kultur terjadi secara terus-menerus. Sistem semikontinu adalah suatu sistem fermentasi yang medium atau substratnya ditambahkan secara kontinu selama fermentasi berlangsung tanpa mengeluarkan sesuatu dari sistem (Smith 1985).
Kromatografi Gas (GC)
Analisis kromatografi gas adalah suatu metode analisis pemisahan komponen kimia secara fisika. Komponen - komponen yang akan dipisahkan didistribusikan di antara dua fase, yaitu fase diam dan fase gerak. Fase gerak dapat berupa gas atau cairan dan fase diam dapat berupa padatan atau cairan (Black & Read 1997). Fase gerak berfungsi membawa sampel sedangkan fase diam
berfungsi untuk mengadsorpsi atau mempartisi komponen.
Peralatan kromatografi gas terdiri atas injektor, kolom, detektor, pemanas (oven),
amplifier, rekorder, gas pembawa, dan
pengatur aliran dan tekanan (Black &Read 1997). Injektor berfungsi sebagai tempat masuknya sampel yang dirancang sedemikian rupa sehingga sampel dapat langsung masuk ke dalam kolom dengan perantaraan gas pembawa. Kolom berfungsi memisahkan komposisi sampel menjadi komponen-komponennya sehingga dapat terelusi dalam waktu yang berbeda. Detektor berfungsi untuk mendeteksi komponen yang keluar dari kolom. Pemanas berfungsi untuk memanaskan injektor, kolom dan detektor untuk injektor, kolom dan detektor yang dilengkapi dengan
thermostate. Amplifier berfungsi untuk memperbesar sinyal arus listrik yang berasal dari detektor. Rekorder berfungsi sebagai pencatat hasil dalam bentuk kromatogram. Gas pembawa berfungsi sebagai pembawa gas sampel. Gas pembawa yang umum digunakan adalah Helium (He), Nitrogen (N2) dan Argon (Ar) (Black &Read 1997). Pengatur aliran dan tekanan berfungsi sebagai pengatur tekanan yang dapat menentukan kecepatan alir gas pembawa.
Prinsip kerja pada GC, yaitu sampel diinjeksikan ke dalam injektor kemudian diangkut oleh gas pembawa masuk ke dalam kolom yang berisi padatan sebagai fase diam (Black & Read 1997). Fase diam memiliki sifat dapat berinteraksi dengan komponen-komponen dalam sampel sehingga dapat menghambat laju alir masing-masing komponen. Besarnya hambatan untuk masing-masing komponen berbeda-beda sehingga sesampai di ujung kolom tidak bersamaan melainkan satu persatu (Black & Read 1997). Komponen yang keluar dari kolom dilewatkan ke detektor sedangkan sinyal dari detektor dikirim melalui amplifier ke rekorder dan dicatat sebagai kromatogram.
Agar peralatan kromatografi gas bisa bekerja dengan maksimal, maka perlu dilakukan optimasi suhu seperti suhu injektor, kolom, dan detektor (Sudarmadji et al. 1997). Injektor selain berfungsi untuk tempat masuknya sampel, juga berfungsi untuk mengubah sampel yang berfase cair atau padat menjadi gas tanpa terjadi dekomposisi. Pada umumnya suhu injektor kira-kira 50 oC lebih tinggi dari titik didih komponen sampel yang mempunyai titik didih paling tinggi. Bila titik didih komponen belum diketahui, dapat dilakukan secara coba-coba (trial), dengan memulai suhu injektor rendah kemudian
5
dinaikkan. Jika diperoleh puncak-puncak kromatogram lebih baik berarti suhu percobaan pertama terlalu rendah sehingga perlu dicoba kembali dengan cara menaikkan suhu secara bertahap hingga mendapatkan kondisi yang tepat. Namun demikian, suhu injektor tidak boleh terlalu tinggi sebab ada kemungkinan terjadinya dekomposisi (penguraian komponen yang hendak dianalisis) (Sudarmadji et al. 1997).
Kolom merupakan perangkat yang memiliki peranan penting dalam proses analisis dengan metode kromatografi sehingga pemilihan jenis kolom yang tepat dan kondisi yang optimal sangat diperlukan. Pada umumnya suhu kolom dibuat kurang lebih sama dengan titik didih rata-rata dari seluruh komponen dalam sampel (Black & Read 1997). Kontrol suhu pada detektor sangat diperlukan terutama untuk detektor yang sensitivitasnya dipengaruhi oleh adanya fluktuasi suhu. Pada umumnya suhu detektor dijaga 20-50 oC lebih tinggi dari suhu kolom, hal ini agar uap sampel tidak terkondensasi (Black & Read 1997).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan antara lain biakan bakteri fotosintetik Rhodobium marinum NBRC (NITE Biological Resource Center) No. 100434, biakan bakteri fotosintetik isolat Sanur yang merupakan koleksi Biotechnology culture collection (BTCC), Larutan NaOH 0.6 N, larutan HCl 0.3 N, Akuades, air steril (mili-Q), D(+)Glukosa (Merck), ekstrak ragi, K2HPO4, KH2PO4, MgSO4.7H2O, MnCl2.4H2O, FeSO4.7H2O, NaCl, natrium suksinat, amonium asetat, larutan feri sitrat (0.1%), NH4Cl, CaCl2.2H2O, ZnSO4.7H2O, H3BO3, CoCl2.6H2O, CuCl2.2H2O, NiCl2.6H2O, Na2MoO4.2H2O, etanol, larutan stok glukosa 1000 ppm, amonium sulfat, larutan MEM Vit. 100X, EDTA.2Na, Na2S.9H2O, NaHCO3, kertas aluminium foil, plastik tahan panas, karet, asam sulfat pekat, larutan fenol 5%, kertas saring, dan kapas.
Peralatan yang digunakan adalah penangas air, spektrofotometer UV-Vis (Beckman DU 650), sentrifus (Jouan MR 1812), autoklaf (Everlight TA-630), laminar air flow cabinet,
shaker, rak tabung, tabung reaksi, falcon 50
ml, gelas piala, kertas saring, labu Erlenmeyer (100 ml, 250 ml, 300 ml, dan 500 ml), pH meter HM-30G, Sensor hidrogen H2 Scan
model 2240, kromatografi gas (GC) HP 5890,
neraca analitik, botol schott, vorteks, dan autopipet.
Metode Percobaan
Media Tumbuh Bakteri Fotosintetik R.
marinum dan Isolat Sanur (Uchino 2006)
Mula-mula dibuat media dasar dengan komposisi: 0.3 g ekstrak ragi, 1 g natrium suksinat, 0.5 g amonium asetat, 5 ml larutan feri sitrat (0.1%), 0.5 g KH2PO4, 0.5 g MgSO4.7H2O, 0.4 g NaCl, 0.4 g NH4Cl, 0.05 g CaCl2.2H2O, 1 ml trace element solution SL-6 (komposisi: 100 mg ZnSO4.7H2O, 30 mg MnCl2.4H2O, 300 mg H3BO3, 200 mg CoCl2.6H2O, 10 mg CuCl2.2H2O, 20 mg NiCl2.6H2O, dan 30 mg Na2MoO4.2H2O, dalam 1L akuades). Kemudian media dasar ini dilarutkan dalam 1 L akuades dan diaduk hingga homogen serta disesuaikan pH-nya hingga 6,8. Setelah itu, media tersebut disterilisasi (autoklaf 121ºC selama 15 menit). Media steril ini setelah dingin kemudian ditambahkan 0.5 ml etanol, 10 ml MEM Vit.
Solution 100X, dan 5 ml larutan Na2S (1.5 g Na2S.9H2O dilarutkan dalam 100 ml akuades dalam botol serum bertutup karet butil. Udara dalam botol tersebut dibebaskan dengan memasukkan gas N2 (1800 kg/cm2 selama 30 menit). Setelah itu disterilisasi dalam autoklaf 121ºC selama 15 menit, kemudian diatur pH-nya hingga pH 7.3 dengan menambahkan H2SO4 2N steril. Larutan dikocok untuk menghindari pengendapan hingga dihasilkan larutan akhir berwarna kuning transparan). Media tumbuh ini siap digunakan.
Kultivasi Bakteri R. marinum dan Bakteri Isolat Sanur (Sirait 2007)
Sebanyak 2 ml suspensi bakteri R.
marinum dan bakteri isolat Sanur
masing-masing ditambahkan ke dalam tabung betutup yang berbeda yang sudah berisi 8 ml media tumbuh. Kemudian dikocok hingga merata. Setelah itu, diinkubasi pada suhu 30 ºC di inkubator goyang selama 3 hari. Optical
density (OD) suspensi bakteri tersebut diukur
setiap hari hingga hari ke-3 (dari jam ke-0 sampai jam ke-76) dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 660 nm. Kemudian 10 ml suspensi bakteri tersebut disuntikkan ke dalam 100 ml media kultur. Kultur bakteri ini diinkubasi pada suhu 30 ºC di inkubator goyang selama 3 hari. Kultur tersebut siap dipanen untuk digunakan dalam fermentasi produksi hidrogen.
6
Fermentasi Bakteri Fotosintetik untuk Produksi Gas Hidrogen (Zaborsky et al. 1998, Kawaguchi 2001)
Fermentasi produksi hidrogen ini dilakukan secara fotofermentasi dengan sistem fermentasi diskontinu (batch). Kultur bakteri R. Marinum dan bakteri isolat Sanur (umur 3 hari) disentrifugasi pada 6000 rpm selama 20 menit. Kemudian peletnya masing-masing diresuspensi dengan 20 ml media produksi (sebanyak 2 mg EDTA.2Na dimasukkan ke dalam botol schoot 1 L. Kemudian ditambahkan 2.8 mg H3BO3, 0.75 mg Na2MoO4.2H2O, 0.24 mg ZnSO4.7H2O, 2.1 mg MnCl2.4H2O, 0.04 mg CuCl2.2H2O, 10 mg FeSO4.7H2O, 0.75 mg CaCl2.2H2O, 200 mg MgSO4.7H2O, dan akuades hingga volume akhir menjadi 1 L. Kemudian media ini disterilisasi dalam autoklaf 121ºC selama 15 menit). Sebanyak 10% (v/v) suspensi bakteri tersebut dimasukkan ke dalam botol serum 100 ml yang sudah berisi 66 ml media produksi, 0.75 ml buffer fosfat 16 % steril, dan 0.75 ml larutan MEM vit. Sol 100X. Setelah itu, dikocok hingga homogen dan dipasang sedemikian rupa pada inkubator goyang (120 rpm, suhu 30 ºC) dan diberi cahaya dari empat lampu TL (60 watt) selama 48 jam (2 hari).
Pengambilan Sampel (Susilaningsih et al. 2008)
Tiap botol serum tersebut pada jam ke-0 dikonfirmasi kondisi pH, OD, dan kadar gula totalnya dengan cara diambil 1 ml medium dan dipindahkan dalam effendorf 1 ml dari tiap botol. Setiap dua jam sekali pada masing-masing botol juga dilakukan pengukuran pertambahan volume gas yang dihasilkan dengan cara melihat langsung perubahan volume air dalam tabung ukur (penampung gas) yang disebabkan oleh adanya tekanan gas hasil fotofermentasi. Kemudian 1 ml gas tersebut diambil dengan menggunakan sirynge khusus untuk diukur gas hidrogennya dengan alat kromatografi gas (GC). Pengukuran Kadar Glukosa (Gula Total) dengan Metode Phenol-Sulphuric Acid (Asam Fenol Sulfat) (Dubois et al. 1956)
Hasil pengambilan sampel dari jam ke-0 sampai jam ke-40 disentrifugasi pada 6000 rpm selama 5 menit. Supernatan kemudian diencerkan 100 kali. Kemudian diambil 0.5 mL dari larutan hasil pengenceran tersebut ke dalam tabung reaksi kecil, setelah itu ditambahkan fenol 5% sebanyak 0.5 mL dan
2.5 mL larutan H2SO4 lalu dikocok dengan
vortex. Setelah dikocok lalu didiamkan 10
menit dan diletakkan di dalam water bath dengan suhu 40 0C selama 20 menit. Kadar glukosa (gula total) dalam sampel dianalisis dengan diukur absorbansinya menggunakan spektrofotometer Vis 490 nm. Sebelumnya dibuat standar glukosa dengan konsentrasi 10, 20, 40, 60, 80, 100, 120, dan 200 ppm.
Analisis Gas Hidrogen dengan
Kromatografi Gas (GC) (Susilaningsih et
al. 2008)
Pengukuran produk fermentasi (gas H2) dilakukan menggunakan GC dengan metode detektor TCD (thermal conductivity detector). Kolom yang digunakan adalah kolom poropak, dengan temperatur injektor, detektor, dan kolom masing-masing adalah 150, 250, dan 80 0C. Gas pembawa yang digunakan adalah gas nitrogen (N2). Sebanyak 1 ml sampel diinjeksikan ke dalam kolom kemudian hasilnya dapat dilihat pada layar monitor setelah lima menit.
HASIL DAN PEMBAHASAN
Pertumbuhan Bakteri FotosintetikR. marinum dan Isolat Sanur
Pertumbuhan bakteri R. Marinum dan isolat Sanur diamati dengan cara mengukur
optical density (OD) bakteri tersebut pada
panjang gelombang 660 nm dengan alat spektrofotometer. Kurva pertumbuhan baketri
R. Marinum dan isolat Sanur menunjukkan
bahwa fase pertumbuhan logaritma atau eksponensial bakteri tersebut terjadi pada jam ke-2 hingga jam ke-18. Kedua bakteri tersebut kemudian mengalami fase stasioner sampai jam ke-30 (Gambar 2, data pada lampiran 4).
Hasil percobaan pertumbuhan bakteri R.
marinum dan isolat Sanur juga menunjukkan
bahwa kedua bakteri tersebut dapat tumbuh pada media dengan substrat glukosa 1%. Media tersebut ber-pH 6-7. Hal tersebut sesuai dengan penelitian yang dilakukan oleh Kawaguchi et al. (2001), yaitu efek pH terhadap pertumbuhan bakteri fotosintetik dan aktivitas enzim nitrogenase yang merupakan enzim yang berperan dalam pembentukan gas hidrogen, hasil penelitian tersebut menyatakan bahwa pH optimal untuk pertumbuhan bakteri
R. marinum adalah pH 6-7.
Pertumbuhan mikrob dapat ditandai dengan peningkatan jumlah dan massa sel. Pertumbuhan bakteri membentuk pola pembelahan biner (Pelczar & Chan 1986).
7
Kurva pertumbuhan bakteri terdiri atas beberapa fase, yaitu fase lag, fase log, fase stasioner, dan fase kematian.
Pertumbuhan bakteri dimulai dari fase lamban atau lag. Ciri-ciri fase ini adalah tidak ada pertumbuhan populasi, sel mengalami perubahan komposisi kimiawi, bertambah ukurannya, dan substansi intraselulernya bertambah. Fase berikutnya adalah fase pertumbuhan logaritma atau eksponensial. Sel dalam fase ini membelah dengan laju yang konstan, massa menjadi dua kali lipat dengan laju yang sama, aktivitas metabolik seimbang, dan pertumbuhan seimbang yang ditandai dengan bertambahnya populasi secara teratur. Fase pertumbuhan selanjutnya adalah fase stasioner. Fase ini ditandai dengan habisnya nutrisi yang dibutuhkan oleh bakteri untuk pertumbuhannya. Hal ini ditandai dengan diproduksinya senyawa atau produk racun yang menyebabkan beberapa sel bakteri mati sedangkan yang lain tumbuh dan membelah secara teratur sehingga jumlah sel yang hidup menjadi tetap. Fase selanjutnya adalah fase kematian atau penurunan pertumbuhan yang ditandai dengan sel-sel bakteri menjadi lebih cepat mati daripada terbentuknya sel-sel baru (Pelczar & Chan 1986).
Kurva Pertum buhan Bakteri
0 0.2 0.4 0.6 0 18 22 30 34 38 60 78 Waktu (jam ) O D 6 6 0 n m
Isolat Sanur R.marinum
Gambar 2 Pertumbuhan bakteri R. Marinum dan isolat Sanur.
Kandungan Gula Total Hasil penentuan kadar gula selama fermentasi (Gambar 3, data dan perhitungan pada lampiran 6) menunjukkan bahwa kandungan gula pada media produksi yang berisi bakteri R. marinum menurun drastis dari 8626 ppm pada jam ke-0 menjadi 3147 ppm pada jam ke-40. Demikian juga pada media produksi yang berisi bakteri isolat Sanur, kandungan gula menurun drastis dari 9811 ppm pada jam ke-0 menjadi 2961.5 ppm pada jam ke-40. Bakteri R. marinum mampu mendegradasi gula dalam media produksi sebesar 63.52%, sedangkan isolat Sanur mampu mendegradasi hingga 69.46%. Li dan Fang (2008) melaporkan bahwa bakteri
fotosintetik Rubrivivax gelatinosus L31 mampu mendegradasi glukosa sebesar 69.2% untuk produksi biohidrogen. Sirait (2007) juga melaporkan bahwa gula total dapat dikonversi menjadi biohidrogen sebesar 52.74% oleh bakteri fotosintetik R. marinum.
Bakteri R. marinum dan isolat Sanur memanfaatkan gula sebagai substrat sehingga menghasilkan produk berupa gas hidrogen dari proses fermentasi tersebut. Kandungan gula yang terdapat pada masing-masing media produksi mengalami penurunan selama fermentasi berlangsung seiring dengan peningkatan OD bakteri (Gambar 4, data dan perhitungan pada lampiran 4 & 6).
Penurunan kadar gula secara drastis pada media yang berisi R. marinum terjadi sampai jam ke-22, proporsional dengan pertumbuhan bakteri tersebut yang sedang mengalami fase logaritmik hingga jam ke-22. Hal yang sama juga terjadi pada media yang berisi isolat Sanur, penurunan kadar gula media secara drastis dan pertumbuhan bakteri mencapai fase logritmik juga terjadi sampai jam ke-22.
Glukosa 1% 0 2000 4000 6000 8000 10000 12000 0 22 34 40 Waktu (Jam ) [G u la T o ta l] ( p p m )
Kontrol R. marinum Isolat Sanur Gambar 3 Kadar gula media produksi selama
proses fermentasi. Rhodobium marinum 0 2000 4000 6000 8000 10000 0 22 34 40 Waktu (jam) [G u la T o ta l] (p p m ) 0 0.5 1 1.5 2 2.5 3 O D 6 6 0 Isolat Sanur 0 5000 10000 15000 0 22 34 40 Waktu (jam) [G u la T o ta l] (p p m ) 0 0.5 1 1.5 2 2.5 O D 6 6 0 Kadar Gula OD
Gambar 4 Hubungan kadar gula medium dan OD bakteri R. marinum dan isolat Sanur.
8
Gas Hasil Fermentasi
Produk yang dihasilkan dari fermentasi ini berupa gas. Gas yang dihasilkan dari fermentasi bakteri fotosintetik R. marinum adalah gas H2 dan CO2 (Zaborsky et al. 1998). Total gas yang dihasilkan oleh bakteri R.
marinum dalam penelitian ini adalah 205.25
ml, sedangkan total gas yang dihasilkan oleh isolat sanur adalah 165.25 ml. Gas pada media yang berisi bakteri R. marinum mulai diproduksi pada jam ke-2 dan berakhir pada jam ke-18. Media yang berisi bakteri isolat Sanur mulai memproduksi gas pada jam ke-6 sampai jam ke-20 (Gambar 5). Gas hasil fermentasi, baik yang dihasilkan oleh bakteri
R. marinum maupun oleh bakteri isolat Sanur
tersebut kemudian dianalisis dengan GC untuk mengetahui jumlah gas hidrogen yang dihasilkan.
Gas Total Hasil Fotofermentasi
0 10 20 30 40 50 0 2 4 6 8 10 12 14 16 18 20 22 Waktu (jam ) V o lu m e G a s ( m l)
R. marinum Isolat Sanur
Gambar 5 Gas total yang dihasilkan selama fotofermentasi.
Analisis Gas Hasil Fermentasi dengan GC Gas hasil fermentasi bakteri R. marinum dan isolat Sanur dianalisis dengan menggunakan kromatografi gas (GC) HP 5890 dengan metode thermal conductivity
detector (TCD). Metode ini khusus digunakan
untuk mendeteksi gas yang dihasilkan namun tidak dapat digunakan untuk mendeteksi asam volatil dan cairan yang mudah menguap lainnya.
Berdasarkan hasil analisis GC, gas hasil fermentasi terdiri atas gas hidrogen (H2) dan CO2. Gambar 6 menunjukkan bahwa gas hidrogen yang dihasilkan oleh R. marinum dengan substrat glukosa 1% adalah 127.311 ml (62% dari total gas yang dihasilkan), setara dengan 3.81 mmol H2 jam-1 L-1 medium. Konsorsium bakteri isolat Sanur dengan substrat glukosa 1% juga dapat menghasilkan gas hidrogen sebanyak 103.61 ml (63% dari total gas yang dihasilkan), setara dengan 2.8 mmol H2 jam-1 L-1 medium. Ike et al. (1999) melaporkan bahwa bakteri R. marinum
dengan menggunakan substrat glukosa mampu menghasilkan gas hidrogen dengan kecepatan rata-rata 5.3 ml H2 jam-1L-1 medium. Bakteri fotosintetik Rubrivivax
gelatinosus L31 mampu menghasilkan gas
hidrogen dari substrat glukosa dengan kecepatan rata-rata 4.1 ml H2 jam-1L-1 medium (Li & Fang 2008).
Isolat Sanur yang merupakan konsorsium bakteri fotosintetik strain lokal sangat potensial untuk dikembangkan dan dimanfaatkan dalam produksi biohidrogen. Adanya bakteri fotosintetik strain lokal tersebut diharapkan mampu meningkatkan produktivitas gas biohidrogen (bioenergi) nasional sehingga dapat menunjang keamanan pasokan energi nasional.
Gas Hasil Ferm entasi
205,25 165,25 127,311 103,61 0 50 100 150 200 250
R. marinum Isolat sanur
Bakteri V o lu m e G a s ( m l)
Gas Produk Hidrogen
Gambar 6 Jumlah gas hasil fermentasi.
SIMPULAN DAN SARAN
Simpulan
Bakteri fotosintetik R. marinum dan isolat Sanur mampu memproduksi gas biohidrogen melalui proses fotofermentasi menggunakan glukosa 1% sebagai substrat. Gas hidrogen yang diproduksi oleh bakteri R. marinum dalam fotofermentasi tersebut adalah 127.311 ml dari 205.25 ml total gas yang dihasilkan (62%), dengan kecepatan produksi 3.81 mmol H2 jam
-1
L-1 medium. Isolat Sanur mampu memproduksi gas hidrogen sebanyak 103.61 ml dari 165.25 ml total gas yang dihasilkan (63%), dengan kecepatan produksi 2.8 mmol H2 jam
-1
L-1 medium . Saran
Penelitian optimasi produksi biohidrogen perlu dilakukan dengan melihat pengaruh konsentrasi glukosa, suhu optimum, OD bakteri optimum, dan instalasi fotobioreaktor yang lebih baik untuk menghasilkan biohidrogen yang maksimum.
9
DAFTAR PUSTAKA
Akkerman I, M Janssen, J Rocha, RH Wijffels. 2002. Photobiological hydrogen production photochemical efficiency and bioreactor design. J Hydrogen Energy 27: 1195-1208.
Black RM, Read RW. 1997. Application of liquid chromatography atmospheric pressure chemical ionization mass
spectrometry and tandem mass
spectrometry to the analysis and identification of degradation products of
chemical warfare agents. J
Chromatography A 759: 79-92.
Bockris J. 2002. The origin of ideas on a hydrogen economy andits solution to the decay of the environment. Int J Hydrogen
Energy 27: 31-40.
Dunn CG, Prescott. 1959. Industrial microbiology. New York: Mc Graw Hill.
Dunn S. 2002. Hydrogen futures: toward a sustainable energy system. Int J Hydrogen Energy 26: 13-28.
Hidayat MA. 2006. Fermentasi asam laktat oleh Rhizopus oryzae pada substrat singkong hasil hidrolisis asam [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hirashi A et al. 1995. A new genus of marine budding phototropic bakteria, Rhodobium gen Nov., which includes Rhodobium orienties sp. Nov and Rhodobium marinum comb. Nov. J Systematic
Bacteriology 45:226-234.
Ike A et al. 1999. Photoproduction of hydrogen from row starch using a halophilic bacterial community. J Biosci
Bioeng 88: 72-78.
Kawaguchi H, K Hashimoto, K Hirata, K Miyamoto. 2001. Hydrogen production from algal biomass by a mixed culture of
R.. marinum A-501 and Lactobacillus amylovorus. J Boscience and Bioenginering 91:27-282.
Kawaguchi et al. 2002. Effect of algal
extract on H2 production by a photosintetic bacterium Rhodobium marinum A-501: analysis of stimulating
effect using a kinetic model. J Bioscience
and Bioenginering 94: 62-69.
Kawaguchi Y et al. 2005. Effect of Innoculum
Conditioning on Hydrogen Fermentation and pH Effect on Bacterial Community Relevant to Hydrogen Production. Osaka:
Kumamoto.
Li RY, Fang HHP. 2008. Hydrogen production characteristics of
photoheterotrophic Rubrivivax
gelatinosus L31. Int J Hydrogen Energy
33: 974-980.
Liu G, Shen J. 2004. Effect of culture and medium condition on hydrogen production of starch using anaerobic bacteria. J Bioscience and bioenginering 98: 251-256.
Nakashimda Y, Nishio N. 2004. High rate production of hydrogen/mathane from various substrat and wastes. Adv. Biochem. Engin. Biotechnol 90:63-67.
Nath K, Das D. 2004. Improvement of fermentative hydrogen production: various approaches. Appl Microbiol Biotechnol 65: 520-529.
Pelczar MJJr, Chan ECS.1986. Dasar-Dasar
Mikrobioligi. Volume ke-1, 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Purwanto J. 2005. Optimasi konsentrasi gliserol dan pH untuk produksi biohidrogen oleh Enterobacter aerogenes AY-2 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rahman MA, Furutani Y, Nakashimada Y, Kakizono T, Nishio N. 1997. Enhanced hydrogen production in altered mixed acid fermentatuion of gluose by Enterobacter aerogenes. J Ferm Bioeng 83: 358-363.
Sirait LR. 2007. Produksi gas hidrogen dari limbah cair tahu dengan bakteri fotosintetik Rhodobium marinum [tesis]. Depok: Sekolah Pascasarjana, Universitas Indonesia.
10
Smith JE. 1985. Prinsip Bioteknologi. Sumo UF, Sumantri B, Subono A, penerjemah; Jakarta: Gramedia. Terjemahan dari:
Biotechnology Principles.
Sudarmadji et al. 1997. Prosedur Analisa
untuk Bahan Makanan dan Peranian.
Yogyakarta: Liberty.
Susilaningsih et al. 2007. Produksi bioenergi gas hidrogen dari biomassa limbah pertanian dan perkebunan melalui proses ermentasi aerobik dengan konsorsium bakteri [laporan penelitian]. Bogor: Puslit Bioteknologi, LIPI.
Zaborsky et al. 1998. BioHydrogen. New York: Plennum Press.
Zhu HT et al. 1999. Hydrogen production from tofu waste water by Rhodobacter sphaeroides immobilized agar gels. Int J
11
12
Lampiran 1 Alur penelitian
Pemanenan
Kultivasi bakteri Rhodobium
marinum atau Isolat Sanur
dalam media cair
Fermentasi (2 hari, inkubator
goyang 120 rpm, suhu 30ºC)
H
2Cahaya
Lampu TL 60 W, 48 jam
Glukosa 1% (b/v)
Media lengkap produksi H
2Sampling dari jam ke-0
hingga jam ke-40
Analisis OD, Volume gas yang
terbentuk, pH, dan kadar gula total
13
Lampiran 2 Kuantifikasi media lengkap dengan fungsinya
Bahan mg / 1000 ml Fungsi
Natrium suksinat 1000 Sumber karbon dan energi pada pre culture
Glukosa 1000 Sumber karbon dan energi pada main culture
K2HPO4 750 Buffer pH, sumber K
KH2PO4 850 Buffer pH, sumber P
(NH4)2SO4 40 Sumber N dan S
MgSO4.7H2O 200 Sumber Mg dan S
CaCl2.2H2O 0.75 Sumber Ca dan Cl
Co(NO3)2.6H2O 290 Sumber Co dan N
Fe(NH4)2SO4.6H2O 10 Sumber Fe, N, dan S
Na2MoO4.2H2O 0.75 Sumber Na dan Mo
MnCl2.4H2O 2.1 Sumber Mn dan Cl
H3BO3 2.8 Mikroelemen
Cu(NO3)2.3H2O 0.04 Sumber Cu dan N
Na2EDTA.2H2O 2 Mikroelemen
Nicotinic acid 0.025 Mikroelemen
Ekstrak khamir 0.3 Sumber vitamin dan faktor pertumbuhan
HCl 3 N Pengkondisian pH asam
NaOH 3 N Pengkondisian pH basa
NaCl Jenuh Pengikat H2
Nitrogen Penekan O2pada medium
Lampiran 3 Fotobioreaktor untuk produksi hidrogen
Keterangan:
Fotofermentasi berlangsung selama dua hari pada suhu 30ºC dengan kecepatan
inkubator goyang 120 rpm, volume media 75/ 125 ml, panjang selang 1 meter,
dan diberi cahaya lampu TL 4 x 15 watt.
14
Lampiran 4 Hubungan OD bakteri dan pH medium terhadap waktu
Jam Ke- R. marinum Isolat Sanur
OD pH OD pH 0 1.6325 7 1.0555 7 22 2.287 5 1.9465 5 34 2.384 5 1.9545 5 40 2.275 5 1.9415 5
Lampiran 5 Kurva standar gula total
[Gula Total ] (ppm) Absorban
10 0.1044 20 0.2326 40 0.4457 60 0.6776 80 0.8622 100 0.9799 120 1.3014 200 2.0036 y = 0.01x + 0.0419 R2 = 0.9956 0 0.5 1 1.5 2 2.5 0 50 100 150 200 250 [Gula Total] (ppm ) A b s o rb a n s i (4 9 0 n m )
Lampiran 6 Data hasil pengukuran gula total sampel
Sampel Jam Ke- Absorban
faktor pengenceran (fp) [Gula Total] (ppm) Kontrol 0 1.165 100 11231 22 1.165 100 11231 34 1.164 100 11221 40 1.163 100 11211 R. marinum 0 0.9045 100 8626
22 0.39595 100 3540.5 34 0.38375 100 3418.5 40 0.3566 100 3147 Isolat Sanur 0 1.023 100 9811 22 0.4757 100 4338 34 0.382 100 3401 40 0.33805 100 2961.5
15
Lampiran 6 (Lanjutan)
Contoh perhitungan pengukuran gula total sampel (kotrol jam ke-0):
ppm fp n pengencera faktor Absorbans total Gula 11231 100 01 , 0 0419 , 0 165 , 1 ) ( 01 , 0 0419 . 0
Lampiran 7 Data hasil pengamatan gas produk fotofermentasi
Substrat : Glukosa 1%
Bakteri : R. marinum dan Isolat sanur
[Glukosa] awal : 10,000 mg/L
OD awal: 1.7 dan 1.1
pH awal : 7
Intensitas Cahaya : 60 W, 48 jam Volume Reaktor : 75/125 ml Panjang Selang : 1 meter
Kecepatan Inkubator Goyang : 120 rpm Temperatur : 30ºC
Sampling Volume Gas (ml)
Jam Ke- Kontrol R. marinum Isolat Sanur
0 0 0 0 2 0 14 0 4 0 31 7.5 6 0 36.5 33.75 8 0 39 37.5 10 0 35 30.5 12 0 22.25 19.5 14 0 12.75 19.5 16 0 13.25 10 18 0 0 7 20 0 0 0 Total 0 205.25 165.25
Gas hasil fotofermentasi diamati dan diukur
volumenya
secara
langsung
dengan
melihat
perubahan volume air (larutan NaCl jenuh) dalam
tabung ukur (penampung gas). Jumlah gas yang
dihasilkan sama dengan selisih volume air awal
dalam tabung ukur (a) dengan volume air saat
sampling
dalam tabung ukur tersebut
(b).
a
16
Lampiran 8 Data hasil pengukuran gas H
2produk fotofermentasi dengan GC
Kondisi GC untuk analisis hidrogen
GC HP 5890 Detektor TCD Kolom Poropak Temperatur kolom 80 ºC Temperatur injektor 150 ºC Temperatur detektor 250 ºC Gas pembawa N2
Sampling Luas area puncak % Hidrogen (GC) Jam Ke- Kontrol Standar H2 R. marinum Isolat Sanur R. marinum Isolat Sanur
0 0 0 0 0 0 0 2 0 739487 484533.5 0 65.5 0 4 0 739487 322831.5 0 43.67 0 6 0 739487 453970 246956 61.4 33.26 8 0 739487 456377 433867.5 61.72 58.67 10 0 739487 294793.5 342124.5 39.86 46.27 12 0 739487 110768.5 572176 14.98 77.37 14 0 739487 430907.5 418995 58.27 56.66 16 0 739487 420900 387283 56.92 52.37 18 0 739487 0 285180.5 0 38.56 20 0 0 0 0 0 0
Contoh perhitungan (sampel R. marinum jam ke-2):
%
5
.
65
%
100
739487
5
.
484533
%
100
tan
%
hidrogen
dar
s
m
kromatogra
pada
puncak
area
luas
sampel
m
kromatogra
pada
puncak
area
luas
Hidrogen
17
Lampiran 9 Gas hidrogen yang dihasilkan selama fotofermentasi
Sampling Rata-rata volume gas Hidrogen yang dihasilkan (ml) Jam Ke- Kontrol R. marinum Isolat Sanur
0 0 0 0 2 0 9.17 0 4 0 13.54 0 6 0 22.41 11.22 8 0 24.01 22.962 10 0 23.63 19.365 12 0 13.33 17.374 14 0 11.112 15.478 16 0 10.050 13.545 18 0 0 3.675 20 0 0 0 Total 0 127.311 103.61 Kecepatan rata-rata (ml/jam) 0 7.956 5.756
Contoh perhitungan (sampel R. marinum jam ke-2):
ml
ml
lampiran
tasi
fotofermen
produk
gas
volume
lampiran
hidrogen
H
gas
Volume
17
.
9
14
%
5
.
65
)
7
(
)
8
(
%
2
Jumlah mol hidrogen yang dihasilkan dari fotofermentasi dihitung dengan
menggunakan persamaan:
RT
PV
n
Keterangan:
)
(
082
.
0
)
(
)
(
K
Suhu
T
R
L
gas
Volume
V
atm
Tekanan
P
mol
Jumlah
n
Bakteri Rhodobium marinum:
mmol
ml
atm
n
15
.
5
301
082
.
0
311
.
127
1
18
Lampiran 9 (Lanjutan)
Jumlah mol hidrogen yang dihasilkan dari fotofermentasi bakteri R. marinum
adalah
jam
L
mmol
jam
ml
L
ml
mmol
81
.
3
18
1000
1
75
15
.
5
Isolat Sanur:
mmol
ml
atm
n
20
.
4
301
082
.
0
610
.
103
1
Jumlah mol hidrogen yang dihasilkan dari fotofermentasi bakteri isolat Sanur
adalah
jam
L
mmol
jam
ml
L
ml
mmol
8
.
2
20
1000
1
75
20
.
4
19
Lampiran 10 Korelasi kadar gula total dan jumlah gas H
2terhadap waktu
fermentasi
Rhodobium marinum
0 5 10 15 20 25 30 35 0 2 4 6 8 10 12 14 16 18 20 Jam Ke-V o lu m e G a s h id ro g e n (m l) 0 1000 2000 3000 4000 5000 6000 7000 8000 9000 10000 [G il a T o ta l] ( p p m )Isolat Sanur
0 5 10 15 20 25 30 35 0 2 4 6 8 10 12 14 16 18 20 Jam Ke-Keterangan: V o lu m e G a s H id ro g e n ( m l) 0 2000 4000 6000 8000 10000 12000 [G u la t o ta l] ( p p m )Gas hidrogen Gula Total