ISOLASI DAN KARAKTERISASI SENYAWA DARI
FRAKSI VI EKSTRAK ETANOL UMBI TALAS
SAFIRA (Colocasia esculenta Schott var.
antiquorum)
SRI WIDIAYATI DJOU
14.01.292
PROGRAM STUDI STRATA SATU FARMASI
SEKOLAH TINGGI ILMU FARMASI
MAKASSAR
i
ISOLASI DAN KARAKTERISASI SENYAWA DARI
FRAKSI VI EKSTRAK ETANOL UMBI TALAS
SAFIRA (Colocasia esculenta Schott var.
antiquorum)
SKRIPSI
Untuk Memenuhi Salah Satu Syarat
Mencapai Gelar Sarjana Farmasi (S.Farm)
SRI WIDIAYATI DJOU
14.01.292
PROGRAM STUDI STRATA SATU FARMASI
SEKOLAH TINGGI ILMU FARMASI
MAKASSAR
ii
HALAMAN PERSETUJUAN SKRIPSI
ISOLASI DAN KARAKTERISASI SENYAWA DARI
FRAKSI VI EKSTRAK ETANOL UMBI TALAS
SAFIRA (Colocasia esculenta Schott var.
antiquorum
SRI WIDIAYATI DJOU
14.01.292
Disetujui Oleh :
Pembimbing Utama Pembimbing Pertama
SUBEHAN,S.Si.,M.Pharm.,Sc.,Ph.D.,Apt Dra. JEANNY WUNAS, MS., Apt
NIDN. 0025097508 NIK. 0802012039
Pembimbing Kedua
ABD. HALIM UMAR, S.Farm., M.Si NIDN.0908118502
iii
SKRIPSI
ISOLASI DAN KARAKTERISASI SENYAWA
DARI FRAKSI VI EKSTRAK ETANOL UMBI
TALAS SAFIRA (Colocasia esculenta Schott
var. antiquorum)
Diajukan dan disusun oleh :
SRI WIDIAYATI DJOU
14.01.292
Skripsi ini telah dipertahankan dihadapan Tim Penguji pada hari Sabtu Tanggal 27 Februari 2016.
Tim Penguji
Ketua : Dr. Nursamsiar, S.Si., M.Si., ...
Sekretaris : Dr. Risfah Yulianty, S.Si., M.Si.,Apt ... Anggota : Fajriansyah, S.Farm.,M.Si.,Apt ... Ex-Officio :
1. Subehan S.Si, M.Pharm.,Sc.,Ph.D.,Apt ... 2. Dra. Jeanny Wunas, Ms., Apt ... 3. Abd. Halim Umar, S.Farm.,M.Si ...
Mengetahui Ketua
Sekolah Tinggi Ilmu Farmasi Makassar
Wahyu Hendrarti, S.Si.,M.Kes.,Apt NIDN. 0923027101
iv
HALAMAN PERNYATAAN ORISINALITAS
Saya yang bertanda tangan di bawah ini:
Nama : Sri widiayati Djou
NIM : 14.01.292
Dengan ini menyatakan bahwa data-data yang terdapat dalam skripsi yang berjudul:
ISOLASI DAN KARAKTERISASI SENYAWA DARI FRAKSI VI EKSTRAK ETANOL UMBI TALAS SAFIRA (Colocasia esculenta Schott var. antiquorum)
Adalah MURNI hasil penelitian yang telah saya lakukan. Bilamana di kemudian hari terbukti bahwa data tersebut merupakan hal jiplakan/plagiat dari karya tulis orang lain maka sesuai dengan kode etik ilmiah, saya menyatakan bersedia untuk diberikan sanksi seberat-beratnya termasuk
PENCOPOTAN/PEMBATALAN gelar akademik saya oleh pihak Sekolah Tinggi Ilmu Farmasi Makassar.
Demikian surat pernyataan ini agar dapat dipergunakan sebagaimana mestinya.
Makassar, 20 Februari 2016 Yang membuat pernyataan
v
KATA PENGANTAR
Assalamu Alaikum Wr.Wb
Alhamdulillah Rabbil Alamin, segala puji dan syukur ke Hadirat Allah SWT serta atas siraman nikmat iman, ilmu, kesehatan dan kesempatan yang telah diberikan sehingga penulis dapat menyelesaikan skripsi ini, sebagai salah satu syarat akademik untuk menyelesaikan studi dan memperoleh gelar Serjana Farmasi di Sekolah Tinggi Ilmu Farmasi Kebangsaan Makassar.
Sholawat dan salam senantiasa penulis haturkan kepada pejuang kehidupan sejati, Rasul dan Kekasih Allah Muhammad SAW yang senantiasa menjadi penguat, motivasi dan panutan bagi penulis.
Mengawali ucapan terima kasih, penulis persembahkan kepada kedua orang tua tercinta. Kepada ayahanda Drs.H.Lagani Djou dan ibunda Hj. Tjendrawati Djou Ika, yang telah begitu sabar dalam
menasehati, mendidik dan memotivasi ananda hingga mampu
mengenyam pendidikan hingga saat ini. Untuk kakak tercinta kakak iva , kakak Tia, dan kakak Bai, serta untuk seluruh keluarga besar, penulis ucapkan banyak terima kasih atas segala dukungan dan perhatiannya.
Tidak lupa pula ucapan terimah kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada :
1. Drs. H. Sahibuddin A. Gani, Apt selaku ketua Yayasan Sekolah Tinggi Ilmu Farmasi Makassar yang telah memberikan kesempatan kepada penulis untuk menimba ilmu di Sekolah Tinggi Ilmu Farmasi Makassar. 2. Wahyu Hendrarti, S.Si., M.Kes., Apt selaku ketua Sekolah Tinggi Ilmu
Farmasi Makassar.
3. Subehan, S.Si., M.Pharm., Sc., PhD, Dra. Jeanny Wunas dan Abd. Halim Umar, S.Farm.,M.Si selaku pembimbing yang telah meluangkan waktu, memberikan banyak ilmu, membimbing dan mengarahkan penulis dalam penyusunan tugas akhir ini.
vi
4. Dr. Nursamsiar, S.Si., M.Si, Dr. Risfah Yulinty S.Si., M.Si., Apt dan Fajriansyah, S.Farm., M.Si., Apt selaku tim penguji yang telah memberikan banyak masukan kepada penulis.
5. Seluruh dosen, staf dan laboran Sekolah Tinggi Ilmu Farmasi Makassar khusunya Kak marwati dan Kak Asriful yang selalu setia membantu penulis selama melakukan penelitian di Laboratorium Biologi Farmasi.
6. Sahabat-sahabatku Nc, Indah, Pink, Ghe, yang selalu setia mendukung dan memberikan semanagat kepada penulis. Untuk ka fara. Ka riza, ka deby, ka in dan teman-teman di STIFA Transfer 2014 yang telah banyak memberi masukan-masukan dan mengajarkan makna sebuah kebersamaan.
Semoga Allah SWT senantiasa membalas segala kebaikan yang kalian berikan. Penulis sadari bahwasanya skripsi ini masih jauh dari kesempurnaan, olehnya itu krirtik dan saran demi perbaikan tugas akhir ini sangat penulis harapkan dari pembaca. Akhir kata, semoga skripsi ini dapat memberi manfaat. Aamiin Yaa Rabbal Alamiin.
Makassar, Januari 2016
vii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIK
Sebagai sivitas akademik Sekolah Tinggi Ilmu Farmasi Makassar, saya yang bertanda tangan di bawah ini:
Nama : Sri widiayati Djou
NIM : 14.01.292
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Sekolah Tinggi Ilmu Farmasi Makassar Hak Bebas Royalti
Noneksklusif atas skripsi saya yang berjudul :
ISOLASI DAN KARAKTERISASI SENYAWA DARI FRAKSI VI EKSTRAK ETANOL UMBI TALAS SAFIRA (Colocasia esculenta Schott var. antiquorum
)
Dengan ini Sekolah Tinggi Ilmu Farmasi Makassar berhak menyimpan, mengalih media/formatkan, mengelola dalam bentuk pangkalan data (database), merawat, dan mempublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta dengan sepengetahuan pembimbing utama dan pertama saya. Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Makassar
Pada tanggal : 27 Februari 2016 Yang membuat pernyataan
viii ABSTRAK
Judul : Isolasi dan Karakterisasi Senyawa Dari Fraksi VI Ekstrak Etanol Umbi Talas Safira (Colocasia esculenta Schott var. antiquorum)
(Dibimbing oleh : Subehan, Jeanny Wunas dan Abd. Halim Umar)
Telah dilakukan isolasi dan karakterisasi senyawa dari fraksi VI umbi talas safira. Tujuan dari penelitian ini adalah untuk mengkarakterisasi isolat dari fraksi VI ekstrak umbi talas safira. Hasil maserasi dari 500 gram simplisia kering umbi talas menggunakan pelarut etanol 70% diperoleh 62 gram ekstrak kental berwarna coklat. Pemisahan dan pemurnian terhadap ekstrak etanol umbi talas dilakukan dengan kromatografi kolom, kromatografi lapis tipis dan kromatografi dua dimensi dengan fase gerak n-heksan dan etil asetat. Pengujian UV-Vis menunjukkan enam pita serapan yaitu pita I pada panjang gelombang 745,00 nm, pita II pada panjang gelombang 692,50 nm, pita III pada panjang 303,00 nm , pita IV pada panjang gelombang 291,50, pita V pada panjang gelombang 262,50 dan pita VI pada panjang gelombang 200,50. Spektrum inframerah menunjukkan bahwa isolat mempunyai gugus-gugus yang khas seperti O-H, C-O-H, C-C, C=C aromatik dan C-O.
Kata kunci: Isolasi, Fraksi VI, Ekstrak Etanol, Umbi Talas, Colocoasia
ix ABSTRACT
Title : Isolation and Characterization of Chemical Compounds from Fraction VI of Ethanol Extract of Taro Tuber (Colocasia
esculenta Schott var. antiquorum)
(Supervised by : Subehan, Jeanny Wunas and Abd. Halim Umar).
Research on the isolation and characterization components from fraction VI of taro tuber ethanol extract have been done. The purpose of this research was to characterize the isolate from fraction VI of taro tuber extract. The maceration results of 500 gram simplicia of taro tuber with 70 % ethanol solvent obtained 62 gram with brown viscous extract. Separation and purification of the taro tuber ethanol extract were done by column chromatography, thin layer chromatography and two dimensional chromatography with n-heksan and ethyl acetate as mobile phase. analysis using UV-Vis spectrophotometer showed six absorption band, at wavelength 745.0 nm, 692.50 nm, 303.00 nm, 291.50, 262.50 and 291.50 nm. The infrared spectrum showed that the isolates had the typical functional groups such as O-H, C-H, C-C, C=C aromatic and C-O.
Keywords: Isolation, Fraction VI, Ethanol Extract, Taro Tuber,
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENUNJUK SKRIPSI ... ii
HALAMAN PERSETUJUAN SKRIPSI ... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERNYATAAN ORISINALITAS ... v
KATA PENGANTAR ... vi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI UNTUK KEPENTINGAN AKADEMIK ... viii
ABSTRAK ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR LAMPIRAN ... xiv
DAFTAR TABEL ... ... xv BAB I PENDAHULUAN ... 1 I.1.Latar Belakang ... 1 I.2.Rumusan Masalah ... 2 I.3.Tujuan Penelitian ... 3 I.4.Manfaat Penelitian ... 3 BAB II TINJAUAN ... 4
II.1. Uraian Tanaman ... 4
II.1.1. Klasifikasi Tanaman ... 4
xi
II.1.3. Morfologi Tanaman ... 5
II.1.4. Kandungan Kimia Tanaman ... 5
II.1.5. Kegunaan Tanaman ... 6
II.3 Metode Ekstraksi... ... 6
II.3.1. Pengertian ... 6
II.3.2. Metode Maserasi ... 7
II.3.3. Metode Soxhletasi ... 8
II.3.4. Metode Perkolasi ... 9
II.3.5. Metode Refluks ... 9
II.3.6. Metode Destilasi Uap ... 10
II.4. Metode Pemisahan ... 10
II.4.1. Kromatografi Lapis Tipis ... 10
II.4.2. Kromatografi Kolom ... 15
II.4.3. Kromatografi Lapis Tipis Preparatif ... 17
II.4.4. Kromatografi Lapis Tipis Dua Dimensi ... 18
II.5. Spektrofotometri UV-Vis ... 18
II.6. Spektrofotometri Infra Merah (FT-IR)... 20
BAB III METODE PENELITIAN ... 24
III.1. Jenis Penelitian ... 24
III.2. Waktu dan Tempat Penelitian ... 24
III.3 Alat dan Bahan ... 24
III.3.1. Alat ... 24
xii
III.4. Metode Kerja ... 25
III.4.1. Pengambilan Sampel ... 25
III.4.2. Pengolahan Sampel ... 25
III.4.3.Pembuatan Ekstrak ... 25
III.4.5. Proses Pemisahan ... 25
III.4.5.1. KLT Orientasi Eluen ... 25
III.4.5.2. Fraksinasi ... 26
III.4.6. Isolasi………. .. 26
III.4.7. Uji Kemurnian……….. ... 26
III.4.8. Karakterisasi Isolat ... 27
III.5. Pengumpulan dan Pengolahan Data ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
BAB V KESIMPULAN DAN SARAN ... 36
V.1. Kesimpulan ... 36
V.2. Saran... 36
xiii DAFTAR LAMPIRAN
Lampiran 1. Skema Kerja ... 40
Lampiran 2. Sampel Penelitian Umbi Talas ... 41
Lampiran 3. Proses Ekstraksi Sampel ... 42
Lampiran 4. Profil KLT Orientasi Eluen ... 43
Lampiran 5. Hasil KLTP ... 47
Lampiran 6. Hasil KLT Dua Dimensi ... 48
Lampiran 7 . Frekuensi dan Adsorbsi Infra Merah ... 49
Lampiran 8. Serapan Khas Gugus Fungsi Pada Infra Merah ... 50
Lampiran 9. Hasil FT-IR Fraksi VI ... 51
Lampiran 10. Hasil FT-IR fraksi III ... 52
xiv DAFTAR TABEL
Tabel 1. Deret eluotropik ... 12 Tabel 2. Hasil Pembacaan Spektrum UV-Vis ... 32 Tabel 3. Hasil Pembacaan Spektrum FT-IR ... 33
1
BAB I
PENDAHULUAN
I.1 Latar belakang
Indonesia kaya akan tumbuhan alam yang berkhasiat baik untuk kesehatan. Seiring perkembangan zaman dan kemajuan teknologi banyak tanaman berkhasiat yang di manfaatkan sebagai bahan obat, salah satunya adalah umbi-umbian. Tanaman pangan lokal umbi-umbian yang sering dimanfaatkan oleh masyarakat salah satunya adalah talas. Talas termasuk suku talas-talasan (Araceae) merupakan tanaman sepanjang tahun.
Manfaat utama umbi talas adalah sebagai bahan pangan sumber karbohidrat. Bagian tanaman ini yang dapat dimakan yaitu umbi, tunas muda, dan batang daun. Selain itu, umbi talas juga banyak dibuat makanan ringan seperti keripik dan getuk talas.
Talas secara umum mengandung flavanoid 6-C-glikosida dan flavonoid O-glikosida, diantaranya saftosida, isosaftosida, orientin,
isovitexin, isoorientin, vitexin dan luteolin 7-O–soforosida (Leong, 2009). Dalam penelitian lain disebutkan pula kandungan daun talas diantaranya saponin, terpen, tanin, flavonoid, flobatanin, antraquinon, dan alkaloid (Biren dkk., 2007; Eddy, 2009).
Penggunaan talas sebagai obat tradisional adalah pembuatan bubur akar rimpang talas yang dipercaya sebagai obat encok. Selain itu
2
cairan akar rimpang sebagai obat bisul, sementara getah daunnya sering digunakan untuk menghentikan pendarahan karena luka dan sebagai obat untuk bengkak. Pelepah dan tangkai daun yang di panggang dapat dimanfaatkan untuk mengurangi gatal-gatal. Pelepah daun juga diyakini mampu mengobati gigitan kalajengking (Akmal 2009)
Beberapa penelitian telah dilakukan untuk menemukan senyawa aktif dari umbi talas. Markus Purap (2014) telah melakukan isolasi dan karakterisasi dari fraksi III ekstrak umbi talas safira dan menunjukkan senyawa yang diduga merupakan senyawa flavonoid flavonol, akan tetapi banyaknya senyawa yang terdapat dalam umbi talas masih memerlukan penelitian lanjutan untuk mendapatkan senyawa aktif dalam umbi talas. Hal ini mendorong peneliti untuk melakukan penelitian terhadap umbi talas agar dapat menentukan senyawa lain yang terkandung di dalamnya. Penelitian yang dilakukan adalah Isolasi dan karakterisasi senyawa dari fraksi VI ekstrak etanol umbi talas safira (Colocasia esculenta Schott var. antiquorum)
I.2.Rumusan Masalah
Adapun rumusan masalah pada penelitian ini yaitu bagaimana karakterisasi fraksi VI dari ekstrak etanol umbi talas safira ?
I.3.Tujuan Penelitian
Untuk mengisolasi dan mengkarakterisasi fraksi VI ekstrak etanol umbi talas safira yang belum pernah di teliti sebelumnya.
3 I.4.Manfaat Penelitaian
Hasil penelitian ini diharapkan dapat memberikan manfaat dalam dunia kesehatan khususnya bidang kefarmasian tentang informasi mengenai kandungan senyawa lain dalam talas safira dan sebagai sumber referensi untuk penelitian selanjutnya.
4 BAB II
TINJAUAN PUSTAKA
II.1 Uraian Tanaman
Tanaman talas berasal dari daerah Asia Tenggara selanjutnya talas menyebar ke Cina, Jepang, daerah Asia Tenggara dan beberapa pulau di Samudera Pasifik kemudian terbawa oleh migrasi penduduk ke Indonesia. Di Indonesia talas biasa dijumpai hampir di seluruh kepulauan dan tersebar dari tepi pantai sampai pegunungan di atas 1000 m dari permukaan laut (Purwono & Heni, 2007).
Talas dapat tumbuh terus-menerus sepanjang tahun di wilayah tropis dan subtropis, biasanya pada kondisi lembab atau tergenang. Suhu rata-rata yang sesuai untuk pertumbuhan talas berkisar antara 21ºC dan 27ºC. Tanaman talas dapat tumbuh pada berbagai jenis tanah, mulai dari tanah liat seperti untuk pertanaman sawah, hingga tanah yang subur, dan dengan berbagai kondisi lahan baik lahan becek maupun kering. Talas termasuk dalam suku talas-talasan. Talas merupakan tanaman pangan yang berupa herba dan merupakan tanaman semusim atau tanaman sepanjang tahun (Purwono & Heni, 2007).
II.1.1 Klasifikasi Tanaman
Tumbuhan talas dapat diklasifikasikan sebagai berikut:
Dunia : Plantae
Divisi : Magnoliophyta
5
Bangsa : Alismatales
Suku : Araceae
Marga : Colocasia
Jenis : Colocasia esculenta Schott var. antiquorum
(Hasil determinasi tumbuhan, 2014)
II.1.2 Nama Lain Tanaman
Talas mempunyai beberapa nama umum yaitu Taro dan Old
cocoyam. Talas dikenal di beberapa negara dengan nama lain, seperti: Abalong (Philipina), Taioba (Brazil), Arvi (India), Keladi (Malaya), Satoimo
(Japan), Tayoba (Spanyol) dan Yu-tao (China) (Syahbania, 2012).
Talas dikenal dengan nama yang berbeda-beda pada beberapa daerah di Indonesia antara lain eumpene (Aceh), suwat (Batak), bolang dan taleus (Sunda), ufi falole (flores), paco (Makassar), aladi (Bugis), bête dan komo (Maluku), kelen, mom, warimu, nomo, uma, biau (Irian jaya) (Dalimrtha, 2006).
II.1.3 Morfologi Tanaman
Umbi talas merupakan umbi dari batang tanaman. Bentuk talas ini bermacam-macam tergantung dari jenis masing-masing talas ada yang lonjong dan agak bulat, warna kulitnyapun berbeda-beda seperti keputihan, kemerahan dan keabuan (Syahbania, 2012).
II.1.4 Kandungan Kimia Tanaman
Talas merupakan tumbuhan yang 85% bagiannya dapat dimakan, karena mengandung sumber karbohidrat, protein dan lemak,
6
selain itu, talas juga mengandung beberapa unsur mineral dan vitamin sehingga dapat dijadikan bahan obat-obatan (Rawuh, 2008). Talas secara umum mengandung flavonoid 6-C-glikosida dan flavonoid O-glikosida, diantaranya saftosida, isosaftosida, orientin, isovitexin, isoorientin, vitexin dan luteolin 7-O–soforosida (Leong, 2009). Dalam penelitian lain disebutkan pula kandungan daun talas diantaranya saponin, terpen, tanin, flavonoid, flobatanin, antraquinon, dan alkaloid (Biren et al., 2007; Eddy, 2009). Kandungan kimia dalam talas dipengaruhi oleh varietas, iklim, kesuburan tanah dan umur panen (Rawuh, 2008).
II.1.5. Kegunaan Tanaman
Manfaat talas yaitu dapat menghilangkan dahak meningkatkan
kerja ginjal, menghilangkan racun tubuh, melancarkan saluran
pencernaan, mencegah terjadinya penggumpalan darah, sebagai obat arthritis (Wirakusumah, 2005). Selain itu umbi talas juga berkhasiat sebagai obat scrofula, radang kulit bernanah, psoriasis, tumor di rongga perut, berak darah, keseleo, ketombe, bisul dan luka bakar. Sementara tangkai dan daunnya digunakan untuk pengobatan urticaria, diare dan pembalut luka (Dalimartha, 2006).
II.2 Metode Ekstraksi
II.2.1 Pengertian
Ekstraksi adalah penyarian zat-zat aktif dari bagian tanaman obat. Proses pengekstraksian komponen kimia dalam sel tanaman yaitu pelarut organik akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dalam pelarut organik
7
di luar sel, maka larutan terpekat akan berdifusi keluar sel dan proses ini akan berulang terus sampai terjadi keseimbangan antara konsentrasi cairan zat aktif di dalam dan di luar sel. Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut. Perpindahan mulai terjadi pada lapisan antarmuka, kemudian berdifusi masuk ke dalam pelarut (Depkes, 1986; Depkes, 1989).
II.2.2 Metode Maserasi
Maserasi merupakan cara penyarian sederhana yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari selama beberapa hari pada suhu kamar dan terlindung dari cahaya. Metode maserasi digunakan untuk menyari simplisia yang mengandung komponen kimia yang mudah larut dalam cairan penyari, tidak mengandung benzoin, tiraks dan lilin.
Keuntungan dari metode ini adalah peralatannya sederhana. Sedangkan kerugiannya antara lain waktu yang diperlukan untuk mengekstraksi sampel cukup lama, cairan penyari yang digunakan lebih banyak, tidak dapat digunakan untuk bahan-bahan yang mempunyai tekstur keras seperti benzoin, tiraks dan lilin (Harborne, 1987).
Macam-macam maserasi yaitu : a. Maserasi digesti
Maserasi yang digunakan untuk komponen kimia yang tahan terhadap pemanasan lemah (40- 50ºC) (Depkes, 1986).
8
b. Maserasi dengan mesin pengaduk
Penggunaan mesin pengaduk yang dapat berputar terus-menerus dapat mempercepat proses ekstraksi sehingga dalam waktu 6-24 jam maserasi dapat selesai (Depkes, 1986).
c. Maserasi remaserasi
Maserasi remaserasi adalah penyarian yang dilakukan dengan membagi dua cairan penyari yang digunakan kemudian seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama kemudian disaring lalu ampasnya dimaserasi kembali dengan cairan penyari kedua (Depkes, 1986).
d. Maserasi melingkar
Maserasi melingkar adalah penyarian yang dilakukan dengan menggunakan cairan penyari yang selalu bergerak dan menyebar (berkesinambungan) sehingga kejenuhan cairan penyari merata (Depkes, 1986).
e. Maserasi melingkar bertingkat
Maserasi melingkar bertingkat adalah sama dengan maserasi melingkar tetapi pada maserasi melingkar bertingkat dilengkapi dengan beberapa bejana penampungan sehingga tingkat kejenuhan cairan penyari setiap bejana berbeda-beda (Depkes, 1986).
II.3.3 Metode Soxhletasi
Soxhletasi merupakan metode penyarian serbuk simplisia secara berkesinambungan dengan alat soxhlet. Proses penyarian diawali dengan
9
pemanasan cairan penyari hingga menguap. Uap cairan penyari tersebut kemudian terkondensasi oleh pendingin balik menjadi molekul-molekul air lalu turun menyari simplisia dalam slongsong kemudian masuk ke dalam labu alas bulat setelah melewati pipa sifon.
Keuntungan metode ini adalah dapat digunakan untuk mengekstraksi sampel yang memiliki tekstur yang lunak dan tidak tahan terhadap pemanasan. Selain itu suhu pemanasan dapat diatur dan pelarut yang digunakan juga sedikit. Sedangkan kerugian dari metode ini adalah penggunaan pelarut yang sama secara terus menerus sehingga ekstrak yang terkumpul terus menerus dipanaskan sehingga dapat menyebabkan reaksi penguraian oleh panas (Depkes, 1986; Harborne, 1987).
II.3.4 Metode Perkolasi
Metode perkolasi merupakan cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Keuntungan metode ini adalah tidak memerlukan langkah tambahan karena sampel padat telah terpisah dari ekstrak. Kerugiannya adalah kontak antara sampel padat dan cairan penyari tidak merata atau terbatas dibandingkan dengan metode refluks. Selain itu pelarut menjadi dingin selama proses perkolasi sehingga tidak melarutkan komponen dari simplisia secara efisien (Depkes, 1986; Harborne, 1987).
II.3.5 Metode Refluks
Metode refluks merupakan penarikan komponen kimia yang dilakukan dengan cara sampel dimasukan ke dalam labu alas bulat
10
bersama-sama dengan cairan penyari lalu dipanaskan. Uap-uap cairan penyari terkondensasi pada kondensor bola menjadi molekul-molekul cairan penyari yang akan turun kembali menuju labu alas bulat dan akan menyari kembali sampel yang berada pada labu alas bulat. Proses ini berlangsung secara berkesinambungan hingga penyarian sempurna. Penggantian pelarut dilakukan sebanyak 3 kali setiap 3-4 jam. Filtrat yang diperoleh kemudian dikumpulkan dan dipekatkan (Melani, 2008).
Keuntungan dari metode ini adalah dapat digunakan untuk mengekstraksi sampel-sampel yang mempunyai tekstur kasar dan tahan terhadap pemanasan langsung. Kerugian dari metode ini adalah membutuhkan volume total pelarut dan sejumlah manipulasi dari operator (Melani, 2008).
II.3.6 Metode Destilasi Uap
Metode ini merupakan metode yang sering digunakan untuk mengekstraksi simplisia yang mengandung minyak-minyak menguap (esensial) atau komponen-komponen kimia yang mempunyai titik didih tinggi pada tekanan udara normal (Melani, 2008).
II.4 Metode Pemisahan
Kromatografi merupakan suatu metode pemisahan campuran yang didasarkan atas perbedaan distribusi diantara 2 fase yaitu fase gerak (mobile) dan fase diam (stationary) (Sudjadi, 1988).
Kromatografi adalah suatu nama yang diberikan untuk teknik
11
menggunakan dua fase yaitu fase diam dan fase gerak. Pemisahan-pemisahan ini bergantung pada gerakan relatif dari dua fase ini. Prinsip dari pemisahan adalah adanya perbedaan sifat fisik dan kimia dari senyawa yaitu kecenderungan dari molekul untuk melarut dalam cairan (kelarutan), kecenderungan molekul untuk menguap (keatsirian), kecenderungan mungkin molekul untuk melekat pada permukaan (adsorpsi, penjerapan) (Sastrohamidjojo, 2007).
Jenis-jenis kromatografi yang bermanfaat dalam analisis kuantitatif dan analisis kualitatif adalah kromatografi kertas, kromatografi lapis tipis (KLT), kromatografi kolom, kromatografi gas dan kromatografi cair kinerja tinggi. Kromatografi kertas dan kromatografi lapis tipis umumnya lebih bermanfaat untuk tujuan identifikasi, karena lebih mudah dan sederhana. Kromatografi kolom memberikan pemilihan fase diam yang lebih luas dan berguna untuk pemisahan suatu campuran secara kuantitatif. Kromatografi gas dan kromatografi cair kinerja tinggi kedua-duanya membutuhkan peralatan yang lebih rumit dan umumnya merupakan metode dengan resolusi tinggi yang dapat digunakan untuk identifikasi serta penetapan kuantitatif bahan dalam jumlah yang sangat kecil (Yazid, 2005).
II.4.1 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis (KLT) atau Thin Layer Chromatography merupakan salah satu bentuk dari Kromatografi Cair Padat (KCP), cara ini didasarkan pada prinsip absorbsi dan partisi. Kromatografi lapis tipis
12
digunakan untuk pemisahan berbagai senyawa seperti ion-ion anorganik dan senyawa organik. Kelebihan penggunaan kromatografi lapis tipis dibandingkan dengan kromatografi kertas adalah karena dapat dihasilkan pemisahan yang sempurna, kepekaan yang lebih tinggi dan dapat
dilaksanakan dengan lebih cepat. Pemisahan suatu senyawa
menggunakan kromatografi lapis tipis tergantung pada jenis pelarut, zat penyerap dan sifat daya serap masing-masing komponen. Komponen yang terlarut dalam fase diam (penyerap) dengan kecepatan bergeraknya komponen terlarut dalam fase gerak (pelarut) yang menjadi dasar untuk mengidentifikasi komponen yang dipisahkan, perbandingan kecepatan ini dinyatakan dengan nilai Rf (Gritter, dkk., 1985).
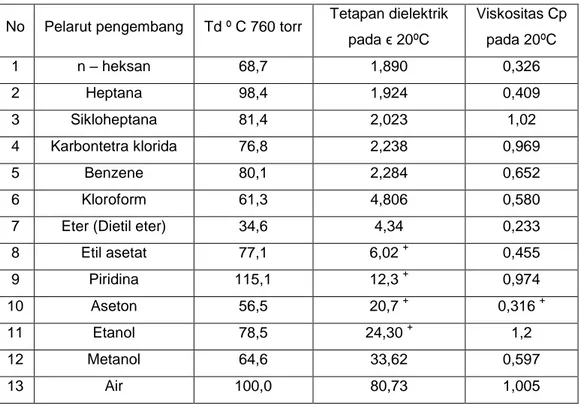
Tabel 1. Deret Eluotropik (Stahl, 1985)
No Pelarut pengembang Td º C 760 torr Tetapan dielektrik
pada ϵ 20ºC Viskositas Cp pada 20ºC 1 n – heksan 68,7 1,890 0,326 2 Heptana 98,4 1,924 0,409 3 Sikloheptana 81,4 2,023 1,02 4 Karbontetra klorida 76,8 2,238 0,969 5 Benzene 80,1 2,284 0,652 6 Kloroform 61,3 4,806 0,580
7 Eter (Dietil eter) 34,6 4,34 0,233
8 Etil asetat 77,1 6,02 + 0,455 9 Piridina 115,1 12,3 + 0,974 10 Aseton 56,5 20,7 + 0,316 + 11 Etanol 78,5 24,30 + 1,2 12 Metanol 64,6 33,62 0,597 13 Air 100,0 80,73 1,005
13
Penampakan noda pada lempeng kromatografi dapat diperjelas melalui beberapa cara, yaitu penyinaran di bawah sinar UV 254 nm, sinar UV 366 nm, menggunakan mata secara langsung dan penyemprotan dengan larutan H2SO4 10%.
Prinsip penampakan noda dengan sinar UV 254 nm adalah lempeng akan berflouresensi sedangkan sampel akan tampak berwarna gelap. Penampakan noda terjadi karena adanya daya interaksi antara sinar UV dengan indikator fluoresensi yang terdapat pada lempeng. Fluoresensi cahaya yang tampak merupakan emisi cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi dari tingkat energi dasar ke tingkat energi yang lebih tinggi kemudian kembali ke keadaan semula sambil melepaskan energi (Sumarno, 2001).
Pada UV 366 nm, noda akan berflouresensi dan lempeng akan berwarna gelap. Penampakan noda pada sinar UV 366 nm terjadi karena adanya daya interaksi antara sinar UV dengan gugus kromofor yang terikat oleh auksokrom yang ada pada noda tersebut. Fluoresensi cahaya yang tampak merupakan emisi cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi dari tingkat energy dasar ke tingkat energi yang lebih tinggi kemudian kembali ke keadaan semula sambil melepaskan energi. Sehingga noda yang tampak pada lampu UV 366 nm terlihat terang karena silika gel yang digunakan tidak berfluororesensi pada sinar UV 366 nm (Sumarno, 2001).
14
Salah satu prinsip penampakan noda lainnya adalah
menggunakan mata secara langsung yaitu melihat secara langsung noda yang terbentuk dan profil penampakan nodanya pada lempeng KLT.
Prinsip penampakan noda pereaksi semprot H2SO4 10% adalah
berdasarkan kemampuan asam sulfat yang bersifat reduktor dalam merusak gugus kromofor dari zat aktif simplisia sehinggas panjang gelombangnya akan bergeser ke arah yang lebih panjang (UV menjadi VIS) sehingga noda menjadi tampak oleh mata (Stahl, 2001).
II.4.1.1 Nilai Rf (Retardation factor)
Identifikasi dari senyawa-senyawa yang terpisah pada lapisan tipis lebih baik dikerjakan dengan pereaksi kimia dan reaksi warna. Lazimnya identifikasi menggunakan harga Rf meskipun harga-harga Rf dalam lapisan tipis kurang tepat bila dibandingkan pada kertas (Gritter, dkk, 1985).
Dapat didefenisikan sbb :
Faktor-faktor yang memepengaruhi gerakan noda dalam kromatografi lapis tipis yang juga mempengaruhi harga Rf (Tamalona, 2005):
a. Struktur kimia dari senyawa yang dipisahkan
b. Sifat dari penyerap dan derajat aktifitasnya
c. Tebal kerataan dari lapisan penyerap
d. Pelarut (dan derajat kemurniannya) fasa gerak
Nilai Rf =
Jarak yang ditempuh noda Jarak yang ditempuh pelarut
15
e. Derajat kejenuhan dari uap
f. Jumlah cuplikan yang digunakan
g. Suhu
h. Kesetimbangan
i. Teknik percobaan
II.4.2 Kromatografi Kolom
Kromatografi kolom adalah kromatografi yang menggunakan kolom sebagai alat untuk memisahkan komponen-komponen dalam campuran. Alat tersebut berupa pipa gelas yang dilengkapi suatu kran dibagian bawah kolom untuk mengendalikan aliran zat cair. Ukuran kolom tergantung dari banyaknya zat yang akan dipisahkan secara umum perbandingan panjang dan diameter kolom sekitar 8:1, sedangkan jumlah penyerapnya adalah 25-30 kali berat bahan yang akan dipisahkan. Pelarut (fase gerak) dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Senyawa larut bergerak melalui kolom dengan laju yang berbeda, memisah dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Yazid, 2005).
Penyerap dapat dikemas ke dalam tabung, baik dengan cara basah maupun dengan cara kering. Pada umumnya cara basah lebih mudah dan lebih sering dipakai untuk silica gel, sedangkan cara kering lebih baik untuk alumina (Gritter, dkk., 1985).
16 II.4.2.1 Cara basah
Selapisan serbuk dimasukkan ke dalam kolom dan tabung pengemasan mungkin sama dengan pelarut yang akan dipakai untuk kromatografi atau mungkin pelarut yang kepolarannya lebih rendah. Penjerap dibuat lumpuran dengan bagian lain dari pelarut dan lumpuran ini dituangkan ke dalam pelarut di dalam tabung. Selama proses pengendapan, tabung dapat diketuk-ketuk pada semua sisi secara perlahan-lahan dengan sumbat karet atau cincin gabus agar diperoleh lapisan yang seragam. Lumpuran dapat dimasukkan bagian demi bagian atau sekaligus, keran dapat dibuka atau ditutup selama penambahan tetapi permukaan pelarut tetap di atas permukaan penjerap. Jika pelarut yang dipakai untuk membuat lumpuran berbeda dengan pelarut yang akan dipakai pada kromatografi, pelarut lumpuran harus didesak keluar dengan pelarut pengelusi sebelum cuplikan ditambahkan.
II.4.2.2 Cara kering
Selapisan serbuk diletakkan di dalam kolom, penjerap dituangkan ke dalam tabung sedikit demi sedikit. Setelah setiap penambahan permukaan diratakan dan dimampatkan sedikit memakai alat pemampat. Alat pemampat ini berupa sumbat karet atau silinder kayu yang dipasangkan pada ujung batang atau gagang. Setelah semua penjerap dimasukkan, di atasnya diletakkan kertas saring dan ditambahkan lagi selapis pasir sehingga jika ditambahkan pelarut permukaan penjerap tidak terganggu. Kemudian pelarut pengelusi
17
dibiarkan mengalir ke bawah melalui penjerap dengan keran terbuka sampai permukaan pelarut tepat sedikit di bagian atas kolom (Melani, 2008).
II.4.3 Kromatografi Lapis Tipis Preparatif
Kromatografi lapis tipis preparatif adalah cara yang ideal untuk pemisahan cuplikan kecil (50 mg sampai 1 g) dari senyawa. Tebal lapisan adsorben dibuat sekitar 0,5-2 cm, ukuran pelat kromatografi biasanya 20x20 cm atau 20x40 cm, setelah adsorben dilapiskan, pelat harus dikeringkan pada suhu kamar sebelum diaktifkan, untuk mencegah keretakan pada lapisan absorben (Gritter, dkk., 1995).
Pada KLT preparatif, cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus pada cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita yang kedudukannya telah diketahui melalui KLT, dikerok dari pelat dengan menggunakan spatula. Hasil kerokan tersebut dikumpulkan diatas corong dengan kertas filter. Kemudian diekstrak dengan pelarut, yang polaritasnya cukup untuk melarutkan secara kuantitatif. KLT preparatif harus dikerjakan secepat mungkin untuk tidak terjadi kerusakan pada masing-masing komponen penyusun (Gritter, dkk., 1985).
Penampakan pita yang mengandung cuplikan pada KLT Preparatif dapat dilakukan dengan menggunakan sinar UV dan pereaksi semprot (Adnan, 1997).
18 II.4.4 Kromatografi Lapis Tipis Dua Dimensi
KLT dua dimensi atau KLT dua arah ini bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia yang hampir sama, karena nilai Rf juga hampir sama, selain itu dua sistem fase gerak yang sangat berbeda dapat digunakan secara berurutan pada suatu campuran tertentu sehingga memingkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama. KLT dua arah dilakukan dengan melakukan penotolan sampel disalah satu sudut lapisan lempeng tipis dan mengembangkannnya sebagaimana biasa dengan eluen pertama. Lempeng kromatografi selanjutnya dipindahkan dari chamber yang menggunakan eluen kedua sehingga pengembangan dapat terjadi pada arah kedua yang tegak lurus dengan arah pengembangan yang pertama. Suksesnya pemisahan tergantung pada kemampuan untuk memodifikasi selektifitas eluen kedua dibandingkan dengan selektifitas eluen pertama (Hostettman dan Marston, 1995).
II.5 Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah anggota tekhnik analisis spetroskopik yang memakai radiasi elektromagnetik ultraviolet dekat (190-380 nm) dan sinar tampak ((190-380-780 nm) dengan memakai instrument spekrofotometer.
Metode spektrofotometri UV-Vis merupakan penyerapan sinar tampak oleh suatu larutan berwarna atau dikenal dengan metode
19
kolorimetri. Hanya larutan berwarna yang dapat ditentukan metode ini. Alasan dilakukan pengukuran serapan pada bilangan gelombang maksimum (Mulya dan Syahrani, 1990):
1. Perubahan serapan untuk setiap konsentrasi adalah bilangan gelombang maksimum dan akan diperoleh kepekaan analisis maksimal 2. Disekitar bilangan gelombang maksimum bentuk kurva serapan kadar 3. Pengukuran ulang serapan bilangan gelombang maksimum akan
memberikan kesalahan yang kecil sekali.
Unsur – unsur terpenting suatu spektrofotometri ultraviolet ditunjukkan secara skematik berikut :
Keterangan : SR : Sumber radiasi M : Monokromator SK : Sampel kompartemen B : Blanko D : Detektor A : Amplifier / Penguat VD : Visual display
Setiap bagian peralatan dari spektrofotometri memegang fungsi dan peranan tersendiri (Mulya dan Suharman, 1995).
SK
M D A VD
SR
20
a. Sinar radiasi
Sumber radiasi yang biasanya digunakan pada spektroskopi absorbsi adalah lampu hidrogen atau lampu deuterium yang digunakan sebagai sumber radiasi pada daerah sinar lembayung.
b. Monokromator
Monokromator digunakan untuk memeproleh sumber sinar yang monokromatis alatnya dapat berupa prisma.
c. Tempat sampel
Biasa disebut kuvet yang merupakan wadah sampel yang dianalisa. d. Detektor UV – VIS
Detektor berfungsi untuk mengubah tenaga radiasi menjadi arus listrik atau listrik atau perubah panas lainnya dan biasanya terintegrasi dengan pencatat (printer). Tenaga cahaya yang diubah menjadi tenaga listrik akan mencatat secara kuantitatif tenaga cahaya tersebut. Persyaratan detector yang baik adalah sensivitas tinggi, respon pendek, stabilitas lama dan sinyal elektronik mudah di perjelas (Mulja ,1990; Rohman, 2007).
II.6 Spektrofotometer Infra Merah
Spektroskopi infra merah membantu mengidentifikasi macam-macam ikatan yang terdapat dalam suatu senyawa. Dengan diketahuinya macamnya ikatan kovalen yang ada dan mana yang tidak ada dapat kita perkirakan gugus fungsional yang ada atau tidak ada dalam suatu struktur misalnya, bila suatu senyawa mempunyai ikatan O–H, maka senyawa
21
dapat berupa asam karboksilat (RCOH2), alkohol (ROH) atau suatu fenol (ArOH). Spektrofotometer IR digunakan dalam penentuan gugus fungsional dari suatu senyawa seperti gugus : N-H, C-H, O-H, C-X, C=O, C-C, C=C,C=N dan juga digunakan untuk analisis kuantitatif, seperti analisis kuantitatif untuk pencemar udara misalnya karbon monoksida dalam udara dengan teknik non-dispersive. Spektrum infra merah
memberikan puncak-puncak maksimal yang jelasnya puncak
minimumnya. Pada dasarnya, instrumentasi yang digunakan dalam radiasi inframerah menggunakan dasar-dasar optik yang sama seperti yang
terdapat dalam spektrofotometer ultravaliolet dan tampak
(Sastrohamidjojo, 2001)
Bagian pokok dari spektrofotometer infra merah adalah sumber cahaya infra merah, monokrometer dan detektor. Cahaya dari sumber dilewatkan melalui cuplikan, dipecah menjadi frekuensi-frekuensi individunya dalam monokromator dan intesitas relatif dari frekuensi individu diukur oleh detektor.
1. Sumber cahaya infra merah
Sumber yang umum digunakan adalah merupakan batang yang dipanaskan oleh listrik yang berupa Nemst glower dan Globar. Nemst
glower biasanya merupakan tabung hampa dari zirkinium dan ytrium oksid
yang dipanaskan dan mempunyai suhu operasi antara 750º hingga 1200ºC. Nemst glower lebih tinggi tanpa mengurangi waktu hidupnya.
22
2. Monokromator
Monokromator yang mendispresikan energi sinar awal menjadi banyak frekuensi dan kemudian setelah melalui serangkaian celah yang menyeleksi frekuensi tertentu yang akan dideteksi oleh detektor.
Prisma dan grating keduanya dapat digunakan. Kebanyakan prisma yang digunakan adalah NaCI, hal ini disebabkan karena NaCI hanya transparan dibawah 625 cm־1, sedang halida logam lainya harus digunakan dalam pekerjaan dengan frekuensi yang rendah. Grating dan prisma mempunyai peranan dalam meresolusi spectra dan dapat dibuat dari bermacam-macam bahan.
3. Detektor
Ada tiga macam detektor yang digunakan pada spektrofotometer infra merah, yaitu Bolometer Termokopel, dan Sel pneumatic Golay. Ketiga macam detektor tersebut bekerja berdasarkan pada pengaruh panas yang dihasilkan bila radiasi infra merah diserap dari bekas sinar yang mengenai. Pada umumnya detektor harus mempunyai daerah peka kecil, kapasitas panas yang rendah, sensitivitas panas yang tinggi, absorptivitas tidak selektif terhadap semua frekuensi radiasi infra merah.
Sinar yang berasal dari celah keluar monokromator difokuskan pada suatu detektor yang berfungsi mendeteksi dan mengukur energi cahaya yang ditimbulkan oleh pengaruh pemanasannya. Variasi suhu kecil yang diakibatkan oleh variasi energi cahaya yang dideteksi ditimbulkan bolometer atau termokopel. Pada bolometer kenaikan suhu
23
menyebabkan perubahan tegangan listrik yang digunakan untuk mengubah tegangan. Termokopel menggunakan energi cahaya untuk memanaskan salah satu dari dua lempeng logam mulia yang dihubungkan dan menghasilkan gaya elektromotif diantara hubungan tersebut. Tegangan yang dihasilkan adalah berbanding langsung dengan jumlah energi cahaya. Jenis detektor lain yang banyak digunakan adalah pneumatic Golay. Detektor ini terdiri dari ruangan yang berisi gas yang mengalami kenaikan tekanan bila terkena panas oleh energi cahaya.
Daerah spektrum infra merah terletak pada bilangan gelombang 4000 hingga 650 cm-1. Proses serapan infra merah seperti halnya penyerapan energi yang lain, molekul akan tereksitasi ke tingkatan yang lebih tinggi bila menyerap radiasi infra merah. Hanya frekuensi tertentu dari radiasi infra merah yang akan diserap oleh molekul. Penyerapan radiasi infra merah sesuai dengan perubahan energi. Radiasi dalam kisaran energi ini sesuai dengan kisaran frekuensi vibrasi rentangan dan vibrasi bengkokan dari ikatan kovalen dalam kebanyakan molekul. Namun, tidak semua ikatan dalam molekul dapat menyerap energi infra merah, meskipun radiasi tetap sesuai dengan gerakan ikatan (Wagner, dkk., 1999).
24 BAB III
METODE PENELITIAN
III.1 Jenis Penelitian
Jenis penelitian yang digunakan pada penelitian ini adalah penelitian eksperimen berskala laboratorium.
III.2 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan November tahun 2015 sampai bulan Januari tahun 2016 di Laboratorium Biologi Farmasi STIFA-AKFAR Kebangsaan Makassar dan Laboraturium Terpadu MIPA Universitas Hasanudin.
III.3 Alat dan Bahan III.3.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah : alat-alat kaca, cawan porselin, lampu ultra violet 254 dan 366 nm, lempeng kromatografi lapis tipis (KLT) GF 254, lempeng kromatografi lapis tipis preparative (KLTP), seperangkat alat maserasi, seperangkat alat kromatografi kolom, Spektrofotometer FT-IR, Spektrofotometer UV-Vis, dan timbangan analitik.
III.3.2 Bahan
Bahan yang digunakan pada penelitian ini adalah : etanol, etil asetat, n-heksan, metanol, kloroform, sampel umbi talas dan serbuk silika gel 60 GF 254.
25 III.4 Metode Kerja
III.4.1 Pengambilan sampel
Sampel umbi talas dikumpulkan dari desa Laloya kabupaten Bantaeng Provinsi Sulawesi Selatan.
III.4.2 Pengolahan sampel
Umbi talas yang telah dikumpulkan disortasi basah, dicuci, dirajang (dipotong kecil-kecil), dikeringkan dengan diangin-anginkan dan dilanjutkan proses pengeringannya dalam lemari pengering kemudian dilakukan sortasi kering lalu diserbukkan.
III.4.3 Pembuatan Ekstrak
Simplisia kering umbi talas safira sebanyak 500 gram diekstraksi dengan metode maserasi menggunakan pelarut etanol 70% selama 5 hari, lalu disaring dan diremaserasi dengan pelarut etanol 70% selama 3 hari. Hasil maserasi diuapkan dan diperoleh ekstrak kental sebanyak 62 gram.
III.4.4 Proses Pemisahan
III.4.4.1 Kromatografi Lapis Tipis Orientasi Eluen
Lempeng diaktivkan dalam oven dengan suhu 115°C selama 15 menit, selanjutnya ekstrak dilarutkan ke dalam cawan poselin dengan pelarut etanol kemudian ditotolkan pada lempeng yang telah di aktivkan.
Dilakukan orientasi eluen dengan cara dibuat eluen n-Heksan : Etil Asetat (3:7), n-heksan : kloroform (3:7), kloroform : metanol (3:7) dan n-heksan : metanol (3:7), lalu eluen dimasukkan ke dalam chamber dan dielusi. Kemudian dilakukan pengamatan pada penampakan noda dengan
26
menggunakan UV 254 nm dan 366 nm dan dipilih eluen koloroform : metanol (3:7) yang memiliki pemisahan yang baik.
III.4.4.2 Fraksinasi
Seperangkat alat kromatografi kolom disiapkan dan dimasukkan
silica gel sebanyak 40 gram ke dalam tabung kolom dengan
menggunakan metode basah sambil diketuk-ketuk tabung kolom hingga mampat.
Ekstrak sebanyak 5 gram dimasukkan ke dalam tabung kolom dan dimasukkan sedikit silica gel kering diatasnya. Dielusi dengan menggunakan eluen kloroform : metanol ( 10 : 0 ; 9 : 1 ; 8 : 2 ; 7 : 3 ; 6 : 4 ; 4 : 6 ; 3 : 7 ; 2 : 8 ; 1 : 9 ; 0 : 10) dengan perbandingan kepolaran yang semakin meningkat. Hasil yang keluar ditampung dalam 121 vial dan vial-vial tersebut dipilih secara acak kemudian diKLT, vial-vial-vial-vial yang memiliki nilai Rf yang sama atau pola kromatogram yang sama digabung menjadi satu fraksi, 9 fraksi yang didapat diuapkan dan diperoleh bobot dari tiap fraksi.
III.4.5. Isolasi
Fraksi 6 dengan bobot yang paling besar dilanjutkan pada kromatografi lapis tipis preparatif ( KLTP ) dengan menggunakan eluen n-heksan : etil asetat (3:2). Selanjutnya pita yang diperoleh dari hasil KLTP dikerok kemudian dilarutkan dengan etanol dan dipisahkan dari silikanya dengan cara di saring menggunakan pipet yang telah dimasukan kapas.
27 III.4.6. Uji Kemurnian
Uji kemurnian dilakukan menggunakan KLT dua dimensi menggunakan eluen tunggal yaitu n-heksan : etilasetat (3:2). isolat menunjukkan noda tunggal pada plat kromatografi maka isolat tersebut relatif murni secara KLT ( hanya mengandung satu macam senyawa ).
III.4.7.Karakterisasi Isolat
Karakterisasi isolat dilakukan dengan menggunakan alat spektrofotometer UV-Vis dan spektrofotometer FT-IR.
III.5. Pengumpulan dan Pengolahan Data
Pengumpulan dan pengolahan data mencakup pemisahan, pemurnian dan pengkarakterisasian.
28
BAB IV
HASIL DAN PEMBAHASAN
Penelitian isolasi dan karakterisasi senyawa dari fraksi VI ekstrak etanol Umbi Talas safira (Colocasia esculenta Schott var. antiquorum) dilakukan dalam enam tahap meliputi preparasi sampel, ekstraksi komponen aktif, pemisahan senyawa aktif menggunakan Kromtografi Kolom yang dilanjutkan dengan Kromatografi Lapis Tipis Preparatif (KLTP), dan karakterisasi senyawa aktif menggunakan Spektrofotometer UV-Vis dan FTIR serta analisis data.
Sampel yang digunakan dalam penelitian ini adalah bagian umbi dari tanaman talas safira. Pada proses pengeringan simplisia dengan cara diangin-anginkan ditemukan masalah yaitu simplisia berubah warna menjadi hitam berjamur. Masalah ini disebabkan karena sifat umbi talas yang higroskopis sehingga perlu dilakukan pengeringan lanjutan dalam lemari oven. Pengeringan dimaksudkan untuk mengurangi kadar air, menghentikan aktifitas mikroba dan mencegah timbulnya jamur sehingga komposisi kimianya tidak mengalami perubahan. Sampel yang telah kering ini kemudian diperkecil lagi ukurannya namun tidak sampai halus karena di khawatirkan akan mengapung saat perendaman dalam metode maserasi yang akan mempengaruhi proses penarikan senyawa.
Ektraksi merupakan proses pemisahan senyawa campuran dengan menggunakan pelarut yang sesuai. Metode yang digunakan
29
dalam penelitian ini adalah metode maserasi. Maserasi adalah salah satu metode pemisahan senyawa dengan cara perendaman menggunakan pelarut organik pada suhu ruangan. Proses maserasi sangat menguntungkan dalam isolasi senyawa bahan alam karena selain murah dan mudah dilakukan, dan aman untuk senyawa yang tidak tahan panas, sedangkan kerugian dari maserasi adalah pengerjaannya yang lama (Guanther, 1990).
Maserasi dilakukan dengan cara merendam sampel dalam pelarut. Proses perendaman sampel tumbuhan akan menyebabkan terjadinya pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam sel dan di luar sel, sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut. Pelarut yang mengalir ke dalam sel dapat menyebabkan protoplasma membengkak dan bahan kandungan sel akan larut sesuai dengan kelarutannya. Pemilihan pelarut untuk proses maserasi akan memberikan efektifitas yang tinggi dengan memperhatikan kelarutan senyawa bahan alam terhadap pelarut tersebut (Lenny, 2006)
Simplisia umbi talas sebanyak 500 gram diektraksi dengan metode maserasi selama 5 hari menggunakan pelarut etanol 70%. Ekstrak etanol yang diperoleh adalah ekstrak kental sebanyak 42 gram dan remaserasi diperoleh ekstrak kental sebanyak 20 gram, total ekstrak kental yang di peroleh adalah 62 gram dengan hasil rendamen sebesar 12,4 %.
30
Sebelum dilakukan pemisahan senyawa menggunakan teknik kromatografi kolom, terlebih dahulu dilakukan pemilihan eluen terbaik menggunakan metode KLT. Pemilihan eluen dilakukan dengan mencoba campuran yang memiliki perbedaan kepolaran yaitu : n-heksan : etil asetat (3:7), n-heksan : kloroform : (3:7), n-heksan : metanol (3:7), dan kloroform : metanol (3:7). Dari keempat eluen tersebut dipilih eluen koloroform : metanol (3:7) karena memiliki pemisahan yang terlihat baik di lampu UV 254 nm dan 366 nm. Dengan mengamati jumlah noda terbanyak dan jarak pemisahan antar noda cukup terpisah maka dapat digunakan sebagai dasar pemilihan campuran eluen terbaik ( Suirta, 2007).
Sebanyak 5 gram ekstrak kental umbi talas digunakan untuk kromatografi kolom. Pemisahan kromatografi kolom didasarkan pada absorbsi komponen-komponen campuran dengan afinitas berbeda-beda terhadap fase diam. Pada saat terabsorbsi, komponen dipaksa untuk berpindah oleh aliran fase gerak yang ditambahkan secara kontinyu akibatnya hanya komponen yang mempunyai afinitas lebih besar terhadap fase diam akan secara selektif tertahan. Komponen dengan afinitas lebih kecil akan bergerak lebih cepat mengikuti aliran fase gerak. Dari hasil kolom di dapatkan 121 vial yang memiliki perbedaan warna dan kekentalan masing-masing.
Berdasarkan pola noda hasil analisis KLT, eluet dapat di gabung dan dikelompokkan menjadi 9 kelompok fraksi yaitu fraksi 1 vial (1-9), fraksi 2 vial (10-14), fraksi 3 vial (15-19), fraksi 4 vial (20-26), fraksi 5 vial
31
(27-29), fraksi 6 vial (30-39), fraksi 7 vial (40-50), fraksi 8 vial (51-71), fraksi 9 vial (72-121).
Hasil penampakan noda pada lempeng KLT ke 9 fraksi tersebut tidak menunjukan pemisahan yang baik sehingga dilakukan pencarian eluen yang lebih baik lagi dan didapatkan eluen n-heksan : etilasetat (3:7). Dari eluen tersebut didapatkan 7 fraksi berdasarkan kesamaan jarak pada profil penampakan nodanya di KLT. 7 fraksi tersebut diuapkan dan di dapatkan bobot dari masing-masing fraksi yaitu fraksi 1 (739,5 mg), fraksi 2 (410 mg), fraksi 3 (509,9 mg), fraksi 4 (666,8 mg), fraksi 5 (939 mg), fraksi 6 (2,37 gram) dan fraksi 7 (272 mg).
Dari ke 7 fraksi , fraksi 1 dan 2 yang memiliki pemisahan yang bagus pada metode KLT, namun karna terdapat banyak pemisahan senyawa sehingga dipilih fraksi yang memiliki bobot paling besar untuk di lanjutkan ke KLTP yaitu fraksi 6. Hasil KLT fraksi 6 menggunakan eluen n-heksan : etilasetat (3:7) tidak menunjukan pemisahan senyawa yang baik sehinggga dilakukan pencarian eluen yang lebih baik lagi untuk fraksi 6, dan didapatkan eluen n-heksan : metanol (3:7). Namun pada saat di lakukan KLTP menggunakan eluen n-hkesan : metanol (3:7) pemisahan senyawanya sangat tidak bagus sehingga dilakukan pencarian eluen kembali untuk mendapatkan pemisahan senyawa yang bagus dan didapatkan eluen n-heksan : etilasetat (3:2). Dari hasil KLTP didapatkan 1 pita menunjukan penampakan noda yang jelas di bawah lampu UV 254 nm dan 366 nm.
32
Kromatografi lapis tipis preparatif merupakan metode pemisahan senyawa dalam jumlah besar. Hasil pemisahan dengan KLTP hampir sama dengan KLT hanya berbeda pada jumlah ekstrak dan lempeng yang digunakan. Untuk metode KLTP digunakan lempeng kaca dan cara penotolan sampelnya berupa garis lurus sepanjang lampeng. Dari hasil KLTP diperoleh bobot isolat yaitu 27 mg.
Dilakukan uji kemurnian terhadap isolat dengan mengggunakan metode KLT dua dimensi menggunakan eluen tunggal yaitu n-heksan : etil asetat ( 3:2). Setelah dilakukan KLT 2 dimensi diperoleh 1 noda tunggal. Kemudian hasil isolat diidentifikasi menggunakan spektrofotometer UV-Vis dan FTIR.
Tabel 3. Hasil Pembacaan Spektrum UV-Vis
No. panjang gelombang
(nm) Absorbansi 1. 745,00 0,286 2. 692,50 0,296 3. 303,00 0, 749 4 291,50 0,763 5 262,50 0,850 6 200,50 3,185
Isolat murni yang diperoleh selanjutnya dikarakterisasi
menggunakan instrumen UV-Vis. adanya golongan senyawa flavanoid flavonol pada bilangan gelombang 250-270 nm (Harborne, 1987).
33
Tabel 4. Hasil Pembacaan Spektrum FTIR
NO Bilangan gelombang isolate (cm-1) Pustaka (silverstein) Pustaka (Fessenden) Pustaka ( Creswell et all,) Prediksi gugus fungsi 1 617,22 - - 1000-650 C-H 2 651,94 - - 1000-650 C-H 3 796,6 675-870 1900-1300 - C-H 4 1099,43 - 1050-1260 - C-O 5 1417,68 - - 1475-1300 C-H 6 1560,41 1500-1600 - - C=C 8 1645,28 - - 1900-1650 C=O 9 1826,59 - - 1900-1650 C=O 10 1867,09 - - 1900-1650 C=O 11 2270,22 2000-3600 - - O-H 12 2335,8 2000-3600 - - O-H 13 2360,87 2000-3600 - - O-H 14 2403,3 2000-3600 - - O-H 15 2856,58 2850-2960 2800-3000 - C-H 16 2927,94 2850-2960 2800-3000 - C-H 17 2962,66 2850-2960 2800-3000 - C-H 28 3450,65 3000-3600 - O-H 19 3728,4 - - 3750-3000 O-H
Isolat murni selanjutnya dikarakterisasi menggunakan instrumen FT-IR. Data spektra FT-IR menunjukan adanya serapan pada frekuensi 617,22 cm-1 hal ini mengindikasikan adanya gugus C-H karena absorbsi
terjadi pada bilangan gelombang 1000-650 cm-1. Data spektra
menunjukkan adanya serapan pada frekuensi 796,6 cm-1 dan hal ini mengindikasikan adanya gugus C–H alifatik karena absorbsi senyawa
34
aromatik terjadi pada bilangan gelombang 675-870 cm-1. Data spektra
menunjukkan adanya serapan pada frekuensi 1099,43cm-1. Hal ini
mengindikasikan adanya gugus C–O eter karena absorbsi terjadi pada panjang gelombang 1050-1260 cm-1. Data spektra menunjukkan adanya serapan pada frekuensi 1417,68 cm-1. Hal ini mengindikasikan adanya gugus C–H alifatik karena serapan terjadi pada bilangan gelombang 1475-1300 cm-1. Data spektra 1560,41cm-1 juga mengindikasikan adanya gugus C=C aromatik karena serapan C=C aromatik terjadi pada bilangan
gelombang 1500-1600 cm1. Data spektra menunjukkan adanya serapan
pada frekuensi 1645,28 cm-1. Hal ini mengindikasikan adanya gugus C=O
karena serapan terjadi pada bilangan gelombang 1900-1650 cm-1. Data
spektra menunjukkan adanya serapan pada frekuensi, 2927,94 cm-1, dan
2962,66 cm-1. Hal ini mengindikasikan adanya gugus C-H alifatik karena terjadi pada bilangan gelombang 2850 cm-1 – 2960 cm-1. Data spectra
menunjukan adanya serapan pada frekuensi 3450,65 cm-1, hal ini
mengindikasikan adanya gugus O-H karena terjadi serapan pada panjang
gelombang 3000-3600 cm-1 (Fessenden,1997; Silverstein,2005).
Pada penelitian yang dilakukan oleh Markus, tahun 2014 yaitu isolasi dan karakterisasi senyawa flavonoid dari fraksksi III ekstrak umbi Talas Safira dengan melakukan uji golongan flavonoid dan melakukan karakterisasi mengggunakan FT-IR menunujukaan adanya gugus fungsi O-H, C-H alifatik, C-C alifatik C=C aromatik dan C-O mengindikasikan adanya senyawa flavonoid. Begitu juga pada penelitian ini yaitu isolasi
35
dalam karakterisasi senyawa fraksi VI dari ekstrak etanol umbi talas safira mengunakan FT-IR menunjukan adanya Gugus fungsi O-H, C-H alifatik, C=C aromatik dan C-O namun belum bisa dikatakan adanya senyawa yang di duga flavonoid karna tidak di lakukan pengujian spesifik golongan flavonoid.
36
BAB V
PENUTUP
V.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, diperoleh
kesimpulan yaitu analisis fraksi VI berupa isolat berwarna putih dengan nilai Rf 0,83 cm menggunakan instrument spektrofotometer FT-IR menunjukan adanya senyawa yang memiliki gugus fungsi O-H, C-H alifatik ,C=C aromatik dan C-O.
V.2 Saran
Diharapkan agar dilakukan penelitian lebih lanjut menggunakan instrumen spektrofotometer Nuclear Magnetic Resonance (NMR) untuk mengetahui karakteristik yang lebih detail dari isolat dan dilakukan uji efek farmakologi terhadap isolat tersebut.
37 DAFTAR PUSTAKA
Adnan, M.,( 1997), Teknik Kromatografi untuk Analisis Bahan Makanan.
Edisi I. cetakan pertama. Yogyakarta. PustakaPelajar. p. 9.
Akmal, Dkk. 2009. Pemanfaatan Talas Bogor Dalam Minuman Probiotik
Strategi Peningkatan Kesejahteraan Petani Talas: Institute Pertanian
Bandung
Biren, N.S., B.S. Nayak, S.P. Bhatt, S.S. Jalalpure, & A.K. Seth., ( 2007) ,The Anti-Inflamatory Activity of The Leaves of Colocasia esculenta.
SPJ, Vol. 15, Nos.3-4.
Creswll.,C, Ollaf Ruquist dan Malkom Campbell. Analisis Senyawa
Oraganic. Bandung : ITB
Dalimartha, S., (2006), Atlas Tumbuhan Obat Indonesia Jilid 4. Depok : Puspa Swara.
Depkes., (1986), Sediaan Galenik, Departemen Kesehatan RI, Jakarta, 10-12.
Depkes., (1989), Materia Medika Indonesia. Jilid V, Departemen Kesehatan RI, Jakarta, 194-197, 516-553.
Fessenden, R.J., dan Fessenden, J.S.,(1997), Dasar-Dasar Kimia
Organik, Binarupa Aksara, Jakarta, 151
Gritter,R.J.,dan Bobbits, J.M.,(1991),Pengantar Kromatografi edisi II. Penerjemah Dr. Kokasih Padmawanita. Bandung. Penerbit ITB. p. 107, 140-141.
Harborne. J.B.,(1987), Metode Fitokimia, Institut Tekhnologi Bandung, Bandung, 2, 1-8..
Hostettmann, K.M., dan A. Marston., (1995), Cara Kromatografi Preparatif, Diterjemahkan oleh Kosasi Padmawinata, Institute Tekhnologi Bandung, Bandung
Lenny. S. 2006. Senyawa terpemoid dan steroid Medan : FMIPA Universitas Sumatra Utara. Katya Ilmiah
Leong, A.C., Yoshinori K., Masakuni T., Hironori I., Hirosuke O., dan Hajime T.,( 2009.) Flavonoid glycosides in the shoot syste of
38
Melani,F.,(2008),Skripsi.Elusidasi dan karakterisasi senyawa penanda
ekstrak methanol daun pegagan (Centellaasiatica L).Sekolah Tinggi
Ilmu Farmasi
Mulja, Syahrani.,(1990), Aplikasi Spektrofotometer UV-VIS.
MecphisoGrafik. Surabaya. p. 3.
Mulya, M., dan H., Suharman., (1995), Analisis Instrumen, Airlangga, University Press, Surabaya.
Prihatman, Talas (Colocasia esculenta (L.) Schott), (online),(http://lc.bppt.
go.id/ttg/Data/bididaya%20pertanian/pangan/talas.pdf, 2000.
(diakses pada tanggal 15 Mei 2014).
Purwono, & Heni Purnamawati., (2007), Budidaya 8 Jenis Tanaman
Pangan Unggul, Jakarta.
Rawuh, Sugeng., (2008), Penghilangan Rasa Gatal Pada Talas. http://yellashakti. wordpress.com.(diakses pada tanggal 5 agustus 2014)
Rohman A.,Ibnu GG.,( 2007.), Kimia FarmasiAnalisis. PustakaPelajar. Yogyakarta. p. 20.
Sastrohamidjojo, H., (2001), Spektroskopi, Liberty, Yogyakarta, 22-36. Sastrohamidjojo, H., Kromatografi. Yogyakarta. UGM-Press. 2007; p. 11, 39, 42.
Slamet D.S dan lg. Tarkotjo .,(1990), Majalah Gizi Jilid 4. Pusat penelitian dan pengembangan kesehatan Depkes RI.Jakarta.
Syahbaniah Nur., (2012), Studi Pemanfaatan Talas (Colocasia esculenta)
Sebagai Bahan Pengisi Dalam Pembuatan Es Krim, Univesitas
Hasanudin, Makasar.
Silverstein,R.M., Webster.Fx.,Kiemle DJ., (2005;),Spectrometric
identification of organic Compounds. New York, 75.
Stahl, E., (2001), Analisis Obat Secara Kromatografi dan Mikroskopi, Intitute Teknologi Bandung, Bandung.
39
Suirta I.W., Puspita, N.M, dan Gumiati N.K.2007. Isolasi Dan Identifikasi
Senyawa Aktif Larvarida Dari Biji Mimba (Azadirachta Imdika.A.Juss) Terhadap Larva Nyamuk Demam Berdarah ( Aeges Aegepty). Jurna Kimia. 1 (1) : 47-54
Sumarno.,( 2001 ),Kromatografi Teori Dasar. Yogyakarta Bagian Kimia Farmasi Universitas Gajah Mada. p. 29.
Talamona, A.,( 2005), Laboratory Chromatography Guide.Switzerland. Penerbit Büchi Labortechnik AG. p. 12.
Wagner, W.L., D.R., Herbst and S.H. Sohmer., (1999), Manual of The Flowering Plants of Hawai’I, Bishop Museum Special Publication, University of Hawai’I and Bishop Museum Press, Honolulu.
Yazid, E., (2005), Kimia Fisika Untuk Paramedis, Andi Yogyakarta, Yogyakarta.
40 Lampiran 2. Sampel Penelitian Umbi Talas
Tanaman talas safira Umbi talas safira
Sampel setelah di cuci Perajangan sampel
41 Lampiran 3. Proses ekstraksi sampel
Maserasi sampel
42 Lampiran 4. Profil KLT Orientasi Eluen
a b
c d
Keterangan Gambar :
a. N : E = n-heksan: etil asetat (3:7) b. N : K = n-heksan: kloroform (3:7) c. K : M = kloroform: metanol (3:7) d. E : M = n-heksan: metanol (3:7)
43
Fase gerak klorofrom : metanol (3:7
44
9 fraksi dengan fase gerak n-heksan : etil asetat (3:7)
45
Fraksi 6 dengan fase gerak n-heksan : etil asetat (3:2)
46 Lampiran 5. Profil KLTP Hasil Kromatografi Kolom dengan
47 Lampiran 6. Profil KLT dua dimensi
Noda A pada penampakan UV 254 nm Noda A pada penampakan UV 366 nm Noda C pada penampakan UV 254 nm Noda B pada penmapakan UV 254 nm
48 Lampiran 7. Frekuensi dan Absorbansi Infra Merah
Jenis ikatan Frekuensi abosorbansi (cm-1)
Karbon – karbon c = c (alkenil) c – c (aril) c = c (alikinil) 1600 – 1700 1450 – 1600 2100 – 2250 Karbon – hidrogen Sp3 C – H Sp2 C – H Sp2 C - H Aldehida C - H 2800 – 3000 3000 – 3300 ~ 3300 2700 – 2780 Alkohol, eter, fenol, dan amin
O – H N – H Alkohol C – O Eter C – O 3000 – 3700 (lebar) 3000 – 3700 900 – 1300 1050 – 1260 Senyawa karbonil Aldehid C = O Keton C = O Karbonil C = O Ester C = O 1720 – 1740 1705 – 1750 1700 – 1725 1735 – 1750
49 Lampiran 8. Serapan Khas Gugus Fungsi Pada Infra Merah
Gugus fungsi Jenis senyawa Daerah serapan (cm-1)
C-H Alkana 2850-2960, 1350-1470 C-H Alkena 3020-3080, 675-870 C-H Aromatik 3000-3100, 675-870 C-H Alkuna 3300 C=C Alkena 1640-1680 C=C Aromatik (cincin) 1500-1600
C-O Alkohol, eter, asam karboksilat, ester 1080-1300
C=O Aldehida, keton, asam karboksilat, ester 1690-1760
O-H Alkohol ,fenol (monomer) 3610-3640
O-H Alkohol, fenol (ikatan H) 2000-3600
O-H Asam karboksilat 3000-3600 (lebar)
N-H Amina 3310-3500
50 Lampiran 9. Hasil FT-IR Fraksi VI
51 Lampiran 11. Hasil UV-Vis Fraksi VI