UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS PENYEMBUHAN LUKA BAKAR
EKSTRAK ETANOL UMBI TALAS JEPANG
(
Colocasia esculenta
(L.) Schott var.
antiquorum
) PADA
TIKUS PUTIH (
Rattus norvegicus
) JANTAN GALUR
SPRAGUE DAWLEY
SKRIPSI
TITIS MAWARSARI
1111102000021
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS PENYEMBUHAN LUKA BAKAR
EKSTRAK ETANOL UMBI TALAS JEPANG
(
Colocasia esculenta
(L.) Schott var.
antiquorum
) PADA
TIKUS PUTIH (
Rattus norvegicus
) JANTAN GALUR
SPRAGUE DAWLEY
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
TITIS MAWARSARI
1111102000021
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK sebab itu, luka bakar dihadapkan pada kompleksitas permasalahan yang memerlukan perhatian secara khusus. Umbi talas jepang (Colocasia esculenta (L.) Schott var. antiquorum) diketahui mengandung senyawa-senyawa yang berperan dalam penyembuhan luka seperti alkaloid, steroid, flavonoid, tanin, fenol, triterpenoid, saponin dan glikosida. Penelitian ini bertujuan untuk mengkaji pemberian ekstrak umbi talas jepang terhadap penyembuhan luka bakar. Ekstrak dibuat dengan maserasi menggunakan pelarut etanol 96%. Penelitian ini menggunakan tikus putih jantan yang dibagi menjadi 5 kelompok yaitu kelompok kontrol positif yang diberikan krim Lanakeloid-E®, kelompok kontrol negatif yang diberikan basis krim dan 3 kelompok uji konsentrasi yang diberikan krim ekstrak dengan konsentrasi yang bervariasi (1%, 5% dan 25%). Metode pembuatan luka bakar derajat dua menggunakan metode Akhoondinasab. Pemberian krim ekstrak dilakukan sebanyak dua kali sehari selama 21 hari. Parameter yang diamati meliputi penurunan luas luka bakar, persentase penyembuhan luka, keberadaan sel radang dan makrofag, serta neokapilerisasi. Hasil analisis statistik uji Paired-Samples T Test menunjukkan perbedaan yang signifikan (p<0,05) terhadap luas luka awal dan luas luka akhir. Hasil analisis statistik uji One-Way ANOVA menunjukkan bahwa krim ekstrak umbi talas jepang dengan 3 konsentrasi berbeda menunjukkan efek penurunan luas luka bakar dan peningkatan persentase penyembuhan luka bakar yang tidak berbeda signifikan dengan kontrol positif dan kontrol negatif. Krim ekstrak etanol umbi talas jepang dapat memicu keberadaan sel radang dan makrofag serta neokapilerisasi. Krim ekstrak etanol umbi talas jepang dapat membantu dalam proses penyembuhan luka bakar derajat dua pada fase inflamasi dan proliferasi.
Kata Kunci : Umbi talas jepang, Colocasia esculenta (L.) Schott var.
ABSTRACT
Name : Titis Mawarsari
Major : Pharmacy
Title : Study of Burn Wound Healing Activity using Ethanolic Extracts of Colocasia esculenta (L.) Schott var. antiquorum
Tuber in White Male Rats (Rattus norvegicus) Sprague Dawley Strain
The acute phase of the burns case is a form of critical trauma with a number of high mortality, which is not necessarily found in other trauma cases. Therefore, burn wounds is facing the complexity of problems that need particular attention.
Colocasia esculenta (L.) Schott var. antiquorum tubers are known to contain compounds that play a role in wound healing such as steroid, alkaloid, flavonoid, tannin, phenol, triterpenoid, saponin and glycoside. The aim of this research is to examine the granting of Japanese taro tuber extracts toward the healing of burns. The extract is made by maceration using solvent ethanol 96%. This research uses white male rats who were divided into 5 groups, the positive control group was given a Lanakeloid-E® cream, the negative control group was given a base cream and 3 groups of test concentration were given the extracts cream with varying concentrations (1%, 5% and 25%). The method of making a second degree burn wound was the Akhoondinasab method. The extracts cream were applied twice a day for 21 days. The observed parameters include extensive burns, percentage of wound healing, the presence of macrophages, inflammation cell and new formed capillaries. The results of the statistical analysis Paired Samples T Test shows a significant difference towards the early and end wound. The results of the statistical analysis One-Way ANOVA test indicates that the extracts cream of tubers with 3 different concentrations indicates that the decreasing extensive burns and increasing percentage of wound healing effects where the burns did not differ significantly with the positive and negative controls. Ethanolic extract cream of the Japanese taro tubers can help trigger the presence of macrophages, inflammation cell and new formed capillaries. Ethanolic extract cream of the Japanese taro tubers can help in the second degree burns healing process at the inflammatory and proliferation phase.
KATA PENGANTAR
Alhamdulillahirobbil’alamin, segala puji, puja dan syukur kehadirat Allah SWT atas segala rahmat, ridho, karunia dan hidayah-Nya yang telah melimpahkan kepada penulis sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Uji Aktivitas Penyembuhan Luka Bakar Ekstrak Etanol Umbi Talas Jepang (Colocasia esculenta (L.) Schott var. antiquorum) Pada Tikus Putih (Rattus norvegicus) Jantan Galur Sprague Dawley”. Sholawat serta salam
semoga selalu tercurah kepada Nabi Muhammad SAW, dan para sahabat serta pengikutnya.
Dalam penyelesaian penelitian dan penulisan skripsi ini penulis banyak menerima bantuan maupun dukungan dari berbagai pihak. Pada kesempatan ini dengan segala kerendahan hati, penulis ingin memberikan penghargaan yang setinggi-tingginya dan menyampaikan terima kasih yang tulus kepada:
1. Ibu Dr. Azrifitria, M. Si., Apt dan Bapak Syaikhul Aziz, M. Si., Apt selaku dosen pembimbing yang selalu memberikan arahan serta meluangkan waktu, tenaga dan pikiran dalam penelitian dan penyusunan skripsi ini. 2. Bapak Drs. Umar Mansur, M. Sc., Apt, Ibu Eka Putri, M. Si., Apt, Bapak
Yardi, Ph. D., M. Si., Apt dan Ibu Prof. Dr. Atiek Soemiati, M. Si., Apt selaku dosen penguji yang telah banyak memberikan evaluasi dan saran dalam penyusunan skripsi ini.
3. Bapak Dr. Arief Sumantri, M. Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. 4. Bapak Yardi, Ph. D., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
5. Kedua orang tua tercinta dan tersayang, Bapak Suwarno dan Ibu Susy Adriyani yang selalu memberikan dukungan baik moril maupun materi, serta kasih sayang dan do’a yang tiada henti.
7. Bapak dan Ibu dosen yang telah memberikan ilmunya selama penulis menempuh pendidikan di Universitas Islam Negeri Syarif Hidayatullah Jakarta.
8. Para staf karyawan dan laboran Program Studi Farmasi yang telah banyak membantu dalam proses berlangsungnya penelitian ini.
9. Sahabat-sahabatku Nurhabiba Edriana, Santi Kurnia Dewi, Batari Wulanning Dyah Sidi, Qurry Mawaddana, Ageng Hasna Fauziyah, Sumiati, Eka Lestari Sitepu, Dina Adlina Amu, Khoirunnisa Robbani yang telah memberikan semangat dan pengalaman yang indah selama pendidikan perkuliahan.
10.Teman seperjuangan yang berjuang bersama dalam proses berlangsungnya penelitian ini, Nurhayati Nasution dan Athiyah Baharmi.
11.Teman-teman Farmasi angkatan 2011 yang sama-sama berjuang menyelesaikan pendidikan perkuliahan.
12.Teman-teman Farmasi 2011 AC yang tidak membuat penulis menyesal telah menjadi bagian dari kalian.
13.Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis selama ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun harapan penulis semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan. Akhir kata, penulis berdo’a semoga Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membalas segala kebaikan semua pihak yang telah membantu penulis dalam penelitian ini.
Ciputat, 2 Oktober 2015
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
1.3. Tujuan Penelitian ... 3
1.4. Hipotesis ... 3
1.5. Manfaat Penelitian ... 3
BAB 2. TINJAUAN PUSTAKA ... 4
2.1. Tanaman Talas ... 4
2.1.1. Klasifikasi Ilmiah ... 5
2.1.2. Nama Lain ... 5
2.1.3. Morfologi Tanaman ... 6
2.1.4. Habitat Tanaman ... 6
2.1.5. Aktivitas Biologi ... 6
2.2. Tinjauan Hewan Percobaan ... 7
2.2.1. Klasifikasi Tikus Putih (Rattus norvegicus) ... 7
2.2.2. Biologis Tikus Putih (Rattus norvegicus) ... 7
2.3. Luka Bakar ... 10
2.3.1. Klasifikasi Luka Bakar ... 10
2.3.2. Luas Luka Bakar ... 12
2.3.3. Faktor yang Berperan ... 13
2.3.4. Patofisiologi Luka Bakar ... 13
2.3.5. Proses Penyembuhan Luka Bakar ... 15
2.4. Kulit ... 21
2.4.1. Anatomi Kulit ... 21
2.4.2. Fisiologi Kulit ... 23
2.5. Metode Ekstraksi dengan Menggunakan Pelarut ... 24
2.5.1. Cara Dingin ... 24
2.5.2. Cara Panas ... 25
BAB 3. METODE PENELITIAN ... 26
3.1. Tempat dan Waktu Penelitian ... 26
3.2. Alat dan Bahan ... 26
3.2.1. Alat Penelitian ... 26
3.2.3. Hewan Uji ... 27
3.3. Rancangan Penelitian ... 27
3.4. Kegiatan Penelitian ... 28
3.4.1. Pemeriksaan Simplisia ... 28
3.4.2. Penyiapan Simplisia ... 28
3.4.3. Pembuatan Ekstrak ... 28
3.4.4. Skrining Fitokimia Ekstrak ... 29
3.4.5. Pengujian Parameter Spesifik dan Non Spesifik ... 32
3.4.6. Pembuatan Krim Ekstrak Etanol Umbi Talas Jepang ... 33
3.4.7. Evaluasi Sediaan Krim ... 34
3.4.8. Persiapan Hewan Uji ... 34
3.4.9. Pembuatan Luka Bakar ... 34
3.4.10. Eksisi Jaringan Kulit Tikus ... 34
3.4.11. Pembuatan Preparat Histopatologi Jaringan Kulit Tikus ... 35
3.4.12. Pengamatan Preparat Histopatologi ... 36
3.4.13. Analisis Statistik ... 36
BAB 4. HASIL DAN PEMBAHASAN ... 37
4.1. Hasil Penelitian ... 37
4.1.1. Determinasi Tanaman ... 37
4.1.2. Ekstraksi Tanaman ... 37
4.1.3. Hasil Penapisan Fitokimia ... 37
4.1.4. Hasil Penentuan Parameter Spesifik dan Non Spesifik ... 38
4.1.5. Hasil Evaluasi Sediaan Krim ... 39
4.1.6. Hasil Pengukuran Berat Badan Tikus ... 39
4.1.7. Hasil Pengukuran Penurunan Luas Luka Bakar ... 40
4.1.8. Hasil Pengamatan Fisiologis Luka Bakar Derajat Dua ... 43
4.1.9. Hasil Pengukuran Ketebalan Epitel Preparat Hari Ke-7 ... 45
4.1.10. Hasil Pengamatan Preparat Histopatologi ... 46
4.2. Pembahasan... 49
BAB 5. KESIMPULAN DAN SARAN ... 58
5.1. Kesimpulan ... 58
5.2. Saran ... 58
DAFTAR GAMBAR
Halaman
Gambar 1. Umbi C. esculenta var. esculenta dan var. antiquorum ... 5
Gambar 2. Potongan Kulit Normal Manusia dan Kedalaman Luka Bakar ... 12
Gambar 3. Diagram Rule of Nines dari Wallace untuk dewasa ... 12
Gambar 4. Anatomi Kulit Tikus ... 22
Gambar 5. Grafik Rerata Pengukuran Berat Badan Tikus ... 40
Gambar 6. Grafik Rerata Persentase Penyembuhan Luka Bakar ... 42
Gambar 7. Grafik Rerata Ketebalan Epitel Pada Preparat ... 45
DAFTAR TABEL
Halaman
Tabel 2.1. Data Biologis Tikus (Sprague Dawley® Rat)... ... ...9
Tabel 2.2. Tabel Lund & Browder ... 12
Tabel 3.1. Pembagian Kelompok Hewan Uji Berdasarkan Pemberian Perlakuan 27 Tabel 3.2. Formula Basis Krim ... 33
Tabel 4.1. Hasil Penapisan Fitokimia Ekstrak Etanol Umbi Talas Jepang ... 38
Tabel 4.2. Hasil Penentuan Parameter Spesifik dan Non Spesifik ... 38
Tabel 4.3. Hasil Evaluasi Sediaan Krim Ekstrak Etanol Umbi Talas Jepang ... 39
Tabel 4.4. Hasil Pengukuran Berat Badan Tikus ... 39
Tabel 4.5. Rerata Penurunan Luas Luka Bakar dan Persentase Penyembuhan ... 41
Tabel 4.6. Hasil Pengamatan Visual Rerata Fisiologis Luka Bakar Derajat Dua .. 44
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Penelitian ... 66
Lampiran 2. Determinasi Tanaman ... 67
Lampiran 3. Hasil Penapisan Fitokimia Ekstrak Etanol Umbi Talas Jepang ... 68
Lampiran 4. Pengamatan Rerata Fisiologis Luka Bakar ... 71
Lampiran 5. Tahapan Pengukuran Luas Luka Bakar ... 73
Lampiran 6. Data Luas Luka Bakar ... 75
Lampiran 7. Data Hasil Pengukuran Ketebalan Epitel Preparat Hari Ke-7 ... 77
Lampiran 8. Hasil Analisis Statistik Ketebalan Epitel Preparat Hari Ke-7 ... 78
Lampiran 9. Hasil Analisis Statistik Luas Luka Bakar Derajat Dua ... 82
BAB 1
PENDAHULUAN
1. 1 Latar Belakang
Luka bakar adalah suatu bentuk kerusakan dan atau kehilangan jaringan disebabkan kontak dengan sumber yang memiliki suhu yang sangat tinggi (misalnya api, air panas, bahan kimia, listrik dan radiasi) atau suhu yang sangat rendah. Saat terjadi kontak dengan sumber termis (atau penyebab lainnya), berlangsung reaksi kimiawi yang menguras energi dari jaringan sehingga sel tereduksi dan mengalami kerusakan (Moenadjat, 2009). Panas yang mengenai tubuh tidak hanya mengakibatkan kerusakan lokal tetapi memiliki efek sistemik. Perubahan ini khusus terjadi pada luka bakar dan umumnya tidak ditemui pada luka yang disebabkan oleh cedera lainnya (Tiwari, 2012).
Prinsip penanganan dalam penyembuhan luka bakar antara lain mencegah infeksi sekunder, memacu pembentukan jaringan kolagen dan mengupayakan agar sisa-sisa sel epitel dapat berkembang sehingga dapat menutup permukaan luka. Proses penyembuhan luka bakar dapat dibagi dalam tiga fase, yaitu fase inflamasi, proliferasi, dan maturasi. Fase inflamasi berlangsung sejak terjadinya luka bakar sampai hari ketujuh, fase proliferasi berlangsung dari akhir fase inflamasi sampai kira-kira akhir minggu ketiga dan fase maturasi dapat berlangsung berbulan-bulan kemudian dan dinyatakan berakhir kalau semua tanda radang sudah lenyap (Sjamsuhidajat dan Jong, 1997).
Tanaman talas sudah tidak asing di Indonesia. Namun, mungkin tak banyak masyarakat yang mengenal jenis talas jepang atau satoimo. Varietas talas dengan nama latin Colocasia esculenta var. antiquorum ini berbeda dengan talas biasa (Kartini P.S., 2009). Daun tanaman ini berkhasiat sebagai antidiabetes (Deshmukh T.A. et al, 2010). Tangkai daunnya berpotensi sebagai antiinflamasi (Murakami et al, 2005). Subhash et al (2012) melaporkan kandungan dari ekstrak umbi Colocasia esculenta
dengan enam pelarut berbeda (petroleum eter, benzen, kloroform, methanol, etanol dan air) positif mengandung alkaloid, steroid, flavonoid, tanin, fenol, triterpenoid, saponin dan glikosida.
Senyawa yang berperan pada proses penyembuhan luka diantaranya, alkaloid sebagai antibakteri (Robinson, 1991 dalam Wijaya dkk, 2014), flavonoid sebagai antiinflamasi dan antibakteri (Anggraini, 2008; Siregar, 2011), saponin sebagai antiseptik (Robinson, 1995), tanin dan triterpenoid sebagai antioksidan (Robinson, 1995).
Pendekatan secara ilmiah Colocasia esculenta untuk penyembuh luka didasarkan pada kandungan beberapa senyawa pada ekstrak umbi yang berpotensi sebagai penyembuh luka. Informasi tersebut mendorong peneliti untuk melakukan penelitian dengan memanfaatkan umbi talas jepang yang terdapat sekitar 15 atau 20 buah umbi dalam satu tanaman (Wang, 1983), untuk mempercepat penyembuhan luka bakar pada tikus putih. Pemilihan bagian umbi dikarenakan masih sangat minimnya penelitian dengan menggunakan umbi talas jepang dibandingkan dengan daunnya.
1. 2 Rumusan Masalah
Berdasarkan uraian latar belakang, maka rumusan masalahnya adalah sebagai berikut:
1. 3 Tujuan Penelitian
Tujuan dari penelitian ini diantaranya:
Untuk mengkaji pemberian ekstrak etanol umbi talas jepang secara topikal (Colocasia esculenta L. Schott var. antiquorum) terhadap penyembuhan luka bakar derajat dua pada tikus putih (Rattus norvegicus) jantan galur Sprague Dawley.
1. 4 Hipotesis
Hipotesis dari penelitian ini diantaranya:
1. Pemberian secara topikal ekstrak etanol umbi talas jepang (Colocasia esculenta L. Schott var. antiquorum) dapat menurunkan luas luka bakar derajat dua dan memberikan perubahan secara visual pada tikus putih (Rattus norvegicus) jantan galur Sprague Dawley. 2. Pemberian secara topikal ekstrak etanol umbi talas jepang
(Colocasia esculenta L. Schott var. antiquorum) dapat meningkatkan pertumbuhan jaringan re-epitelisasi pada hari ke-7 terhadap luka bakar derajat dua pada tikus putih (Rattus norvegicus) jantan galur
Sprague Dawley.
3. Pemberian secara topikal ekstrak etanol umbi talas jepang (Colocasia esculenta L. Schott var. antiquorum) dapat meningkatkan infiltrasi sel radang dan makrofag terhadap luka bakar derajat dua pada tikus putih (Rattus norvegicus) jantan galur Sprague Dawley.
1. 5 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2. 1 Tanaman Talas
Talas (Colocasia esculenta (L.) Schott) merupakan tanaman herba perenial yang termasuk dalam famili Araceae, C. esculenta yang dikelompokkan menjadi dua varietas, yaitu C. esculenta var. esculenta
(dasheen) dan C. esculenta var. antiquorum (eddoe). Talas dasheen memiliki umbi yang besar, sedangkan talas eddoe atau sering disebut talas satoimo memiliki umbi yang kecil dengan banyak anak umbi di sekitarnya. Beberapa sumber menyebutkan bahwa talas berasal dari daerah di Asia Selatan (India) atau Asia Tenggara (Malaysia), lalu menyebar ke Cina, Jepang, daerah Asia Tenggara lainnya, Kepulauan Pasifik, Afrika Barat, dan beberapa daerah di kawasan Caribia melalui migrasi penduduk (Onwueme, 1999). Menurut Purseglove (1992), talas eddoe terbentuk setelah mengalami perkembangan dan seleksi saat ditanam di Cina dan Jepang. Di Indonesia talas dapat dijumpai hampir di seluruh kepulauan dan tersebar dari tepi pantai sampai pegunungan, baik liar maupun budidaya (Fitriani, 2013).
Gambar 1. (A) Umbi C. esculenta var. esculenta dan (B) C.
esculenta var. antiquorum(Deo et al, 2009)
2. 1. 1 Klasifikasi Ilmiah (Koawara, 2013)
Tanaman talas jepang secara taksonomi mempunyai klasifikasi ilmiah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Subdivisi : Angiospermae
Kelas : Monocotyledonae
Ordo : Arales
Famili : Araceae
Genus : Colocasia
Species : Colocasia esculenta (L.) Schott var. antiquorum
2. 1. 2 Nama Lain
2. 1. 3 Morfologi Tanaman
Tanaman talas mempunyai sistem perakaran serabut, liar dan pendek. Umbi mempunyai jenis bermacam-macam. Umbi dapat mencapai 4 kg atau lebih, berbentuk silinder atau bulat, berukuran 30 cm x 15 cm, berwarna cokelat. Daunnya berbentuk perisai atau hati, lembaran daunnya 20-50 cm panjangnya, dengan tangkai mencapai 1 m panjangnya, warna pelepah bermacam-macam. Pembungaan terdiri atas tongkol, seludang dan tangkai. Bunga jantan dan bunga betina terpisah berada di bawah, bunga jantan di bagian atasnya dan pada puncaknya terdapat bunga mandul. Bunga bertipe buah buni, bijinya banyak, berbentuk bulat telur dan panjangnya 2 mm (Telaumbanua, 2005).
2. 1. 4 Habitat Tanaman
Di Indonesia tanaman talas dapat tumbuh dan berproduksi di dataran rendah sampai dataran tinggi yang berketinggian ± 1300 meter di atas permukaan laut. Lingkungan tumbuh yang ideal untuk tanaman talas bersuhu 21-27⁰C dengan kelembaban udara 50-90%, mendapat sinar matahari langsung dan bercurah hujan 240 mm/tahun. Di daerah yang berketinggian ± 250 meter di atas permukaan laut dan beriklim basah sehingga dapat tumbuh dengan baik dan berkualitas prima (Rukmana, 1998).
2. 1. 5 Aktivitas Biologi
antifungi, antikanker, hipolipidemik, antiinflamasi dan penguat syaraf. Selain itu Kubde et al. (2010) menyimpulkan bahwa semua tanaman
Colocasia esculenta diselidiki ditemukan aktif sebagai anthelmintik tradisional. Seong Wei et al, (2008) juga melaporkan bahwa daun
Colocasia esculenta memberikan aktivitas antibakteri terhadap
Citrobacter freundii, Vibrio alginolyticus, Vibrio cholerae, dll.
2. 2. Tinjauan Hewan Percobaan
2. 2. 1. Klasifikasi Tikus Putih (Rattus norvegicus)
Menurut Krinke (2000) klasifikasi tikus putih (Rattus norvegicus) adalah sebagai berikut:
Kingdom : Animalia
Phylum : Chordata
Subphylum : Vertebrata
Class : Mammalia
Order : Rodentia
Family : Muridae
Genus : Rattus
Species : Rattus norvegicus
2. 2. 2. Biologis Tikus Putih (Rattus norvegicus)
Kelompok tikus laboratorium pertama-tama dikembangkan di Amerika Serikat antara tahun 1877 dan 1893. Keunggulan tikus putih dibandingkan tikus liar antara lain lebih cepat dewasa, tidak memperlihatkan perkawinan musiman, dan umumnya lebih cepat berkembang biak. Kelebihan lainnya sebagai hewan laboratorium adalah sangat mudah ditangani, dapat ditinggal sendirian dalam kandang asal dapat mendengar suara tikus lain dan berukuran cukup besar sehingga memudahkan pengamatan. Secara umum, berat badan tikus laboratorium lebih ringan dibandingkan berat badan tikus liar. Biasanya pada umur empat minggu beratnya 35-40 g, dan berat dewasa rata-rata 200-250 g, tetapi bervariasi tergantung pada galur. Galur
Sprague Dawley merupakan galur yang paling besar diantara galur yang lain.
Terdapat beberapa galur tikus yang sering digunakan dalam penelitian. Galur-galur tersebut antara lain: Wistar, Sprague Dawley,
Long Evans, dan Holdzman. Dalam penelitian ini digunakan galur
Sprague Dawley dengan ciri-ciri berwarna putih, berkepala kecil dan ekornya lebih panjang daripada badannya (Smith, 1998). Tikus ini pertama kali diproduksi oleh peternakan Sprague Dawley. Tikus
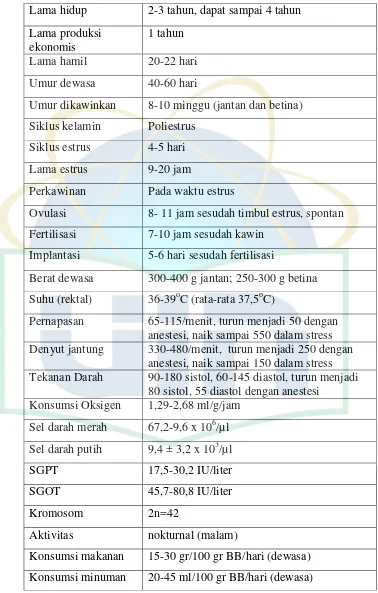
Tabel 2.1. Data Biologis Tikus (Sprague Dawley® Rat)
Lama hidup 2-3 tahun, dapat sampai 4 tahun Lama produksi
ekonomis
1 tahun Lama hamil 20-22 hari Umur dewasa 40-60 hari
Umur dikawinkan 8-10 minggu (jantan dan betina) Siklus kelamin Poliestrus
Siklus estrus 4-5 hari
Lama estrus 9-20 jam
Perkawinan Pada waktu estrus
Ovulasi 8- 11 jam sesudah timbul estrus, spontan Fertilisasi 7-10 jam sesudah kawin
Implantasi 5-6 hari sesudah fertilisasi
Berat dewasa 300-400 g jantan; 250-300 g betina Suhu (rektal) 36-39oC (rata-rata 37,5oC)
Pernapasan 65-115/menit, turun menjadi 50 dengan anestesi, naik sampai 550 dalam stress Denyut jantung 330-480/menit, turun menjadi 250 dengan
anestesi, naik sampai 150 dalam stress Tekanan Darah 90-180 sistol, 60-145 diastol, turun menjadi
80 sistol, 55 diastol dengan anestesi Konsumsi Oksigen 1,29-2,68 ml/g/jam
Sel darah merah 67,2-9,6 x 106/µl Sel darah putih 9,4 ± 3,2 x 103/µl
SGPT 17,5-30,2 IU/liter
SGOT 45,7-80,8 IU/liter
Kromosom 2n=42
Aktivitas nokturnal (malam)
2. 3 Luka Bakar
Luka bakar adalah suatu bentuk kerusakan dan atau kehilangan jaringan disebabkan kontak dengan sumber yang memiliki suhu yang sangat tinggi (misalnya api, air panas, bahan kimia, listrik dan radiasi) atau suhu yang sangat rendah (Moenadjat, 2009). Luka bakar disebabkan oleh perpindahan energi dari sumber panas ke tubuh. Panas tersebut mungkin dipindahkan melalui konduksi atau radiasi elektromagnetik. Luka bakar dikategorikan sebagai luka bakar termal, radiasi atau luka bakar kimiawi (Effendi, 1999)
2. 3. 1 Klasifikasi Luka Bakar (Moenadjat, 2009)
2. 3. 1. 1 Berdasarkan Penyebab
a. Luka bakar karena api dan atau benda panas lainnya b. Luka bakar karena minyak panas
c. Luka bakar karena air panas
d. Luka bakar karena bahan kimia yang bersifat asam kuat atau basa kuat
e. Luka bakar karena listrik dan petir f. Luka bakar karena radiasi
g. Luka bakar karena ledakan (perlu disebutkan penyebab ledakan; misal, ledakan bom, ledakan tabung gas, dsb)
h. Trauma akibat suhu sangat rendah
2. 3. 1. 2 Berdasarkan Kedalaman Kerusakan Jaringan (Luka)
a. Luka bakar derajat I
a) Kerap diberi simbol 1⁰
b) Kerusakan jaringan terbatas pada bagian permukaan (superfisial) yaitu epidermis.
c) Perlekatan epidermis dengan dermis (dermal-epidermal junction) tetap terpelihara baik.
e) Nyeri karena ujung-ujung saraf sensorik teriritasi.
f) Penyembuhan terjadi secara spontan dalam waktu 5-7 hari.
g) Contoh: luka bakar akibat sengatan matahari.
b. Luka bakar derajat II, terbagi atas derajat II dangkal dan II dalam.
a) Kerap diberi simbol 2⁰
b) Kerusakan meliputi seluruh ketebalan epidermis dan sebagian superfisial dermis.
c) Respon yang timbul berupa reaksi inflamasi akut disertai proses eksudasi.
d) Nyeri karena ujung-ujung saraf sensorik teriritasi. c. Luka bakar derajat III
a) Kerap diberi simbol 3⁰
b) Kerusakan meliputi seluruh ketebalan kulit (epidermis dan dermis) serta lapisan yang lebih dalam.
c) Apendises kulit (adneksa, integumen) seperti folikel rambut, kelenjar keringat, kelenjar sebasea mengalami kerusakan.
d) Kulit yang terbakar tampak berwarna pucat atau lebih putih karena terbentuk eskar.
e) Secara teoritis tidak dijumpai rasa nyeri, bahkan hilang sensasi karena ujung-ujung serabut saraf sensorik mengalami kerusakan / kematian.
Gambar 2. Potongan Kulit Normal Manusia dan Kedalaman Luka Bakar
(Moenadjat, 2009)
2. 3. 2 Luas Luka Bakar
Luas luka bakar pada dewasa dihitung menggunakan rumus sembilan (Rule of Nine) yang diprovokasi oleh Wallace; didasari atas perhitungan kelipatan 9, dimana 1% luas permukaan tubuh adalah luas telapak tangan penderita. Pada anak-anak menggunakan tabel dari Lund dan Browder yang mengacu pada ukuran bagian tubuh terbesar pada seorang bayi / anak (yaitu kepala) (Moenadjat, 2009).
Gambar 3. Diagram Rule of Nines dari Wallace untuk
Dewasa (Moenadjat, 2009)
Tabel 2.2 Tabel Lund & Browder (untuk anak)
Usia (tahun) 0 1 5 10 15 Dewasa
2. 3. 3 Faktor yang Berperan (Moenadjat, 2009)
2. 3. 4 Patofisiologi Luka Bakar
Hilangnya plasma merupakan penyebab syok hipovolemik pada penderita luka bakar. Jumlah kehilangan cairan tergantung pada luasnya luka bakar (Tiwari, 2012).
Peningkatan permeabilitas kapiler secara sistemik tidak terjadi pada luka lainnya. Hanya terdapat reaksi lokal pada lokasi luka karena inflamasi menyebabkan vasodilatasi progresif persisten dan edema. Syok hipovolemik yang terjadi pada trauma lain biasanya karena kehilangan darah dan membutuhkan transfusi segera (Tiwari, 2012).
Saat terjadi kontak antara sumber panas dengan kulit, tubuh akan merespon untuk mempertahankan homeostasis dengan adanya proses kontraksi, retraksi dan koagulasi pembuluh darah. Jackson pada tahun 1947 mengklasifikasikan 3 zona respon lokal akibat luka bakar yaitu:
a. Zona koagulasi, terdiri dari jaringan nekrosis yang membentuk eskar, yang terbentuk dari koagulasi protein akibat cidera panas, berlokasi ditengah luka bakar, tempat yang langsung mengalami kerusakan dan kontak dengan panas.
b. Zona stasis, daerah yang langsung berada diluar disekitar zona koagulasi. Di daerah ini terjadi kerusakan endotel pembuluh darah disertai kerusakan trombosit dan leukosit, sehingga terjadi gangguan perfusi (no flow phenomena), diikuti perubahan permeabilitas kapiler dan respon inflamasi lokal, yang beresiko terjadinya iskemia jaringan. Zona ini bisa menjadi nekrosis atau hiperemis, menjadi zona hiperemis jika resusitasi yang diberikan adekuat, atau menjadi zona koagulasi jika resusitasi yang diberikan tidak adekuat.
spontan atau berubah menjadi zona statis (Hettiaratchy dan Dziewulski, 2004).
Luka bakar merusak fungsi barier kulit terhadap invasi mikroba serta adanya jaringan nekrotik dan eksudat menjadi media pendukung pertumbuhan mikroorganisme, sehingga beresiko untuk menjadi infeksi. Semakin luas luka bakar, semakin besar resiko infeksi (Hemsley dan Ansermino, 2004). Tidak seperti kebanyakan luka lain, luka bakar biasanya steril pada saat cidera. Panas yang menjadi agen penyebab membunuh semua mikroorganisme pada permukaan. Setelah minggu pertama luka bakar cenderung terinfeksi, sehingga membuat sepsis luka bakar sebagai penyebab utama kematian pada luka bakar. Sedangkan luka lain misalnya luka gigitan, luka tusukan,
crush injury dan ekskoriasi terkontaminasi pada saat terjadi trauma dan jarang menyebabkan sepsis secara sistemik (Tiwari, 2012)
2. 3. 5 Proses Penyembuhan Luka Bakar
maturasi/remodelling yang bertujuan memaksimalkan kekuatan dan integritas struktur dari luka (Gurtner, 2007).
a. Fase inflamasi (lag phase)
Fase inflamasi dimulai segera setelah terjadinya trauma/cidera dan umumnya sampai hari ke-5 pasca trauma. Tujuan utama fase ini pada umumnya adalah hemostasis, hilangnya jaringan yang mati dan pencegahan kolonisasi maupun infeksi oleh agen mikrobial patogen (Gurtner, 2007). Perbedaan antara luka bakar dan luka biasa pada fase ini yaitu pada luka bakar tejadi vasodilatasi lokal dengan ekstravasasi cairan dalam ruang ketiga. Dalam luka bakar yang luas, adanya peningkatan permeabilitas kapiler menyebabkan ekstravasasi plasma yang cukup banyak dan membutuhkan penggantian cairan (Tiwari, 2012).
Pada luka bakar, proses koagulasi akibat panas menyebabkan dilepaskannya faktor kemotaktik seperti kallkireins dan peptida fibrin, sedangkan sel mast melepaskan faktor nekrosis tumor, histamin, protease, leukotriens dan sitokin sehingga terjadi migrasi sel-sel inflamasi. Neutrofil dan monosit merupakan sel pertama yang bermigrasi di lokasi peradangan (Tiwari, 2012).
Berbagai mediator inflamasi yakni prostaglandin,
terjadinya konversi dari luka akut menjadi luka kronis (Regan dan Barbul, 1994; Gurtner, 2007).
Makrofag juga akan mengikuti netrofil menuju luka setelah 48-72 jam dan menjadi sel predominan setelah hari ketiga pasca trauma. Debris dan bakteri akan difagositosis oleh makrofag. Makrofag juga berperan utama memproduksi berbagai growth factor yang dibutuhkan dalam produksi matriks ekstraseluler oleh fibroblas dan pembentukan neovaskularisasi. Keberadaan makrofag oleh karenanya sangat penting dalam fase inflamasi ini (Gurtner, 2007).
Pada luka bakar sel-sel inflamasi diatas membantu dalam fagositosis, pembersihan jaringan yang mati dan racun yang dikeluarkan oleh jaringan yang terbakar. Selain melalui proses fagositosis, netrofil dan makrofag juga berperan dalam eliminasi bakteri dengan cara memproduksi dan melepaskan beberapa proteinase dan reactive oxygen species (ROS). ROS melalui sifat radikal bebasnya penting dalam mencegah infeksi bakterial, namun tingginya kadar ROS secara berkepanjangan juga akan menginduksi kerusakan sel tubuh lainnya. ROS juga mengaktivasi dan mempertahankan kaskade asam arakidonat yang akan memicu ulang timbulnya berbagai mediator inflamasi lagi seperti prostaglandin dan leukotrien, sehingga proses inflamasi akan menjadi berkepanjangan (Lima et al, 2009).
Limfosit dan sel mast merupakan sel terakhir yang bergerak menuju luka dan dapat ditemukan pada hari kelima sampai ketujuh pasca trauma. Peran keduanya masih belum jelas hingga saat ini (Gurtner, 2007).
menyediakan lingkungan yang secara metabolik mendukung proses penyembuhan luka.
b. Fase proliferasi (fibroplasi, regenerasi)
Fase proliferasi berlangsung umumnya mulai hari ke-4. Pada luka bakar superfisial, migrasi keratinosit yang berada pada tepi luka sesungguhnya telah mulai bekerja beberapa jam pasca trauma, menginduksi terjadinya re-epitelisasi yang biasanya menutup luka dalam 5-7 hari. Setelah re-epitelisasi, membran basalis terbentuk antara epidermis dan dermis. Pembentukan kembali dermis dibantu oleh proses angiogenesis dan fibrogenesis. Pada fase ini matriks fibrin yang didominasi oleh platelet dan makrofag secara gradual digantikan oleh jaringan granulasi yang tersusun dari kumpulan fibroblas, makrofag dan sel endotel yang membentuk matriks ekstraseluler dan neovaskuler (Gurtner, 2007).
Fibroblas memiliki peran yang sangat penting dalam fase ini. Fibroblas memproduksi matriks ekstraseluler yang akan mengisi kavitas luka dan menyediakan landasan untuk migrasi keratinosit. Matriks ekstraseluler merupakan komponen yang paling nampak pada skar di kulit. Makrofag memproduksi
(VEGF), fibroblas growth factor (FGF)-2, angiopoietin-1 dan
thrombospondin akan menstimulasi sel endotel membentuk neovaskular melalui proses angiogenesis (Gurtner, 2007).
Pada luka bakar yang dalam untuk mempercepat penyembuhan perlu dilakukan eksisi dan tandur kulit (skin graft). Tindakan penutupan luka dengan skin graft setelah eksisi kulit yang terbakar merupakan bagian dari fase proliferasi pada penyembuhan luka (Tiwari, 2012).
Hal yang menarik dari fase proliferasi ini adalah bahwa pada suatu titik tertentu, seluruh proses yang telah dijabarkan di atas harus dihentikan. Fibroblas akan segera menghilang segera setelah matriks kolagen mengisi kavitas luka dan pembentukan neovaskular akan menurun melalui proses apoptosis. Kegagalan regulasi pada tahap inilah yang hingga saat ini dianggap sebagai penyebab terjadinya kelainan fibrosis seperti skar hipertrofik (Gurtner, 2007).
c. Fase maturasi (remodelling)
Fase maturasi ini di luka pada umumnya berlangsung mulai hari ke-21 hingga sekitar 1 tahun, namun pada luka bakar derajat 2 yang dalam dan yang mengenai seluruh ketebalan kulit yang dibiarkan sembuh sendiri fase ini bisa memanjang menjadi bertahun-tahun (Tiwari, 2012). Fase ini segera dimulai segera setelah kavitas luka terisi oleh jaringan granulasi, proses re-epitelisasi usai, dan setelah kolagen menggantikan matriks temporer (Gurtner, 2007). Pada fase ini terjadi maturasi luka dan graft (Tiwari, 2012).
makrofag dan sel endotel. Sekitar 80% kolagen pada kulit adalah kolagen tipe I yang memungkinkan terjadinya tensile strength pada kulit (Gurtner, 2007).
Keseimbangan antara proses sintesis dan degradasi kolagen terjadi pada fase ini. Kolagen yang berlebihan didegradasi oleh enzim kolagenase dan kemudian diserap. Sisanya akan mengerut sesuai tegangan yang ada. Hasil akhir dari fase ini berupa jaringan parut yang pucat, tipis, lemas dan mudah digerakkan dari dasarnya (Bisono dan Pusponegoro, 1997).
Kolagen awalnya tersusun secara tidak beraturan, sehingga membutuhkan lysyl hydroxylase untuk mengubah lisin menjadi hidroksilisin yang dianggap bertanggung jawab terhadap terjadinya cross-linking antar kolagen. Cross-linking
inilah yang menyebabkan terjadinya tensile strength sehingga luka tidak mudah terkoyak lagi. Tensile strength akan bertambah secara cepat dalam 6 minggu pertama, kemudian akan bertambah perlahan selama 1-2 tahun. Pada umumnya tensile strength pada kulit dan fascia tidak akan pernah mencapai 100%, namun hanya sekitar 80% dari normal (Marzoeki, 1993; Schultz, 2007).
Pada luka bakar derajat 2 dalam dan yang mengenai seluruh ketebalan kulit bila dibiarkan sembuh sendiri dapat terbentuk hipertrofik jaringan parut dan kontraktur. Hiperpigmentasi terjadi pada luka bakar superfisial karena respon berlebihan melanosit dari trauma panas dan hipopigmentasi terjadi pada luka bakar yang dalam karena kerusakan melanosit pada kulit. Pada luka bakar post skin graft
2. 4 Kulit
2. 4. 1 Anatomi Kulit
Kulit adalah organ tubuh terbesar yang membentuk 15% berat badan total (Gibson, 2002). Kulit terdiri dari tiga lapisan yang masing-masing terdiri dari berbagai jenis sel dan memiliki fungsi yang bermacam-macam. Ketiga lapisan tersebut adalah epidermis, dermis, dan subkutis (Wasiatmadja dan Syarif, 2007).
2. 4. 1. 1 Epidermis
Epidermis merupakan lapisan terluar terutama terdiri dari epitel skuamosa bertingkat. Sel-sel yang menyusunnya secara berkesinambungan dibentuk oleh lapisan germinal dalam epitel silindris dan mendatar ketika didorong oleh sel-sel baru ke arah permukaan, tempat kulit terkikis oleh gesekan. Lapisan luar mengandung keratin, protein bertanduk, hanya sedikit darinya pada permukaan tubuh yang terpajan untuk terpakai dan terkikis, seperti pada permukaan dalam lengan, paha dan lebih banyak lagi pada permukaan ektensor, lapisan ini terutama tebal pada kaki (Gibson, 2002). Lapisan ini terdiri atas:
a. Stratum corneum (lapisan tanduk)
Terdiri atas beberapa lapis sel yang pipih, mati, tidak memiliki inti, tidak mengalami proses metabolisme, tidak berwarna dan sangat sedikit mengandung air. Lapisan ini sebagian besar terdiri atas keratin, yaitu jenis protein yang tidak larut dalam air dan sangat resisten terhadap bahan-bahan kimia. Hal ini berkaitan dengan fungsi kulit untuk memproteksi tubuh dari pengaruh luar. b. Stratum lucidum (lapisan jernih)
Berada tepat di bawah stratum corneum. Merupakan lapisan yang tipis, jernih. Lapisan ini tampak jelas pada telapak tangan dan telapak kaki.
c. Stratum granulosum (lapisan berbutir-butir)
d. Stratum spinosum (lapisan malphigi)
Sel berbentuk kubus dan seperti berduri, intinya besar dan oval. Setiap sel berisi filamen-filamen kecil yang terdiri atas serabut protein.
e. Stratum germinativum (lapisan basal)
Adalah lapisan terbawah epidermis. Di lapisan ini juga terdapat sel-sel melanosit yaitu sel yang membentuk pigmen melanin.
2. 4. 1. 2 Dermis
Dermis adalah lapisan yang terdiri dari kolagen, jaringan fibrosa dan elastin. Lapisan superfisial menonjol ke dalam epidermis berupa sejumlah papila kecil. Lapisan yang lebih dalam terletak pada jaringan subkutan. Lapisan ini mengandung pembuluh darah, pembuluh limfe dan syaraf (Gibson, 2002).
2. 4. 1. 3 Subkutis
Lapisan subkutis kulit terletak dibawah dermis. Lapisan ini terdiri dari lemak dan jaringan ikat dan berfungsi sebagai peredam kejut dan insulator panas. Lapisan subkutis adalah tempat penyimpanan kalori. Di lapisan ini terdapat ujung-ujung saraf tepi, pembuluh darah dan saluran getah bening (Wasiatmaja dan Syarif, 2007).
Gambar 4. Anatomi KulitTikus (Krinke, 2000) Keterangan :
1. Epidermis 2. Dermis 3. Folikel Rambut 4. Kelenjar
2. 4. 2 Fisiologi Kulit
2. 4. 2. 1 Proteksi
Kulit merupakan barrier fisik antara jaringan di bawahnya dan lingkungan luar. Kulit memberikan perlindungan dari abrasi, dehidrasi, radiasi ultraviolet, dan invasi mikroorganisme (Gunstream, 2000). Sebagian besar mikroorganisme mengalami kesulitan untuk menembus kulit yang utuh tetapi dapat masuk melalui kulit yang luka dan lecet. Selain proteksi yang diberikan oleh lapisan tanduk, proteksi tambahan diberikan oleh keasaman keringat dan adanya asam lemak dalam sebum, yang menghambat pertumbuhan mikroorganisme (Gibson, 2002).
2. 4. 2. 2 Sensasi
Kulit terdiri dari ujung saraf dan reseptor yang dapat mendeteksi stimulus yang berhubungan dengan sentuhan, tekanan, temperatur dan nyeri. (Gunstream, 2000). Sensasi raba, nyeri, perubahan suhu dan tekanan pada kulit dan jaringan subkutan, ditransmisikan melalui saraf sensorik menuju medula spinalis dan otak(Gibson, 2002).
2. 4. 2. 3 Regulasi Suhu
Selama periode kelebihan produksi panas oleh tubuh, sekresi keringat dan evaporasi melalui permukaan tubuh membantu menurunkan temperatur tubuh (Gunstream, 2000).
2. 4. 2. 4 Penyimpanan
Kulit bekerja sebagai tempat penyimpanan air dan lemak, yang dapatditarik berdasarkan kebutuhan (Gibson, 2002).
2. 4. 2. 5 Ekskresi
2. 4. 2. 6 Sintesis vitamin D
Pajanan terhadap radiasi ultraviolet dapat mengkonversi molekul prekursor (7-dihidroksi kolesterol) dalam kulit menjadi vitamin D. Namun, hal tersebut tidak dapat menyediakan vitamin D secara keseluruhan bagi tubuh, sehingga pemberian vitamin D secara sistemik masih diperlukan (Gunstream, 2000; Wasiatmaja& Syarif, 2007).
2. 5 Metode Ekstraksi dengan Menggunakan Pelarut (DepKes, 2000)
2. 5. 1 Cara Dingin
a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya.
b. Perkolasi
2. 5. 2 Cara Panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3 – 5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40 - 50⁰C.
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96 - 98⁰C) selama waktu tertentu (15 – 20 menit).
e. Dekok
BAB 3
METODE PENELITIAN
3. 1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Mei 2015 hingga Agustus 2015. Pemeliharaan dan perlakuan hewan uji dilakukan di Animal House (MAH) Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta, sedangkan untuk pembuatan preparat histologi dilakukan di Laboratorium Patologi Universitas Indonesia.
3. 2 Alat dan Bahan
3. 2. 1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah timbangan analitik (AND GH-202 dan Wiggen Hauser), beaker glass, batang pengaduk, lumpang, alu, spatula, kapas, tabung reaksi, pipet tetes, oven (Memmert), tanur (Thermo Scientific), waterbath, alumunium foil, timbangan hewan (Ohauss), kandang tikus beserta tempat makanan dan minum, spuit 1 cc, wadah pembiusan, plat besi berukuran 4x2 cm, kaca objek dan penutupnya, cawan penguap, mikroskop cahaya (Olympus SZ61) dan termometer.
3. 2. 2 Bahan Penelitian
Bahan uji yang digunakan dalam penelitian ini adalah ekstrak etanol 96% umbi talas jepang (Colocasia esculenta (L.) Schott var.
antiquorum). Bahan lain yang digunakan dalam penelitian ini adalah akuades, Lanakeloid-E, alcohol swab, HCl 2 M, NaCl, pereaksi (Mayer, Wagner, Dragendorff), amonia 25%, kloroform, HCl, logam Mg, FeCl3, garam gelatin, H2SO4 pekat, NaCl 10%, n-heksan, etanol,
indikator pH universal, Na2SO4 anhidrat, asam asetat anhidrat cairan
injeksi ketamin 50 mg/ml, asam stearat, trietanolamin, adeps lanae, parafin liquidum, nipagin, nipasol, larutan formaldehid 10% dan
3. 2. 3 Hewan Uji
Hewan uji yang akan digunakan dalam penelitian ini adalah tikus putih jantan galur Sprague Dawley yang sehat berumur 2 – 3 bulan dengan berat badan 100 – 150 gram yang diperoleh dari Fakultas Kedokteran Hewan Institut Pertanian Bogor.
3. 3 Rancangan Penelitian
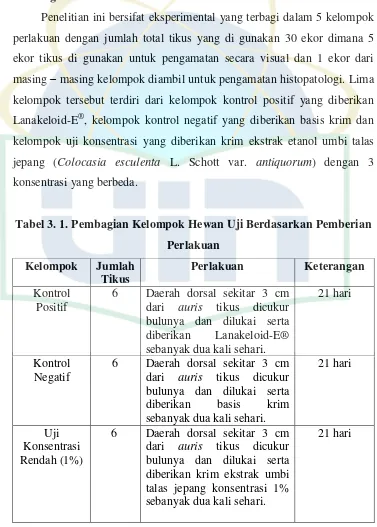
Penelitian ini bersifat eksperimental yang terbagi dalam 5 kelompok perlakuan dengan jumlah total tikus yang di gunakan 30 ekor dimana 5 ekor tikus di gunakan untuk pengamatan secara visual dan 1 ekor dari masing – masing kelompok diambil untuk pengamatan histopatologi. Lima kelompok tersebut terdiri dari kelompok kontrol positif yang diberikan Lanakeloid-E®, kelompok kontrol negatif yang diberikan basis krim dan kelompok uji konsentrasi yang diberikan krim ekstrak etanol umbi talas jepang (Colocasia esculenta L. Schott var. antiquorum) dengan 3 konsentrasi yang berbeda.
Tabel 3. 1. Pembagian Kelompok Hewan Uji Berdasarkan Pemberian
Perlakuan diberikan basis krim sebanyak dua kali sehari. diberikan krim ekstrak umbi talas jepang konsentrasi 1% sebanyak dua kali sehari.
Kelompok Jumlah diberikan krim ekstrak umbi talas jepang konsentrasi 5% diberikan krim ekstrak umbi talas jepang konsentrasi 25% sebanyak dua kali sehari.
21 hari
3. 4 Kegiatan Penelitian
3. 4. 1 Pemeriksaan Simplisia (Determinasi)
Sebelum dilakukan penelitian, Colocasia esculenta (L.) Schott var. antiquorum terlebih dahulu di determinasi di Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor untuk memastikan kebenaran simplisia.
3. 4. 2 Penyiapan Simplisia
Umbi talas jepang (Colocasia esculenta (L.) Schott var. antiquorum) diperoleh dari CV. Agro Lawu International, Magetan, Jawa Timur. Selanjutnya sortasi basah, pencucian, perajangan, pengeringan, sortasi kering dan penyerbukan umbi talas jepang dilakukan di Balai Tanaman Obat dan Aromatik (BALITTRO). Serbuk simplisia disimpan dalam wadah yang kering, tertutup rapat dan terlindung dari cahaya.
3. 4. 3 Pembuatan Ekstrak
maserasi dilakukan hingga larutan mendekati tidak berwarna. Filtrat yang diperoleh dipekatkan dengan menggunakan vacuum rotary evaporator sampai diperoleh ekstrak kental. Ekstrak kental yang dihasilkan kemudian ditimbang dan dicatat beratnya dan selanjutnya disimpan dalam lemari pendingin atau freezer dan digunakan untuk perlakuan.
3. 4. 4 Skrining Fitokimia Ekstrak
a. Identifikasi Alkaloid
b. Identifikasi Flavonoid
Sebanyak 3 g sampel diuapkan, dicuci dengan n-heksan sampai jernih. Residu dilarutkan dalam 20 ml etanol kemudian di saring. Filtrat dibagi 4 bagian A, B, dan C. Filtrat A sebagai blangko, filtrat B ditambahkan 0,5 ml HCl pekat kemudian dipanaskan pada waterbath, jika terjadi perubahan warna merah tua sampai ungu menunjukkan hasil yang positif (metode Bate Smith-Metchalf). Filtrat C ditambahkan 0,5 ml HCl dan 0,5 mg logam Mg kemudian diamati perubahan warna yang terjadi (metode Wilstater). Warna merah sampai jingga diberikan oleh senyawa flavon, warna merah tua diberikan oleh flavonol atau flavonon, warna hijau sampai biru diberikan oleh aglikon atau glikosida (Marliana et al, 2005).
c. Identifikasi Saponin
Uji Saponin dilakukan dengan metode Forth yaitu dengan cara memasukkan 2 ml sampel ke dalam tabung reaksi kemudian ditambahkan 10 ml akuades lalu dikocok selama 30 detik, diamati perubahan yang terjadi. Apabila terbentuk busa yang mantap (tidak hilang selama 30 detik) maka identifikasi menunjukkan adanya saponin. Uji penegasan saponin dilakukan dengan menguapkan sampel sampai kering kemudian mencucinya dengan n-heksan sampai filtrat jernih. Residu yang tertinggal ditambahkan 1 ml kloroform, diaduk 5 menit, kemudian ditambahkan 1 ml Na2SO4 anhidrat dan disaring.
Filtrat dibagi menjadi menjadi 2 bagian, A dan B. Filtrat A sebagai blangko, filtrat B ditetesi anhidrat asetat sebanyak 5 tetes, diaduk perlahan, kemudian ditambah 1 ml H2SO4 pekat
d. Identifikasi Terpenoid
Sebanyak 3 gram ekstrak dicampurkan dengan 2 ml kloroform.
Kemudian ditambahkan 3 ml H2SO4 pekat dengan hati-hati.
Terbentuknya warna coklat kemerahan pada antarmuka dalam
larutan, menunjukkan adanya terpenoid (Edeoga et al, 2005).
e. Identifikasi Steroid
Sebanyak 0,5 gram ekstrak ditambahkan 2 ml asam asetat
anhidrat. Kemudian ditambahkan 2 ml H2SO4 pekat. Adanya
steroid ditandai dengan perubahan warna dari violet menjadi
biru atau hijau (Edeoga et al, 2005)
f. Identifikasi Tanin dan Polifenol
Sebanyak 3 g sampel diekstraksi dengan akuades panas kemudian didinginkan. Setelah itu ditambahkan 5 tetes NaCl 10% dan disaring. Filtrat dibagi 3 bagian A, B, dan C. Filtrat A digunakan sebagai blangko, ke dalam filtrat B ditambahkan 3 tetes pereaksi FeCl3, dan ke dalam filtrat C ditambah 3 ml garam
gelatin. Kemudian diamati perubahan yang terjadi (Marliana et al, 2005).
g. Identifikasi Glikosida Jantung
Uji glikosida jantung dilakukan dengan metode Keller Kelliani yaitu sebanyak 1 g ekstrak dicuci dengan n-heksan hingga jernih. Residu yang tertinggal dipanaskan diatas waterbath
kemudian ditambahkan 3 ml pereaksi FeCl3 dan 1 ml H2SO4
3. 4. 5 Pengujian Parameter Spesifik dan Non Spesifik
3. 4. 5. 1 Parameter Spesifik
1. Identitas
Deskripsi tata nama a. Nama ekstrak
b. Nama lain tumbuhan (sistematika botani)
c. Bagian tumbuhan yang digunakan (rimpang, daun, dsb) d. Nama Indonesia tumbuhan
2. Organoleptik
a. Bentuk : padat, serbuk-kering, kental, cair. b. Warna : kuning, coklat, dll.
c. Bau : aromatik, tidak berbau, dll. d. Rasa : pahit, manis, kelat, dll.
3. 4. 5. 2 Parameter Non Spesifik
1. Penetapan Kadar Air
Sejumlah 1 gram ekstrak ditimbang dalam botol timbang bertutup yang sebelumnya telah dipanaskan pada suhu 105C selama 30 menit dan telah ditara. Ekstrak dikeringkan dengan tutup terbuka pada suhu 105C selama 5 jam dan ditimbang. Kemudian botol timbang dalam keadaan tertutup dibiarkan dan mendingin dalam desikator hingga suhu kamar, bobot yang diperoleh dicatat. Pengeringan dilanjutkan dan ditimbang pada jarak 1 jam sampai bobot tetap. Kemudian dicatat bobot tetap yang diperoleh untuk menghitung kadar air (Depkes RI, 2000). Kadar air
x 100%
Keterangan :
W0 = Bobot wadah kosong yang telah ditara
W1 = Bobot ekstrak + wadah sebelum pemanasan
2. Penetapan Kadar Abu Total
Sebanyak 1 gram ekstrak ditimbang seksama (W1) dimasukkan dalam krus silikat yang sebelumnya telah dipijarkan dan ditimbang (W0). Setelah itu ekstrak dipijar dengan menggunakan tanur secara perlahan-lahan (dengan suhu dinaikkan secara bertahap hingga 600 ± 25C) (Depkes RI, 1980 dalam Arifin et al, 2006) hingga arang habis. Kemudian ditimbang hingga bobot tetap (W2).
Kadar Abu Total
x 100%
Keterangan :
W0 = bobot cawan kosong (gram)
W1 = bobot ekstrak awal (gram)
W2 = bobot cawan + ekstrak setelah diabukan (gram)
3. 4. 6 Pembuatan Krim Ekstrak Etanol Umbi Talas Jepang
Tabel 3.2 Formula Basis Krim (Wijaya dkk, 2013)
Bahan Jumlah
Asam stearat 14,5 gram
Trietanolamin 1,5 ml
Adeps lanae 3 gram
Paraffin liquidum 5 ml
Nipagin 0,10 gram
Nipasol 0,05 gram
Akuades 100 ml
Basis krim dibuat dengan cara: semua bahan yang diperlukan ditimbang, kemudian fase minyak dipindahkan dalam cawan penguap, dipanaskan diatas waterbath dengan suhu 70C sampai lebur. Fase air
dipanaskan di atas waterbath pada suhu 70C sampai lebur. Fase
3. 4. 7 Evaluasi Sediaan Krim
3. 4. 7. 1 Uji Organoleptik
Pemeriksaan organoleptik sediaan krim yang diamati secara visual meliputi bentuk, warna dan bau krim. Uji organoleptik dilakukan untuk mengetahui krim yang dibuat sesuai dengan warna dan bau ekstrak yang digunakan.
3. 4. 7. 2 Uji Homogenitas
Pemeriksaan homogenitas dilakukan dengan cara sebanyak 1 gram sediaan krim ditimbang dan kemudian dioleskan di atas kaca objek dan ditutup rapat dengan kaca objek lain, selanjutnya homogenitas krim diamati. Krim harus menunjukkan susunan yang homogen dan tidak terlihat adanya butir-butir halus.
3. 4. 8 Persiapan Hewan Uji
Hewan uji yang di gunakan adalah tikus putih jantan Sprague-Dawley berumur 2-3 bulan dengan berat badan 100-150 gram di adaptasi selama satu minggu agar dapat menyesuaikan dengan lingkungannya. Selama proses adaptasi, dilakukan pengamatan kondisi umum dan penimbangan berat badan.
3. 4. 9 Pembuatan Luka Bakar (Akhoondinasab et al, 2014)
Luka bakar dibuat dibagian punggung tikus sekitar 3 cm dibawah telinga yang telah dicukur bulunya menggunakan Veet® dengan menggunakan plat besi berukuran 4x2 cm selama 10 detik yang telah dipanaskan dalam air mendidih selama 5 menit.
3. 4. 10 Eksisi Jaringan Kulit Tikus
bulu yang mulai tumbuh kembali, jaringan kulit diambil dengan ketebalan ± 3 mm hingga lapisan subkutis dan sekitar 2 cm dari tepi luka. Jaringan kulit yang diperoleh kemudian difiksasi dengan larutan formalin 10% dan disimpan.
3. 4. 11 Pembuatan Preparat Histopatologi Jaringan Kulit Tikus
Jaringan kulit yang diperoleh kemudian dibuat preparat histopatologi dengan pewarna Hematoxylin-Eosin yang dilakukan di Laboratorium Patologi Fakultas Kedokteran Universitas Indonesia. Pembuatan preparat dilakukan dengan cara: jaringan kulit yang telah difiksasi menggunakan larutan formalin 10% lalu dilakukan trimming
3. 4. 12 Pengamatan Preparat Histopatologi
Pengamatan secara histopatologi dilakukan pada preparat jaringan kulit. Pengamatan dilakukan menggunakan mikroskop cahaya secara deskriptif. Pengamatan ini meliputi parameter-parameter yang berperan dalam penyembuhan luka seperti keberadaan sel radang dan makrofag, serta neokapilerisasi.
3. 4. 13 Analisis Statistik
Data hasil pengujian dianalisis menggunakan software pengolah data dan disajikan dalam bentuk mean dan standar deviasi dari masing-masing kelompok. Data dianalisis dengan uji One-Way ANOVA dan uji
BAB 4
HASIL DAN PEMBAHASAN
4. 1 Hasil Penelitian
4. 1. 1 Determinasi Tanaman
Determinasi tanaman dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi LIPI, Bogor, Jawa Barat. Hasil determinasi menyatakan bahwa tanaman yang digunakan sebagai sampel adalah tanaman talas jepang (Colocasia esculenta (L.) Schott) famili Araceae.
4. 1. 2 Ekstraksi
Sebanyak 1,5 kg serbuk umbi talas jepang (Colocasia esculenta
(L.) Schott var. antiquorum) dimaserasi dengan pelarut etanol 96% sampai larutan mendekati tidak berwarna. Filtrat yang diperoleh kemudian dipekatkan dengan vacuum rotary evaporator dan diperoleh ekstrak kental sejumlah 168,859 gram. Rendemen yang diperoleh sebesar 11,257%.
4. 1. 3 Hasil Penapisan Fitokimia
Tabel 4.1 Hasil Penapisan Fitokimia Ekstrak Etanol Umbi Talas
Jepang
Identifikasi Golongan Senyawa Hasil Penapisan Fitokimia
Keterangan : (+) memberikan hasil positif. (-) memberikan hasil negatif.
4. 1. 4 Hasil Penentuan Parameter Spesifik dan Non Spesifik
Uji parameter spesifik dan non spesifik pada ekstrak etanol umbi talas jepang (Colocasia esculenta (L.) Schott var. antiquorum) dilakukan setelah uji penapisan fitokimia. Hasil uji parameter spesifik dan non spesifik terhadap ekstrak etanol umbi talas jepang dapat dilihat pada tabel 4.2.
Tabel 4.2 Hasil Penentuan Parameter Spesifik dan Non Spesifik
Karakteristik Hasil
Uji Parameter Spesifik
Identitas
4. 1. 5 Hasil Evaluasi Sediaan Krim
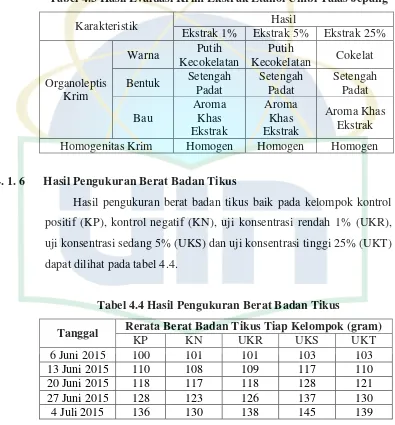
Evaluasi krim ekstrak etanol umbi talas jepang (Colocasia esculenta (L.) Schott var. antiquorum) meliputi uji organoleptik dan uji homogenitas. Hasil evaluasi krim ekstrak etanol umbi talas jepang dapat dilihat pada tabel 4.3.
Tabel 4.3 Hasil Evaluasi Krim Ekstrak Etanol Umbi Talas Jepang
Karakteristik Hasil Homogenitas Krim Homogen Homogen Homogen
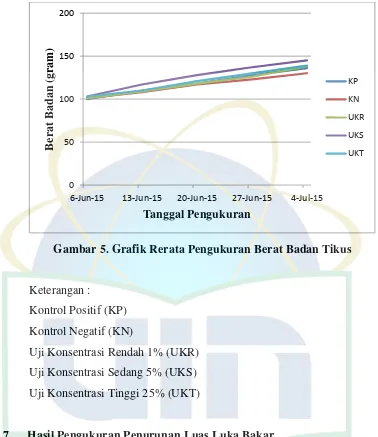
4. 1. 6 Hasil Pengukuran Berat Badan Tikus
Hasil pengukuran berat badan tikus baik pada kelompok kontrol positif (KP), kontrol negatif (KN), uji konsentrasi rendah 1% (UKR), uji konsentrasi sedang 5% (UKS) dan uji konsentrasi tinggi 25% (UKT) dapat dilihat pada tabel 4.4.
Tabel 4.4 Hasil Pengukuran Berat Badan Tikus
Tanggal Rerata Berat Badan Tikus Tiap Kelompok (gram)
Gambar 5. Grafik Rerata Pengukuran Berat Badan Tikus
Keterangan :
Kontrol Positif (KP) Kontrol Negatif (KN)
Uji Konsentrasi Rendah 1% (UKR) Uji Konsentrasi Sedang 5% (UKS) Uji Konsentrasi Tinggi 25% (UKT)
4. 1. 7 Hasil Pengukuran Penurunan Luas Luka Bakar
Hasil pengukuran penurunan luas luka bakar pada kelompok kontrol positif, kelompok kontrol negatif, kelompok uji konsentrasi rendah, kelompok uji konsentrasi sedang dan kelompok uji konsentrasi tinggi pada hari ke-1 hingga hari ke-21 menggunakan metode perlukaan Akhoondinasab dapat dilihat pada tabel 4.5.
Tabel 4.5 Rerata Penurunan Luas Luka Bakar & Persentase
Data luas luka bakar yang diperoleh menggunakan software ImageJ kemudian diolah secara statistik dengan menggunakan uji
Paired-Samples T Test. Penurunan luas luka bakar pada kelompok kontrol positif, kelompok kontrol negatif, kelompok uji konsentrasi rendah, kelompok uji konsentrasi sedang dan kelompok uji konsentrasi tinggi berbeda secara signifikan (p<0,05) dari hari 1 sampai hari ke-21. Hal ini menunjukkan bahwa terdapat adanya proses penyembuhan pada semua kelompok tikus terhadap luas luka bakar.
uji konsentrasi). Hal ini menunjukkan bahwa ekstrak etanol umbi talas jepang pada semua kelompok uji konsentrasi memiliki aktivitas terhadap penurunan luas luka bakar derajat dua dibandingkan dengan kelompok kontrol positif dan kontrol negatif tetapi tidak berbeda signifikan.
Gambar 6. Grafik Rerata Persentase Penyembuhan Luka Bakar
Keterangan : KP (Kontrol Positif), KN (Kontrol Negatif), UKR (Uji Konsentrasi Rendah), UKS (Uji Konsentrasi Sedang), UKT (Uji
Konsentrasi Tinggi)
4. 1. 8 Hasil Pengamatan Fisiologis Luka Bakar Derajat Dua
Tabel 4.6 Hasil Pengamatan Visual Rerata Fisiologis Luka Bakar Derajat Dua
Berdasarkan tabel 4.6 dapat diamati bahwa kelompok kontrol negatif mengalami proses penyembuhan yang lebih lama jika dilihat dari perubahan warna luka bakar derajat dua, waktu terbentuknya keropeng (scab) dan waktu lepasnya keropeng (scab). Hal ini menunjukkan bahwa pemberian basis krim saja tidak mempengaruhi percepatan penyembuhan luka, sehingga dapat dikatakan kelompok kontrol negatif mengalami proses penyembuhan luka secara normal.
4. 1. 7 Hasil Pengukuran Ketebalan Epitel Preparat Pada Hari Ke-7
Hasil pengukuran ketebalan epitel pada preparat histopatologi menggunakan software mikroskop cahaya (Olympus SZ61) pada kelompok kontrol positif, kelompok kontrol negatif, kelompok uji konsentrasi rendah, kelompok uji konsentrasi sedang dan kelompok uji konsentrasi tinggi terhadap jaringan luka pada hari ke-7 dengan 5 lapang pandang dapat dilihat pada gambar 7.
Gambar 7. Grafik Rerata Ketebalan Epitel Pada Preparat
Keterangan : KP (Kontrol Positif), KN (Kontrol Negatif), UKR (Uji Konsentrasi Rendah), UKS (Uji Konsentrasi Sedang), UKT (Uji
Data yang diperoleh kemudian diolah secara statistik dengan menggunakan uji One-Way ANOVA. Dilihat dari hasil statistik data bersifat homogen (p>0,05), terdistribusi normal dan tidak terdapat perbedaan yang signifikan pada kelompok kontrol positif, kontrol negatif dan ketiga kelompok uji konsentrasi. Hal ini menunjukkan bahwa pemberian ekstrak etanol umbi talas jepang dengan konsentrasi 1% dan 25% dapat membantu pertumbuhan re-epitelisasi dengan ketebalan rerata 28,49 µm dan 28,70 µm dibandingkan kelompok kontrol positif (27,47 µm) dan kontrol negatif (21,16 µm).
4. 1. 8 Hasil Pengamatan Preparat Histopatologi
A
A
A
Kelompok Perbesaran
100x 200x 400x
Kontrol Positif
Kontrol Negatif Uji Konsentrasi
Rendah (1%)
Uji Konsentrasi Sedang (5%)
Uji Konsentrasi Tinggi (25%)
Gambar 8. Hasil Pengamatan Preparat Histopatologi Hari Ke-7
Keterangan : Nekrosis pada epidermis (A), infiltrasi sel radang dan makrofag (B), neokapilerisasi (C).
Hasil penilaian parameter pada pengamatan preparat histopatologi pada hari ke-7 yang dilakukan menggunakan mikroskop cahaya (Olympus SZ61) dapat dilihat pada tabel 4.7.
B
C
A
A
B B
B B
C C C
Tabel 4.7. Hasil Penilaian Parameter Pada Preparat Hari Ke-7
Keterangan : (+) terdapat nekrosis dan sedikit infiltrasi sel radang, makrofag (<20) dan neokapilerisasi.
(++) terdapat banyak infiltrasi sel radang dan makrofag (20-40). (+++) terdapat lebih banyak infiltrasi sel radang dan makrofag (>40). (-) tidak terdapat nekrosis dan infiltrasi sel radang, makrofag dan neokapilerisasi.
4. 2 Pembahasan
Pada penelitian ini uji aktivitas penyembuhan luka bakar didasarkan pada penurunan luas luka bakar, persentase penyembuhan luka bakar dan parameter histopatologi. Adapun parameter histopatologi yang diamati meliputi keberadaan sel radang, neokapilerisasi serta ketebalan epitel.
Talas jepang (Colocasia esculenta (L.) Schott var. antiquorum) sedang gencar dibudidayakan diberbagai daerah di Indonesia karena potensi pasar ekspor untuk talas ini sangat besar, terutama di negara Jepang yang setengah dari jumlah penduduknya mengkonsumsi talas satoimo sebagai makanan pokok (Pudjiatmoko, 2008). Wadankar et al (2011) melaporkan bahwa ekstrak daun Colocasia esculenta (L.) Schott dapat digunakan sebagai salah satu pengobatan tradisional untuk menyembuhkan luka di daerah Maharashtra (India). Wijaya dkk (2014) juga melaporkan bahwa ekstrak etanol tangkai daun talas dapat dijadikan sebagai alternatif obat luka pada kulit kelinci. Bagian tanaman yang digunakan dalam penelitian ini adalah umbi talas jepang yang diperoleh dari CV. Agro Lawu International, Magetan, Jawa Timur yang telah dideterminasi untuk memastikan kebenaran jenis tanaman yaitu Colocasia esculenta (L.) Schott dari famili Araceae.
Iswanti (2009) menjelaskan bahwa pelarut etanol dapat menyari hampir keseluruhan kandungan simplisia, baik polar, semi polar maupun non polar, sehingga diharapkan dapat menarik kandungan berbagai senyawa pada sampel yang diprediksi berkhasiat dalam penyembuhan luka. Pelarut etanol 96% dipilih karena tidak banyak mengandung kadar air sehingga ekstrak yang dihasilkan lebih kental dan murni. Selain itu konstanta dielektrik etanol 96% adalah 24,3 dimana semakin tinggi konstanta dielektrikum suatu pelarut akan semakin baik pula kemampuannya dalam menarik senyawa-senyawa aktif dari sampel.
Filtrat hasil maserasi diuapkan menggunakan vacuum rotary evaporator dengan tujuan untuk menghilangkan pelarut sehingga didapatkan ekstrak kental, kemudian ekstrak kental yang diperoleh dikeringkan dalam oven vacuum dengan suhu 40⁰C dan tekanan 17 mmHg selama 9 hari untuk mengurangi kadar air dan residu pelarut pada ekstrak. Dari 1,5 kg serbuk umbi talas jepang diperoleh 168,859 gram ekstrak kental. Rendemen yang diperoleh adalah 11,257%.
Uji kadar air bertujuan untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air dalam bahan (Depkes RI, 2000). Uji kadar air ekstrak etanol umbi talas jepang dilakukan dengan metode gravimetri dan diperoleh hasil kadar air sebesar 17,105%. Hasil ini sesuai dengan persyaratan batas kadar air untuk ekstrak kental adalah antara 5-30%. Penentuan kadar air juga terkait dengan kemurnian ekstrak. Semakin sedikit kadar air pada ekstrak maka semakin sedikit kemungkinan ekstrak terkontaminasi oleh pertumbuhan jamur (Saifudin et al, 2011 dalam Haryani et al, 2013).
Kemudian dilakukan skrining fitokimia pada ekstrak etanol umbi talas jepang. Hasil skrining fitokimia menunjukkan bahwa ekstrak etanol umbi talas jepang mengandung alkaloid, flavonoid, saponin, terpenoid, steroid, tanin, polifenol dan glikosida jantung. Senyawa-senyawa tersebut berperan dalam menyembuhkan luka. Selain itu, hal ini sesuai dengan penelitian sebelumnya oleh Subhash et al (2012) yang menggunakan ekstrak umbi Colocasia esculenta dengan enam pelarut berbeda (petroleum eter, benzen, kloroform, methanol, etanol dan air) diketahui positif mengandung alkaloid, steroid, flavonoid, tanin, fenol, triterpenoid, saponin dan glikosida.