UIN SYARIF HIDAYATULLAH JAKARTA
FORMULASI DAN EVALUASI FISIK MIKROEMULSI
YANG MENGANDUNG EKSTRAK UMBI TALAS
JEPANG (
Colocasia esculenta
(L.) Schott
var antiquorum
)
SEBAGAI
ANTI-AGING
.
SKRIPSI
ATHIYAH
1111102000031
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
FORMULASI DAN EVALUASI FISIK MIKROEMULSI
EKSTRAK UMBI TALAS JEPANG (
Colocasia esculenta
(L.) Schott
var antiquorum
) SEBAGAI
ANTI-AGING
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ATHIYAH
1111102000031
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Athiyah
NIM : 1111102000031
Tanda Tangan : :
Nama : Athiyah
NIM : 1111102000031
Program Studi : Farmasi
Judul : Formulasi dan Evaluasi Fisik Mikroemulsi Ekstrak Umbi Talas Jepang (Colocasia esculenta (L.) Schott var antiquorum) sebagai
Anti-Aging
Disetujui Oleh:
Pembimbing II
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Skripsi ini diajukan oleh:
Nama : Athiyah
NIM : 1111102000031
Program Studi : Strata-1- Farmasi
Judul Skrips : Formulasi dan Evaluasi Fisik Mikroemulsi Ekstrak Umbi Talas Jepang (Colocasia esculenta (L.) Schott var antiquorum) sebagai Anti-Aging
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing I : Dr. Azrifitria, M.Si., Apt. ( )
Pembimbing II : Afriani Rahma, M.Farm., Apt. ( )
Penguji I : Yuni Anggraeni, M.Farm.,Apt. ( )
Penguji II : Ismiarni Komala, M.Sc., Ph.D., Apt. ( )
Ditetapkan di : Jakarta
Program Studi : Strata-1- Farmasi
Judul Skripsi : Formulasi dan Evaluasi Fisik Mikroemulsi Ekstrak Umbi Talas Jepang (Colocasia esculenta (L.) Schott var antiquorum) sebagai
Anti-Aging.
Umbi Talas Jepang merupakan salah satu tanaman yang berpotensi sebagai
anti-aging. Umbi talas jepang megandung senyawa polifenol, vitamin C, vitamin A, monogliserida, besi, tarin dan saponin yang berperan dalam menghambat dan memperlambat proses penuaan. Pada penelitian ini dilakukan pengembangan formulasi berupa mikroemulsi ekstrak umbi talas jepang untuk meningkatkan kemampuan penetrasi ke dalam kulit. Pembuatan mikoemulsi dilakukan menggunakan kombinasi surfaktan tween 80 dan span 80 serta variasi jenis kosurfaktan (propilen glikol, gliserin, etanol, dan polietilen glikol 400) denganberbagaikonsentrasi. Kemudiandihasilkanmikroemulsidengankomposisi 15% tween 80, 23% span 80, 5% polietilen glikol 400, 48,5% minyak zaitun, 0,5% vitamin E, 3% ekstrak umbi talas jepang, dan 5% akuades dengan kecepatan pengadukan ±750 rpm, suhu 31-35 ⁰C selama 30 menit. Hasil evaluasi fisik mikroemulsi menunjukan nilai pH 5,875, nilai viskositas 364 cP dengan tipe aliran Newton, tipe air dalam minyak (a/m), bobot jenis 0,959 g/ml, dan stabil pada suhu ruang (25 ± 2 ⁰C) dan suhu rendah (4 ± 2 ⁰C).
Program Study : Pharmacy
Title : Formulation and Physical Evaluation of microemulsion of Japanese Taro Tuber Extract (Colocasia esculenta (L.) Schott var antiquorum) as an Anti-Aging agent
Japanese taro tuber is a plant that has potential as an anti-aging angent. Japanese taro tuber consistst of polyphenol compounds, vitamin C, vitamin A, monoglycerides, iron, tarin and saponins that play a role in inhibiting and slowing the aging process. In this research, the development of a microemulsion formulation of the Japanese taro root extract is to increase the ability to penetrate the skin. Microemultion is made by using a combination of surfactants, which are tween 80 and span 80 as well as variations in the type of cosurfactant (propylene glycol, glycerin, ethanol, and polyethylene glycol 400) with various concentrations. The result of the obtained microemulsion had a composition of 15% tween 80, 23% span 80, 5% polyethylene glycol 400, 48.5% olive oil, 0.5% vitamine E, 3% taro root extract, and 5% distilled water with stirring speed at±750 rpm, temperature at 31-35 ⁰C for 30 minutes. Microemulsion physical evaluation results showed that the value of pH was 5.875, viscosity value was 364 cP with the Newton flow type, thewater-in-oil (a / m) type , the specific gravity was 0.959 g / ml, and showed stability at room temperature (25 ± 2 ⁰C) and low temperature ( 4 ± 2 ⁰C).
Puji syukur saya panjatkan kepada Allah SWT, karena atas berkat dan
rahmat-Nya, saya dapat menyelesaikan skripsi saya yang berjudul “Formulasi
dan Evaluasi Fisik Mikroemulsi Ekstrak Umbi Talas Jepang (Colocasia
esculenta (L.) Schott var antiquorum) Sebagai Anti-Aging”. Penulisan skripsi
ini dilakukan dalam rangka memenuhi salah satu syarat untk mencapai gelar
Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam
Negeri (UIN) Syarif Hidayatullah Jakarta.
Saya menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak,
dari masa perkuliahan sampai pada penyusunan skripsi ini. Oleh karena itu, saya
mengucapkan terimakasih kepada:
1. Ibu Dr. Azrifitria, M.Si., Apt. dan IbuAfriani Rahma, M.Si., Apt. sebagai
Pembimbing yang telah bersedia memberikan ilmu, waktu, tenaga,
nasehat, serta arahan selama penelitian dan penulisan skripsi ini.
2. Bapak Yardi, Ph.D., Apt danIbuNelly Suryani, M.Si., Ph.D., Apt.sebagai
ketua dansekretarisProgram Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan.
3. Bapak Dr. Arief Sumantri, SKM, M.Kes selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
4. Ibu Puteri Amelia M.Farm., Apt.sebagai pembimbing akademik yang telah
membimbing dan memberikan dukungan dalam menghadapi
permasalahan-permasalahan akademik.
5. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan
bimbingan dan bantuan selamamenempuh pendidikan di Program Studi
Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam
Negeri (UIN) Syarif Hidayatullah Jakarta.
6. Kedua orangtua tercinta Ayahanda Abu Yazid dan Almarhumah Ibunda
Siti Barkah,serta adik-adiktersayangHafiz, Qanita, dan Sami dankeluarga
besar yang selalu ikhlas tanpa pamrih memberikan kasih sayang,
rintangan bersama dan tempat berbagi keluh kesah.
8. Sahabat-sahabat tercinta, Laila, Elsa, Annisa, Tiara, Silvia, Karimah,
Sheila, Arini, Puput, Sheila, Meryza, dan teman-teman Farmasi ABCD
yang telah menjadi keluarga kedua yang telah menghabiskan waktu susah
senang bersama.
9. Laboran-laboran yang telah membantu dalam kelancaran penelitian ini
Kak Eris, Kak Lisna, Kak Rani, Kak Tiwi,dan Kak Rahmadi.
10.Semua pihak yang telah membantu penulis selama melakukan penelitian
dan penulisan yang tidak dapat disebutkan satu per satu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah
SWT. Penulis menyadari bahwa masih banyak kekurangan dalam penulisan ini,
oleh karena itu kritik dan saran sangat diharapkan demi perbaikan skripsi ini. Dan
semoga skripsi ini bisa bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 8 Juli 2015
Sebagai sivitas akademik Universitas Islma Negeri (UIN) Syarif Hidayatullah
Jakarta, Saya yang bertanda tangan di bawah ini:
Nama : Athiyah
NIM : 1111102000031
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK)
Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya
dengan judul:
FORMULASI DAN EVALUASI FISIK MIKROEMULSI EKSTRAK UMBI
TALAS JEPANG (Colocasiaesculenta (L.) Schott varantiquorum) SEBAGAI
ANTI-AGING
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Jakarta
Pada Tanggal : 8 Juli 2015
Yang menyatakan,
(Athiyah)
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
LEMBAR PENGESAHAN SKRIPSI ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... ix
DAFTAR ISI ... x
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
BAB 2. TINJAUAN PUSTAKA ... 4
2.1 TanamanTalasJepang ... 4
2.1.1 Taksonomi ... 4
2.1.2 Kandungan Kimia ... 4
2.2 Kulit ... 5
2.4.1Teori Proses Penuaan ... 11
2.4.2 Proses PenuaanpadaKulit ... 12
2.4.3Faktor-Faktor yang MempengaruhiPenuaanKulit ... 13
2.5Antioksidan ... 14
2.7.4 Poletilen Glikol 400 (PEG 400) ... 19
2.7.5Vitamin E ... 19
BAB 3. METODOLOGI PENELITIAN ... 21
3.1 Lokasi dan Waktu Penelitian ... 21
3.2 Alat dan Bahan ... 21
3.2.1 Alat ... 21
3.2.2 Bahan ... 21
3.3.2.2Karakterisasispesifik ... 23
3.3.2.3UjiKelarutan ... 23
3.3.3 MetodeEkstraksi ... 22
3.3.4PenapisanFitokimia ... 23
3.3.5Penetapan Kadar Polifenol Total... 24
3.3.5.1PembuatanLarutanIndukAsamGalat ... 24
3.3.5.2 Penetapan PanjangGelombangMaksimum... 24
3.3.5.3PembuatanKurvaStandar ... 25
3.3.5.4Penentuan Kadar Total SenyawaPolifenol ... 25
3.3.6UjiAntioksidandenganMetode DPPH ... 26
BAB 4. HASIL DAN PEMBAHASAN ... 30
4.1DeterminasiTanaman ... 30
4.2Karakterisasi ... 30
4.3PenapisanFitokimia ... 32
4.4Penetapan Kadar Total Polifenol ... 34
4.5UjiAntioksidandenganMetode DPPH ... 37
4.6FormulasiMikroemulsi ... 38
4.7EvaluasiFisikMikroemulsi ... 46
4.7.1PemeriksaanOrganoleptik ... 46
4.7.2 Uji pH ... 47
4.7.3 Uji Viskositas ... 47
4.7.4PenentuanTipeMikroemulsi ... 48
4.7.5PengukuranBobotJenis ... 49
4.7.6 Uji Sentrifugasi ... 49
4.7.7Cycling Test ... 49
4.7.8UjiStabilitas ... 50
BAB 5. PENUTUP ... 54
Tabel 2.1 PerbedaanAntara Penuaan Intrinsik dan Ekstrinsik ... 13
Tabel 3.1 Formula Mikroemulsi Ekstrak Umbi Talas Jepang ... 27
Tabel 4.1 Hasil Karakterisasi Ekstrak Umbi Talas Jepang ... 31
Tabel 4.2 Hasil Penapisan Fitokimia Ekstrak Umbi Talas Jepang ... 33
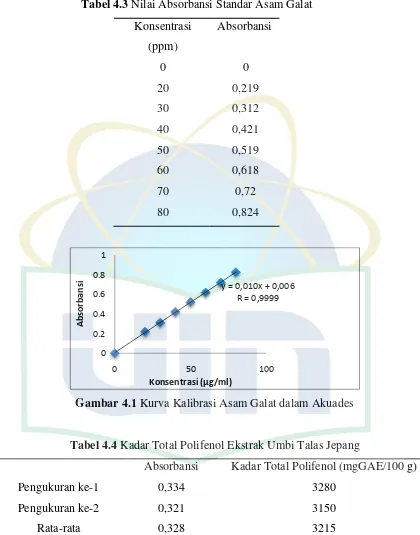
Tabel 4.3 Nilai Absorbansi Standar Asam Galat ... 35
Tabel 4.4 Kadar Total Polifenol Ekstrak Umbi Talas Jepang ... 36
Tabel 4.5 Nilai Absorbansi, % Inhibisi, dan IC50 Ekstrak Umbi Talas Jepang .... 37
Tabel 4.6 Hasil Optimasi Formula Sediaan Mikroemulsi ... 41
Tabel 4.7 Hasil Optimasi Kondisi Pemebentukan Mikroemulsi ... 45
Tabel 4.8 Hasil Formula dan Kondisi Terbaik ... 45
Tabel 4.9 HasilPemeriksaanOrganoleptikdanHomogenitas ... 46
Tabel 4.10 Nilai Viskositas Mikroemulsi pada Berbagai Kecepatan ... 48
Tabel 4.11 Hasil Pengamatan Organoleptik Mikroemulsi pada Cycling Test ... 50
Tabel 4.12 Hasil Pengamatan Makroskopik Mikroemulsi pada Berbagai Suhu ... 51
Gambar 2.1 Umbi Talas Jepang ... 4
Gambar 2.2 Struktur Anatomi Kulit ... 5
Gambar 2.3 Struktur Alpha Tocopherol ... 19
Gambar 4.1 Kurva Kalibrasi Asam Galat ... 36
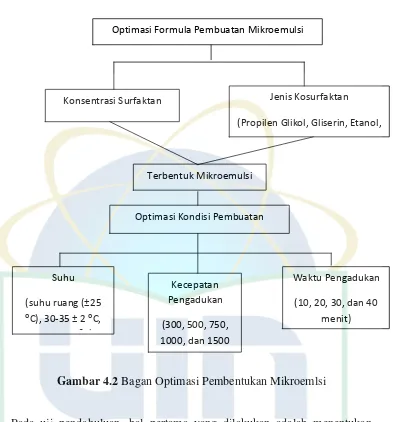
Gambar 4.2 Bagan Optimasi Pembentukan Mikroemulsi ... 40
Gambar 4.3 Diagram Fase Pseudoterner Mikroemulsi ... 43
Lampiran 1. Alur Penelitian ... 55
Lampiran 2. Hasil Determinasi Tanaman ... 56
Lampiran 3. Gambar Hasil Penapisan Fitokimia ... 57
Lampiran 4. Perhitungan Parameter Non Spesifik Ekstrak Umbi Talas Jepang 59 Lampiran 5. Perhitungan dan Hasil Penetapan Kadar Total Polifenol ... 60
Lampiran 6. Hasil dan PerhitunganAktivitas Antioksidan ... 63
Lampiran 7. Nilai Viskositas Mikroemusi pada Berbagai Kecepatan ... 66
Lampiran 8. Gambar Hasil Penelitian ... 70
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Penuaan telah menjadi masalah tersendiri bagi kaum wanita. Penuaan
merupakan suatu proses multidimensional, yakni mekanisme perusakan dan
perbaikan di dalam tubuh dan sistem tersebut terjadi secara bergantian pada
kecepatan dan saat-saat yang berbeda (Tambayong, 2000). Proses terjadinya
penuaan kulit tidak sama pada setiap orang. Pada orang tertentu proses penuaan
kulit terjadi sesuai dengan usianya sedangkan pada orang lain dapat datang lebih
cepat, keadaan ini disebut sebagai penuaan dini (premature aging). Hal ini
menunjukan bahwa proses penuaan pada setiap individu berbeda, tergantung dari
berbagai faktor yang mempengaruhi dan mempercepat proses penuaan
(Cunningham, 1998 dan Soepardiman, 2003). Meskipun proses penuaan adalah
sesuatu yang harus terjadi, namun berbagai usaha untuk mencegah atau
memperlambatnya terus dilakukan. Salah satu bentuk upaya untuk mencegah atau
memperlambat terjadinya proses penuaan dini adalah dengan menggunakan
sediaan kosmetik, berupa anti-aging yang memiliki kemampuan untuk mencegah
atau memperlambat terjadinya proses tersebut (Elsnerdan Howard, 2000 dan
Tranggono dan Latifah, 2007).
Kurun waktu terakhir, banyak dikembangkan penelitian yang berfokus
pada bahan alam, termasuk penelitian di bidang kosmetik. Penggunaan bahan
alami dari tanaman memiliki beberapa keunggulan, diantaranya adalah tidak
menyebabkan terjadinya efek samping (Chen, Pearson, dan Gray, 1992; Kahl dan
Kappus, 1993). Salah satu tumbuhan yang telah digunakan oleh masyarakat
sebagai anti-aging adalah talas jepang (Colocasia esculenta (L.) Schott var
antiquorum. Talas jepang juga biasa digunakan sebagai obat dalam mempercepat
penyembuhan luka sehingga talas jepang dianggap memiliki kemampuan untuk
meregenerasi sel yang rusak. Talas jepang memiliki kandungan polifenol, vitamin
sebagai anti-aging (Wang, 1983; Lintner dan Sederma, 2015; Sharma dan Arvind
Sharma, 2012; dan Kim, Moon, Seon Yeo, dan Kang, 2010). Hal inilah yang
melatarbelakangi pembuatan sediaan anti-aging dari ekstrak umbi talas jepang.
Kulit memiliki pertahanan yang sulit ditembus oleh molekul obat terutama
yang bersifat hidrofilik (Tranggono dan Latifah, 2007) sehingga ekstrak umbi
talas jepang akan sulit untuk berpenetrasi karena ekstrak talas jepang bersifat
hidrofilik. Zat aktif dalam sediaan harus mampu melewati kulit terutama lapisan
tanduk (stratum korneum) yang merupakan lapisan penghalang utama
(Fatmawaty, Tjendra, Riski, dan Nisa, 2012). Oleh sebab itu perlu dikembangkan
bentuk sediaan yang dapat meningkatkan penetrasinya, diantaranya adalah bentuk
sediaan mikroemulsi.
Produk kosmetik ekstrak umbi talas jepang yang telah beredar adalah
dalam bentuk krim sehingga bentuk mikroemulsi ini merupakan salah satu dari
upaya pengembangan dari produk ekstrak umbi talas jepang. Kosmetik dalam
bentuk mikroemulsi merupakan kosmetik yang mulai dikembangkan di zaman
teknologi yang lebih maju seperti sekarang, karena memiliki sistem penghantaran
baru dan menjanjikan hasil yang lebih baik dan lebih cepat dibandingkan sediaan
topical lainnya, seperti sediaan krim. Mikroemulsi tersusun atas air, minyak, dan
surfaktan, terkadang bersama kosurfaktan (Flanagan dan Singh, 2006; Cho, Kim,
Bae, Mok, dan Park, 2008). Sifat mikroemulsi yang termodinamis dapat
mendukung partisi ke dalam kulit. Sarana mikroemulsi juga dapat mengurangi
penghalang difusi dari stratum korneum dan menunjukan peningkatan efisiensi
dalam penetrasi melalui kulit (Zhu dan Gao, 2008; Shetye dkk, 2010).
Pada penelitian ini akan dilakukan pembuatan sediaan mikroemulsi tipe air
dalam minyak (a/m) dari ekstrak umbi talas jepang dan melihat kestabilannya
secara fisik. Tipe ini dipilih karena zat aktif (fase terdispersi) berifat hidrofil.
Pembuatan mikroemulsi ini dilakukan dengan menggunakan minyak zaitun dan
vitamin E sebagai fase minyak. Pada penelitian ini dilakukan penentuan
konsentrasi kombinasi surfaktan yang digunakan, yakni span 80 dan tween 80
dengan beberapa variasi kosurfaktan, yakni propilen glikol, gliserin, etanol, dan
polietilen glikol (PEG) 400 pada berbagai konsentrasi agar dapat menghasilkan
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah disebutkan, terdapat masalah yang
harus terselesaikan, yaitu:
1.2.1 Apakah jenis kosurfaktan dan berapa konsentrasi kosurfaktan dan
surfakatan (tween 80 dan span 80) yang dapat membentuk mikroemulsi
tipe air dalam minyak (a/m) ekstrak umbi talas jepang?
1.2.2 Apakah produk ekstrak umbi talas jepang dapat dibuat menjadi sediaan
mikroemulsi air dalam minyak (a/m) yang stabil secara fisik?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mendapatkan formula mikroemulsi
air dalam minyak (a/m) ekstrak umbi talas jepang dan mengevaluasi kestabilan
fisik sediaan.
1.4 Manfaat Peneltian
Penelitian ini dapat memberikan informasi mengenai stabilitas fisik
mikroemulsi air dalam minyak (a/m) ekstrak umbi talas jepang dan memberikan
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Talas Jepang
2.1.1 Taksonomi
Kingdom : Plantae
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Liliopsida
Sub Kelas : Arecidae
Ordo : Arales
Famili : Araceae
Genus : Colocasia
Spesies : Colocasia esculenta (L.) Schott
Varian : Colocasia esculenta (L.) Schott var antiquorum
(Anonim, 2012, p. 376)
Gambar 2.1.Umbi Talas Jepang
[sumber : Bebeja, 2014]
2.1.2 Kandungan Kimia
Umbi talas jepang mengandung senyawa polifenol, vitamin C, vitamin A,
81,40% air; 0,07% lemak; 15, 34% karbohidrat; 0,63% serat; 1,44% protein;
0,013 kalsium; 0,032% fosfat; 0,0015% besi; kalsium oksalat; alkaloid, vitamin
B1.Talas jepang mengandung sejumlah tinggi seng dan asam folat (Irawan,
(Okamoto, 1967 dalam Wang, 1983), antosianin, karoten, steroid, pati,
glukosamin, galaktosa, glukosa, arabinosa, ribosa, ramnosa, dan glukonolakton
(Wang, 1983).
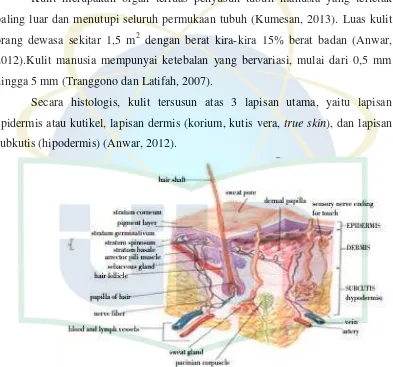
2.2 Kulit
Kulit merupakan organ terluas penyusun tubuh manusia yang terletak
paling luar dan menutupi seluruh permukaan tubuh (Kumesan, 2013). Luas kulit
orang dewasa sekitar 1,5 m2 dengan berat kira-kira 15% berat badan (Anwar,
2012).Kulit manusia mempunyai ketebalan yang bervariasi, mulai dari 0,5 mm
hingga 5 mm (Tranggono dan Latifah, 2007).
Secara histologis, kulit tersusun atas 3 lapisan utama, yaitu lapisan
epidermis atau kutikel, lapisan dermis (korium, kutis vera, true skin), dan lapisan
subkutis (hipodermis) (Anwar, 2012).
Gambar 2.2.Struktur Anatomi Kulit
[sumber :US National Institute of Health, 2013]
2.2.1 Epidermis
Epidermis merupakan jaringan epitel berlapis pipih, dengan sel epitel yang
mempunyai lapisan tertentu. Lapisan ini terdiri dari lima bagian, yakni (Anwar,
a. Stratum germinativum (stratum basal)
Merupakan lapisan terbawah epidermis.Di dalamnya terdapat sel-sel
melanosit, yaitu sel-sel yang tidak mengalami keratinasi dan fungsinya hanya
membentuk pigmen-pigmen melanin dan memberikannya kepada sel-sel
keratinosit melalui dendrit-dendritnya.Melanin merupakan pigmen utama untuk
warna dari kulit manusia (Hearing, 2005).
b. Stratum spinosum
Memiliki sel yang berbentuk kubus dan seperti berduri.Intinya besar dan
oval.Setiap sel berisi filamen-filamen kecil yang terdiri atas serabut protein
(Tranggono dan Latifah, 2007).Seluruh selnya terikat rapat lewat serat-serat yang
ada pada sitoplasma sehingga secara keseluruhan lapisan sel-selnya
berduri.Lapisan ini untuk menahan gesekan dan tekanan dari luar, tebal, dan
terdapat di daerah tubuh yang banyak bersentuhan atau menahan beban dan
tegangan (Syaifuddin, 2009).
c. Stratum granulosum
Tersusun oleh sel-sel keratinosit yang berbentuk poligonal, berbutir kasar,
berinti mengkerut (Tranggono dan Latifah, 2007).Lapisan ini menghalangi
masuknya benda asing, kuman, dan bahan kimia masuk ke dalam tubuh
(Syaifuddin, 2009).
d. Stratum lusidum
Merupakan lapisan yang tipis, jernih, mengandung eleidin, sangat tampak
jelas pada telapak tangan dan telapak kaki.Antara stratum lusidum dan stratum
granulosum terdapat lapisan keratin tipis yang disebut rein’s barrier yang tidak
bisa ditembus (impermeable) (Tranggono dan Latifah, 2007).
e. Stratum korneum
Lapisan ini terdiri atas beberapa lapis sel yang pipih, mati, tidak memiliki
inti, tidak mengalami proses metabolisme, tidak berwarna, dan sangat sedikit
mengandung air. Lapisan ini sebagian besar terdiri atas keratin, jenis protein yang
tidak larut dalam air, dan sangat resisten terhadap bahan-bahan kimia (Tranggono
dan Latifah, 2007).
Dari sudut kosmetik, epidermis merupakan bagian kulit yang menarik
2.2.2 Dermis
Dermis merupakan jaringan ikat fibroelastis.Lapisan ini jauh lebih tebal
daripada epidermis(Anwar, 2012).Dermis terutama terdiri dari bahan dasar
serabut kolagen dan elastin, yang berada di dalam substansi dasar yang bersifat
koloid dan terbuat dari gelatin mukopolisakarida.Serabut kolagen dapat mencapai
72 persen dari keseluruhan berat kulit manusia bebas lemak. Di dalam dermis
terdapat adneksa-adneksa kulit, seperti folikel rambut, papilla rambut, kelenjar
keringat, saluran keringat, kelenjar sebasea, otot penegak rambut, ujung pembuluh
darah dan ujung saraf, juga sebagian serabut lemak yang terdapat pada lapisan
lemak bawah kulit (Tranggono dan Latifah, 2007).
2.2.3 Subkutis
Lapisan ini ditandai dengan adanya jaringan ikat longgar dan sel-sel lemak
yang membentuk jaringan lemak.Lapisan lemak ini disebutpanikulus adipose
yang berfungsi sebagai cadangan makanan dan bantalan.Di lapisan ini terdapat
ujung-ujung saraf tepi, pembuluh darah, dan saluran getah bening (Anwar, 2012).
2.2.4 Fisiologi Kulit
Fungsi kulit sangat kompleks dan berkaitan satu dengan yang lainnya di
dalam tubuh manusia, dengan berbagai fungsi antara lain (Anwar, 2012):
a. Fungsi proteksi
Kulit dapat melindungi bagian dalam tubuh manusia terhadap gangguan
fisik maupun mekanik. Gangguan fisik misalnya tekanan mekanik, gesekan,
tarikan, panas, dingin, gangguan sinar radiasi atau sinar ultraviolet, dan gangguan
kuman, jamur, bakteri atau virus sedangkan gangguan kimiawi, seperti zat-zat
kimia iritan. Gangguan fisik dan mekanik ditanggulangi dengan adanya bantalan
lemak subkutis, tebalnya lapisan kulit dan serabut penunjang yang berfungsi
sebagai pelindung bagian luar tubuh. Gangguan kimia ditanggulangi dengan
adanya lemak permukaan kulit yang berasal dari kelenjarpalit kulit yang
b. Fungsi absorpsi
Kulit yang sehat tidak mudah menyerap air, larutan maupun benda
padat.Tetapi cairan yang mudah menguap lebih mungkin mudah diserap kulit,
begitu pula zat yang larut dalam minyak.Kemampuan absorpsi kulit dipengaruhi
oleh tebal tipisnya kulit, hidrasi, kelembapan udara, metabolisme, dan jenis
pembawa zat yang menempel di kulit.Absorpsi dapat melalui celah antar sel,
saluran kelenjar atau kelenjar rambut (Anwar, 2012).
c. Fungsi ekskresi
Kelenjar-kelenjar pada kulit mengeluarkan zat-zat yang tidak berguna atau
sisa metabolisme dalam tubuh, misalnya NaCl, urea, asam urat, amonia, dan
sedikit lemak (Anwar, 2012).
d. Fungsi pengindra (sensori)
Kulit mengandung ujung-ujung saraf sensorik di dermis dan
subkutis.Badan Ruffini yang terletak di dermis, menerima rangsangan dingin dan
rangsangan panas diperankan oleh badan Krause.Badan taktil Meissner yang
terletak di papil dermis menerima rangsang rabaan, demikian pula badan
Merkel-Renvier yang terletak di epidermis (Anwar, 2012).
e. Fungsi termoregulasi (pengaturan suhu tubuh)
Kulit melakukan peran ini dengan cara mengeluarkan keringat dan
mengerutkan otot dinding pembuluh darah kulit (Anwar, 2012).
f. Fungsi pembentukan pigmen (melanogenesis)
Sel pembentuk pigmen kulit (melanosit) terletak di lapisan basal
epidermis.Jumlah melanosit dan besarnya melanin yang terbentuk menentukan
warna kulit (Anwar, 2012).
g. Fungsi keratinisasi
Keratinisasi dimulai dari sel basal yang kuboid, bermitosis ke atas berubah
bentuk lebih poligonal yaitu sel spinosum, terangkat ke atas menjadi lebih gepeng
dan bergranula menjadi sel granulosum. Kemudian sel tersebut terangkat ke atas
lebih gepeng dan granula serta intinya hilang menjadi sel spinosum dan akhirnya
sampai di permukaan kulit menjadi sel yang mati, protoplasmanya mongering
terus-menerus dan berguna untuk fungsi rehabilitasi kulit agar dapat
melaksanakan fungsinya secara baik (Anwar, 2012).
h. Fungsi produksi vitamin D
Kulit juga dapat membuat vitamin D dari bahan baku
7-dihidroksikolesterol dengan bantuan sinar matahari. Namun, produksi ini masih
lebih rendah dari kebutuhan tubuh (Anwar, 2012).
2.2.5Penetrasi Obat Melalui Kulit
Penetrasi obat melintasi stratum korneum dapat terjadi karena adanya
proses difusi melalui dua mekanisme, yaitu (Anwar, 2012):
a. Absorpsi transepidermal
Jalur ini merupakan jalur utama bila dibandingkan dengan jalur melalui
kelenjar-kelenjar lainnya karena luas permukaan epidermal 100 sampai 1000 kali
lebih luas dari permukaan kelenjar-kelenjar tersebut.Jalur absorpsi transepidermal
merupakan jalur difusi melalui stratum korneum yang terjadi melalui dua jalur,
yaitu jalur transelular yang berarti melalui protein di dalam sel dan melewati
daerah yang kaya akan lipid, dan jalur paraselular yang berarti jalur melalui ruang
antar sel (Anwar, 2012).
Penetrasi transepidermal berlangsung melalui dua tahap.Pertama,
pelepasan obat dari pembawa ke stratum korneum, tergantung koefisien partisi
obat dalam pembawa dan stratum korneum.Kedua, difusi melalui epidermis dan
dermis dibantu oleh aliran pembuluh darah dalam lapisan dermis (Anwar, 2012).
b. Absorpsi transappendageal
Merupakan jalur masuknya obat melalui folikel rambut dan kelenjar
keringat disebabkan karena adanya pori-pori di antaranya, sehingga
memungkinkan obat berpenetrasi (Anwar, 2012).
Faktor-faktor yang mempengaruhi absorpsi perkutan adalah sifat-sifat
fisikokimia dari obat, sifat pembawa yang digunakan, dan kondisi fisiologis
2.3 Kosmetik
Menurut peraturan Menteri Kesehatan RI No. 44/Menkes/Permenkes/1998
kosmetik adalah sediaan atau paduan bahan yang siap untuk digunakan pada
bagian luar badan (epidermis, rambut, kuku, bibir, dan organ kelamin bagian
luar), gigi, dan rongga mulut untuk membersihkan, menambah daya tarik,
mengubah penampilan, melindungi supaya dalam keadaan baik, memperbaiki bau
badan tetapi tidak dimaksudkan untuk mengobati atau menyembuhkan suatu
penyakit (Tranggono dan Latifah, 2007).
Kosmetik menurut kegunaannya bagi kulit dibagi menjadi kosmetik
perawatan kulit (skin-care cosmetics), kosmetik untuk mulut (oral cosmetics), dan
wangi-wangian (fragrances) (Mitsui, 1993).
Kosmetik perawatan kulit disebut juga kosmetik wajah dan terutama
digunakan pada wajah (Mitsui, 1993).Kosmetik wajah terdiri dari kosmetik untuk
membersihkan kulit atau cleanser (sabun, cleansing cream, cleansing milk, dan
freshener), Kosmetik untuk melembabkan kulit atau moisturizer (moisturizing
cream, night cream, anti wrinkle cream), kosmetik untuk menipiskan kulit atau
peeling (scrub cream).Kosmetik anti penuaan atau anti-aging merupakan salah
satu kosmetik perawatan kulit (Wasitaatmadja, 1997; Tranggono dan Latifah,
2007).
Kosmetik riasan diperlukan untuk merias dan menutup cacat pada kulit
sehingga menghasilkan penampilan yang lebih menarik serta menimbulkan efek
psikologis yang baik. Contoh dari kosmetik riasan ini adalah foundation, eye make
up, lipstick, dan rouges (Wasitaatmadja, 1997; Tranggono dan Latifah, 2007).
Kosmetik perawatan rambut diantaranya adalah shampoo, preparat
perawatan dan gaya rambut (hair styling). Produk yang termasuk didalamnya
yaitu promoter penumbuh rambut dan perawatan kulit kepala dan rambut (Mitsui,
1993).
Kosmetik perawatan mulut diantaranya, yaitu pasta gigi dan produk
2.4 Penuaan
Proses penuaan merupakan proses fisiologis yang akan terjadi pada semua
makhluk hidup yang meliputi seluruh organ tubuh termasuk kulit (Cunningham,
1998).
2.4.1 Teori Proses Penuaan
Bermacam-macam teori proses penuaan telah dikemukakan para ahli
namun sampai saat ini mekanisme yang pasti belum diketahui. Ada berbagai teori
penuaan, antara lain (Soepardiman, 2003 dan Wasiaatmadja, 1997):
1. Teori Replikasi DNA
Teori ini mengemukakan bahwa terjadinya proses penuaan disebabkan
kematian sel secara perlahanlahan antara lain akibat pengaruh sinar ultraviolet
(sinar matahari) yang merusak sel DNA sehingga mempengaruhi masa hidup sel
(Cunningham, 1998; Soepardiman, 2003; dan Wasiatmadja, 1997).
2. Teori Kelainan Alat
Proses penuaan terjadi kibat kerusakan DNA yang menyebabkan
terbentuknya molekul-molekul yang tidak sempurna sehingga terjadi kelainan
enzim-enzim intraselular yang mengakibatkan kerusakan atau kematian sel
(Cunningham, 1998; Soepardiman, 2003; dan Wasiatmadja, 1997).
3. Teori Ikatan Silang
Proses penuaan merupakan akibat dari pembentuan ikatan silang yang
progresif dari protein-protein intraseluler dan interseluler serabut kolagen yang
menyebabkan kolagen kurang lentur dan tidak tegang (Cunningham, 1998;
Soepardiman, 2003; dan Wasiatmadja, 1997).
4. Teori Neuro-Endokrin
Proses menjadi tua diatur oleh organ-organ penghasil hormon seperti timus,
hipotalamus, hipofisis, tiroid yang secara berkaitan mengatur keseimbangan
hormonal dan regenerasi sel-sel tubuh manusia (Cunningham, 1998;
Soepardiman, 2003; dan Wasiatmadja, 1997).
5. Teori Radikal Bebas
Teori radikal bebas dewasa ini lebih banyak dianut dan dipercaya sebagai
tubuh yang mempunyai elektron yang tidak berpasangan sehingga tidak stabil dan
sangat reaktif. Sebelum memiliki pasangan, radikal bebas akan terus menerus
menghantam sel-sel tubuh guna mendapatkan pasangannya termasuk menyerang
sel-sel tubuh yang normal. Akibatnya sel-sel akan rusak dan menua serta
mempercepat timbulnya kanker (Cunningham, 1998; Soepardiman, 2003; dan
Wasiatmadja, 1997).
2.4.2 Proses Penuaan pada Kulit
Proses penuaan kulit mempunyai dua fenomena yang saling berkaitan,
yaitu:
1. Proses Kronologis (Penuaan Intrinsik)
Merupakan proses penuaan fisiologis yang berlangsung secara alamiah,
disebabkan berbagai faktor dari dalam tubuh sendiri seperti genetik, hormonal,
dan rasial. Fenomena ini tidak dapat dicegah atau dihindari dan mengakibatkan
perubahan kulit yang menyeluruh sesuai dengan pertambahan usia (Cunningham,
1998; Soepardiman, 2003; dan Wasiatmadja, 1997).
2. Proses penuaan ekstrinsik
Proses ini terjadi akibat berbagai faktor dari luar tubuh. faktor lingkungan
seperti sinar matahari, kelembaban udara, suhu, dan berbagai faktor eksternal
lainnya dapat mempercepat proses penuaan kulit sehingga terjadi penuaan dini.
Perubahan pada kulit terutama terjadi di daerah terpajan seperti kulit wajah
sehingga wajah terlihat lebih tua, tidak sesuai dengan usia yang sebenarnya
(Cunningham, 1998; Soepardiman, 2003; dan Wasiatmadja, 1997).
Secara garis besar gejala penuaan intrinsik dan penuaan ekstrinsik
(photoaging) dapat dibedakan sebagai berikut (Soepardiman, 2003 dan
Tabel 2.1 Perbedaan Antara Penuaan Intrinsik dan Ekstrinsik
Penuaan Intrinsik Penuaan Ekstrinsik
Kulit tipis dan halus
Kulit kering
Kerut halus, garis ekspresi lebih
dalam
Kulit kendur
Dapat timbul tumor jinak
Kulit menebal dan kasar
Kulit kering
Kerut lebih dalam dan nyata
Bercak pigmentasi tidak teratur
Pelebaran pembuluh darah
Dapat timbul tumor jinak, pra
kanker maupun kanker kulit
2.4.3 Faktor-Faktor yang Mempengaruhi Penuaan Kulit
Faktor-faktor yang mempengaruhi terjadinya proses penuaan pada kulit
dibedakan menjadi dua, yaitu:
1. Faktor intrinsik
Merupakan faktor-faktor dari dalam tubuh yang berpengaruh pada proses
penuaan kulit, diantaranya (Cunningham, 1998 dan Soepardiman, 2003):
a. Keturunan (genetik)
b. Rasial
c. Hormonal
2. Faktor ekstrinsik
Berbagai faktor dari luar tubuh yang dapat menyebabkan proses penuaan
dini, antara lain:
a. Faktor lingkungan
1. Sinar matahari
Sinar matahari merupakan faktor utama penyebab terjadinya proses
penuaan kulit. Penuaan dini yang terjadi akibat paparan sinar matahari disebut
sebagai photo aging (dermatoheliosis) (Wasiatmadja, 1997 dan Pellerano dan
Bemstein, 1996). Kulit yang terpapar oleh sinar matahari akan menyerap
radiasi sinar UV dan menghasilkan komponen yang berbahaya yaitu Reactive
Oxygen Species (ROS) yang dapat menyebabkan kerusakan oksidatif pada
komponen seluler seperti dinding sel, membran lipid, mitokondria, dan DNA.
merupakan faktor transkripsi yang menghambat produksi kolagen dan
meningkatkan penghancuran kolagen dengan memperbanyak enzim yang
disebut matriks metalloproteinase (MMPs) (Helfrich, Sachs, and Voorhees,
2008).
Radiasi UV juga menyebabkan penurunan pembentukan transforming
growth factor (TGF)-beta yang merangsang pembentukan kolagen sehingga
pembentukan kolagen menurun (Helfrich, Sachs, and Voorhees, 2008). Selain
itu, radikal bebas juga dapat dihasilkan polusi udara, asap rokok, paparan dari
bahan kimia, dan bahan tambahan pada makanan seperti pengawet, pewarna,
dan pelezat (Cunningham, 1998 dan Wasiatmadja, 1997).
2. Kelembaban udara
Kelembaban udara yang rendah di daerah pengunungan atau dataran
tinggi, ruangan AC, paparan angin, dan suhu dingin akan menyebabkan kulit
menjadi kering sehingga mempercepat proses penuaan kulit (Wasiatmadja,
1997 dan Pellerano dan Bemstein, 1996).
3. Keadaan gizi yang buruk
4. Stress psikologis
5. Pemakaian otot-otot muka yang berulang-ulang dan berlagsung lama
6. Penyakit menahun
7. Kehilangan struktur penunjang kulit yang berlebihan (Cunningham, 1998;
Soepardiman, 2003; dan Wasiatmadja, 1997).
Berbagai masalah dan kelainan kulit dapat timbul pada kulit yang menua,
yakni:
1. Kulit kering dan kasar (Pindha IGAS, 2000).
2. Kulit kendur, timbul kerutan, dan lipatan kulit yang nyata (Pindha IGAS,
2000).
3. Bercak pigmentasi (Cunningham, 1998; Pellerano dan Bemstein, 1996; dan
Pindha IGAS, 2000).
4. Tumor kulit (Cunningham, 1998; Pellerano dan Bemstein, 1996; dan Pindha
2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyi struktur molekul yang dapat
memberikan elektron dengan cuma-cuma kepada molekul radikal bebas
(Kumalaningsih, 2006). Senyawa ini memiliki berat molekul kecil, tetapi mampu
menginaktivasi berkembangnya reaksi oksidasi dengan cara mencegah
terbentuknya radikal. Antioksidan dibagi menjadi 2 golongan, yaitu antioksidan
larut air seperti natrium metabisulfit dan vitamin C dan antioksidan larut lemak
seperti BHT dan BHA (Angela, 2012).
Ada berbagai metode dalam menguji aktivitas antioksidan, beberapa
diantaranya adalah dengan meenggunakan metode aktivitas penghambatan radikal
superoksida, metode Reducing Power, metode uji kapasitas serapan radikal
oksigen, metode tiosianat, dan metode peredaman dengan DPPH (2,2
Diphenyl-1-picrylhidrazyl), dan metode penimbangan (Angela, 2012).
Metode peredaman dengan DPPH merupaka uji aktivitas antioksidan yang
paling sering digunakan.Metode ini merupakan metode yang mudah, cepat dan
murah serta memberikan informasi reaktivitas senyawa yang diuji dengan suatu
radikal stabil.DPPH memberikan serapan kuat pada panjang gelombang 517 nm
dengan warna violet gelap.Penangkapan radikal bebas menyebabkan elektron
menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang
sebanding dengan jumlah elektron yang diambil (Sunarni, 2005).
Menurut Bois (1958), uji dengan metode peredaman DPPH akan
menunjukkan kekuatan aktivitas antioksidan yang ditentukan berdasarkan IC50.
Aktivitas antioksidan dikatakan sangat kuat bila nilai IC50 lebih kecil dari 50
μg/ml, kuat bila nilai IC50 antara 50-100 μg/ml, sedang bila nilai IC50 antara
100-150 μg/ml, dan dikatakan lemah bila IC50 antara 151-200 μg/ml (Angela, 2012).
2.6 Mikroemulsi
Konsep mikroemulsi diperkenalkan pertama kali pada tahun 1940 oleh
Hoar dan Schulman.Mikroemulsi adalah dispersi isotropik, stabil
secaratermodinamis, transparan, dengan ukuran partikel berkisarantara 5-100 nm,
berasal dari pembentukan spontan bagian hidrofobik dan hidrofilik molekul
dengan kosurfaktan (Flanagan dan Singh, 2006; Cho, Kim, Bae, Mok, dan Park.,
2008).
Keunggulan mikroemulsi lainnya adalah mempunyai viskositas yang
rendah dan preparasinyamudah (Flanagan dan Singh, 2006) serta menunjukan
kecepatan dan efisiensi dalam penetrasi ke dalam kulit. Hal tersebut menjanjikan
untuk rute pengiriman transdermal dan dermal yang efisien (Kreilgaard, 2002;
Rhee dkk., 2001; Kreilgaard dkk., 2000; Baboota Kohli, Dixit, Shakeel., 2007;
Kamal dkk., 2007; Chen dkk., 2007). Beberapa mekanisme telah diusulkan untuk
menjelaskan keuntungan dari mikroemulsi untuk rute pengiriman transdermal dan
dermal.Pertama, termodinamika terhadap kulit meningkat karena sejumlah besar
obat tergabung dalam formulasi.Kedua, peningkatan aktivitas termodinamika obat
dapat mendukung partisi ke dalam kulit. Ketiga, sarana mikroemulsi dapat
mengurangi penghalang difusi dari stratum korneum dan meningkatkan tingkat
penetrasi obat melalui kulit dengan bertindak sebagai peningkat permeasi
sehingga memungkinkan sejumlah besar obat dapat berpenetrasi karena struktur
dan formulasinya dibandingkan sediaan topikal lainnya (Zhu danGao, 2008 dan
Shetye dkk, 2010).
Pada awalnya, minyak yang digunakan pada pembuatanmikroemulsi
berupa hidrokarbon minyak mineral, terutama karena mudah membentuk
mikroemulsi dan juga kemurnian sistem hidrokarbon (Flanagan dan Singh,
2006).Akan tetapi, minyak yang memiliki komposisi asam lemak jenuh dan asam
lemak rantai sedang lebih banyak memiliki keuntungan tersendiri karena lebih
stabil dan memerlukan jumlah surfaktan yang lebih sedikit untuk membentuk
mikroemulsi (Yuwanti dkk, 2011).
Surfaktan HLB rendah memudahkan pelarutan komponen larut minyak,
surfaktan HLB tinggi akan memudahkan pelarutan komponen larut air. Surfaktan
HLB sedang mempunyai polaritas sedang diharapkan dapat berinteraksi dengan
kedua surfaktan lainnya, tegangan antar muka menjadi lebih rendah dan
memungkinkan pembentukan droplet baru dengan ukuran lebih kecil sehingga
diperoleh mikroemulsi yang lebih stabil (Yuwanti dkk, 2011).Campuran
muka dan ukuran droplet mikroemulsi sehingga memperbaiki stabilitas
mikroemulsi yang dihasilkan (Cho Kim, Bae, Mok, dan Park, 2008).
Mikroemulsi dibagi menjadi tiga jenis, yaitu mikroemulsi air dalam
minyak (a/m), mikroemulsi minyak dalam air (m/a), dan mikroemulsi
bicontinuous. Jenis mikroemulsi yang terbentuk bergantung pada komposisi
pembentuknya.Mikroemulsi minyak dalam air terbentuk karena fraksi dari minyak
rendah.Sedangkan mikroemulsi air dalam minyak terjadi ketika fraksi dari air
rendah. Sistem mikroemulsi bicontinuous mungkin terjadi jika jumlah air dan
minyak hampir sama (Lawrence, 2000).
Mikroemulsi yang stabil ditandai dengan dispersi globul yang seragam
dalam fase continue. Namun dapat terjadi penyimpangan dari kondisi
tersebut.Disamping itu suatu mikroemulsi mungkin sangat dipengaruhi oleh
kontaminasi dan pertumbuhan mikroba serta perubahan fisika dan kimia lainnya.
Seperti emulsi, ketidakstabilan mikroemulsi bisa digolongkan sebagai berikut
(Fauzy, 2012):
a. Creaming
Agregat dari bulatan fase dalam mempunyai kecenderungan yang lebih
besar untuk naik ke permukaan mikoemulsi atau jauh ke dasar mikroemulsi
tersebut daripada partikel-partikelnya sendiri (Fauzy, 2012).
b. Flokulasi
Flokulasi adalah agregasi globul menjadi kelompok besar (Fauzy, 2012).
c. Coalescence (breaking, cracking)
Coalescence merupakan penggabungan bulatan-bulatan fase dalam
(coalesense) dan pemisahan fase tersebut menjadi suatu lapisan. Sedangkan
pemisahan fase dalam dari mikroemulsi tersebut disebut “pecah” atau “retak”
(cracked). Hal ini bersifat irreversible karena lapisan pelindung di sekitar
bulatan-bulatan fase terdispersi tidak ada lagi (Djajadisastra, 2004).
2.7 Komponen Mikroemulsi
2.7.1 Minyak Zaitun
Minyak zaitun merupakan campuran dari gliserida asam lemak.Minyak
merupakan cairan minyak berwarna jernih atau kuning, transparan.Minyak zaitun
umumnya berfungsi sebagai pembawa berminyak.Aplikasinya biasa digunakan
dalam enema, linimen, salep, plaster, dan sabun (Rowe, Sheskey, dan Quin,
2009).
Minyak zaitun sedikit larut dalam etanol (95%), dapat bercampur dengan
eter, kloroform, petroleum putih (50-70 ºC), dan karbon disulfida. Ketika
didinginkan, minyak zaitun akan menjadi keruh kira-kira pada suhu 10 ºC, dan
menjadi seperti massa mentega pada suhu 0 ºC. Minyak zaitun dapat mengalami
saponifikasi dengan alkali hidroksida.Minyak zaitun cenderung mudah teroksidasi
dan inkompatibel dengan agen pengoksidasi (Rowe, Sheskey, dan Quin, 2009).
Minyak zaitun digunakan dalam formulasi ini sebagai basis atau pembawa
minyak.Minyak zaitun memiliki khasiat dan manfaat bagi kesehatan kulit.Minyak
zaitun berkhasiat untuk melembabkan dan menutrisi kulit. Minyak zaitun sangat
kompatibel dengan pH kulit, kaya akan vitamin dan zat-zat bernutrisi lainnya
yang melembutkan dan melindungi kulit (Smaoui, 2012).
2.7.2 Span 80
Span 80 merupakan cairan kental berwarna kuning dengan pH 8. Span 80
merupakan ester sorbitan yang memiliki bau dan rasa yang khas. Span 80 biasa
digunakan sebagai agen pengemulsi, agen pelarut, dan agen pembasah. Span 80
umumnya larut atau terdispersi dalam minyak, larut dalam pelarut organik. Di
dalam air span 80 dapat terdispersi. Span 80 stabil dalam asam maupun basa
lemah. span 80 harus disimpan dalam wadah tertutup, dingin, dan kering. (Rowe,
Sheskey, dan Quin, 2009).
2.7.3 Tween 80
Tween 80 disebut juga sebagai polisorbat 80 (polioksietilen 20 sorbitan
monooleat).Tween 80 memiliki karakteristik cairan berminyak berwarna kuning
pada suhu 25 C dan suhu hangat, serta berasa pahit. Tween 80 larut dalam etanol
dan air, tidak larut dalam minyak mineral dan minyak nabati.Tween 80 berfungsi
sebagai pengemulsi, surfaktan nonionik, solubilizing agent, agen pensuspensi, dan
Tween 80 stabil untuk elektrolit dan asam serta basa lemah, saponifikasi
terjadi dengan asam dan basa kuat.Ester asam oleat sestitif terhadap
oksidasi.Tween 80 higroskopis dan harus disimpan dalam wadah tertutup baik,
terlindung dari cahaya, dingin, dan kering (Rowe, Sheskey, dan Quin, 2009).
2.7.4 Polietilen Glikol 400 (PEG 400)
Polietilen glikol 400 berwujud cairan kental, jernih, tidak berwarna atau
berwarna sedikit kuning.PEG 400 sedikit berbau serta berasa pahit dan sedikit
membakar.PEG 400 memiliki berat molekul 380-420, titik leleh 6-8 ºC, pH
4,0-7,0 (larutan 5% w/v), massa jenis 1,120 g/cm3 pada suhu 25 ºC. PEG 400 larut
dalam air, aseton, alkohol, benzena, gliserin, dan glikol.PEG 400 stabil secara
kimia dalam udara dan dalam larutan.PEG 400 inkompatibel dengan beberapa
agen pewarna.Aktivitas antibakteri dari antibiotik dikurangi dalam basis polietilen
glikol (penisillin dan basitrasin).PEG400 dapat bereaksi dengan golongan
sulfonamida dan sorbitol.Sulfonamida dapat mengalami kehilangan warna
sedangkan sorbitol dapat diendapkan dari campurannya.Plastik, seperti polietilen,
fenolformaldehid, polivinil klorida, dan membran ester sellulosa (dalam
penyaring) dapat dilembutkan atau tidak larut dengan polietilen glikol. Migrasi
dari polietilen glikol dapat terjadi dari pelapis film tablet, tertama interaksi dengan
komponen inti (Rowe, Sheskey, and Quin, 2009).
2.7.5 Vitamin E (Alpha Tocopherol)
Gambar 2.3 Struktur Alpha Tocopherol
[sumber :Rowe, Sheskey, and Quin, 2009]
Vitamin E memiliki fungsi sebagai antioksidan dan agen terapi. Vitamin E
merupakan produk alami berupa larutan kental berminyak,jernih, tidak berwarna,
atau berwarna kuning seperti coklat. Vitamin E memiliki titik didih 23 ºC dengan
aseton, etanol, eter, dan minyak nabati.Vitamin E dioksidasi secara lambat oleh
oksigen atmosfir dan secara cepat oleh garam besi dan perak.Vitamin E harus
disimpan di bawah gas inert, di dalam wadah kedap udara, dingin, kering dan
terlindung dari cahaya.Vitamin E inkompatibel dengan peroksida dan ion metal,
terutama besi, tembaga, dan perak (Rowe, Sheskey, and Quin, 2009).
Vitamin E digunakan dalam formulasi ini sebagai antioksidan untuk
sediaan.Vitamin E juga dapat memelihara stabilitas jaringan ikat di dalam sel
(menjga integritas serat elastin antara dermis dan kolagen sehingga kelenturan dan
BAB 3
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Penelitian 2, Laboratorium
Farmakognosi dan Fitokimia, Laboratorium Kimia Obat, Laboratorium Kesehatan
Lingkungan, Laboratorium Penelitian 1, Laboratorium Biologi, dan Laboratorium
Steril Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan,
Universitas Islam Negeri, Syarif Hidayatullah, Jakarta. Waktu penelitian dimulai
pada bulan Januari hingga Juni 2015.
3.2. Alat dan Bahan
3.2.1 Alat
Alat yang digunakan dalam penelitian ini meliputi homogenizer (IKA®
RW 20 Digital), spektofotometri UV-Vis (Hitachi), sentrifugator (Eppendorf
SH7R), viskometer (Visco Tester 6R HAAKE), hotplate stirrer, oven (France
Etuves C 3000®), refrigerator (Sanyo Medicool), piknometer (Iwaki pyrex®), pH
meter (Horiba F-52, Jepang), mikroskop optik (Olympus), magnetic stirrer,
mikropipet (Rainin, USA), timbangan analitik (KERN ACJ 220-4M, Balingen),
termometer, tabung eppendorf, tanur, krus silikat, piknometer, termometer, botol
timbang, dan alat gelas (Iwaki pyrex®) lain yang biasa digunakan.
3.2.2 Bahan
Bahan yang digunakan adalah umbi talas jepang dan ekstrak umbi talas
jepang (CV Rajawali Mas, Indonesia), span 80 (Brataco, Indonesia), tween 80
(Brataco, Indonesia), minyak zaitun (Brataco, Indonesia), polietilen glikol 400
(Brataco, Indonesia), vitamin E (Bronson & Jacobs, Indonesia), akuades (Alam
Kimia, Indonesia), DPPH, metanol pro analisa (Merck, Jerman), Na2CO3 pro
analisa (Sinopharm, China), Folin-Ciocalteu (Merck, Jerman), asam galat standar
(Sigma, USA), kloroform, H2SO4 2 N, pereaksi mayer, pereaksi dragendorff,
etanol, serbuk Mg, HCl, H2SO4 pekat, asam asetat anhidrat, FeCl3 1%, H2SO4
3.3 Prosedur Kerja
3.3.1 Determinasi Tanaman
Tanaman umbi talas jepang yang didapat dari CV Rajawali Mas
dideterminasi di Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor.
3.3.2 Metode Ekstraksi
Ekstrak umbi talas jepang dibuat dengan menggunakan metode
pengepresan (expression) dan dipanaskan pada suhu 50 ⁰C selama 2 jam,
kemudian didiamkan selama 24 jam. Metode ini akan menghasilkan dua lapisan
setelah dipanaskan. Lapisan yang digunakan adalah lapisan atas yang berwujud
cair. Ekstrak kemudian ditempatkan di dalam desikator untuk mendapatkan kadar
air yang memenuhi persyaratan.
3.3.3 Karakterisasi Ekstrak Umbi Talas Jepang
3.3.2.1Karakterisasi non-spesifik
Adapun karakterisasi non-spesifik yang dilakukan meliputi penetapan
kadar air dan kadar abu.
a. Kadar air
Dimasukan lebih kurang 0,1 gram ekstrak, dan ditimbang seksama dalam
wadah yang telah ditara. Keringkan pada suh 105 ⁰C selama 2 jam, dan timbang.
Lakukan pengeringan dan timbang pada jarak 30 menit sampai perbedaan antara
jarak penimbangan bertururt-turut tidak lebih dari 0,25% (Anonim, 1995).
% Kadar air =Bobot awal −Bobot akhir
Bobot awal × 100%
b. Uji kadar abu
Ditimbang sebanyak 2 gram bahan uji dan dimasukkan ke dalam krus
silikat yang telah dipijar dan ditara, pijarkan perlahan-lahan hingga arang habis,
dinginkan dan ditimbang. Kadar abu total dihitung terhadap berat bahan uji,
dinyatakan dalam % b/b (Anonim, 2000).
% Kadar abu total = w 3−w1
w2 × 100%
W1 = Bobot wadah (gram)
W2 = Bobot zat awal (gram)
W3 = bobot wadah dan abu zat setelah pemanasan (gram)
3.3.2.2Karakterisasi spesifik
a. Organoleptik
Penetapan organoleptik yaitu dengan pengenalan secara fisik
menggunakan panca indera dalam mendeskripsikan bentuk, warna, bau, dan rasa
(Anonim, 2000).
3.3.2.3Uji Kelarutan
Kelarutan ekstrak diukur dengan menggunakan pelarut akuades. Sebanyak
0,1 gram ekstrak dilarutkan dengan akuades sedikit demi sedikit hingga larut.
Kemudian dihitung jumlah akuades yang digunakan.
3.3.3 Penapisan Fitokimia
a. Identifikasi golongan alkaloid
Sampel dicampur dengan 5 mL kloroform dan 5 mLamoniak kemudian
dipanaskan, dikocok dan disaring. Ditambahkan 5 tetes asam sulfat 2 N pada
masing-masing filtrat, kemudian dikocok dan didiamkan. Bagian atas dari
masing-masing filtrat diambil dan diuji dengan pereaksi Meyer dan Dragendorff.
Terbentuknya endapan putih dan jingga yang menunjukkan adanya alkaloid
(Anonim, 2000).
b. Identifikasi golongan flavonoid
Sampel dicampur dengan 5 mL etanol, dikocok, dipanaskan, dan dikocok
lagi kemudian disaring. Kemudian ditambahkan serbuk Mg 0,2 g dan 3 tetes HCl
pada masing-masing filtrat. Terbentuknya warna merah pada lapisan etanol
menunjukkan adanya flavonoid (Anonim, 2000).
Sampel dididihkan dengan 20 mLair dalam penangas air. Filtrat dikocok
dan didiamkan selama 15 menit. Terbentuknya busa yang stabil berarti positif
terdapat saponin (Anonim, 2000).
d. Identifikasi golongan steroid
Sampel diekstrak dengan etanol dan ditambah 2 mLasam sulfat pekat
dan 2 mLasam asetat anhidrat. Perubahan warna dari ungu ke biru atau hijau
menunjukkan adanya steroid (Anonim, 2000).
e. Identifikasi golongan triterpenoid
Sampel dicampur dengan 2 mL kloroform dan 3 mL asam sulfat pekat.
Terbentuknya warna merah kecoklatan pada antar permukaan menunjukkan
adanya triterpenoid (Anonim, 2000).
f. Identifikasi golongan tannin
Sampel didihkan dengan 20 mLa ir lalu disaring. Ditambahkan beberapa
tetes FeCl3 1% dan terbentuknya warna coklat kehijauan atau biru kehitaman
menunjukkan adanya tannin (Anonim, 2000).
3.3.4 Penetapan Kadar Polifenol Total
Dilakukan dengan menggunakan spektrofotometri UV-Vis dan asam galat
sebagai standar.
3.3.4.1Pembuatan Larutan Induk Asam Galat dalam Akuades
Larutan standar asam galat dengan konsentrasi 1000 ppm (µg/mL) dapat
dibuat dengan cara 10 mg asam galat standar dilarutkan dalam 1 mL metanol pro
analisa lalu ditambahkan akuades di dalam labu ukur 10 mL sampai tanda batas
(Ratnayani, 2012).
3.4.4.2 Penentuan Panjang Gelombang Maksimum Asam Galat dalam
Akuades
Larutan standar asam galat 40 ppm (µg/mL) dibuat dengan cara
mengambil 0,2 mL larutan induk asam galat 1000 ppm (µg/mL), lalu dimasukkan
ke dalam labu ukur 5 mL dan ditambahkan akuades sampai tanda batas. Sebanyak
0,5 mL larutan standar 40 ppm dimasukkan ke dalam tabung reaksi, kemudian
ditambahkan 2,2 mL akuades. Larutan diinkubasi pada suhu kamar selama 2 jam.
Campuran larutan tersebut kemudian diukur serapannya pada panjang gelombang
400 sampai 800 nm. Hasil yang diperoleh dibuat dalam bentuk kurva, sebagai
sumbu y adalah absorbansi dan panjang gelombang cahaya sebagai sumbu x. Dari
kurva tersebut dapat ditentukan panjang gelombang yang memberikan serapan
maksimum (Alfian, Susanti, 2012 dan Pontis, Costa, Silva, Flach, 2014).
3.4.4.3Pembuatan Kurva Standar Asam Galat dalam Akuades
Larutan standar asam galat dengan konsentrasi 20, 30, 40, 50, 60, 70, dan
80 ppm (µg/mL) dibuat dengan cara mengambil masing-masing sebanyak 0,2 mL;
0,3 mL; 0,4 mL; 0,5 mL; 0,6 mL; 0,7 mL dan 0,8 mL larutan induk asam galat
1000 ppm (µg/mL), lalu dimasukkan ke dalam labu ukur 10 mL, dan ditambahkan
akuadessampai tanda batas. Sebanyak 0,5 mL dari masing-masing seri konsentrasi
larutan tersebut dimasukkan dalam tabung reaksi, kemudian ditambah 0,3 mL
reagen Folin-Ciocalteu dan 2 mL larutan Na2CO3 15%, lalu ditambahkan 2,2 mL
akuades. Campuran larutan tersebut kemudian diinkubasi selama 2 jam. Semua
larutan diukur absorbansinya menggunakan spektrofotometer UV-Vis pada
panjang gelombang 755 nm, kemudian dibuat kurva kalibrasi hubungan antara
konsentrasi asam galat (μg/mL) dengan absorbansi (Pontis, Costa, Silva, Flach, 2014).
3.4.4.4 Penentuan Kadar Total Senyawa Polifenol dalam Ekstrak Umbi Talas
Jepang
Sebanyak 10 mg ekstrak umbi talas jepang dilarutkan dalam
akuades di dalam labu ukur 10 mL sampai tanda batas. Sebanyak 0,5 mL
larutan ekstrak yang diperoleh dimasukkan ke dalam tabung reaksi, kemudian
ditambah 0,3 mL reagen Folin-Ciocalteu dan 2 mL larutan natrium karbonat
15%, lalu ditambahkan 2,2 mL akuades. Larutan diinkubasi pada suhu kamar
selama 2 jam. Campuran larutan tersebut diukur absorbansinya menggunakan
spektrofotometer UV-Vis pada panjang gelombang 755 nm, kadar senyawa
dari kurva kalibrasi. Kadar total polifenol ditetapkan sebagai ekivalen asam
galat (GAE) (Pontis, Costa, Silva, Flach, 2014).
3.3.5 Uji Antioksidan dengan Metode DPPH (Harun, 2014)
3.3.5.1Pembuatan Larutan DPPH 0,1 mM
Sebanyak 1,98 mg DPPH (BM 394,32) dilarutkan dengan methanol pro
analisa dan dimasukkan kedalam labu ukur 50 mL. Volume dicukupkan dengan
metanol pro analisa hingga tanda batas, kemudian ditempatkan dalam botol gelap.
3.3.5.2Pembuatan Larutan Blangko
Dipipet 2 mL larutan DPPH (0,1 mM) kedalam tabung reaksi dan
ditambahkan metanol p.a sebanyak 2 mL. Ditutup dengan aluminium foil.
Kemudian dihomogenkan dengan vortex dan diinkubasi dalam ruangan gelap
selama 30 menit.
3.3.5.3Pembuatan Larutan Uji Ekstrak Umbi Talas Jepang
a. Pembuatan Larutan Uji Ekstrak Umbi Talas Jepang
Ditimbang sebanyak 50 mg ekstrak kemudian dilarutkan dengan
metanol pro analisa. Larutan dimasukkan ke dalam labu ukur 50 mL.Volume
dicukupkan dengan metanol pro analisa sampai tanda batas (1000 ppm).
Kemudian dari larutan induk dibuat seri konsentrasi 100 ppm, 300 ppm, 500
ppm, 700 ppm, dan 1000 ppm.
b. Pengukuran Serapan dengan Menggunakan Spekrofotometer
UV-Vis
Masing-masing konsentrasi larutan uji sebanyak 2 mL dimasukkan ke
dalam tabung reaksi. Ditambahkan larutan DPPH 0,1 mM sebanyak 2 mL,
dihomogenkan dengan vortex. Selanjutnya diinkubasi dalam ruangan gelap
selama 30 menit. Lalu diukur absorbansinya pada panjang gelombang 517 nm.
3.3.6 Pembuatan Mikroemulsi
3.3.6.1Uji Pendahuluan
Percobaan pendahuluan dilakukan untuk menentukan kondisi percobaan
jernih dan stabil. Dilakukan percobaan pembuatan mikroemulsi dengan span 80
dan tween 80 sebagai surfaktan dan propilen glikol, gliserin, PEG 400, dan etanol
sebagai kosurfaktan dengan berbagai variasi konsentrasi. Kondisi yang harus
diperhatikan dalam pembuatan sediaan mikroemulsi ini meliputi:
1. Konsentrasi kombinasi surfaktan (15-45%),
2. Kecepatan pengadukan (300, 500, 750, 1000, 1500 rpm),
3. Temperatur (suhu ruang (25 ± 2 ⁰C), 30-35 ± 2 ⁰C, dan 36-40 ± 2 ⁰C),
4. Lama pengadukan (10, 20, 30, dan 40 menit).
3.3.6.2Formulasi Mikroemulsi
Mikroemulsi yang akan dibuat terdiri dari minyak zaitun, vitamin E, span
80, tween 80, PEG 400, ekstrak umbi talas jepang, dan akuades. Adapun formula
mikroemulsi ekstrak umbi talas jepang yang diperoleh, terdiri dari:
Tabel 3.1 Formula Mikroemulsi Ekstrak Umbi Talas Jepang
No. Nama Bahan Konsentrasi
(%b/v)
Fungsi
1 Minyak Zaitun 48,5 Pembawa minyak
2 Vitamin E 0,5 Antioksidan untuk sediaam
3 Span 80 23 Surfaktan
4 Tween 80 15 Surfaktan
5 PEG 400 5 Kosurfaktan
6 Ekstrak Umbi Talas Jepang 3 Zat aktif
7 Akuades 5 Pelarut
Prosedur pembuatan dilakukan dengan cara masing-masing fase, yakni
fase minyak (minyak zaitun, vitamin E, dan span 80) dan fase air (ekstrak umbi
talas jepang, PEG 400, tween 80, dan akuades) dicampurkan didalam beaker glass
yang berbeda dengan menggunakan magnetic stirrer pada suhu 30-35 ± 2 ⁰C.
Setelah homogen, fase airdimasukan sedikit demi sedikit ke dalam fase minyak
dan diaduk dengan menggunakan homogenizer pada kecepatan ±750 rpm hingga
3.3.7 Evaluasi Fisik Mikroemulsi
3.3.7.1Pemeriksaan Organoleptik
Sediaan mikroemulsi diperiksa secara visual warna, homogenitas, dan
kosistensinya (Haneefa dkk,2012).
3.3.7.2Uji pH
Sebanyak 10 gram sediaan mikroemulsi diukur pH sediaan dengan
menggunakan alat potensiometrik (pH meter) pada suhu 25 ± 2 ⁰C (Sharma,
Sharma, Sandeep, Gupta, dan Bishnol, 2012).
3.3.7.3Uji Tipe Mikroemulsi
Dilakukan dengan menggunakan uji pengenceran, dengan cara
mengencerkan mikroemulsi dengan air. Jika mikroemulsi tercampur baik dengan
air, maka tipe mikroemulsi adalah minyak dalam air (m/a), sebaliknya jika air
yang ditambahkan membentuk globul pada mikroemulsi maka tipe mikroemulsi
adalah air dalam minyak (a/m) (Martin, Swarbrick, dan Cammarata, 2008).
3.3.7.4Penentuan Viskositas
Pengukuran dilakukan dengan Visco Tester 6R HAAKE pada temperatur
ruang (25 ± 2 ⁰C). Shear rates dan shear stress diaplikasikan pada sampel
sejumlah 150 gram dan akan menghasilkan reogram yang akan dibuat untuk
menentukan viskositas dan reologi sampel (Mortazavi, Pishrochi, dan Jafari azar,
2013).
3.3.7.5Pengukuran Bobot Jenis
Bobot jenis diukur dengan menggunakan piknometer pada suhu ruang.
Bobot piknometer kosong ditimbang pada suhu ruangan (A gram). Kemudian diisi
dengan air sampai penuh dan ditimbang (A1 gram). Air dikeluarkan dari
piknometer dan piknometer dibersihkan. Sediaan mikroemulsi diisikan dalam
piknometer sampai penuh dan ditimbang (A2 g). Bobot jenis sediaan diukur
dengan perhitungan sebagai berikut (Deepak dan Vedha Hari, 2013):
3.3.7.6Uji Stabilitas
Uji stabilitas dilakukan dengan cara menempatkan masing-masing sediaan
(150 gram) pada suhu tinggi (40 ± 2 ⁰C), kamar (25 ± 2 ⁰C), dan suhu rendah (4 ±
2 ⁰C) selama 1 bulan. Dilakukan pengamatan organoleptik setiap 2 minggu sekali
serta pengukuran pH dan viskositas pada hari terakhir (Lou, Qiu, Crill, Helms,
dan Almoazen, 2013; Fahima MH, Dalia, Mohamed, Aliaa, 2011; Fauzy, 2010).
3.3.7.7 Cyling test (Uji freeze-thaw)
Sampel sebanyak ±150 gram diuji kestabilannya secara bergantian pada
suhu dingin (4 ± 2 ⁰C) dan suhu tinggi (40 ± 2 ⁰C), masing-masing temperatur
diuji selama 24 jam. Uji dilakukan sebanyak 6 siklus, untuk diuji kestabilan
fisiknya. Dilakukan pengamatan organoleptik dan pengukuran pH pada sediaan
mikroemulsi setelah cyling test (Fauzy., 2012).
3.3.7.8Uji Sentrifugasi
Sediaan mikroemulsi (5 gram) dimasukan ke dalam tabung sentrifugasi
kemudian dilakukan sentrifugasi pada kecepatan 13.000 rpm selama 30 menit.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Determinasi Tanaman
Hasil determinasi tanaman yang dilakukan di Lembaga Ilmu Pengetahuan
Indonesia (LIPI), Bogor menyatakan bahwa tanaman yang digunakan adalah
benar talas jepang (Colocasia esculenta (L.)Schott) familiAraceae.Hasil
determinasi dapat dilihat pada lampiran 2.
4.2 Karakterisasi
Standardisasi atau karakterisasi merupakan proses penjaminan produk
akhir agar mempunyai nilai parameter tertentu yang konstan dan ditetapkan
terlebih dahulu (Helmi dkk, 2006). Standardisasi merupakan proses yang penting
untuk menjamin mutu dan keamanan bahan. Karakterisasi dilakukan terhadap
parameter spesifik, parameter non-spesifik, dan uji kelarutan.
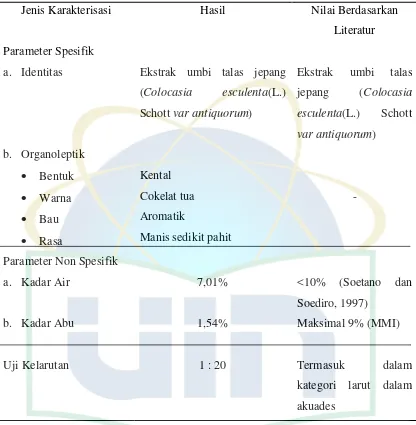
Parameter spesifik meliputi identitas dan organoleptik, yakni bentuk,
warna, bau, dan rasa sedangkan parameter non-spesifik yang diujikan yaitu kadar
air dan kadar abu. Hasil dari karakterisasi ekstrak umbi talas jepang dapat dilihat
Tabel 4.1 Hasil Karakterisasi Ekstrak Umbi Talas Jepang
Jenis Karakterisasi Hasil Nilai Berdasarkan
Literatur
(Colocasia esculenta(L.)
Schott var antiquorum)
Kental
kategori larut dalam
akuades
Berdasarkan hasil pengamatan diperolehidentitas dan organoleptikekstrak
adalah ekstrak umbi talas jepang (Colocasia esculenta(L.) Schott var
antiquorum)dengan warna cokelat tua, berbau khas aromatik, dan memiliki rasa
yang manis sedikit pahit. Rasa pahit dari ekstrak disebabkan dari kadaralkaloid
yang terdapat di dalamnya (Anam dkk, 2013).
Kadar airekstrak umbi talas jepang yang diperoleh sebesar 7,01%. Hal ini
telah sesuai dengan persyaratan dimana kadar air seharusnya adalah antara <10%
sehingga ekstrak umbi talas jepang dapat digunakan dalam formulasi mikroemulsi
(Soetarno dan Soediro, 1997). Jika kadar air terlalu tinggi akan memudahkan