71 FORMULASI BIOPESTISIDA BERBAHAN AKTIF JAMUR ENDOFITIK DAN BAKTERI RHIZOSFIR SPESIFIK LOKASI
LAHAN PASANG SURUT
UNTUK PENGENDALIAN PENYAKIT BUSUK PANGKAL BATANG PADI
(Rhizoctonia solani)
Ismed Setya Budi, Mariana dan Ismed Fachruzi Fakultas Pertanian Unlam Banjarbaru
e-mail: isb_unlam@yahoo.co.id
ABSTRAK
Penelitian ini bertujuan untuk menguji keampuhan kombinasi bakteri rhizosfir dan jamur endofitik spesifik lokasi lahan pasang surut terhadap tingkat ketahanan tanaman padi akibat penyakit busuk pangkal batang (Rhizoctonia solani) di lahan pasang surut. Hasil uji berpasangan terlihat bahwa daya hambat jamur T. viride PS-2.1 (88,00%), dan FNP PS-1.5 (77,98%), sedangkan dari kelompok bakteri; P. flourescent PS-4.8 (65,80%), dan Bacillus sp. PS-3.14 (52,00%). Hasil uji daya antagonis di rumah kaca, menunjukkan bahwa aplikasi antagonis ke dalam tanah satu minggu sebelum tanam dan ditambah dengan cara perendaman benih selama 24 jam sebelum tanaman, ternyata pada kombinasi FNP PS-1.5 + P. flourescen PS-4.8 intensitas penyakit hanya 10,00% dengan tinggi tanaman 52,20 cm, sedangkan pada kombinasi T. viride 2.1 + P. flourescent PS-4.8 intensitas penyakit 10,47% dengan tinggi tanaman 69,29 cm. Berdasarkan hasil uji di lapang ternyata pada fase taradak, ampak dan lacak menunjukkan bahwa aplikasi formulasi terbaik adalah T. viride PS-2.1 + P. fluorescens PS-4.8 dengan intensitas penyakit 8,73%, 10,40% dan 5,00% dengan tinggi tanaman masing-masing 24,15 cm, 44,17 cm dan 64,15 cm. Intensitas penyakit tertinggi pada fase ampak dengan perlakuan FNP PS-1.5 + Bacillus sp. PS-3.14 sebesar 23,28%. Dari hasil uji viabilitas menunjukkan bahwa antagonis berada dalam batang dan akar tanaman padi, sehingga dapat direisolasi kembali saat tanaman dipanen.
Ismed et al. Semnas Pestisida Nabati IV, Jakarta 15 Oktober 2011
PENDAHULUAN
Pengendalian hayati penyakit tanaman menggunakan mikroba antagonis terus berkembang pesat seiring dengan makin meningkatnya kebutuhan dan tantangan untuk menyediakan pangan yang sehat dan berkualitas.
Penggunaan endofitik antagonis sebagai alternatif pengendalian yang mampu mengendalikan perkembangan penyakit secara efektif, efisien dan aman terhadap lingkungan, perlu terus dikembangkan untuk menjawab tantangan masa depan.
Penyakit busuk pangkal batang padi akibat Rhizoctonia solani menjadi masalah utama pada penanaman padi di lahan pasang surut Kalimantan Selatan. Intensitas penyakit terus meningkat akibat pengendalian menggunakan pestisida sintetis mengalami kendala karena kondisi lahan yang kadang tergenang (Budi dan Mariana, 2007). Kegagalan pengendalian juga akibat di dalam tanah pestisida sintetis mengalami pencucian, fiksasi oleh liat, dan perombakan oleh mikroorganisme tanah tertentu menjadi derivat yang tidak efektif (Bollen 1961; Frissel dan Bolt 1962). Bahkan pada sistem penanaman varietas lokal di lahan pasang surut dengan tiga kali pemindahan (taradak, ampak dan lacak) mengakibatkan penggunaan pestisida kurang efisien (Budi et al. 2010).
Penggunaan gabungan beberapa antagonis mampu lebih baik dibanding hanya menggunakan antagonis secara tunggal, namun hasilnya tidak menentu karena dipengaruhi oleh kondisi lingkungan dan waktu aplikasi (Yigit dan Dikilitas 2007). Penelitian menggunakan Trichoderma spp. dan Gliocladium sp. memperoleh hasil yang optimal untuk mengendalikan patogen tular tanah dan udara bila aplikasi dilakukan pada saat populasi inokulum patogen masih rendah (Cook dan Baker 1983). Oleh sebab itu, waktu aplikasi yang tepat perlu dipelajari.
Penelitian ini bertujuan untuk mempelajari pengaruh aplikasi formulasi mikroba antagonis pada penanaman padi di lahan pasang surut terhadap pertumbuhan tanaman dan penekanan perkembangan patogen busuk pangkal batang (R. solani).
73 METODE PENELITIAN
Isolasi dan perbanyakan agens antagonis
Isolasi antagonis dilakukan dengan mengambil tanaman sampel dari tanaman sehat yang berada di areal pertanaman padi yang terinfestasi R. solani. Isolasi endofitik dari akar dan pangkal batang tanaman padi sesuai menurut prosedur Homby (Tuite 1970) dan dilanjutkan dengan metode teknik cawan pengenceran (dilution plate technique) pada tingkatan 10-4
sampai 10-6. Isolasi bakteri Pseudomonas kelompok fluorescens
menggunakan media selektif Sands dan Rovira (1970) dengan prosedur isolasi menurut Bashan et al. (1993). Setiap Pseudomonas kelompok fluorescens yang diperoleh kemudian diuji menurut metode Dhingra dan Sinclair (1995).
Uji in-vitro daya hambat antagonis terhadap R. solani dan uji
kesesuaian kombinasi antagonis
Uji dilakukan pada media agar dengan cara menginokulasikan isolat yang ada secara berpasangan dalam cawan petri berdiameter 9 cm2. Isolat
yang akan diuji diambil dari biakan yang sudah berumur tujuh hari dan diambil menggunakan pelubang gabus (cork borrer) berdiameter 3 mm dengan jarak masing-masing 3 cm dari tepi cawan Petri (Gambar 1).
* * A B
Gambar 1. Peletakan Kedua Isolat dalam Cawan Petri. A = isolat jamu Endofitik/ bakteri, dan B = isolat patogen
Perhitungan daya penghambatan dilakukan dengan menggunakan rumus Fokhema et al. (1959);
I = ( r1 - r2 ) (r1)-1 x 100 Keterangan:
I = persentase penghambatan
r1 = jari-jari koloni A yang tumbuh ke arah berlawanan dengan tempat B
Ismed et al. Semnas Pestisida Nabati IV, Jakarta 15 Oktober 2011
Uji in-vivo Kemampuan Isolat Antagonis Menekan Penyakit Busuk Batang
Uji in vivo dilakukan di rumah kaca pada kondisi tanah steril dan di lahan petani yang sudah terinfeksi penyakit busuk pangkal batang. Inokulasi patogen di rumah kaca dilakukan pada tanaman padi berumur tiga minggu, sedangkan aplikasi antagonis sesuai perlakuan. Pengamatan dilakukan tiga minggu kemudian pada tiap fase penanaman (taradak, ampak dan lacak) dengan menghitung jumlah tanaman yang layu atau bergejala busuk pangkal batang dan mengukur tinggi tanaman.
Semua perlakuan diuji dengan rancangan lingkungan acak kelompok dengan lima ulangan pada tiap perlakuan. Untuk mengetahui pengaruh antar perlakuan dilakukan uji beda nilai tengah Duncan (DMRT) taraf uji 5%.
HASIL DAN PEMBAHASAN
Hasil isolasi mikroba pada empat tipe lahan pasang, secara akumulatif ditemukan sebanyak 98 koloni dan diantaranya terdapat 14 koloni bakteri, sedangkan hasil isolasi endofit dari pangkal batang tanaman padi ditemukan 17 koloni jamur. Hal ini membuktikan bahwa lahan sawah pasang surut yang kadang tergenang akibat pengaruh langsung dari pasang surutnya air laut memiliki mikroba yang berbeda. Dengan demikian, masing-masing tipe lahan memiliki ekosistem yang khas sehingga macam dan jumlah mikroba dominan juga berbeda.
Berdasarkan hasil uji daya hambat secara berpasangan terhadap semua isolat yang ada, terbukti semua isolat mampu menghambat pertumbuhan patogen R. solani. Isolat yang mempunyai kemampuan daya hambat tertinggi adalah End 2.1 (Trichoderma viride PS-2.1) sebesar 88,00%, dan isolat End 1.5 (Fusarium non-patogen PS-1.5) sebesar 77,98%. Pada kelompok bakteri rhizosfir, kemampuan tertinggi pada isolat Bak 4.8 (Pseudomonas fluorescent PS-4.8) sebesar 65,80% sedangkan isolat Bak 3.14 (Bacillus sp PS-3.14) sebesar 52,00%.
Dari hasil uji kesesuaian kemungkinan pasangan isolat, terbukti ada empat kombinasi pasangan yang tepat yakni (T. viride PS-2.1+ P. fluorescens PS-4.8), (FNP PS-1.5 + P. fluorescens PS-4.8), (T. viride PS-2.1 + Bacillus sp.) dan pasangan (FNP PS-1.5 + Bacillus sp PS-3.14).
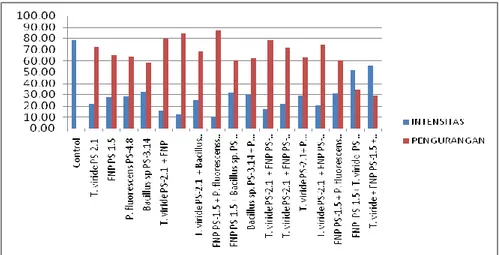
75 Penggunaan antagonis secara tunggal maupun dengan kombinasi terbukti mampu menghambat perkembangan patogen busuk pangkal batang padi. Dibanding dengan kontrol terjadi pengurangan penyakit berkisar antara 29,22 – 87,29%, dan kombinasi terbaik adalah penggunaan pasangan T. viride PS-2.1 + P. fluorescens PS-4.8 (84,50%) dan FNP PS-1.5 + P. fluorescens PS-4.8 (87,29%). Penggunaan gabungan beberapa antagonis akan mampu meningkatkan daya hambat terhadap perkembangan penyakit busuk pangkal batang padi. Guetsky et al. (2001) menyatakan bahwa kombinasi antagonis yang tepat mampu meningkatkan daya hambat terhadap penyakit.
Hasil uji waktu aplikasi menunjukkan bahwa penggunaan antagonis akan lebih efektif apabila aplikasi ke tanah dilakukan satu minggu sebelum tanam dan ditambah dengan perendaman benih selama 12 jam sebelum tanam dalam suspensi antagonis dengan kerapatan 105 konidia/ml, dimana
aplikasi kombinasi (T. viride PS-2.1+ P. fluorescens PS-4.8) mampu mengurangi serangan sebesar 84,50% sedangkan aplikasi kombinasi (FNP PS-1.5 + P. fluorescens PS-4.8) sebesar 87,29%. Namun aplikasi gabungan empat macam antagonis (T. viride + FNP PS-1.5 + P. fluorescens PS-4.8 + Bacillus sp. PS-3.14) terjadi pengurangan hanya 29,22% (Tabel 1).
Hasil penelitian ini sama dengan yang pernah dilakukan Yigit dan Dikilitas (2007), bahwa penggunaan (FNP + P. fluorescent) dan (T. harzianum T-22 + P. fluorescent) pada uji laboratorium menunjukkan kemampuan yang terbaik menghambat perkembangan Fusarium oxysporum f.sp. lycopersici Snyder dan Hansen dibanding hanya menggunakan satu jenis. Bahkan sebelumnya Fuchs et al. (1999) dan Alabouvette et al (1993) sudah membuktikan bahwa kombinasi Fusarium isolat Fo47 + dan P. fluorescent strain C7 terbaik dalam menghambat perkembangan layu fusarium pada tomat. Aplikasi gabungan antara P. fluorescent dan Bacillus subtilis pada uji di tanah steril menunjukkan kemampuan daya hambat yang lebih baik dibanding aplikasi hanya satu jenis secara tunggal karena kedua bakteri mampu bekerja secara sinergis (Janisiewiez et al. 1988).
Ismed et al, Prosiding Semnas Pesnab IV, Jakarta, 15 Oktober 2011
Gambar 2. Pengaruh perlakuan terhadap intensitas penyakit akibat R. solani Kemampuan Trichoderma spp memang sudah banyak diteliti yang menunjukkan adanya mekanisme kerja dari enzim seperti β-1-3 glucanases dan β-1-4 glucanases. Trichoderma juga mampu menghasilkan zat antibiosis, dapat memacu perkembangan ketahanan (induced resistance) dan kemampuannya berkompetisi ruang dan nutrisi dibanding patogen. Namun yang tidak kalah pentingnya jamur ini mampu meningkatkan kesuburan tanah, terbukti dengan adanya penambahan tinggi tanaman baik pada saat fase taradak, ampak maupun lacak (Tabel 1). Keberadaan jamur antagonis disamping mampu menekan perkembangan penyakit, juga mampu sebagai penyedia unsur hara bagi pertumbuhan tanaman (Altomare et al. 1999; Hanson dan Howell 2004; Harman 2006).
Kemampuan FNP tidak kalah dibanding Trichoderma sp menurut Benhamou et al. (2002) karena ke-mampuannya mengkoloni permukaan akar tanaman dengan cepat sehingga menjadi pelindung bagi gangguan patogen, namun menurut Tamietti et al. (1993) justru yang lebih berperan karena kemampuannya menghasilkan enzym kitinase, β-1-3 glucanase dan 1-4 glucosidase, bahkan ditambahkan oleh Thomashow dan Weller (1996) akibat beberapa faktor seperti adanya toksin, antibiotik dan siderofor.
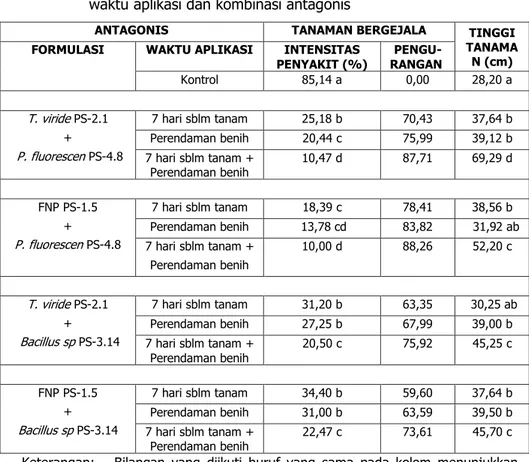
77 Tabel 1. Intensitas penyakit busuk pangkal batang padi pada perlakuan
waktu aplikasi dan kombinasi antagonis
ANTAGONIS TANAMAN BERGEJALA TINGGI
TANAMA N (cm)
FORMULASI WAKTU APLIKASI INTENSITAS
PENYAKIT (%) RANGAN
PENGU-Kontrol 85,14 a 0,00 28,20 a T. viride PS-2.1 + P. fluorescen PS-4.8 7 hari sblm tanam 25,18 b 70,43 37,64 b Perendaman benih 20,44 c 75,99 39,12 b 7 hari sblm tanam + Perendaman benih 10,47 d 87,71 69,29 d FNP PS-1.5 + P. fluorescen PS-4.8 7 hari sblm tanam 18,39 c 78,41 38,56 b Perendaman benih 13,78 cd 83,82 31,92 ab 7 hari sblm tanam + Perendaman benih 10,00 d 88,26 52,20 c T. viride PS-2.1 + Bacillus sp PS-3.14 7 hari sblm tanam 31,20 b 63,35 30,25 ab Perendaman benih 27,25 b 67,99 39,00 b 7 hari sblm tanam + Perendaman benih 20,50 c 75,92 45,25 c FNP PS-1.5 + Bacillus sp PS-3.14 7 hari sblm tanam 34,40 b 59,60 37,64 b Perendaman benih 31,00 b 63,59 39,50 b 7 hari sblm tanam + Perendaman benih 22,47 c 73,61 45,70 c Keterangan: Bilangan yang diikuti huruf yang sama pada kolom menunjukkan
tidak berbeda pada taraf 5% uji DMRT
Penggunaan variasi kombinasi antagonis terbukti mampu meningkatkan daya antagonis dan menambah kesuburan tanaman. Hasil ini sama seperti pengujian yang dilakukan oleh Duijff et al. (1998) yang memperlihatkan bahwa terjadi sinergistik pada penggunaan kombinasi antara Pseudomonas fluorescent WCS417 + FNP sehingga mampu menghambat perkembangan patogen layu fusarium dengan lebih baik dibanding secara tunggal. Alabouvette et al. (2003) berhasil mengurangi variabilitas pengendalian pada kondisi lingkungan berbeda dengan menggunakan dua macam antagonis yaitu F. oxysporum avirulen digabungkan dengan Pseudomonas kelompok fluorescens dalam
Ismed et al, Prosiding Semnas Pesnab IV, Jakarta, 15 Oktober 2011
mengendalikan penyakit layu pada berbagai tanaman. Kombinasi beberapa isolat bakteri antagonis dengan jamur Trichoderma hamatum lebih efektif menekan penyakit disebabkan R. solani dibandingkan dengan hanya satu jenis isolat antagonis (Kwok et al. 1987).
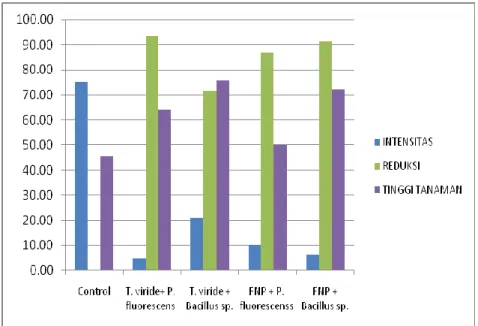
Gambar 3. Intensitas penyakit dan tinggi tanaman padi setelah aplikasi antagonis di lahan pasang surut
Kemampuan dari FNP menghambat perkembangan beberapa penyakit pernah dikemukakan Weller (1988), mekanisme pertahanan tanaman yang dipicu oleh suatu imbasan tertentu seperti adanya agens antagonis yang bersifat endofit. Informasi sebelumnya pernah dikemukakan oleh Loon et al. (1998) bahwa sebagai agen induksi resistensi (induced resistance) yang dapat memicu pertahanan tanaman dapat berupa bahan kimia tertentu, mikroorganisme non-patogen, patogen virulen atau ras inkompatibel.
Kemampuan jamur endofit mengambat perkembangan patogen karena mekanisme antibiosis, kompetisi dan mikoparasit. Ozbay dan Newman (2004) membuktikan bahwa jamur Trichoderma spp mampu mengakumulasi CO dalam kompetisinya mendapatkan ruang dan nutrisi,
79 bahkan pada T. harzianum strain T24 mampu menghasilkan enzim selulose berupa 1,3-glukanase satu jam setelah inokulasi. Pada strain SC164, SC 167 dan SC 168 yang diuji di rumah kaca mampu menghambat serangan R. solani pada tomat karena menghasilkan enzim khitinasi dan glukanase.
Dengan demikian, jamur endofit dari dalam batang tanaman dan bakteri dari rhizosfir tanah sekitar akar, setelah diperbanyak dan dilepas kembali ke daerah perakaran tanaman merupakan usaha konservasi lingkungan rhizosfir yang akan memberikan prospek cerah dalam usaha konservasi lingkungan secara hayati. Navi dan Bandyopadhyay (2002) menyatakan aplikasi lahan pertanaman jahe dengan penambahan (augment) jamur rhizosfir asal tanaman seperti T. viride, maka akan terjadi resistensi berkelanjutan karena terjadi kelimpahan jamur antagonis yang mampu melindungi tanaman terhadap patogen penyebab tanaman layu. Demikian pula, aplikasi T. viride pada tanaman pisang mampu mencegah penyakit layu akibat Fusarium sp. (Getha dan Vineswary 2002).
KESIMPULAN
Kombinasi formulasi terbaik adalah menggunakan T. viride + P. fluorescen atau FNP + P. fluorescen.
Waktu aplikasi antagonis terbaik adalah pmberian ke tanah 7 hari sebelum tanam dan ditambah dengan cara perendaman benih selama 24 jam sebelum tanaman.
Antagonis T. viride, FNP, P. flurichoderma sp bukan hanya sebagai biopestisida yang efektif untuk penyakit busuk pangkal batang pada padu tapi juga dapat sebagai biofertilizer karena terbukti mampu meningkatkan pertumbuhan tanaman
Perlu dilakukan pengujian biopestisida terhadap penyakit busuk batang pada tanaman lain seperti kedelai, tomat, jagung dan kelapa sawit, mengingat semua tanaman tersebut sering pula ditanam di lahan pasang surut
Ucapan terima kasih: Terima kasih diucapkan kepada Direktorat Jenderal pendidikan Tinggi
Kementerian Pendidikan Nasional yang telah memberikan bantuan dana penelitian melalui Hibah Bersaing tahun 2010/2011
Ismed et al, Prosiding Semnas Pesnab IV, Jakarta, 15 Oktober 2011
DAFTAR PUSTAKA
Alabouvette, C.,P. Lemanceuau dan C. Steinberg. 1993. Recent advances in the biological control of Fusarium wilt. Pestic. Sci., 37:365-373
Altomare, C., W.A. Norvell, T. Bjbrkmar dan G.E. Harman. 1999. Solubilization of phosphates dan micronutriens by the plant growth promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-22. Applied Environ. Microbiol, 65: 2926-2933.
Baker, K.F. dan R.J. Cook. 1996. The nature and Practice of Biological Control of Plant Pathogen 3nd . The Amer. Phytopathol. Soc. pp. 367
Benhamou,N., C. Garand dan A Goulet. 2002. Ability of Nonpathogenic Fusarium oxysporum Strain Fo47 to Induce resistence aggainst Pythium ultimum infection in cucumber. Applied Environ. Microbiol.68:4044-4060 Budi, I.S. dan Mariana. 2007. Upaya pengendalian penyakit layu padi di lahan
pasang surut Kalimantan Selatan dengan memanfaatkan antagonis dan pestisida botanis . Fakultas Pertanian Unlam Banjarbaru.
Budi, I.S. dan Mariana. 2009. Formulasi biopestisida berbahan aktif jamur Endofitik untuk pengendalian penyakit busuk batang padi (Rhizoctonia solani). Fakultas Pertanian Unlam Banjarbaru.
Cook, R.J. & K.F. Baker. 1983. The Nature and Practice of Biological Control of Plant Pathogens. APS Press, St. Paul, MN, USA.
Duijff, B.J., D. Pouhair, C. Olivain, C. Alabouvette dan P. Lemanceau. 1998. Implication of systemic induced resistance in the suppresion of fusarium wilt of tomato by Pseudomonas fluorescens WCS417r and by nonpathogenic Fusarium oxysporum Fo47. Eur. J. Palnt Pathol. 104: 903-910.
Dhingra,O.D. & J.B. Sinclair. 1995. Basic Plant Pathology Methods. Second edition. CRC Press, Inc., Boca Raton.
Fokkema, N.J., J.H. Bond dan H.A. Fribourg. 1959. Methods for Studying Soil Microflora Plant Disease Relationships. Burgess Publ. Co. USA. pp. 247. Fuchs, J.G., Y. Moenne-Loccoz dan G. Defago. 1999. Nonpathogenic Fusarium
oxysporum strain Fo47 to protect tomato against Fusarium wilt. Bio. Control, 4:105-110 in tomato
81 Agents to reduce the variability of biological control. Phytopathol 91: 621-627.
Howell, C.R. dan Stipanovic. 1995. Mechanisms in the control of Rhizoctonia solani induced cotton seedling disese by Gliocladium virens antibiosis. Phytopathol. J. 85:469-472
Hanson, L.E. dan C.R. Howell. 2004. Elicitors of plant defense responses from biocontrol strains of Trichoderma virens. Phytopathol. 94:171-176. Harman G.E. 2006. Overview of mechanisms and uses of Trichoderma spp.
Phytopatol. 96:190-194
Kwok, O. C. H., Gahy, P. C., Hoitink, H. A. J., dan Kuter, G. A. 1987. Interactions Between bacteria and Trichoderma hamatum in uppression of Rhizoctonia damping-off in bark compost media. Phytopathology 77:1206-1212.
Menge, J.A. & L.W. Timmer. 1982. Procedures for inoculation of plants with vesicular-arbuscular mycorrhizae in the laboratory, greenhouse and field. pp. 59-68 In. N.C.Schenck (Ed.). Methods and Principles of Mycorrhizal Research. American Phytopathological Society, St. Paul.
Nel, B., C. Steinberg, N. Labuschagne dan A. Vilioen. 2006. The potential of non-pathogenic Fusarium oxysporum and other biological control organisms for suppressing fusarium wilt of banana. Plant Pathol. Journal, 1(55):217-223
Ozbay, N dan S. Newman. 2004. Biocontrol with Trichoderma spp with emphasis on T. harzianum. Pakistan Journal of Biological Science 7(4):478-484
Sands, D.C. & A.D. Rovira. 1970. Isolation of fluorescent pseudomonads with a selective medium. Applied Microbiology 20: 513-514.
Thomashow,L.S. dan D.M. Weller. 1996. Current concepts in the use of introduced bacteria for biological disease control: Mechanisms and antifungal metabolites. In: Plant-Microbe Interactions. Stacey, G., dan N.T. Keen (Eds) New York: Chapman and Hill. Pp:236-271.
Tuite, J. 1970. Plant Pathological Method Fungi and Bacteria. Burgess Publ. Co. Minneapolis. pp. 232
Ismed et al, Prosiding Semnas Pesnab IV, Jakarta, 15 Oktober 2011
Von Alten, H., A. Lindemann dan F. Schönbeck. 1993. Stimulation of vesicular arbuscular mycorrhiza by fungicides or rhizosphere bacteria. Mycorrhiza 2 :
Weller, D. M. 1988. Biological control of soilborne plant pathogens in the rhizosphere with bacteria. Annu. Rev. Phytopathol. 26:379-407.
Yigit, F dan M. Dikilitas. 2007. Control of Fusarium wilt of tomato by combination of Fluorescent Pseudomonas, Non-pathogen Fusarium and Trichoderma harzianum T-22 in Greenhouse Conditions. Plant Pathol. Journal 6: 159-163