Bahan ajar mata kuliah
TEKNOLOGI PENCEGAHAN KOROSI
Wahyu Budi Utomo
JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI UJUNG PANDANG MAKASSAR, 2008
LEMBAR PENGESAHAN
Mata Kuliah : Teknologi Pencegahan Korosi
Kode :
Dosen Penyusun : Wahyu Budi Utomo, MSc
Buku ajar ini telah diperiksa dan disetujui untuk digunakan sebagai bahan kuliah bagi mahasiswa
Politeknik Negeri Ujung Pandang Menyetujui
Ketua Unit P3AI Ketua Jurusan
Teknik Kimia,
B a h r i, SE, Msi Ir. Swastanti Brotowati, MSi
NIP: 132052853 NIP: 131 856648
Mengetahui/Menyetujui Pembantu Direktur I
Ir. Muhammad Anshar, MSi NIP: 131 856 651
KATA PENGANTAR
Puji syukur kehadirat Allah SWT oleh karena atas limpahan rahmad dan hidayahNya sehingga bahan ajar mata kuliah Teknologi Pencegahan Korosi ini dapat terselesaikan sesuai waktu yang telah ditentukan. Bahan ajar ini disusun berdasarkan kurikulum pada program studi Teknik Kimia Politeknik Negeri Ujung Pandang.
Kami sadari bahwa bahan ajar ini masih jauh dari kesempurnaan, oleh karena itu kritik dan saran sangat diharapkan demi perbaikan di masa yang akan datang.
Atas bantuan semua pihak dalam penyelesaian bahan ajar ini tak lupa kami ucapkan terima kasih.
Semoga bahan ajar ini dapat bermanfaan bagi semua pihak.
Makassar, September 2008
DAFTAR ISI BAB I Prinsip Dasar Korosi
1. Definisi
2. Karakter Elektrokimia Korosi 3. Jenis Korosi
BAB II Potensial Elektroda 1. Potensial elektroda 2. Diagram Potensial/pH 3. Pengukuran Potensial BAB III Kinetika Korosi
1. Hukum Faraday
2. Exchange Current Density 3. Polarisasi Elektrokimia 4. Polarisasi Konsentrasi BAB IV Dasar Proteksi Katodik
1. Konsep Dasar Proteksi Katodik 2. Potensial Proteksi
3. Kriteria Proteksi Katodik BAB V Aplikasi Proteksi Katodik
1. Struktur yang Dapat Diproteksi
2. Sistem Anoda Korban dan Arus Tanding 3. Keperluan Arus Proteksi
4. Rancang Bangun Proteksi Katodik BAB VI Rancang Bangun Sistem Anoda Korban
1. Contoh Rancang Bangun 2. Keperluan Arus Proteksi 3. Tipe, Berat dan Jumlah Anoda 4. Keluaran Arus Anoda
5. Pemasangan 6. Pengujian
DAFTAR ISI
HALAMAN JUDUL i
HALAMAN PENGESAHAN ii
KATA PENGANTAR iii
DAFTAR ISI iv
DAFTAR GAMBAR DAFTAR TABEL
KONTRAK PERKULIAHAN
BAB I. PRINSIP DASAR KOROSI 1
1.1 Pendahuluan 1
1.2 Penyajian 1
1.3 Penutup 10
BAB II POTENSIAL ELEKTRODA 13
2.1 Pendahuluan 13
2.2 Penyajian 13
2.3 Penutup 22
BAB III KINETIKA KOROSI 25
3.1 Pendahuluan 25
3.2 Penyajian 25
1. Hukum Faraday 26
2. Polarisasi Elektrokimia 27
3.3 Penutup 32
BAB IV. DASAR PROTEKSI KATODIK 34
4.1 Pendahuluan 34
4.2 Penyajian 34
1. Konsep Dasar Proteksi Katodik 35
2. Potensial Proteksi 36
BAB V. APLIKASI PROTEKSI KATODIK 41
4.1 Pendahuluan 41
4.2 Penyajian 42
1. Struktur yang Dapat Diproteksi Katodik 42
2. Sistem Anoda Korban vs Arus Tanding 43
3. Keperluan Arus Proteksi 44
4. Rancang Bangun Proteksi Katodik 48
BAB VI. RANCANG BANGUN SISTEM ANODA KORBAN 51
6.1 Pendahuluan 51
6.2 Penyajian 52
1. Contoh Rancang Bangun 52
2. Keperluan Arus Proteksi 53
3. Tipe Berat dan Jumlah Anoda Mg 53
4. Keluaran Arus Anoda 55
5. Pemasangan 57
6. Pengujian 58
BAB VII. RANCANG BANGUN SISTEM ARUS TANDING 67
7.1 Pendahuluan 67
7.2 Penyajian 67
1. Proteksi Katodik dengan Sistem Arus Tanding 67
7.3 Penutup 74
DAFTAR GAMBAR
Gambar 1.1 Ilustrasi Proses Korosi 4
Gamabr 1.2. Korosi Merata 5
Gambar 1.3. Korosi Galvanik 5
Gambar 1.4. Korosi Celah 6
Gambar 1.5. Korosi Sumuran (Pitting Corrossion) 7 Gambar 1.6. Korosi Rek Tegang (Stress Corrossion Cracking) 7 Gambar 1.7. Kerusakan oleh Hidrogen (Hydrogen Embritlement) 8 Gambar 1.8. Korosi Antar Butir (Intergranullar Corrossion) 9 Gambar 2.1 Struktur permukaan elektroda ekivalen kapasitor listrik. 13 Gambar 2.2 Diagram potensial/pH Kesetimbangan Air 17 Gambar 2.3 Diagram Pourbaix untuk aluminium dan besi 19
Gambar 3.1 Potensial Korosi Logam 27
Gambar 3.2 Overpotensial Aktivasi atau Tavel Plot. 28
Gambar 3.3 Pasivity 29
Gambar 3.4 Distribusi Konsentrasi H+ Pada Permukaan Logam 29
Gambar 4.1 Logam Terkorosi 34
Gambar 4.2 Prinsip Proteksi Katodik 35
Gambar 4.3 Potensial Korosi Logam 36
Gambar 4.4 Potensial Proteksi 37
Gambar 4.5 Urutan nilai poytensial elektroda pembanding 38
Gambar 6.1 Pemasangan Anoda Mg 57
Gambar 6.2 Sketsa pemasangan anoda dengan jarak ~110 m (non-skala) 58 Gambar 6.3 Pemasangan kabel pada anoda dengan kotak uji 59
BAB I
PRINSIP DASAR KOROSI
1.1 Pendahuluan Deskripsi singkat.
Pada sesi peretemuan ini diharapkan mahasiswa dapat menerangkan tentang kerugian yang diakibatkan oleh korosi, definisi korosi, karakteristik elektrokimia korosi, dan jenis-jenis korosi.
Relevansi.
Berbagai jenis korosi terjadi di sekitar lingkungan tanpa disadari telah mengakibatkan kerugian sangat besar. Bab ini Sangay relevan dengan mata kuliah teknologi nimia karena korosi juga terjadi di lingkungan industri dan satuan-satuan opereasi teknik kimia.
Setelah mengikuti matakuliah ini mahasiswa dapat menjelaskan tentang dasar-dasar korosi, definisi, jenis korosi,
1.2 Penyajian
Korosi terjadi di banyak bagian dari kehidupan manusia, kendaraan, alat rumah tangga, industri, pesawat terbang, struktur jembatan, baja beton semua mengalami korosi dan biaya mahal untuk mencegah.
Korosi merupakan pemborosan biaya. Untuk menghasilkan logam, diperlukan biaya besar. Oleh karena itu kerusakan logam adalah suatu kehilangan biaya. Lebih-lebih kalau logam tersebut belum melakukan fungsinya dalam melayani manusia. Hal seperti ini banyak dialami di Indonesia (konstruksi yang dibangun tetapi tidak bekerja).
Berdasarkan penelitian-penelitian Biaya korosi Indonesia diperkirakan ~ 2 milyar dolar / th.(1996). Biaya korosi dapat dihemat 20 - 25 % bila teknologi anti korosi diterapkan dengan benar.
Di Indonesia, ditinjau dari segi penerapan teknologi anti korosi yang dapat dikatakan masih belum memadai, penghematan lebih dari 25 % mungkin dapat dicapai.
Bila dianggap 25% dapat dihemat, ini berarti :
25 % x $ 2.000.000.000 = $ 500.000.000 per tahun
Oleh karena itu setiap usaha pengendalian korosi seharusnya digalakkan dan didukung. Usaha ini dapat dilakukan melalui : Pendidikan, Kursus, Workshop, Seminar, Pelatihan dll.
Kerugian dapat pula bersumber dari;
Plant down Time. Kerugian karena penghentian produksi jauh lebih besar dari pada kerugian karena penggantian alat yang terkorosi.
Loss of Product. Kebocoran tangki dan pipa sangat merugikan dan biaya besar. Kebocoran dan tumpahan juga berbahaya bagi lingkungan dan masyarakat. Banyak kebocoran tangki bahan bakar harus diperbaiki untuk mencegah kejadian berulang dan mencegah pencemaran.
Loss of Efficiency. Akumulasi produk corosi di dalam perpipaan menurunkan efisiensi pertukaran panas dan menurunkan kapasitas pompa.
Contaminasi. Produk korosi yang dapat larut bias mencemari proses produksi. Korosi pipa air melepas produk korosi mencemari air konsumsi masyarakat.
Overdesign. Tanpa adanya informasi laju korosi, overdesign diperlukan untuk menjamin usia pabrik, akibatnya pemborosan material dan membutuhkan daya lebih besar untuk penggerak bagian-bagian bergerak dalam pabrik. Kadang para engineer mengabaikan informasi korosi yang telah tersedia.
1. Definisi
Korosi adalah dampak destructive suatu reaksi kimia antara logam atau alloy dengan lingkungan. Sejumlah energi yang dibutuhkan untuk mengekstrak logam dari mineralnya dilepaskan pada reaksi kimia korosi.
Korosi mengembalikan logam ke keadaannya di dalam senyawa kimia yang sama bahkan identik dengan mineral asal logam tersebut. Jadi Korosi juga disebut sebagai reaksi balik dari metalurgi ekstractif.
Banyak ion non-logam, seperti keramik, terdiri atas logam yang memiliki formasi ikatan dengan ion-ion reaktif lain seperti oksida dan silikat bersifat tidak reaktif. Begitu pula polimer juga tidak reaktif karena ikatan kovalen sangat stabil. Degradasi material semacam ini oleh suhu atau keausan mekanis tidak termasuk korosi.
2. Karakter Elektrokimia Korosi Aqueous
Reaksi korosi melibatkan perpindahan muatan elektronik dalam larutan aqueous. Reaksi Elektrokimia.
Korosi antara Seng dan asam klorida disimbolkan dengan raksi overall berikut ini;
Zn + 2 HCl ZnCl2 + H2 [1-1]
Seng berreaksi dengan larutan asam membentuk seng klorida dan melepaskan hydrogen di permukaan. Reaksi seperti ini dipakai untuk pembersihan permukaan dan acid pickling untuk logam dan alloy. Dalam bentuk ionic, reaksi adalah;
Zn + 2H+ + 2Cl- Zn2+ + 2Cl- + H 2
Hilangkan 2Cl- di kanan dan kiri reaksi, menjadi
Zn + 2H+ Zn2+ + H
2 [1-2]
Reaksi [2] dapat dipisah sbb;
2H+ + 2e- H
2 reaksi katodik [1-4]
Jika electron disuplai dari sumber luar ke logam, laju korosi atau reaksi anodic [3] menurun, sedangkan laju reaksi pelepasan hydrogen [4] meningkat.
Pemberian potensial negative pada logam selalu menurunkan laju korosi. Ini adalah dasar PROTEKSI KATODIK untuk perpipaan, instalasi pengeboran minyak, bangunan dan tangki bawah tanah.
Secara umum REAKSI ANODIK adalah sbb;
M Mn+ + ne- [-5]
Sedangkan REAKSI KATODIK biasanya melibatkan; reduksi ion hydrogen [4] dalam larutan asam,
2H+ + 2e- H 2
reduksi ion yang telah teroksidasi, contoh reduksi oin ferric menjadi ferrous, Fe3+ + e- Fe2+
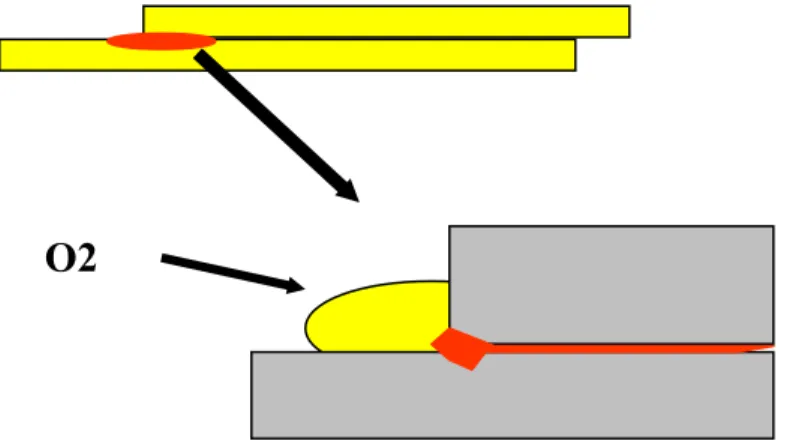
Reduksi oksigen terlarut, O2 + 2H2O + 4e- 4OH
Gambar 1.1 Ilustrasi Proses Korosi
e K e e H2 H+ M++ M ++ M++ H+ H+ H+ A
3. Jenis Korosi
Korosi merata. (Uniform Corrosion)
Pelepasan logam dari permukaan secara merata sangat biasa terjadi. Korosi jenis ini terjadi jika logam punya komposisi seragam, lingkungan seragam.
Serangan korosi bentuk ini merata di seluruh permukaan, yang mudah sekali dilihat, dan mudah juga menentukan umur suatu logam yang terkorosi merata.
Gamabr 1.2. Korosi merata
Korosi Galvanik (Galvanic Corrosion)
Bila dua logam beda jenis bersambungan di lingkungan elektrolit korosif, salah satu logam akan terkorosi dan yang lain terlindungi dari korosi.
Logam akan terkorosi bila bersambungan dengan logam lain yang punya potensial lebih positif.
Gambar 1.3. Korosi Galvanik
KOROSI GALVANIK
KOROSI GALVANIK
Cu
Fe
Korosi celah (Crevise Corrosion)
Korosi celah adalah korosi yang terjadi pada celah-celah. Pada dasarnya korosi ini terjadi karena perbedaan konsentrasi oksigen antara daerah-daerah yang berbeda dalam atau mengandung elektrolit. Seperti kita ketahui, adanya kandungan oksigen akan memungkinkan reaksi katodik : O2 + 2H2O + 4e (4OH-). Pada suatu celah, bagian yang langsung berhubungan dengan udara akan mempunyai konsentrasi oksigen yang lebih tinggi dan daerah ini bersifat katodik. Bagian sebelah dalam yang bersifat lebih anodik akan terkorosi.
Gambar 1.4. Korosi Celah
Korosi sumur. (Pitting Corrosion)
Korosi bentuk sumur terjadi karena suatu serangan yang intensif setempat. Sumur-sumur tadi dapat berdekatan atau terpisah jauh. Korosi tipe ini biasanya terjadi dalam lingkungan tertentu, misalnya, air yang mengandung klorida, larutan yang mengandung ion-ion Fe3+ dan Cu2+ dan klorida, dan bakteri pereduksi sulfat.
Korosi sumur cenderung terbentuk dalam air tenang, dan sumuran terjadi karena ada proses otokatalitik.
Gamabar 1.5. Korosi Sumuran (Pitting Corrossion)
Korosi Retak Tegang (Stress Corrosion Craking)
Korosi tipe ini merupakan hasil aksi gabungan antara tegangan tarik dan lingkungan korosif. Kegagalan yang disebabkan oleh korosi tipe ini biasanya mendadak dan parah. Korosi retak tegang adalah korosi yang terjadi dari aksi gabungan antara lingkungan korosif dan tegangan statis. Tegangan ini dapat berupa tegangan dalam (sisa) atau tegangan dari luar. Awal retakan di permukaan dapat dimulai dari suatu korosi sumur yang kemudian berkembang.
Karakteristik dari retakannya adalah berawal dari satu titik kemudian makin ke dalam makin bercabang. Sifat lain dari korosi tipe ini adalah bahwa suatu paduan logam tertentu terkorosi dalam lingkungan tertentu yang spesifik. Misalnya paduan tembaga terkorosi tipe ini dalam lingkungan amonia, baja karbon dalam larutan alkalis, baja tahan karat dan paduan aluminium dalam air laut atau yang mengandung klorida.
KOROSI SUMURAN
KOROSI SUMURAN
KOROSI TEGANGAN (SCC)
SEBANBYA ADALAH ADANYA TEGANGAN STATIK &
LINGKUNGAN KOROSIF YANG BERSIFAT SPESIFIK
Gambar 1.6. Korosi Rek Tegang (Stress Corrossion Cracking) Kerusakan oleh hydrogen (Hydrogen Embritlement)
Bentuk korosi tipe lain adalah “hydrogen embrittlement” (perapuhan hidrogen), dimana atom hidrogen disini tidak menbentuk gas H2, melainkan tetap sebagai atom yang menempatkan diri di daerah-daerah dislokasi, dan menyebabkan logam menjadi rapuh.
Atom hidrogen yang masuk ke dalam logam dan membentuk gas H2 atau dalam baja
mungkin CH4 dapat menimbulkan retakan karena tekanan gas tersebut makin besar,
atau sebagai akibat tekanan yang berasal dari luar. Kehadiran As, Se, Ti, Bi, S dan Sb dalam baja akan menghambat reaksi : H + H (H2 pada permukaan logam, dan hal ini
akan memperbesar peluang penetrasi hidrogen atom ke dalam logam. Dalam lingkungan sulfida, S= juga dapat menghambat reaksi tersebut di atas, dan dapat menimbulkan “peretakan hidrogen” dalam baja.
Gambar 1.7. Kerusakan oleh Hidrogen (Hydrogen Embritlement)
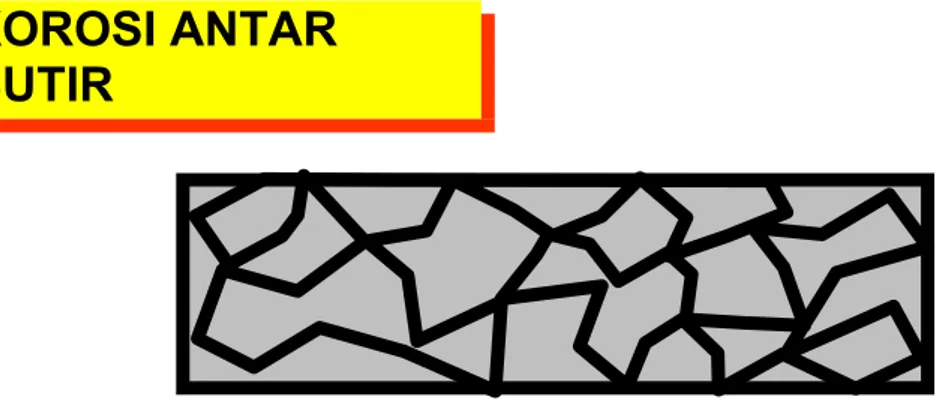
Korosi antar butir (Intergranular Corrosion)
Korosi tipe ini serangannya mengikuti batas butir (kristal). Dalam kondisi normal,
H
H
H
H
2H
H
H
2H
+H
+e
e
merata. Tetapi karena suatu perlakuan terhadap paduan, di batas butis dapat tercipta daerah-daerah anodik dan katodik, sehingga terjadilah serangan korosi di batas butir. Sebagai contoh baja tahan karat austenitik yang mengalami sensitisasi antara suhu 400 –8500oC akan terserang korosi antar butir. Karbida krom (Cr
23C6) cenderung akan
terendapkan sepanjang batas butir, dan matriks didekatnya akan kekurangan krom menjadi seperti baja karbon biasa, yang bersifat lebih anodik dan akan terkorosi dalam lingkungan klorida atau asam.
Korosi antar butir dapat pula terjadi pada paduan aluminium, yang serangannya sejajar dengan permukaan, terkenal dengan istilah “eksfoliasi”.Pengendalian korosi tipe ini adalah dengan jalan menghindarkan terjadinya endapan-endapan dibatas butir.
Gambar 1.8. Korosi Antar Butir (Intergranullar Corrossion)
Korosi erosi (Erosion Corrosion)
Tipe korosi ini merupakan akibat dari lingkungan korosif dan adanya gesekan, benturan, atau aliran fluida. Jenis-jenis korosi ini adalah korosi erosi, korosi kavitasi, korosi gesekan, korosi benturan.
Korosi erosi terjadi dalam fluida yang mengalir. Karena adanya aliran, produk korosi terenyahkan dari permukaan, permukaan tidak rata lagi dan terjadi turbulensi yang cenderung menyebabkan serangan korosi lokal, seperti misalnya pada daerah-daerah las. Permukaan yang terkorosi biasanya mengkilap dan bentuknya “undercut pit”. Paduan yang membentuk lapisan pasif dapat terserang korosi erosi. Korosi tipe ini biasa dialami pada belokan, pompa, kran, baling-baling, dan sebagainya. Serangan makin parah bila fluida mengandung partikel padatan.
KOROSI ANTAR
BUTIR
1.3
Penutup
Kesimpulan
Korosi adalah dampak destructive suatu reaksi kimia antara logam atau alloy dengan lingkungan. Keaksi kimia korosi bersifat eksotermik karena melepas sejumlah energi. Reaksi korosi melibatkan perpindahan muatan elektronik dalam larutan aqueous. Suplai elektron ke logam menurunkan laju korosi atau reaksi anodic sedangkan laju reaksi pelepasan hydrogen meningkat.
Pemberian potensial negative pada logam yang menurunkan laju korosi adalah dasar PROTEKSI KATODIK.
REAKSI ANODIK ; M Mn+ + ne-
REAKSI KATODIK;
reduksi ion hydrogen dalam larutan asam, 2H+ + 2e- H
2
reduksi ion yang telah teroksidasi, contoh reduksi oin ferric menjadi ferrous, Fe3+ + e- Fe2+
Reduksi oksigen terlarut, O2 + 2H2O + 4e- 4OH
-Reduksi air, 2H2O + 4e- H2 + 2H2O
Jenis korosi antara lain korosi merata (Uniform Corrosion), Korosi Galvanik (Galvanic Corrosion), Korosi celah (Crevise Corrosion), Korosi sumur. (Pitting Corrosion), Korosi Retak Tegang (Stress Corrosion Craking), Kerusakan oleh hydrogen (Hydrogen Embritlement), Korosi antar butir (Intergranular Corrosion) dan Korosi erosi (Erosion Corrosion).
Contoh Soal
1. Jelaskan kerugian yang dapat ditimbulkan oleh korosi secara langsung maupun secara tak langsung.
Korosi menyebabkan kerusakan terhadap struktur bangunan, jembatan dan sejenisnya.
Secara tak langsung berupa Plant down Time, Loss of Product, Loss of Efficiency, Contamination, Overdesign.
2. Definisi korosi
Korosi adalah dampak destructive suatu reaksi kimia antara logam atau alloy dengan lingkungan. Korosi juga disebut sebagai reaksi balik dari metalurgi ekstractif.
3. Jelaskan reaksi yang terjadi pada proses korosi
Reaksi Anodik adalah oksidasi logam menjadi ion logam dalam larutan M Mn+ + ne-
Sedangkan salah satu REAKSI KATODIK adalah reduksi ion hydrogen dalam larutan asam,
2H+ + 2e- H 2
Test/Umpan balik
1. Jelaskan definisi korosi
2. Jelaskan mengapa degradasi bahan organic tidak digolongkan sebagai korosi 3. Jelaskan yang dimaksud dengan kerugian akibat korosi karena overdesign. 4. Dasar proteksi katodik adalah
BAB II
POTENSIAL ELEKTRODA 2.1 Pendahuluan
- Deskripsi singkat/gambaran umum.
Dalam bab ini akan dijelaskan tetang perubahan energi yang terjadi di dalam reaksi elektrokimia korosi. Perubahan energi yang terukur sebagai beda potensial ini menyebabkan daya dorong (driving force) dan merupakan kendali arah reaksi kimia. - Relenvasi.
Dari besaran potensial, arah reaksi korosi dapat diketahui sehingga korosi dapat diprediksi.
- TIK
Setelah mengikuti mata kuliah pada bab ini mahasiswa diharapkan dapat menjelaskan tentang potensial elektroda, pengaruh konsentrasi terhadap potensial elektroda, menjelaskan diagram potensial logam dan dapat mengukur potensial elektroda.
2.2 Penyajian
Pengantar
Korosi di dalam larutan aqueous melibatkan perpindahan elektron. Perubahan potensial elektrokimia atau aktivitas elektron pada permukaan logam sangat berpengaruh pada laju reaksi korosi, sehingga reaksi korosi dapat disebut sebagai bersifat elektrokimia. Termodinamika reaksi korosi dapat memberi pengertian tentang perubahan energi yang terjadi dalam reaksi elektrokimia korosi. Sedangkan perubahan energi pada reaksi elektrokimia tersebut terukur sebagai potensial elektroda.
Isi Materi
1. Potensial Elektroda
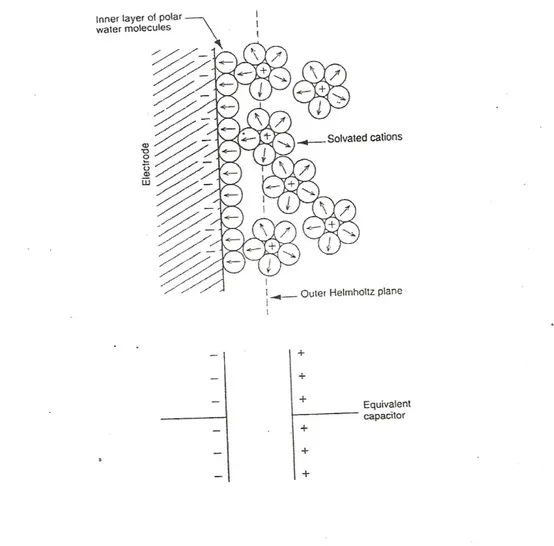
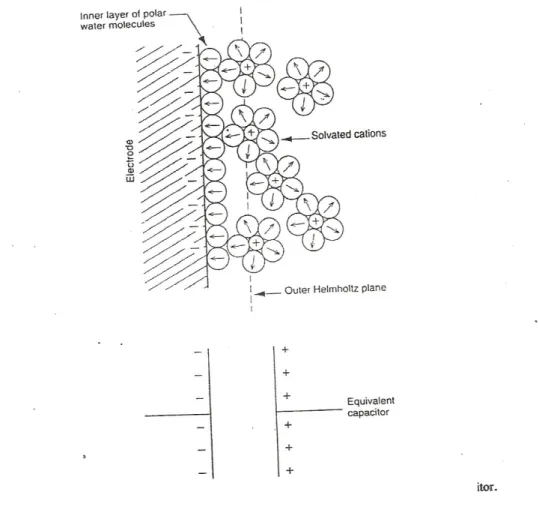
Logam konduktor yang mengandung elektron bergerak membentuk antar muka kompleks (complex interface) yang bersentuhan dengan larutan aqueous. Molekul H2O polar taksimetri tertarik ke permukaan konduktif sehingga membentuk lapisan
terarah yang menghambat spesies dari larutan untuk mendekat ke permukaan logam. Ion bermuatan juga menarik molekul air yang polar sehingga semakin menghambat permukaan. Lapisan ion positif yang terdekat ke permukaan logam yang bermuatan negatif biasa disebut dengan Outer Helmholtz Plane dan lapisan ini membentuk electrical double layer dan bersifat seperti kapasitor. Medan listrik struktur double layer ini menghambat perpindahan muatan listrik dan membatasi reaksi kimia permukaan.
Reaksi korosi logam di dalam air melibatkan perpindahan muatan dan perubahan potensial di permukaan merubah laju korosi. Jadi reaksi korosi adalah peristiwa elektrokimia.
Sebagai contoh dalam reaksi korosi seng,
Zn + 2 HCl ZnCl2 + H2
Terjadi perubahan energi, ∆G = -nFE (reaksi spontan)
n = jumlah electron, F = Konstanta Faraday 96.500 c/eq, ∆G = Perubahan energi; E = Potensial Sel
Zn Zn2+ + 2e- reaksi anodik E
a
2H+ + 2e- H
2 reaksi katodik Ec
Ea dan Ec adalah potensial setengah reaksi.
Esel = Ea + Ec
Jika keadaan standar ditetapkan, maka Ea dan Ec menjadi potensial standar setengah
reaksi Eao dan Eco .
Daftar reaksi setengah sel untuk korosi dinyatakan dalam bentuk reaksi reduksi dengan arah kiri ke kanan (Stockholm Convention 1953)
Logam bernilai potensial positifi (+) lebih stabil (tak reaktif) sedangkan yang berpotensial negatif (–) bersifat reaktif. Potensial absolut setengah reaksi tidak dapat diukur secara praktek, namun hanya potensial relatif terhadap referensi primer, yaitu reaksi setengah hidrogen pada kondisi standart yang ditetapkan potensial nol, walaupun sesungguhnya potensial setengah sel hidrogen tidak bernilai nol. Potensial logam lain diukur relatif terhadap hidrogen.
Tabel 2.1. Potensial Standar (Potensial Standar Reduksi)
Secara umum reaksi setengah sel;
aA + mH+ +ne- = bB + dH 2O
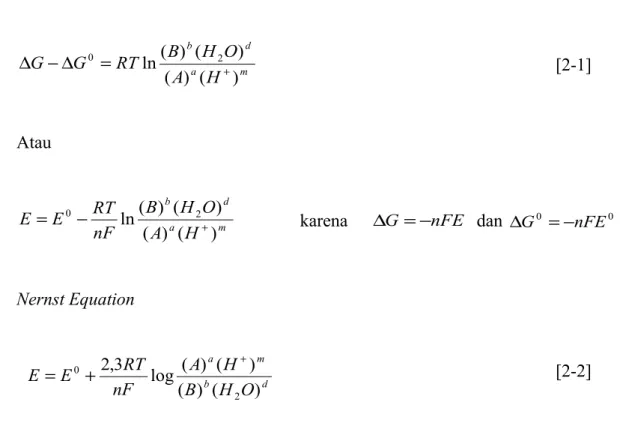
Semua reaksi korosi mengalami pergeseran keadaan dari keadaan standart, pergeseran keadaan dari standar tersebut dapat diprediksi menggunakan persamaan NERNST.
m a d b H A O H B RT G G ) ( ) ( ) ( ) ( ln 2 0 + = ∆ − ∆ [2-1] Atau m a d b H A O H B nF RT E E ) ( ) ( ) ( ) ( ln 2 0 + −
= karena ∆G =−nFE dan ∆G0 =−nFE0
Nernst Equation d b m a O H B H A nF RT E E ) ( ) ( ) ( ) ( log 3 , 2 2 0 + + = [2-2]
Persamaan ini menunjukkan bahwa potensial setengah sel menjadi lebih positif (noble) jika aktivitas spesies yang teroksidasi meningkat, (A) dan (H+) meningkat.
Aktivitas untuk larutan korosif yang relatif encer dapat dinyatankan dalam konsentrasi dengan satuan gram ekivalen per liter.
Aktivitas suatu larutan dinyatakan dengan (A)= f.CA
Dimana, f = koefisien aktifitas
pH n m B A n E E b a o 0,059 ) ( ) ( log 059 , 0 − + = [2-3]
2. Diagram Potensial/pH (Pourbaix)
Diagram potensial/pH adalah suatu peta yang memperlihatkan kondisi daya pengoksidasi larutan (potensial) dan keasaman (pH) untuk berbagai fasa yang stabil di dalam system elektrokimia aqueous. Garis-garis batas di dalam diagram yang memisahkan area kestabilan dihitung dari persamaan Nernst. Diagram ini banyak kegunaannya termasuk untuk fuel cell, batere, elektroplating, metalurgi dan korosi.
Diagram potensial/pH memperlihatkan reaksi dan produk reaksi yang terjadi jika kesetimbangan telah tercapai. Dengan diagram potensial/pH ini kondisi termodinamik korosi dapat diketahui sehingga potensial atau pH dapat diatur untuk mencegah korosi secara termodinamik.
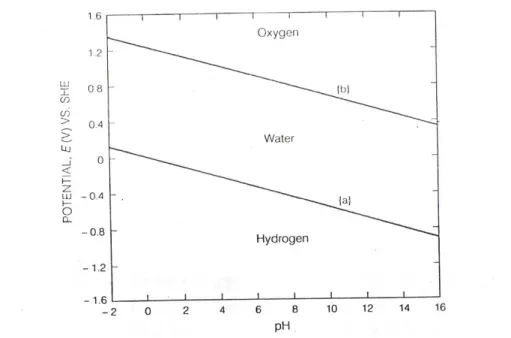
Gambar 2.2 Diagram potensial/pH Kesetimbangan Air
Kesetimbangan antara gas hidrogen dan larutan asam:
2H+ + 2e- H
2 [2-4]
Reaksi ekivalen dengan reaksi tersebut diatas di dalam larutan netral atau alkali adalah
2H2O + 2e- H2 + 2OH- {a}
Maka,
E
H HE
H H2,0
059
pH
2 /
0
/
=
+−
+ adalah keterkaitan pH terhadap potensial
elektroda setengah sel.. Reaksi [a] memperlihatkan bahwa pelepasan hidrogen adalah akibat dekomposisi air. Pada potensial lebih negatif (lebih aktif) dari potensial setengah reaksi, EH+/ H2maka hidrogen akan dilepaskan dan air menjadi tidak stabil
perlahan. Dalam larutan asam, H+ akan dikonsumsi oleh reaksi 4 sampai pH
meningkat dan air akan terurai langsung menjadi gas hidrogen. Garis {a} pada diagram diatas menunjukkan bahwa air tidak stabil dan akan terurai menjadi H2.
Diatas garis {a}air bersifat stabil dan bila ada gas H2 akan teroksidasi menjadi H+ atau
H2O.
Pada saat potensial menjadi lebih positif (nobel) akan terjadi reaksi lain yang melibatkan air,
O2 + 2H2O + 4e 4 OH- {b}
Maka persamaan Nernst untuk reaksi tersebut adalah,
E
O HOE
O2 H2O0
,
059
pH
2
2 /
0
/
=
−
Pada pH=0,
E
O2/H2O1
,
226
V
0
=
pada diagram tergambar garis {b}. Jika potensiallebih positif (noble) dari EO2/H2O pada semua nilai pH, air menjadi tidak stabil dan
ter oksidasi menjadi O2. Dibawah nilai potensial tersebut air menjadi stabil dan
oksigen terlarut akan direduksi menjadi air.
3. Diagram Pourbaix untuk logam terkorosi
Diagram Pourbaix untuk korosi logam ditandai dengan area pasif, korosi dan imun, namun laju korosi logam tidak dapat diprediksi dari diagram ini. Korosi bisa terjadi di area diagram Pourbaix dimana ion logam terlarut bersifat stabil. Logam menjadi pasif di area dimana oksida bersifat stabil. Di area dimana hanya logam tereduksi bersifat stabil maka logam disebut imun. Berikut ini adalah diagram Pourbaix untuk aluminium dan besi.
Gambar 2.3. Diagram Pourbaix untuk aluminium (a) dan besi (b).
Oksida aluminium larut pada pH rendah dan tinggi. Al3+ stabil pada pH rendah, AlO2-
stabil pada pH tinggi, dan oksida Al2O3 stabil pada pH pertengahan. Pada potensial
rendah logam aluminium imun terhadap korosi. Laju korosi aluminium sangat rendah karena hambatan kinetik, walaupun driving force untuk reaksi korosi besar.
Di wilayah oksida stabil, logam menjadi bersifat pasif. Pasivitas adalah karakter ketahanan korosi yang disebabkan oleh lapisan permukaan protektif walaupun secara termodinamik memungkinkan terjadi korosi. Korosi akan terjadi bilamana ion solubel bersifat stabil. Di wilayah dimana logam besifat stabil berarti logam imun atau tahan korosi.
Logam besi hampir sama dengan aluminium bahwa oksida protektif terbentuk pada larutan mendekati netral. Namun area kestabilan oksida lebih lebar pada pH tinggi dan besi sangat lebih tahan korosi pada larutan alkali. Penyebab ketahanan korosi besi adalah potensial elektroda setengah sel untuk reaksi pelarutan anodik lebih positif (nobel) sehingga menurunkan driving force untuk reaksi korosi.
Secara umum logam M berreaksi secara anodik dalam air sbb; teroksidasi menjadi kation aqueous,
M = Mn+ + ne-
Menjadi logam hidroksida atau oksida, M + nH2O = M(OH)n + nH+ + ne
-Menjadi anion aqueous,
-Ketiga reaksi tersebut adalah dasar yang digunakan untuk menyusun diagram Pourbaix untuk aluminium dan besi.
2.3 Penutup Kesimpulan
Lapisan ion positif yang terdekat ke permukaan logam yang bermuatan negatif biasa disebut dengan Outer Helmholtz Plane dan lapisan ini membentuk electrical double layer dan bersifat seperti kapasitor. Medan listrik struktur double layer ini menghambat perpindahan muatan listrik dan membatasi reaksi kimia permukaan.
Reaksi korosi adalah peristiwa elektrokimia karena reaksi korosi logam di dalam air melibatkan perpindahan muatan dan perubahan potensial di permukaan merubah laju korosi.
Semua reaksi korosi mengalami pergeseran keadaan dari keadaan standart, pergeseran keadaan dari standar tersebut dapat diprediksi menggunakan persamaan NERNST.
m a d b H A O H B nF RT E E ) ( ) ( ) ( ) ( ln 2 0 + − = atau pH n m B A n E E b a o 0,059 ) ( ) ( log 059 , 0 − + =
Diagram potensial/pH adalah suatu peta yang memperlihatkan kondisi daya pengoksidasi larutan (potensial) dan keasaman (pH) untuk berbagai fasa yang stabil di dalam system elektrokimia aqueous. Dengan diagram potensial/pH ini kondisi termodinamik korosi dapat diketahui sehingga potensial atau pH dapat diatur untuk mencegah korosi secara termodinamik.
Diagram Pourbaix untuk korosi logam ditandai dengan area pasif, korosi dan imun, namun laju korosi logam tidak dapat diprediksi dari diagram ini. Korosi bisa terjadi di area diagram Pourbaix dimana ion metal solubel bersifat stabil. Logam menjadi pasif di area dimana oksida bersifat stabil. Di area dimana hanya metal erreduksi bersifat stabil maka logam sebut imun.
Contoh soal
1. Jelaskan bagaimana proses pembentukan elektrical doubel layer pada permukaan logam.
Electrical double layer terbentuk dengan adanya lapisan ion positif yang berada di dekat ke permukaan logam yang bermuatan negatif yang disebut dengan Outer Helmholtz Plane dan bersifat seperti kapasitor. Medan listrik struktur double layer ini menghambat perpindahan muatan listrik dan membatasi reaksi kimia permukaan. Berikut adalah gambar diagram electrical doubel layer.
2. Tuliskan reaksi umum yang terjadi terhadap logam M yang terkorosi di dalam air yang digunakan sebagai dasar penyusunan diagram Pourbaix.
Secara umum logam M berreaksi secara anodik dalam air sbb; teroksidasi menjadi kation aqueous,
M = Mn+ + ne-
Menjadi logam hidroksida atau oksida, M + nH2O = M(OH)n + nH+ + ne
-Menjadi anion aqueous,
M + nH2O = MOnn+ + 2nH+ + ne
-Umpan balik
1. Hitung nilai 2,303RT/F pada suhu 40oC
2. Dengan asumsi keadaan standar untuk reaksi dan produk, tentukan arah reaksi berikut ini dengan menghitung potensial sel
a. Cu + 2HCl = CuCl2 + H2 b. Fe + 2HCl = FeCl2 + H2
c. 2AgNO3 + Fe = Fe(NO3)2 + 2Ag d. Ag + FeCl3 = FeCl2 + AgCl
3. Besi di dalam larutan NaCL pH = 1 memperlihatkan potensial +0,2 V Vs SHE. Reaksi anodik dan katodik apa saja yang kemungkinan terjadi. Asumsi diagram Pourbaix besi berlaku pada reaksi tersebut.
BAB III
KINETIKA KOROSI 3.1 Pendahuluan
- Deskripsi singkat/gambaran umum.
Dalam bab ini akan dijelaskan tetang kondisi-kondisi lingkungan yang memungkinkan untuk reaksi korosi dapat terjadi, laju korosi, hukum dasar kinetika reaksi elektrokimia.
- Relenvasi.
Topik pada bab ini sangat relevan dengan kebutuhan bahan logam tahan korosi untuk pengembangan teknologi baru seperti pesawat terbang, mobil, pembangkit energi dan manufaktur.
- TIK
Setelah mengikuti mata kuliah pada bab ini mahasiswa diharapkan dapat menjelaskan tentang termodinamik lingkungan yang mempengaruhi reaksi korosi, menghitung laju korosi, menjelaskan hukum dasar kinetik elektrokimia.
3.2 Penyajian
Pengantar
Korosi secara termodinamik dapat terjadi pada segala jenis kondisi lingkungan. Kebutuhan teknologi baru terhadap kondisi suhu tinggi, tekanan tinggi, kecepatan tinggi, konsentrasi tinggi maka laju korosi menjadi semakin meningkat. Korosi di dalam larutan aqueous ditentukan utamanya oleh reaksi-reaksi elektrokimia. Pemahaman tentang hukum dasar kinetik elektrokimia diperlukan untuk meningkatkan metode perlindungan terhadap korosi.
1. Hukum Faraday
Reaksi elektrokimia mengkonsumsi elektron atau memproduksi elektron sehingga laju aliran elektron ke atau dari antarfasa adalah ukuran laju reaksi.
Arus elektron atau arus listrik,
I satuam anpere = 1 coloum(6,2 x 1018 elektron)/detik
Sedangkan proporsionalitas antara arus, I dengan massa yang berreaksi, m dinyatakan dengan Hukum Faraday,
F t I x n a m= . [3-1]
F adalah konstanta Faraday (96.500 coulombs/equivalent) n jumlah equivalent berreaksi
a berat atom t waktu laju korosi, r AnF Ita tA m r = = atau nF ia tA m r = = [mg/dm2.hari] [3-2]
dimana i adalah kerapatan arus = A I
Laju korosi biasa juga dinyatakan dalam satuan mpy [mills (0,001 inc) per year] Dengan membagi persamaan [2] dengan densitas logam, D.
nD ia
r =0,129 (mpy) disebut laju penetrasi per satuan waktu [3-3]
Untuk reaksi 2H+ + 2e- H2 pada porensial redoks standar,
e
0H+/H2 reaksi iniberada pada keadaan kesetimbangan dimana laju arah kanan, rf sama dengan laju
nF a i r
rf = r = 0 [3-4]
i0 adalah exchange current density ekivalen terhadap laju reversibel pada keadaan
kesetimbangan. Sedangkan potensial setengah sel adalah karakteristik parameter termodinamik reaksi elektrokimia, sedangkan i0 adalah parameter kinetik dasar.
Potensial elektroda dan exchange current density tidak bisa dihitung dengan prinsip pertama namun harus ditentukan secara eksperimental.
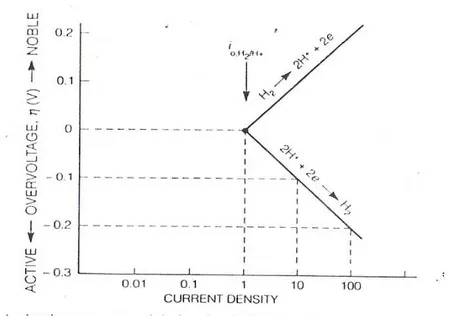
2. Polarisasi Elektrokimia
Polarisasi, η adalah perubahan potensial, E – e dari potensial setengah sel kesetimbangan, e yang disebabkan oleh total laju reaksi permukaan untuk reaksi setengah sel. Untuk polarisasi katodik, ηc electron disuplai ke permukaan dan
akumulasi pada permukaan logam karena laju reaksi yang lambat menyebabkan potensial, E menjadi lebih negative dari e.
Reaksi anodik dan katodik pada proses korosi berlangsung dengan laju sangat kecil. Jika suplai electron berlebih diberikan pada reaksi katodik logam, permukaan logam akan sangat negative, maka hanya sebagian electron berreaksi. Keadaan ini disebut POLARISASI KATODIK. Polarisasi katodik menurunkan laju korosi.
Untuk polarisasi anodik, elektron dipisahkan dari logam, kekurangan elektron menyebabkan kekurangan elektron perubahan potensial positif karena pelepasan elektron oleh permukaan menjadi lambat, dan ηa bernilai positif.
Kekurangan electron akibat reaksi anodik menghasilkan potensial positif di permukaan disebut POLARISASI ANODIK. Polarisasi anodic meningkatkan laju korosi.
Dalam larutan aqueous, permukaan akan mencapai potensial steady state, Ecorr, saat
reaksi anodic dan katodik berlangsung. Kalau potensial meningkat dari Ecorr menjadi
E, dan laju korosi meningkat.
Gambar 3.1. Potensial Korosi Logam
Pada beberapa logam, termasuk besi, nikel, krom, titanium dan kobalt, laju korosi menurun drastis diatas potensial kritis, Ep. Keadaan seperti ini (korosi menurun, pada peningkatan potensial) disebut PASIVITY. Laju korosi pasif sangat kecil, disebabkan oleh pembentukan oksida tipis, protektif, yang berfungsi menghambat reaksi disolusi anodic.
Polarisasi Aktivasi
Jika salah satu langkah (step) dalam reaksi setengah sel mengendalikan laju aliran muatan, maka reaksi tersebut berada pada keadaan aktivasi atau kendali perpindahan muatan, hasilnya adalah polarisasi aktivasi.
2H+ + 2e- H2
Hubungan antara polarisasi aktivasi atau overpotensial, η dan laju reaksi ditunjukikan oleh ia atau ic, (+) P O T E N S I A L (-) Ecorr E Laju Korosi Ea
0 log i ia a a β η = [3-5]
Untuk polarisasi anodik dan
0 log i ia c c β η = [3-6]
Untuk anodic overpotensial, ηa bernilai positif dan βa juga positif. Untuk polarisasi
katodik, ηc bernilai negatif dan βc juga negatif. βa dan βc adalah konstanta Tafel. Plot
overpotensial ηac versus log i bersifat linier untuk polarisasi anodik dan katodik. Slope
adalah konstanta Tafel bernilai ± 0,1 V. Untuk η = 0 maka i=i0 , jika potensial turun
dibawah potensial standar setengah sel maka reaksi reduksi 2H+ + 2e- H
2 akan
berlangsung, sed angkan bila potensial naik diatas potensial standar setengah sel maka reaksi oksidasi H2 2H+ + 2e-.
Gambar 3.3. Pasivity
Polarisasi Konsentrasi
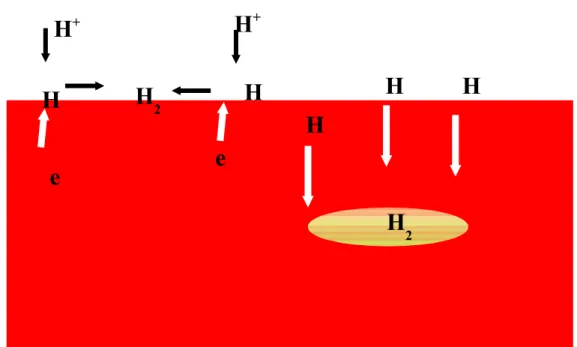
Pada laju tinggi, reaksi reduksi menurunkan konsentrasi spesies terlarut di dalam larutan. Konsentrasi H+ tergambar pada diagram berikut,
Gambar 3.4. Distribusi Konsentrasi H+ pada Permukaan Logam
(+) P O T E N S I A L (-) Ecorr Laju Korosi Pasif Aktif
Konsentrasi H+ dalam larutan di dekat permukaan yang terpengaruh polarisasi konsentrasi. CB adalah konsentrasi H+ pada larutan bulk, δ adalah ketebalan gradien
konsentrasi dalam larutan. Potensial elektroda setengah sel eH+/ H2 larutan dekat
permukaan dinyatakan dalam persamaan Nernst sebagai fungsi konsentrasi H+ atau
activity (H+). 2 2 2 2 0 / / ) ( log 3 , 2 H H H H H P H nF RT e e + = + + + [3-7]
Dari persamaan tersebut diatas terlihat bahwa potensial elektroda setengah-sel, e menurun sesuai penurunan (H+) dari permukaan. Penurunan potnsial seperti ini disebut
dengan Polarisasi Konsentrasi, ηconc,
− = L c conc i i nF RT log 1 3 , 2 η [3-8] L
i adalah ukuran laju reaksi maksimum yang tidak dapat terlampaui karena keterbatasan laju difusi H+ di dalam larutan.
Polarisasi Gabungan
Total Polarisasi Katodik, ηT .c adalah jumlah polarisasi aktivasi dan konsentrasi:
conc c act c T η η η . = . +
Dapat dijabarkan menjadi,
− + = L c c c c T i i nF RT i i 1 log 3 , 2 log 0 . β η [3-9]
Karena pada polarisasi anodik tidak terjadi polarisasi konsentrasi maka total polarisasi anodik reaksi pelarutan logam adalah,
log i ia a a β η = [3-10]
3.3 Penutup Kesimpulan
Proporsionalitas antara arus, I dengan massa yang berreaksi, m dinyatakan dengan Hukum Faraday, F t i x n a m = .
F adalah konstanta Faraday (96.500 coulombs/equivalent) n jumlah equivalent berreaksi
a berat atom t waktu (detik) laju korosi, r AnF Ita tA m r = = atau nF ia tA m r = = [mg/dm2.hari]
Polarisasi, η adalah perubahan potensial, E – e dari potensial setengah sel kesetimbangan, e yang disebabkan oleh total laju reaksi permukaan untuk reaksi setengah sel. Untuk polarisasi katodik, ηc electron disuplai ke permukaan dan
akumulasi pada permukaan logam karena laju reaksi yang lambat menyebabkan potensial, E menjadi lebih negative dari e.
POLARISASI ANODIK didefinisikan; Ea = E – Ecorr
Hubungan antara polarisasi aktivasi atau overpotensial, η dan laju reaksi ditunjukikan oleh ia atau ic, 0 log i ia a a β η =
Untuk polarisasi anodik dan
0 log i ia c c β η =
Untuk polarisasi anodic Umpan Balik
1. Sampel seng di dalam larutan asam kehilangan 25 mg selama 12 jam pengujian. (a) berapa arus ekivalen yang mengalir disebabkan oleh korosi? (b) Jika luas sampel 200 cm2 berapa laju korosi dalam satuan mg/dm2 per
hari ?, (c) berapa laju korosi dalam mpy dan μm/y?
2. Permukaan kristal tunggal (100) nikel terkorosi pada laju konstan 5 μA/cm2 .
BAB IV
DASAR PROTEKSI KATODIK 4.1 Pendahuluan
- Deskripsi singkat/gambaran umum.
Dalam bab ini akan dijelaskan tetang dasar proteksi katodik - Relenvasi.
Topik pada bab ini sangat relevan dengan pencgahan korosi - TIK
Setelah mengikuti mata kuliah pada bab ini mahasiswa diharapkan dapat menjelaskan dasar proteksi katodik.
4.2 Penyajian
1. Konsep Dasar Proteksi Katodik
Bila suatu logam/paduan terkorosi ada bagian-bagian yang bersifat sebagai anoda di mana korosi terjadi, dan ada bagian-bagian yang bersifat sebagai katoda di mana korosi tidak terjadi. Korosi terjadi di mana arus listrik meninggalkan logam menuju elektrolit, dan sebaliknya korosi tidak terjadi di mana arus listrik masuk ke dalam logam. Tidak terkorosi Terkorosi
K
A
Dari gejala tersebut di atas dapat disimpulkan, bahwa jika kita dapat memperlakukan logam secara keseluruhan sebagai katoda, maka logam tersebut tidak akan terkorosi. Perlakuan ini berarti kita harus memindahkan atau memisahkan bagian yang bersifat sebagai anoda tadi ke tempat lain yang masih berada dalam lingkungan elektrolitik sama dan dihubungkan secara elektrikal dengan logam tadi. Ini berarti kita harus menciptakan suatu anoda tambahan baru, yang secara skematik dapat digambarkan pada gambar 4.1. Daerah anodik sekarang terisolasi, dan logam tidak terkorosi lagi. Dengan mengisolasi anoda dengan anoda baru ini, maka seluruh logam sekarang bersifat sebagai katoda dan tidak terkorosi. Ini adalah konsep dasar dari proteksi
katodik. i
Dalam keadaan terproteksi katodik, logam yang diproteksi dialiri arus listrik melalui anoda dan lingkungan menuju logam, atau logam dibanjiri dengan elektron.
Gambar 4.2. Prinsip Proteksi Katodik Anoda e e e e e e Katoda
2. Potensial Proteksi
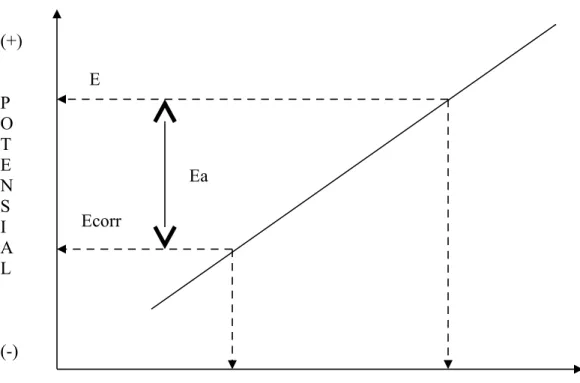
Suatu logam yang terkorosi dalam lingkungan basah, mempunyai suatu nilai potensial tertentu, yang merupakan potensial campuran (mixed potential) antara potensial anodik dan katodiknya pada rangakian terbuka (open circuit potentals). Pada nilai potensial ini pada umumnya logam akan terkorosi, dan nilai potensial tersebut dinamakan potensial korosi.
Dengan memperlakukan struktur sebagai katoda (memproteksi katodik), mengakibatkan potensial logam turun menjadi lebih rendah dari potensial korosinya, lihat gambar 4.3.
E , Volt
Korosi (ion logam stabil)
M
+ Potensial korosiM
Proteksi katodik (logam stabil)Apabila potensial suatu logam diturunkan, maka logam akan cenderung bertahan sebagai logam, karena ia lebih stabil, dan sebaliknya bila potensial dinaikkan logam akan cenderung menjadi ion (ion stabil) atau terkorosi.
Pengertian dari uraian tersebut di atas adalah bahwa setiap penurunan potensial dari potensial korosi berarti sudah suatu perlakukan proteksi katodik, di mana logam cenderung lebih stabil dan laju korosinya berkurang. Makin besar arus listrik dialirkan, makin besar penurunan potensialnya dan logam makin stabil atau tingkat laju korosinya makin rendah.
Dalam praktek kita tidak dapat menurunkan potensial secara sembarangan. Penurunan yang berlebihan akan merupakan suatu kerugian ditinjau dari segi biaya dan kadang-kadang juga dari segi teknis. Oleh karena itu ada suatu kriteria proteksi yang perlu diketahui dan diperhatikan. Kriteria proteksi ini umumnya berbeda untuk tiap logam dan lingkungan.
3. Kriteria Proteksi Katodik
Proteksi katodik akan menurunkan laju korosi, secara teoritis sampai nol, yaitu apabila potensial logam diturunkan sampai potensial anodik rangkaian terbuka (open circuit potential), yang dengan teknik polarisasi diilustrasikan pada gambar 4.4
Berdasarkan teori polarisasi pada potensial tersebut terjadi suatu kondisi setimbang, rapat arus anodik sama dengan rapat arus katodik, dan terjadi pertukaran rapat arus (exchange current density), sehingga korosinya sama dengan nol. Teori ini dikemukakan sekitar tahun 1930-an (Mears dan Brown). Tetapi ini adalah teoritis, di mana kondisinya ideal. Dalam praktek kondisinya sangat kompleks, sehingga pada umumnya potensial proteksinya berbeda, lebih tinggi dari nilai teoritis tersebut.
Potensial suatu logam dapat diukur dengan elektroda standar. Elektroda standar yang dapat digunakan untuk pengkuran potensial seperti terlihat dalam Tabe 4.l dan urutannya digambakan pada gambar 4.5.
Tabel 4.1. Elektroda Pembanding
Jenis elektroda Standar Potensial terhadap potensial stadar hidrogen, V
Cu/CuSO4 (CSE, Copper/Copper
sulfate Elect). (jenuh)
Ag/AgCl (Siver/Silver Chloride) Hg/Hg 2 Cl 2 ( Calomel ,SCE),
jenuh
Hidrogen (SHE) Zn
0,33 (untuk lingkungan tanah)
0,25 (untuk lingkungan laut )
0,24 (untuk lingkungan klorida. lab) 0,00 (hanya untuk ACUAN)
- 0,76 (untuk lingkungan laut,bila untuk tanah dengan backfill).
I
korGambar 4.4 Potensial Proteksi
A
E
protI, Amper
I
protE
korE, Volt
K
Bedasarkan standar NACE, RP 0169-92 dan standar-standar lain potensial proteksi untuk beberapa logam adalah sebagai dapat dilihat pada Tabel 4.2.
Tabel. 4.2. Kriteria Potensial Proteksi
Logam Potensial Proteksi, -V (CSE) Baja : kondisi aerobik
kondisi anaerobik Timbal
Tembaga Aluminium
Lebih dari satu logam/ paduan dalam satu kesatuan
0,85 0,95 0,6 0,5 - 0,65 0,95 - 1,20
Potensial diturunkan sampai yang diperlukan untuk proteksi katodik yang paling negatif
Cu/CuSO4 Ag/AgCl Hg/Hg2Cl2 H/H+ 0,33 0,24 0,25 0,00 -0,76 Zn/Zn++
Khusus untuk besi/baja ada beberapa kriteria yang dapat diterapkan :
Dalam tanah : (1) ≤ -0,85 V(CSE), diukur dengan meng-kontakkan elektroda pada elektrolit yang berhubungan
(2). ≥ 100 mV, sisa polarisasi katodik (absolut)
Dalam air laut : (1) ≤ - 800 mV (Ag/AgCl)
(2) digeser 300 mV atau lebih besar ke arah negatif (absolut) dari potensial korosi.
Perlu dicatat bahwa kriteria tersebut bukanlah suatu keharusan mutlak, tetapi atas dasar pengalaman tiap industri dapat menentukan sendiri nilai yang paling sesuai dengan kondisi setempat.
BAB V
APLIKASI PROTEKSI KATODIK
5.1 Pendahuluan
Proteksi katodik dikenal mulai awal abad 19. Tetapi karena suatu kegagalan dalam aplikasi, teknik ini dilupakan orang selama satu abad, dan baru sekitar tahun 1920-an pertama proteksi katodik mulai diterapkan lagi. Sejak itu teori-teori mulai dikembangkan, dan sekitar tahun 1930-an mulai berkembang. Setelah perang dunia kedua, dengan berkembangnya industri minyak bumi, proteksi katodik berkembang pesat.
Di Indonesia, menurut catatan, penerapan proteksi katodik dimulai di industri minyak di Sumatra pada sekitar tahun 1950-an. Sebelum proteksi katodik diterapkan secara luas, pengendalian korosi untuk struktur yang berada dalam elektrolit (tanah atau/dan air) umumnya hanya mengandalkan pada lapis lindung, ditambah dengan disain yang faktor keamanannya tinggi.
Teknik pengendalian korosi dengan proteksi katodik kemudian mendunia, dan standar-standar kemudian dikembangkan di berbagai negara. Pada saat ini standar proteksi katodik sudah dapat dikatakan seragam, dan diterima di semua negara. Perkembangan standar ini dimulai sekitar tahun 1960-an, dan sampai sekarang terus dilakukan modifikasi. Pada umumnya para praktisi menginginkan standar sederhana, supaya mudah difahami dan mudah dilaksanakan di lapangan. Dalam praktek, pada umumnya proteksi katodik tidak berdiri sendiri, dan bahkan merupakan pelengkap dari pengedalian korosi dengan lapis lindung, kecuali untuk beberapa struktur tertentu.
Pada prinsipnya proteksi katodik sederhana saja, yaitu menurunkan potensial logam ke daerah imun menurut diagram pH-potensial. Tetapi karena sistem struktur yang diproteksi umumnya sangat kompleks, aplikasi proteksi katodik menjadi iktu rumit, cenderung lebih banyak seninya dari pada teknik. Oleh karena itu faktor pengalaman menjadi sangat berperan dalam keberhasilan aplikasi.
Aplikasi proteksi katodik sangat luas, dapat untuk mengendalikan korosi semua strutur logam asal berada dalam lingkungan elektrolit: dalam tanah, air,
larutan kimia. Ini berarti bahwa proteksi katodik secara praktis tidak dapat diterapkan untuk pengendalian korosi di udara.
Semua bentuk korosi dapat dikendalikan dengan proteksi katodik, termasuk : korosi merata, korosi sumuran (pitting), korosi celah, korosi tegangan,(SCC), korosilelah, korosi kavitasi, korosi oleh bakteri, dsb..
5.2 Penyajian
1. Struktur Yang Dapat Diproteksi Katodik
Struktur dalam tanah dan dalam air
• Jaringan pipa dan tanki bahan bakar.
• Struktur bangunan logam.
• Tulangan beton.
• Kabel komunikasi.
• Dasar tanki yang berkontak tanah.
• Kaki-kaki menara.
• Casing pipa sumur bor.
• Tiang pancang jembatan. dermaga, sheet pile, dll..
• Pipa dalam laut dan dasar laut.
• Intake screen, pompa-pompa intake.
• Pintu-pintu air kanal.
• Dll.
Struktur di atas tanah
• Bagian dalam tanki air.
• Kondenser dan heat-exchanger.
• Tanki-tanki air panas.
• Tanki-tanki atau bejana-bejana dalam proses.
• Dll.
Struktur terapung
• Kapal, tanker, kapal keruk. dll.
• Anjungan lepas pantai.
• Dok apung.
• Barges.
• Ponton.
• Peralatan bant navigasi.
• Dll.
2 Sistem Anoda Korban vs Arus Tanding Sistem anoda korban
Keuntungan :
• Tidak perlu tenaga listrik dari luar.
• Pemasangan relatif mudah
• Tidak ada bahaya interaksi.
• Murah untuk struktur kecil.
• Daerah padat struktur.
• Bahaya over-proteksi ringan.
• Distribusi arus merata.
• Tidak perlu pemeliharaan, kecuali inspeksi rutin.
• Tidak perlu biaya operasi.
Kerugian :
• Keluaran arus anoda terbatas, pada hal makin lama makin diperlukan arus lebih besar karena degradasi lapis lindung.
• Untuk struktur yang besar diperlukan anoda banyak jumlahnya.
Sistem arus tanding.
Keuntungan :
• Sistem instalasi dapat memproteksi struktur yang besar.
• Sistem dapat didisain yang beubah dengan waktu.
• Keluaran arus proteksi mudah diatur sesuai dengan keperluan.
• Sistem dapat didisain untuk masa guna lebih dari 20 tahun.
• Biaya awal lebih murah.
Kerugian :
• Kemungkinan ada interaksi terhadap struktur lain
• Tergantung dari keberadaan sumber listrik luar.
• Perlu pemeliharaan dan inspeksi rutin yang cermat.
• Perlu biaya operasi.
• Dapat terganggu oleh kegagalan catu daya listrik.
Dalam praktek pemilihan antara kedua sistem tersebut masih tergantung banyak faktor lain, yang kadang-kadang sifatnya non-teknis.
3. Keperluan Arus Proteksi
Sebagian besar proteksi katodik diterapkan untuk struktur dari baja, oleh karena itu data keperluan arus proteksi yang dianggap sudah mapan adalah untuk baja, meskipun angkanya mempunyai selang yang agak panjang. Nilai-nilai yang diperoleh berdasarkan pengalaman dari banyak praktisi lapangan telah didokumentasikan, dan pada umumnya angkanya tidak berbeda jauh. Bahkan untuk lingkungan laut, sudah ada data untuk seluruh dunia, termasuk Indonesia. Sebagai pedoman, berikut ini
disampaikan perkiraan keperluan rapat arus proteksi yang diperlukan untuk struktur baja untuk dalam berbagai lingkungan.
Tabel. 5.1. Perkiraan keperluan arus proteksi baja dalam berbagai lingkungan.
Lingkungan
Arus proteksi, mA/m2
BAJA POLOS : Tanah netral
Tanah netral ter-aerasi Tanah kering, teraerasi
Tanah basah, kondisi sedang-gawat Tanah asam
Tanah mengandung bakteri anaerobik
Tanah panas Beton kering Beton basah Air tawar tenang Air tawar mengalir
Air tawar turbulen mengandung oksigen
Air panas
Air muara yang terpolusi Air laut
Larutan kimia dalam bejana porses Heat-exchanger box dengan pipa non-fero
BAJA DENGAN LAPIS LINDUNG BAIK
Tanah
BAJA DENGAN LAPIS LINDUNG BAIK SEKALI. Tanah 4 - 16 21 - 32 5 - 16 25 - 65 50 - 160 ~ 450 50 - 270 5 - 16 50 - 270 ~ 50 55 - 65 55 - 160 55 - 160 540 - 1600 60 - 270 60 - 270 ~ 1345 0,01 - 0,2 ~ 0,01
Tabel 5.2. Kriteria Disain Untuk Lingkungan Laut
Wilayah Resistivitas Air (0hm-cm) Suhu Air (C) Faktor Turbulensi/ Arus Air Rapat Arus Disain mA/m2 Teluk Mexico Pantai Barat A.S. Cook Inlet Laut Utara Teluk Persi Indonesia 20 24 50 26-33 15 19 22 15 2 0-12 30 24 Sedang/Sedang Sedang/Sedang Rendah/Tinggi Tinggi/Rendah Sedang/Rendah Sedang/Sedang 54-65 76-106 380-430 86-216 54-86 54-65 NACE RP 01-76 (1983 Revision)
Kalau kita perhatikan angka-angka keperluan arus proteksi untuk struktur dalam tanah sangat bervariasi dibanding dengan keperluan arus proteksi di lingkungan laut. Hal ini disebabkan oleh sangat bervariasinya resistivitas tanah, sedang resistivitas air laut relatif sama dan kondisi pergerakan air laut relatif tetap untuk suatu wilayah, sehingga keperluan arus proteksinya berselang pendek.
Mengenai pengaruh resistivitas tanah terhadap laju korosi sudah diklasifikasikan secara kualitatif seperti terlihat pada Tabel 3.3. berikut.
Tabel. 5.3. Klasifikasi Korosi Ditinjau Dari Resistivitas Tanah
Resistivitas, Ohm-cm Klasifikasi Korosi
Sampai - 700 700 - 2000 2000 - 5000 5000 - 10000 lebih dari 10000 Sangat korosif Korosif Korosif Sedang Korosif Ringan Tidak Korosif
Kondisi tanah sewaktu-waktu dapat berubah karena perubahan musim atau oleh karena pencemaran lingkungan. Oleh karena itu meskipun resistivitasnya lebih dari 10.000 ohm-cm yang diklasifikaskan sebagai tidak korosif, justru sangat berbahaya oleh kemungkinan terjadinya korosi sumuran, dan proteksi katodik tetap harus diterapkan.
4. Rancang Bangun Proteksi Katodik. Beberapa Masalah
Rancang bangun proteksi katodik adalah penerapan teori korosi dan teknologi pengendalian korosi ke dalam praktek lapangan. Secara teori, untuk menghasilkan proteksi yang sempurna, seluruh permukaan struktur logam harus diturunkan potensialnya, sehingga memenuhi krteria secara merata. Dalam praktek sanagat sukar mencapai kondisi tersebut, karena kemungkinan adanya variasi lingkungan dan kondisi permukaan logam sangat besar ditambah struktur yang makin kompleks, sehingga distribusi arus per satuan luas tidak merata.
Banyak ahli mengatakan, bahwa penerapan proteksi katodik lebih banyak seni dari pada teknik. Kenyataannya memang demikian, kebehasilan rancang bangun prtoteksi katodik lebih banyak ditentukan oleh pengalaman.
Masalah ini sering tidak difahami oleh pihak-pihak yang terlibat, sehingga menjadikan proteksi katodik tidak efisien, dan menjadi mahal. Hal ini dapat membahayakan fasilitas produksi. Persoalan akan menjadi lebih rumit kalau ditambahi masalah birokrasi yang sering menghambat.
Data Yang Diperlukan
Sebelum rancang bangun dilakukan pertama-tama harus diketahui data utama, di antaranya :
• Struktur yang akan diproteksi (bahan, geometri, fabrikasi, dll.)
• Lapis lindung (bahan dan kualitasnya).
• Umur struktur.
• Sejarah kegagalan.
• Kondisi lingkungan (geologi, tanah, air, resistivitas, pH, komposisi kimia, bakteri, dll.)
• Struktur lain di sekitarnya (yang berdekatan, yang memotong, ddl.).
• Interferenssi (AC-DC).
• Umur proteksi yang dikehendaki.
• Standar-standar yang digunakan.
• Dan lain-lain, termasuk kondisi non-teknis.
• Dll.
Untuk kesempurnaan rancang bangun diperlukan data seperti tersebut di atas. Akan tetapi jarang sekali dapat diperoleh dalam tahap awal. Pada umumnya data yang disajikan mentah, dan bahkan sering diambil saja dari data lain yang sering tidak tepat, misalnya :
• Harus digunakan sistem arus tanding karena lebih murah, pada hal lokasi struktur di daerah banyak sekali struktur.
• Harus menggunakan sistem anoda korban, tapi harganya mahal.
• Kita harus membuat rancang bangun proteksi katodik dengan hanya diberi data ukuran dan panjang pipa.
• Keperluan arus proteksi yang ordenya sekitar 1 A harus menggunakan deep groundbed dalam 100 m, dengan kapasitas arus 25 A.
• Harus dipasang anoda sementara, tetapi jumlahnya cukup untuk memproteksi lebih dari 20 tahun.
• Rancang bangun yang digunakan dalam mengajukan tender dianggap mengikat.
• Pemilik konstruksi atau kontraktor utama mencontoh begitu saja, kurang paham akan maksud proteksi katodik, kurang memahami standar dan kriteria proteksi, sehingga sering timbul masalah.
• Dan sebagainya.
Tahap-tahap yang baik dalam membuat rancang bangun adalah sebagai berikut :
• Rancang bangun awal (preliminary design) dibuat atas dasar data yang dan mengacu kepada kasus-kasus yang sama.
• Rancang bangun dimodifikasi bila perlu, disesuaikan dengan perubahan-peruhana konstruksi yang sering terjadi dalam praktek.
• Setelah konstruksi lengkap terpasang, dibuat rancang bangun proteksi katodik akhir.
• Modifikasi masih mungkin dilakukan bila ternyata proteksi katodik kurang sempurna.
BAB VI
RANCANG BANGUN SISTEM ANODA KORBAN
6.1 Pendahuluan
Dengan data tersebut di atas umumnya kita sudah dapat membuat rancang bangun. Pada umumnya pemilik struktur atau konsultannya akan memberikan data tersebut, tetapisangat sering data yang tersedia sangat minim. Bagi perancang yang sudah berpengalaman, dengan data minim tadi biasanya dapat membuat rancangan sedikit kasar, dan dengan memasukkan faktor-faktor keamanan, rancangannya dapat dipertanggung jawabkan.
Untuk rancang bangun sistem anoda korban ini akan berikan contoh rancang bangun proteksi katodik struktur pipa dalam tanah. Dari sini kita sudah memutuskan, bahwa anoda yang harus digunakan adalah anoda Mg. atau Zn. Berikut ini dasar pemilihan antara kedua anoda tersebut.
6.2 Penyajian
Beberapa hal mengenai penggunaan anoda Mg.
• Anoda Mg. dapat dgunakan sampai resistivitas tanah sekitar 6000 ohm-cm, di atas nilai tersebut kurang efisien dan mahal.
• Arus proteksi dapat didistribusikan dengan mudah, dengan memasangnya sepanjang jalur pipa.
• Selalu ada over-proteksi di dekat anoda. kerugian dapat dikurang dengan mengattur keluaran arus.
• Anoda Mg. tidak dapat digunakan bila lapis lindung struktur jenis coaltar, karena akan cepat rusak bila potensial struktur lebih rendah dari -1200mV CSE.
• Proteksi katodik dengan anoda Mg. selalu lebih mahal dari yang lain.
• Anoda menjadi lebih efisien kalau arus proteksi kecil, atau struktur yang diproteksi sedikit.
Beberapa hal mengenai penggunaan anoda Zn.
• Karena tegangan dorongnya rendah, maka anoda Zn hanya digunakan untuk tanah dengan resistivitas rendah, sampai maksimum 1500 ohm-cm. Belakangan orang menerapkan sampai resistivitas 3000 ohm-cm (publikasi tahun 1998).
• Over-proteksi tidak terjadi seperti halnya anoda Mg.
• Dengan anoda Zn dapat didisain umur proteksi 20 sampai 40 tahun, sedang dengan anoda Mg. umumnya kurang dari 20 tahun.
• Bila resistivitas tanah berubah, keluaran arus anoda Zn berubah sedikit saja, dan seolah-olah bertindak sebagai sistem proteksi potensial tetap.
• Anoda Zn dapat digunakan untuk lapis lindung jenis coaltar.
1. Contoh Rancang Bangun
Misalnya data yang diberikan untuk disain proteksi katodik kostruksi pipa gas dalam tanah sbb.:
Ukuran pipa : dia. 18” x 50 km (t= 0,375”)
Lapis lindung pipa : pita polietilen (polyethylene tape wrap ) overlap 5 cm, lulus uji holiday detector.
ROW tanah persawahan, perkebunan, ada river crossing, beberapa road crossing. Di sebelah kanan pipa ada pipa lain dia. 14” pada jarak sekitar 2m sejajar pipa baru,
yang diproteksi katodik dengan anoda korban. Umur proteksi yang diminta 20 tahun.
Resistivitas tanah rata-rata 2000 ohm-cm. Asumsi keperluan arus proteksi baja 20 mA/m2. Coating breakdown untuk umur 20 tahun 2,5%. Keperluan arus proteksi 0,5 mA/m2
Kesimpulan dari data :
• Sistem yang harus diterapkan adalah sistem anoda korban, karena di sebelahnya ada pipa yang juga menggunakan anoda koran.
• Anoda yang harus digunakan adalah anoda Mg. tipe potensial 1.5V dengan backfill, dilihat dari resistivitas tanah (anoda Zn boleh diusulkan).
• Keperluan arus proteksi umumnya 20 mA/m2 untuk kondisi telanjang.
• Lapis lindung baik, biasanya cacat dianggap antara 0,5% - 1% pada saat awal, rata-rata 2,5% untuk jangka waktu 20 tahun.
• Dalam hal ini pemilik telah menentukan keperluan arus proteksi 0,5mA/m2,
yaitu standar yang digunakan Pertamina untuk pipa baru dengan lapis lindung baik, untuk umur proteksi 20 tahun.
• (Untuk coating baik, menurut ISO 15589-1 (2003) untuk umur disain 20 tahun arus proteksi disain 0,6 mA/m2,jadi ausmsi tersebut diatas sangat wajar).
Selanjutnya kita melakukan perhitungan2 sebagai berikut.
2. Keperluan Arus Proteksi.
Luas permukaan yang diproteksi total = π x 18 x 0,0254 x 60.000 = 86137 m2.
Keperluan arus proteksi total, I = 86137 x 0,5 = 43068 mA = 43,068 A.
3. Tipe Berat Dan Jumlah Anoda Mg
guna faktor x kapasitas proteksi umur x I W =
Berat total anoda Mg. W = (I x umur proteksi)/ (kapasitas x faktor guna)
= (43,068 A x 20 Y x 8760 Jam/Y)/(1200 A.jam/kg x 0.8) = 7860 kg.
Karena 1 tahun = 24 jam/hari x 365 hari = 8760 jam
Untuk menentukan ukuran anoda ada pedoman (Rule of Thumb) :
Resitivitas tanah :
sampai 1500 ohm-cm ~ 25 kg sampai 2500 ohm-cm ~ 15 kg lebih dari 2500 ohm-cm ~ 8 kg
Rule of thumb ini ditentukan berdasarkan pengalaman lapangan. Berbeda dengan yang ada dibuku, karena perkembangan lapis lindung yang makin baik. Masalah ukuran anoda adalah masalah keluaran arus proteksi dikaitkan dengan keperluan arus proteksi.
Berdasar resistivitas tanah kita dapat menggunakan anoda ukuran 15 kg dan 8 kg. Tetapi biasanya orang memilih untuk meggunakan satu ukuran saja supaya sederhana, karena kita dapat melakukan suatu modifikasi di lapangan, misalnya jarak antara anoda diperbesar atau kita mengubur lebih dari satu anoda dalam satu lubang. Penerapan sistem anoda korban memang ada akal-akal tertentu dan keberhasilannya memang ditentukan di lapangan.
Untuk ini kita menentukan untuk menggunakan anoda tipe berat 15 kg, dan setelah mengecek yang ada di pasaran ternyata yang cocok adalah tipe berat, w = 14,5kg, dengan data.
Ukuran anoda Mg. : dia. D = 15 cm, Panjang L = 51 cm Dengan backfill : D = 20 cm, L = 60 cm Jumlah total anoda, N = W/w = 7860/14,5 = 543 buah.
Penyediaan anoda sebaiknya ditambah 10% untuk keamanan dan pemasanga di tempat-tempat kritis, seperti river crossing dsb. .
Pemesanan anoda = 543 x 110% = 598 buah.
Jarak pemasangan anoda : 60.000 m / 543 ~ 110 m. Di lapangan kita belum tentu (pada umumnya sukar) untuk secara eksak mengenai jarak ini, karena kondisi lapangan sangat menentukan. Modifikasi lapangan sering dilakukan, dan hal ini biasa bila menyangkut anoda korban.
4. Keluaran arus anoda.
Keluaran arus anoda, I = E/R
di mana E = 0,7 V, sedang R adalah tahanan anoda yang harus dihitung, menurut rumus : − = 1 D L 4 ln L π 2ρ Rh ohm 8 8 , 7 1 20 60 x 4 ln 60 π 2 2000 Rh = − = − = 1 D L 8 ln L π 2 ρ Rv ohm 58 , 11 1 20 60 x 8 ln 60 π 2 2000 Rv = − =
Rh = tahanan anoda bila dipasang horizontal
Rv = tahanan anoda bila dipasang vertikal
Jadi : Iah = 0,7/ 7,88 = 88,83 mA
Iav = 0,7/11,58 = 60,45 mA
Keluaran arus total, Ih = 543 x 88,83 = 48235 mA
Iv = 543 x 60,45 = 32824 mA
Kesimpulan : Kalau anoda dipasang horizontal arus anoda cukup. Kalau anoda dipasang vertkal arus anoda kurang.