PRODUKSI PEREAKSI IMUNOKIMIA UNTUK
PENGEMBANGAN TEKNIK ELISA OKRATOKSIN A
(OTA) DALAM RANGKA MONITORING KEAMANAN
PAKAN TERNAK
(Immunoreagent Production for Development of ELISA Ochratoxin-A
Technique in Monitoring Livestock Feed Security)
SRI RACHMAWATI
Balai Besar Penelitian Veteriner Jl. R.E. Martadinata No. 30, Bogor 16114
ABSTRACT
Ochratoxin A (OTA) contaminates feed material such as corn, starting from pre up to post harvest. For monitoring purpose of OTA contamination and quality control, there is a need to provide a tool capable of analyzing contaminant rapidly with high accuracy. Currently, there are only limited number of laboratories in Indonesia capable of analizing OTA, and mostly using the instrument such as HPLC which need big investation, skilled operator, long preparation, and expensive cost. So, immunodetection for quantifying OTA is necessary to be developed in Indonesia. The objective of this research was to produce the immunoreagent for development of OTA ELISA kit. The research activities involved: (a) Polyclonal antibody anti OTA production in rabbit serum; (b) preparation of OTA-HRP (horseraddish peroxidase) conjugate for development of direct competitive ELISA and (c) development and characterization of indirect and direct competitive ELISA to find out the sensitivity of reagents produced. Blood serum was coolected from 1st, 2nd, 3rd, and 4th bleeding, the serum was purified using protein A sepharose column, the IgG content were in the range of 1 – 6 mg/ml for 1st – 4th bleeding antibody. Indirect ELISA test using 3rd bleed antibody with IgG content of 1.7 mg/ml indicated that antibody anti OTA had the actifity given the high different of OD value (0.9) with the OD of control serum (pre-immunization serum) on dilution factor of 50. The diluted antibody of 1/400 (dilution factor of 400) still gave good response. Increasing activity of antibody of 3rd bleed also found by an increase of coating antigen OTA-BSA 0.4; 2 and 10 µg/ml. Liniearity testing of 3rd bleed antibody gave a linier curve in the range of 1 up to 100 ppb of OTA standard. However the response seemed not too sensitive as the percent inhibition given of 100 ppb OTA standard only 43%. Combination of coated antigen OTA-BSA and antibody still have to be studied to find out the optimum condition of indirect ELISA test. Immunoreagent of conjugate OTA-HRPO was also prepared for the direct ELISA test. Titration of conjugate gave value of 0.7 OD for 1/300 and 0.4 for 1/900. The conjugate test did not give a satisfied result. Further synthesizing and testing of conjugate still needed to find sensitive results.
Key Words: Feed, Food Safety, Ochratoxin A, ELISA Rapid Assay
ABSTRAK
Okratoksin A dapat mengkontaminasi bahan dasar pakan (jagung) sejak pra sampai pascapanen dan selama penyimpanan. Untuk sarana kontrol kandungan OTA dan sertifikasi mutu, diperlukan alat deteksi yang cepat, akurat, dan murah. Saat ini uji deteksi OTA di Indonesia baru dapat dilakukan di sedikit laboratorium uji mutu dengan menggunakan alat HPLC yang memerlukan investasi besar, operator khusus, preparasi sampel lama dan biaya analisis mahal. Teknik imunodeteksi memiliki potensi sangat sensitif dan spesifik sehingga perlu dikembangkan untuk deteksi dan kuantifikasi OTA. Teknik imunodeteksi juga dapat dikembangkan dalam bentuk kit uji (rapid assay) yang murah dan mudah digunakan sehingga terjangkau untuk sarana perbaikan mutu pakan. Penelitian bertujuan untuk menghasilkan pereaksi imunokimia untuk pengembangan kit ELISA OTA. Kegiatan penelitian meliputi: (a) Produksi antibodi poliklonal anti OTA dari anti serum kelinci; (b) pembuatan konjugat OTA-HRP (horseraddish peroxidase) untuk pengembangan direct
competitive ELISA, dan (c) Pengembangan dan karakterisasi indirect competitive dan direct competitive ELISA untuk mengetahui sensitivitas dari pereaksi yang dihasilkan. Telah diperoleh serum darah yang
column protein A dan telah pula dilakukan pengukuran kadar IgG nya. Diperoleh kadar IgG yang berkisar
antara 1 – 6 mg/ml dari pengumpulan serum bleed ke-1 sampai ke-4. Pada uji serum darah secara indirect
competitive ELISA dengan menggunakan serum darah bleeding ke-3, kadar IgG 1,7 mg/ml menunjukkan
adanya aktivitas antibodi anti OTA dengan nilai OD yang cukup tinggi dan selisih nilai OD dengan kontrol (serum pra-imunisasi) sebesar 0,9 pada penggunaan serum pengenceran 50 kali dan antibodi dapat digunakan sampai pengenceran 400 kali. Antibodi anti OTA memberikan respon meningkat pada bleed ke-1 dan ke-2, sedangkan pada bleed ke-3 dan ke-4 respon cenderung steady. Respon meningkat juga diperoleh pada penggunaan conjugated antigen OTA-BSA yang dilapis pada plat mikro konsentrasi 0,4 sd 10 µg/ml. Pada uji linearitas ternyata antibodi anti OTA bleed ke-3 dapat memberikan kurva linier dengan kisaran standar OTA 1 sampai dengan 100 ppb (ng/ml), namun belum begitu sensitif dimana pada konsentrasi OTA 100 ppb baru memberikan nilai inhibisi 43%. Kombinasi coated antigen dan antibodi masih perlu dipelajari untuk mendapatkan hasil yang cukup sensitif. Telah pula diperoleh konjugat OTA-HRPO pereaksi imunokimia untuk pengembangan direct competitive ELISA. Pada uji sensitivitas (titrasi konjugat) secara direct ELISA ternyata konjugat yang dibuat belum memberikan hasil yang memuaskan. Konjugat dapat digunakan dengan pengenceran 300 s/d 900 kali (1/300 s/d 1/900) dan memberikan nilai OD 0,7 dan 0,4. Untuk mendapatkan respon yang lebih sensitif, sintesis konjugat dan pengujian lebih lanjut masih diperlukan.
Kata Kunci: Pakan, Keamanan Pangan, Okratoksin A, ELISA Rapid Assay
PENDAHULUAN
Okratoksin adalah salah satu jenis toksin hasil metabolit sekunder dari kapang
Aspergillus ochraceus dan Penicillium
verrucosum (ICMSF, 1996; SINGLETON dan
SAINSBURY, 1997). Kondisi iklim di Indonesia dengan suhu dan kelembaban yang tinggi sangat mendukung untuk tumbuhnya berbagai jenis kapang tersebut pada bahan makanan terutama pada penyimpanan yang kurang baik. Okratoksin pertama kali ditemukan pada jagung di Afrika Selatan pada tahun 1965. Sejak itu toksin ini juga ditemukan pada berbagai bahan pangan, seperti gandum, sorgum, beras, kedelai, kacang-kacangan, kopra, kakao dan kopi. Bahan dasar pakan seperti jagung dilaporkan mengandung OTA relatif tinggi. Okratoksin terdiri dari tiga jenis yaitu A, B dan C, dan yang paling toksik adalah okratoksin A (OTA).
Okratoksin yang masuk ke dalam tubuh hewan percobaan dilaporkan dapat menyebabkan beberapa kerusakan organ, terutama ginjal (CHEREMISINOOFF et al., 1994).
WHO dan International Agency for Research on Cancer menggolongkan OTA sebagai senyawa toksik yang bersifat karsinogenik pada manusia (CHATURVEDI et al., 1999; ISMAYADI, 1997). Pengaruh utama OTA adalah menghambat sintesis RNA dan protein. Selain itu OTA juga berpengaruh terhadap peningkatan peroksidasi lipida dan menghambat produksi ATP dalam mitokondria
yang dapat menghambat aliran Cl- pada membran sel dalam ginjal.
Toksisitas akut dari OTA sangat bervariasi antar spesies, namun sampai saat ini belum pernah dilaporkan adanya kasus keracunan akut pada manusia. Meskipun demikian pengaruh kronik pada hewan dan manusia akibat terkontaminasi OTA dosis rendah secara terus menerus lebih berbahaya, terutama pada organ ginjal (ISMAYADI, 1997). OTA dengan dosis 100 µg yang masuk ke tubuh ternak ayam secara oral maupun subcutan dapat menyebabkan kematian dengan kerusakan berupa visceral gout, sedangkan secara mikroskopik terlihat adanya nekrosis yang akut, degenerasi pada hati atau nekrosis fokal dan enteritis (PECKHAM et al., 1971). Pemberian OTA 4 mg / kg/ hari selama 2 bulan terhadap ayam pedaging menyebabkan kematian sebesar 42% (GIBSON et al., 1990). OTA juga sangat toksik terhadap embrio ayam. Inokulasi OTA dosis 0,01 hingga 0,05 µg embrio ayam pada hari ke-8 memperlihatkan retardasi pertumbuhan fetus, mikrotalmia maupun paruh bengkok (EDRINGTON et al., 1995). Percobaan pada sapi umur 5 minggu yang diberi OTA sangat tinggi (11 – 25 mg/kg berat badan) secara oral menyebabkan kematian dalam waktu 24 jam. Sedangkan pemberian 13,3 mg/kg melalui lambung pada sapi laktasi menyebabkan terdeteksinya residu OTA 650 µg/l dan 4500 µg/l di susu pada hari berikut pascapemberian OTA (RUBELIN et al., 1978). OTA dalam daging menghilang 24 jam
dihentikan dan bertahan hingga lebih dari 48 jam di hati dan ginjal, namun di lemak dan kulit tidak ditemukan adanya residu OTA (PRIOR dan SISCODIA, 1978).
Hasil survei di Indonesia dari basal diet pakan, terutama jagung menunjukkan bahwa bahan-bahan tersebut terkontaminasi mikotoksin, diantaranya aflatoksin, okratoksin A, dan zearalenon (TANGENDJAYA et al., 2008). Kadar OTA dalam jagung lokal terdeteksi rata-rata 2,42 ppb (dari 328 sampel yang dianalisis, kisaran tidak terdeteksi sampai tertinggi 59,6 ppb). Jagung impor dari Amerika juga mengandung OTA rata-rata 0,7 ppb (22 sampel, kisaran tt – 5,7 ppb).
Untuk sarana kontrol kandungan OTA dan sertifikasi mutu bahan pakan jagung, diperlukan alat deteksi yang cepat, akurat, dan murah. Teknik imunodeteksi yang dikenal sangat sensitif dan spesifik perlu dikembangkan untuk deteksi dan kuantifikasi OTA. Teknik imunodeteksi juga dapat dikembangkan dalam bentuk kit uji (rapid
assay) yang murah dan mudah digunakan
sehingga terjangkau untuk sarana perbaikan mutu bahan pakan dan pakan ternak. Untuk pengembangan kit ELISA OTA ini diperlukan pereaksi imunokimia, maka dilakukan pembuatan antibodi anti OTA yang diperoleh dengan mengimunisasi kelinci New Zealand White dengan antigen OTA-BSA dan dilakukan pula pembuatan konjugat OTA-HRPO serta pengembangan format ELISA.
MATERI DAN METODE Produksi antibodi anti OTA
Antibodi terhadap OTA dihasilkan dengan menyuntikkan antigen OTA-BSA komersial (Sigma 108K4036) ke dalam tubuh kelinci secara subcutan. Jadwal dan dosis penyuntikan antigen OTA-BSA adalah sebagai berikut; suntikan pertama dengan dosis 0,5 mg/ml OTA-BSA yang dicampur dengan Freund’s
complete adjuvant (1 : 1, v/v), 2 minggu
kemudian dilakukan dua kali suntikan booster menggunakan dosis OTA-BSA sebesar 0,25 mg/ml yang dicampur dengan Freund’s
complete adjuvant, suntikan 2 kali booster
dilakukan dengan interval waktu 2 minggu.
Sepuluh hari setelah suntikan booster kedua diberikan, kelinci diambil darahnya, untuk kemudian diuji kualitas antibodi yang dihasilkan. Namun, biasanya dari darah yang diambil pertama kali belum diperoleh kualitas antibodi yang baik. Selanjutnya injeksi booster berikut tetap diberikan dengan dosis 0,25 mg/ml OTA-BSA yang dicampur dengan
Freund’s complete adjuvant setiap 1 bulan
sekali, dan setiap 10 hari setelah suntikan
booster, pengambilan darah kelinci dilakukan
untuk yang kedua, ketiga sampai kelima. Darah kelinci dikumpulkan, kemudian diambil serumnya dan serum/antibodi dimurnikan dengan menggunakan Protein A sepharose
column dan selanjutnya diukur kadar IgG nya
dengan alat spektrofotometer. Antibodi yang sudah dipurifikasi diawetkan dengan penambahan sodium azide atau thimerosal kemudian disimpan dalam botol-botol kecil di dalam freezer untuk jangka waktu lama. Sebagian antibodi yang digunakan untuk pengujian disimpan dalam refrigerator (4°C).
Pembuatan konjugat
Pembuatan konjugat OTA-horseraddish
peroxidase (OTA-HRP) untuk pengembangan direct competitive ELISA dilakukan mengacu
pada metode CHU et al. (1982) dan STAROS et
al. (1986) dalam KWAK dan SHON (2000).
Secara garis besar 1 mg dari N-NHS, 50 μl 10% ethylenediamine (EDA) dan 50 mg EDC ditambahkan ke dalam larutan HRP (3 mg HRP dalam 650 μl air destilasi). Campuran reaksi dipertahankan pada pH kira-kira 5,5 dengan penambahan 1N HCl, kemudian campuran diaduk selama 24 jam pada temperatur kamar di tempat yang tidak tembus cahaya (ruang gelap). Kemudian ke dalam larutan EDA-HRP ini ditambahkan 48 mg EDC; 2,15 mg S-NHS dan 400 μl larutan OTA (1 mg/ml dalam etanol). Campuran reaksi diaduk selama 24 jam pada suhu kamar, selanjutnya larutan campuran didialisis dalam PBS sebanyak empat kali. Hasil konjugasi diukur sensitivitasnya dengan melakukan titrasi konjugat pada plate mikro dengan metode
direct ELISA, sedangkan sensitivitas antibodi
diukur dengan mengujinya secara indirect
Pengujian respon/aktivitas antibodi dan pengembangan/karakterisasi ELISA
Karakterisasi tes ELISA meliputi uji sensitivitas, dengan menguji respon antibodi OTA dan konjugat OTA-HRPO secara indirect atau direct competitive ELISA (XIANG et al.,
2007). Respon antibodi juga diuji secara dot
blot yang dilakukan mengikuti prosedur ATKIN
et al. (1995)
Prosedur indirect ELISA menggunakan 100 μl (0,4; 2,0 dan 10 ug/ml) antigen OTA-BSA dalam coating buffer karbonat. Buffer berisi OTA-BSA dilapis pada microplate, dan diinkubasi selama 24 jam pada suhu kamar. Keesokan harinya plate dicuci dalam PBS/T sebanyak tiga kali. Selanjutnya ke dalam plate ditambahkan 200 μl larutan pemblok (skim
milk 2,5% dalam PBS), diinkubasi selama 1
jam suhu kamar, kemudian dicuci kembali dalam PBS tiga kali. Ke dalam setiap lubang
plate ditambahkan 100 μl OTA antibodi yang
diencerkan dalam 1% BSA dalam PBS dan 100 μl standar OTA atau standar mikotoksin lain, diinkubasikan selama 1 jam. Plate kemudian dicuci lagi dalam PBS/T tiga kali. Ke dalam lubang-lubang plate yang sudah kering ditambahkan 100 μl IgG-HRP goat anti rabbit larutan encer (1/2500). Reaksi dibiarkan selama 1 jam lagi, dicuci kembali dan kemudian ditambahkan larutan substrat (0,01% TMB dalam Buffer sitrat) dan didiamkan selama 30 menit sampai terbentuk warna. Reaksi enzim dihentikan dengan penambahan 50 μl 1,25 M asam sulfat. Pembentukan warna dibaca dengan ELISA reader pada panjang gelombang 450 nm. OD rata-rata didapatkan dari 2 lubang per perlakuan.
Untuk pengembangan metode direct
ELISA, konjugat OTA-HRPO perlu
dipersiapkan/dibuat. Tahapan tes (titrasi) konjugat secara direct ELISA yaitu pertama antibodi OTA dilapiskan pada pelat mikro (microplate) (100 μl, 10 μg/ml anti-OTA/lubang), kemudian diinkubasi selama 24 jam pada suhu kamar. Keesokan harinya antibodi OTA dicuci seperti pada prosedur
indirect ELISA, kemudian ditambahkan 100 μl
OTA-HRP konjugat (berbagai pengenceran 1/100 – 1/2700) ke dalam setiap lubang dan
reaksi didiamkan selama 1 jam pada temperatur kamar. Selanjutnya reaksi warna dibuat seperti pada metode indirect dengan penambahan substrat dan larutan penghenti reaksi dan dilakukan pembacaan intensitas warnanya.
HASIL DAN PEMBAHASAN Produksi antibodi anti OTA
Serum darah telah berhasil dikumpulkan pada lima kali pengambilan, yaitu bleeding ke-1 sampai 5. Pada pengambilan darah ke-3, 4 dan 5 berhasil dikumpulkan sebanyak 20 – 30 ml darah untuk setiap ekor kelinci, selanjutnya dipisahkan serum darahnya dan diperoleh kira-kira 15 – 20 ml serum darah. Serum darah selanjutnya dimurnikan dengan menggunakan kolom Protein A Sepharose, masing-masing untuk setiap 2,5 ml serum diencerkan (1 : 1) dengan diluent buffer fosfat yang mengandung asam kaproat 25 mM dan IgG-nya dielusi dengan elution buffer (natrium sitrat 0,2 M; pH 4,0), dimana hasil elusi 1 dan 2 ditampung/ dikumpulkan dan diukur kadar IgG-nya secara spektrofotometer pada panjang gelombang 280 nm. Kadar IgG (mg/ml) diperoleh dari nilai OD serum darah kali faktor pengenceran dibagi
distinction coefficient IgG (1,36). Protein A sepharose column sangat baik digunakan untuk
pemurnian serum kelinci karena sangat kuat mengikat molekul IgG, dimana sepasang protein A dapat mengikat sedikitnya dua molekul IgG. Protein A merupakan reagen yang diisolasi dari Staphylococcus aureus, merupakan rantai polipeptida dan mempunyai afinitas yang sangat tinggi terhadap fragmen
crystalizable dari imunoglobulin (Ig) terutama
IgG dari spesies mamalia dan dapat menghasilkan preparat yang sangat murni. (WILEY dan INC, 1999). Hasil pengukuran dan perhitungan kadar IgG dari purified serum seperti pada Tabel 1. Untuk setiap 2,5 ml serum darah dapat dikumpulkan kira-kira 10 ml purified serum, yang selanjutnya pH eluant dinetralkan dengan tris basa pH 11, dan disimpan pada suhu freezer (-4°C) dalam botol-botol kecil. Untuk pengujian purified
Tabel 1. Kadar IgG purified serum (antibodi anti OTA) pada berbagai bleeding
IgG (mg/ml), pada elusi
Kelinci A Kelinci B
Pengambilan darah ke-
1 2 1 2
1 3,6 1,6 6,3 2,7
2 3,1 1,0 3,5 1,5
3 1,8 1,3 2,2 1,3
4 1,8 1,1 1,9 1,1
Pembuatan konjugat dan pengujian direct
ELISA
Konjugat OTA-HRPO diperlukan untuk pengembangan format direct competitive
ELISA, biasanya format direct competitive
lebih sensitif dibandingkan dengan indirect
competitive ELISA. Telah diperoleh konjugat
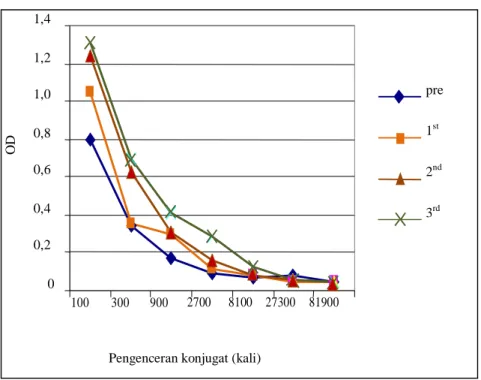
OTA-HRPO, namun pada pengujian aktivitas, konjugat belum memberikan hasil optimum, seperti pada Gambar 1. Pada penggunaan 1/300 dan 1/900 (pengenceran 300 dan 900 ×) dengan
coating antibodi bleeding ke-3, respon
konjugat memberikan nilai OD 0,7 dan 0,4.
Pengujian respon/aktivitas antibodi/Indirect
competitive ELISA
Hasil pengujian aktivitas antibodi anti OTA secara indirect competitive ELISA disajikan pada Tabel 2. Purified serum yang diuji adalah dari bleeding ke-1 s/d ke-3, dibandingkan dengan serum kelinci yang diambil sebelum diimunisasi (pra-imunisasi). Kondisi penetapan yaitu plat dilapis dengan coating antigen OTA-BSA konsentrasi 10 µg/ml setiap lubang. Plat dicuci, dikeringkan, ditambahkan blocking
solution skim milk 2,5% dalam PBS (100 ul/
lubang) diinkubasi 2 jam, dicuci kembali,
Gambar 1. Hasil titrasi konjugat OTA-HRPO pada penggunaan coating antibodi anti OTA pengambilan
darah (bleeding) ke-1 s/d 3 (1/100)
Respon konjugat OTA-HRPO
0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 100 300 900 2700 8100 27300 81900
Pengenceran konjugat (kali)
O D pre 1st 2nd 3rd
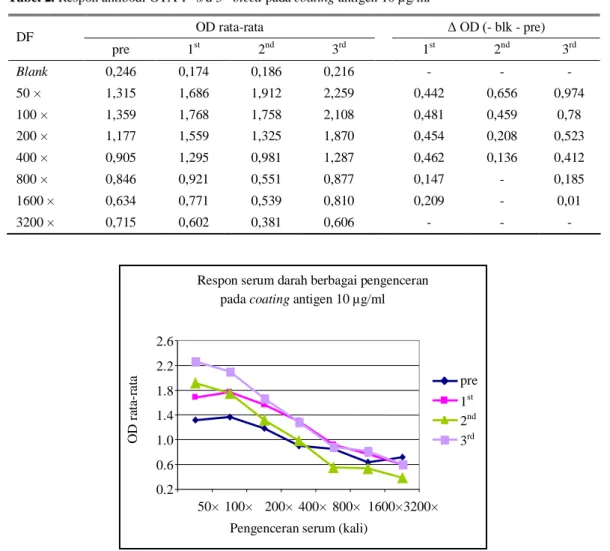
kemudian ditambahkan 100 µl purified serum berbagai pengenceran mulai dari 1/50 (50 ×) sampai 1/3200 (3200 ×), diinkubasikan selama 1 jam, dicuci kembali dan selanjutnya ditambahkan konjugat (Goat anti rabbit-HRPO = 1/2500) diinkubasi kembali 1 jam, dicuci kembali dan akhirnya ditambahkan substrat TMB/sitrat buffer untuk pengembangan warna hijau dan reaksi dihentikan dengan menambahkan asam sulfat 1,25 M masing-masing 50 µl/lubang, warna berubah kuning dan diukur serapannya pada panjang gelombang 450 nm. Pada plat berbeda dilakukan pula hal yang sama seperti di atas, namun berbeda pada penggunaan coating antigen yaitu konsentrasi 0,4 µg/ml dan 2,0 ng/ml. Terlihat pada Tabel 2 dan Gambar 2, bahwa respon antibodi meningkat dari mulai
bleeding ke-1 sampai ke-3, dan pada
penggunaan serum pra-imunisasi juga menunjukkan adanya respon tidak spesifik, namun pada bleeding ke-3 terlihat perbedaan/selisih nilai OD yang cukup tinggi pada pengenceran 1/50 yaitu 0,974 sampai pengenceran 1/400 (selisih nilai OD 0,412) menunjukkan adanya respon spesifik antibodi anti OTA.
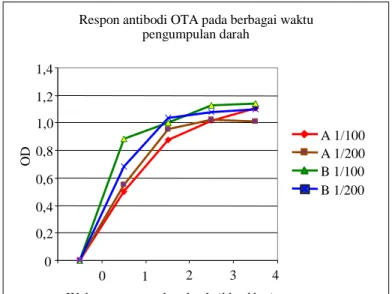
Respon antibodi juga ditunjukkan cukup jelas pada Gambar 3, dimana pada penggunaan antibodi yang dikumpulkan dari kelinci A dan B pada berbagai waktu bleeding dan dengan pengenceran 100 – 200 kali (1/100 dan 1/200),
coating antigen OTA-BSA 0,4 µg/ml pada plat
mikro terlihat respon antibodi meningkat mulai
bleed ke-1 sampai bleed ke-2 dan mulai steady
pada pengambilan darah ke-3 dan ke-4.
Tabel 2. Respon antibodi OTA 1st s/d 3rd bleed pada coating antigen 10 µg/ml
OD rata-rata Δ OD (- blk - pre) DF pre 1st 2nd 3rd 1st 2nd 3rd Blank 0,246 0,174 0,186 0,216 - - - 50 × 1,315 1,686 1,912 2,259 0,442 0,656 0,974 100 × 1,359 1,768 1,758 2,108 0,481 0,459 0,78 200 × 1,177 1,559 1,325 1,870 0,454 0,208 0,523 400 × 0,905 1,295 0,981 1,287 0,462 0,136 0,412 800 × 0,846 0,921 0,551 0,877 0,147 - 0,185 1600 × 0,634 0,771 0,539 0,810 0,209 - 0,01 3200 × 0,715 0,602 0,381 0,606 - - -
Respon serum darah berbagai pengenceran pada coating antigen 10 µg/ml
0.2 0.6 1.0 1.4 1.8 2.2 2.6 50× 100× 200× 400× 800× 1600× 3200× Pengenceran serum (kali)
O D r at a-ra ta pre 1st 2nd 3rd
Gambar 3. Respon antibodi pada berbagai waktu pengumpulan darah
Gambar 4. Respon serum darah pada berbagai konsentrasi coating antigen OTA-BSA
Pada penggunaan coating antigen OTA-BSA 0,4; 2,0 dan 10 µg/ml dan 1/100 antibodi
bleeding ke-3, memberikan respon/aktivitas
antibodi yang meningkat dengan pembacaan OD yang lebih tinggi pada coating antigen 10 µg/ml, dan terlihat jelas pula respon antibodi
bleed ke-3 lebih tinggi Gambar 4.
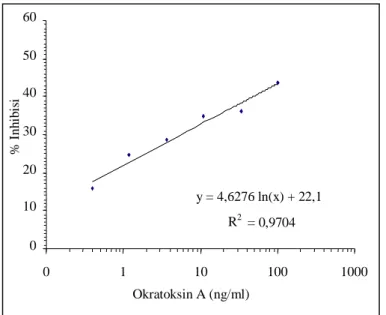
Pengujian linieritas diperlukan untuk suatu analisa kuantitatif, serum darah/antibodi diuji apakah dapat memberikan kurva linier terhadap seri standar OTA, yang menandakan adanya respon spesifik antibodi anti OTA. Pada Gambar 5, terlihat bahwa kurva linier diperoleh pada kisaran konsentrasi OTA 0,4 Respon antibodi OTA pada berbagai waktu
pengumpulan darah 0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 0 1 2 3 4
Waktu pengumpulan darah (bleed ke-)
O D A 1/100 A 1/200 B 1/100 B 1/200
Respon serum darah pada berbagai konsentrasi coating antigen OTA-BSA
0,4 0,8 1,2 1,6 2,0 2,4 0,4 2,0 10 OTA-BSA coated (µg/ml) O D - ra ta -r at a pra 1st 2nd 3rd
Gambar 5. Respon linear antibodi anti OTA bleeding ke-3
sampai 100 ng/ml (ppb), pada penggunaan antibodi bleeding ke-3 pengenceran 1/200 dengan coating antigen 0,4 µg/ml setiap lubang. Namun % inhibisi yang diperoleh untuk 100 ppb OTA belum mencapai optimal, hanya 44%. pengujian dengan berbagai variasi konsentrasi coating antigen OTA-BSA dan konsentrasi/pengenceran serum/antibodi perlu dicoba untuk mendapatkan kondisi penetapan yang optimal.
KESIMPULAN
Dari penelitian yang dilakukan telah diperoleh serum darah yang dikoleksi pada
bleeding 1 hingga 5, dan serum telah
dipurifikasi menggunakan kolom protein A
sepharose dengan kadar IgG berkisar antara
1 – 6 mg/ml. Pengujian secara direct
competitive ELISA, konjugat OTA-HRPO,
dapat digunakan dengan pengenceran 1/300 atau 1/900 dan nilai OD yang diberikan yaitu 0,7 dan 0,4. Penggunaan kombinasi konsentrasi
coating antigen 0,4 ug/ml dan antibodi bleeding ke-3 pengenceran 1/200 pada uji
secara indirect competitive ELISA memberikan kurva linier pada kisaran 0,4 sampai 100 ng/ml OTA. Kombinasi konsentrasi coating antigen OTA-BSA dan antibodi masih perlu dipelajari untuk mendapatkan kondisi penetapan yang
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada Dewan Riset Nasional, Kementerian Negara Riset dan Teknologi, yang telah mendanai kegiatan penelitian ini melalui program Insentif Riset Terapan tahun 2010, dan tim yang telah membantu dalam pelaksanaan.
DAFTAR PUSTAKA
ATKIN A.L., N. ALTAMURA, P. LEEDS and H.R. CULBERTON. 1995. Immunobilon-P membranes from Milipore works (for Immunoblotting protocols). Mol. Biol. Cell. 6: 611 – 625.
CHATURVEDI,P.,T.SMITH,N.ZABE and B.A.KOHN. 1999. A New Method for Simultaneous Aflatoxin and Ochratoxin Cleanup for HPLC Analysis in Grain. Annual Meeting of the IFT (Institute of Food Technologists), Chicago. 64-8.
CHEREMISINOOFF, N.P.,J.A. KING and R.BOYKO. 1994. Dangerous Properties of Industrial and Consumer Chemicals. Marcel Dekker Inc., New York, p. 520.
EDRINGTON,T.S.,R.B.HARVEY and L.F.KOMENA. 1995. Toxics effects of aflatoxin B1 and ochratoxin A, alone and in combination, on chicken embryos. Bull. Environ. Contam. y = 4,6276 ln(x) + 22,1 R2 = 0,9704 0 10 20 30 40 50 60 0 1 10 100 1000 Okratoksin A (ng/ml) % I nh ib is i
INTERNATIONAL COMMISSION ON MICROBIOLOGICAL SPECIFICATION FOR FOODS (ICMSF). (1996). Microorganisms in Food. Blackie Academic and Professional, London.
ISMAYADI, C. 1997. Acaman kontaminasi okhratoksin A pada kopi. Warta Pusat Penelitian Kopi 13(1): 20 – 27.
KWAK, B.Y. and D.H. SHON. 2000. Detection of ochratoxin A in agricultural commodities using enzyme-linked immunosorbent assay. Food Sci. Biotechnol. 9(3): 168 – 173. GIBSON,R.C.,C.BALEY,L.KLUENA,W.HUFF and
R. HARVEY. Impact of phenilallanin supplementation on the performance of three weeks old broiler fed diet containing ochratoxin A. Effect on body weight, feed conversion, relative organ weight, and mortality. Poult. Sci. 69: 414 – 419.
PECKHAM,I.C.,B.DOUPNIK JR. and O.H.JONES JR. 1971. Acute toxicity of ochratoxin A and B in chicks. Appl. Microbiol. 21(3): 492 – 494.
PRIOR,M.G.and C.S.SISODIA. 1978. Ochratoxicosis in white Leghorn hens. Poult. Sci. 57(3): 619 – 623.
RUBELIN,W.E.,F.FUKUSHIMA andP.E.STILL. 1978. The toxicity of ochratoxin in ruminants. Can. J. Comp. Med. 42: 172 – 176.
SINGLETON,P.and D.SAINSBURY. 1997. Dictionary of Microbiology and Molecular Biology. John Wiley and Sons, Chester. 7: 64 – 65.
TANGENDJAYA, B., S. RACHMAWATI and E.WINA. 2008. Mycotoxin contamination on corn used by feed mills in Indonesia. Indon. J. Agri. Sci. 9(2): 68 – 76.
WILEY,J. and S. INC. 1999. Antibody Purification. New York Publisher. pp. 27 – 35.
XIANG, H.W, T.L. XU and Y.Z. WANG. 2007. Enzyme linked immunosorbent assay and coloidal gold immunoassay for ochratoxin A: investigation of analytical condition and sample matrix on assay performance. Anal. Bioanal. Chem. 389: 903 – 911.
DISKUSI
Pertanyaan:
Aplikasi konjugat bagaimana?
Jawaban:
Konjugat untuk pengembangan direct competitive. Coating antibiotik yang memberikan respon. Semalam diinkubasi di-blocking oleh skim powder baru di tambah standar okratoksin, harus ada kompetisi, cuci baru diberi warna.