OPTIMASI METODE PENETAPAN KADAR HEPTAMINOL HCl DENGAN AGEN PENDERIVATO-FTALALDEHID SECARA
SPEKTROFOTOMETRI ULTRAVIOLET
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Fitriana Susanti
NIM : 078114108
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Fitriana Susanti
NIM : 078114108
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Success is not the key to happiness. Happiness is the key to
success. If you love what you are doing, you will be successful
(Albert Schweitzer)
JESUS looked at them and said,
“With man this is impossible,
but with GOD all things are possible.”
Matthew 19 : 26
Karya ini kupersembahkan untuk :
Papa, mama, dan kakakku tercinta sebagai ungkapan terima kasihku atas
semua doa, dukungan, dan semangatnya selama menyelesaikan studi.
vi
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas
segala anugerah dan bimbingan-Nya kepada penulis selama menyelesaikan
penelitian ini.
Skripsi berjudul “Optimasi Metode Penetapan Kadar Heptaminol HCl
dengan Agen Penderivat o-ftaladehid secara Spektrofotometri Ultraviolet” ini
disusun dalam rangka untuk memenuhi salah satu syarat memperoleh gelar
Sarjana Farmasi (S.Farm) Program Studi Ilmu Farmasi Universitas Sanata
Dharma.
Keberhasilan dalam penulisan skripsi ini juga tidak terlepas dari bantuan
dan dukungan berbagai pihak yang telah memberikan saran, kritik, dan dukungan
kepada penulis, maka dari itu penulis mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Tuhan Yesus Kristus dan Bunda Maria, penolongku
2. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
3. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen pembimbing yang
dengan sabar memberikan pengarahan, masukan, kritik dan saran baik
selama penelitian maupun penyusunan skripsi ini.
4. Christine Patramurti, M.Si., Apt. selaku dosen penguji yang telah
vii
7. PT. Corsa Indonesia yang telah bersedia memberikan baku heptaminol
HCl yang berguna dalam skripsi.
8. Kak Seny yang telah memberikan bantuan reageno-ftalaldehid.
9. Segenap dosen dan karyawan atas ilmu dan pengalaman yang berharga
sehingga berguna dalam proses penyusunanan skripsi.
10. Pak Parlan dan Mas Bimo selaku laboran Laboratorium Kimia Organik
dan Laboratorium Kimia Analisis Instrumental, Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta yang telah banyak membantu
selama proses penelitian di laboratorium.
11. Pak Bambang dan Mas Devi selaku laboran Laboratorium Analisis
Makanan, Fakultas Farmasi Universitas Gadjah Mada Yogyakarta atas
bantuan dan kerjasamanya selama penelitian.
12. Teman-teman seperjuangan dan sahabatku, Agnes Anania dan Anggun
Aji Mukti. Terima kasih atas kebersamaan, kekompakan, pengalaman
suka maupun duka selama melakukan penelitian ini. Kita percaya kita
bisa, dan kita telah melakukannya.
13. Papa, Mama dan Hendrikus, yang tak pernah bosan memberikan
semangat, doa, dan dukungan sampai akhirnya skripsi ini selesai.
14. Fandri, atas semangat “kemauan keras”, dukungan, perhatian, diskusi,
viii
15. Oki, Putri, Riris, Septi, Fetri, Selasih, dan Pace atas segala dukungan,
semangat dan persahabatan yang terjalin selama perkuliahan.
16. Sahabat-sahabatku, Neisya dan Catrin, terima kasih untuk tiap semangat,
doa dukungan, dan tempat berbagi cerita.
17. Teman-teman kost Flaurent (Ci Grace, Ci Yustine, Ci Dian, dan Ci
Vanny) yang telah memberikan keceriaan, kebersamaan, dan dukungan
kepada penulis.
18. Teman-teman kelompok praktikumku, khususnya Tiwi, Tere, Lilis,
Yunita, Devina, Ardi, Dani, Wawan, dan Yudi terima kasih atas
kekompakan dan kerjasama selama perkuliahan dan praktikum.
19. Teman-teman Fakultas Farmasi angkatan 2007 kelas C dan kelas Farmasi
Sains dan Teknologi (FST) A terima kasih atas kebersamaan kita selama
ini yang tak mungkin terlupakan.
20. Semua pihak yang telah membantu penulis dan tidak tertulis di sini,
terima kasih atas semua bantuannya.
Penulis menyadari bahwa penyusunan skripsi ini masih banyak
kekurangan, untuk itu penulis dengan senang hati menerima segala kritik dan
saran yang dapat membangun penelitian ini. Akhir kata, penulis berharap hasil
penelitian ini dapat bermanfaat bagi pembaca sekalian.
Yogyakarta
x
DAFTAR ISI
HALAMAN JUDUL ...i
HALAMAN PERSETUJUAN PEMBIMBING ...ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ...iv
LEMBAR PERNYATAAN PUBLIKASI...v
PRAKATA...vi
PERNYATAAN KEASLIAN KARYA ...ix
DAFTAR ISI...x
DAFTAR TABEL...xiv
DAFTAR GAMBAR ...xv
DAFTAR LAMPIRAN...xvii
INTISARI ...xviii
ABSTRACT...xix
BAB I PENGANTAR ...1
A. Latar Belakang ...1
1. Perumusan Masalah ... 4
2. Keaslian Penelitian ... 4
xi
A. Heptaminol HCl ...7
B.O-ftalaldehid (OPA)... 8
C. Derivatisasi...10
D. Spektrofotometri UV ... 10
E. Landasan Teori ...15
F. Hipotesis ...17
BAB III METODE PENELITIAN ...18
A. Jenis dan Rancangan Penelitian ...18
B. Variabel Penelitian ... 18
1. Variabel Bebas ...18
2. Variabel Tergantung ...18
3. Variabel Pengacau Terkendali ...18
C. Definisi Operasional... 19
D. Bahan dan Alat Penelitian...19
1. Bahan Penelitian ... 19
2. Alat Penelitian...20
xii
1. Pembuatan Larutan Stok Heptaminol HCl ...20
2. Pembuatan Dapar Borat pH 8, 9, dan 10 ...20
3. Pembuatan Larutan OPA ...21
4. Penentuan Panjang Gelombang Maksimum Pengukuran ...21
5. Penentuan pH Dapar Optimum...22
6. PenentuanOperating Time(OT) ...22
7. Penentuan Nilai Ekstingsi Molar (ε)...23
F. Analisis Hasil...24
1. Panjang Gelombang Maksimum...24
2. pH Dapar Optimum ...24
3. Waktu (Operating Time)...24
4. Nilai Ekstingsi Molar (ε) ...24
BAB IV HASIL DAN PEMBAHASAN ...25
A. Pembuatan Larutan ... 25
1. Larutan Heptaminol HCl ...25
2. Larutan Dapar Borat ...25
3. Larutan OPA ...26
4. Larutan Baku Heptaminol HCl ...28
xiii
E. PenentuanOperating Time(OT) ...41
F. Penentuan Nilai Ekstingsi Molar (ε)...44
BAB V KESIMPULAN DAN SARAN ...46
A. Kesimpulan ...46
B. Saran...46
DAFTAR PUSTAKA ...47
LAMPIRAN...49
xiv
DAFTAR TABEL
Tabel I. Data penentuan pH dapar optimum... 39
Tabel II. Data penentuanoperating timeantara heptaminol dengan agen
penderivat OPA... 42
xv
Gambar 2. Strukturo-ftalaldehid (OPA) ... 8
Gambar 3. Reaksi antara OPA dengan amina primer ... 9
Gambar 4. Diagram tingkat energi elektronik ...12
Gambar 5. SpektrofotometerSingle-beam...15
Gambar 6. SpektrofotometerDouble-beam...15
Gambar 7. Reaksi cannizzaro pada OPA...27
Gambar 8. Reaksi pembentukan heptaminol HCl menjadi heptaminol...29
Gambar 9. Reaksi derivatisasi heptaminol dengan agen penderivat OPA...30
Gambar 10. Mekanisme reaksi derivatisasi heptaminol dengan agen penderivat OPA yang diusulkan...31
Gambar 11. Gugus kromofor dan auksokrom pada heptaminol hasil derivatisasi ...32
Gambar 12. Reaksi degradasi hasil derivat antara OPA dengan heptaminol ...32
Gambar 13. Mekanisme reaksi degradasi hasil derivat yang diusulkan ...33
xvi
Gambar 15. Spektra absorbansi OPA ...36
Gambar 16. (A) Spektra absorbansi hasil derivatisasi setelah 1,5 menit
penambahan heptaminol dengan reagen OPA (menit ke-0
reaksi); (B) spektra absorbansi hasil derivatisasi setelah 1
jam reaksi...37
Gambar 17. Spektra absorbansi hasil derivatisasi heptaminol HCl
dengan OPA pada dapar borat pH 8, 9, dan 10 ...39
Gambar 18. Spektra absorbansi untuk penentuan OT ...41
Gambar 19. Perkiraan spektra absorbansi hasil derivatisasi setelah 15
xvii
Lampiran 3. Spektra hasil penentuan panjang gelombang maksimum
senyawa derivat hasil reaksi antara heptaminol HCl dengan
agen penderivat OPA ... 56
Lampiran 4. Spektra hasilscanningpenentuan pH dapar optimum untuk reaksi derivatisasi antara heptaminol HCl dengan agen penderivat OPA...66
Lampiran 5. Data penentuan pH dapar borat optimum... 75
Lampiran 6. Spektra absorbansi untukoperating time... 76
Lampiran 7. Data penentuan OT ...80
xviii
INTISARI
Heptaminol merupakan salah satu obat generik yang banyak digunakan masyarakat untuk berbagai tujuan medis, baik untuk pengobatan hipotensi ortostatik, kardiotonik, maupun sebagai vasodilator. Saat ini masih jarang dilakukan penelitian tentang analisis heptaminol dengan metode spektrofotometri karena heptaminol tidak memiliki gugus kromofor dan auksokrom, sehingga susah ditetapkan kadarnya. Oleh karena itu, dibutuhkan metode analisis alternatif untuk penetapan kadar heptaminol yaitu melalui derivatisasi menggunakan agen penderivat o-ftalaldehid (OPA) secara spektrofotometri UV untuk meningkatkan sensitivitasnya.
Hasil derivat yang terbentuk dari derivatisasi heptaminol HCl dengan agen penderivat OPA kurang stabil dan dapat terdegradasi seiring dengan berjalannya waktu. Oleh karena itu, perlu dilakukan penelitian optimasi derivatisasi heptaminol HCl dengan agen penderivat OPA untuk mendapatkan kondisi optimum yang akhirnya dapat digunakan untuk menetapkan kadar heptaminol HCl.
Penelitian ini merupakan jenis penelitian eksperimental. Kondisi optimum hasil penelitian yang diperoleh adalah absorbansi maksimum pada panjang gelombang 332 nm, pH dapar optimum adalah dapar borat pH 9, operating time
atau waktu reaksi optimumnya adalah pada menit ke-15. Nilai koefisien ekstingsi molar (ε) rata-rata dari derivat adalah 667,354 M-1cm-1.
xix
hypotension, cardiotonic, and vasodilator. Nowadays, research for determination heptaminol by spectrophotometry is rare because heptaminol has no chromophore and auxochrome groups, so it is hard to determine the heptaminol. Therefore, we need an alternative analysis method for determination of heptaminol through derivatization using o-phthalaldehyde (OPA) by UV spectrophotometry to improve its sensitivity.
Derivative heptaminol is less stable and can be degraded over time. Therefore, optimation is needed to obtain optimum conditions that ultimately may be used to determine heptaminol HCl.
This study is an experimental design. The optimum conditions obtained research results are the maximum absorbance at a wavelength of 332 nm, optimum pH buffer for derivatization reaction between heptaminol HCl and the OPA is buffer borate pH 9, operating time or optimum time for derivatization reaction is on minute of 15. The average of extinction molar coefficient of the derivates is 667,354 M-1cm-1.
1
BAB I PENGANTAR
A. Latar Belakang
Heptaminol HCl merupakan salah satu obat generik yang banyak
digunakan masyarakat untuk berbagai tujuan medis. Heptaminol HCl merupakan
obat yang biasanya digunakan bagi pasien bertekanan darah rendah, khususnya
untuk jenis hipotensi ortostatik, yaitu merupakan penurunan tekanan darah
berlebihan yang menyebabkan berkurangnya aliran darah ke otak. Selain untuk
mengobati hipotensi ortostatik, heptaminol HCl digunakan juga sebagai
kardiotonik dan vasodilator.
Seperti obat-obat lainnya, penggunaan heptaminol HCl selain
memberikan efek terapeutik juga dapat menghasilkan efek toksik apabila dosisnya
berlebih atau tidak memberikan efek apabila dosisnya kurang. Oleh sebab itu,
pemberiannya harus dilakukan dengan benar agar kerja heptaminol HCl efektif
dan aman. Tercapainya keefektifan dan keamanan obat didukung oleh kualitas dan
mutu obat yang baik. Oleh karena itu, sangat penting dilakukan kontrol kualitas
terhadap heptaminol HCl untuk mengetahui keefektifan dan keamanannya.
Metode penetapan kadar heptaminol HCl belum banyak diteliti. Salah
satu alasannya adalah karena heptaminol HCl tidak memiliki gugus kromofor dan
auksokrom, sehingga tidak bisa dideteksi langsung menggunakan
spektrofotometri ultraviolet (UV) ataupun visible (vis). Berdasarkan strukturnya,
jauh(λ= 100-190 nm). Hal inilah yang menyebabkan heptaminol HCl tidak dapat
dideteksi secara spektrofotometri UV-Vis, karena heptaminol terdeteksi pada
daerah UV jauh, sedangkan spektrofotometri UV berada pada daerah UV dekat
(λ= 190-380 nm) dan spektrofotometrivisibleberada pada daerahvisible(λ=
380-780 nm) (Mulja dan Suharman, 1995). Hal tersebut menjadi masalah tersendiri
khususnya bagi produsen obat dalam melaksanakan kontrol kualitas untuk
memberikan jaminan kontrol kualitas karena heptaminol sukar untuk dianalisis.
Untuk itulah dalam analisisnya biasanya dilakukan derivatisasi terlebih dahulu
terhadap heptaminol HCl untuk meningkatkan sensitivitasnya, sehingga kemudian
dapat ditetapkan kadarnya menggunakan spektrofotometri UV atauvisible.
Analisis heptaminol yang telah dilakukan antara lain dengan
menggunakan: Kromatografi Lapis Tipis (KLT)-fotodensitometri, dengan
derivatisasi menggunakan4-chloro-7-nitrobenzo-2,1,3-oxadiazole(Morros, Borja,
and Segura, 1985); spektrofotometri dan spektrofluorometri dengan
ditambahkannya reagen asetilaseton-formaldehida (Fattah, El-Yazbi, Belal, and
Abdel-Razak, 1997); Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik
dengan derivatisasi pra-kolom menggunakan o-phthalaldehyde dan detektor
fluoresensi (Brodie, Chasseaud, Rooney, Darragh, and Lambe, 1983).
Pada penelitian ini, heptaminol HCl akan diderivatisasi dengan agen
penderivat OPA menggunakan metode spektrofotometri UV, dimana penelitian ini
belum pernah dilakukan sebelumnya. Berdasarkan data yang diperoleh, penetapan
kadar heptaminol yang didahului dengan derivatisasi pernah dilakukan
3
fluoresensi karena senyawa derivat yang terbentuk berfluoresensi. Dipilih metode
spektrofotometri dalam penelitian ini karena metode spektrofotometri memiliki
persamaan dengan metode spektrofluorometri, yaitu dapat mendeteksi senyawa
yang memiliki gugus kromofor dan auksokrom. Oleh karena itu, heptaminol HCl
terderivatisasi dipastikan dapat dianalisis juga secara spektrofotometri. Selain itu,
alasan digunakan metode spektrofotometri UV pada penelitian ini adalah karena
metode spektrofotometri UV merupakan metode yang praktis, cepat, akurat, dan
memiliki sensitivitas yang cukup baik. Spektrofotometer UV merupakan alat yang
paling banyak dimiliki oleh laboratorium-laboratorium analisis di Indonesia pada
umumnya.
Dalam penelitian ini dipilih OPA sebagai agen penderivat heptaminol
HCl karena OPA memiliki beberapa kelebihan, yaitu: OPA spesifik untuk reaksi
dengan amina primer, reaksi derivatisasi dengan amina primer berlangsung dalam
waktu yang singkat, OPA memiliki sensitivitas yang tinggi bila dibandingkan
dengan agen penderivat lain yang umum digunakan, seperti ninhidrin dan
fluorescamine. OPA lebih larut dan stabil dalam larutan dapar, dan sensitivitasnya
dalam mendeteksi protein 5-10 kali lebih besar dibandingkan fluorescamine
(Benson and Hare, 1975).
Derivatisasi heptaminol HCl dengan OPA dapat membentuk suatu
derivat berkromofor dan berauksokrom yang dapat ditetapkan kadarnya dengan
menggunakan spektrofotometer UV. Akan tetapi, hasil derivat yang terbentuk
kurang stabil dan dapat terdegradasi seiring dengan berjalannya waktu (Lindroth,
optimasi derivatisasi heptaminol HCl dengan agen penderivat OPA secara
spektrofotometri UV untuk mendapatkan kondisi optimal yang akhirnya dapat
digunakan untuk menetapkan kadar heptaminol HCl. Melalui penelitian ini,
penulis hendak melakukan optimasi untuk mengetahui kondisi optimum dari
metode penetapan kadar heptaminol HCl setelah diderivatisasi dengan agen
penderivat OPA secara spektrofotometri UV.
1. Perumusan masalah
Berdasarkan latar belakang di atas, maka permasalahan yang muncul
adalah:
a. Berapakah panjang gelombang maksimum pengukuran untuk penetapan kadar
hasil derivatisasi heptaminol HCl dengan agen penderivat OPA menggunakan
metode spektrofotometri UV?
b. Berapakah pH dapar optimum untuk melakukan derivatisasi heptaminol HCl
dengan agen penderivat OPA agar dapat ditetapkan kadarnya menggunakan
metode spektrofotometri UV?
c. Kapankah operating time (OT) optimum untuk reaksi derivatisasi heptaminol
HCl dengan agen penderivat OPA?
d. Berapakah nilai koefisien ekstingsi molar (ε) dari senyawa hasil derivatisasi
heptaminol HCl dengan agen penderivat OPA?
2. Keaslian penelitian
Berdasarkan fakta-fakta penelitian sebelumnya yang diperoleh penulis
masih jarang ditemukan penetapan kadar heptaminol secara spektrofotometri UV.
5
umumnya menggunakan metode spektrofluorometri atau KCKT dengan detektor
fluoresensi.
Analisis heptaminol dan mexiletine dalam sedian obat pernah dilakukan
oleh Fattah et al. (1997) menggunakan metode spektrofotometri dan
spektrofluorometri dengan penambahan reagen asetilaseton-formaldehida. Selain
dengan metode spektrofotometri, penetapan kadar heptaminol dalam plasma dan
urin pernah dilakukan menggunakan metode KCKT fase terbalik dengan detektor
fluoresensi setelah diderivatisasi dengan OPA. Metode ini memiliki sensitivitas
yang cukup baik untuk studi farmakokinetika (Brodie et al., 1983). Penetapan
kadar heptaminol dalam plasma dengan menggunakan metode Kromatografi
Lapis Tipis danin situFluorometri dengan derivatisasi menggunakan
4-chloro-7-nitrobenzo-2,1,3-oxadiazolejuga pernah dilakukan oleh Morroset al.(1985).
3. Manfaat penelitian
a. Manfaat Metodologis. Penelitian ini diharapkan dapat memberikan
sumbangan ilmiah mengenai metode alternatif menggunakan metode
spektrofotometri UV untuk penetapan kadar heptaminol HCl, yaitu menggunakan
agen penderivat OPA.
b. Manfaat Praktis. Penelitian ini diharapkan dapat menyediakan metode
penetapan kadar heptaminol yang sensitif dan dapat dimanfaatkan oleh pihak
B. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan yang muncul maka
penelitian ini bertujuan untuk:
1. Mengetahui panjang gelombang maksimum pengukuran untuk penetapan
kadar hasil derivatisasi heptaminol HCl dengan agen penderivat OPA
menggunakan metode spektrofotometri UV.
2. Mengetahui pH dapar optimum untuk melakukan derivatisasi heptaminol
HCl dengan agen penderivat OPA agar dapat ditetapkan kadarnya
menggunakan metode spektrofotometri UV.
3. Mengetahui operating time (OT) optimum untuk reaksi derivatisasi
heptaminol HCl dengan agen penderivat OPA.
4. Mengetahui nilai koefisien ekstingsi molar (ε) dari senyawa hasil
7
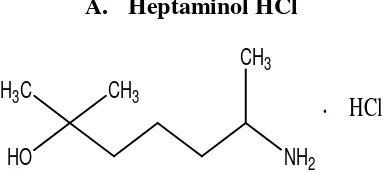
Gambar 1. Struktur heptaminol HCl
Heptaminol (6-amino-2-metil-2-heptanol) adalah turunan amina yang
digunakan sebagai kardiotonik dan vasodilator dalam kedokteran hewan.
Heptaminol digunakan sebagai korektor efek hipotensif dan neuroleptik. Dosis
terapetiknya berkisar antara 1-3 mg/kg BB (Anonim, 2010a). Rumus molekul
heptaminol HCl adalah C8H20ClNO dan memiliki rumus bangun pada gambar 1,
dengan bobot molekul 180,7 g/mol (Anonim, 2010b) dan titik lebur antara
178-180° C. Heptaminol HCl sangat mudah larut dalam air, larut dalam alkohol, dan
praktis tidak larut dalam aseton, benzen, dan eter (Anonim, 1989).
Heptaminol HCl mempunyai 2 khasiat utama, yaitu:
1. Khasiat terhadap sistem kardiosirkulasi
Heptaminol akan meningkatkan kekuatan sistolik dan kapasitas kerja jantung,
output jantung dan aliran darah koroner. Selain itu, heptaminol memperkuat
pembuluh darah perifer. Heptaminol memperbaiki hipotensi dan penurunan
cukup sederhana dan secara fisiologis, yaitu dengan mengembalikan
fungsi-fungsi sirkulasi darah.
2. Khasiat terhadap sistem neuromuskuler
Heptaminol HCl memperkuat dan menormalkan sistem neuromuskuler yang
mengalami kronaksi saraf yang menurun (melibatkan neuron-neuron formasio
retikularis dan hipotalamus) dan kronaksi otot yang menurun. Daya anti
kelelahan heptaminol secara preventif menunda terjadinya tanda-tanda
kelelahan kronaksi pada saraf dan otot (Hardjasaputra, Budipranoto, Sembiring
dan Kamil, 2002).
Dilihat dari strukturnya, heptaminol hanya memiliki gugus –NH2 dan
–OH yang penting untuk keperluan analisis. Menurut Snyder, Kirkland, dan
Glajch (1997), gugus –NH2 tidak memiliki nilai koefisien ekstingsi molar (ε)
sehingga heptaminol sukar untuk terdeteksi.
B. O-ftalaldehid (OPA) O
O H
H
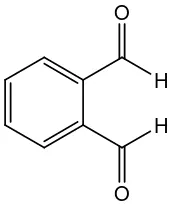
Gambar 2. Strukturo-ftalaldehid (OPA)
OPA (gambar 2) memiliki rumus molekul C8H6O2, berbentuk kristal atau
serbuk berwarna kuning (Anonim, 2005). OPA larut dalam metanol, dan dietil
9
Penetapan kadar protein menggunakan OPA cepat dan sensitif.
Reaksinya selesai dalam waktu kurang dari 1 menit. Dalam penetapan standar,
protein dapat dideteksi paling rendah pada kadar 10 µg/mL. Namun dalam
penetapan kadar mikro, batas deteksi terendahnya dapat mencapai 50 ng/mL.
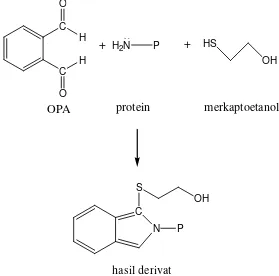
OPA dapat bereaksi dengan amina primer dalam protein. Dengan kehadiran
merkaptoetanol, OPA dapat bereaksi dengan amina primer seperti terlihat pada
gambar 3 dan menghasilkan senyawa berfluoresensi biru yang memiliki panjang
gelombang eksitasi maksimum pada 340 nm dan panjang gelombang emisi
maksimum pada 455 nm. Reaksi ini berlangsung secara spontan, sehingga
reaksinya berlangsung dalam beberapa menit (Ahmed, 2005).
C
Gambar 3. Reaksi antara OPA dengan amina primer
OPA memberikan sensitivitas yang lebih besar dalam deteksinya. Hal ini
sendiri dan dengan demikian tidak akan mengganggu deteksinya. Kedua,
reaksinya terjadi dengan cepat pada suhu kamar, meminimalkan penggunaan
waktu yang lama (Blackburn, 1989).
Derivat yang terbentuk dari reaksi derivatisasi antara amina primer
dengan OPA akan membentuk senyawa berflurosensi, yaitu senyawa dengan
struktur rigid, planar, serta memiliki gugus kromofor dan auksokrom.
C. Derivatisasi
Dalam suatu analisis, kemungkinan banyak terdapat zat-zat yang
memberikan absorbansi maksimal pada panjang gelombang 200-210 nm,
umumnya merupakan bahan-bahan yang digunakan sebagai pelarut, khususnya
yang mempunyai ikatan hidrogen. Proses derivatisasi dilakukan untuk mengatasi
keadaan tersebut dengan cara mereaksikan zat yang dianalisis dengan zat tertentu
sehingga terjadi pergeseran panjang gelombang maksimal ke arah pergeseran
merah atau mereaksikan zat yang dianalisis dengan zat tertentu sehingga
menghasilkan senyawa yang berfluoresensi.
Perlu diperhatikan bahwa zat penderivat harus memberikan reaksi yang
cepat dan stabil serta meningkatkan sensitivitas pengukuran (Mulja dan
Suharman, 1995).
D. Spektrofotometri UV
Spektrofotometri UV adalah salah satu teknik analisis spektroskopik
11
dengan menggunakan alat spektrofotometer. Spektrofotometri UV menggunakan
energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga
spektrofotometri UV lebih banyak digunakan untuk analisis kuantitatif daripada
analisis kualitatif. Pada analisis menggunakan spektrofotometri UV, dilakukan
pembacaan absorbansi (penyerapan) atau transmitansi (penerusan) radiasi
elektromagnetik oleh suatu molekul. Hasil pembacaan absorbansi disebut sebagai
absorban (A) dan tidak memiliki satuan, sedangkan hasil pembacaan transmitansi
disebut transmitan dan memiliki satuan % T (Mulja dan Suharman, 1995).
Absorbansi cahaya oleh molekul dalam daerah spektrum UV danvisible
tergantung dari struktur elektronik molekul (Sastrohamidjojo, 2001). Apabila
suatu molekul dikenai oleh radiasi elektromagnetik (REM) maka akan terjadi
eksitasi ke tingkat energi yang lebih tinggi yang dikenal sebagai orbital elektron
antiikatan (Mulja dan Suharman, 1995). Absorpsi cahaya UV mengakibatkan
transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar,
highest occupied molecular orbital(HOMO) berenergi rendah ke orbital keadaan
tereksitasi berenergi lebih tinggi lowest unoccupied molecular orbital (LUMO)
(Supratman, 2010). Ada empat tipe transisi elektronik yang mungkin terjadi yaitu
σ → σ*, π → π*, n → π*, n → σ*. Eksitasi elektron (σ → σ*) membutuhkan
energi yang terbesar dan terjadi pada daerah UV jauh yang diberikan oleh ikatan
tunggal, misalnya alkana. Eksitasi elektron π → π* diberikan oleh ikatan rangkap
dua dan rangkap tiga, juga terjadi pada daerah UV jauh. Eksitasi elektron (n →
σ*) terjadi pada gugus karbonil yang terjadi pada UV jauh (Mulja dan Suharman,
Gambar 4. Diagram tingkat energi elektronik (Gandjar dan Rohman, 2007)
Panjang gelombang cahaya UV atau cahaya tampak bergantung pada
mudahnya promosi elektron. Molekul-molekul yang memerlukan lebih banyak
energi untuk promosi elektron, akan menyerap pada panjang gelombang yang
lebih pendek. Molekul yang memerlukan energi lebih sedikit akan menyerap pada
panjang gelombang yang lebih panjang. Daerah yang paling berguna dari
spektrum UV adalah daerah dengan panjang gelombang di atas 200 nm. Transisi
berikut menimbulkan absorpsi dalam daerah 100-200 nm yang tak berguna: π →
π* untuk ikatan rangkap menyendiri dan σ → σ* untuk ikatan-ikatan karbon
biasa. Transisi yang berguna (200-400 nm) adalah π → π* untuk senyawa dengan
ikatan rangkap berkonjugasi serta beberapa transisi n → σ* dan n → π*
(Fessenden dan Fessenden, 1994).
Bouguer, Lambert dan Beer membuat suatu persamaan matematik yang
menghubungkan antara absorban atau transmitan terhadap intensitas radiasi atau
13
A =ε. b. c (1)
keterangan: T = % transmitan
A = absorban
ε= absorbansi molar (Lt.mol-1cm-1)
c = konsentrasi (mol.Lt-1)
b = tebal larutan (cm)
Hubungan antara nilai dengan absorbansi molar (ε) adalah sebagai
berikut:
ε= x M-1. cm-1. (2)
Nilai ε didefinisikan sebagai absorbansi molar atau koefisien ekstingsi
molar. Nilai εadalah karakteristik untuk molekul atau ion penyerap dalam pelarut
tertentu, pada panjang gelombang tertentu dan tidak bergantung pada konsentrasi
dan panjang gelombang lintasan radiasi (Sastrohamidjojo, 2001). Secara umum,
dapat dikatakan bahwa nilai ε sangat mempengaruhi puncak spektrum yang
dihasilkan oleh suatu zat. Rincian nilai εterhadap puncak spektrum adalah: 1-10:
sangat lemah; 10-102: lemah; 102-103: sedang; 103-104: kuat; 104-105: sangat kuat
(Mulja dan Suharman, 1995).
Pembacaan absorbansi sebesar 0,2 – 0,8 atau persen transmitan sebesar
15 - 65% akan memberikan persen kesalahan analisis yang masih dapat diterima
(0,5 – 1%) (Mulja dan Suharman, 1995).
Pemilihan pelarut yang digunakan dalam spektroskopi UV merupakan
hal yang cukup penting. Kriteria pelarut yang baik adalah yang tidak
pelarut yang dipilih adalah yang tidak memiliki sistem terkonjugasi. Air, etanol
95% dan n-heksana merupakan pelarut yang banyak digunakan. Zat-zat tersebut
tidak terlihat dalam daerah spektrum ultraviolet dimana puncak absorbsi analit
biasanya muncul (Pavia, Lampman, and Kriz, 2001).
Analisis kuantitatif zat tunggal pada spektrofotometri menggunakan
pengukuran absorbansi senyawa pada panjang gelombang maksimum, yaitu
panjang gelombang dimana terjadi eksitasi elektronik yang memberikan
absorbansi yang maksimum (Mulja dan Suharman, 1995). Beberapa alasan
digunakannya panjang gelombang maksimum dalam suatu analisis kuantitatif
adalah sebagai berikut:
1. Pada panjang gelombang maksimum diperoleh kepekaan analisis yang
maksimal, karena pada panjang gelombang tersebut perubahan absorbansi
untuk setiap satuan konsentrasi adalah yang paling besar.
2. Di sekitar panjang gelombang maksimum, bentuk kurva absorbansi datar dan
pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
3. Jika dilakukan pengukuran ulang akan memberikan kesalahan yang kecil
ketika digunakan panjang gelombang maksimum (Gandjar dan Rohman, 2007).
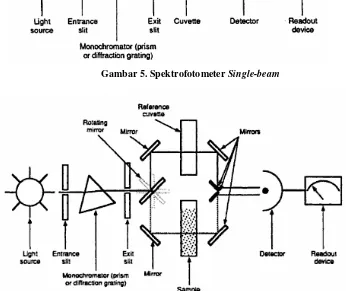
Pada umumnya konfigurasi dasar spektrofotometer UV berupa susunan
15
Gambar 5. SpektrofotometerSingle-beam
Gambar 6. SpektrofotometerDouble-beam
(Haven, Tetrault, and Schenken, 1994)
E. Landasan Teori
Heptaminol HCl merupakan salah satu obat generik yang banyak
digunakan masyarakat untuk berbagai tujuan medis, baik untuk pengobatan
hipotensi ortostatik, kardiotonik, maupun sebagai vasodilator. Dilihat dari
strukturnya, heptaminol HCl tidak memiliki gugus kromofor dan auksokrom
dengan spektrofotometri UV atau untuk meningkatkan sensitivitasnya.
Berdasarkan strukturnya, senyawa alifatis seperti heptaminol HCl hanya akan
terdeteksi pada daerah UV jauh sehingga tidak dapat terdeteksi pada daerah UV
dekat yang digunakan pada spektrofotometer UV. Setelah dilakukan derivatisasi
maka heptaminol HCl terderivatisasi akan meningkat sensitivitasnya dan dapat
terdeteksi pada daerah UV dekat dan dapat ditetapkan kadarnya secara
spektrofotometri UV. Peningkatan sensitivitas terjadi karena bertambah
panjangnya ikatan rangkap terkonjugasi yang menyebabkan terjadinya
peningkatan nilaiε, dimana nilaiεberbanding lurus dengan luas area kromofor.
Agen penderivat yang dipilih adalah agen penderivat OPA. Dipilih OPA
karena reaksi derivatisasinya hanya memerlukan waktu yang singkat dan hasilnya
sensitif.
Salah satu keterbatasan dari hasil derivat yang terbentuk adalah derivat
kurang stabil dan dapat terdegradasi seiring dengan berjalannya waktu. Oleh
karena itu, dilakukan optimasi derivatisasi heptaminol HCl dengan agen
penderivat OPA untuk mendapatkan kondisi optimal yang akhirnya dapat
digunakan untuk menetapkan kadar heptaminol HCl. Kondisi optimal penetapan
kadar heptaminol HCl adalah berupa panjang gelombang maksimum pengukuran,
pH dapar basa optimum dimana reaksi derivatisasi antara heptaminol HCl dengan
OPA hanya berlangsung pada suasana basa, dan waktu reaksi optimum antara
heptaminol HCl dengan OPA. Pada kondisi optimal yang nantinya akan
dioptimasi maka heptaminol HCl dapat ditetapkan kadarnya karena meningkatnya
17
F. Hipotesis
Derivatisasi menggunakan agen penderivat OPA pada panjang
gelombang maksimum pengukuran, pH dapar basa optimum, dan operating time
optimum dapat digunakan untuk meningkatkan sensitivitas dalam penetapan kadar
18
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental karena terdapat
perlakuan terhadap subyek uji.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas pada penelitian ini adalah panjang gelombang maksimum
pengukuran hasil derivatisasi heptaminol HCl dengan OPA (λ maksimum), pH
dapar basa untuk mereaksikan heptaminol HCl dengan OPA (pH reaksi), dan
waktu reaksi optimum antara heptaminol HCl dengan OPA (operating time).
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah kestabilan derivat yang
terbentuk (absorbansi) dan nilai koefisien ekstingsi molar (ε) derivat.
3. Variabel pengacau terkendali
a. Suhu reaksi. Untuk mengatasinya digunakan suhu kamar sebagai suhu
reaksi.
b. Cahaya. Untuk mengatasinya, pengerjaan dilakukan di ruangan
dengan intensitas cahaya yang terbatas serta dengan penggunaan aluminium foil.
c. Kemurnian pelarut. Untuk mengatasinya, digunakan pelarut dengan
19
C. Definisi Operasional
1. Heptaminol baku yang dianalisis adalah heptaminol HCl dari PT. Corsa,
Indonesia (Sertifikat analisis terlampir pada Lampiran 1.).
2. Derivat yang dianalisis adalah derivat yang terbentuk dari hasil reaksi antara
heptaminol HCl dengan OPA.
3. Panjang gelombang maksimum pengukuran adalah panjang gelombang dimana
absorbansi dari hasil derivatisasi heptaminol HCl dengan OPA maksimum.
4. Dapar yang digunakan adalah dapar borat pH 8, 9, dan 10.
5. Operating time adalah waktu reaksi derivatisasi optimum antara heptaminol
HCl dengan OPA.
6. Nilai koefisien ekstingsi molar atau absorbansi molar (ε) yang diukur adalah
nilaiεdari hasil derivatisasi heptaminol HCl dengan OPA.
7. Sistem spektrofotometri yang digunakan adalah seperangkat alat
spektrofotometri UV-Vis merk Genesys 10 UV.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini meliputi heptaminol
HCl baku pembanding (PT. Corsa);o-ftalaldehid (p.a., Nacalai); merkaptoetanol;
metanol; asam borat; NaOH; dan KCl (p.a., E. Merck); aquabidestilata (LPPT
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini meliputi Spektrofotometer
UV-Vis merk Genesys 10 UV, kuvet UV, vortex merk Thermolyne, pH meter
merk pHep family, neraca merk PJ Precisa Junior, neraca analitik merk Precisa
125 A SCS, mikropipet 100-1000 µL, seperangkat alat gelas yang lazim digunakan
di laboratorium analisis.
E. Tata Cara Penelitian 1. Pembuatan larutan stok heptaminol HCl (2 mg/mL)
Ditimbang lebih kurang seksama 20,0 mg baku heptaminol HCl,
dimasukkan ke dalam labu takar 10,0 mL, dilarutkan dengan aquabidestilata
hingga tanda.
2. Pembuatan dapar borat pH 8, 9, dan 10
a. Pembuatan campuran H3BO3dan KCl. Ditimbang lebih kurang seksama
1,55 g H3BO3. Kemudian ditambahkan 1,85 g KCl, dan dilarutkan dalam
aquabidestilata sampai 250,0 mL.
b. Pembuatan dapar borat pH 8. Sejumlah 25,0 mL campuran H3BO3dan
KCl (poin 2a) diambil, kemudian ditambahkan dengan larutan NaOH 0,1 M
sebanyak 1,95 mL, dan diencerkan dengan aquabidestilata sampai volume 50,0
mL. Ukur pH larutan, kemudian ditepatkan pH-nya menjadi 8 dengan
menambahkan larutan H3BO3atau larutan NaOH (Perrin and Dempsey, 1974).
c. Pembuatan dapar borat pH 9. Sejumlah 25,0 mL campuran H3BO3dan
21
sebanyak 10,4 mL, dan diencerkan dengan aquabidestilata sampai volume 50,0
mL. Ukur pH larutan, kemudian ditepatkan pH-nya menjadi 9 dengan
menambahkan larutan H3BO3atau larutan NaOH (Perrin and Dempsey, 1974).
d. Pembuatan dapar borat pH 10.Sejumlah 25,0 mL campuran H3BO3dan
KCl (poin 2a) diambil, kemudian ditambahkan dengan larutan NaOH 0,1 M
sebanyak 21,85 mL, dan diencerkan dengan aquabidestilata sampai volume 50,0
mL. Ukur pH larutan, kemudian ditepatkan pH-nya menjadi 10 dengan
menambahkan larutan H3BO3atau larutan NaOH (Perrin and Dempsey, 1974).
3. Pembuatan larutan OPA
Dimasukkan 100 mg OPA dalam 2 mL metanol ke dalam wadah yang
telah dibungkus dengan aluminium foil. Kemudian ditambahkan 100 µL
merkaptoetanol dan 200 mL dapar borat pH 8 atau 9 atau 10. Dicampur sampai
homogen, disimpan dalam lemari es dan ditempat gelap.
4. Penentuan panjang gelombang maksimum pengukuran
Sejumlah 50; 150; dan 250 µL larutan stok heptaminol HCl (poin 1)
dipipet, dimasukkan ke dalam labu takar 10 mL. Kemudian diencerkan dengan
aquabidestilata hingga volume tepat 10,0 mL, sehingga diperoleh konsentrasi 10;
30; dan 50 µg/mL. Dimasukkan masing-masing 3 mL larutan OPA (poin 3) ke
dalam 3 flakon yang telah dibungkus dengan aluminium foil (larutan OPA yang
digunakan pada penentuan panjang gelombang maksimum pengukuran adalah
larutan OPA dengan dapar borat pH 9). Kemudian ditambahkan masing-masing
300 µL larutan baku 10; 30; dan 50 µg/mL ke dalam flakon tersebut. Campuran
larutan discan pada spektrofotometer UV-Vis antara panjang gelombang 200-400
nm sehingga diperoleh spektra absorbansi dan panjang gelombang terpilih.
5. Penentuan pH dapar optimum
Sejumlah 150 µL larutan stok heptaminol HCl (poin 1) dipipet,
dimasukkan ke dalam labu takar 10 mL. Kemudian diencerkan dengan
aquabidestilata hingga volume tepat 10,0 mL, sehingga diperoleh konsentrasi 30
µg/mL. Dimasukkan masing-masing 3 mL larutan OPA (poin 3) ke dalam flakon
yang telah dibungkus dengan aluminium foil. Kemudian ditambahkan
masing-masing 300 µL larutan baku 30 µg/mL ke dalam flakon tersebut. Campuran
tersebut divortex selama 10 detik. Setelah 30 menit disimpan dalam tempat gelap,
larutan discan pada panjang gelombang maksimal terpilih sehingga diperoleh
spektra absorbansi. Prosedur ini dilakukan untuk penambahan larutan OPA (poin
3) dengan dapar borat pH 8, 9, dan 10. Dilakukan replikasi sebanyak 3 kali
kemudian tentukan pH dapar borat yang memberikan absorban hasil derivatisasi
yang reprodusibel. Dihitung nilai Coefficient of variance (CV) absorban yang
dihasilkan. Nilai CV yang kecil menunjukkan absorbansi yang reprodusibel.
6. Penentuanoperating time(OT)
Sejumlah 1,0 mL larutan stok heptaminol HCl (poin 1) dipipet dan
dimasukkan ke dalam labu takar 10 mL. Kemudian diencerkan dengan
aquabidestilata hingga volume tepat 10,0 mL, sehingga diperoleh konsentrasi 0,2
mg/mL. Dimasukkan masing-masing 3 mL larutan OPA dengan dapar borat hasil
optimasi (poin 3) ke dalam flakon yang telah dibungkus dengan aluminium foil.
23
tersebut. Campuran tersebut divortex selama 10 detik. Kemudian diukur
absorbansinya menggunakan spektrofotometer UV pada panjang gelombang
maksimum hasil pengukuran. Pembacaan absorbansi dilakukan pada menit ke-0
sampai menit ke-60 dengan interval 5 menit (menit ke-0 pengukuran dihitung
setelah 1,5 menit sesudah penambahan larutan heptaminol HCl ke dalam larutan
OPA). Tentukan waktu dimana hasil derivatisasi heptaminol memberikan nilai
absorbansi yang reprodusibel. Dilakukan replikasi sebanyak 4 kali kemudian
hitung nilaiCoefficient of variance(CV) absorban yang dihasilkan. Nilai CV yang
kecil menunjukkan absorbansi yang reprodusibel.
7. Penentuan nilai ekstingsi molar (ε)
Ditimbang lebih kurang seksama 100,0 mg baku heptaminol HCl,
dimasukkan ke dalam labu takar 25,0 mL, kemudian dilarutkan dengan
aquabidestilata hingga tanda. Sejumlah 375; 500; 625; 750; dan 875 µL dari
larutan tersebut dipipet dan dimasukkan ke dalam labu takar 10 mL. Kemudian
diencerkan dengan aquabidestilata hingga volume tepat 10,0 mL, sehingga
diperoleh larutan dengan konsentrasi sebesar 0,15; 0,2; 0,25; 0,3; dan 0,35
mg/mL. Dimasukkan masing-masing 3 mL larutan OPA ke dalam 5 flakon yang
telah dibungkus dengan aluminium foil. Ditambahkan masing-masing 300 µL dari
larutan baku 0,15; 0,2; 0,25; 0,3 dan 0,35 mg/mL ke dalam flakon tersebut.
Campuran tersebut divortex selama 10 detik. Kemudian diukur absorbansinya
pada panjang gelombang maksimum hasil pengukuran menggunakan
spektrofotometer UV setelah didiamkan ditempat gelap selama waktu reaksi
F. Analisis Hasil
Hasil optimasi metode penetapan kadar heptaminol HCl dengan agen
penderivat OPA dapat dilihat dari:
1. Panjang gelombang maksimum
Panjang gelombang maksimum yang dipilih adalah panjang gelombang
dimana derivat heptaminol memberikan absorbansi yang maksimum, kemudian
dibandingkan dengan panjang gelombang maksimum dari OPA.
2. pH dapar optimum
pH dapar yang dipilih adalah pH dapar yang menghasilkan absorbansi
yang reprodusibel dengan nilai CV terkecil.
CV = x 100 % (3)
3. Waktu (operating time)
Waktu (operating time) yang dipilih adalah waktu dimana absorbansi
yang dihasilkan reprodusibel dengan nilai CV terkecil.
4. Nilai ekstingsi molar (ε)
Nilaiεdihitung untuk kelima konsentrasi dengan persamaan:
(4)
Keterangan: ε= ekstingsi molar
A = absorbansi
b = tebal kuvet (cm)
25
BAB IV
HASIL DAN PEMBAHASAN
A. Pembuatan Larutan 1. Larutan heptaminol HCl
Heptaminol yang digunakan sebagai baku adalah heptaminol HCl yang
berbentuk garam, sehingga memiliki sifat mudah larut di dalam air. Oleh karena
itu, digunakan aquabidestilata sebagai pelarut dari baku heptaminol HCl.
Aquabidestilata dipilih sebagai pelarut karena memenuhi kriteria pelarut
yang baik untuk analisis secara spektrofotometri, yaitu tidak mengabsorbsi radiasi
UV pada daerah yang sama dengan analitnya, tidak berwarna, tidak memiliki
sistem rangkap terkonjugasi, tidak berinteraksi dengan analit, serta memiliki
kemurnian yang tinggi sehingga dapat digunakan untuk analisis.
2. Larutan dapar borat
Larutan dapar borat merupakan campuran dari asam borat (H3BO3) dan
kalium klorida (KCl), serta dengan adanya penambahan larutan natrium
hidroksida (NaOH). Fungsi dapar borat adalah untuk memberikan dan
mempertahankan kondisi basa pada saat berlangsungnya reaksi derivatisasi,
dimana reaksi derivatisasi antara amina primer dengan agen penderivat OPA
dapat terjadi pada pH basa. Pada suasana basa, amina primer akan terdapat dalam
bentuk molekul seluruhnya, sehingga akan terbentuk reaksi antara OPA dengan
amina primer yang optimal. Dalam kondisi basa, gugus NH2 akan memiliki
pH di bawah 6 tidak terjadi reaksi antara OPA dengan amina primer (Blackburn,
1989). Hal tersebut disebabkan karena pada pH di bawah 6 (asam) gugus amina
dari heptaminol akan terprotonasi, sehingga akan hilang sifat nukleofilisitasnya
dan tidak dapat bereaksi dengan gugus aldehid dari OPA.
Menurut Blackburn (1989), pada pH 7,4-10 derivat antara amina primer
dengan OPA akan meningkat. Untuk itulah dalam penelitian ini dilakukan
optimasi dapar pada rentang pH basa yaitu pada pH 8, 9, dan 10.
3. Larutan OPA
Pembuatan larutan OPA mengikuti cara pembuatan reagen yang
tercantum dalam deskripsi produk untuk “OPA, Amine Detection Reagent” dari
Uptima. OPA dilarutkan dalam metanol, karena OPA larut dalam metanol
(Anonim, 2010c). Metanol merupakan pelarut organik yang cukup polar, dengan
indeks polaritas sebesar 6,6 dan memiliki kelarutan dalam air sebesar 100%
(Stauffer, Dolan, and Newman, 2008). Metanol juga memiliki UV-cut off pada
panjang gelombang 205 nm (Pavia, et al., 2001), sehingga kehadirannya tidak
akan mengganggu pengukuran absorbansi analit.
Fungsi dari merkaptoetanol pada larutan OPA adalah sebagai senyawa
pengkopling, yaitu untuk menambah gugus auksokrom pada derivat yang
terbentuk antara heptaminol HCl dengan OPA. Gugus auksokrom akan
memperpanjang konjugasi gugus kromofor dari hasil derivatisasinya, sehingga
dapat meningkatkan nilai koefisien ekstingsi molar (ε) dari derivatnya, yang
27
Merkaptoetanol merupakan senyawa organik sehingga lebih mudah bercampur
dalam pelarut metanol.
Dapar borat yang ditambahkan ke dalam larutan OPA adalah dapar borat
pH 8, 9, dan 10 yang kemudian masing-masing akan dioptimasi. Tidak dilakukan
optimasi pada dapar borat dengan pH yang lebih tinggi karena pada pH terlalu
tinggi (pH > 10) dikhawatirkan gugus aldehid dari OPA akan mengalami reaksi
cannizzaro (self reaction) menghasilkan ion o-hidroksimetil benzoat (gambar 7).
Senyawa hasil reaksi ini sukar bereaksi dengan heptaminol, karena gugus C
karbonilnya akan menjadi kurang elektrofilik dibandingkan dengan C karbonil
dari OPA. Hal ini disebabkan karena adanya stabilisasi resonansi antara elektron
bebas dari gugus O karbonil kepada gugus C karbonilnya. Menurut McDonald
and Sibley (1981), pada pH 10-14 terjadi penurunan absortivitas molar atau
koefisien ekstingsi molar (ε) dari OPA yang disebabkan karena berkurangnya
gugus kromofor dari OPA, dimana ikatan rangkap dari gugus aldehid OPA akan
hilang sehinggaεmenjadi lebih kecil.
O
Larutan OPA kemudian disimpan di dalam lemari pendingin, karena
larutan ini hanya dapat tahan pada suhu ruangan selama 2 jam saja. Selain itu,
OPA mudah rusak oleh cahaya (fotodegradatif), sehingga harus disimpan dalam
tempat yang gelap. Dengan adanya cahaya, OPA dapat mengalami oksidasi
sehingga gugus aldehid dari OPA berubah menjadi bentuk karboksilatnya. Oleh
karena itu, jika OPA telah mengalami fotodegradasi, maka tidak akan terjadi
reaksi derivatisasi antara heptaminol dengan OPA, sehingga tidak akan terbentuk
derivat.
4. Larutan baku heptaminol HCl
Larutan baku heptaminol HCl terdiri dari larutan heptaminol HCl yang
dicampur dengan larutan OPA. Secara teori, reaksi antara heptaminol dengan
OPA membutuhkan heptaminol dan OPA dengan perbandingan molekul yang
sama (1:1). Namun, untuk menjamin bahwa semua heptaminol telah
terderivatisasi, maka dilakukan penambahan OPA secara berlebih.
Pembuatan larutan baku ini mengikuti prosedur preparasi sampel yang
terdapat dalam deskripsi produk OPA dari Uptima, yaitu dengan perbandingan
sekitar 1:40. Reagen OPA memiliki absorban maksimal pada panjang gelombang
206 nm (gambar 15), sehingga sisa agen penderivat OPA tidak akan mengganggu
perhitungan absorbansi dari hasil derivat yang terbentuk.
Campuran antara heptaminol dan OPA kemudian disimpan di tempat
gelap pada suhu kamar. Hal ini disebabkan karena OPA dan derivatnya bersifat
fotodegradatif, sehingga akan rusak oleh cahaya. Flakon yang digunakan sebagai
29
melindungi senyawa dari cahaya. Vortex yang dilakukan bertujuan untuk
menghomogenkan hasil derivatisasi yang terbentuk. Reaksi derivatisasi dilakukan
pada suhu kamar, karena menurut Braithwaite dan Smith (1999) serta Blackburn
(1989), reaksi antara amina primer dengan OPA berlangsung cepat pada suhu
kamar. Menurut Direktorat Jenderal Pengawasan Obat dan Makanan RI pada
Farmakope Indonesia edisi IV (1995), suhu kamar terkendali adalah suhu dengan
rentang 15-300C. Reaksi tidak dilakukan pada suhu yang lebih tinggi untuk
mencegah terjadinya reaksi cannizzaro pada OPA. Jika terjadi reaksi cannizzaro
maka tidak akan terjadi reaksi derivatisasi, sehingga tidak akan terbentuk derivat.
B. Reaksi Derivatisasi
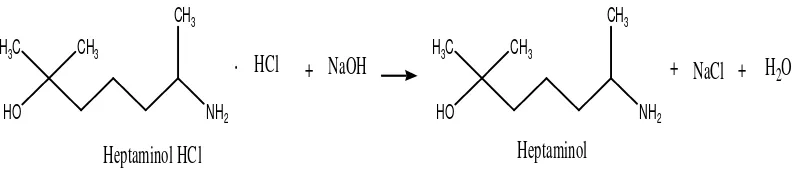
Heptaminol HCl merupakan bentuk garam. Sebelum direaksikan dengan
OPA, heptaminol HCl diubah terlebih dahulu menjadi bentuk heptaminol melalui
reaksi dengan dapar borat. Dapar borat berisi H3BO3, KCl, dan NaOH.
Heptaminol HCl akan bereaksi dengan NaOH dari dapar borat untuk membentuk
heptaminol melalui reaksi yang ditunjukkan pada gambar 8.
CH3
Gambar 8. Reaksi pembentukan heptaminol HCl menjadi heptaminol
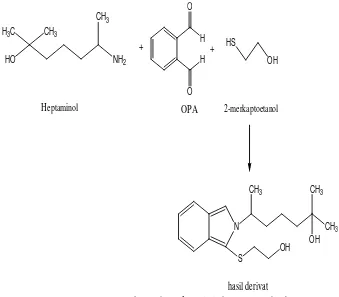
Setelah terbentuk heptaminol, maka dapat terjadi reaksi derivatisasi
antara heptaminol dengan agen penderivat OPA bersama dengan adanya
dengan OPA membentuk derivatnya, sehingga absorbansi derivat menunjukkan
absorbansi dari heptaminol HCl (A derivat ≈ A heptaminol HCl). Reaksi
derivatisasinya ditunjukkan dalam gambar 9.
CH3
Gambar 9. Reaksi derivatisasi heptaminol dengan agen penderivat OPA
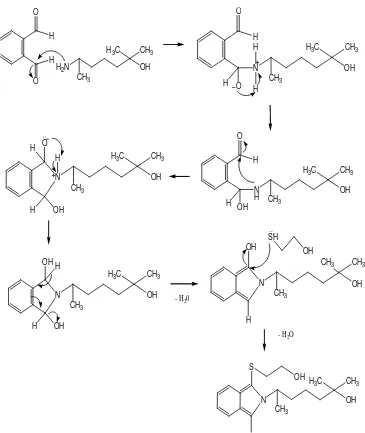
Mekanisme reaksi derivatisasi heptaminol dengan agen penderivat OPA
yang diusulkan dapat dilihat pada gambar 10. Reaksi pembentukan derivat yang
31
Gambar 10. Mekanisme reaksi derivatisasi heptaminol dengan agen penderivat OPA yang diusulkan (proposed mechanismhasil diskusi dengan Dr. Pudjono, S.U., Apt., 2010)
Senyawa yang diukur secara spektrofotometri UV harus memiliki gugus
kromofor dalam strukturnya agar dapat menyerap radiasi UV. Penyerapan sinar
radiasi oleh suatu senyawa tergantung pada struktur elektronik dari senyawa
tersebut. Pada gugus kromofor yang dimiliki hasil derivat heptaminol terdapat
ikatan rangkap yang mengandung elektron π yang bila dikenai sinar radiasi
Selain gugus kromofor, terdapat juga gugus auksokrom yang langsung terikat
pada gugus kromofor. Gugus auksokrom memiliki pasangan elektron bebas pada
orbital n yang dapat berinteraksi dengan elektron π pada gugus kromofor,
sehingga dengan adanya auksokrom ini akan mengubah panjang gelombang serta
intensitas absorbansi maksimal dari senyawa (pergeseran batokromik). Gugus
kromofor dan auksokrom dari senyawa derivat ditunjukkan pada gambar 11.
Gambar 11. Gugus kromofor dan auksokrom pada heptaminol hasil derivatisasi
Derivat yang terbentuk antara OPA dengan heptaminol memiliki
keterbatasan, yaitu akan terdegradasi seiring berjalannya waktu. Menurut
Lindroth, Hamberger, and Sandberg (1985), degradasi ini disebabkan karena
penyusunan ulang intermolekulernya, menghasilkan senyawa yang memiliki
gugus kromofor dan auksokrom yang berbeda dengan hasil derivat yang semula
(gambar 12).
33
Mekanisme reaksi degradasi yang diusulkan dari hasil derivatisasi
heptaminol HCl dengan agen penderivat OPA menjadi bentuk degradasinya dapat
dilihat pada gambar 13.
N OH
Gambar 13. Mekanisme reaksi degradasi hasil derivat yang diusulkan (proposed mechanismhasil diskusi dengan Dr. Pudjono, S.U., Apt, 2010)
C. Penentuan Panjang Gelombang Maksimum Pengukuran
Penentuan panjang gelombang maksimum merupakan faktor yang sangat
penting di dalam analisis kimia dengan metode spektrofotometri. Tujuan
penentuan panjang gelombang maksimum dalam penelitian ini adalah untuk
OPA yang memberikan absorbansi maksimum. Panjang gelombang maksimum
ini nantinya akan digunakan untuk mengukur absorbansi hasil derivat heptaminol
yang hendak dianalisis.
Panjang gelombang maksimum merupakan panjang gelombang suatu
larutan analit yang menunjukkan absorbansi maksimum. Pembacaan absorban
pada panjang gelombang maksimum akan memberikan sensitivitas dan presisi
analisis yang maksimal. Selain itu, akan diperoleh spektra absorban yang relatif
datar di sekitar panjang gelombang maksimum dan kemungkinan kesalahan yang
terjadi pada saat pengulangan relatif kecil.
Pengukuran panjang gelombang maksimum dilakukan pada seri
konsentrasi larutan baku heptaminol yang berbeda untuk melihat apakah pada
konsentrasi yang berbeda terjadi perubahan panjang gelombang absorbansi
maksimum. Konsentrasi yang digunakan adalah 10; 30; dan 50 µg/mL.
Pengukuran panjang gelombang maksimum dilakukan melalui scanning pada
panjang gelombang 200-400 nm. Rentang panjang gelombang ini dipilih karena
daerah UV terletak pada panjang gelombang antara 190-380 nm. Hasil scanning
panjang gelombang absorbansi maksimum untuk derivatisasi heptaminol HCl
35
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA
Gambar 14. Spektra absorbansi maksimum derivat yang terbentuk dari hasil reaksi antara OPA dengan heptaminol HCl pada 3 konsentrasi
Berdasarkan hasil penelitian, absorbansi maksimum dari ketiga seri
larutan baku heptaminol HCl menunjukkan nilai yang sama. Pengukuran pada
konsentrasi heptaminol HCl 10; 30; dan 50 µg/mL memberikan hasil panjang
gelombang maksimum pada 332 nm. Oleh karena pengukuran panjang gelombang
maksimum pada 3 konsentrasi yang berbeda memberikan hasil yang sama, maka
panjang gelombang absorbansi maksimum yang digunakan untuk pengukuran
hasil derivat adalah pada 332 nm. Hasil ini tidak dapat dibandingkan dengan
panjang gelombang maksimum teoritis, karena panjang gelombang maksimum
gelombang maksimum yang didapatkan benar-benar panjang gelombang
pengukuran untuk hasil derivatisasi heptaminol, dilakukan pula pengukuran
terhadap panjang gelombang maksimum reagen penderivat OPA.
* = absorbansi larutan OPA (0,05 mg/mL) dalam dapar borat pH 9
Gambar 15. Spektra absorbansi OPA
Berdasarkan spektra di atas, dapat dilihat bahwa reagen penderivat OPA
memiliki panjang gelombang absorbansi maksimum pada 206 nm (gambar 15).
Pada spektra absorbansi yang diperoleh dari reagen OPA, diketahui bahwa OPA
tidak memberikan absorbansi yang berarti pada panjang gelombang 332 nm.
Senyawa hasil derivatisasi heptaminol HCl dan OPA dapat mengalami
degradasi seiring berjalannya waktu. Untuk memastikan hal ini, maka dilakukan
scanningpanjang gelombang maksimum hasil degradasi derivatnya, dan diperoleh
bahwa hasil degradasinya memiliki absorbansi maksimum pada panjang
37
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA (kadar 0,25 mg/mL)
Gambar 16. (A) Spektra absorbansi hasil derivatisasi setelah 1,5 menit penambahan heptaminol dengan reagen OPA (menit ke-0 reaksi); (B) Spektra absorbansi hasil
derivatisasi setelah 1 jam reaksi
Gambar 16.(A) menunjukkan bahwa pada waktu 1,5 menit setelah
penambahan reagen OPA (menit ke-0 reaksi) telah terjadi degradasi dari hasil
derivatisasinya menjadi produk dengan struktur seperti dapat dilihat pada gambar
12. Kemudian pada waktu 1 jam setelah reaksi berlangsung, absorbansi dari hasil
degradasi meningkat, sedangkan absorbansi hasil derivatisasinya menurun
(gambar 16. (B)).
Berdasarkan data tersebut, dapat disimpulkan bahwa panjang gelombang
332 nm adalah benar-benar merupakan panjang gelombang maksimum untuk
pengukuran hasil derivatisasi heptaminol, dimana pada panjang gelombang
pengukuran tersebut akan diperoleh absorbansi dari hasil derivatisasi yang
D. Penentuan pH Dapar Optimum
pH memegang peranan penting agar reaksi antara heptaminol dengan
agen penderivat OPA dapat berjalan optimum. Secara teori, derivatisasi antara
heptaminol dengan OPA dapat berjalan pada suasana basa. Pada suasana asam
(pH di bawah 6) tidak akan terjadi reaksi derivatisasi. Pada kondisi basa gugus
amin pada heptaminol akan tetap berada dalam bentuk molekulnya. Dalam
kondisi basa gugus NH2 akan memiliki tingkat nukleofilisitas yang tinggi.
Sedangkan pada kondisi asam, gugus NH2 akan terprotonasi sehingga akan
kehilangan sifat nukleofilisitasnya.
Menurut Blackburn (1989), pada pH 7,4-10 derivatnya akan meningkat.
Untuk itulah dalam penelitian ini dilakukan optimasi dapar pada rentang pH basa
tersebut, yaitu digunakan dapar borat pH 8, 9 dan 10. Dipilih dapar borat karena
rentang pH dapar borat adalah antara pH 8-10,2 (Perrin and Dempsey, 1974),
sehingga dapar borat dapat digunakan dalam penelitian ini karena pH yang akan
dioptimasi adalah pH 8, 9, dan 10. Selain itu, bahan-bahan untuk membuat dapar
borat cukup mudah untuk didapatkan dibandingkan bahan-bahan untuk membuat
dapar lain pada rentang pH 8-10, contohnya dapar Kaliump-fenolsulfonat. Tidak
dilakukan optimasi pada pH yang terlalu tinggi, karena pada pH terlalu tinggi atau
pada kondisi basa yang semakin kuat dikhawatirkan terjadi reaksi cannizzaro pada
OPA sehingga tidak dapat terjadi derivatisasi dengan heptaminol.
Pada penelitian ini, yang dimaksud dengan pH dapar optimum adalah pH
dapar yang dapat menghasilkan absorbansi yang reprodusibel. Hasil pengukuran
39
hasil scanning derivatisasi pada penentuan pH dapar optimum dapat dilihat pada
gambar 17.
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA (kadar 30μg/mL)
Gambar 17. Spektra absorbansi hasil derivatisasi heptaminol HCl dengan OPA pada dapar borat pH 8, 9, dan 10
Tabel I. Data penentuan pH dapar optimum
Absorbansi* pada λ 332 nm
pH Dapar
Borat I II III
CV (%)
8 0,331 0,299 0,277 8,99
9 0,213 0,212 0,209 0,98
10 0,204 0,220 0,200 5,08
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA (kadar 30μg/mL)
Nilai absorbansi pada dapar borat pH 8 paling besar dibandingkan nilai
absorbansi dapar borat pH lainnya. Akan tetapi absorbansi dapar borat pH 8
memberikan nilai CV yang sangat besar, yaitu 8,99%. Hal ini menunjukkan pada
dapar borat pH 8 tidak memberikan nilai reprodusibilitas yang baik. Demikian
10 menunjukkan nilai CV dari absorbansi sebesar 5,08% yang menunjukkan tidak
diperolehnya nilai reprodusibilitas yang baik. Dalam penelitian ini, absorbansi
optimum diperoleh ketika larutan baku heptaminol HCl direaksikan dengan OPA
pada kondisi dapar borat pH 9, yang menghasilkan absorbansi yang nilainya
reprodusibel jika dibandingkan dengan absorbansi yang dihasilkan pada kondisi
dapar pH 8 ataupun 10. Nilai CV yang dihasilkan pada dapar borat pH 9 adalah
yang paling kecil dibandingkan nilai absorbansi dapar borat pH lainnya yang
dioptimasi, yaitu memberikan nilai CV sebesar 0,98%.
Dipilih dapar borat yang memberikan nilai absorbansi yang reprodusibel
karena dengan nilai absorbansi yang reprodusibel dapat untuk menjamin presisi
pengukuran berikutnya ketika diaplikasikan. Jika hanya memilih nilai absorbansi
yang besar tetapi tidak memberikan reprodusibilitas yang baik, maka konsentrasi
yang akan terukur tidak terjamin presisinya. Walaupun nilai absorbansi dapar
borat pH 9 lebih kecil dibandingkan dengan nilai absorbansi dapar borat pH 8, hal
ini masih diperbolehkan. Alasan yang pertama adalah karena nilai CV yang
dihasilkan kecil (0,98%) yang berarti absorbansi yang dihasilkan mempunyai
reprodusibilitas yang baik. Alasan kedua adalah absorbansi yang diperoleh dapar
borat pH 9 masih memenuhi rentang absorbansi yang baik menurut hukum
Lambert-Beer, yaitu berada pada rentang absorbansi 0,2-0,8. Dengan demikian,
dapat disimpulkan bahwa dapar borat yang memberikan absorbansi optimum
41
E. PenentuanOperating Time(OT)
Penentuan OT dilakukan pada larutan heptaminol HCl konsentrasi 0,2
mg/mL pada panjang gelombang maksimum yang telah diperoleh, yaitu pada 332
nm. Pembacaan absorbansi dilakukan pada menit ke-0 sampai menit ke-60 dengan
interval 5 menit. Menit ke-0 yang dimaksud dalam penelitian ini dihitung setelah
1,5 menit sesudah penambahan OPA pada larutan heptaminol HCl. Hasil OT dari
reaksi derivatisasi heptaminol HCl dengan agen penderivat OPA ditunjukkan pada
tabel II dan gambar 18.
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA (kadar 0,2 mg/mL)
Tabel II. Data penentuanoperating timeantara heptaminol dengan agen penderivat OPA
Absorbansi* pada λ 332 nm
Waktu
(menit) I II III IV
SD x
rata-rata
CV (%)
0 0,450 0,450 0,432 0,448 8,7178 x 10-3 0,445 1,959
5 0,439 0,436 0,419 0,429 8,8835 x 10-3 0,43075 2,062
10 0,416 0,419 0,402 0,412 7,4105 x 10-3 0,41225 1,797
15 0,397 0,401 0,385 0,395 6,8068 x 10-3 0,3945 1,725
20 0,379 0,384 0,368 0,380 6,8495 x 10-3 0,37775 1,8132
25 0,361 0,367 0,351 0,366 7,3200 x 10-3 0,36125 2,0262
30 0,344 0,351 0,334 0,352 8,3016 x 10-3 0,34525 2,4045
35 0,328 0,335 0,316 0,338 9,3273 x 10-3 0,3295 2,8307
40 0,312 0,319 0,301 0,326 0,01066 0,3145 3,3895
45 0,299 0,305 0,286 0,314 0,01174 0,301 3,900
50 0,284 0,291 0,272 0,302 0,01257 0,28725 4,3579
55 0,269 0,277 0,258 0,290 0,01347 0,2735 4,925
60 0,255 0,264 0,244 0,279 0,01479 0,2605 5,6775
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA (kadar 0,2 mg/mL)
Dari tabel II dapat dilihat bahwa absorbansi derivat heptaminol HCl yang
terbentuk semakin turun seiring berjalannya waktu. Ketidakstabilan absorbansi
derivat heptaminol HCl menyebabkan tidak diperolehnya rentang waktu dimana
absorbansi stabil. Oleh karena itu, dipilih waktu saat derivatnya memberikan nilai
absorbansi yang reprodusibel pada setiap replikasi. OT yang dimaksud pada
penelitian ini adalah waktu reaksi optimum antara heptaminol HCl dengan OPA,
dimana setiap kali pengulangan atau replikasi pengukuran dilakukan pada waktu
tersebut. OT yang diperoleh adalah pada menit ke-15, dimana pada waktu tersebut
memberikan nilai absorbansi yang reprodusibel dengan CV yang paling baik dan
paling kecil, yaitu 1,725%.
Dalam penentuan OT selain mempertimbangkan reprodusibilitas yang
baik seharusnya dipertimbangkan pula tingkat overlapping antara derivat dan
43
antara derivat dan produk degradasinya seperti terlihat pada gambar 16. Penentuan
OT seharusnya mempertimbangkan reprodusibilitas yang baik (nilai CV kecil)
serta mempertimbangkan waktu dimana tingkat overlapping yang terjadi paling
kecil, sehingga overlapping ini tidak mengganggu dalam pengukuran. Salah satu
keterbatasan pada penelitian ini adalah tidak dilakukannya penentuan OT
berdasarkan pertimbangan tingkat overlapping-nya, sehingga OT hanya dipilih
berdasarkan nilai reprodusibilitas yang baik.
Tingkat overlapping derivat dan produk degradasinya tidak dapat
diketahui secara pasti karena tidak dilakukan pada penelitian ini, sehingga tidak
dapat diamati. Dari spektra pada gambar 16, kemudian dilihat bagaimana
pengaruh hasil degradasinya terhadap hasil derivatisasi pada OT, yaitu seberapa
besar tingkat overlapping-nya pada OT yang akan digunakan. Perkiraan spektra
absorbansi (gambar 19) pada menit ke-15 dibuat dengan menggunakan
perbandingan antara absorbansi yang diperoleh pada menit ke-0 (1,5 menit setelah
penambahan larutan OPA) dengan absorbansi yang diperoleh pada menit ke-60,
berasal dari data yang diperoleh seperti tertera pada gambar 16.
*=absorbansi hasil derivatisasi antara heptaminol HCl dengan OPA (kadar 0,25 mg/mL)
Gambar 19. Perkiraan spektra absorbansi hasil derivatisasi setelah 15 menit reaksi
λ = 269 nm
Seperti yang terlihat pada gambar 19, tingkat overlapping antara spektra
absorbansi hasil derivatisasi dengan spektra absorbansi hasil degradasinya hanya
terjadi sangat sedikit, sehingga dapat dikatakan bahwa hasil degradasinya tidak
mengganggu dalam pengukuran absorbansi hasil derivatisasi antara heptaminol
HCl dengan OPA pada OT-nya.
F. Penentuan Nilai Ekstingsi Molar (ε)
Nilai ekstingsi molar (ε) dari kelima konsentrasi senyawa heptaminol
hasil derivatisasi dapat dilihat pada tabel III melalui perhitungan berikut.
M-1cm-1 (5)
keterangan:ε= ekstingsi molar
A = absorbansi
b = tebal kuvet (cm)
c = konsentrasi (Molar)
Tabel III. Perhitungan nilai ekstingsi molar (ε)
Konsentrasi (M) Tebal Kuvet (cm) Absorbansi* ε(M-1cm-1)
0,000447 1 0,281 628,635
0,000593 1 0,391 659,359
0,000741 1 0,493 665,317
0,000889 1 0,617 694,038
0,00104 1 0,717 689,423
* = absorbansi hasil derivatisasi heptaminol HCl dengan OPA
Menurut Snyder (1997), nilai ε kuantifikasi untuk spektrofotometri UV
adalah≥1000 M-1cm-1. Namun, dalam penelitian ini hanya didapatkan nilaiε
mudah-45
tidaknya senyawa tersebut dapat dianalisis menggunakan spektrofotometri UV
(Mulja dan Suharman, 1995).
Umumnya, analisis menggunakan spektrofotometri UV memerlukan nilai
ε diatas 1000 M-1cm-1, karena absorbansi yang diperoleh akan lebih besar pada
konsentrasi analit yang kecil. Akan tetapi, analit dengan nilai ε yang cukup kecil
(100-1000 M-1cm-1) masih diperbolehkan, meskipun intensitas absorbansinya
akan jauh lebih kecil dibandingkan dengan senyawa lain dengan nilaiεlebih besar
(Pavia, et al., 2001). Hal ini dapat diatasi dengan menggunakan analit dengan
konsentrasi yang cukup besar, sehingga intensitas absorbansi yang diperoleh juga
46
A. Kesimpulan
1. Panjang gelombang maksimum pengukuran untuk penetapan kadar hasil
derivatisasi heptaminol HCl dengan agen penderivat OPA menggunakan
metode spektrofotometri UV adalah pada 332 nm.
2. pH dapar optimum untuk melakukan derivatisasi heptaminol HCl dengan agen
penderivat OPA agar dapat ditetapkan kadarnya menggunakan metode
spektrofotometri UV adalah dapar borat pH 9.
3. Operating time (OT) optimum untuk reaksi derivatisasi heptaminol HCl
dengan agen penderivat OPA adalah pada menit ke-15.
4. Nilai rata-rata koefisien ekstingsi molar (ε) dari senyawa hasil derivatisasi
heptaminol HCl dengan agen penderivat OPA adalah 667,354 M-1cm-1.
B. Saran
Perlu dilakukan penelitian lebih lanjut tentang metode penetapan kadar
heptaminol HCl melalui derivatisasi dengan agen penderivat OPA agar didapatkan
47
DAFTAR PUSTAKA
Ahmed, H., 2005, Principles and Reactions of Protein Extraction, Purification, and Characterization, CRC Press, USA, pp. 64-66.
Anonim, 1989, The Merck Index, An Encyclopedia of Chemicals, Drugs, and Biological,Eleventh Edition, Merck & Co., Inc., USA, pp. 4576.
Anonim, 2005, Safety Data for O-Phthalaldehyde, http://msds.chem.ox.ac.uk/ PH/o-phthalaldehyde.html, diakses 28 Mei 2010.
Anonim, 2010a, Committee For Veterinary Medicinal Products, Heptaminol; Summary Report, EMEA, 043, 95.
Anonim, 2010b,VentiCardyl®,http://www.agrovetmarket.com/Files/046885c0 6ae7 -4346-8371-6022b05e69cc.pdf, diakses tanggal 28 Mei 2010.
Anonim, 2010c, Material Safety Data Sheet o-Pthalaldehyde MSDS, http://www.sciencelab.com/msds.php?msdsId=9926544, diakses 28 Mei 2010.
Benson, J.R., Hare, P.E., 1975, o-Phthalaldehyde: Fluorogenic Detection of Primary Amines in the Picomole Range. Comparison with Fluorescamine and Ninhydrin,Proc. Nat. Acad. Sci., 72 (2), 619-622.
Blackburn, S., 1989,Handbook of Chromatography, CRC Press, USA, pp. 268.
Brodie, R.R., Chasseaud, L.F., Rooney, L., Darragh, A., and Lambe, R.F., 1983, Determination of Heptaminol In Human Plasma and Urine By High-Performance Liquid Chromatography, J. Chromatogr. B Biomed. Sci. Appl., 274, 179-186.
Braithwaite, A. and Smith, F.J., 1999, Chromatographic Methods, Kluwer Academic Publishers, The Netherlands, pp.500.
Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995, Farmakope Indonesia, jilid IV, Departemen Kesehatan Republik Indonesia, Jakarta, pp. li.
Fattah, A., El-Yazbi, F.A., Belal, S.F., and Abdel-Razak, O., 1997, Spectrophotometric and Spectrofluorometric Determination of Heptaminol and Mexiletine in Their Dosage Forms,Anal. Lett., 30, 2029-2043.