Diajuka Mempe
UN
SKRIPSI
jukan untuk Memenuhi Salah Satu Syarat mperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Wilfrida Maria Du’a NIM : 088114071
FAKULTAS FARMASI
NIVERSITAS SANATA DHARMA YOGYAKARTA
IDENTIFIKASI SE BINA
Dia Me
U
i
I SENYAWA FRAKSI I EKSTRAK n-HEKS AHONG (Anredera cordifolia(Ten.) Steenis)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Wilfrida Maria Du’a NIM : 088114071
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
iv
Berpikirlah bahwa kita tidak ingin menjadi seperti ini agar kelak kita tidak
akan melakukan kesalahan yang sama
tetap lakukan apa yg bisa kita lakukan sekarang seperti yang kita mau
aku ada, aku berdiri, aku bisa terus berjuang dengan semangat dan tidak menyerah pada
keadaan karena ada banyak kasih yang senantiasa memelukku dan aku tahu di belakangku
selalu ada doa dari orang-orang yang menyayangiku
vii
PRAKATA
Segala pujian dan syukur penulis haturkan kepada Tuhan karena hanya
dengan anugerah, berkat, cinta, kasih, dan pertolongan-Nya, penulis dapat
menyelesaikan penelitian dan penyusunan skripsi yang berjudul ”Identifikasi Senyawa Fraksi I Ekstrak n-Heksana Daun Binahong (Anredera cordifolia
(Ten.) Steenis)”. Skripsi ini disusun guna memenuhi salah satu syarat untuk memperoleh gelar Sarjana Strata Satu Program Studi Farmasi (S.Farm).
Terselesaikannya penulisan laporan akhir ini tidak lepas dari bantuan
berbagai pihak, karena itu penulis mengucapkan terima kasih kepada:
1. Ibu Lucia Wiwid Wijayanti, M.Si. selaku Dosen Pembimbing yang telah
memberikan petunjuk, saran, arahan, dan bimbingan kepada penulis dalam
proses penyusunan skripsi ini
2. Bapak Yohanes Dwiatmaka, M.Si. dan Prof. Dr. C. J. Soegihardjo, Apt.
selaku Dosen Penguji skripsi yang telah memberikan saran dan masukan
demi kesempurnaan skripsi ini
3. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan dan segenap staf serta
karyawan Laboratorium Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta
4. Ma’Epa, teman seperjuangkanku yang telah dengan sabar menghadapi semua
kemalasanku, mendukung dan menyemangati aku selama masa-masa galau
bersama di lab.
viii
6. Kawan-kawan seperjuangan di lab: Paul, Hepy, Adi, Pandu, Aldosa, Valent,
Novie, Ike, Usi, Satya, Sasa, Vica, Dimbek, Seco, Yuni, Elisa, dan Brian atas
kerja sama, kebersamaan dan keceriaan di lab selama proses penelitian ini
7. Seluruh teman-teman farmasi, khususnya kelas B angkatan 2008 dan FST A
2008 yang telah banyak berbagi keceriaan dan kesedihan
8. Nenek, Tante, Ma Heny, Tanta Ratna, Om Bruno, Kugu, Steve, Ceci, Ka Ibet,
Enenk, Metonk, Indah, Boge, Ma’u, Yelly, Putri , dan semua keluarga yang
selalu jadi saya punya semangat dan jadi obat waktu saya rindu rumah
9. “Cika-cika muah”: Rodhu, Giting dan Lombok yang selalu dukung beta
dengan besong pung cara masing-masing. Sayang besong buanyak2 :-*
10. Papao, yang setelah marah-marah karena beta ngawur tulis skripsweet tapi
terus rasa bersalah dan minta maaf
11. Huluk, Ivon, Nitha, Itin, Cumy, Liany, Stefi, Lina, Kaco-kaco, Tikus Klapa,
Anak Pelangi, Komunitas Sant’Egidio
12. Serta semua pihak yang telah banyak membantu penyusunan skripsi ini yang
tidak dapat disebutkan satu per satu
Penulis menyadari bahwa penulisan skripsi ini masih banyak kekurangan
dan kelemahan karena keterbatasan pikiran, tenaga, dan waktu penulis. Untuk itu
penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir
kata semoga skripsi ini dapat berguna dan bermanfaat bagi pembaca semua.
Yogyakarta, 6 Juni 2012
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
PRAKATA... vii
DAFTAR ISI... ix
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xix
INTISARI... xx
ABSTRACT... xxi
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan... 4
2. Keaslian penelitian ... 4
3. Manfaat penelitian... 5
x
1. Tujuan umum ... 6
2. Tujuan khusus ... 6
BAB II PENELAHAAN PUSTAKA... 7
A. Tanaman Binahong ... 7
B. Ekstraksi... 9
1. Ekstraksi dengan alat sokhlet ... 9
2. Ekstraksi secara perkolasi ... 9
3. Ekstraksi secara maserasi ... 10
4. Ekstraksi secara refluks ... 10
5. Ekstraksi secara penyulingan ... 11
C. Skrining Fitokimia ... 11
1. Alkaloid ... 11
2. Flavonoid... 12
3. Tanin... 13
4. Saponin... 14
5. Terpenoid ... 14
6. Steroid ... 15
D. Isolasi ... 15
1. Kromatografi ... 15
E. Elusidasi Struktur... 18
1. Spektroskopi ... 17
F. Landasan Teori... 23
xi
BAB III METODE PENELITIAN... 25
A. Jenis dan Rancangan Penelitian ... 25
B. Variabel dan Defenisi Operasional ... 25
1. Variabel penelitian ... 25
2. Defenisi operasional ... 25
C. Bahan Penelitian ... 26
D. Alat Penelitian... 27
E. Tata Cara Penelitian ... 27
1. Determinasi tanaman binahong ... 27
2. Preparasi sampel... 27
3. Uji pandahuluan ... 28
4. Optimasi fase gerak 1 ... 33
5. Kromatografi kolom 1 ... 33
6. Kromatografi lapis tipis 1... 34
7. Kromatografi kolom 2 ... 34
8. Kromatografi lapis tipis 2... 35
9. Optimasi fase gerak 2 ... 35
10. Kromatografi lapis tipis preparatif ... 36
11. Kromatografi lapis tipis 3... 37
12. Spektroskopi UV/Vis ... 37
13. GC-MS ... 37
xii
H. Analisis Data ... 38
BAB IV HASIL DAN PEMBAHASAN ... 39
A. Determinasi Tanaman Binahong... 39
B. Preparasi Sampel... 39
C. Ekstraksi Sampel... 41
D. Uji Pendahuluan... 42
1. Alkaloid... 43
2. Flavonoid ... 46
3. Tanin ... 48
4. Saponin ... 50
5. Triterpenoid dan steroid ... 51
E. Optimasi Fase Gerak 1... 53
F. Kromatografi Kolom 1... 55
G. Kromatografi Lapis Tipis 1... 55
H. Kromatografi Kolom 2... 57
I. Kromatografi Lapis Tipis 2... 57
J. Optimasi Fase Gerak 2... 58
K. Kromatografi Lapis Tipis Preparatif ... 61
L. Kromatografi Lapis Tipis 3... 62
M. Spektroskopi UV/Vis ... 63
N. GC-MS ... 65
O. Spektroskopi Inframerah... 78
xiii
BAB V KESIMPULAN DAN SARAN... 81
A. Kesimpulan ... 81
B. Saran ... 81
DAFTAR PUSTAKA ... 82
LAMPIRAN ... 84
xiv
DAFTAR TABEL
Halaman
Tabel I. Hasil uji pendahuluan ekstrak n-heksana daun binahong . 43
Tabel II. Hasil KLT senyawa alkaloid dalam (a) ekstrak n-heksana
daun binahong dan (b) fraksi I kromatografi kolom 2
ekstrak n-heksana daun binahong ... 45
Tabel III. Hasil KLT senyawa flavonoid dalam (a) ekstrak
n-heksana daun binahong dan (b)fraksi I kromatografi
kolom 2 ekstrak n-heksana daun binahong... 47
Tabel IV. Hasil KLT senyawa triterpenoid dan steroid dalam (a)
ekstrak n-heksana daun binahong dan (b) fraksi I
kromatografi kolom 2 ekstrak n-heksana daun binahong . 52
Tabel V. Hasil KLT ekstrak n-heksana daun binahong dengan
fase diam silika gel dan fase gerak asetonitril;
n-heksana; kloroform; kloroform : metanol (1:1); dan
metanol... 54
Tabel VI. Hasil KLT fraksi I kromatografi kolom 1 dengan fase
diam silika gel dan fase gerak a. kloroform; b.
kloroform : metanol (1:1); c. metanol... 56
Tabel VII. Hasil KLT fraksi I kromatografi kolom 2 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak a. kloroform; b. kloroform : metanol (1:1); c.
xv
Tabel VIII. Hasil KLT fraksi I kromatografi kolom 2 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak a. kloroform; b. kloroform : metanol (1:1); c.
metanol... 60
Tabel IX. Hasil KLT fraksi I kromatografi kolom 2 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak a. kloroform; b. kloroform : metanol (1:1); c.
metanol... 62
Tabel X. Hasil spektrum MS senyawa yang diisolasi dari
xvi
DAFTAR GAMBAR
Halaman
Gambar 1. Kromatografi kolom ... 16
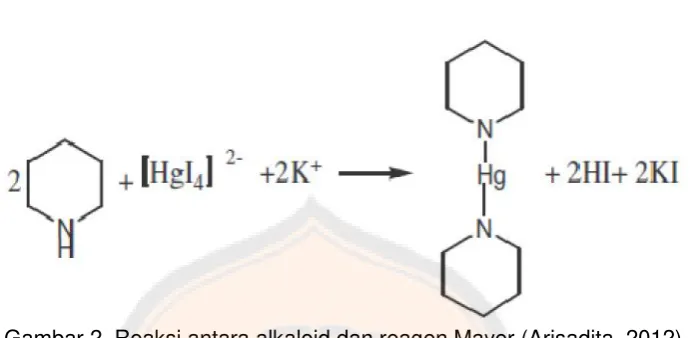
Gambar 2. Reaksi antara alkaloid dan reagen Mayer ... 43
Gambar 3. Hasil KLT ekstrak n-heksana ekstrak daun binahong dan
fraksi 1 kromatografi kolom 2 ekstrak n-heksana daun
binahong dengan a. pereaksi Dragendorff; b. asam sulfat 45
Gambar 4. Reaksi pembentukan warna antara flavonoid
dengan logam magnesium (Mg) ... 46
Gambar 5. Hasil KLT ekstrak n-heksana ekstrak daun binahong dan
fraksi 1 kromatografi kolom 2 ekstrak n-heksana daun
binahong dengan pereaksi amonia ... 47
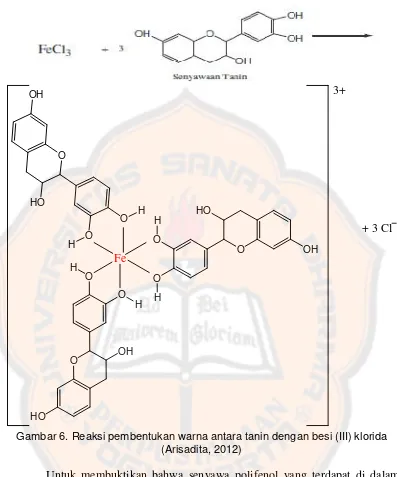
Gambar 6. Reaksi pembentukan warna antara tanin dengan
besi (III) klorida (FeCl3) ... 49
Gambar 7. Reaksi pengendapan antara tanin dengan gelatin ... 50
Gambar 8. Hasil KLT ekstrak n-heksana ekstrak daun binahong dan
fraksi 1 kromatografi kolom 2 ekstrak n-heksana daun
binahong dengan pereaksi Lieberman-Buncard... 53
Gambar 9. Hasil KLT ekstrak n-heksana daun binahong dengan fase
gerak a. asetonitril; b. n-heksana; c. kloroform; d.
kloroform : metanol (1:1); e. metanol... 54
Gambar 10. Kromatografi kolom ekstrak n-heksana daun binahong
xvii
Gambar 11. Hasil KLT fraksi I kromatografi kolom 1 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak a. kloroform; b. kloroform : metanol (1:1); c.
metanol... 56
Gambar 12. Hasil KLT fraksi I kromatografi kolom 2 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak a. kloroform; b. kloroform : metanol (1:1); c.
metanol... 58
Gambar 13. Hasil KLT fraksi I hasil kromatografi kolom 2 ekstrak
n-heksana daun binahong dengan fase diam silika gel dan
fase gerak kloroform : metanol; a. 15:1, b. 13:1, c. 11:1,
d. 9:1, e. 7:1, f. 5:1, g. 2:1, h. kloroform, i. 1:1, j.
metanol, k. 1:2, l. 1:3, m. 1:5, n. 1:9, dan o. 1:19 ... 61
Gambar 14. Hasil KLT preparatif dengan fase gerak
kloroform : metanol 1:19 ... 61
Gambar 15. Hasil KLT dengan fase gerak a. kloroform;
b. kloroform : metanol (1:1); c. metanol... 62
Gambar 16. Spektrum UV/Vis fraksi I ekstrak n-heksana ... 63
Gambar 17. Senyawa
1,2,8a-trimethyl-1,2,3,4,8,8a-hexahydronaphthalene... 64 Gambar 18. Spektrum MS peak 1 pada GC dengan Retention time
18,721menit ... 65
xviii
Gambar 20. (a) keton; (b) potongan gugus metil; (c) metil
karboksilat; (d) metil etil ester ... 66
Gambar 21. Fragmen hasil pemutusan (-OCH3)... 66
Gambar 22. Spektrum MS peak 2 pada GC dengan Retention time
20,496menit ... 67
Gambar 23. Spektrum MS peak 3 pada GC dengan Retention time
20,728menit ... 68
Gambar 24. Spektrum MS peak 4 pada GC dengan Retention time
23,192menit ... 69
Gambar 25. (a) ion 1-oktanol; (b) ion hasil pemutusan ion
1-oktanol dari dioktil adipat... 69
Gambar 26. Fragmen hasil pemutusan (-OC8H17)... 69
Gambar 27. Spektrum MS peak 5 pada GC dengan Retention time
24,509menit ... 70
Gambar 28.isobenzofuran-1,3-dione... 71 Gambar 29. Fragmen hasil pemutusan (-OC8H17dan–C8H17)... 71
Gambar 30. Spektrum MS peak 6 pada GC dengan Retention time
25,505menit ... 72
Gambar 31. Spektrum MS peak 7 pada GC dengan Retention time
26,961menit ... 72
xix
DAFTAR LAMPIRAN
Lampiran 1. Surat Determinasi Binahong
(Anredera cordifolia(Ten.) Steenis) ... 85
Lampiran 2. Contoh Perhitungan Nilai Rf KLT ... 86
Lampiran 3. Spektrum UV/Vis ... 86
Lampiran 4. Kromatogram GC dan Spektrum MS ... 88
xx
INTISARI
Tanaman binahong (Anredera cordifolia (Ten.) Steenis) telah diketahui secara turun-temurun sebagai tanaman obat di Indonesia dan berpotensi untuk dijadikan bahan fitofarmaka. Penelitian ini dilakukan untuk mengidentifikasi senyawa yang terdapat dalam fraksi I ekstrak n-heksana daun binahong khususnya senyawa terpenoid, steroid dan asam lemak.
Metode penelitian dilakukan secara deskriptif eksperimental. Penelitian ini diawali dengan melakukan maserasi pada daun binahong menggunakan pelarut n-heksana, skrining fitokimia, fraksinasi menggunakan kromatografi kolom dan fraksi I hasil kromatografi kolom diisolasi menggunakan Kromatografi Lapis Tipis (KLT) preparatif. Hasil isolasi dinyatakan murni setelah hasil KLT yang diperoleh menghasilkan satu bercak dengan harga Rf yang berbeda pada tiga fase gerak dengan kepolaran yang berbeda. Fase gerak yang dipilih adalah kloroform (IP=4,1), kloroform:metanol (1:1) (IP=4,6) dan metanol (IP=5,1). Senyawa yang terbukti murni secara KLT lalu dielusidasi strukturnya dengan menggunakan UV/Vis, GC-MS, dan IR. Dari hasil skrining fitokimia dan elusidasi struktur maka dapat disimpulkan bahwa senyawa yang terdapat pada ekstrak n-heksana daun binahong adalah senyawa golongan steroid, asam lemak (metil heksadekanoat, asam oleat, metil 16-metilheptadekanoat, dioktil adipat, dioktil ptalat) dan alkana (metil oktakosana dan tetratetrakontana).
xxi
ABSTRACT
Binahong (Anredera cordifolia (Ten.) Steenis) has been known for generations as medicinal plants in Indonesia and potential to make an phytopharmaca. The study was conducted to identify the compounds contained in 1st fraction on n-hexane extracts from binahong leaves especially terpenoid, steroids and fatty acids compounds.
The method of research conducted by experiment description. The first phase of the study was carried out by maceration of binahong leaves using the n-hexane solvent, further identification of the compound, fractionation by column chromatography and isolated by preparative Thin Layer Chromatography (TLC). The results revealed the pure isolation if the isolate obtained a single spot on TLC with different Rf on the three mobile phases with different polarity. The selected mobile phase was chloroform (IP = 4.1), chloroform: methanol (1:1) (IP = 4.6) and methanol (IP = 5.1). Compound which proved to be pure by TLC and its structure was identification using UV/Vis, GC-MS, and IR. From the results of phytochemical screening and identification of the structure it can be concluded that the compounds contained in extracts of n-hexane from binahong leaves are steroids, fatty acids (methyl hexadecanoate, oleic acid, methyl 16-methylheptadecanoate, dioctyl adipate, dioctyl phthalate) and alcane (octacosane dan tetratetracontane).
1
BAB I PENDAHULUAN A. Latar Belakang
Sejak dahulu manusia telah menggunakan tanaman sebagai bahan obat
secara tradisional yang berfungsi untuk menjaga kesegaran tubuh, mencegah
penyakit, mengurangi rasa sakit, menyembuhkan penyakit, bahkan untuk
mempercantik diri. Salah satu tanaman yang biasa dijadikan sebagai bahan obat
ialah tanaman binahong (Anredera cordifolia (Ten.) Steenis). Tanaman ini memiliki potensi yang sangat besar untuk dijadikan bahan fitofarmaka mengingat
manfaatnya yang banyak digunakan untuk mengobati berbagai macam penyakit.
Penggunaan tanaman binahong biasanya dengan langsung mengunyah daun
binahong, merebusnya, mencampurkan daun binahong dengan makanan lain
seperti ketika membuat mie serta dengan dibuat dalam bentuk jus. Secara
tradisional tanaman binahong telah digunakan untuk menyembuhkan sakit batuk,
muntah darah, penyakit paru-paru, diabetes melitus, radang ginjal, ambeien,
disentri, gusi berdarah, luka paska operasi dan melahirkan, jerawat, luka akibat
kecelakaan, luka bakar, meningkatkan vitalitas pria, menjaga stamina, serta
menurunkan kolesterol (Manoi, 2009). Namun belum dilakukan uji praklinis dan
klinis untuk membuktikan khasiat tanaman binahong tersebut.
Melihat begitu banyak khasiat binahong sebagai tanaman obat maka
banyak dilakukan penelitian terhadap senyawa metabolit sekunder yang terdapat
dalam tanaman binahong dengan skrining fitokimia untuk mengetahui golongan
binahong sebagai bahan obat. Golongan senyawa metabolit sekunder yang
terdapat pada tanaman binahong antara lain steroid (Barboza, Cantero, Nunez,
Pacciaroni, and Espinar, 2009). Dalam jurnal ini dikatakan bahwa tanaman
binahong memiliki aktivitas biologi sebagai antibakteri dengan menggunakan
daun yang telah dikeringkan dan secara tradisional, daun kering tanaman
binahong digunakan sebagai antineuralgik, eye washes, neonatal dan paediatries care, serta untuk perawatan kulit (jamur, kutil, gigitan serangga, gatal-gatal dan iritasi). Dalam jurnal lain (Fai and Tao, 2009) dikemukakan bahwa tanaman
binahong mengandung asam oleanolat dan saponin, serta asam ursolat (Wibisono,
2010) yang telah ditetapkan kadarnya dengan Kromatografi Cair Kinerja Tinggi
fase terbalik. Berdasarkan hasil penelitian pendahuluan Universitas Gadjah Mada,
dinyatakan bahwa pada kultur in vitro daun binahong terkandung senyawa aktif
flavonoid, alkaloid, terpenoid, dan saponin (Manoi, 2009). Hasil uji pendahuluan
yang dilakukan oleh Khunaifi (2010) pada ekstrak etil asetat daun binahong
menunjukkan adanya alkaloid, flavonoid, dan polifenol, sedangkan menurut
Arisandi dan Andriani (2006) dikatakan bahwa daun tanaman binahong memiliki
kandungan kimia berupa γ-glucan, karoten, asam organik, mukopolisakarida dan
asam aldonat, juga mengandung saponin, vitamin A, B, dan C.
Selain kandungan metabolit sekunder, telah dilakukan juga uji efek
farmakologi yang dilakukan antara lain uji aktivitas antibakteri ekstrak daun
binahong terhadap bakteri staphylococcus aureus dan pseudomonas aerugino (Khunaifi, 2010), uji aktivitas antimikroba ekstrak n-heksana dan fraksi terpenoid
Eschericia coli danCandida albicans (Arisadsita, 2010), uji efek tonikum infusa daun binahong (Anredera cordifolia (Ten.) Steenis) pada mencit putih (Mus musculus) jantan galurSwiss Webster (Asriani, 2011), uji efektivitas ekstrak daun binahong (Anredera cordifolia (Ten.) Steenis.) sebagai antibakteri Salmonella typhi penyebab tifus (Kurniati, 2011), dan uji aktivitas penangkap radikal ekstrak petroleum eter, etil asetat dan etanol daun binahong (Anredera cordifolia (Ten.) Stenis) dengan metode DPPH (2,2-difenil-1- pikrihidrazil) (Handayani, 2009).
Dilihat dari penggunaanya secara tradisional, senyawa metabolit
sekunder dan uji efek farmakologi maka tanaman binahong berpotensi sangat
besar untuk dijadikan bahan fitofarmaka. Potensi ini khususnya terkait dengan
kegunaannya secara tradisional untuk meningkatkan stamina dan vitalitas pria
yang berhubungan dengan kandungan metabolit sekunder berupa senyawa
golongan sterid yang belum banyak ditemukan pada tanaman lain serta uji
farmakologi berupa efek tonikum. Karena itu, pada penelitian ini akan digunakan
pelarut yang bersifat nonpolar untuk proses ekstraksi agar senyawa streroid yang
bersifat nonpolar akan ikut terekstrak. Namun, karena terdapat banyak senyawa
lain yang terkandung dalam tanaman binahong maka yang terdapat dalam ekstrak
bukan hanya senyawa metabolit sekunder golongan steroid tetapi terdapat juga
golongan terpenoid dan asam lemak yang bersifat nonpolar.
Seluruh bagian dari tanaman binahong ini dapat digunakan sebagai bahan
obat, namun bahan yang paling sering digunakan dalam penelitian adalah bagian
daun tanaman karena mudah diperoleh dan dibersihkan serta memiliki
Pada penelitian ini, daun tanaman binahong yang telah dikeringkan akan
dimaserasi dengan menggunakan n-heksana, kemudian akan dilakukan fraksinasi
dengan sistem kromatografi kolom serta KLT preparatif dan struktur dari senyawa
tersebut akan diketahui dengan spektrometri UV/Vis, GC-MS dan IR.
1. Permasalahan
a. Berdasarkan skrining fitokimia, senyawa golongan apakah yang
terkandung dalam fraksi I ekstrak n-heksana daun binahong?
b. Berdasarkan analisis spektroskopi, senyawa apakah yang terkandung
dalam fraksi I ekstrak n-heksana daun binahong?
2. Keaslian penelitian
Penelitian terhadap tanaman binahong telah banyak dilakukan, namun
penelitian ini hanya berkisar pada skrining fitokimia untuk mengetahui golongan
senyawa metabolit sekunder dan uji efek farmakologi dari tanaman binahong
tetapi belum diketahui secara spesifik senyawa kimia apa dari golongan metabolit
sekunder yang telah terbukti ada pada tanaman binahong ini.
Golongan senyawa metabolit sekunder yang terdapat pada tanaman
binahong antara lain steroid (Barboza, Cantero, Nunez, Pacciaroni, and Espinar,
2009). Dalam jurnal ini dikatakan bahwa tanaman binahong memiliki aktivitas
biologi sebagai antibakteri dengan menggunakan daun yang telah dikeringkan dan
secara tradisional, daun kering tanaman binahong digunakan sebagai
antineuralgik, eye washes, neonatal dan paediatries care, serta untuk perawatan kulit (jamur, kutil, gigitan serangga, gatal-gatal dan iritasi). Dalam jurnal lain (Fai
oleanolat dan saponin, serta asam ursolat (Wibisono, 2010) yang telah ditetapkan
kadarnya dengan Kromatografi Cair Kinerja Tinggi fase terbalik. Berdasarkan
hasil penelitian pendahuluan Universitas Gadjah Mada, dinyatakan bahwa pada
kultur in vitro daun binahong terkandung senyawa aktif flavonoid, alkaloid,
terpenoid, dan saponin (Manoi, 2009). Hasil uji pendahuluan yang dilakukan oleh
Khunaifi (2010) pada ekstrak etil asetat daun binahong menunjukkan adanya
alkaloid, flavonoid, dan polifenol, sedangkan dari menurut Arisandi dan Andriani
(2006) dikatakan bahwa daun tanaman binahong memiliki kandungan kimia
berupa γ-glucan, karoten, asam organik, mukopolisakarida, asam aldonat, juga
mengandung saponin, vitamin A, B, dan C.
Uji efek farmakologi yang dilakukan antara lain uji aktivitas antibakteri
ekstrak daun binahong terhadap bakteri staphylococcus aureus danpseudomonas aerugino (Khunaifi, 2010), uji aktivitas antimikroba ekstrak n-heksana dan fraksi terpenoid tanaman binahong terhadap Staphylococcus aureus, Eschericia colidan Candida albicans (Arisadsita, 2010), uji efek tonikum infusa daun binahong pada mencit putih (Mus musculus) jantan galur Swiss Webster (Asriani, 2011), uji efektivitas ekstrak daun binahong sebagai antibakteri Salmonella typhi penyebab tifus (Kurniati, 2011), dan uji aktivitas penangkap radikal ekstrak petroleum eter,
etil asetat dan etanol daun binahong dengan metode DPPH
(2,2-difenil-1-pikrihidrazil) (Handayani, 2009).
Berdasarkan penelitian yang telah dilakukan sebelumnya, maka peneliti
ingin mengisolasi senyawa steroid yang dapat berfungsi untuk meningkatkan
jawab terhadap efek farmakologis sebagai efek tonikum. Karena itu perlu
dilakukan penelitian lebih lanjut dengan skrining fitokimia untuk mencari
kandungan senyawa hasil isolasi dan identifikasi dengan metode spektroskopi
untuk mengetahui struktur senyawa kimia dalam tanaman binahong.
3. Manfaat penelitian
a. Manfaat teoritis. Mendapatkan informasi sebagai data kimia, metabolit
sekunder yang terkandung dalam daun tanaman binahong.
b. Manfaat metodologis. Mendapatkan informasi mengenai metode yang
digunakan untuk melakukan fraksinasi dan identifikasi senyawa kimia
dalam fraksi I ekstrak n-heksana daun binahong.
c. Manfaat praktis. Mengetahui kandungan senyawa kimia dalam fraksi I
ekstrak n-heksana daun binahong sehingga tanaman binahong dapat
dikembangkan menjadi suatu fitofarmaka.
B. Tujuan Penelitian 1. Tujuan umum
Mendukung memberikan informasi tentang aktifitas tanaman binahong
berdasarkan senyawa kimia yang terkandung di dalamnya.
2. Tujuan khusus
Mengetahui golongan senyawa metabolit sekunder yang terkandung
dalam ekstrak fraksi I n-heksana daun binahong dengan skrining fitokimia dan
7
BAB II
PENELAAHAN PUSTAKA A. Tanaman Binahong
Binahong berupa tumbuhan menjalar, berumur panjang (perenial), bisa mencapai panjang ± 5m. Akar berbentuk rimpang, berdaging lunak. Batang lunak,
silindris, saling membelit, berwarna hijau, bagian dalam solid, permukaan halus,
kadang membentuk semacam umbi yang melekat di ketiak daun dengan bentuk
tak beraturan dan bertekstur kasar. Daun tunggal, bertangkai sangat pendek
(subsessile), tersusun berseling, berwarna hijau, bentuk jantung (cordata), panjang 5-10cm, lebar 3-7cm, helaian daun tipis lemas, ujung runcing, pangkal berlekuk
(emerginatus), tepi rata, permukaan licin, bisa dimakan. Bunga majemuk berbentuk tandan, bertangkai panjang, muncul di ketiak daun, mahkota berwarna
krem keputih-putihan berjumlah lima helai tidak berlekatan, panjang helai
mahkota 0,5-1cm, berbau harum. Perbanyakan generatif (biji), namun lebih sering
berkembang atau dikembangbiakan secara vegetatif melalui akar rimpangnya
(Manoi, 2009).
Klasifikasi tanaman binahong
Kingdom :Plantae(tumbuhan)
Ordo :Caryophyllales Famili :Basellaceae Genus :Anredera
Spesies :Anredera cordifolia(Ten.) Steenis
(Manoi, 2009).
Secara tradisional tanaman binahong telah digunakan untuk
menyembuhkan sakit batuk, muntah darah, penyakit paru-paru, diabetes melitus,
radang ginjal, ambeien, disentri, gusi berdarah, luka paska operasi dan
melahirkan, jerawat, luka akibat kecelakaan, luka bakar, meningkatkan vitalitas
pria, menjaga stamina, serta menurunkan kolesterol. Cara penggunaan tanaman
binahong sebagai bahan obat biasanya dilakukan dengan langsung mengunyah
daun binahong, merebusnya, mencampurkan daun binahong dengan makanan lain
seperti ketika membuat mie serta dengan dibuat dalam bentuk jus (Manoi, 2009).
Golongan senyawa metabolit sekunder yang terdapat pada tanaman
binahong berdasarkan penelitian yang telah dilakukan antara lain: steroid
(Barboza, dkk., 2009), asam oleanolat, saponin, dan asam ursolat (Wibisono,
2010), flavonoid, alkaloid, terpenoid dan saponin (Anonim, 2009), alkaloid,
flavonoid dan polifenol pada ekstrak etil asetat daun binahong (Khunaifi, 2010),
serta γ-glukan, karoten, asam organik, dan mukopolisakarida seperti L-arabinosa,
D-galaktosa, L-ramnosa, dan asam aldonat, juga saponin, vitamin A, B, dan C
B. Ekstraksi
Ekstraksi adalah penyarian zat-zat berkhasiat atau zat-zat aktif dari
bagian tanaman obat, hewan dan beberapa jenis ikan termasuk biota laut. Tujuan
ekstraksi bahan alam adalah untuk menarik komponen kimia yang terdapat pada
bahan alam. Ekstraksi ini didasarkan pada prinsip perpindahan massa komponen
zat ke dalam pelarut, dimana perpindahan mulai terjadi pada lapisan antar muka
kemudian berdifusi masuk ke dalam pelarut (Umi, 2011).
Jenis ekstraksi bahan alam yang sering dilakukan adalah ekstraksi secara
panas dengan cara refluks, penyulingan uap air dan dengan alat sokhlet, serta
ekstraksi secara dingin dengan cara maserasi dan perkolasi (Umi, 2011).
1. Ekstraksi dengan alat sokhlet
Ekstraksi ini merupakan ekstraksi secara berkesinambungan. Cairan
penyari dipanaskan sampai mendidih, uap penyari akan naik melalui pipa
samping, kemudian diembunkan oleh pendingin tegak. Cairan penyari turun untuk
menyari zat aktif dalam simplisia. Selanjutnya bila cairan penyari mencapai sifon,
maka seluruh cairan akan turun ke labu alas bulat dan terjadi proses sirkulasi.
Demikian seterusnya sampai zat aktif yang terdapat dalam simplisia tersari
seluruhnya yang ditandai jernihnya cairan yang lewat pada tabung sifon (Umi,
2011).
2. Ekstraksi secara perkolasi
Perkolasi dilakukan dengan cara membasahkan 10 bagian simplisia
dengan derajat halus yang cocok, menggunakan 2,5 bagian sampai 5 bagian cairan
dipindahkan sedikit demi sedikit ke dalam perkolator dan ditambahkan cairan
penyari. Perkolator ditutup dibiarkan selama 24 jam, kemudian kran dibuka
dengan kecepatan 1 ml permenit, sehingga simplisia tetap terendam. Filtrat
dipindahkan ke dalam bejana, ditutup dan dibiarkan selama 2 hari pada tempat
terlindung dari cahaya (Umi, 2011).
3. Ekstraksi secara maserasi
Maserasi dilakukan dengan cara memasukkan 10 bagian simplisia
dengan derajat halus yang cocok ke dalam bejana, kemudian dituangi dengan
penyari 75 bagian, ditutup dan dibiarkan selama 5 hari, terlindung dari cahaya
sambil diaduk sekali-kali setiap hari lalu diperas dan ampasnya dimaserasi
kembali dengan cairan penyari. Penyarian diakhiri setelah pelarut tidak berwarna
lagi, lalu dipindahkan ke dalam bejana tertutup, dibiarkan pada tempat yang tidak
bercahaya, setelah dua hari lalu endapan dipisahkan (Umi, 2011).
4. Ekstraksi secara refluks
Ekstraksi dengan cara ini pada dasarnya adalah ekstraksi
berkesinambungan. Bahan yang akan diekstraksi direndam dengan cairan penyari
dalam labu alas bulat yang dilengkapi dengan alat pendingin tegak, lalu
dipanaskan sampai mendidih. Cairan penyari akan menguap, uap tersebut akan
diembunkan dengan pendingin tegak dan akan kembali menyari zat aktif dalam
simplisia tersebut, demikian seterusnya. Ekstraksi ini biasanya dilakukan 3 kali
5. Ekstraksi secara penyulingan
Penyulingan dapat dipertimbangkan untuk menyari serbuk simplisia yang
mengandung komponen kimia yang mempunyai titik didih yang tinggi pada
tekanan udara normal, yang pada pemanasan biasanya terjadi kerusakan zat
aktifnya. Untuk mencegah hal tersebut, maka penyari dilakukan dengan
penyulingan (Umi, 2011).
C. Skrining Fitokimia
Salah satu pendekatan untuk penelitian tumbuhan obat adalah
penampisan senyawa kimia yang terkandung dalam tanaman. Cara ini digunakan
untuk mendeteksi senyawa tumbuhan berdasarkan golongannya. Sebagai
informasi awal dalam mengetahui senyawa kimia apa yang mempunyai aktivitas
biologi dari suatu tanaman (Umi, 2011).
1. Alkaloid
Alkaloid, sekitar 5500 telah diketahui, merupakan zat tumbuhan
sekunder yang terbesar. Pada umumnya alkaloid mencakup senyawa bersifat basa
yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan,
sebagai bagian dari sistem siklik. Alkaloid sering kali beracun bagi manusia dan
banyak yang mempunyai kegiatan fisiologi yang menonjol; jadi digunakan secara
luas dalam bidang pengobatan. Alkaloid biasanya tidak berwarna, sering kali
bersifat optis aktif, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa
cairan pada suhu kamar. Uji sederhana, tetapi sama sekali tidak sempurna, untuk
alkaloid dalam daun atau buah segar adalah rasa pahitnya di lidah (Harborne,
Secara umum, golongan senyawa alkaloid mempunyai sifat-sifat sebagai
berikut:
I. Biasanya berupa kristal tak berwarna, tidak mudah menguap, tidak larut
dalam air, larut dalam pelarut-pelarut organik seperti etanol, eter dan
kloroform. Beberapa alkaloid (seperti koniina dan nikotina) berwujud cair
dan larut dalam air. Ada juga alkaloid yang berwarna, misalnya berberina
(kuning).
II. Bersifat basa; pada umumnya berasa pahit, bersifat racun, mempunyai efek
fisiologis serta optik aktif.
III. Dapat membentuk endapan dengan larutan asam fosfolframat, asam
fosfomolibdat, asam pikrat, kalium merkuriiodida, dan lain sebagainya. Dari
endapan-endapan ini, banyak juga yang memiliki bentuk kristal yang khusus
sehingga sangat bermanfaat dalam identifikasinya (Tobing, 1989).
2. Flavonoid
Semua flavonoid, menurut strukturnya, merupakan turunan senyawa
induk flavon yang terdapat berupa tepung putih pada tumbuhan primula, dan semuanya mempunyai sejumlah sifat yang sama. Flavonoid terutama berupa
senyawa yang larut dalam air. Dapat diekstraksi dengan etanol 70% dan tetap ada
dalam lapisan air setelah ekstrak ini dikocok dengan eter minyak bumi. Flavonoid
berupa senyawa fenol, karena itu warnanya berubah bila ditambah basa atau
amonia; jadi, mereka mudah dideteksi pada kromatogram atau dalam larutan
Flavonoid mengandung sistem aromatik yang terkonjugasi dan karena itu
menunjukan pita serapan kuat pada daerah spektrum UV dan spektrum tampak.
Flavonoid umumnya terdapat pada tumbuhan, terikat pada gula sebagai glikosida
dan aglikon flavonoid yang manapun mungkin terdapat dalam satu tumbuhan
dalam beberapa bentuk kombinsi glikosida. Flavonoid terdapat pada semua
tumbuhan berpembuluh tetapi beberapa kelas lebih tersebar dari pada yang
lainnya (Harborne, 1987).
3. Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae
terdapat khusus dalam jaringan kayu. Menurut batasanya, tanin dapat bereaksi
dengan protein membentuk kepolumer mantap yang tidak larut dalam air. Dalam
industri, tanin adalah senyawa yang berasal dari tumbuhan, yang mampu
mengubah kulit hewan yang mentah menjadi kulit siap pakai karena
kemampuanya menyambung silang protein (Harbrorne, 1987).
Di dalam tumbuhan letak tanin terpisah dari protein dan enzim
sitoplasma, tetapi bila jaringan rusak, misalnya bila hewan memakanya, maka
reaksi penyamakan dapat terjadi. Reaksi ini menyebabkan protein lebih sukar
dicapai oleh cairan pencernaan hewan. Pada kenyataanya, sebagian besar
tumbuhan yang banyak bertanin dihindari oleh hewan pemakan tumbuhan karena
rasanya yang sepat. Kita menganggap salah satu fungsi utama tanin dalam
tumbuhan ialah sebagai penolak hewan pemakan tumbuhan (Harbrorne, 1987).
Secara kimia terdapat dua jenis utama tanin yang tersebar tidak merata
paku-pakuan dan gimnospermae, serta tersebar luas dalam angiospermae,
terutama pada jenis tumbuhan berkayu. Sebaliknya, tanin yang terhidrolisiskan
penyebaranya terbatas pada tumbuhan berkeping dua (Harborrne, 1987).
4. Saponin
Komponensurface-activeini terdistribusi secara luas pada tumbuhan dan terdapat pada daun yang digunakan secara tradisional sebagai sabun. Saponin
tersusun dari residu gula yang memiliki gugus β-OH pada C3 dari C27-aglikon
yang berhubungan langsung dengan sapogenin (Mann, Davidson, Hobbs,
Banthorpe, and Harbone, 1994).
5. Terpenoid
Terpenoid mencakup sejumlah besar senyawa tumbuhan dan istilah ini
digunakan untuk menunjukan bahwa secara biosintesis semua senyawa tumbuhan
itu berasal dari senyawa yang sama. Jadi semua terpenoid berasal dari molekul
isoprena CH2═C(CH3)─CH═CH2 dan kerangka karbonnya dibangun oleh
penyambungan dua atau lebih satuan C5 ini. Kemudian senyawa itu dipilah-pilah
menjadi beberapa golongan berdasarkan jumlah satuan yang terdapat dalam
senyawa tersebut: dua (C10), tiga (C15), empat (C20), enam (C30), atau delapan
(C40) satuan. Terpenoid terdiri dari beberapa senyawa, mulai dari komponen
minyak atsiri, yaitu monoterpena dan siskuiterpena yang mudah menguap (C10
dan C15), diterpena yang lebih sukar menguap (C20), sampai ke senyawa yang
tidak menguap, yaitu triterpenoid dan sterol (C30). Masing-masing golongan
terpenoid itu penting, baik bagi pertumbuhan dan metabolisme maupun pada
6. Steroid
Senyawa sederhana steroid dapat diartikan sebagai kelas senyawa
organik bahan alam yang kerangka strukturnya terdiri dari androstan
(siklopentanofenantren). Androstan adalah suatu sistem cincin tetrasiklik;
keempat cincinnya berturut-turut ditandai dengan A, B, C, dan D dan semua atom
C yang terdapat dalam struktur diberi nomor mulai dari 1 sampai dengan 19.
Sebagian besar dari steroid mempunyai sifat-sifat sebagai berikut:
I. mengandung gugus fungsi oksigen (sebagai = O atau–OH) pada C3
II. mengandung gugus sampai pada C17
III. banyak yang mengandung ikatan rangkap di antara C4-C5atau C5-C6
(Tobing, 1989).
D. Isolasi 1. Kromatografi
Kromatografi adalah suatu metode pemisahan fisik di mana
komponen-komponen yang dipisahkan didistribusikan di antara dua fase, salah satu fase
tersebut adalah suatu lapisan stasioner dengan permukaan yang luas, yang lainnya
sebagai fluida yang mengalir lembut di sepanjang landasan stasioner (Day and
Underwood, 2002).
a. Kromatografi kolom
Kromatografi cair yang dilakukan di dalam kolom besar
merupakan metode kromatografi terbaik untuk memisahkan campuran
dalam jumlah besar (lebih dari 1g). Fase diam dalam banyak kasus
yang mengisi ruang antar partikel yang teradsorbsi. Kolomnya (tabung
gela) diisi dengan bahan seperti alumina, silika gel atau pati yang
dicampur dengan adsorben, dan pastanya diisikan ke dalam kolom.
Gambar 1. Kromatografi kolom (Gritter, Bobbitt, and Schwarting, 1991)
Pada kromatografi kolom, campuran yang akan dipisahkan
diletakkan berupa pita pada bagian atas kolom penjerap yang berada di
dalam tabung kaca, tabung logam, atau bahkan tabung plastik. Larutan
sampel kemudian diisikan ke dalam kolom dari atas sehingga sampel
diasorbsi oleh adsorben. Kemudian pelarut (fasa gerak; pembawa)
ditambahkan tetes demi tetes dari atas kolom. Partisi zat terlarut
berlangsung di pelarut yang turun ke bawah (fasa gerak) dan pelarut yang
teradsorbsi oleh adsorben (fasa diam). Selama perjalanan turun, zat
terlarut akan mengalami proses adsorpsi dan partisi berulang-ulang. Laju
penurunan berbeda untuk masing-masing zat terlarut dan bergantung
pada koefisien partisi masing-masing zat terlarut. Akhirnya, zat terlarut
akan terpisahkan membentuk beberapa lapisan dan masing-masing
lapisan dapat dielusi dengan pelarut yang cocok untuk memberikan
karena senyawa yang akan dipisahkan, dielusi dari kolom (Gritter et al., 1991).
b. Kromatografi lapis tipis
Pada kromatografi lapis tipis, fase diamnya akan berupa lapisan
tipis (tebal 0,1-2mm) yang terdiri atas bahan padat yang dilapiskan
kepada permukaan penyangga datar yang biasanya terbuat dari kaca
tetapi dapat pula terbuat dari plat polimer atau logam dan fase geraknya
mengalir karena kerja kapiler. Lapisan fase diam akan melekat pada
permukaan dengan bantuan bahan pengikat, biasanya kalsium sulfat atau
amilum (pati) (Gritteret al., 1991).
Perilaku senyawa tertentu di dalam sistem KLT dinyatakan
dengan harga Rf. Angka ini diperoleh dengan membagi jarak yang
ditempuh oleh bercak eluen dengan jarak yang ditempuh oleh garis depan
pelarut. Keduanya diukur dari titik awal, dan harga Rf beragam mulai
dari 0 sampai 1 (Gritteret al., 1991).
Salah satu metode pemisahan yang memerlukan pembiayaan
paling murah dan memakai peralatan paling dasar ialah Kromatografi
Lapis Tipis Preparatif (KLTP). Penjerap yang paling umum ialah silika
gel untuk campuran senyaa lipofil maupun hidrofil, dengan ketebalan
yang sering digunakan 0,5-2mm dan ukuran plat 20x20cm atau 20x40cm.
Pembatasan ketebalan dan ukuran pelat dapat mengurangi jumlah bahan
yang dapat dipisahkan dengan KLT (Hostettmann, Hostettmann, and
Cuplikan yang ditotolkan harus berupa pita yang harus sesempit
mungkin karena pemisahan bergantung pada lebar pita. Konsentrasi
cuplikan harus sekitar 5-10%. Cuplikan 10-100mg dapat dipisahkan pada
lapisan silika gel atau aluminium oksida 20x20cm yang tebalnya 1mm.
Pilihan pelarut dapat ditentukan berdasarkan pemeriksaan pendahuluan
dengan memakai KLT analitik. Karena ukuran partikel penjerap kira-kira
sama, pelarut yan dipakai pada KLT analitik dapat langsung dipakai pada
KLTP. Fase gerak biner (dalam berbagai perbandingan) yang sering
digunakan pada pemisahan secara KLTP adalah heksana-etil asetat,
n-heksana-aseton, kloroform-metanol (Hostettmannet al., 1986).
Pita yang kedudukannya telah diketahui dikerok dari plat
dengan spatula atau pengerok berbentuk tabung yang disambungkan ke
pengumpul vakum. Senyawa harus diekstraksi dari penjerap dengan
pelarut yang paling kurang polar (sekitar 5mL pelarut untuk 1g penjerap)
karena makin polar pelarut pengekstraksi, makin banyak bahan yang
tidak diinginkan terekstraksi. Harus diperhatikan bahwa makin lama
senyawa berkontak dengan penjerap makin besar kemungkinan
terjadinya penguraian (Hostettmannet al., 1986).
E. Elusidasi Struktur 1. Spektroskopi
Spektroskopi serap merupakan pengukuran suatu interaksi antara radiasi
elektromagnit dan molekul atau atom dari suatu zat kimia (Departemen Kesehatan
elektromagnitik digunakan untuk menganalisis spesies kimia dan menelaah
interaksinya dengan radiasi elektromagnitik. Suatu foton memiliki energi tertentu
dan dapat menyebabkan transisi tingkat energi suatu atom atau molekul. Karena
tiap spesies kimia memiliki tingkat energi yang berbeda, maka transisi perubahan
energinya juga berbeda. Berarti suatu spektrum yang diperoleh dengan memplot
beberapa fungsi frekwensi terhadap frekwensi radiasi elektromagnitik adalah khas
untuk spesies kimia tertentu dan berguna untuk identifikasi (Khopkar, 1990).
a. Spektroskopi UV/Vis
Spektroskopi ini didasarkan pada serapan sinar UV tampak yang
menyebabkan terjadinya transisi di antara tingkat energi elektronik
molekul. Transisi ini dapat terjadi antar orbital ikatan (bonding) atau
orbital anti ikatan (antibonding). Panjang gelombang sinar yang diserap
sebanding dengan perbedaan tingkat energi orbital. Kegunaan utama
Spektroskopi UV adalah untuk identifikasi jumlah ikatan
rangkap/konjugasi aromatik. Spektrum UV biasanya diukur dalam
larutan sangat encer, dengan syarat pelarut harus tidak menyerap pada
panjang gelombang di mana dilakukan pengukuran, agar tidak ada
serapan (back ground) (Panji, 2012).
b. Kromatografi gas dan spektroskopi massa
Kromatografi gas adalah suatu proses dimana suatu campuran
dipisah menjadi komponen-komponennya oleh fase gas yang bergerak
melewati suatu lapisan serapan (sorben) yang diam. Suatu kromatografi
tabung bertekanan tinggi (seperti helium, nitrogen, hidrogen, atau argon,
tergantung pada faktor ketersediaan, kemurnian yang dituntut, konsumsi
dan tipe detektor yang digunakan), tempat penginjeksian, kolom, dan
detektor (berfungsi untuk merasakan dan mengukur kualitas kecil dari
komponen yang telah terpisah yang ada dalam aliran gas pengembang
yang meninggalkan kolom). Pemilihan detektor akan bergantung pada
tingkat konsentrasi yang harus diukur dan sifat dasar
komponen-komponen yang akan dipisahkan (Bassett, Denney, Jeffery, and
Mendham, 1994).
Spektroskopi massa didasarkan pada fragmen molekul yang
dihasilkan pada reaksi fragmentasi (pemecahan molekul). Dengan kata
lain, dari data fragmentasi dapat diidentifikasi struktur senyawa utuhnya.
Perkembangan alat spektrometer yang dilengkapi dengan komputer dapat
membantu membandingkan spektrum yang dihasilkan dengan spektrum
senyawa standar yang disimpan dalam basis data komputer. Salah satu
metode komputer dalam membandingkan spektrum suatu senyawa
dengan spektrum senyawa standar adalah dengan mengelompokan
komponen spektrum ke dalam kategori kesamaan (similarity), kelebihan (excess), dan kehilangan (missing). Komputer akan menghitung probabilitas makin besar atau makin positif bahwa senyawa yang
dianalisis sama dengan standar dalam basis data jika makin banyak
kesamaan. Hasil perbandingan tersebut dinyatakan sebagai probabilitas
kasus, jika persentase kesamaan mencapai 97% atau lebih, hasilnya
cukup dapat dipercaya bahwa memang benar senyawa yang dianalisis
identik dengan senyawa standar (Panji, 2012).
Gas Chromatography-Mass Spectroscopy (GC-MS) saat ini menjadi alat yang handal untuk penentuan struktur molekul senyawa
organik, khususnya untuk senyawa organik yang cukup volatil. Bahkan,
beberapa senyawa yang memiliki titik didih cukup tinggi, seperti minyak
dengan asam lemak rantai panjang, masih dapat dianalisis langsung
dengan GC-MS, sedangkan jika dianalisis dengan GC saja (tanpa MS)
harus diesterifikasi terlebih dahulu untuk menurunkan titik didih. Hal ini
disebabkan pada GC-MS, perangkat MS dilengkapi sistem vakum hingga
10-6torr yang sangat membantu dalam proses penguapan cuplikan. GC
dan MS sangat compactible (cocok), karena senyawa yang keluar dari kolom GC berupa gas atau uap, dan yang dibutuhkan oleh MS juga
senyawa dalam fase uap (Panji, 2012).
c. Spektroskopi infra merah
Spektroskopi inframerah pada dasarnya sama dengan
spektroskopi ultraviolet dan cahaya tampak, hanya berbeda pada sumber
energi, bahan optik dan detektor. Spektroskopi inframerah harus sering
dikalibrasi terhadap skala panjang gelombang, misalnya menggunakan
film polistiren (Departemen Kesehatan Republik Indonesia, 1979). Di
daerah inframerah dan inframerah dekat diperlukan kadar masing-masing
memadai; untuk daerah spektrum ini biasanya dipakai sel dengan panjang
0,01mm hingga 3mm. Daerah inframerah spektrum elektromagnit yang
digunakan untuk analisis obat meliputi 4000cm-1 hingga 250cm-1
(2,5µm-40µm). Spektrum serapan inframerah suat zat mempunyai
gambaran yang khas untuk zat yang bersangkutan hingga dapat
digunakan untuk identifikasi. Untuk keperluan identifikasi spektrum zat
yang diuji dapat dibandingkan dengan spektrum zat pembanding yang
ditetapkan dengan cara yang sama, atau dibandingkan dengan spektrum
pembanding (Departemen Kesehatan Republik Indonesia, 1979).
Spektroskopi IR biasanya digunakan untuk menentukan struktur,
khususnya senyawa organik (Khopkar, 1990). Daerah inframerah dekat
terutama sesuai untuk penetapan gugus –OH dan–NH, seperti air dalam
alkohol –OH dalam lingkungan amina, alkohol dalam hidrokarbon, dan
amina primer dan sekunder dalam lingkungan amina tersier. Spektrum
inframerah bersifat khas untuk suatu senyawa kimia tertentu, dengan
pengecualian isomer optik yang mempunyai spektum identik. Namun
polimorfisme kadang-kadang dapat menjadi penyebab perbedaan dalam
spektrum inframerah suatu senyawa tertentu dalam keadaan padat.
Seringkali perbedaan kecil dalam struktur menyebabkan perbedaan
segnifikan dalam spektrum. Karena banyaknya maksimum yang terdapat
dalam spektrum serapan inframerah, kadang-kadang dimungkinkan untuk
campuran yang komposisi kualitatifnya diketahui tanpa pemisahan
terlebih dahulu (Departemen Kesehatan Republik Indonesia, 1995).
F. Landasan Teori
Dari putaka yang ada, telah diketahui bahwa tanaman binahong memiliki
senyawa aktif golongan steroid, saponin, flavonoid, alkaloid, terpenoid, polifenol,
asam organik, asam oleanolat, asam ursolat, γ-glukan, karoten, mukopolisakarida
(L-arabinosa, D-galaktosa, L-ramnosa), asam aldonat, serta vitamin A, B, dan C.
Serta adanya efek farmakologi sebagai antibakteri, tonikum dan penangkap
radikal. Pustaka-pustaka memberitahukan golongan senyawa yang terdapat pada
tanaman binahong dan uji efek farmakologinya, namun belum diketahui senyawa
aktif spesifik yang bertanggung jawab terhadap efek farmakologi yang diberikan
oleh tanaman binahong, karena itu pada penelitian ini akan dilakukan isolasi dan
identifikasi struktur dari isolat yang diperoleh dari fraksi I ekstrak n-heksana daun
binahong.
Dalam identifikasi, langkah awal yang dilakukan adalah mengekstraksi
simplisia daun tanaman binahong dengan metode maserasi menggunakan pelarut
n-heksana. n-Heksana merupakan pelarut yang bersifat nonpolar maka senyawa
yang akan ikut tersari ke dalam n-heksana adalah senyawa yang bersifat nonpolar.
Metabolit sekunder yang bersifat nonpolar ini antara lain senyawa golongan
terpenoid, steroid dan asam lemak. Metode identifikasi yang sering dilakukan
untuk mengetahui kandungan metabolit sekunder yang terdapat pada tanaman
adalah dengan uji pendahuluan (skrining fitokimia). Uji pendahuluan ini hanya
secara spesifik senyawa kimianya penelitian akan dilanjutkan dengan pemisahan
(fraksinasi) ekstrak n-heksana daun binahong dengan menggunakan kromatografi
kolom dan kromatografi lapis tipis preparatif dan kemudian senyawa yang
terpisah diidentifikasi strukturnya dengan metode spektroskopi (UV/Vis, GC-MS,
dan IR).
G. Hipotesis
Struktur senyawa yang berhasil diidentifikasi dari fraksi I ekstrak
25
BAB III
METODE PENELITIAN A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian deskriptif eksperimental.
Penelitian ini merupakan penelitian yang bersifat deskriptif karena dalam penelitian
hanya mendeskripsikan keadaan pada saat penelitian dan merupakan jenis
penelitian eksperimental karena tidak dilakukan manipulasi terhadap subjek uji.
B. Variabel dan Definisi Operasional 1. Variabel penelitian
a. Variabel utama
1) Variabel bebas : ekstrak n-heksana daun binahong
2) Variabel tergantung : kandungan steroid, terpenoid dan asam
lemak ekstrak n-heksana daun binahong
b. Variabel pengacau
1) Variabel pengacau terkendali:
a) tempat hidup tanaman binahong
b) paparan sinar matahari yang diterima daun tanaman binahong
2) Variabel pengacau tidak terkendali:
a) waktu pemetikan daun binahong
2. Definisi operasional
1) Preparasi sampel merupakan salah satu tahap dalam sampel yang dapat
menentukan kelayakan dan reproduksibiltas suatu analisis dalam matrik
pengotor.
2) Ekstraksi adalah penyarian zat-zat berkhasiat atau zat-zat aktif dari bagian
tanaman obat, hewan dan beberapa jenis ikan termasuk biota laut.
3) Evaporasi merupakan suatu tahapan yang bertujuan untuk memekatkan
larutan.
4) Spektrum adalah jarak atau rentang frekuensi yang mengandung sinyal.
5) Peak merupakan puncak dari suatu kromatogram atau spektrum.
6) Kromatogram adalah presentasi hasil analisa atau pemisahan komponen
zat dengan teknik kromatografi dengan maksud mengenali masing-masing
zat.
7) Isolasi merupakan proses pemisahan suatu senyawa dari campuran
beberapa senyawa.
8) Detektor adalah alat yang digunakan untuk membaca serapan dari sistem
kromatografi.
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah daun tanaman
binahong (Anredera cordifolia (Ten.) Steenis), air mengalir, aquadest, n-heksana, asetonitril, asam siliko wolframat LP, asam fosfomolibdat LP, asam fosfowolframat
LP, Bouchardat LP, Wagner LP, Mayer LP, Dragendorff LP, Marme LP, Hager LP,
amonia pekat P, eter P, kloroform, natrium sulfat anhidrat P, asam asetat anhidrat P,
Molish LP, asam sulfat P, metanol P, Baljet LP, Kadde LP, kalium hidroksida 1N,
asam sulfat 2N, benzena P, natrium hidroksida 2N, serbuk seng P, asam klorida 2N,
asam klorida pekat P, etanol (95%) P, serbuk magnesium P, serbuk halus asam
borat P, serbuk halus asam oksalat P, eter P, FeCl3 1%, gelatin, silika gel,
kloroform p.a., metanol p.a., KBr, DMSO d6, tetrametilsilan (TMS).
D. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah oven, blender,
pengayak nomor 40, timbangan analitik, shaker, erlenmeyer, kertas saring, rotary vaccum evaporator, labu alas bulat, labu hisap, sendok, batang pengaduk, beaker glass, gekas ukur, pipet tetes, gelas arloji, corong pisah, corong, penangas air, cawan porselin, bunsen, gelas ukur, tabung reaksi, pipa kapiler, spatula,
spektrofluorometer, alat degassing ultrasonik, Milipore ukuran pori 0,45 μ m, TLC
Plate Coater, chamber, plat KLT, kolom, seperangkat alat UV/Vis, seperangkat alat GC-MS, seperangkat alat spektrometer inframerah.
E. Tatacara Penelitian 1. Determinasi tanaman binahong
Determinasi tanaman binahong dilakukan dengan membandingkan dengan
Flora of Java. Kemudian tanaman binahong dibuat herbariumnya dalam bentuk kering meliputi akar, batang, daun, bunga dan rimpang.
2. Preparasi sampel
a. Pemilihan sampel
Sampel yang dipilih adalah daun tanaman binahong yang segar
dan tidak berpenyakit (tidak dijangkiti oleh infeksi virus, bakteri atau
terpisah dari pencemar lain seperti tangkai binahong, atau bahan lain selain
daun binahong. Daun tanaman binahong yang diambil berasal dari daerah
Yogyakarta.
Daun dipanen kemudian dicuci dengan air mengalir dan
dipisahkan daun binahong dan pengotor (tangkai, bunga, umbi dan akar).
Tiriskan dan keringanginkan daun agar air sisa pencucian dapat hilang.
Keringkan daun binahong dengan oven pada suhu 40-60ºC. Setelah
dikeringkan, daun diserbuk dengan menggunakan blender dan diayak
dengan menggunakan pengayak nomor 40.
b. Ekstraksi sampel
Maserasi dilakukan dengan perbandingan simplisia kering daun
tanaman binahong : n-heksana (1:10). Ditimbang sebanyak 5g daun
tanaman binahong kering kemudian diekstraksi selama 3jam dengan
pelarut n-heksana sebanyak 50mL, dilakukan sebanyak 3kali. Hasil
maserasi lalu disaring dengan menggunakan kertas saring dan bantuan
vakum. Ekstrak kemudian dikentalkan dengan rotary vaccum evaporator.
3. Uji pendahuluan
a. Alkaloida
Larutan percobaan untuk pengendapan alkaloid dibagi menjadi 4
golongan sebagai berikut.
I. Golongan I : larutan percobaan dengan alkaloida membentuk garam
yang tidak larut: asam siliko wolframat LP, asam fosfomolibdat LP dan
II. Golongan II : larutan percobaan yang dengan alkaloid membentuk
senyawa kompleks bebas, kemudian membentuk endapan: Bouchardat
LP dan Wagner LP.
III. Golongan III : larutan percobaan yang dengan alkaloida membentuk
senyawa adisi yang tidak larut : Mayer LP, Dragendorff LP dan Marme
LP.
IV. Golongan IV : larutan percobaan yang dengan alkaloida membentuk
ikatan asam organik dengan alkaloid: Hager LP.
Cara percobaan :
Ambil kurang lebih 25mL ekstrak kental daun binahong
ditambahkan 1mL HCl 2N dan 9mL air, dipanaskan di atas penangas air
selama 2menit, dinginkan dan saring. Pindahkan 3tetes filtrat pada kaca
arloji, tambahkan 2tetes Bouchardat LP atau Mayer LP. Jika pada kedua
percobaan tidak terjadi endapan maka serbuk tidak mengandung alkaloida.
Jika dengan Mayer LP terjadi endapan menggumpal berwarna
putih atau kuning yang larut dalam metanol P dan dengan Bouchardat LP
terbentuk endapan berwarna cokelat sampai hitam, maka ada kemungkinan
terdapat alkaloida.
Lanjutkan percobaan dengan mengocok sisa filtrat dengan 3mL
amonia pekat P dan 10mL campuran 3 bagian volume eter P dan 1 bagian
volume kloroform (hati-hati jangan menggojok terlalu kuat, bisa terjadi
emulsi, pakai corong pisah). Ambil fase organik, tambahkan natrium sulfat
sedikit HCl 2N. Lakukan percobaan dengan keempat golongan larutan
percobaan. Serbuk mengandung alkaloida jika sekurang-kurangnya
terbentuk endapan dengan menggunakan 2 golongan larutan percobaan.
Dengan KLT :
Ekstrak kental n-heksan daun binahong ditotolkan pada plat KLT
yang telah dibuat. Plat kemudian dielusikan dengan menggunakan larutan
pengembang berupa kloroform dan dimasukkan ke dalam chamber yang telah dijenuhkan dengan kloroform. Setelah dielusi, plat dikeluarkan dan
dibiarkan kering lalu disemprotkan dengan pereaksi Dragendorff dan asam
sulfat encer.
b. Flavonoid
Cara percobaan
I. Uapkan hingga kering 1mL larutan percobaan, sisa dilarutkan dalam
1mL sampai 2mL etanol (95%) P; tambahkan 0,5mg serbuk seng P dan
2mL asam klorida 2N, diamkan selama 1menit. Tambahkan 10tetes
asam klorida pekat P. Jika dalam waktu 2 sampai 5menit terjadi warna
merah intensif, menunjukan adanya flavonoid (glikosida 3-flavonol).
II. Uapkan hingga kering 1mL larutan percobaan, sisa dilarutkan dalam
1mL etanol (95%) P, tambahkan 0,1g serbuk magnesium P. Jika terjadi
warna merah jingga sampai merah ungu, menunjukan adanya flavonaid.
Jika terjadi warna kuning jingga, menunjukan adanya flavon, kalkon,
III. Uapkan hingga kering 1mL larutan percobaan, basahkan sisa dengan
aseton P, tambahkan sedikit serbuk halus asam borat P dan serbuk halus
asam oksalat P, panaskan hati-hati di atas penangas air dan hindari
pemanasan yang berlebihan. Campur sisa yang diperoleh dengan 10mL
eter P. Amati dengan sinar UV 366nm; larutan berfluorosensi kuning
intensif, menunjukan adanya flavonoid.
(MMI)
Dengan KLT :
Ekstrak kental n-heksana daun binahong ditotolkan pada plat
KLT yang telah dibuat. Plat kemudian dielusi dengan menggunakan
larutan pengembang berupa kloroform dan dimasukkan ke dalam chamber
yang telah dijenuhkan dengan kloroform. Setelah dielusi, plat dikeluarkan
dan dibiarkan kering lalu disemprotkan dengan pereaksi amonia.
c. Tanin
i. Uji dengan FeCl3
Ekstrak kental n-heksana daun binahong ditambahkan dengan 2-3tetes
larutan besi (IV) klorida 1%. Jika larutan menghasilkan warna hijau
kehitaman atau biru tinta, maka bahan tersebut mengandung tanin.
ii. Uji dengan larutan gelatin
Ekstrak kental n-heksana daun binahong dimasukkan dalam tabung
reaksi ditambah dengan larutan gelatin. Jika terbentuk endapan putih,
d. Saponin
Encerkan 1mL ekstrak kental n-heksana daun binahong dengan
10mL air dan kocok kuat-kuat selama 10menit. Terbentuk buih yang
mantap selama tidak kurang dari 10menit setinggi 1-10cm. Pada
penambahan 1 tetes asam klorida 2N, buih tidak hilang.
e. Triterpenoid dan steroid
Ekstrak kental n-heksana daun binahong dimasukkan dalam
tabung reaksi, dilarutkan dalam 0,5mL kloroform lalu dipanaskan dan
didinginkan. Diambil 1mL dan dimasukkan dalam tabung reaksi lalu
diteteskan pereaksi Lieberman-Burchard. Jika hasil yang diperoleh berupa
cincin kecoklatan atau violet pada perbatasan dua pelarut menunjukkan
adanya triterpenoid, sedangkan jika terbentuk warna hijau kebiruan
menunjukkan adanya steroid.
(Sriwahyuni, 2010)
Dengan KLT :
Ekstrak kental n-heksana daun binahong ditotolkan pada plat
KLT yang telah dibuat. Plat kemudian dielusi dengan menggunakan
larutan pengembang berupa kloroform dan dimasukkan ke dalam chamber yang telah dijenuhkan dengan kloroform. Setelah dielusi, plat dikeluarkan
dan dibiarkan kering lalu disemprotkan dengan pereaksi
4. Optimasi fase gerak 1
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
dibuat bubur dengan 21mL aquadest. Bubur yang telah ada kemudian diratakan
pada plat kaca dengan ukuran 5x15cm dengan menggunakan alat TLC Plate Coater. Setelah adsorben pada plat kaca rata, plat lapis tipis yang terbentuk dikeringkan dalam oven pada suhu 100–120oC selama paling kurang 1jam.
Ekstrak kental n-heksana daun binahong ditotolkan pada plat KLT yang
telah dibuat. Ekstrak kemudian dielusi dengan menggunakan 5 larutan
pengembang, yaitu: asetonitril, n-heksana, kloroform, kloroform:metanol (1:1), dan
metanol.
Dari hasil elusi dilihat fase gerak mana yang menghasilkan pemisahan
terbaik. Fase gerak yang memberikan pemisahan terbaik kemudian digunakan
sebagai fase gerak pada kromatografi kolom.
5. Kromatografi kolom 1
Campurkan adsorben (silika gel) dengan fase gerak (kloroform) hingga
terbantuk suspensi yang seperti bubur. Suspensi ini kemudian dimasukan ke dalam
kolom hingga pencapai tiga perempat dari tinggi kolom.
Sampel yang berupa ekstrak kental n-heksana daun binahong sebanyak
0,5mL dimasukkan ke dalam kolom, dibiarkan mengendap lalu dialirkan fase gerak
berupa kloroform untuk mengelusi dan eluen ditampung pada flakon tiap 3menit.
6. Kromatografi lapis tipis 1
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
diratakan pada plat kaca dengan ukuran 5x15cm dengan menggunakan alat TLC Plate Coater. Setelah adsorben pada plat kaca rata, plat lapis tipis yang terbentuk dikeringkan dalam oven pada suhu 100–120oC selama paling kurang 1jam.
Eluen hasil isolasi dengan kromatografi kolom dari ekstrak kental
n-heksana daun binahong ditotolkan pada plat KLT yang telah dibuat. Eluen
kemudian dielusi dengan menggunakan 3 larutan pengembang, yaitu: kloroform,
kloroform:metanol (1:1), dan metanol.
Dari hasil elusi dilihat apakah telah diperoleh senyawa yang dikatakan
murni secara KLT.
7. Kromatografi kolom 2
Campurkan adsorben (silika gel) dengan fase gerak (kloroform) hingga
terbantuk suspensi yang seperti bubur. Suspensi ini kemudian dimasukkan ke dalam
kolom hingga pencapai tiga perempat dari tinggi kolom.
Sampel yang berupa fraksi 1 hasil kromatografi kolom 1 dari ekstrak
kental n-heksan daun binahong sebanyak 0,5mL dimasukkan ke dalam kolom. Ke
dalam kolom lalu dialirkan fase gerak berupa metanol dan eluen ditampung pada
flakon tiap 3menit. Kemudian ke dalam kolom dialirkan kloroform dan ditampung
setian 3menit.
Eluen kemudian dikembangkan dengan KLT, dengan menggunakan 3 fase
gerak yaitu kloroform, kloroform:metanol (1:1), dan metaol. Jika dari hasil elusi
8. Kromatografi lapis tipis 2
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
dibuat bubur dengan 21mL pelarut (aquadest). Bubur yang telah ada kemudian
diratakan pada plat kaca dengan ukuran 5x15cm dengan menggunakan alat TLC Plate Coater. Setelah adsorben pada plat kaca rata, plat lapis tipis yang terbentuk dikeringkan dalam oven pada suhu 100–120oC selama paling kurang 1jam.
Eluen hasil isolasi dengan kromatografi kolom 2 kemudian ditotolkan pada
plat KLT yang telah dibuat. Eluen kemudian dielusi dengan menggunakan 3 larutan
pengembang, yaitu: kloroform, kloroform:metanol (1:1), dan metanol.
Dari hasil elusi dilihat apakah telah diperoleh senyawa yang dikatakan
murni secara KLT, jika belum murni maka dapat dilanjutkan dengan isolasi
menggunakan KLTP dengan terlebih dahulu melakukan optimasi fase gerak untuk
mendapatkan pemisahan terbaik.
9. Optimasi fase gerak 2
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
dibuat bubur dengan 21mL aquadest. Bubur yang telah ada kemudian diratakan
pada plat kaca dengan ukuran 5x15cm dengan menggunakan alat TLC Plate Coater. Setelah adsorben pada plat kaca rata, plat lapis tipis yang terbentuk dikeringkan dalam oven pada suhu 100–120oC selama paling kurang 1jam.
Eluen hasil isolasi dengan kromatografi kolom eluen hasil kolom2
kemudian ditotolkan pada plat KLT yang telah dibuat. Eluen kemudian dielusi
perbandingan: 1:1, 1:2, 1:3, 1:5, 1:9, 1:19, 15:1, 13:1, 11:1, 9:1, 7:1, 5:1, 3:1, dan
2:1.
Dari hasil elusi dilihat fase gerak mana yang menghasilkan pemisahan
terbaik. Fase gerak yang memberikan pemisahan terbaik kemudian digunakan
sebagai fase gerak pada KLTP.
10. Kromatografi lapis tipis preparatif
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
dibuat bubur dengan 21mL pelarut (aquadest). Bubur yang telah ada kemudian
diratakan pada plat kaca dengan ukuran 20x20cm dengan menggunakan alat TLC Plate Coater. Setelah adsorben pada plat kaca rata, plat lapis tipis yang terbentuk dikeringkan dalam oven pada suhu 100–120oC selama paling kurang 1jam.
Eluen hasil isolasi dengan kromatografi kolom eluen hasil kolom 2
kemudian ditotolkan berupa pita pada plat KLT yang telah dibuat. Eluen kemudian
dielusi dengan menggunakan larutan pengembang berupa kloroform:metanol (1:19)
hasil optimasi sebelumnya.
Hasil elusi kemudian dikeringkan dan dikerok dengan menggunakan
spatula kemudian ditampung dan diekstraksi dengan menggunakan kloroform.
Hasil ekstraksi lalu dipekatkan dengan menggunakanrotary vaccum evaporator.
11. Kromatografi lapis tipis 3
Sebanyak 7g adsorben (silika gel) yang akan digunakan untuk pelapis
dibuat bubur dengan 21mL pelarut (aquadest). Bubur yang telah ada kemudian