ke dalam persamaan regresi (Y=aX+b) dengan konsentrasi zeolit sintesis (% berat) sebagai absis (sumbu X) dan nilai persentase inhibisi sebagai ordinat (sumbu Y). Nilai IC50 diperoleh pada saat persentase inhibisi sebesar 50%.
Penentuan Kapasitas Adsorpsi ( Hediana 2011)
Sebanyak 50.0mg zeolit sintesis dan yang terpilar ditambahkan larutan biru metilena 100, 200, 300, 400 dan 500mg L-1 sebanyak 15 ml, kemudian dikocok menggunakan vortex selama 2 jam. Setelah itu larutan disentrifugasi dengan kecepatan 500rpm selama 20 menit. Konsentrasi supernatant ( biru metilena / Ct) ditentukan dengan spektrofotometer UV – tampak pada panjang gelombang maksimum ( λ maks). Penentuan λ maks dilakukan dengan mengukur serapan larutan biru metilena pada rentang panjang gelombang 200 – 700nm. Larutan baku biru metilena dibuat dengan konsentrasi 2 , 3, 4, 5, dan 6 mg L-1. Kapasitas adsorpsi ditentukan dengan persamaan :
Q =
Dimana Q = kapasitas adsorpsi ( mg g-1), V = volume larutan biru metilen (L),
Co = konsentrasi biru metilen awal (mg L-1),
Ct = konsentrasi biru metilena sisa (mg L-1), dan m = massa zeolit (mg)
HASIL DAN PEMBAHASAN
Hasil Pencirian Zeolit , Zeolit Terpilar TiO2 serta Zeolit Terpilar Fe2O3
Zeolit yang dibuat dalam penelitian ini berasal dari kaolin. Kaolin merupakan bahan yang banyak digunakan sebagai bahan baku pembuatan zeolit , karena kaolin mengandung SiO2 dan Al2O3 sebagai bahan dasar untuk menyintesis zeolit (Barrer 1978). Hal ini karena struktur dan senyawa penyusun kaolin mirip dengan penyusun zeolit. Kaolin mempunyai struktur yang berupa lapisan 1 : 1, yaitu untuk setiap lembar terdiri atas satu lapisan tetrahedral oksida – Si (lapisan silikat) dan satu lapisan oktahedral hidroksioksida – Al (lapisan aluminat). Selembar silika tetrahedral dikombinasi dengan hidroksil oktahedral yang dibagi dengan lembar alumina oktahedral (Murray 2000). Sementara zeolit memiliki struktur tetrahedral semua,oleh sebab itu diperlukan pemanasan agar struktur oktahedral aluminat kaolin dapat diubah menjadi struktur tetrahedral aluminat zeolit. Morfologi serbuk kaolin, metakaolin, zeolit sintetik dan zeolit sintetik terpilarisasi diperlihatkan pada Gambar 1.
Gambar 1 memperlihatkan perbedaan mendasar pada kaolin (K), metakaolin (M) dan zeolit sintetik (ZS). Perubahan yang terjadi yaitu dari kaolin yang semula serbuk berwarna putih (Gambar 1a), kemudian setelah dikalsinasi
pada suhu 700 C menjadi sedikit kecoklatan tetapi masih berbentuk serbuk kasar yang kemudian disebut metakaolin (Gambar 1b). Pemanasan 700 C bertujuan meruntuhkan struktur kristal kaolin yang ditandai dengan hilangnya gugus hidroksil yang terikat secara kimia.
Adapun reaksinya diperlihatkan pada Persamaan 1 (Hosseini et al. 2011).
(1)
Kaolin metakaolin
Persamaan 1 menunjukkan perubahan jumlah molekul oksigen dan hidrogen dari kaolin. Selama proses kalsinasi struktur kaolin terdegradasi dan dua molekul H2O akan terdehidroksilasi (Hosseini et al. 2011). Dehidroksilasi adalah hilangnya molekul air yang terserap pada kisi-kisi kristal dari mineral kaolin membentuk metakaolin. Proses kalsinasi telah merubah molekul Al2O3 yang berbentuk oktahedral pada kaolin membentuk ion AlO2- yang berbentuk tetrahedral pada metakaolin.
Metakaolin selanjutnya direaksikan dengan NaOH 2M yang berfungsi sebagai pemberi suasana basa yang memengaruhi waktu nukleasi dengan mengubah fase metakaolin dari fase padat menjadi larutan. NaOH juga berfungsi sebagai donor kation yang berperan dalam mengarahkan dan menyeimbangkan muatan pada kerangka struktur zeolit (Georgiev et al. 2009). Larutan metakaolin dipanaskan pada suhu 40 C selama 6 jam untuk mempercepat proses pembentukan inti kristal zeolit. Pemanasan dilanjutkan pada suhu 100 C selama 24 jam untuk menyempurnakan pembentukan kristal zeolit.
Zeolit sintetik (ZS) yang diperoleh dicuci menggunakan air bebas ion hingga pH netral. Pencucian bertujuan menghilangkan material yang tidak menjadi bagian dari penyusun zeolit yang mungkin ada di permukaan dan larut dalam air bebas ion. ZS selanjutnya dikeringkan dalam oven pada suhu 100 C selama 24 jam dengan tujuan selain menguapkan air yang terperangkap dalam pori-pori kristal zeolit juga agar jumlah pori dan luas permukaan spesifiknya bertambah (Suardana 2008). ZS yang dihasilkan berupa kristal putih kekuningan (Gambar 1c). ZS yang diperoleh dipanaskan lagi pada suhu 300 C selama 5 jam dengan tujuan memperbaiki kristalinitas, meski secara fisik tidak terjadi perubahan warna yang mencolok (Gambar 1d) tetapi dari data difraktogram terjadi kenaikan kristalinitas.
Pemilaran menggunakan TiO2 (Gambar 1e) dilakukan melalui penambahan TiO2 ke larutan awal metakaolin – NaOH menghasilkan zeolit sintetik ZSTi (Gambar 1f) yang warnanya putih kekuningan dengan bentuk serbuk lebih halus . Kemudian ZSTi dioksidasi lagi dan diperoleh hasil ZSTiO berbentuk serbuk lebih kasar (Gambar 1g) dibandingkan serbuk ZSTi. Pemilaran TiO2 secara fisik dilakukan melalui penambahan TiO2 pada zeolit yang telah disintesis menghasilkan campuran/komposit berupa serbuk berwarna kuning pucat (Gambar 1h) yang selanjutnya disebut ZSTiF.
Pemilaran ZS dengan Fe2O3 (Gambar 1i) dilakukan melalui penambahan Fe2O3 ke larutan awal metakaolin – NaOH menghasilkan serbuk berwarna merah coklat ZSFe (Gambar 1j). Warna serbuk akan lebih tua lagi jika dioksidasi lanjut
ZSFeO (Gambar 1k). Pemilaran secara fisik antara ZS dengan Fe2O3 menghasilkan serbuk ZSFeF (Gambar 1l) yang berwarna merah coklat pekat dibandingkan dengan ZSFe.
Serbuk TiO2 berwarna putih dan Fe2O3 berwarna merah bata , apabila kedua bahan ini dicampurkan dengan zeolit sintetik baik secara fisik maupun saat proses sintesis zeolit maka warnanya akan saling mempengaruhi. Proses sintesis zeolit dengan pilarisasi TiO2 dan Fe2O3 yang dilakukan secara fisik maupun saat proses sintesis memengaruhi warna zeolit yang dihasilkan, namun secara kasat mata semuanya bercampur dengan merata. Morfologi zeolit maupun zeolit terpilar TiO2 dan Fe2O3 akan terlihat lebih jelas menggunakan SEM – EDS dan keberhasilan pemilaran ini juga diamati dengan XRD.
a b c
d e f
g h i
j k l
Gambar 1 Morfologi serbuk (a) K, (b) M, (c) ZS, (d) ZSO, (e) TiO2, (f) ZSTi, (g) ZSTiO, (h) ZSTiF, (i) Fe2O3, (j) ZSFe, (k) ZSFeO, dan (l) ZSFeF.
Karakter zeolit melalui pengamatan menggunakan XRD
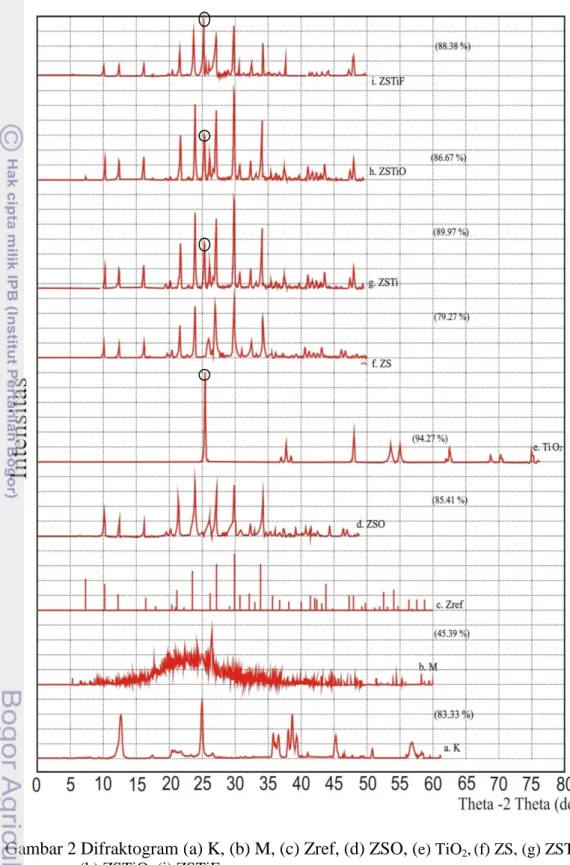
Difraksi sinar X digunakan untuk mengidentifikasi jenis mineral zeolit yang terkandung dan kristalinitasnya. Gambar 2a dan 3a menunjukkan difraktogram
kaolin, sedangkan Gambar 2b dan 3b memperlihatkan difraktogram metakaolin. Perbandingan kedua difraktogram ini memperlihatkan adanya perbedaan puncak antara kaolin dan metakaolin, yang berarti bahwa telah terjadi perubahan struktur pada kaolin, yaitu lepasnya gugus hidroksil. Perubahan ini menghasilkan metakaolin dengan struktur yang lebih amorf dibandingkan kaolin, diindikasikan oleh kristalinitas metakaolin (45.39%), dan kaolin (83.33%).
Gambar 2c dan 3c memperlihatkan difraktogram zeolit sintetik referensi
Joint Committee on Powder Difraction Standards (JCPDS ) nomor 39 – 0222, sedangkan difraktogram zeolit sintetik hasil penelitian ditunjukkan pada Gambar 2f dan 3e. ZS hasil penelitian memiliki puncak pada sudut 2θ=10.19°, 12.47°, 16.10°, 21.64°, 23.95°, 26.07°, 27.08°, 29.90°, 32.49°, dan 34.14° dengan kristalinitas sebesar 79.27%. Berdasarkan JCPDS nomor 39–0222 puncak khas zeolit referensi tersebut sebagai zeolit tipe A mempunyai sudut 2θ sebesar 10.17°, 12.46° , 16.11°, 21.36° , 23.99°, 26.11°, 27.11°, 29.94°, 32.54°, dan 34.18°.
Berdasarkan perbandingan pola difraktogram antara ZS hasil penelitian dengan referensi disimpulkan bahwa zeolit hasil penelitian merupakan zeolit sintetik tipe A. Hasil pemanasan tidak menunjukkan perubahan yang signifikan pada nilai 2θ yaitu berturut-turut 10.24°, 12.52°, 16.16°, 21.72°, 24.03°, 26.18°, 27.16°, 29.99°, 32.59°, dan 34.24°. Bagaimanapun, pemanasan menghasilkan zeolit dengan kristalinitas yang lebih baik, ditunjukkan oleh meningkatnya kristalinitas dari 79.27% menjadi 85.41% (Gambar 2d). Kenaikan kristalinitas ini disebabkan oleh terjadinya penyusunan ulang kristal seiring kenaikan suhu.
Gambar 2e memperlihatkan difraktogram TiO2 (anatase) dengan tiga puncak yang kuat pada sudut difraksi (2θ) yaitu 25.32° (d=3.51440Ȧ), 48.06° (d=1.89158Ȧ), dan 37.80° (d=2.37805Ȧ), sedangkan Gambar 2g sampai 2i
memperlihatkan pola difraktogram ZS setelah dipilar menggunakan TiO2. ZS yang dipilar TiO2 bersamaan saat sintesis zeolit (ZSTi) yang diperlihatkan pada Gambar 2g menunjukkan puncak 2θ pada 25.29°, puncak ini merupakan puncak dari TiO2 yang berhasil disisipkan. Selain itu terjadi peningkatan kristalinitas dari 79.27% menjadi 89.97%, hasil ini sedikit berbeda ketika ZSTi dioksidasi (Gambar 2h). Setelah dioksidasi, terjadi perbedaan puncak 2θ pada ZSTi dari 25.29° menjadi 29.95° dan penurunan kristalinitas dari 89.97% menjadi 86.67%. Turunnya kristalinitas dan berubahnya 2θ setelah dioksidasi menunjukkan bahwa proses oksidasi mengakibatkan interaksi fisik antara ZS dengan TiO2 menjadi lebih lemah. Namun, hasil yang cenderung sama diperlihatkan pada pemilaran TiO2 yang dilakukan secara fisik (ZSTiF) dengan terlihat puncak 2θ yang tidak jauh berbeda, yaitu pada 25.31° (d=3.51592 A˚) dan kristalinitas sebesar 88.37% (Gambar 2i).
Difraktogram Fe2O3 (hematit) memperlihatkan puncak 2θ pada 33.18° (d=2.69725Ȧ), 35.66° (d=2.51563Ȧ), dan 54.10° (d=1.69379Ȧ) (Gambar 3d). Gambar 3f menunjukkan difraktogram zeolit yang dipilar dengan Fe2O3 bersamaan saat sintesis dengan sudut 2θ pada 30.01° dengan kristalinitas 90.68%. Ketika ZSFe dioksidasi, terjadi sedikit perubahan pada sudut sudut 2θ, yaitu dari 30.01° menjadi 29.94° dan naiknya kristalinitas dari 90.68% menjadi 95.45% (Gambar 3g). Gambar 3hmenunjukkan difraktogram zeolit ketika dipilar dengan Fe2O3 secara fisik (ZSFeF) dengan sudut 2θ pada 29.93° dengan kristalinitas 84.20%. Telah terjadinya pilarisasi pada zeolit juga diperlihatkan pada data EDS (Lampiran 3). Data EDS memperlihatkan bahwa sebelum dipilar dengan Fe2O3,
ZS tidak mengandung unsur Fe. Sementara, setelah dipilar terdapat unsur Fe sebesar 2.31%. Artinya, ZS telah berhasil dipilar dengan Fe.
Gambar 2 Difraktogram (a) K, (b) M, (c) Zref, (d) ZSO, (e) TiO2,(f) ZS, (g) ZSTi,
Gambar 3 Difraktogram sinar-X (a) K, (b) M, (c) Zref, (d) Fe2O3,(e) ZS, (f) ZSFe,
(g) ZSFeO, (h) ZSFeF.
Apabila TiO2 dan Fe2O3 memiliki aktivitas antioksidan maka proses pilarisasi TiO2 dan Fe2O3 ke dalam zeolit sintesis akan meningkatkan aktivitas antioksidannya, namun hal ini bergantung pada seberapa banyak TiO2 dan Fe2O3 yang terpilar pada zeolit sintesis dan bagaimana cara pilarisasinya. Proses pilarisasi TiO2 dan Fe2O3 ke dalam zeolit melalui pemilaran fisik hanya akan menghomogenkan campuran dan tidak dapat memaksimalkan penyisipan antara TiO2 dan Fe2O3 dengan zeolit sintetik, namun hal ini dapat dilakukan dengan cara pemilaran secara hidrotermal, karena TiO2 dan Fe2O3 dapat bergerak secara termal menembus ruang-ruang kosong zeolit dan menyisip diantaranya sehingga meningkat nilai derajat kristalinitasnya. Meningkatnya nilai derajat kristalinitasnya sangat berhubungan erat dengan proses sintesis antara pemilaran fisik saja dengan bersamaan proses sintesis zeolit.
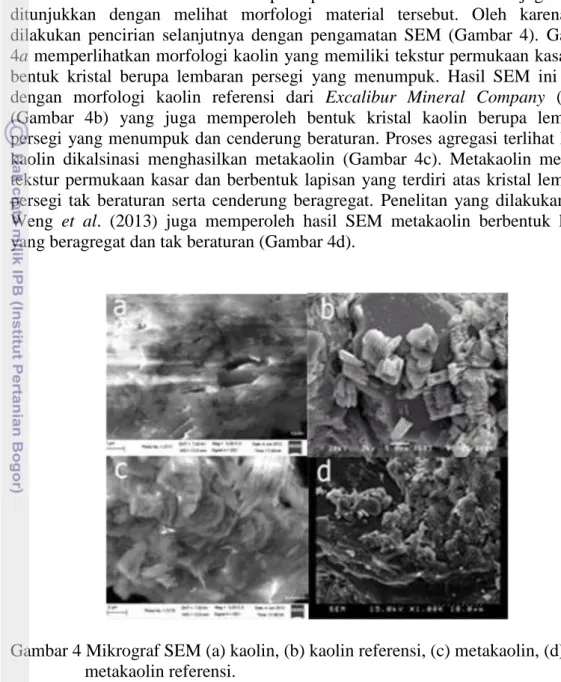
Hasil Pengamatan SEM terhadap morfologi zeolit dan kompositnya Keberhasilan sintesis maupun pemilaran suatu material juga dapat ditunjukkan dengan melihat morfologi material tersebut. Oleh karena itu, dilakukan pencirian selanjutnya dengan pengamatan SEM (Gambar 4). Gambar 4a memperlihatkan morfologi kaolin yang memiliki tekstur permukaan kasar dan bentuk kristal berupa lembaran persegi yang menumpuk. Hasil SEM ini mirip dengan morfologi kaolin referensi dari Excalibur Mineral Company (2010) (Gambar 4b) yang juga memperoleh bentuk kristal kaolin berupa lembaran persegi yang menumpuk dan cenderung beraturan. Proses agregasi terlihat ketika kaolin dikalsinasi menghasilkan metakaolin (Gambar 4c). Metakaolin memiliki tekstur permukaan kasar dan berbentuk lapisan yang terdiri atas kristal lembaran persegi tak beraturan serta cenderung beragregat. Penelitan yang dilakukan oleh Weng et al. (2013) juga memperoleh hasil SEM metakaolin berbentuk kristal yang beragregat dan tak beraturan (Gambar 4d).
Gambar 4 Mikrograf SEM (a) kaolin, (b) kaolin referensi, (c) metakaolin, (d) metakaolin referensi.
Gambar 5a memperlihatkan zeolit sintetik tipe A referensi dari Warzywoda (2000) dengan ciri-ciri berbentuk kristal kubus. Zeolit dalam penelitian ini memperlihatkan morfologi yang sama dengan zeolit tipe A (Gambar 5a dan 5b). Perbandingan morfologi zeolit pada Gambar 5 dengan metakaolin pada Gambar 4 menunjukkan perubahan struktur yang lebih teratur dan berbentuk kubus dari metakaolin menjadi zeolit. Gambar 5c menujukkan morfologi dari zeolit sintesis dengan pemanasan lebih lanjut pada 300 ºC. Pemanasan tidak mengakibatkan banyak perubahan pada permukaan zeolit sintetik. Bentuk kristal zeolit terlihat masih berbentuk kubus, hanya saja terlihat lebih menumpuk. Data EDS juga menunjukkan komposisi logam-logam yang terkandung dalam zeolit
cenderung tidak jauh berbeda. Artinya, zeolit sintetik tahan terhadap pemanasan atau dengan kata lain pemanasan tidak merubah struktur zeolit.
Gambar 5 Mikrograf SEM (a) referensi zeolit tipe A (b) Zeolit hasil sintesis dan (c) Zeolit hasil sintesis setelah dioksidasi.
Gambar 6a, 6b, dan 6cmenunjukkan mikrograf SEM hasil pilarisasi TiO2 ke dalam ZS. Dari ketiga gambar tersebut terlihat TiO2 paling sedikit menempel di permukaan ZS ketika dipilar secara hidrotermal (Gambar 6a). Hal ini terjadi karena TiO2 ikut masuk ke dalam kerangka struktur zeolit sehingga hanya sedikit TiO2 yang terlihat di permukaan zeolit. Meskipun TiO2 terlihat sedikit menempel di permukaan, namun jumlah titanium berdasarkan data EDS pada ZSTi paling besar dibandingkan zeolit sintesis yang dipilar dengan TiO2 secara fisik. Sementara zeolit sintetik yang dipilar dengan TiO2 setelah dioksidasi memperlihatkan lebih banyak TiO2 menempel di permukaan zeolit dibandingkan sebelum ZSTi dioksidasi (Gambar 6b). Hal ini disebabkan oleh efek pemanasan mengakibatkan TiO2 keluar dari kerangka struktur zeolit dan diduga TiO2 bereaksi dengan NaOH menjadi titanat seperti yang diperlihatkan pada Persamaan 2 (Qin
et al. 2000).
(2) Titanium titanat
Data EDS menunjukkan jumlah titanium dalam ZSTi setelah dioksidasi menurun menjadi 0.40%. Oksidasi dilakukan pada suhu 300 ºC selama 5 jam, suhu ini belum cukup untuk menguapkan TiO2 yang memiliki titik didih 1825 ºC. Dengan demikian, penurunan jumlah titanium disebabkan oleh adanya titanium yang bertransformasi menjadi titanat. Titanat yang terbentuk ini diduga menempel di permukaan (tidak berada dalam kerangka struktur zeolit), sedangkan TiO2 yang dipilar secara fisik (Gambar 6c) menunjukkan paling banyak TiO2 terlihat menempel di permukaan zeolit. Artinya, TiO2 yang dipilar secara fisik berinteraksi dengan zeolit hanya di permukaan, diduga hanya sedikit sekali yang masuk ke dalam kerangka struktur zeolit. Data EDS menunjukkan titanium yang terdapat pada zeolit sintesis yang dipilar TiO2 secara fisik sebesar 0.41%. Analisis data EDS menunjukkan bahwa pemilaran TiO2 ke dalam zeolit secara hidrotermal lebih efektif dibandingkan dengan pemilaran secara fisik.
Gambar 6 Mikrograf SEM (a) ZSTi, (b) ZSTiO, (c) ZSTiF.
Keterangan: bagian yang dilingkari menunjukkan TiO2
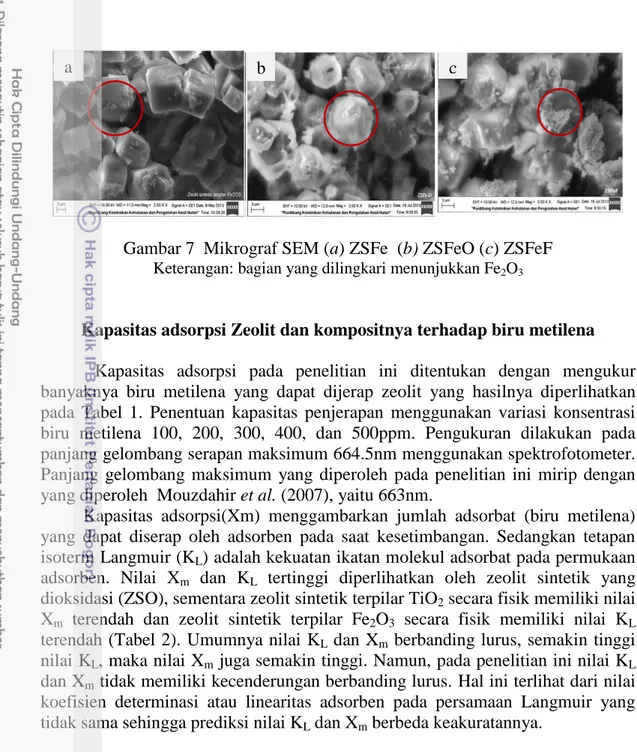
Gambar 7a, 7b dan 7cmenunjukkan mikrograf SEM hasil pilarisasi Fe2O3 ke dalam ZS. Mikrograf SEM hasil pemilaran zeolit sintetik dengan Fe2O3 cenderung mirip dengan hasil mikrograf SEM zeolit sintetik yang dipilar dengan TiO2. Zeolit sintetik yang dipilar dengan Fe2O3 secara hidrotermal memperlihatkan hanya sedikit Fe2O3 yang menempel di permukaan zeolit (Gambar 7a). Setelah zeolit sintetik yang telah dipilar Fe2O3 dioksidasi, Fe2O3 terlihat lebih banyak menempel (Gambar 7b). Hal ini terjadi sebelum dioksidasi, Fe2O3 ikut masuk ke dalam kerangka struktur zeolit (hanya sedikit yang menempel di luar), sementara setelah dioksidasi Fe2O3 keluar dari kerangka struktur zeolit dan diduga bereaksi dengan NaOH membentuk senyawa NaHFe3O4 sesuai Persamaan 3.
(3) Sama seperti pada pemilaran dengan TiO2, oksidasi dilakukan pada suhu 300 ºC selama 5 jam. Suhu ini belum cukup untuk menguapkan Fe2O3 yang memiliki titik didih 1538 ºC. Hal ini didukung dari data EDS, yaitu ZSFe sebelum dioksidasi memiliki jumlah Fe sebesar 4.26%, sedangkan setelah dioksidasi jumlahnya menurun menjadi 1.68%. Penurunan jumlah Fe2O3dapat terjadi karena diduga Fe2O3 bertransformasi menjadi NaHFe3O4. Senyawa ini diduga menempel di permukaan zeolit sintetik. Sementara zeolit sintetik yang dipilar dengan Fe2O3 secara fisik (Gambar 7c) menunjukkan paling banyak Fe2O3 terlihat menempel di permukaan zeolit. Data EDS zeolit sintetik yang dipilar Fe2O3 secara fisik memperlihatkan jumlah Fe sebesar 2.31%. Artinya, meskipun terlihat banyak menempel di permukaan zeolit, namun jumlah Fe yang terkandung dalam zeolit sintetik yang dipilar dengan Fe2O3 lebih sedikit dibandingkan jumlah Fe yang terkandung pada zeolit sintetik yang dipilar dengan Fe2O3 secara hidrotermal. Dengan demikian, pemilaran zeolit secara hidrotermal baik dengan TiO2 maupun dengan Fe2O3 lebih efektif dibandingkan pemilaran zeolit secara fisik.
Pilarisasi dengan TiO2 maupun Fe2O3, baik secara fisik maupun hidrotermal dan hidrotermal dilanjutkan dengan pemanasan tidak mengubah bentuk kristal dari zeolit sintetik. Bentuk kristal zeolit masih berbentuk kubus dengan perbandingan Si/Al mendekati 1. Dengan demikian, penambahan TiO2 atau Fe2O3 maupun pemanasan saat sintesis zeolit tidak mengganggu proses pembentukan inti kristal.
c
a b
Gambar 7 Mikrograf SEM (a) ZSFe (b) ZSFeO (c) ZSFeF
Keterangan: bagian yang dilingkari menunjukkan Fe2O3
Kapasitas adsorpsi Zeolit dan kompositnya terhadap biru metilena Kapasitas adsorpsi pada penelitian ini ditentukan dengan mengukur banyaknya biru metilena yang dapat dijerap zeolit yang hasilnya diperlihatkan pada Tabel 1. Penentuan kapasitas penjerapan menggunakan variasi konsentrasi biru metilena 100, 200, 300, 400, dan 500ppm. Pengukuran dilakukan pada panjang gelombang serapan maksimum 664.5nm menggunakan spektrofotometer. Panjang gelombang maksimum yang diperoleh pada penelitian ini mirip dengan yang diperoleh Mouzdahir et al. (2007), yaitu 663nm.
Kapasitas adsorpsi(Xm) menggambarkan jumlah adsorbat (biru metilena) yang dapat diserap oleh adsorben pada saat kesetimbangan. Sedangkan tetapan isoterm Langmuir (KL) adalah kekuatan ikatan molekul adsorbat pada permukaan adsorben. Nilai Xm dan KL tertinggi diperlihatkan oleh zeolit sintetik yang dioksidasi (ZSO), sementara zeolit sintetik terpilar TiO2 secara fisik memiliki nilai Xm terendah dan zeolit sintetik terpilar Fe2O3 secara fisik memiliki nilai KL terendah (Tabel 2). Umumnya nilai KL dan Xm berbanding lurus, semakin tinggi nilai KL, maka nilai Xm juga semakin tinggi. Namun, pada penelitian ini nilai KL dan Xm tidak memiliki kecenderungan berbanding lurus. Hal ini terlihat dari nilai koefisien determinasi atau linearitas adsorben pada persamaan Langmuir yang tidak sama sehingga prediksi nilai KL dan Xm berbeda keakuratannya.
Korelasi antara kapasitas adsorpsi zeolit dan kompositnya dengan aktivitas antioksidan melalui pengamatan adsorpsi terhadap DPPH
Pengukuran aktivitas antioksidan biasanya dilakukan dengan beberapa metode di antaranya uji kapasitas antioksidan reduksi kuprat (CUPRAC), uji kekuatan antioksidan mereduksi ferat (FRAP), dan metode DPPH. Metode CUPRAC (Apak et al.2007) menggunakan bis(neokuproin) tembaga(II) (Cu(Nc)22+) sebagai pereaksi kromogenik. Pereaksi (Cu(Nc)22+) yang berwarna biru akan mengalami reduksi menjadi Cu(Nc)2+ yang berwarna kuning dengan reaksi sebagai berikut:
n Cu(Nc)22+ + Ag(OH)n nCu(Nc)2+ + Ag(=O)n + n H+
Metode FRAP (Benzie dan Strain 1996) menggunakan Fe(TPTZ)23+ kompleks besi ligan 2,4.6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe(TPTZ)23+ akan berfungsi sebagai zat pengoksidasi dan akan mengalami reduksi menjadi Fe(TPTZ)23+ yang berwarna kuning dengan reaksi berikut :
Fe(TPTZ)23+ + AgOH Fe(TPTZ)23+ + H+ + Ag=O
Pada penelitian ini uji aktivitas antioksidan zeolit menggunakan metode DPPH (Molyneux 2004). Metode DPPH menggunakan 2,2-difenil-1- pikrilhidrazil sebagai sumber radikal bebas. Anonim (2006) melaporkan mekanisme zeolit sebagai antioksidan dengan cara menjebak molekul DPPH ke dalam pori-pori zeolit seperti yang diperlihatkan pada Gambar 8.
Gambar 8 Penjebakan molekul DPPH oleh zeolit (sumber: Anonim 2006)
Keterangan : warna kuning menunjukkan struktur zeolit, sedangkan warna hijau menunjukkan molekul DPPH
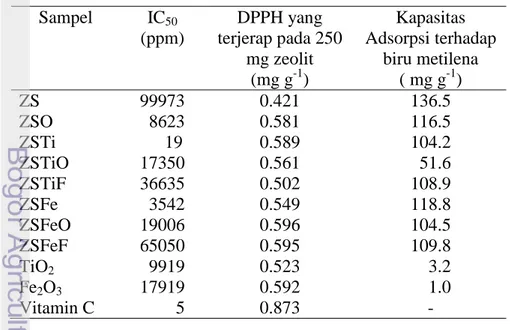
Tabel 1 Aktivitas antioksidan zeolit sintetik dengan DPPH dan kapasitas adsorpsi zeolit sintetik terhadap biru metilena
Sampel IC50 (ppm) DPPH yang terjerap pada 250 mg zeolit Kapasitas Adsorpsi terhadap biru metilena ( mg g-1) (mg g-1) ZS 99973 0.421 136.5 ZSO 8623 0.581 116.5 ZSTi 19 0.589 104.2 ZSTiO 17350 0.561 51.6 ZSTiF 36635 0.502 108.9 ZSFe 3542 0.549 118.8 ZSFeO 19006 0.596 104.5 ZSFeF 65050 0.595 109.8 TiO2 9919 0.523 3.2 Fe2O3 17919 0.592 1.0 Vitamin C 5 0.873 -
Tabel 2 Nilai koefisien korelasi dan koefisien determinasi adsorpsi biru metilena oleh zeolit sintetik, komposit zeolit sintetik, TiO2 dan Fe2O3
Mineral Isoterm Adsorpsi Langmuir Isoterm Adsorpsi Freundlich
R R2 R R2 ZS 0.99 99.20% 0.82 67.20% ZSO 0.99 99.90% 0.30 9.30% ZSTi 0.99 99.90% 0.82 67.60% ZSTiO 0.95 90.50% 0.62 38.90% ZSTiF 0.97 93.50% 0.85 72.50% ZSFe 0.99 99.70% 0.85 71.50% ZSFeO 0.99 99.60% 0.52 27.50% ZSFeF 0.95 90.60% 0.84 70.20% TiO2 0.99 98.50% 0.53 28.00% Fe2O3 0.99 99.90% 0.69 48.50%
Tabel 3 Kapasitas adsorpsi terhadap biru metilena dan tetapan isoterm Langmuir adsorben. Adsorben Xm (mg g-1) KL (L g-1) ZS 21.46 5.61 ZSO 51.55 12.12 ZSTi 22.07 2.15 ZSTiO 22.52 3.04 ZSTiF 20.88 1.43 ZSFe 22.12 2.12 ZSFeO 21.23 1.46 ZSFeF 23.75 1.28 TiO2 21.98 3.61 Fe2O3 21.01 2.36
Penangkapan radikal DPPH merupakan salah satu metode uji untuk menentukan aktivitas antioksidan. Metode DPPH dipilih karena sederhana, mudah, cepat dan hanya memerlukan sedikit sampel. Mekanisme penangkapan radikal DPPH oleh antioksidan cukup sederhana dengan memberikan proton kepada radikal, sehingga senyawa-senyawa yang memungkinkan untuk mendonasikan protonnya memiliki aktivitas penangkapan radikal cukup kuat. Donasi proton menyebabkan radikal DPPH (berwarna ungu) menjadi senyawa tidak radikal, maka aktivitas penangkapan radikal dapat dihitung dari peluruhan radikal DPPH. Kadar radikal DPPH tersisa diukur secara spektrofotometri pada panjang gelombang 517nm (Blois 1958). Reaksi penangkapan DPPH oleh antioksidan diperlihatkan pada Gambar 9.
Metode DPPH ini juga dapat diterapkan pada suatu mineral alam yang memiliki pori seperti zeolit (Molyneux 2004). Kemampuan suatu senyawa untuk menangkap radikal DPPH merupakan suatu indikasi bahwa senyawa tersebut memiliki aktivitas antioksidan. Berbeda dari reaksi penangkapan DPPH oleh antioksidan pada umumnya, zeolit berperan sebagai antioksidan dengan cara
menjebak/menangkap DPPH ke dalam kerangka strukturnya. Setelah terjebak dalam kerangka struktur zeolit, DPPH menjadi tidak aktif sebagai radikal bebas nantinya dapat dengan aman dihilangkan dari tubuh (Anonim 2006 ).
Gambar 9 Reaksi penangkapan radikal bebas DPPH
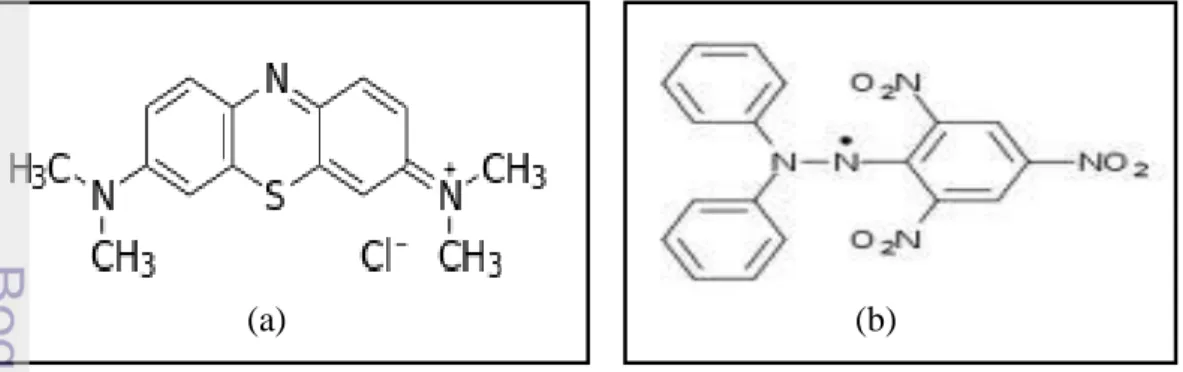
Aktivitas antioksidan diukur sebagai penurunan serapan larutan DPPH akibat penambahan sampel zeolit yang diukur absorbansinya dan ditentukan IC50 menggunakan spektrofotometer pada panjang gelombang 517.5nm yang hasilnya diperlihatkan pada Tabel 1. Nilai IC50 merupakan konsentrasi suatu senyawa yang diperlukan untuk menghambat aktivitas radikal DPPH sebesar 50% (IUPAC 1997). Semakin rendah IC50 maka aktivitas antioksidan semakin tinggi. Sedangkan, kapasitas adsorpsi merupakan jumlah maksimum adsorben yang dapat menjerap adsorbat. Semakin tinggi kapasitas adsorpsi diduga aktivitas antioksidan semakin tinggi. Meskipun pada penentuan kapasitas adsorpsi menggunakan biru metilena, dan penetapan kapasitas adsorpsi zeolit dan kompositnya tidak dilakukan terhadap DPPH, tetapi kedua senyawa DPPH dan biru metilena memiliki struktur yang relatif sama besar (Gambar 10), maka kapasitas adsorpsi terhadap biru metilena dapat digunakan untuk menganalisis adsorpsi DPPH.
(a) (b)
Gambar 10 Struktur molekul (a) biru metilena (b) DPPH
Tabel 1 memperlihatkan bahwa terjadi penurunan nilai IC50 ZS, ketika ZS dioksidasi maupun dipilar dengan TiO2 dan Fe2O3. Penurunan nilai IC50 ini mengindikasikan terjadi kenaikan aktivitas antioksidan pada ZS dengan perlakuan pemanasan maupun pilarisasi. ZS yang dipilar dengan TiO2 memiliki aktivitas antioksidan yang lebih tinggi jika dibandingkan dengan ZS yang dipilar dengan
Fe2O3. Hal ini dapat terjadi karena TiO2 memiliki aktivitas antioksidan yang lebih tinggi daripada Fe2O3 yang ditunjukkan dari nilai IC50 TiO2 (9919ppm) yang lebih rendah dibandingkan Fe2O3 (17919ppm). Sehingga kontribusi TiO2 dalam meningkatkan aktivitas antioksidan zeolit lebih besar dibandingkan Fe2O3. Aktivitas antioksidan tertinggi diperlihatkan oleh ZSTi yaitu sebesar 19ppm. Jika dibandingkan dengan nilai IC50 vitamin C, yaitu sebesar 5ppm , nilai IC50 ZSTi masih jauh lebih besar. Artinya, aktivitas antioksidan ZSTi belum seefektif vitamin C. Penelitian yang dilakukan oleh Jati (2013) juga menunjukkan terjadi peningkatan aktivitas antioksidan zeolit alam sebesar 14.8% setelah zeolit alam dipilar dengan TiO2.
Kapasitas adsorpsi zeolit dan nanokomposit terhadap biru metilena berada di kisaran 105mg g-1 dengan nilai yang cenderung tidak berfluktuasi, nilai tertinggi ditunjukkan oleh ZS, dan terendah oleh ZSTiO. Namun bila dibandingkan dengan nilai IC50 zeolit dan nanokomposit terhadap DPPH terlihat bahwa nilai IC50 sangat dipengaruhi oleh oksida logam yang digunakan sebagai pemilar dan proses pemilaran. Pencampuran zeolit dengan TiO2 atau Fe2O3 secara fisik meningkatkan nilai IC50 yang tinggi, dan nilai ini dapat dikorelasikan sebagai rendahnya kapasitas adsorpsi campuran zeolit terhadap DPPH. Proses pilarisasi secara hidrotermal memberikan hasil yang sangat baik terhadap nilai IC50, yaitu dihasilkan nilai IC50 terendah dibandingkan seluruh perlakuan. Nilai IC50 ZSTi adalah 19ppm dan ini hanya 4 kali lipat lebih besar dari nilai IC50 vitamin C. Artinya ZSTi memiliki kemampuan menyerap DPPH dalam jumlah besar, dan nilai ini dapat dikorelasikan dengan tingginya aktivitas antioksidan ZSTi. Proses pemilaran secara umum meningkatkan nilai IC50, dan bila nilai ini diartikan sebagai adsorpsi DPPH, maka dapat disimpulkan bahwa proses pemilaran meningkatkan kapasitas adsorpsi zeolit / nanokomposit terhadap DPPH.
Pemanasan zeolit terpilar TiO2 atau Fe2O3 yang disintesis melalui metode hidrotermal menghasilkan nilai IC50 yang lebih rendah dari ZS. Artinya daya adsorpsi komposit ini tinggi terhadap DPPH. Hal ini dapat diakibatkan oleh penyusunan ulang pada zeolit yang terpilar bila dipanaskan pada suhu tinggi. Penyusunan ulang ini kemungkinan besar menghasilkan ukuran pori yang lebih kecil, sehingga nilai kapasitas adsorpsi terhadap biru metilena maupun DPPH yang berukuran relatif besar menjadi turun. Tabel 1 menunjukkan korelasi antara turunnya kapasitas adsorpsi ZSTiO dan ZS terhadap biru metilena dan turunnya nilai IC50 kedua komposit tersebut terhadap DPPH.
Rendahnya nilai IC50 untuk ZSTi memberikan indikasi bahwa ZSTi tidak hanya menjerap DPPH namun juga melakukan reaksi antioksidan. Secara umum terlihat bahwa pemilaran zeolit dengan TiO2 atau Fe2O3 menurunkan kapasitas adsorpsi terhadap biru metilena, hal ini diduga karena zeolit pemilar mengisi sebagian rongga zeolit yang seharusnya dipakai untuk proses adsorpsi. Namun hal ini tidak terlihat pada adsorpsi DPPH. Pemilaran tidak menurunkan daya adsorpsi zeolit terhadap DPPH, bahkan dapat dikatakan bahwa daya adsorpsinya meningkat sampai hampir 5000 kali lipat (Tabel 1). Tentunya peningkatan daya adsorpsi ini tidak dapat hanya disimpulkan sebagai adsorpsi sederhana. Dapat diduga bahwa ZSTi juga memiliki mekanisme pemadaman radikal, meskipun mekanismenya masih belum dapat diamati secara detail.
Salah satu kemungkinan yang terjadi pada proses sintesis zeolit yang berlangsung bersamaan dengan pilarisasi oksida logam secara hidrotermal adalah