STOIKIOMETRI
I. Standar Kompetensi
Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri)
II. Kompetensi Dasar
Mendeskripsikan tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya.
Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
III. Tujuan Pembelajaran
1.
Siswa dapat menjelaskanhukumdasarkimia,antaralainhukumkekekalanmassa,hukumProust(hukumperbandingantetap),hukumDalton(hukumkelipatanperbandingan),danhukumGayLussac(hukumperb andinganvolume) berdasarkan eksperimen atau data hasil eksperimen.
2.
Siswa dapat menjelaskan pengertian mol sebagai satuan jumlah zatserta dapat mengkonversikan jumlah zat dengan jumlah mol, massa dan volum zat.3.
Siswa dapat menentukan rumus empiris senyawa4.
Siswa dapat menentukian rumus molekul senyawa5.
Siswa dapat menentukan kadar unsur dalam suatu senyawa6.
Siswa dapat menentukan pereaksi pembatas dalam suatu reaksiIV. Peta Konsep
Stoikiometri kelas XMIA 1
STOIKIOMETRI
Dalam ilmu kimia, stoikiometri dibagi menjadi stoikiometri senyawa (komposisi) dan stoikiometri reaksi. Istilah stoikiometri berasal dari bahasa Yunani yaitu stoicheion yang berarti elemen atau unsur dan metron yang artinya mengukur. Jadi, stoikiometri dapat diartikan sebagai perhitungan kimia yaitu ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia). Konsep–konsep yang mendasari perhitungan kimia adalah massa atom relatif, rumus kimia, persamaan kimia, dan konsep mol.
A. Hukum–Hukum Dasar Kimia
Berikut ini akan dipelajari beberapa hukum yang mendasari perhitungan kimia, di antaranya hukum kekekalan massa (hukum Lavoisier), hukum perbandingan tetap (hukum Proust), hukum kelipatan perbandingan (hukum Dalton), dan hukum perbandingan volume (hukum Gay Lussac).
1. Hukum Lavoiser (Hukum Kekekalan Massa)
Antoine Laurent Lavoisier telah menyelidiki massa zat-zat sebelum dansesudah reaksi. Lavoisier menimbang zat sebelum bereaksi, kemudianmenimbang hasil reaksinya. Ternyata massa zat sebelum dan sesudah reaksiselalu sama. Lavoisier menyimpulkan hasil penemuannya dalam suatu hukumyang disebut hukum kekekalan massa, yaitu: “Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah sama.”
Contoh:
Kawat tembaga (Cu) dibakar dalam pembakar bunsen sehingga terbentuk tembaga oksida (CuO), dengan persamaan: 2Cu(s) + O2(g)→2CuO(s)
Jika berat Cu semula 32 g dan CuO yang terbentuk 40 g, berapa berat O2 yang bereaksi?
Jawab:
Menurut Hukum Kekekalan Massa, dalam reaksi kimia tidak terjadi perubahan massa.Oleh karena itu, berat O2 yang
bereaksi adalah 40 g – 32 g = 8 g 32 g Cu(s) + 8 g O2(g) →40 g CuO(s)
2. Hukum Proust (Hukum Perbandingan Tetap)
Tabel 1. Data hasil eksperimen Proust Gambar 1. Antoine Laurent Lavoisier/
Perancis (1743 – 1794)
Jika kita mengamati proses pembakaran kayu atau kertas, massa hasil reaksi seolah-olah berkurang karena kita hanya mendapatkan abu yang jumlahnya sedikit dari sisa pembakaran. Reaksi pembakaran yang kita lakukan berlangsung pada wadah yang terbuka, sedangkan sebagian besar hasil reaksi adalah gas sehingga massa zat yang tertinggal menjadi lebih sedikit. Tetapi, jika kita melakukan pembakaran tersebut pada ruang tertutup, maka massa zat sebelum dan sesudah reaksi akan sama.
Gambar 2. Joseph Louis Proust (1754-1826)
Berdasarkan penelitian terhadap berbagai senyawa yang dilakukannya, Proust menyimpulkan bahwa “Perbandingan massa unsur-unsur dalam satu senyawa adalah tertentu dan tetap.”
3. Hukum Dalton (Hukum Kelipatan Berganda)
Tabel 2. Data hasil eksperimen Dalton
Dengan massa oksigen yang sama, ternyata perbandingan massa nitrogendalam senyawa nitrogen dioksida dan senyawa nitrogen monoksida merupakanbilangan bulat dan sederhana.
Dalam NO => Nitrogen : Oksigen = 0,875 : 1 Dalam NO2 => Nitrogen : Oksigen = 1,75 : 1
Perbandingan:
Stoikiometri kelas XMIA 3
Gambar 3. John Dalton (1766 – 1844)
Hukum Proust dikembangkan lebih lanjut oleh ilmuwan lain untuk unsur-unsur yang dapat membentuk lebih dari satu senyawa. John Dalton (1766-1844) adalah ilmuan dari Inggris yang mengamati adanya suatu keteraturan yang terkait dengan perbandingan massa unsur-unsur dalam suatu senyawa.
Untuk memahami hal ini, perhatikan tabel hasil percobaan reaksi antara nitrogen dengan oksigen berikut.
LATIHAN!
1. Perbandingan massa karbon (C) terhadap oksigen (O) dalam senyawa karbon dioksida(CO2) adalah 3 : 8. Berapa gram
massa karbon dioksida yang terbentuk dan sisapereaksi, jika direaksikan: a. 6 gram karbon dengan 16 gram oksigen
b. 6 gram karbon dengan 8 gram oksigen c. 3 gram karbon dengan 10 gram oksigen d. 12 gram karbon dengan 24 gram oksigen
2. Diketahui perbandingan massa kalsium dan oksigen dalam membentuk senyawa kalsium oksida adalah 5 : 2. Bila direaksikan 10 gram kalsium dan 12 gram oksigen, tentukanmassa kalsium oksida (CaO) yang terbentuk dan sisa pereaksi!
3. Perbandingan massa Fe : S dalam senyawa FeS adalah 7 : 4. Berapakah massa FeSyang terbentuk dan massa sisa pereaksi, jika direaksikan 35 gram besi dan 16 grambelerang?
4. Diketahui perbandingan massa tembaga dan oksigen dalam senyawa CuO adalah4 : 1. Tentukan massa CuO yang terbentuk dan sisa pereaksi, jika direaksikan:
a. 8 gram tembaga dengan 2 gram oksigen b. 12 gram tembaga dengan 3 gram oksigen c. 20 gram tembaga dengan 10 gram oksigen d. 32 gram tembaga dengan 5 gram oksigen
Nitrogen (dalam NO) : Nitrogen (dalam NO2) = 0,875 : 1,75 = 1 : 2
Berdasarkan hasil percobaannya, Dalton merumuskanhukum kelipatan perbandingan(hukum Dalton)yang berbunyi: “Jika dua unsur membentuk dua senyawa atau lebih dan jika massa salah satu unsur dalam senyawa tersebut sama, maka perbandingan massa unsur lainnya dalam senyawa tersebut merupakan bilangan bulat sederhana.”
Berikut adalah contoh penerapan hukum kelipatan perbandingan:
4. Hukum Gay Lussac (Hukum Perbandingan Volume)
Kemudian, pada tahun 1808 Gay Lussac melakukan percobaan terhadap berbagai reaksi dan mengamati volume gas-gas yang terlibat dalam reaksi tersebut. Pengamatanmenunjukkan bahwa reaksi pada temperatur (T) dan tekanan (P) yangsama diperoleh hasil sebagai berikut:
1) Pada volume tertentu gas hidrogen (H2) bereaksi dengan volume tertentu gas klorin (Cl2) menghasilkan gas hidrogen klorida
(HCl), perbandingan volumenya adalah 1 : 1 : 2. H2(g) + Cl2(g)→ 2HCl(g)
2) Pada reaksi antara gas hidrogen dengan gas oksigen menghasilkan air, perbandingan volumenya adalah 2 : 1 : 2. 2H2(g) + O2(g)→ 2H2O(g)
3) Pada reaksi antara gas nitrogen dengan gas hidrogen membentuk amonia, perbandingan volumenya adalah 1 : 3 : 2. N2(g) + 3H2(g) → 2NH3(g)
Dari data tersebut, Gay Lussac menyimpulkan penemuannya sebagai Hukum Perbandingan Volume, sebagai berikut: “Pada kondisi temperature (T) dan tekanan (P) yang sama, perbandinganvolume gas-gas pereaksi dengan gas-gas hasil reaksi berbanding sebagai bilangan yang bulat dan sederhana.”
Contoh:
Amonia dibuat dari reaksi gas hidrogen dengan gas nitrogen menurutpersamaan: 3H2(g) + N2(g)→ 2NH3(g)
Gambar 4. Joseph Louis Gay Lussac (1778 – 1850)
Joseph Louis Gay Lussac (1788-1850) dariPerancis tertarik pada penemuan Henry Cavendish (1731-1810) dari Inggris, yang menemukan perbandingan volume hidrogen yang bereaksi dengan oksigen membentuk air adalah2 : 1, jika kedua gas itu diukur pada suhu (T) dan tekanan (P) yang sama.
LATIHAN!
1. Fosfor dan oksigen membentuk dua macam senyawa. Dalam 55 gram senyawa I terdapat 31 gram fosforus, sedangkan 71 gram senyawa II mengandung 40 gram oksigen. Tunjukkan bahwa kedua senyawa itu memenuhi hukum Dalton!
2. Unsur nitrogen dan oksigen dapat membentuk lebih dari satu senyawa, seperti NO,NO2, N2O3, dan N2O4.Pada kondisi
Jika 6 liter gas hidrogen bereaksi dengan gas nitrogen untuk membentukamonia, hitunglah volume N2 yang bereaksi serta
volume NH3 yangterbentuk jika diukur pada kondisi temperatur dan tekanan yang sama.
Jawab:
Perbandingan koefisien H2 : N2 : NH3 = 3 : 1 : 2.
Jadi, jika H2 = 6 L
Maka:
Volume N2 =
1
3
x
6
L
=
2
L
Volume NH3 =
2
3
x
6
L
=
4
L
Jadi, volume N2 yang bereaksi = 2 L dan volume NH3 yang terbentuk = 4 L.
B. Hipotesis Avogadro
Avogadro menjelaskan hukum perbandingan volume dengan mengajukan hipotesis sebagai berikut:
“Pada suhu dan tekanan sama, gas-gas yang volumenya sama mengandungjumlah molekul yang sama.” Dengan kata lain, perbandingan volume gas-gas yang bereaksi sama dengan koefisien reaksinya.
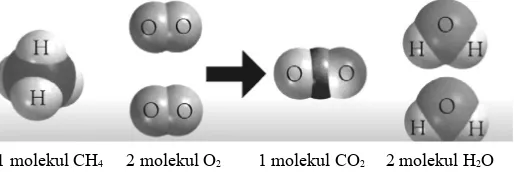
Salah satu contoh penerapan hipotesis Avogadro adalah pada reaksi pembakaran metana.
Gambar 6. Reaksi pembakaran metana
Dengan persamaan reaksi:
Stoikiometri kelas XMIA 5
LATIHAN!
1. Hitunglah volume gas metana dan karbon dioksida pada reaksi pembakaran metana berikut: gas metana + gas oksigen → karbondioksida + uap air
volume gas oksigen yang bereaksi adala 15 mL dan perbandingan volumenya adalah 1 : 2 : 1 : 2 2. Perhatikan persamaan reaksi berikut:
2H2(g) + O2(g) → 2H2O(g)
Hitung volume gas hidrogen dan gas oksigen yangdiperlukan untuk membuat 60 liter air!
3. Tiga liter gas propana (C3H8) dibakar sempurna dengan gas oksigen membentuk gaskarbon dioksida dan air, sesuai
persamaan reaksi berikut.
C3H8(g) + O2(g) → CO2(g) + H2O(l)
a. Berapa liter gas oksigen yang diperlukan? b. Berapa liter gas karbon dioksida yang terbentuk? c. Berapa liter air yang terbentuk?
4. Lima liter gas N2O5 terurai sesuai reaksi berikut:
N2O5(g) → N2(g) + O2(g)
Pada suhu dan tekanan yang sama, tentukan volume gas nitrogen dan volume gasoksigen yang terbentuk!
5.10 mL gas nitrogen (N2) dan 15 mL gas oksigen (O2) tepat habis bereaksi menjadi10 mL gas NaOb. Tentukan rumus kimia
gas NaObtersebut!
Gambar 5. Amedeo Avogadro (1776–1856)
Penemuan Gay Lussac dan hukum Dalton dikembangkan oleh seorang ahli fisika Italia, Amedeo Avogadro. Pada 1811, Avogadro menemukan bahwa gabungan dari atom-atom yang sama membentuk suatu molekul dengan kata lain Avogadromengemukakanbahwa partikel unsur tidak harus berupa atom tunggal, tetapi dapat juga berupa molekul.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Maka perbandingan volume = perbandingan jumlah molekul = perbandingan koefisien Yaitu: 1 : 2 : 1 : 2
Contoh:
Suatu senyawa hidrokarbon (CxHy) yang berwujud gas terbakar menurut reaksi:
CxHy(g) + O2(g) → CO2(g) + H2O(g) (belum setara)
Dari percobaan diketahui bahwa untuk membakar 2 liter gas CxHy(T, P) diperlukan 5liter gas oksigen (T, P) dan dihasilkan 4
liter gas karbon dioksida (T, P). Tentukanrumus molekul hidrokarbon tersebut! Jawab:
Karena perbandingan volume sama dengan perbandingan koefisien reaksi, maka persamaan reaksinyamenjadi: 2CxHy(g) + 5O2(g) → 4CO2(g) + …. H2O(g) (belum setara)
Jumlah atom oksigen disetarakan sehingga persamaan reaksi menjadi: 2CxHy(g) + 5O2(g) → 4CO2(g) + 2H2O(g)
Untuk menyetarakan atom C dan H dengan cara sebagai berikut:
Jadi, rumus molekul hidrokarbon tersebut adalah C2H2.
C. Stoikiometri Reaksi–Reaksi Gas
Hukum Gay Lussac dan hipotesis Avogadro merupakan dasar bagi stoikiometri reaksi–reaksi gas. Jika pengukuran dilakukan pada temperatur dan tekanan yang sama, maka perbandingan volum gas yang terlibat dalam reaksi sama dengan koefisien reaksinya. Sehingga, jika salah satu volume komponen diketahui, maka volum komponen lainnya dapat ditentukan dengan cara berikut:
volum gas ditanya
=
koef . gas diketahui x volum gas diketah ui
koef . gas ditanya
Contoh 1:
5 liter gas butana (C4H10) dibakar sempurna menurut reaksi:
C4H10(g) + O2(g) → CO2(g) + H2O(l)(belum setara)
Hitunglah volume oksigen yang dibutuhkan dan volume gas karbon dioksida yangterbentuk! Jawab:
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(l)
Volume oksigen
=
13
2
x
5
=
32,5
liter
Volume karbon dioksida
=
8
2
x
5
=
20
liter
LATIHAN!
1. Dua liter (T, P) gas nitrogen (N2) bereaksi dengan 4 liter (T, P) gas oksigen (O2) membentuk 4liter gas X. Tentukan
rumus molekul gas X tersebut!
2. Pada penguraian sempurna 10 liter (T, P) suatu oksida nitrogen (NaOb) yang berupagas dihasilkan 20 liter (T, P) gas nitrogen dioksida dan 5 liter (T, P) gas oksigen.Tentukan rumus molekul NaOb!
3. Pada pembakaran sempurna 5 liter (T, P) gas CxHy diperlukan 15 liter (T, P) gasoksigen dan dihasilkan 10 liter (T, P) gas karbon dioksida sesuai persamaan reaksi berikut:
CxHy(g) + O2(g) → CO2(g) + H2O(l) (belum setara)
Contoh 2:
Pada pembakaran sempurna 5 liter (T, P) campuran CH4 dan C2H6 dihasilkan 7 liter(T, P) karbon dioksida. Tentukan volume
masing-masing gas dalam campuran tersebut! Jawab:
Persamaan setara reaksi pembakaran CH4 dan C2H6 adalah:
CH4(g) + 2O2(g)→ CO2(g) + 2H2O(l)
2C2H6+ 7O2(g)→ 4CO2(g) + 6H2O(l)
Misal: volume C2H6 = x liter
volume CH4 = (5 - x) liter
1) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
(5 - x) liter (5 - x) liter 2) 2C2H6 + 7O2(g) → 4CO2(g) + 6H2O(l)
x liter
4
2
xliter= 2x liter Dari persamaan 1 dan 2, maka:
volum CO2 total = (5 - x) liter + 2x liter
7 liter = 5 + xliter x = 2 liter
jadi, volume C2H6 = x liter = 2 liter
volume CH4 = (5 - x) liter = 3 liter
Stoikiometri kelas XMIA 7
LATIHAN!
1. Gas belerang dioksida dibuat dengan reaksi antara gas belerang dan gas oksigen menurutpersamaan reaksi: S(g) + O2(g) → SO2(g)
Berapa volume gas belerang (T, P) dan gas oksigen (T, P) yang diperlukan untukmembuat 50 liter gas belerang dioksida (T, P)?
2. Pada pembakaran 5 liter (T, P) alkohol menurut reaksi: C2H5OH(g) + O2(g) → CO2(g) + H2O(l)
tentukan volume oksigen yang bereaksi (T, P) dan volume gas karbon dioksida yang dihasilkan (T, P)!
3. Pada pembakaran sempurna 10 liter (T, P) campuran CH4 dan C2H4dihasilkan 12 liter gas karbon dioksida sesuai reaksi:
CH4(g) + O2(g) → CO2(g) + H2O(l)
C2H4(g) + O2(g) → CO2(g) + H2O(l)
tentukan susunan volume dalam campuran tersebut!
4. Pembakaran sempurna gas metana dan etana menghasilkan gas karbondioksida dan air. Jika volum gas CH4 dan C2H6 yang
dibakar sama, reaksi pembakaran gas mana yang menghasilkan karbon dioksida terbanyak?
UJI PEMAHAMAN
1. Berikut adalah hasil percobaan reaksi antara tembaga (Cu) dengan belerang (S)menghasilkan tembaga sulfida.
Berdasarkan data hasil percobaan tersebut, berapakah perbandingan massa tembagadan belerang dalam senyawa CuS? 2. Dua liter suatu gas hidrokarbon (CxHy) dibakar sempurna memerlukan 6 liter gas oksigen dan menghasilkan 4 liter gas
karbon dioksida dan uap air. Tuliskan persamaan reaksi dan tentukan rumus kimia gas hidrokarbon tersebut!
3. Pada reaksi pembakaran 8 liter campuran gas metana (CH4) dan propana (C3H8) diperlukan25 liter gas oksigen. Berapakah
volume masing-masing gas tersebut?
4. Berapa liter gas H2dan gas O2yang dibutuhkan untuk menghasilkan 15 liter uap air? Tuliskanpersamaan reaksinya!
5. Pada suhu dan tekanan tertentu, gas etanol (C2H5OH) dibakar sempurna dengan 60 liter udara yang mengandung 20%
oksigen, menurut persamaan reaksi: C2H5OH + O2 → CO2+ H2O
Bila diukur pada suhu dan tekanan yang sama, tentukan: a. volume etanol yang dibakar
b. volume gas karbon dioksida yang dihasilkan
6. Suatu bahan bakar gas terdiri dari 80% volume metana (CH4) dan sisanya etana(C2H6). Hitunglah volume oksigen (T, P)
D. Konsep Mol
Dalam kehidupan sehari-hari kita sering menggunakan satuan untuk menyebutkanbilangan yang besar untuk mempermudah perhitungan. Sebagai contohsatuan lusin, kilo, ons dan lain –lain.
Satuan jumlah zat dalam ilmu kimia disebutmol. Satu mol zat mengandung jumlah partikelyang sama dengan jumlah partikel dalam 12gram C–12, yaitu 6,02 × 1023 partikel. Jumlahpartikel ini disebut sebagai bilangan Avogadro.Partikel zat dapat berupa
atom, molekul, atauion. Contoh:
a. 1 mol besi (Fe) mengandung 6,02 × 1023atom besi (partikel unsur besi adalah atom).
b. 1 mol air (H2O) mengandung 6,02 × 1023molekul air (partikel senyawa air adalahmolekul).
c. 1 mol Na+ mengandung 6,02 × 1023 ion Na+(partikel ion Na+ adalah ion).
Bilangan 6,02 × 1023 disebut tetapan Avogadro dan dinyatakan dengan lambang L.
1) Hubungan Mol dengan Jumlah Partikel
Hubungan antara jumlah mol (n) dengan jumlah partikel (X) dalam zat dapat dinyatakan sebagai berikut:
Contoh:
1. Tentukan jumlah partikel dalam 5 mol emas murni! Penyelesaian:
X
=
n . L
X
=
5
.
6,02
×
1 0
23= 3,01 × 1024 atom emas2. Hitunglah jumlah partikel dalam 0,25 mol O2!
Penyelesaian:
X
=
n . L
X
=
0,25
.
6,02
×
1 0
23 = 1,505 × 1023molekul O22) Massa Molar
L = 6,02 × 1023 atom/molekul/ion
X
=
n . L
X
=
n .
6,02
x
1 0
23LATIHAN!
1. Berapa jumlah atom karbon yang terkandung dalam 0,05 mol karbon? 2. Tentukan jumlah mol dari zat-zat berikut:a. 1,204 × 1024 atom Cu
b. 3,01 × 1022 molekul CO 2
c. 1.505 × 1024 ion Na+
3. Tentukan jumlah partikel dari zat-zat berikut: a. 0,05 mol H2O
b. 0,75 mol Fe c. 1,5 mol Cl
-4. Hitunglah jumlah mol NO2 di udara yang mengandung 0,7525 x 1023 molekul!
Massa molar (mm) menyatakan massa yang dimiliki oleh 1 mol zat. Massa 1 mol zat sama dengan massa molekul relatif (Mr)
zat tersebut dengan satuan gram/mol atau dengan kata lain, bilangan massa molar suatu zat sama dengan massa molekul relatifnya, yang membedakan hanya satuannya.
Hubungan jumlah mol (n) dengan massa zat (m) adalah sebagai berikut:
dengan, m = massa zat (gram) n = jumlah mol (mol)
mm = massa molar (gram/mol) Contoh:
1. Hitunglah massa dari 0,75 mol urea CO(NH2)2! (Ar C = 12, O = 16, N = 14, dan H = 1)
Penyelesaian:
mmCO(NH2)2= 60 g/mol
m
=
n. m
mm
=
0,75
mol .
60
mol
g
=
45
g
3) Volume Molar Gas
Hipotesis Avogadro menyebutkan bahwa pada suhu dan tekanan yang sama,semua gas dengan volume yang sama akan mengandung jumlah partikel yangsama pula. Oleh karena 1 mol setiap gas mempunyai jumlah molekul yangsama, maka pada suhu dan tekanan yang sama pula, 1 mol setiap gas mempunyaivolume yang sama. Volume per mol gas disebut volume molar dan dilambangkanVm.
Volume molar gas tidak tergantung pada jenisnya, tetapi hanya pada jumlah mol serta suhu dan tekanan pengukuran. Hubungan mol dengan volum gas dapat dinyatakan sebagai berikut:
Stoikiometri kelas XMIA 9
V
=
n .V
mn
=
V
V
mm
=
n. m
mn
=
m
m
mLATIHAN!
A. Hitunglah jumlah mol dari:a. 2,3 gram natrium (Ar Na = 23)
b. 45 gram C6H12O6 (Ar C = 12, H = 1, dan O = 16)
c. 35,1 gram NaCl (Ar Na = 23 dan Cl = 35,5) d. 196,5 gram seng (Ar Zn = 65,5)
B. Hitunglah massa dari:
a. 0,5 mol barium (Ar Ba = 137) b. 5 mol belerang (Ar S = 32)
c. 2,5 mol K2SO4 (Ar K = 19, S = 32, dan O = 16)
d. 0,3 mol CO2 (Ar C = 12 dan O = 16)
e. 10 mol K2Cr2O7 (Ar K = 39, Cr = 52, dan O = 16)
C. Tentukan Ar perak jika 5 mol perak massanya 540 gram!
D. Hitunglah jumlah partikel gas O2 (ArO= 16) yang memiliki massa 16 gram!
E. Hitunglah jumlah partikel gas Br2 (Mr =160) yang memiliki massa 1,6 g!
dengan, P = tekanan gas (atm)
V = volume gas (liter)
n = jumlah mol (mol)
R = tetapan gas (0,082 L atm mol-1K-1)
T = suhu mutlak gas (K) Dengan, V = volume gas (liter)
n = jumlah mol (mol) Vm = volume molar (liter/mol)
Berikut merupakan beberapa keadaan yang dapat diadikan acuan dalam penentuan volume gas
a) Keadaan Standar (STP)
Keadaan standar dinyatakan dengan STP (Standard Temperature and Pressure) yaitu kondisi dengan suhu 0oC dan tekanan 1
atm. Pada keadaan STP, volume molar gas sama dengan 22,4 liter/mol.
b) Keadaan Kamar (RTP)
Keadaan kamar dinyatakan dengan RTP (Room Temperature and Pressure) yaitu kondisi dengan suhu 25oC dan tekanan 1
atm. Pada keadaan STP, volume molar gas sama dengan 24 liter/mol.
c) Persamaan Gas Ideal
Volume gas pada suhu dan tekanan yang diketahui dapat dihitung denganmenggunakan persamaan gas yang disebut persamaan gas ideal berikut:
Contoh:
Tentukan volume dari 2 mol gas nitrogen jika diukur pada: a. keadaan standar (STP)
b.keadaan kamar (RTP)
c. suhu 30 °C dan tekanan 1 atm penyelesaian:
a. Pada keadaan standar (STP),Vm= 22,4 liter/mol
V
=
n .V
mV
=
2
mol .
22,4
liter
/
mol
V = 44,8 literb. Pada keadaan kamar (RTP), Vm = 24 liter/mol
V
=
n .V
mV
=
2
mol .
24
liter
/
mol
V = 48 literc. Pada suhu 30 °C dan tekanan 1 atm, dihitung dengan PV = nRT T = 273 + 30 = 303 K
V
=
nRT
P
V
=
2
mol
.0,082
L atm mol
−1
K
−1.303
K
1
atm
V = 49,692 liter
d) Membandingkan Volume Gas
Pada suhu dan tekanan yang sama, volume gas hanya bergantung padajumlah molnya. Misalkan gas pertama dengan jumlah mol n1 dan volumeV1 dan gas kedua dengan jumlah mol n2 dan volume V2, maka pada suhu dantekanan yang sama berlaku:
Pada keadaan STP:
V
m=
22,4
liter mol
−1PV
=
nRT
V
=
nRT
P
Pada keadaan RTP:
V
m=
24
liter mol
−Contoh:
Tentukan volume dari 2 mol gas nitrogen jika diukur pada suhu dan tekanan yang sama di mana 0,5 mol gas oksigen mempunyai volume 15 liter:
Penyelesaian:
n
N2V
N2=
n
O2V
O2V
N2=
n
N2.VO2n
O2V
N2=
2
mol x
15
liter
0,5
mol
V
N2=
60
liter
4) Kemolaran Larutan
Kemolaran atau Molaritas (M) adalah salah satu cara menyatakan konsentrasi ataukepekatan larutan. Molaritas menyatakan jumlah mol zat terlarut dalam tiap
liter larutan. Satuan molaritas (M) adalah mol/liter atau mmol/mL.
dengan, M = kemolaran larutan (mol/lliter)
n = jumlah mol (mol)
V = volume larutan (liter)
Contoh:
Tentukan jumlah mol yang terdapat dalam 200 mL larutan urea 0,5 M! Penyelesaian:
M
=
V
n
n
=
M x V
n
=
0,5
mol
/
liter x
0,2
liter
n
=
0,1
mol
Stoikiometri kelas XMIA 11
M
=
V
n
n
1V
1=
n
2V
2LATIHAN!
1. Tentukan volume dari 0,25 mol gas oksigen pada suhu 27 °C dan tekanan 1 atm! 2. Tentukan volume dari 5 mol gas karbon dioksida pada keadaan standar (STP)!
3. Berapakah volume dari 0,75 mol gas belerang yang diukur pada suhu dan tekananyang sama pada saat 3 mol gas nitrogen volumenya 12 liter?
Tugas!
Buatlah jembatan mol yang menggambarkan hubungan mol dengan jumlah partikel, massa, volume serta kemolaran zat! 5. Tentukan volume dari 0,2 mol gas hidrogen yang diukur pada:
a. keadaan standar (STP) b.keadaan kamar (RTP)
c. suhu 28 °C dan tekanan 1 atm
d.suhu dan tekanan yang sama pada saat 2 mol gas karbon monoksida volumenya 25 liter
6. Berapakah molaritas larutan yang dibuat dengan melarutkan 5,85 gram NaCl (Ar Na= 23, Cl = 35,5) dalam 500 mL air? 7. Hitunglah massa NaOH (Ar Na = 23, O = 16, dan H = 1) yang harus dilarutkan untukmembuat 100 mL larutan NaOH
0,1 M!
8. Tentukan molaritas larutan dari: a. 0,8 mol dalam 250 mL larutan NaCl b. 0,5 mol dalam 1.000 mL larutanKOH
9. Tentukan molaritas larutan yang dibuat dengan melarutkan:
a. 50 gram CaCO3 (Ar Ca = 40, C = 12, dan O = 16) dalam 250 mL air b. 11,6 gram Mg(OH)2 (Ar Mg = 24, O = 16, dan H = 1) dalam 2 liter air
10. Berapakah volume air yang dibutuhkan untuk melarutkan 2 mol KOH (Ar K = 39, O = 16, dan H = 1) untuk membuat larutan KOH 0,05 M?
11. Berapakah massa zat terlarut dalam 500 mL larutan Ca(OH)2 0,1 M (Ar Ca = 40, O = 16, dan H = 1)?
12. Berapa jumlah molekul N2yang terdapat dalam 5,6 L gas N2 diukur pada keadaanSTP?
UJI PEMAHAMAN
1. Suatu senyawa massanya 22 g dan jumlah molnya 0,5 mol.Berapa Mr senyawa itu?
2. Suatu senyawa dengan massa 12 g dan jumlah molekul2,408 × 1023 molekul. Tentukan massa molekul relatif senyawa
tersebut!
3. Berapa volume gas X yang diukur pada keadaan standar jika massa gas tersebut 34 g dan massa molar17 g mol–1?
4. Pada suhu dan tekanan sama, berapa volume gasCO2 yang diukur pada keadaan 1 liter gas NO yang massanya 14 g?
5. Diketahui massa atom relatif (Ar) C = 12, N = 14, O = 16, dan H = 1. Tentukan volumestandar (STP) dari: a. 4,4 gram gas CO2
b. 4 mol O2
c. 6,8 gram NH3
d. 1,806 × 1022 molekul H 2
6. Diketahui Ar C = 12, N = 14, O = 16, S = 16, H = 1, dan Fe = 56. Tentukan massa dari: a. 4,48 liter gas dinitrogen pentaoksida (STP)
b. 5 mol CO(NH2)2
c. 0,6 mol gas SO2 (RTP)
d. 6,02 × 1021 atom besi
7. Tentukan jumlah partikel dari: a. 3 mol molekul H2O
b. 2 liter gas oksigen pada 27 °C dan tekanan 1 atm c. 3,2 gram O2 (Ar O = 16)
d. 40 gram CaCO3 (Ar Ca = 40, C = 12, dan O = 16)
E. Stoikiometri Senyawa 1) Kadar Unsur dalam Senyawa
Dengan mengetahui jenis dan massa dari setiap komponen penyusun zat, kitadapat mengetahui komposisi zat tersebut. Komposisi zat dinyatakan dalam persen massa (% massa) atau disebut juga kadar. Perhitungan persen massa untuk setiap komponen dapat menggunakan persamaan berikut:
Contoh:
Seorang ahli kimia melakukan analisis terhadap sampel kimia dan dia menemukan
Stoikiometri kelas XMIA 13
9. Pada suhu dan tekanan tertentu (T, P), 4,4 gram CO2 bervolume 10 liter. Pada suhudan tekanan yang sama, tentukan
volume dari 19,2 gram gas SO2 (Ar C = 12, O = 16,dan S = 32)!
10. Berapakah volume dari 12,8 gram gas SO2 (Ar S = 32, O = 16) yang diukur pada suhu28 °C dan tekanan 1 atm?
11. Tentukan volume dari 0,5 mol gas CO yang diukur pada suhu 30 °C dan tekanan 1atm!
12. Berapakah massa C6H12O6 yang dibutuhkan untuk membuat 2 liter larutan C6H12O60,05 M (Ar C = 12, H = 1, O = 16)?
bahwa sampel seberat 65 gram tersebut mengandung 48 gram karbon, 9 gram hidrogen,dan 8 gram oksigen. Nyatakan komposisi zat tersebut dalam persen massa!
Penyelesaian:
%
massaC
=
massa zat x
massaC
100 %
%
massaC
=
48
65
gram
gram x
100 %
= 73, 85 %
%
massa H
=
massa zat x
massa H
100 %
%
massa H
=
65
9
gram
gram x
100 %
=
13,85 %
%
massaO
=
massa zat x
massa O
100 %
%
mas sa C
=
65
8
gram
gram x
100 %
=
12, 30 %
Kadar unsur atau komponen penyusun suatu senyawa juga dapat ditentukan melalui rumus kimia senyawanya, yaitu menggunakan massa atom relatif (Ar) unsur dan massa molekul relatif (Mr) senyawanya. Secara umum, untuk menghitung kadar atau persen massa unsur dalam suatu senyawa digunakan persamaan berikut:
Untuk menentukan massa unsur – unsur penyusun suatu senyawa, dan massa senyawa tersebut diketahui maka dapat digunakan persamaan berikut:
Contoh:
Tentukan kadar unsur C, H, dan O dalam senyawa glukosa (C6H12O6)!
(Ar C =12, H = 1, dan O = 16)! Penyelesaian:
kadar C
=
Mr C
6
X Ar C
6
H
12O
6X
100 %
kadar C
=
6
180
X
12
X
100 %
=
40 %
kadar H
=
Mr C
12
X Ar H
6
H
12O
6X
100 %
kadar H
=
12
180
X
1
X
100 %
=
6,7 %
kadar O
=
Mr C
6
X Ar O
6
H
12O
6X
100 %
kadar O
=
6
180
X
16
X
100 %
=
53,3 %
Stoikiometri kelas XMIA
kadar Unsur
=
angka indeks X Ar unsur
Mr senyawa
X
100 %
massa Unsur
=
angka indeks X Ar unsur
Mr senyawa
X massa senyawa
LATIHAN!
1.Satu sampel suatu zat mengandung 2,4 gram karbon, 3,2 gram oksigen, 5,6 gramnitrogen, dan 0,8 gram hidrogen. Nyatakan komposisi zat tersebut dalam persen massa!
2.Tentukan kadar C dan N dalam urea (CO(NH2)2)! (Ar C = 12, O = 16,
N = 14, dan H = 1)
3.Berapakah massa oksigen yang diperlukan untuk membuat 500 kg air? (Ar H = 1 dan O = 16)
4.Berapakah massa kalsium yang terdapat dalam 250 kg CaCO3?
(Ar Ca = 40, C = 12, dan O = 16)
2)
3) Menentukan Rumus Kimia Zat
Rumus kimia menunjukkan jenis atom/unsur dan jumlah relatif masing – masing unsur yang terdapat dalam zat. Jumlah unsur yang terdapat dalam zat ditunjukkan dengan angka indeks. Rumus kimia zat dapat dibedakan menjadi rumus empiris dan rumus molekul.
Rumus molekul menyatakan jenis dan jumlah atom – atom dalam satu molekul, sedangkan rumus empiris menyatakan perbandingan paling sederhana dari atom – atom dalam suatu molekul.
Contoh:
Tabel 1. Contoh Rumus Molekul dan Rumus Empiris Senyawa
Senyawa Rumus Molekul
Rumus Empiris
Benzena C6H6 CH
Glukosa C6H12O6 CH2O
Propena C3H6 CH2
Amonia NH3 NH3
a. Menentukan Rumus Empiris
Rumus empiris merupakan perbandingan paling sederhana dari atom–atom unsur penyusun suatu senyawa. Hal yang penting untuk menentukan rumus empiris suatu senyawa adalah menghitung jumlah mol yaitu perbandingan paling sederhana mol unsur–unsur penyusun senyawa.
Contoh:
Sebanyak 3 gram senyawa organik mengandung 1,2 gram karbon, 0,2 gram hidrogen dan sisanya adalah oksigen. Tentukan rumus empiris senyawa tersebut, jika diketahui Ar H = 1; C = 12; dan O = 16!
Penyelesaian:
i) Menentukan jumlah mol masing-masing unsur
n
=
m
m
mJumlah mol C =
12
1,2
g
g
/
mol
=
0,1
mol
Jumlah mol H =
1
0,2
g
g
/
mol
=
0,2
mol
Jumlah mol O =
16
1,6
g
g
/
mol
=
0,1
mol
ii) Menentukan perbandingan mol unsur - unsur
Perbandingan mol C : mol H : mol O = 0,1 : 0,2 : 0,1 = 1 : 2 : 1
Sehingga, rumus empiris senyawa tersebut adalah CH2O.
b. Menentukan Rumus Molekul
Rumus molekul rumus kimia yang menunjukkan jumlah atom dari masing–masing unsur dalam suatu senyawa. Pada dasarnya rumus molekul merupakan kelipatan-kelipatan dari rumus empirisnya. Sehingga, hubungan rumus empiris (RE) dan rumus molekul (RM) dapat dituliskan sebagai berikut:
Nilai n dapat ditentukan jika rumus empiris dan massa molekul relatif(Mr) zat diketahui.
LATIHAN!
1. Tentukan rumus empiris dari asam asetat, pentena, propane, urea dan karbon dioksida!
2. Suatu senyawa mengandung 32,4 % natrium; 22,6 % belerang; dan sisanya oksigen(Ar Na = 23, S = 32, dan O =16).
Tentukanlah rumus empiris senyawa tersebut!
3. Suatu senyawa nitrogen oksida terdiri dari 7 gram nitrogen dan 12 gram oksigen(Ar N = 14 dan O = 16).Tentukan rumus empiris nitrogen oksida tersebut!
4. Suatu senyawa mengandung 32,4 % natrium; 22,6 % belerang; dan sisanya oksigen(Ar Na = 23, S = 32, dan O =16).
Tentukanlah rumus empiris senyawa tersebut!
5. Suatu senyawa mengandung 52,14% C; 13,03% H; dan 34,75% O. (Ar: C=12, H=1,O=16). Tentukan rumus
perbandingan senyawa itu!
¿
Contoh:
Suatu senyawa dengan rumus empiris CH (Ar C = 12 dan H = 1) mempunyai Mr = 26. Tentukan rumus molekul senyawa tersebut!
Penyelesaian:
Mr = n × (Ar C + Ar H)
26 = n × (12 + 1) 26 = n × 13 n = 2
Jadi, rumus molekul senyawa tersebut adalah (CH)2 = C2H2.
F. Stoikiometri Reaksi 1) Koefisien Reaksi
Stoikiometri kelas XMIA 17
LATIHAN!
1. Suatu senyawa memiliki rumus empiris C4H9 dan massa molekul relatif 114 g/mol.Tentukan rumus molekul senyawa
tersebut!
2. Suatu senyawa memiliki rumus molekul CH3. Jikamolekul tersebut memiliki massa molekul relatif 30.Tentukan rumus molekulnya.
3. Suatu senyawa memiliki komposisi massa sebagaiberikut:54% C; 10% H; dan 36% O. Jika Mr senyawa tersebut 266 g/mol. Tentukan:
a. rumus empiris; b. rumus molekul; dan
c. massa C, H, dan O jika massa senyawa 28 gram.
4. Suatu hidrokarbon CxHy yang berbentuk gas terdiri dari 80% karbon dan sisanyahidrogen. Tentukan rumus empiris senyawa tersebut. Jika diketahui massa dari 1 litersenyawa itu (STP) adalah 1,34 gram, tentukan rumus molekul senyawa hidrokarbontersebut!
5. Senyawa CxHyOz tersusun dari 40% karbon, 6,67% hidrogen, dan sisanya oksigen.Jika Mr senyawa tersebut adalah 90, tentukan rumus molekul senyawa tersebut!
6. Suatu senyawa organik dengan Mr = 60 tersusun dari 40% karbon; 6,6% hidrogen; dansisanya oksigen (Ar C=12; H = 1; O = 16). Tentukan rumus molekul senyawa tersebut!
Koefisien reaksi merupakan perbandingan jumlah partikel dari zat yang terlibat dalam reaksi. Oleh karena 1 mol setiap zat mengandung jumlah partikel yang sama, maka perbandingan jumlah partikel sama dengan perbandingan jumlah mol. Jadi, koefisien reaksi merupakan perbandingan jumlah mol zat yang terlibat dalam reaksi.
Dengan pengertian tersebut, maka banyaknya zat yang diperlukan atau dihasilkan dalam reaksi kimia dapat dihitung dengan menggunakan persamaan reaksi setara. Apabila jumlah mol salah satu zat yang bereaksi diketahui, maka jumlah mol zat yang lain dalam reaksi itu dapat ditentukan dengan menggunakan perbandingan koefisien reaksinya.
mol zat ditanya
=
koef . zat diketahui x mol zat diketahui
koef . zat ditanya
Contoh:
Aluminium larut dalam larutan asam sulfat menghasilkan larutan aluminium sulfat dan gas hidrogen. Persamaan reaksinya:
2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Berapa mol gas hidrogen dan mol larutan aluminium sulfat yang dihasilkan jika digunakan 0,5 mol aluminium?
Penyelesaian:
2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
0,5 mol
perbandingan koefisien Al : H2SO4 : Al2(SO4)3 : H2 adalah 2 : 3 : 1 : 3
Jumlah mol gas hidrogen =
3
2
x
0,5
mol
=
0,75
mol
Jumlah mol larutan aluminium sulfat =
1
2
x
0,5
mol
=
0,25
mol
LATIHAN!
1. 5,6 gram besi (Ar Fe = 56) dilarutkan dalam larutan asam klorida sesuai reaksi:Fe(s) + HCl(aq) → FeCl3(aq) + H2(g)
Tentukan volume H2 yang dihasilkan pada keadaan standar (STP)!
2. Sebanyak 32 gram kalsium karbida (CaC2) dilarutkan dalam air menghasilkan gasasetilena (C2H2) menurut reaksi:
CaC2(s) + H2O(l) → Ca(OH)2(s) + C2H2(g)
Tentukan: a. mol CaC2
b. massa Ca(OH)2 yang dihasilkan
c. volume gas asetilena yang dihasilkan pada keadaan standar (Ar Ca = 40, C = 12, O= 16, dan H = 1) 3. Diketahui persamaan reaksi: Mg(s) + HCl(aq) → MgCl2(aq) + H2(g)
Jika Mg yang bereaksi adalah 2 mol, hitunglah: a. mol HCl yang bereaksi,
b. volum gas H2 yang dihasilkan pada STP.
4. Gas propana C3H8 direaksikan dengan gas oksigen menghasilkan gas karbondioksida dan air. Jika C3H8 yang bereaksi
adalah 4,4 gram, pada STP, tentukan: a.volum O2 yang bereaksi,
b.volum CO2 yang dihasilkan,
c.massa H2O yang dihasilkan.
5. Logam aluminium dapat bereaksi dengan larutan HCl menghasilkan larutan AlCl3 dan gas H2. Berapa gram gas H2
yang terbentuk dan jumlah molekul hidrogen dari 9 gram aluminium? ( Ar Al = 27, H = 1). 6. Pada saat korek api gas dinyalakan, reaksi yang terjadi adalah:
C4H10(g) + O2(g) → CO2(g) + H2O(l)
2) Menentukan Rumus Kimia Hidrat
Hidrat adalah zat padat yang mengikat beberapa molekul air sebagai bagian dari struktur kristalnya.
Contoh:
1. Terusi (CuSO4.5 H2O): tembaga(II) sulfat pentahidrat
2. Gipsum (CaSO4.2 H2O): kalsium sulfat dihidrat
3. Garam inggris (MgSO4.7H2O): magnesium sulfat heptahidrat
4. Soda hablur (Na2CO3.10H2O): natrium karbonat dekahidrat
Jika suatu senyawa hidrat dipanaskan, maka ada sebagian atau seluruh airkristalnya dapat dilepas (menguap). Jika suatu hidrat dilarutkan dalam air, maka air kristalnya akan lepas.
Contoh:
CuSO4.5H2O(s) → CuSO4(aq) + 5H2O(l)
Gambar 7. CuSO4.5H2O (kiri) dan CuSO4 (kanan)
Contoh:
Sebanyak 5 gram hidrat dari tembaga(II) sulfat (CuSO4.xH2O) dipanaskan sampai semua air kristalnya menguap. Jika massa
padatan tembaga (II) sulfat yang terbentuk adalah 3,2 gram, tentukan rumus hidrat tersebut! (Ar Cu = 63,5, S = 32, O = 16, dan H = 1).
Penyelesaian:
Massa H2O = 5 gram – 3,2 gram = 1,8 gram
Mol CuSO4 =
m
m
m =3,2
g
159,5
g
/
mol
=
0,02
mol
Mol H2O =
m
m
m =1,8
g
18
g
/
mol
=
0,1
mol
Persamaan reaksi pemanasan CuSO4.xH2O:CuSO4.xH2O(s) → CuSO4(aq) + xH2O(l)
0,02 mol 0,1 mol Perbandingan mol CuSO4 : H2O = 0,02 mol : 0,1 mol = 1 : 5 Karena perbandingan mol = perbandingan koefisien, maka x = 5. Jadi, rumus hidrat tersebut adalah CuSO4.5H2O.
3) Pereaksi Pembatas
Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yangditambahkan tidak selalu sama dengan perbandingan koefisien reaksinya. Halini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih dahulu yang disebut sebagaipereaksi pembatas.
Contoh:
1 mol larutan natrium hidroksida direaksikan dengan 1 mol larutan asam sulfat sesuai reaksi: 2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O(l)
Tentukan:
a. pereaksi pembatas b. pereaksi yang sisa c. mol H2O yang dihasilkan
Penyelesaian:
2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O(l)
m : 1 mol 1 mol
r : 1 mol 0,5 mol 0,5 mol 1 mol s : - 0,5 mol 0,5 mol 1 mol a. Pereaksi pembatasnya adalah NaOH
b. Pereaksi sisanya adalah H2SO4
c. Mol H2O yang dihasilkan adalah 1 mol.
Stoikiometri kelas XMIA 20
LATIHAN!
1. Sebanyak 10 gram hidrat besi (II) sulfat dipanaskan sehingga diperoleh senyawa anhidratnya sebanyak 5,47 gram. Tentukan rumus hidrat senyawa tersebut!
2. 24,0 gram magnesium sulfat anhidrat bergabung dengan 25,2 gram airmembentuk senyawa magnesium sulfat hidrat. Tentukan rumus senyawa hidrattersebut. ( Mr MgSO4 = 120, H2O = 18)
LATIHAN!
1.100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuaireaksi:
Ca(OH)2(aq) + HCl(aq) → CaCl2(aq) + H2O(l)
Tentukan pereaksi pembatas!
2.Perhatikan persamaan reaksi berikut: N2(g) + 3H2(g) → 2NH3(s)
Jika 1 mol N2 direaksikan dengan 2 mol H2, tentukan:
a. pereaksi pembatas! b. jumlah mol yang tersisa! c. jumlah mol NH3!
3.Di dalam bejana tertutup, 44,8 L gas NH3 direaksikan dengan 89,6 L gas O2
pada STP dengan reaksi: NH3(g) + O2(g) → N2(g) + H2O(g).
a. Hitung volum gas N2 yang dihasilkan.
b. Hitung volum H2O yang dihasilkan.
c. Hitung volum gas yang tersisa.
4.108 gram aluminium dibakar dengan 160 gram gas oksigen untuk membentuk aluminium oksida, Al2O3. Berapa gram Al2O3 terbentuk dan massa unsur yang
tersisa? ( Ar Al = 27, O = 16)
1. Persentase massa kalsium dalam batu kapur (CaCO3) adalah . . . .
(ArCa = 40, C = 12, O =16)
a. 12% c. 40% e. 60% b. 16% d. 48%
a. Volum
2. 3 gram gas C2H6 pada STP adalah . . . . ( Ar C = 12, H = 1)
a. 3,5 liter b. 7 liter c. 14 liter d. 2,24 liter e. 28 liter
3. Pada suhu dan tekanan yang sama, 1 L gas berikut yang memiliki massapaling besar adalah . . . .( ArH = 1, C = 12, O = 16, S = 32 , N = 14)
a. NH3 d. NO2
b. CO2 e.CH4
c. SO2
4. Jumlah apa yang sama di antara satu mol etanol C2H5OH dengan satu moletana C2H6 ?
a. Massa
b. Volum pada STP
c. Jumlah atom d. Jumlah ikatan
e. Jumlah molekul
5. Natrium hidrogen karbonat jika dipanaskan terurai dengan reaksi:
2NaHCO3(s) → Na2CO3(s)+ CO2(g)+ H2O(g). Jika 5 mol sampel NaHCO3dipanaskan, maka volum gas CO2 yang dihasilkan
adalah (dik: Volum molar gas= 24 L) . . . .
a. 24 L b. 60 L c. 36 L d. 72 L e. 48 L
Stoikiometri kelas XMIA 21
6. 20 mL gas NH3 bereaksi dengan 20 mL gas oksigen (O2) pada STP dengan reaksi: 4NH3(g)+ 3O2(g) →2N2(g) +
6H2O(l).Volum oksigen yang bereaksiadalah . . . .
a. 0 mL b. 15 mL
c. 5 mL d. 10 mL
e. 7,5 mL
7. Senyawa hidrida XH3 mengandung 90% unsur X. Ar dari X adalah . . . .
a. 8 b. 90
c. 27 d. 118
e. 30
8. Reaksi besi(II) sulfida dengan gas oksigen berlangsung menurut reaksi: FeS(s) + O2(g) → Fe2O3(s) + SO2(g)
Jikabereaksi 8,8 gram FeS murni (Ar Fe = 56, O= 16, S = 32), gas SO2 yang dihasilkan pada keadaan standar (STP) adalah
a. 24,2 liter b. 2,24 liter c. 22,4 liter d. 1,12 liter e. 2,42 liter
9. Suatu senyawa organik terdiri dari 40% C, 6,67% H, dan sisanya oksigen. JikaAr C = 12, H = 1, O = 16 dan massa molekul senyawa tersebut 60, maka rumus
molekul senyawa tersebut adalah … . a. CH4O
b. CH2O
c. C2H5OH
d.CH3COOH
e. CH3COH
10.Pada suhu dan tekanan yang sama, semua gas yang memiliki volume yang sama akan memiliki jumlah partikel yang sama. Pernyataan tersebut dikenal dengan hukum . . . .
a. Gay Lussac b. Avogadro
c. Dalton d. Proust
e. Lavoisier
11. Jika dalam 8 liter gas CO2 (P, T) terdapat 6,02 × 1022 molekul gas tersebut, makapada suhu dan tekanan yang sama, 1,505 ×
1021 molekul gas NO
2 akan menempatiruang yang volumenya . . . .
a. 0,2 liter b.2 liter
c. 8 liter d.16 liter
e. 20 liter
12. Massa yang terkandung dalam 3 mol urea (CO(NH2)2) (Ar C = 12, O = 16, N =14, dan H = 1) adalah . . . .
a. 60 gram b.120 gram
c. 150 gram d.180 gram
e. 240 gram
13. Untuk membuat 500 mL larutan NaOH dengan konsentrasi 0,2 M diperlukan NaOH (Ar Na = 23, O = 16, dan H = 1) sebanyak . . . .
a. 2 gram b.10 gram c. 4 gram d.16 gram e. 8 gram
14. Diketahui reaksi:
Mg(s) + CuSO4(aq) → MgSO4(aq) + Cu(s)
Bila 6 gram magnesium tepat habis bereaksi dengan larutan CuSO4 (Ar Mg = 24,Cu = 63,5), maka dihasilkan tembaga sebanyak ... .
a. 7,94 gram b.48 gram
c. 15,88 gram d.63,5 gram
e. 31,75 gram
15.Berdasarkan reaksi:
bila 30 mL larutan Pb(NO3)2 0,1 M direaksikan dengan 20 mL larutan KI 0,4 M, maka massa endapan PbI2 (Ar Pb = 207, I =
127) yang terbentuk adalah ... a. 0,692 gram
b.2,766 gram
c. 1,383 gram d.3,688 gram
e. 1,844 gram
16. Dalam kompor gas, 5 mol propana dibakar dengan 5mol gas oksigen menghasilkan CO2(g) sebanyak ....
a. 3 mol b.5 mol c. 10 mol d.15 mol e. 30 mol
17. Volume 0,5 mol gas oksigen yang diukur pada 25°Cdan 1 atm adalah .... a. 11,2 liter
b.22,4 liter
c. 24,44 liter d.28,25 liter
e. 30,00 liter
18. Unsur-unsur yang membentuk dua atau lebih senyawaharus merupakan kelipatan bilangan bulat dansederhana. Pernyataan ini dikenal dengan Hukum
a Lavoisier b Proust
c Dalton d Avogadro
e Gay–Lussac
19. Jika x mL gas H2 direaksikan dengan 3x mL gas Cl2maka gas HCl yang dibentuk sebanyak ....
a. x mL b.2x mL c. 3x mL d.4x mL e. 3x2 mL
20. Volume O2 yang dibutuhkan untuk pembakarancampuran 5 liter CH4 dan 5 liter C2H4adalah . . . .
a. 5 liter b.20 liter c. 10 liter d.25 liter e. 15 liter
21. Hukum perbandingan tetap dikemukakan oleh . . . . a. Avogadro
b. Proust
c. Dalton d. Newton
e. Lavoisier
22. Pernyataan di bawah ini yang dikemukakan oleh Gay Lussac adalah . . . . a. energi tidak dapat diciptakan dan tidak dapat dimusnahkan
b. massa zat sebelum dan sesudah reaksi adalah tetap
c. perbandingan massa unsur-unsur dalam senyawa selalu tetap
d. volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi pada T dan Psama berbanding sebagai bilangan bulat dan sederhana
e. pada T dan P sama, semua gas bervolume sama mengandung jumlah molekulyang sama
23. Pada suhu dan tekanan tertentu, m molekul H2S bervolume 0,25 liter. Pada suhudan tekanan yang sama, volume dari
4m molekul NH3 adalah . . . .
a. 0,25 liter b. 1,5 liter
c. 0,5 liter d.2 liter
e. 1 liter
24. Pada suhu dan tekanan tertentu, 2 liter gas nitrogen mengandung n molekul gasnitrogen. Pada suhu dan tekanan yang sama, jumlah molekul gas oksigen yang volumenya 10 liter adalah . . . .
a. n molekul gas oksigen b. 2n molekul gas oksigen c. 3n molekul gas oksigen d. 4n molekul gas oksigen
e. 5n molekul gas oksigen
25. Gas hidrokarbon (CxHy) bervolume 3 liter tepat dibakar sempurna dengan 18liter oksigen menghasilkan 12 liter gas karbon dioksida sesuai reaksi:
CxHy+ O2 → CO2 + H2O (belum setara)Rumus molekul hidrokarbon tersebut adalah . . . .
a. C5H12 b. C4H8 c. C5H10 d. C3H8 e. C4H6
26. Sebanyak 6 liter campuran gas metana (CH4) dan gas etana (C2H6) dapat dibakarsempurna dengan 19 liter gas oksigen
pada suhu dan tekanan yang sama.Persamaan reaksinya: CH4 + 3O2 → CO2 + 2H2O
2C2H6 + 7O2→ 4CO2 + 6H2O
Volume gas CH4 dan C2H6 berturut-turut adalah . . . . liter.
a. 1 dan 5 b. 2 dan 4 c. 5 dan 1 d. 2 dan 3 e. 4 dan 2
27. Suatu campuran terdiri dari 60% volume gas N2 dan 40% volume gas O2.Perbandingan molekul gas N2 dan O2 dalam
campuran itu adalah . . . .
a. 3 : 2 b. 16 : 21 c. 4 : 3 d.2 : 3 e. 21 : 16
28. Pada suhu dan tekanan tertentu, 10 liter gas NO bereaksi dengan 5 liter gas O2,sehingga menghasilkan 10 liter gas
NxOypada suhu dan tekanan yang sama.Rumus molekul senyawa NxOyadalah . . . .
a. NO2 b. N2O5 c. N2O4 d. N2O e. N2O3
29. Pada suhu 25 °C dan tekanan 1 atm diketahui kadar oksigen dalam udara adalah20%. Reaksi pembakaran karbon:C + O2 → CO2
Pada pembakaran karbon dengan 100 liter udara dihasilkan gas karbon dioksida sebanyak . . .
a. 10 liter b. 80 liter c. 20 liter d. 100 liter e. 50 liter
30. Logam aluminium yang dapat dihasilkan dari 10.000 kg bauksit murni menurutreaksi: 2Al2O3(s) → 4Al(s) + 3O2(g)(Ar Al = 27 dan O = 16) adalah . . . .
a. 8 000 kg b. 4.700 kg
c. 6.600 kg d. 1.900 kg
e. 5.300 kg
31. Sebanyak 11,2 gram serbuk besi (Fe) dipanaskan secara sempurna dengan 6,4gram serbuk belerang (S), sesuai reaksi:Fe + S → FeS
Senyawa besi(II) sulfida (FeS) yang terbentuk sebanyak . . . .
a. 6,4 g b. 17,6 g c. 11,2 g d. 22,4 g e. 12,8 g
32. Perbandingan massa magnesium dengan massa oksigen dalam senyawa magnesiumoksida adalah 3 : 2. Jika 12 gram magnesium direaksikan dengan 6 gramoksigen, maka massa magnesium oksida (MgO) yang terbentuk adalah . . . .
a. 6 g21 g b. 10 g c. 30 g d. 15 g
33. Diketahui data percobaan pembentukan senyawa pirit sebagai berikut.
Massa Besi (Fe) Massa Belerang (S) Massa pirit (FeS)
7 gram 8 gram 15 gram
14 gram 16 grm 40 gram
21 gram 24 gram 45 gram
Perbandingan Fe : S adalah … .
a. 1 : 2 b. 5 : 8 c. 2 : 3 d. 7 : 8 e. 4 : 3
34. Satu liter campuran gas terdiri dari 60% volume metana (CH4) dan sisanya gasetana (C2H6) dibakar sempurna sesuai
reaksi:
CH4 + 3O2 → 2CO2 + 2H2O
2C2H6 + 7O2 → 4CO2 + 6H2O
Volume gas oksigen yang dibutuhkan adalah . . . .
a. 2,4 l b. 3,0 l c. 2,6 l d. 3,2 l e. 2,8 l
35. Jika diketahui massa atom relatif H = 1, S = 32, O = 16 dan massa molekulrelatif (NH4)2SO4 = 132, maka massa atom
relatif N adalah … .
a. 7 b. 20 c. 12 d. 28 e. 14
a. 0,4 mol SO3
b. 0,5 mol C4H10
c. 2 mol CH4
d. 1 mol O2
e. 0,5 mol SO2
37. Jumlah mol dari 29,8 gram amonium fosfat ((NH4)3PO4) (Ar N = 14, H = 1, dan P = 31) adalah . . . .
a. 0,05 mol b. 0,25 mol
c. 0,15 mol d. 1,10 mol
e.
f. 0,20 mol
38. Jika diketahui Ar Ca = 40, C = 12, O = 16 dan bilangan Avogadro = 6,02×1023,maka 50 gram CaCO
3mempunyai
jumlah molekul . . . . a. 3,01 × 1021
b. 3,01 × 1022
c. 6,02 × 1022
d. 3,10 × 1023
e. 1,204 × 1023
39. Pada senyawa K2Cr2O7 (Ar K = 39, Cr = 52, O = 16), kadar oksigen adalah
a. 12% b. 42% c. 28% d. 62% e. 38%
40. Dalam 1.500 kg urea (CO(NH2)2) terkandung unsur nitrogen sebesar . . . .
a. 250 kg b. 650 kg
c. 300 kg d. 700 kg
e. 500 kg
41. Sebanyak 305 kg pupuk ZA ((NH4)2SO4) (Ar N = 14, H = 1, S = 32, dan O = 16)disebar secara merata pada sawah
seluas 1 hektar (10.000 m2). Massa nitrogenyang diperoleh setiap 10 m2tanah adalah . . . .
a. 35 gram b. 140 gram
c. 65 gram d. 210 gram
e. 105 gram
42. Dalam 100 gram pupuk urea (CO(NH2)2) terdapat 22,4 gram nitrogen (Ar C = 12,O = 16, N = 14, H = 1). Kadar
nitrogen dalam pupuk urea tersebut adalah . . . . a. 96%
b. 23,3%
c. 48% d. 22,4%
e. 44,8%
43. Suatu senyawa mempunyai rumus empiris (CH2O)n dengan massa molekul relatif180 (Ar C = 12, H = 1, dan O = 16).
Rumus molekul senyawa tersebut adalah . . . . a. CH2O
b. C4H6O4
c. C2H2O2
d. C6H12O6
e. C3H6O3
44. Suatu senyawa hidrokarbon mempunyai rumus empiris CH2 (Ar C = 12 danH = 1). Jika 5,6 liter (STP) gas tersebut
mempunyai massa 14 gram, maka rumus molekul gas tersebut adalah . . . .
a. C2H4 b. C4H8 c. C2H6 d. C5H10 e. C3H8
45. Suatu senyawa oksida nitrogen NxOymengandung 63,16% nitrogen dan 36,84%oksigen (Ar N = 14 dan O = 16).
Senyawa tersebut adalah . . . .
a. NO b. N2O3 c. N2O d. N2O5 e. NO2
46. Sebanyak 0,37 gram senyawa organik CxHyOz(Ar C = 12, H = 1, dan O = 16)dibakar sempurna menghasilkan 0,88
gram CO2 dan 0,45 gram H2O sesuai reaksi:CxHyOz+ O2 → CO2 + H2O (belum setara)
Rumus kimia senyawa organik tersebut adalah . . . . a. CH3OH
b. C4H9OH
c. C2H5OH
d. CH3COOH
e. C3H7OH
47. Pada kristalisasi 3,19 gram tembaga(II) sulfat (CuSO4) terbentuk 4,99 gram hidratCuSO4.xH2O (Ar Cu = 63,5, S = 32,
O = 16, dan H = 1). Harga x adalah . . . . .
a. 3 b. 6 c. 4 d. 7 e. 5
48. Apabila kristal BaCl2.x H2O (Ar Ba = 137, Cl = 35,5, H = 1, dan O = 16)mengandung 14,75% air kristal, maka rumus
yang tepat untuk kristal tersebut adalah . . . . a. BaCl2.H2O
b. BaCl2.4H2O
c. BaCl2.2H2O
d. BaCl2.5H2O
e. BaCl2.3H2O
49.Pada pembakaran sempurna 6 gram C2H6 (Ar C = 12 dan O = 16) sesuai reaksi:2C2H6(g) + 7O2(g) → 4CO2(g) +
6H2O(l)gas CO2 yang dihasilkan pada keadaan standar (STP) adalah . . . .
a. 2,24 liter b. 8,96 liter c. 4,48 liter d. 11,2 liter
50. 6,72 literReduksi besi(III) oksida dengan CO menghasilkan besi sesuai reaksi:
Fe2O3+ 3CO → 2Fe + 3CO2Untuk menghasilkan 11,2 kg besi dibutuhkan Fe2O3 (Ar Fe = 56 dan O = 16) sebanyak . .
a. 22 kg c. 20 kg e.18 kg
GLOSARIUM
Stoikiometri : Pengukuran hubungan antara banyaknya reaksi dan hasil reaksi dari perubahan kimia yang ditunjukkan oleh persamaan reaksi kimia
Rumus Empiris: dalam rumus hanya ditunjuk macam–macam atom dan jumlah (relative)-nya tanpa ditunjuk pengugusan
Rumus Kimia : gabungan lambang kimia untuk menyatakan susunan molekul, senyawa, atau campuran
Rumus Molekul: rumus senyawa kimia yang mengandung lambing atom–atom atau radikal yang ada, yang diikuti denganangka bawah yang menyatakan jumlah setiap jenis atom atau radikal dalam molekul.
DAFTAR PUSTAKA
Anderton, J. D., et al. (1996). Foundations Chemistry Second Edition. Australia: Longman.
Brady, J. E. (1999). Kimia Universitas Asas dan Struktur Jilid 1 Edisi ke 5. Jakarta: Binarupa Aksara Briggs, J. G. R. 1998. For GCE O – Level. Singapore. Longman.
Day, R. A. dan Underwood, A. L. (1992). Analisis Kimia Kuantitatif. Jakarta: Erlangga. Pujaatmaka, H. A. (1989). Kimia Universitas Azas dan Struktur Edisi ke-5. Jakarta: Erlangga