commit to user
DETEKSI VIRUS HEPATITIS C PADA KOMUNITAS GIGOLO SURAKARTA
MENGGUNAKAN NESTED PCR YANG MENGAMPLIFIKASI
SEBAGIAN REGIO NS5B
SKRIPSI
Untuk Memenuhi Persyaratan
Memperoleh Gelar Sarjana Kedokteran
Wike Astrid Cahayani
G.0008023
FAKULTAS KEDOKTERAN
UNIVERSITAS SEBELAS MARET
Surakarta
commit to user
1 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Infeksi yang disebabkan Virus Hepatitis C (HCV) telah menjadi beban
kesehatan masyarakat. Diperkirakan 170 juta orang terinfeksi HCV di seluruh
dunia (Chevaliez et al., 2009). Dalam kurun waktu 20-30 tahun, sekitar 80% dari
kasus tersebut berkembang menjadi infeksi hepatitis C kronis yang dapat
menyebabkan sirosis hati dan karsinoma hepatoseluler (Alter, 2007). Selain itu,
angka kejadian infeksi hepatitis C di Indonesia hampir 2,4% dari seluruh
penduduk (WHO, 2003). Adanya koinfeksi HCV pada pasien HIV (Human
Immunodeficiency Virus) positif juga menimbulkan masalah baru karena dapat
mempercepat penurunan sistem imunitas tubuh, terutama oleh infeksi HCV
genotipe 1 (Balogun et al., 2010).
Saat terjadi infeksi hepatitis C akut, gejala pada penderita seringkali tidak
tampak sehingga terjadi keterlambatan diagnosis (Alter, 2007). Padahal, infeksi
hepatitis C akut dapat berkembang menjadi kronis sehingga dapat meningkatkan
mortalitas dan morbiditas (Alter, 2007; Schnuriger et al., 2006). Oleh karena itu,
deteksi dini terhadap infeksi hepatitis C berperan penting dalam mencegah
penularan lebih lanjut, khususnya pada kelompok dengan risiko tinggi. Deteksi
dini juga bermanfaat membantu tenaga kesehatan dalam menentukan diagnosis
serta penatalaksanaan yang sesuai, sehingga kasus infeksi hepatitis C dapat diatasi
commit to user
Pada umumnya, kelompok yang memiliki risiko tinggi tertular infeksi
hepatitis C pernah menggunakan narkotika suntik, memiliki tato atau tindik, dan
seseorang dengan HIV/AIDS (Albeldawi et al., 2010; Jafari et al., 2010). Adapun
riwayat berhubungan seksual dengan banyak pasangan, dikategorikan sebagai
faktor risiko rendah (Albeldawi et al., 2010). Meskipun tergolong berisiko rendah,
aktivitas seksual merupakan aktivitas yang umum, sehingga penularan HCV dapat
terjadi secara lebih luas. Di Amerika Serikat misalnya, kelompok dengan pasangan
seksual lebih dari 50 orang memiliki prevalensi anti-HCV 5% lebih besar
dibandingkan kelompok dengan pasangan seksual kurang dari 50 orang
(Armstrong et al., 2006). Selain itu, kasus koinfeksi HCV pada pasien HIV juga
meningkat pada kelompok yang memiliki aktivitas seksual berisiko tinggi dan
menggunakan jarum suntik (Operskalski dan Kovacs, 2011).
Berkaitan dengan permasalahan tersebut, alasan dipilihnya komunitas
pekerja seks komersial pria (gigolo) di Surakarta dalam penelitian ini karena
mereka aktif secara seksual. Perilaku aktif secara seksual dalam komunitas gigolo
tidak hanya dengan pasangan wanita, tetapi juga dengan pria dan transgender
(Baral et al., 2010; dos Ramos Farías et al., 2011). Di samping memiliki perilaku
seksual yang berisiko, komunitas gigolo juga mempunyai perilaku berisiko tinggi
lain yang mempermudah penyebaran infeksi HCV, seperti penggunaan narkotika
suntik, tato, dan tindik (Baral et al., 2010; Estcourt et al., 2000). Hal ini
menjadikan mereka sebagai subjek penelitian yang unik serta lebih rentan
terinfeksi hepatitis C dibandingkan pekerja seks komersial wanita (dos Ramos
commit to user
Selain pengetahuan tentang faktor risiko penularan, pemahaman akan
identifikasi genotipe dan subtipe HCV juga dibutuhkan dalam mempelajari
epidemiologi tentang HCV. Regio NS5B diamplifikasi karena memiliki karakter
yang sangat informatif serta heterogen (Baclig et al., 2010; Cantaloube et al.,
2006). Hasil penelitian Cantaloube et al. (2006) dan Murphy et al. (2007)
memperlihatkan bahwa NS5B mampu membedakan HCV subtipe 1a dari subtipe
1b dalam lebih dari 90% kasus. Dengan demikian, regio NS5B berpotensi
memfasilitasi identifikasi subtipe HCV secara lebih akurat. Identifikasi subtipe
HCV ini bermanfaat sebagai langkah awal dalam studi epidemiologi molekuler
mengenai strain HCV yang beredar di Indonesia.
Studi ini merupakan bagian dari penelitian payung epidemologi molekuler
Human Blood Borne Viruses yang dilakukan oleh Laboratorium Mikrobiologi
Fakultas Kedokteran UNS, bekerja sama dengan Laboratorium Biomedik Fakultas
Kedokteran UNS dan Division of Virology Faculty of Medicine Tottori University
Japan. Kerjasama penelitian tersebut berupa penelitian epidemiologi molekular
yang difokuskan terhadap Human Immunodeficiency Virus, Hepatitis B Virus,
Hepatitis C Virus, Hepatitis D Virus, Human T-Lymphotropic Virus 1/2, dan
Torque Teno Virus di Indonesia. Berkaitan dengan studi tersebut, produk
Polymerase Chain Reaction (PCR) yang dihasilkan akan disekuensing dan
dianalisis secara molekuler. Namun, dalam skripsi ini hanya dilaporkan data
epidemiologi dan hasil pemeriksaan serologi molekuler HCV dan tidak dilakukan
commit to user B. Perumusan Masalah
Bagaimanakah virus hepatitis C pada komunitas gigolo di Surakarta
menggunakan Nested PCR yang mengamplifikasi sebagian regio NS5B?
C. Tujuan Penelitian
Tujuan jangka pendek dari penelitian ini adalah memperoleh data awal
epidemiologi infeksi hepatitis C pada komunitas gigolo di Surakarta. Data awal ini
diharapkan dapat digunakan untuk membuat kebijakan di bidang kesehatan dalam
rangka mengeradikasi infeksi hepatitis C.
Adapun tujuan jangka panjang dari penelitian ini adalah mengetahui profil
epidemiologi dan strain human blood borne viruses (khususnya HCV) yang
beredar di Indonesia, sekaligus untuk pengumpulan isolat virus yang dapat
digunakan untuk studi lanjutan HCV di bidang patogenesis, diagnosis, terapi, dan
vaksin.
D. Manfaat Penelitian
1. Manfaat Teoritis
Penelitian ini dapat memberikan informasi tentang epidemiologi HCV
pada komunitas gigolo di Surakarta.
2. Manfaat Praktis
Manfaat praktis penelitian ini adalah diperolehnya data awal mengenai
infeksi hepatitis C yang dapat digunakan oleh petugas maupun dinas kesehatan
dalam melaksanakan program preventif, diagnosis, maupun kuratif terhadap
commit to user
5 BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Virus Hepatitis C (HCV)
a. Klasifikasi HCV
HCV termasuk dalam famili Flaviviridae dan genus Hepacivirus
(ICTVdB, 2006). HCV dapat diklasifikasikan dalam beberapa genotipe dan
subtipe berdasarkan susunan gennya. Genotipe HCV dibedakan antara satu
dengan lainnya berdasarkan 31-33% perbedaan urutan nukleotida, sedangkan
subtipe dibedakan berdasarkan 20-25% perbedaan urutan nukleotida
(Simmonds et al., 2005). Saat ini terdapat tujuh genotipe HCV yang
diklasifikasikan menjadi beberapa subtipe, yaitu a, b, c, d, dan seterusnya
(Sharma, 2010; Simmonds et al., 2005).
b. Morfologi dan Komponen HCV
HCV termasuk virus yang berukuran kecil (kurang lebih 55-65 nm),
berbentuk sferis, dan memiliki selubung glikoprotein (Sharma, 2010). Genom
HCV merupakan RNA rantai tunggal positif sepanjang 9,6 kb dengan daerah
Open Reading Frame (ORF) yang diapit oleh 5’-Untranslated Region (UTR)
dan 3’-UTR (Lemon et al, 2007).
Poliprotein HCV yang dihasilkan secara fungsional dapat dibagi
menjadi tiga daerah, yaitu N-terminal, tengah, dan C-terminal. Daerah
commit to user
envelope glycoprotein 1 dan 2 (E1 dan E2). Daerah tengah terdiri atas protein
p7 dan NS2. Daerah C-terminal terdiri atas protein nonstruktural (NS3, NS4A,
NS4B, NS5A, dan NS5B) yang berfungsi penting dalam replikasi RNA
(Lemon et al, 2007; Sharma, 2010).
Ujung 5’-UTR diketahui sangat terkonservasi dan telah digunakan
dalam deteksi HCV secara klinis (Simmonds et al., 2005). Meskipun demikian,
regio ini tidak mampu mendiskriminasi subtipe secara akurat. Di sisi lain,
terdapat regio NS5B yang lebih potensial dalam membedakan subtipe HCV
dibandingkan 5’UTR. Heterogenitas pada sekuens NS5B lebih banyak,
sehingga NS5B memiliki akurasi yang lebih tinggi dalam mendeteksi subtipe
HCV (Baclig et al, 2010).
2. Hepatitis C pada Pekerja Seks Komersial Pria (Gigolo)
Kelompok yang berisiko terhadap penularan infeksi HCV dapat
diklasifikasikan menjadi tiga kelompok, yaitu kelompok dengan risiko tinggi,
sedang, dan rendah (Albeldawi et al., 2010, Jafari et al., 2010). Kelompok risiko
tinggi meliputi pengguna narkotika suntik, penderita hemofilia, penderita HIV,
serta pengguna tato dan tindik. Kelompok dengan risiko sedang meliputi resipien
transfusi darah, resipien transplantasi organ, dan bayi yang dilahirkan oleh ibu
dengan infeksi hepatitis C. Kelompok dengan risiko rendah terdiri atas kelompok
yang memiliki banyak pasangan seksual atau berhubungan seksual dengan orang
yang terinfeksi hepatitis C, serta pekerja kesehatan yang terpapar HCV melalui
commit to user
Penggunaan narkotika suntik dilaporkan sebagai rute utama yang
berperan dalam penularan infeksi HCV (Albeldawi et al., 2010; Roy et al.,
2001). Studi meta-analisis yang dikemukakan oleh Hagan et al. (2011)
menyebutkan bahwa prevalensi infeksi HCV pada pengguna narkotika suntik
bervariasi antara 40-90%. Jumlah ini jauh lebih besar dibandingkan prevalensi
infeksi HCV pada pengguna narkotika nonsuntik yang hanya berkisar 5% (Fuller
et al., 2004). Terkait dengan komunitas gigolo, Baral et al. (2010), menemukan
sebanyak 8% dari 50 gigolo di Moscow, Rusia, merupakan pengguna narkotika
suntik. Adapun di Australia, studi terhadap komunitas yang sama menemukan
17% (16/94) gigolo dengan anti-HCV positif memiliki riwayat sebagai pengguna
narkotika suntik (Estcourt et al., 2000).
Tato dan tindik merupakan faktor risiko tinggi lain dalam penularan
infeksi hepatitis C (Jafari et al., 2010; Roy et al., 2001). Pada penelitian Roy et
al. (2001), di antara 247 remaja jalanan di Kanada yang memiliki setidaknya
satu tato pada tubuh mereka, 10,3% positif anti-HCV, sedangkan di antara 342
remaja yang memiliki satu tindik atau lebih, 13,5% positif anti-HCV. Prevalensi
anti-HCV positif tersebut lebih besar dibandingkan angka seropositif HCV pada
remaja yang tidak menggunakan tato dan tindik, yaitu hanya 6,7% dari 284
remaja (Roy et al., 2001). Mengenai studi di Indonesia, sejauh yang peneliti
ketahui belum terdapat studi yang mengobservasi faktor risiko penggunaan
narkotika suntik, tato, maupun tindik pada komunitas gigolo.
Di samping risiko terinfeksi HCV melalui penggunaan narkotika suntik,
commit to user
seksual mereka. Penelitian tentang transmisi HCV melalui hubungan seksual
pada masyarakat umum dikemukakan oleh Kao et al. (2000) yang menemukan
adanya risiko penularan infeksi HCV di antara pasangan suami istri. Penelitian
lain juga mendapati kasus hepatitis C akut pada seorang istri yang telah menikah
selama 30 tahun dengan suami yang terinfeksi hepatitis C (Nishimura et al.,
2010). Risiko penularan HCV melalui aktivitas seksual ini akan meningkat
seiring bertambahnya jumlah pasangan seksual yang terlibat (Armstrong et al.,
2006).
Adapun penelitian yang mengobservasi prevalensi HCV pada komunitas
pekerja seks komersial terdapat dalam beberapa studi. Pada studi yang dilakukan
terhadap 1.527 pekerja seks komersial wanita di Korea Selatan, didapatkan 1,4%
partisipan dengan anti-HCV positif (Kweon et al., 2006). Semua subjek tidak
memiliki riwayat HIV positif maupun menggunakan narkotika suntik. Penelitian
serupa yang melibatkan 1.144 pekerja seks komersial wanita di Kongo
menunjukkan adanya prevalensi anti-HCV sebesar 6,6% (Laurent et al., 2001).
Studi lain yang dilakukan terhadap 625 pekerja seks komersial wanita di enam
kota di Argentina menunjukkan prevalensi hepatitis C sebesar 4,3% (Pando et
al., 2006).
Berbeda dengan penelitian pada pekerja seks komersial wanita, studi
tentang prevalensi HCV pada komunitas gigolo masih terbatas. Pada penelitian
Baral et al. (2010), 8% dari 50 gigolo di Moscow, Rusia, terinfeksi HCV.
Sementara itu, prevalensi HCV pada gigolo di Argentina sebesar 6,1% dari 82
commit to user
studi mengenai data epidemiologi HCV pada komunitas gigolo. Sejauh yang
peneliti peroleh, terdapat satu penelitian terkait HCV pada komunitas pekerja
seks di Indonesia, yaitu penelitian Basri et al. (2003) yang mengemukakan
prevalensi anti-HCV sebesar 9,1% pada 33 orang pekerja seks komersial wanita
di kota Padang.
3. Koinfeksi HCV dengan HIV
Hingga tahun 2007, diperkirakan 33 juta orang di dunia telah terinfeksi
HIV. Di Indonesia, jumlah penduduk yang terinfeksi HIV diperkirakan
meningkat menjadi 270.000 orang pada tahun 2007, di mana sebelumnya 93.000
orang pada tahun 2001 (UNAIDS, 2008). Dari seluruh orang yang terinfeksi
HIV di dunia, sekitar 4-5 juta orang mengalami koinfeksi dengan HCV
(Operskalski dan Kovacs, 2011). Adapun di Indonesia, belum terdapat data
resmi mengenai prevalensi koinfeksi HCV dengan HIV.
Terdapat rute penularan infeksi HIV yang hampir sama dengan infeksi
HCV, yaitu melalui penggunaan narkotika suntik dan hubungan seksual. Oleh
karena itu, kejadian koinfeksi HCV dengan HIV sangat mungkin terjadi (Chen et
al., 2011). Infeksi HIV berdampak signifikan terhadap riwayat alamiah penyakit
hepatitis C. Koinfeksi HIV dengan HCV dapat mempercepat tingkat kerusakan
hepar yang mengakibatkan elevasi ALT, mempercepat terjadinya sirosis hati,
serta meningkatkan risiko karsinoma hepatoseluler (Chen et al., 2011; Thomas et
al., 2000).
Terkait jalur penularan infeksi HIV dan HCV, terdapat koinfeksi HCV
commit to user
Amerika Serikat dan beberapa negara Eropa serta Asia (Operskalski dan Kovacs,
2011). Penggunaan tato dengan cara yang tidak aman juga disinyalir
berkontribusi dalam terjadinya koinfeksi HCV dengan HIV (Thomas et al.,
2011). Akan tetapi, berbeda dengan penggunaan narkotika suntik, koinfeksi
HCV terjadi kurang dari 15% pada populasi yang tertular HIV melalui hubungan
seksual (Operskalski dan Kovacs, 2011; Thomas et al., 2011).
B. Kerangka Pemikiran
Data awal epidemiologi HCV pada komunitas gigolo di Surakarta Komunitas gigolo di Surakarta
Faktor risiko transmisi HCV: 1. Aktivitas seksual dengan lebih
dari satu pasangan
2. Penggunaan narkotika suntik 3. Tato
4. Tindik
(Albeldawi et al., 2010; Armstrong et al., 2006; Baral et al., 2010; dos Ramos Farías et al., 2011; Jafari et al., 2010; Roy et al., 2001)
Skrining anti-HCV
Anti-HCV negatif
Amplifikasi sebagian genom HCV NS5B dengan Nested PCR
Anti-HCV positif
commit to user
11 BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian eksploratif dengan pendekatan
cross-sectional.
B. Lokasi penelitian
Deteksi serologi dilaksanakan di Laboratorium Mikrobiologi dan deteksi
molekuler dilakukan di Laboratorium Biomedik Fakultas Kedokteran Universitas
Sebelas Maret.
C. Subjek Penelitian
Subjek yang digunakan dalam penelitian ini adalah komunitas gigolo di
Surakarta. Subjek yang bersedia menandatangani surat persetujuan menjadi
partisipan studi serta informed consent untuk semua tindakan yang akan dilakukan,
dilibatkan dalam penelitian ini. Penelitian ini telah mendapatkan ethical clearance
dari Komisi Etik Penelitian Fakultas Kedokteran Universitas Sebelas Maret
Surakarta/RSUD Dr. Moewardi Surakarta.
D. Teknik Sampling
Teknik sampling yang digunakan dalam penelitian ini adalah non
probability sampling, menggunakan teknik quota sampling dengan jumlah sampel
commit to user E. Alur Kerja Penelitian
Sampel darah
Skrining dengan kit Ortho HCV Ab PA II®
Anti-HCV positif Anti-HCV negatif
Sintesis cDNA
Nested PCR
Elektroforesis Fraksinasi
Aliquot Plasma
Isolasi RNA HCV dari aliquot plasma
F. Instrumentasi Penelitian
1. Alat penelitian
a. Centrifuge (Eppendorf, Hamburg, Deutschland)
b. Mastercycler Personal® PCR (Eppendorf, Hamburg, Deutschland)
c. Micropipette (P1000, P200, P10) (Gilson, Middleton, WI)
d. Vortex (Thermo Fisher Scientific, Worcester, MA)
e. Digital scale (Mettler Toledo, Greifensee, Switzerland)
f. Autoclave (Hirayama, Saitama, Japan)
commit to user h. Magnetic stirrer (Biomega, Redding, CA)
i. Deepfreezer (New Brunswick Scientific, Edison, NJ)
j. Aparatus elektroforesis (chamber, comb, dan power supply) (BioRad,
Los Angeles, CA)
k. Gel DocTM XR (Bio-Rad, Hercules, CA)
l. Refrigerator (Sharp, Osaka, Japan)
m. Class II safety cabinet (ESCO, Portland, OR)
n. Tube rack
o. Beaker glass
2. Bahan penelitian
a. Filter tips RNase/DNase pyrogen free (10 l, 200 l, dan 1000 l)
b. Microcentrifuge tube 1,5 ml
c. PCR tube dan PCR cap
d. Polypropylene (PP) tube 15 ml
e. F96 MicroWell™ Plates (Nunc, Rochester, NY)
f. Sarung tangan
g. Masker
h. Kertas tisu
i. Bufer Tris-EDTA (TE) pH 8
j. Etidium bromida (EtBr) 0,5 μg/ml
k. Agarose
l. Bufer TAE (Tris-acetate EDTA) 1 x (Promega, Madison, WI)
commit to user n. Etanol 70% dan 96%
o. Kit Ortho HCV Ab PA II® (Fujirebio, Tokyo, Japan)
p. Kit PureLink™ Viral RNA/DNA (Invitrogen, Carlsbad, CA)
q. Kit SuperScript™ First-Strand Synthesis System Mix (Invitrogen,
Carlsbad, CA)
r. Kit Platinum® PCR SuperMix (Invitrogen, Carlsbad, CA)
s. Loading Quick®λ/Hind III digest, DNA-110 (Toyobo, Osaka, Japan)
t. Loading Quick®ϕX174/Hae III digest, DNA-112 (Toyobo, Osaka, Japan)
G. Cara Kerja
1. Fraksinasi Plasma Darah
Sampel darah disentrifugasi pada kecepatan 3.000 rpm selama 15
menit. Setelah itu, diperoleh tiga lapisan pada tabung. Lapisan pertama adalah
plasma darah, lapisan kedua merupakan peripheral blood mononuclear cell
(PBMC), dan lapisan ketiga adalah red blood cell (RBC). Plasma darah pada
lapisan pertama diambil sebanyak mungkin tanpa mengenai dua lapisan di
bawahnya, kemudian dibuat aliquot. Sebagian aliquot dipergunakan langsung
untuk skrining dan sebagian lain disimpan pada suhu –80°C.
2. Pemeriksaan Serologi HCV
Pemeriksaan serologi sampel darah untuk anti-HCV menggunakan kit
Ortho HCV Ab PA II® (Fujirebio). Satu mililiter reconstituting solution
dimasukkan ke dalam tabung control particles lyophilized, kemudian dicampur
menggunakan micropipette. Setelah itu, F96 MicroWell™Plates (Nunc)
commit to user
setiap sampel yang diperiksa. Dari ketiga well tersebut, pada well ke-1
dimasukkan 75 µl sample diluent, sedangkan pada well ke-2 dan ke-3
masing-masing dimasukkan 25 µl sample diluent. Plasma darah sebanyak 25 µl
dimasukkan ke dalam well ke-1 dan dicampur menggunakan micropipette.
Selanjutnya, transfer antar well dilakukan sebagai berikut: 25 µl larutan
diambil dari well ke-1, dimasukkan ke dalam well ke-2 dan dicampur
menggunakan micropipette; 25 µl larutan diambil dari well ke-2, dimasukkan
ke dalam well ke-3 dan dicampur menggunakan micropipette; dari well ke-3
diambil 25 µl larutan kemudian dibuang ke tempat sampah infeksius.
Selanjutnya, 25 µl control particle dimasukkan ke dalam well ke-2 dan 25 µl
sensitized particle dimasukkan ke dalam well ke-3. F96 MicroWell™Plates
(Nunc) ditutup dengan plastik dan diinkubasi selama dua jam pada suhu ruang.
Setelah dua jam, pola aglutinasi yang terjadi di dasar well diinterpretasi
sebagai berikut:
a. Positif dua (++): partikel yang teraglutinasi menyebar secara seragam di
dasar well dan dikelilingi lingkaran merah.
b. Positif satu (+): partikel membentuk pola cincin dengan garis terluar
terlihat kasar dan tidak teratur, serta dikelilingi lingkaran merah kecil.
c. Positif negatif (+-): partikel membentuk pola cincin bergaris luar halus
dengan lubang di tengah. Pada hasil seperti ini, dilakukan pemeriksaan
commit to user
d. Negatif (-): partikel membentuk titik di tengah dasar well dengan garis
luar halus, atau partikel membentuk pola cincin dengan lubang sangat
kecil di tengahnya dan bergaris luar halus.
3. Isolasi Asam Nukleat
Isolasi asam nukleat menggunakan kit PureLink™ Viral RNA/DNA
(Invitrogen).
a. Preparasi lisat untuk volume plasma 200 μl.
Dua puluh lima mikroliter Proteinase K, 200 μl cell-free sample, dan
200 μl Lysis Buffer dimasukkan ke dalam microcentrifuge tube steril. Setelah
itu, microcentrifuge tube ditutup dan di-vortex selama 15 detik. Kemudian,
lisat diinkubasi pada suhu 56°C selama 15 menit. Proses presipitasi
dilakukan dengan menambahkan 250 μl 96% etanol ke dalam tabung.
Selanjutnya, tabung ditutup dan di-vortex selama 15 detik. Lisat diinkubasi
pada suhu ruang selama lima menit.
b. Purifikasi lisat.
Lisat dipindahkan dari microcentrifuge tube ke Viral Spin Column
dalam tabung koleksi dan disentrifugasi pada 6.000 rpm selama satu menit.
Selanjutnya, cairan bersama tabung koleksi dibuang dan spin column
ditempatkan dalam Wash Tube baru. Spin column dicuci dengan 500 μl Wash
Buffer (W5) dan disentrifugasi pada kecepatan 6.000 rpm selama satu menit.
Cairan yang tertampung dalam Wash Tube dibuang dan Wash Tube
digunakan kembali. Spin column dicuci kembali dengan 500 μl Wash Buffer
commit to user
disentrifugasi pada 14.000 rpm selama satu menit untuk membuang sisa
Wash Buffer (W5). Kemudian, spin column diletakkan dalam 1,7 ml
Recovery Tube dan dielusi dengan 50 μl TE. Spin column diinkubasi pada
suhu ruang selama satu menit, kemudian disentrifugasi pada 14.000 rpm
selama satu menit. Setelah langkah tersebut, Recovery Tube berisi asam
nukleat virus murni sehingga spin column dapat dibuang. Asam nukleat
murni selanjutnya dapat disimpan pada suhu -80°C atau digunakan untuk
tahap berikutnya (Invitrogen, 2006).
4. Sintesis cDNA
Sintesis cDNA dari RNA menggunakan kit SuperScript™
First-Strand Synthesis System Mix (Invitrogen). Enam mikroliter asam nukleat
(RNA), 1 μl primer random hexamer, dan 1 μl Annealing Buffer dimasukkan
ke dalam PCR tube, kemudian diinkubasi pada suhu 65°C selama lima menit.
Setelah itu, campuran reaksi didinginkan pada suhu 4°C selama satu menit dan
di-spin down. Berikutnya, 10 μl 2X First-Strand Reaction Mix dan 2 μl
SuperScript® III/RNaseOUT™ Enzyme Mix ditambahkan ke dalam PCR tube,
dicampur menggunakan micropipette, kemudian di-spin down. Inkubasi
dilakukan selama 50 menit pada suhu 50°C dan reaksi diakhiri pada suhu 85°C
selama lima menit. Setelah didinginkan pada suhu 4°C, cDNA ini dapat
disimpan pada suhu –20°C atau langsung digunakan untuk PCR (Life
commit to user
5. Amplifikasi Sebagian Regio NS5B dengan Nested PCR
Nested PCR dilakukan menggunakan kit Platinum® PCR SuperMix
(Invitrogen). Pasangan primer oligonukleotida yang digunakan untuk
mengamplifikasi sebagian regio NS5B adalah hep31b, sense outer (5’-TGG
GST TCT CDT ATG AYA CC-3’); hep32, antisense outer (5’-GCD GAR
TAC CTG GTC ATA GC-3’); hep33b, sense inner (5’-AYA CCC GMT GYT
TTG ACT C-3’); hep34b, antisense inner (5’-CCT CCG TGA AKR CTC
KCA G-3’). Kode huruf standar yang digunakan sebagai alternatif basa adalah
D = A, G, atau T; K = G atau T; M = A atau C; R = A atau G; S = C atau G;
dan Y = C atau T.
Prosedur amplifikasi sebagian regio NS5B dengan Nested PCR dimulai
dengan mencairkan Platinum® PCR SuperMix (Invitrogen) pada suhu kamar,
kemudian dilakukan spin down. Selanjutnya, 4,5 μl cDNA ditambahkan pada
22,5 μl Platinum® PCR SuperMix (Invitrogen), 0,57 μl primer forward
(hep31b), dan 0,57 μl primer backward (hep32). Tahapan siklus Nested PCR
putaran pertama terdapat pada tabel 1.
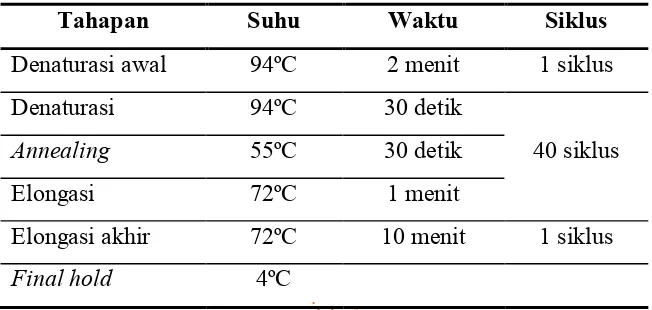
Tabel 1. Tahapan Siklus Nested PCR Putaran Pertama.
Tahapan Suhu Waktu Siklus
Denaturasi awal 94ºC 2 menit 1 siklus
Denaturasi 94ºC 30 detik
40 siklus
Annealing 55ºC 30 detik
Elongasi 72ºC 1 menit
Elongasi akhir 72ºC 10 menit 1 siklus
Final hold 4ºC
commit to user
Selanjutnya, diambil 2,5 μl produk PCR putaran pertama dan
ditambahkan pada 22,5 μl Platinum® PCR SuperMix (Invitrogen), 0,53 μl
primer forward (hep33b), dan 0,53 μl primer backward (hep34b). Tahapan
siklus Nested PCR putaran kedua terdapat pada tabel 2. Ukuran produk PCR
yang didapatkan dari Nested PCR putaran kedua adalah 328 bp.
Tabel 2. Tahapan Siklus Nested PCR Putaran Kedua.
Tahapan Suhu Waktu Siklus
Denaturasi awal 94ºC 2 menit 1 siklus
Denaturasi 94ºC 30 detik
40 siklus
Annealing 60ºC 30 detik
Elongasi 72ºC 1 menit
Elongasi akhir 72ºC 10 menit 1 siklus
Final hold 4ºC
(White et al., 2000).
6. Elektroforesis
Analisis produk Nested PCR dilakukan dengan elektroforesis pada
agarose 1,5% dalam larutan TAE. Untuk membuat 200 ml larutan agarose
1,5%, 3 gram agarose dimasukkan ke dalam beaker glass, kemudian
ditambahkan 1xTAE hingga 200 ml. Agarose tersebut dicairkan, setelah itu
dicampur menggunakan magnetic stirrer dalam keadaan panas dan
didinginkan hingga 55ºC sebelum dituangkan. EtBr ditambahkan hingga
mencapai konsentrasi 0,5 μg/ml, kemudian dicampur menggunakan magnetic
stirrer. Selanjutnya, agarose dituangkan ke dalam gel tray yang sudah
dipasangi comb dan didiamkan pada suhu kamar selama 15-20 menit sampai
commit to user
ke dalam electrophoresis chamber dan digenangi (sampai cukup tergenang)
dengan bufer TAE. Kemudian, 5 μl Loading Quick® λ/Hind III digest, DNA
-110 (Toyobo) dimasukkan ke dalam sumur pertama dan 5 μl Loading Quick®
ϕX174/Hae III digest, DNA-112 (Toyobo) dimasukkan ke dalam sumur kedua,
dilanjutkan 2,5 l produk Nested PCR ke dalam sumur berikutnya secara urut
sesuai nomor sampel. Elektroforesis dilakukan pada voltase 100 Volt selama
30 menit (Prasetyo, 2011).
H. Analisis Data
Analisis data terkait faktor risiko dan hasil pemeriksaan Nested PCR
commit to user
21 BAB IV
HASIL PENELITIAN
Dalam penelitian ini, telah dilakukan wawancara dan pemeriksaan darah
terhadap 30 gigolo di Surakarta pada bulan Mei hingga Juni tahun 2011. Hasil uji
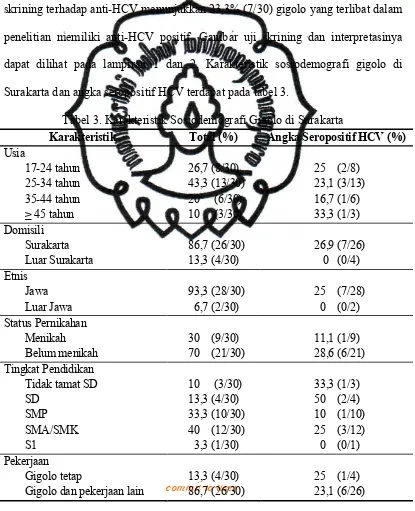
skrining terhadap anti-HCV menunjukkan 23,3% (7/30) gigolo yang terlibat dalam
penelitian memiliki anti-HCV positif. Gambar uji skrining dan interpretasinya
dapat dilihat pada lampiran 1 dan 2. Karakteristik sosiodemografi gigolo di
Surakarta dan angka seropositif HCV terdapat pada tabel 3.
Tabel 3. Karakteristik Sosiodemografi Gigolo di Surakarta
commit to user
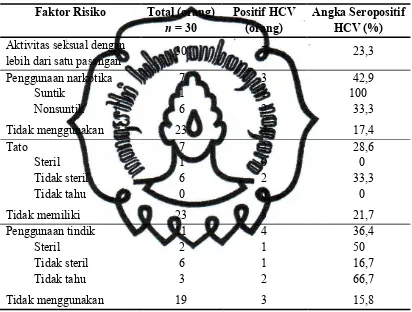
Faktor risiko penularan HCV yang diteliti dalam skripsi ini adalah aktivitas
seksual gigolo dengan lebih dari satu pasangan seksual, penggunaan narkotika
suntik, tato, dan tindik. Secara keseluruhan, faktor risiko transmisi HCV pada
gigolo di Surakarta dan angka seropositif HCV terangkum dalam tabel 4.
Tabel 4. Faktor Risiko Penularan HCV pada Komunitas Gigolo di Surakarta
Faktor Risiko Total (orang)
risiko. Berikut gambaran faktor risiko transmisi HCV yang terdapat pada gigolo
commit to user
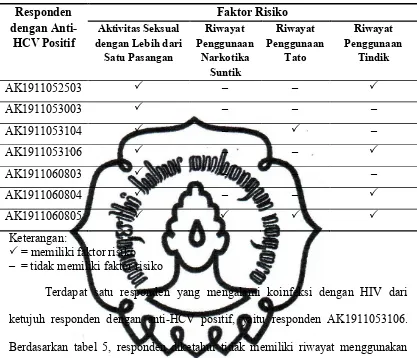
Tabel 5. Faktor Risiko Transmisi HCV pada Gigolo dengan Anti-HCV Positif
Responden
Terdapat satu responden yang mengalami koinfeksi dengan HIV dari
ketujuh responden dengan anti-HCV positif, yaitu responden AK1911053106.
Berdasarkan tabel 5, responden diketahui tidak memiliki riwayat menggunakan
narkotika suntik maupun tato. Faktor risiko yang dimiliki responden adalah
aktivitas seksual dengan lebih dari satu pasangan dan penggunaan tindik.
Sebelumnya, responden juga pernah melakukan operasi plastik pada daerah
hidung, bibir, dan dagu atas indikasi kosmetik di suatu salon kecantikan. Selain
mengalami koinfeksi dengan HIV, tujuh bulan sebelum wawancara dan
pemeriksaan darah dilakukan, responden juga sempat dirawat di rumah sakit
karena menderita tuberkulosis (TB) paru.
Faktor risiko aktivitas seksual dengan lebih dari satu pasangan dimiliki
commit to user
terlibat dengan gigolo di Surakarta tercantum dalam tabel 6. Pengklasifikasian
jumlah pasangan seksual tersebut disesuaikan dengan penelitian yang dilakukan
oleh Armstrong et al. (2006).
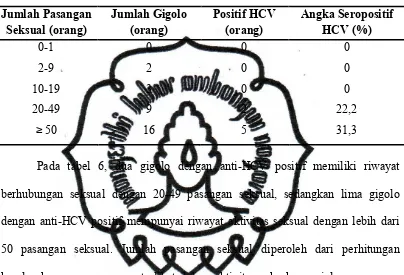
Tabel 6. Jumlah Pasangan Seksual Gigolo di Surakarta
Jumlah Pasangan
berhubungan seksual dengan 20-49 pasangan seksual, sedangkan lima gigolo
dengan anti-HCV positif mempunyai riwayat aktivitas seksual dengan lebih dari
50 pasangan seksual. Jumlah pasangan seksual diperoleh dari perhitungan
keseluruhan pasangan yang terlibat dalam aktivitas seks komersial maupun non
komersial dengan gigolo, berjenis kelamin pria dan wanita, Warga Negara Asing
(WNA), serta pasangan yang terlibat dalam pesta seks. Rincian jumlah pasangan
seksual tersebut dapat dilihat pada lampiran 4.
Mengenai faktor risiko penggunaan narkotika suntik, faktor ini hanya
dimiliki oleh satu dari tujuh gigolo dengan anti-HCV positif, yaitu
AK1911060805. Responden AK1911060805 menggunakan narkotika suntik saat
berada dalam penjara dan pernah menggunakannya secara bergantian dengan
penghuni penjara lain. Selama di penjara, responden menggunakan narkotika
commit to user
narkotika dan jarum suntik bersama pada komunitas gigolo di Surakarta
selengkapnya dapat dilihat pada lampiran 5.
Faktor risiko penggunaan tato terdapat pada dua orang gigolo dari tujuh
gigolo dengan anti-HCV positif. Hasil wawancara mengenai riwayat penggunaan
tato pada responden terdapat pada lampiran 6. Kedua responden dengan tato
tersebut adalah:
1. Responden AK1911053104
Responden melakukan prosedur tato di rumah dengan bantuan teman.
Responden mengaku menggunakan alkohol saat menato bagian tubuhnya, akan
tetapi jarum tato dipergunakan secara bergantian dengan lima orang teman yang
lain. Dengan demikian, tindakan tato responden AK1911053104 tergolong tidak
steril.
2. Responden AK1911060805
Responden mendapatkan tato saat di penjara. Tato diperoleh secara tidak
steril karena jarum tato digunakan secara bergantian dengan penghuni penjara lain.
Adapun faktor risiko penggunaan tindik terdapat pada empat orang gigolo
dari tujuh gigolo dengan anti-HCV positif. Data mengenai penggunaan tindik pada
responden dapat dilihat pada lampiran 7. Keempat gigolo dengan tindik tersebut
adalah:
1. Responden AK1911052503
Responden melakukan prosedur tindik di tempat komersial pada salah satu
pusat perbelanjaan. Responden mengaku tidak tahu secara pasti apakah prosedur
commit to user 2. Responden AK1911053106
Responden melakukan prosedur tindik di salah satu pusat perbelanjaan.
Responden mengaku tidak tahu apakah prosedur tindik dilakukan secara steril.
Akan tetapi, menurut responden jarum pada alat tindik yang saat itu digunakan
juga dimanfaatkan secara bergantian dengan orang lain.
3. Responden AK1911060804
Responden melakukan prosedur tindik di rumah. Responden menyatakan
bahwa tindik yang dilakukan telah melalui langkah yang steril dan jarum yang
digunakan untuk menindik tidak dipakai secara bergantian.
4. Responden AK1911060805
Responden melakukan prosedur tindik di rumah. Responden tidak
mengetahui secara pasti apakah telah melakukan prosedur sterilisasi secara benar.
Jarum yang dipergunakan untuk menindik tidak digunakan secara bergantian.
Sesuai alur kerja penelitian, sampel anti-HCV positif yang diperoleh dari
skrining awal selanjutnya dikonfirmasi dengan pemeriksaan Nested PCR. Hasil
pemeriksaan Nested PCR yang dilakukan tidak berhasil mengamplifikasi sebagian
gen HCV NS5B pada semua sampel anti-HCV positif. Gambar hasil elektroforesis
commit to user
27 BAB V
PEMBAHASAN
Deteksi HCV yang dilakukan pada penelitian ini telah melibatkan 30
gigolo di Surakarta. Deteksi tersebut dilakukan dengan skrining anti-HCV, di
mana hasil positif selanjutnya diperiksa dengan Nested PCR yang tujuannya
mengamplifikasi sebagian regio NS5B. Hasil dari pemeriksaan ini kemudian
disajikan secara deskriptif bersama faktor risiko penyebaran infeksi hepatitis C,
sehingga diharapkan dapat menghasilkan data awal epidemiologi infeksi hepatitis
C pada komunitas gigolo di Surakarta.
Skrining anti-HCV dan Nested PCR yang dilakukan terhadap sampel
plasma darah dapat mengarahkan pada diagnosis terjadinya infeksi hepatitis C akut
maupun kronis. Perbedaan antara infeksi hepatitis C akut dari infeksi kronis
tergantung dari presentasi klinis yang tampak pada penderita, misal adanya gejala
ikterus dan apakah terdapat riwayat peningkatan level serta durasi dari serum
alanine aminotransferase (ALT) (Ghany et al., 2009). Setelah terjadi paparan akut,
RNA HCV pada umumnya terdeteksi di dalam serum sebelum terbentuknya
antibodi terhadap HCV. RNA HCV tersebut dapat diidentifikasi sejak dua minggu
setelah terjadi paparan, sedangkan anti-HCV belum bisa terdeteksi hingga 8-12
minggu kemudian (Centers for Disease Control and Prevention, 2003; Ghany et
commit to user
Pada penelitian ini, diperoleh angka seropositif HCV pada tujuh responden
(23,3%) dan angka seronegatif HCV pada 23 responden (76,7%). Mengenai faktor
risiko yang diteliti, dideskripsikan bersama hasil pemeriksaan serologi dengan
anti-HCV positif. Faktor risiko penularan HCV yang dipilih adalah riwayat
aktivitas seksual dengan lebih dari satu pasangan, penggunaan narkotika suntik,
penggunaan tato, serta penggunaan tindik.
Pada responden yang memiliki faktor risiko berhubungan seksual dengan
20-49 pasangan, angka seropositif HCV diperoleh sebesar 22,2% (2/9). Adapun
pada responden yang melakukan aktivitas seksual dengan lebih dari atau sama
dengan 50 pasangan, angka seropositif HCV didapatkan sebesar 31,3% (5/16). Hal
tersebut menunjukkan bahwa anti-HCV positif lebih banyak ditemui pada
responden dengan jumlah pasangan seksual terbanyak, yaitu lebih dari 50 orang.
Hasil demikian sejalan dengan penelitian Armstrong et al. (2006).
Pada faktor risiko penggunaan narkotika dalam komunitas gigolo, angka
seropositif HCV didapatkan sebesar 42,9% (3/7). Faktor risiko pemakaian
narkotika ini terbagi menjadi narkotika suntik dan nonsuntik. Angka seropositif
HCV pada gigolo yang menggunakan narkotika suntik adalah 100% (1/1),
sedangkan pada gigolo yang memakai narkotika nonsuntik adalah 33,3% (2/6).
Pada gigolo yang tidak menggunakan narkotika jenis apapun, angka seropositif
HCV diperoleh sebesar 17,4% (4/23). Sebelumnya diketahui bahwa penggunaan
narkotika suntik merupakan salah satu rute utama dalam penularan infeksi HCV
(Albeldawi et al., 2010). Pada penelitian Quaglio et al. (2003) juga didapatkan
commit to user
dibandingkan pengguna narkotika nonsuntik, yaitu 81,6% banding 20%. Oleh
karena itu, hasil yang berbeda dari penelitian ini dimungkinkan karena jumlah
responden yang diteliti jauh lebih sedikit dibandingkan penelitian Quaglio et al.
(2003) maupun penelitian lain dengan hasil yang serupa.
Adapun angka seropositif HCV pada gigolo yang memiliki tato adalah
28,6% (2/7). Pada gigolo yang tidak memiliki tato, angka seropositif HCV 21,7%
(5/23). Semua gigolo yang menato bagian tubuh mereka tidak melakukan prosedur
sterilisasi sebelumnya. Pada penelitian Roy et al. (2001), angka seropositif HCV
pada kelompok yang memiliki tato adalah 18,2%, lebih besar jika dibandingkan
angka seropositif HCV pada kelompok yang tidak memiliki tato (5,3%). Hasil
yang diperoleh dalam penelitian ini sesuai dengan studi yang dilakukan oleh Roy
et al. (2001). Roy et al. (2001) dan Jafari et al. (2010) juga mengemukakan bahwa
terdapat peningkatan risiko terjadinya infeksi hepatitis C pada seseorang yang
mendapatkan tato secara tidak profesional atau tidak melalui prosedur sterilisasi.
Pada gigolo dengan faktor risiko penggunaan tindik, angka seropositif
HCV diperoleh sebesar 36,4% (4/11), sedangkan pada gigolo yang tidak
menggunakan tindik diperoleh lebih kecil, yaitu 15,8% (3/19). Dari 11 gigolo yang
menggunakan tindik, terdapat dua orang yang menempuh prosedur steril,
sedangkan enam orang tidak melakukan secara steril dan tiga orang lainnya tidak
tahu secara pasti apakah mereka sudah melewati prosedur yang steril. Hasil
penelitian ini sesuai dengan penelitian Chaudhry et al. (2010) dan Roy et al.
commit to user
ditemui pada kelompok yang menggunakan tindik dibandingkan kelompok yang
tidak menggunakan tindik.
Anti-HCV positif menunjukkan terjadinya infeksi hepatitis C di masa lalu
atau saat ini (Centers for Disease Control and Prevention, 2003). Sesuai algoritma
dari kerangka pemikiran yang telah disusun sebelumnya, sampel dengan anti-HCV
positif diuji dengan Nested PCR. Setelah produk PCR divisualisasi dengan
elektroforesis, tidak didapatkan sampel dengan PCR positif. Interpretasi hasil
deteksi hepatitis C di mana anti-HCV positif dengan PCR negatif, menunjukkan
adanya infeksi hepatitis C akut dengan viremia rendah, infeksi HCV yang telah
diobati, kondisi non-viremia pada infeksi hepatitis C kronis, atau adanya hasil
negatif palsu akibat kesalahan prosedur laboratorium (Albeldawi et al., 2010;
Centers for Disease Control and Prevention, 2003; Ghany et al., 2009).
Dalam penelitian ini, kemungkinan hasil negatif palsu akibat kesalahan
prosedur laboratorium dapat dieliminasi, mengingat pemeriksaan serologi dan
Nested PCR telah diulang beberapa kali. Di samping itu, kontrol amplifikasi
eksternal juga sudah digunakan dalam Nested PCR. Pada deteksi molekuler
terhadap sebagian gen E1-E2 HCV, Nested PCR juga memberikan hasil yang
negatif meskipun telah menggunakan sampel dan kit yang sama. Oleh karena itu,
hal tersebut menyingkirkan kemungkinan adanya kontaminasi pada sampel,
kerusakan kit dan primer, maupun kesalahan dalam teknik penelitian.
Pada seseorang dengan infeksi hepatitis C aktif, terdapat situasi tertentu di
mana hasil PCR dapat menjadi negatif (Centers for Disease Control and
commit to user
sedangkan titer anti-HCV meningkat selama fase infeksi akut. Dengan demikian,
RNA HCV dapat tidak terdeteksi pada orang tertentu selama fase akut infeksi
hepatitis C. Di samping itu, terdapat penelitian yang telah mengobservasi penderita
dengan infeksi hepatitis C kronis dan ditemukan hasil positif RNA HCV yang
intermiten (Thomas et al., 2000). Oleh karena itu, dengan tidak adanya informasi
klinis tambahan, maka makna dari suatu hasil negatif RNA HCV belum dapat
diketahui dan perlu dilakukan pemantauan lebih lanjut (Centers for Disease
Control and Prevention, 2003).
Hasil PCR negatif juga dapat mengindikasikan adanya infeksi HCV yang
sudah diobati. Telah diketahui bahwa 15-25% dapat mengalami kesembuhan
sehingga hasil PCR menjadi negatif (Alter dan Seeff, 2000). Oleh karena itu,
untuk menentukan apakah infeksi hepatitis C pada seseorang telah teratasi, harus
ditunjukkan melalui hasil negatif dari pemeriksaan PCR yang dilakukan dalam 4-6
bulan berikutnya (Ghany et al., 2009).
Pada penderita infeksi hepatitis C kronis, viremia dapat diklasifikasikan
menjadi tiga derajat, yaitu viremia ringan dengan level RNA HCV < 106 kopi/ml,
viremia sedang dengan level RNA HCV 106-108 kopi/ml, dan viremia berat
dengan level RNA HCV > 108 kopi/ml (Rahman dan Mannan, 2010). Dalam hal
ini, hasil PCR dapat menjadi negatif pada pasien hepatitis C kronis dengan viremia
ringan terkait level RNA HCV yang rendah (Scott et al., 2006). Di samping itu,
terdapat penelitian pada pasien hepatitis C kronis di Jepang dengan RNA HCV
seronegatif yang sebelumnya seropositif, setelah enam dari 310 pasien tersebut
commit to user
al., 1999). Pada kondisi tersebut, level viremia pada pasien hepatitis C kronis tidak
dipengaruhi oleh derajat kerusakan pada hepar, kecuali pada beberapa pasien yang
memasuki stadium akhir penyakit hepar, di mana pasien tersebut memiliki level
RNA HCV yang rendah bahkan mungkin tidak terdeteksi (Pawlotsky, 2002;
Rahman dan Mannan, 2010). Penurunan kadar viremia pada penyakit hepar
stadium akhir ini lebih dimungkinkan akibat terjadinya deplesi pada sel-sel
hepatosit dan fibrosis hepar yang meluas, daripada adanya perubahan struktur
virus (Pawlotsky, 2002).
Selain faktor viremia rendah dan infeksi HCV yang sudah diobati, terdapat
faktor lain yang dapat menyebabkan RNA HCV terdeteksi negatif pada sampel
responden. Faktor tersebut adalah adanya variasi atau polimorfisme yang terlibat
dalam respon imun yang berkontribusi pada kemampuan tubuh untuk
mengeliminasi virus (Ge et al., 2009). Hal ini disimpulkan dari penelitian genome
wide association study (GWAS) yang berhasil mengidentifikasi adanya single
nucleotide polymorphism (SNP) pada kromosom 19q13, yaitu rs12979860, yang
terkait kuat dengan terjadinya sustained virological response (SVR) pada infeksi
hepatitis C kronis dan pembersihan HCV spontan pada fase infeksi akut (Ge et al.,
2009; Thomas et al., 2009). SVR tercapai apabila RNA HCV pasien tetap negatif
setelah enam bulan pasca pengobatan hepatitis C (Veldt et al., 2007). Individu
yang memiliki genotipe C/C pada SNP rs12979860 berkesempatan mencapai
status SVR hingga tiga kali lipat lebih besar dibandingkan pasien lain dengan
genotipe C/T dan T/T. Hal ini mengindikasikan bahwa alel C dapat mendukung
commit to user
SNP rs12979860 terletak 3 kb upstream dari gen interleukin-28B (IL-28B)
yang menyandi interferon (IFN)-λ3 (Ge et al., 2009). IFN-λ3 termasuk dalam
keluarga sitokin IFN-λ yang berperan sebagai sitokin antivirus endogen. Saat sel
hepatosit terinfeksi RNA HCV, akan terbentuk protein retinoid-acid inducible
gene 1 (RIG1) dan Toll-like receptor 3 (TLR3) dalam sitoplasma hepatosit, suatu
protein yang berfungsi sebagai pattern recognition receptor yang dapat
mendeteksi adanya infeksi virus. Keduanya mengaktifkan faktor transkripsi
interferon regulatory factor 3 (IRF3) dan IRF 7 yang berfungsi sebagai sinyal
terhadap nukleus hepatosit untuk membentuk IFN-α dan IFN-β. Sebagai respon
terhadap sinyal tersebut, gen IL28B pada kromosom 19 juga mengekspresikan
IFN-λ3. IFN-α dan IFN-β kemudian ditranspor ke luar sel untuk berikatan dengan
reseptor IFN tipe I yang terdapat pada membran sel hepatosit dan
antigen-presenting cell (APC), sedangkan IFN-λ3 berikatan dengan reseptor IFN tipe III.
Ikatan pada reseptor tersebut mengaktifkan jalur transduksi sinyal Janus
kinase-signal transducer and activator of transcription (JAK-STAT) yang memicu
pembentukan molekul efektor interferon-stimulated genes (ISGs). ISGs ini
selanjutnya berperan dalam menghambat replikasi HCV (Balagopal et al., 2010;
Gonzalez dan Keffe, 2011).
Selain rs12979860, sejauh ini terdapat sembilan SNP lain pada gen IL-28B
yang telah berhasil diidentifikasi. SNP tersebut adalah rs12980275, rs8105790,
rs11881222, rs8103142, rs28416813, rs4803219, rs8099917, rs7248668,
rs10853728 (Chen et al., 2011; Ito et al., 2011; Lin et al., 2011). Dari kesembilan
commit to user
akhir pengobatan infeksi hepatitis C, yaitu rs8099917 (Balagopal et al., 2010;
Chen et al., 2011). SNP rs8099917 terletak 8 kb upstream dari gen IL-28B
(Balagopal et al., 2010; Mahboobi et al., 2011). Akan tetapi, terdapat sebuah studi
meta-analisis yang melaporkan bahwa SNP rs12979860 lebih erat kaitannya
dengan pencapaian SVR pada pasien hepatitis C kronis dibandingkan SNP
rs8099917 (Lin et al., 2011; Mahboobi et al., 2011).
Meskipun mekanisme inhibisi replikasi HCV yang dimediasi oleh IFN-λ3
telah dipahami, namun sampai saat ini masih belum jelas bagaimana polimorfisme
pada gen IL28B meregulasi aktivitas dan fungsi dari IFN-λ3 sehingga terdapat
respon yang berbeda pada beberapa orang yang terinfeksi hepatitis C. Sejauh ini,
penelitian yang dikemukakan oleh Ge et al. (2009), Gonzalez dan Keffe (2011),
serta Thomas et al. (2009), hanya menyimpulkan bahwa adanya polimorfisme
pada IL28B dapat mendukung terjadinya pembersihan spontan HCV pada fase
akut dan memprediksi hasil terapi pada pasien hepatitis C kronis. Dengan
demikian, polimorfisme tersebut dapat berdampak pada status klinis pasien yang
terinfeksi HCV, sehingga pada individu-individu tertentu hasil pemeriksaan PCR
commit to user
35 BAB VI
SIMPULAN DAN SARAN
A. Simpulan
1. Dua puluh tiga koma tiga persen dari 30 gigolo di Surakarta memiliki
anti-HCV positif.
2. Gigolo dengan HCV seropositif mempunyai faktor risiko terinfeksi HCV
melalui aktivitas seksual dengan lebih dari satu pasangan, penggunaan
narkotika suntik, tato, dan tindik.
3. Deteksi dengan Nested PCR pada sebagian gen HCV NS5B menunjukkan
hasil yang negatif pada semua sampel HCV seropositif.
B. Saran
1. Penelitian mengenai deteksi HCV ini diharapkan dapat dilanjutkan dengan
komunitas gigolo yang lebih besar dan mencakup wilayah yang lebih luas.
2. Hasil penelitian ini diharapkan dapat dimanfaatkan oleh petugas kesehatan
dan pihak terkait dalam melakukan sosialisasi peningkatan status
commit to user
36
DAFTAR PUSTAKA
Albeldawi M., Rodriguez E.R., Carey W.D. 2010. Hepatitis C virus: prevention, screening, and interpretation of assays. Cleaveland Clin J Med. 77:616-626.
Alter M.J. 2007. Epidemiology of hepatitis C infection. World J Gastroenterol. 13:2436-2441.
Alter H.J. and Seeff LB. 2000. Recovery, persistence, and sequelae in hepatitis C virus infection: a perspective on long-term outcome. Semin Liver Dis. 20:17–35.
Armstrong G.L., Wasley A., Simard E.P., McQuillan G.M., Kuhnert W.L., Alter M.J. 2006. The prevalence of hepatitis C virus infection in the United States, 1999 through 2002. Ann Intern Med. 144:705-714.
Baclig M.O., Chan V.F., Ramos J.D.A., Cervantes J.G., Natividad F.F. 2010. Correlation of the 5’untranslated region (5’UTR) and non-structural 5B (NS5B) nucleotide sequences in hepatitis C virus subtyping. Int J Mol Epidemiol Genet. 1:236-244.
Balagopal A., Thomas D.L., Thio C.L. 2010. IL28B and the control of hepatitis C virus infection. J Gastro. 139:1865–1876.
Balogun T.M., Emmanuel S., Wright K.O. 2010. Hepatitis C virus co infection in HIV positive patients. Nig Q J Hosp Med. 20:117-120.
Baral S., Kizub D., Masenior N.F., Peryskina A., Stachowiak J., Stibich M., Moguilny V., et al. 2010. Male sex workers in Moscow, Russia: a pilot study of demographics, substance use patterns, and prevalence of HIV-1 and sexually transmitted infections. AIDS Care. 1:112–118.
Basri H, Zubir N, Julius. 2003. Gambaran HbsAg dan anti-HCV pada pekerja seks komersil di kota Padang. Acta Med Indones. 25: 140-143.
Cantaloube J.F., Laperche S., Gallian P., Bouchardeau F., de Lamballerie X., de Micco1 P. 2006. Analysis of the 5’noncoding region versus the NS5B region in genotyping hepatitis C virus isolates from blood donors in France. J Clin Microbiol. 44:2051-2056.
commit to user
Chaudhry M.A., Rizvi F., Afzal M., Ashraf M.Z., Niazi S., Beg A., Kharal T.H. 2010. Frequency of risk factors for hepatitis B (HBV) and hepatitis C virus (HCV). Ann Pak Inst Med Sci. 6:161-163.
Chen J.J., Yu C.B., Du W.B., Li L.J. 2011. Prevalence of hepatitis B and C in HIV-infected patients: a meta-analysis. Hepatobiliary Pancreat Dis Int. 10:122-127.
Chen J.Y., Lin C.Y., Wang C.M., Lin Y.T., Kuo S.N., Shiu C.F., Chang S.W., et al. 2011. IL28B genetic variations are associated with high sustained virological response (SVR) of interferon-α plus ribavirin therapy in Taiwanese chronic HCV infection. Genes Immun. 12:300-309.
Chevaliez S., Alias M.B., Brillet R., Pawlotsky J.M. 2009. Hepatitis C virus transmitted infections among trans (male to female transvestites, transsexuals, or transgender) and male sex workers in Argentina: high HIV, HPV, HBV, and syphilis prevalence. Int J Infect Dis. 15:635-640.
Estcourt C.S., Marks C., Rohrsheim R., Johnson A.M., Donovan B., Mindel A. 2000. HIV, sexually transmitted infections, and risk behaviours in male commercial sex workers in Sydney. Sex Transm Inf. 76:294-298.
Fuller C.M., Ompad D.C., Galea S., Wu Y., Koblin B., Vlahov D. 2004. Hepatitis C incidence—a comparison between injection and noninjection drug users in New York city. J Urban Health. 81:20-24.
Ge D., Fellay J., Thompson A.J., Simon J.S., Shianna K.V., Urban T.J., Heinzen E.L., et al. 2009. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 461:399-401.
Ghany M.G., Strader D.B., Thomas D.L., Seeff L.B. 2009. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology. 49:1335-1374.
commit to user
Hagan H., Pouget E.R., Jarlais D.C.D. 2011. A systematic review and meta-analysis of interventions to prevent hepatitis C virus infection in people who inject drugs. J Infect Dis. 204:74-83.
ICTVdB. 2006. Index of Viruses-Flaviviridae. In : ICTVdB-The Universal Virus Database, version 4. Büchen-Osmond, C (Ed), Columbia University, New York, USA. http://www.ncbi.nlm.nih.gov/ICTVdb/Ictv/fs_index.htm. (1 Januari 2011).
Invitrogen. 2006. PureLink™ Viral RNA/DNA Kits. http://tools.invitrogen.com/ content/sfs/manuals/purelink_viral_rna_dna_man.pdf. (19 Januari 2011).
Ito K., Higami K., Masaki N., Sugiyama M., Mukaide M., Saito H., Aoki Y., et al. 2011. The rs8099917 polymorphism, when determined by a suitable genotyping method, is a better predictor for response to pegylated alpha interferon/ribavirin therapy in Japanese patients than other single nucleotide polymorphisms associated with interleukin-28b. J Clin Microbiol. 49:1853-1860.
Jafari S., Copes R., Baharlou S., Etminan M., Buxton J. 2010. Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis. Int J Infect Dis. 1145:xxx.e1–xxx.e13.
Kao J.H., Liu C.J., Chen P.J., Chen W., Wang T.H., Chen D.S. 2000. Low incidence of hepatitis C virus transmission between spouses: a prospective study. J Gastroenterol Hepatol. 15:391–395.
Kweon S.S., Shin M.H., Song H.J., Jeon D.Y., Choi J.S. 2006. Seroprevalence and risk factors for hepatitis C virus infection among female commercial sex workers in South Korea who are not intravenous drug users. Am J Trop Med Hyg. 74:1117-1121.
Laurent C., Henzel D., Kabeya C.M., Maertens G., Larouzé B., Delaporte E. 2001. Seroepidemiological survey of hepatitis C virus among commercial sex workers and pregnant women in Kinshasa, Democratic Republic of Congo. Int J Epid. 30:872-877.
Lemon S.M., Walker C., Alter M.J., Yi M.K. 2007. Hepatitis C Virus. In : Knipe D.M. and Howley P.M. (eds). Fields Virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins, pp: 1254-1265.
commit to user
Lin C.Y., Chen J.Y., Lin T.N., Jeng W.J., Huang C.H., Huang C.W., Chang S.W., et al. 2011. IL28B SNP rs12979860 is a critical predictor for on-treatment and sustained virologic response in patients with hepatitis C virus
genotype-1 infection. PLoS ONE. 6: e18322.
doi:10.1371/journal.pone.0018322.
Mahboobi N., Behnava B., Alavian S.M. 2011. IL28B SNP genotyping among Iranian HCV-infected patients: a preliminary report. Hepat Mon. 11:386-387.
Murphy D.G., Willems B., Deschênes M., Hilzenrat N., Mousseau R., Sabbah S. 2007. Use of sequence analysis of the NS5B region for routine genotyping of hepatitis C virus with reference to C/E1 and 5’ untranslated region sequences. J Clin Microbiol. 45:1102–1112.
Nishimura N., Isoda N., Higashizawa T., Otake T., Tsukui M., Nagashima S., Takahashi M. 2010. A case of acute hepatitis C caused by interspousal transmission after 30 years of marriage. Clin J Gastroenterol. 3:50–56.
Operskalski E.A. and Kovacs A. 2011. HIV/HCV co-infection: pathogenesis, clinical complications, treatment, and new therapeutic technologies. Curr HIV/AIDS Rep. 8:12-22.
Pando M.A., Berini C., Bibini M., Fernandez M., Reinaga E., Maulen S., Marone R., et al. 2006. Prevalence of HIV and other sexually transmitted infections among female commercial sex workers in Argentina. Am J Trop Med Hyg. 74:233–238.
Pawlotsky J.M. 2002. Use and interpretation of virological tests for hepatitis C.
Hepatology. 36:S65-S73.
Prasetyo A.A. 2011. Teknik Biologi Molekuler Dasar. Surakarta: LPP UNS dan UNS Press, pp: 94-95.
Quaglio G., Lugoboni F., Pajusco B., Sarti M., Talamini G., Lechi A., Mezzelani P., et al. 2003. Factors associated with hepatitis C virus infection in injection and noninjection drug users in Italy. Clin Infect Dis. 37:33-40.
Rahman M.A. and Mannan S.R. 2010. Degree of viremia and liver histology in chronic hepatitis C. AKMMC J. 1:17-20.
commit to user
Schnuriger A., Dominguez S., Valantin M.A., Tubiana R., Duvivier R., Ghosn J., Simon A., et al. 2006. Early detection of hepatitis C virus infection by use of a new combined antigen-antibody detection assay: potential use for high-risk individuals. J Clin Microbiol. 44:1561-1563.
Scott J.D., McMahon B.J., Bruden D., Sullivan D., Homan C., Christensen C., Gretch D. 2006. High rate of spontaneous negativity for hepatitis C virus RNA after establishment of chronic infection in Alaska natives. Clin Infec Dis. 42:945-952.
Sharma S.D. 2010. Hepatitis C virus: molecular biology and current therapeutic options. Indian J Med Res. 131:17-34.
Simmonds P., Bukh J., Combet C., Deléage G., Enomoto N., Feinstone S., Halfon P., et al. 2005. Consensus proposal for a unified system of nomenclature of hepatitis C virus genotype. Hepatology. 42:962-973.
Thomas D.L., Astemborski J., Rai R.M., Anania F.A, Schaeffer M., Galai N., Nolt K., et al. 2000. Natural history of hepatitis C virus infection: host, viral, and environmental factors. J Am Med Assoc. 284:450-456.
Thomas D.L., Leoutsakas D., Zabransky T., Kumar M.S. 2011. Hepatitis C in HIV-infected individuals: cure and control, right now. J Int AIDS Soc. 14:1-8.
Thomas D.L., Thio C.L., Martin M.P., Qi Y., Ge D., O’huigin C., Kidd J. 2009. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 461:798-801.
UNAIDS. 2008. Report on the Global AIDS Epidemic.
http://www.unaids.org/en/media/unaids/contentassets/dataimport/pub/globa lreport/2008/jc1510_2008globalreport_en.zip. (5 Desember 2011).
Veldt B.J., Heathcote E.J., Wedemeyer H., Reichen J., Hofmann W.P., Zeuzem S., Manns M.P., et al. 2007. Sustained virologic response and clinical outcomes in patients with chronic hepatitis C and advanced fibrosis. Ann Intern Med. 147:677-684.
White P.A., Zhai X., Carter I., Zhao Y., Rawlinson W.D. 2000. Simplified hepatitis C virus genotyping by heteroduplex mobility analysis. J Clin Microbiol. 38:477-482.
WHO. 2003. Global Alert and Response: Hepatitis C.
commit to user