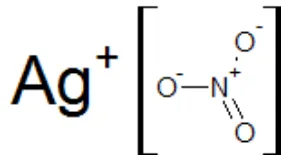i
PENGARUH PENAMBAHAN ION LOGAM Ag
+TERHADAP
AKTIVITAS ENZIM TRIPSIN
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan
Alam
Universitas Negeri Yogyakarta Untuk Memenuhi
Sebagian Persyaratan Guna Memperoleh
Gelar Sarjana Sains Kimia
Oleh :
TITIK TRI WIJAYANTI
12307144032
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
v MOTTO
“dan bahwasanya seorang manusia tiada memperoleh selain
apa yang telah diusahakannya”
(QS. An-Najm: 39)
“ Hai orang-orang beriman, mintalah pertolongan (kepada
Allah) dengan sabar dan shalat, sesungguhnya Allah beserta orang-orang yang sabar”
(QS. Al-Baqarah: 153)
“sesungguhnya sesudah kesulitan itu ada kemudahan”
vi
HALAMAN PERSEMBAHAN
Skripsi ini saya persembahkan untuk:
Bapak Djadug Wijono dan Ibu Suparni
Atas doa dan kasih sayang yang tak pernah putus. terima kasih atas semua yang telah diberikan. Semoga Umi dan Bapak bisa bangga denganku.
Kakakku, Pebriyani Puji Hastuti dan Jadhiyono Dwi Kassulat Terima kasih atas kasih sayang dan bimbingannya untuk adikmu ini.
My Partner in Crime, Deni Rachmat Sabani atas dukungan, kesabaran dan
waktunya.
Kirana, Mufti, dan Nurul atas kerja samanya menyelesaikan penelitian ini.
Sika, Sari, Mufti, Della, Ismi, Buperi, Fitri, teman-teman KWB (Fia, Tika, Bebi, Bembi, Mamak, Bendot, mbak Kar, Prili, Sita, Nadoy), teman-teman Keluarga Cemara, teman-teman KMS Reg. Jogja dan teman-teman Kimia Swadana 2012,
vii
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT, atas limpahan rahmat dan hidayah-Nya
sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh
Penambahan Ion Logam Ag+ terhadap Aktivitas Enzim Tripsin”. Penulis
menyadari bahwa dari masa kuliah hingga terselesaikannya skripsi ini tidak lepas
dari bantuan, bimbingan dan arahan dari banyak pihak. Oleh karena itu, penulis
mengucapkan terima kasih kepada:
1. Bapak Dr. Hartono, selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan
Alam Universitas Negeri Yogyakarta.
2. Bapak Drs. Jaslin Ikhsan, M.App.Sc., Ph.D. selaku Ketua Jurusan Pendidikan
Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri
Yogyakarta.
3. Ibu Eddy Sulistyowati, Apt., MS. selaku dosen penasehat akademik, dosen
pembimbing skripsi, dan ketua penguji yang telah memberikan bimbingan,
arahan dan saran.
4. Ibu Dr. Das Salirawati, M.Si selaku penguji utama, atas pertanyaan, kritik, dan
saran yang diberikan.
5. Ibu C. Budimarwanti, M.Si selaku penguji pendamping, atas pertanyaan,
kritik, dan saran yang diberikan.
6. Bapak Erfan Priyambodo, M.Si selaku sekretaris penguji, atas pertanyaan,
kritik, dan saran yang diberikan.
7. Seluruh Dosen, Staff dan Laboran Jurusan Pendidikan Kimia FMIPA UNY
viii
8. Semua pihak yang telah membantu dan memberikan dukungan secara moral
maupun material dalam penyelesaian tugas akhir skripsi ini, yang tidak dapat
penulis sebut satu per satu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari
kesempurnaan, sehingga penulis mengharap kritik dan saran yang bersifat
membangun. Semoga skripsi ini bermanfaat bagi pembaca dan almamater.
Yogyakarta, Desember 2016
ix DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN PERSETUJUAN ... ii
HALAMAN PERNYATAAN... iii
HALAMAN PENGESAHAN ... iv
DAFTAR LAMPIRAN ... xiii
x
H. Penentuan Kadar Protein ... 20
I. Penentuan Aktivitas Enzim Tripsin dengan Metode Anson ... 22
J. Penelitian yang Relevan ... 23
K. Kerangka Berfikir ... 24
BAB III. METODE PENELITIAN ... 26
A. Subjek dan Objek Penelitian ... 26
B. Variabel Penelitian ... 26
C. Alat dan Bahan Penelitian ... 26
D. Prosedur Penelitian ... 30
E. Teknik Analisa Data ... 37
BAB IV. HASIL DAN PEMBAHASAN ... 38
A. Hasil Penelitian ... 38
B. Pembahasan ... 45
BAB V. KESIMPULAN DAN SARAN ... 68
A. Kesimpulan ... 68
B. Saran ... 68
DAFTAR PUSTAKA ... 69
xi
DAFTAR TABEL
Halaman
Tabel 1. Hasil Penentuan pH Optimum Enzim Tripsin ... 40
Tabel 2. Hasil Penentuan Suhu Optimum Enzim Tripsin... 41
Tabel 3. Hasil Penentuan Waktu Inkubasi Optimum Enzim Tripsin ... 42
Tabel 4. Hasil Penentuan Konsentrasi Substrat Optimum Enzim Tripsin... 43
Tabel 5. Aktivitas Enzim Tripsin pada Kondisi Optimum ... 44
Tabel 6. Aktivitas Enzim Tripsin dengan Penambahan Ion Logam Ag+ dalam bentuk Senyawa AgNO3 ... 45
xii
Gambar 4. Reaksi Hidrolisis oleh Enzim Tripsin... 11
Gambar 5. Pengaruh Konsentrasi Enzim terhadap Aktivitas Enzim ... 13
Gambar 6. Pengaruh Konsentrasi Substrat terhadap Kecepatan Reaksi ... 14
Gambar 7. Pengaruh Suhu terhadap Aktivitas Enzim ... 15
Gambar 8. Pengaruh pH terhadap Aktivitas Enzim ... 16
Gambar 9. Struktur Perak Nitrat... 19
Gambar 10. Reaksi Protein dengan Cu2+ ... 21
Gambar 11. Reaksi Oksidasi Tirosin ... 22
Gambar 12. Reaksi Reduksi Fosfotungstat Menjadi Tungsten dan Fosfomolibdat Menjadi Molibdenum Biru ... 22
Gambar 13. Kurva Standar Protein ... 39
Gambar 14. Hubungan Panjang Gelombang dan Absorbansi Kasein ... 47
Gambar 15. Hubungan pH dengan Aktivitas Enzim Tripsin ... 49
Gambar 16. Hubungan Suhu dengan Aktivitas Enzim Tripsin ... 51
Gambar 17. Hubungan Waktu Inkubasi dengan Aktivitas Enzim Tripsin ... 53
Gambar 18. Hubungan Konsentrasi Substrat dengan Aktivitas Enzim Tripsin ... 54
Gambar 19. Letak Hidrolisis oleh Enzim Tripsin ... 57
Gambar 20. Reaksi Tirosin dengan Cu2+ ... 59
Gambar 21. Reaksi Reduksi Cu2+ Menjadi Cu+ ... 59
Gambar 22. Reaksi Oksidasi Cu(I)-tirosin ... 60
xiii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur Penentuan Panjang Gelombang Maksimum Kasein.... 72
Lampiran 2. Prosedur Penentuan Kurva Standar Protein Kasein ... 73
Lampiran 3. Prosedur Penentuan Kadar Protein Enzim Tripsin ... 74
Lampiran 4. Prosedur Penentuan pH Optimum... 75
Lampiran 5. Prosedur Penentuan Suhu Optimum ... 76
Lampiran 6. Prosedur Penentuan Waktu Inkubasi Optimum ... 77
Lampiran 7. Prosedur Penentuan Konsentrasi Substrat Optimum ... 78
Lampiran 8. Prosedur Penentuan Aktivitas Enzim Tripsin pada Kondisi Optimum ... 79
Lampiran 9. Prosedur Penentuan Aktivitas Enzim Tripsin dengan Penambahan Ion Logam Ag+ dalam bentuk Senyawa AgNO3 ... 80
Lampiran 10. Data Hasil Penentuan Panjang Gelombang Maksimum ... 81
Lampiran 11. Data Hasil Penentuan Kurva Standar Protein Kasein ... 82
Lampiran 12. Data Hasil Penentuan Kadar Protein Enzim Tripsin ... 83
Lampiran 13. Data Hasil Penentuan pH Optimum ... 84
Lampiran 14. Data Hasil Penentuan Suhu Optimum ... 87
Lampiran 15. Data Hasil Penentuan Waktu Inkubasi Optimum ... 91
Lampiran 16. Data Hasil Penentuan Konsentrasi Substrat Optimum ... 95
Lampiran 17. Data Hasil Penentuan Aktivitas Enzim Tripsin pada Kondisi Optimum ... 99
Lampiran 18. Data Hasil Penentuan Aktivitas Enzim Tripsin dengan Penambahan Ion Logam Ag+ dalam Bentuk Senyawa AgNO 3 .. 101
xiv
PENGARUH PENAMBAHAN ION LOGAM Ag+ TERHADAP AKTIVITAS ENZIM TRIPSIN
Oleh:
Titik Tri Wijayanti
NIM 12307144032
Pembimbing: Eddy Sulistyowati, Apt., MS.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan ion logam
Ag+ dalam bentuksenyawa AgNO
3 terhadap aktivitas enzim tripsin. Sebelumnya
dilakukan penentuan kondisi optimum enzim tripsin meliputi pH, suhu, waktu inkubasi dan konsentrasi substrat.
Penentuan aktivitas enzim tripsin dengan substrat kasein dilakukan dengan menggunakan metode Anson. Penentuan aktivitas enzim tripsin dengan dan tanpa
penambahan ion logam Ag+ dalam bentuk senyawa AgNO
3 dilakukan dalam
kondisi optimum yang telah diperoleh. Variasi konsentrasi senyawa AgNO3 yang
ditambahkan adalah 0,001 M; 0,003 M; 0,005 M; dan 0,007 M. Data yang diperoleh dalam penelitian ini adalah aktivitas enzim tripsin dalam satuan mg/mL/menit pada suhu 37°C. Analisis data yang digunakan adalah deskriptif kualitatif dengan membandingkan aktivitas enzim tripsin dengan dan tanpa
penambahan ion logam Ag+ pada kondisi optimum yang telah diperoleh.
Hasil penelitian ini menunjukkan kondisi optimum enzim tripsin pada pH 8, suhu 37°C, waktu inkubasi 20 menit dan konsentrasi substrat 10 mg/mL. Aktivitas enzim tripsin pada kondisi optimum yaitu 0,00319 mg/mL/menit pada
suhu 37°C. Sedangkan aktivitas enzim tripsin dengan penambahan ion logam Ag+
dalam bentuk senyawa AgNO3 pada konsentrasi 0,001 M; 0,003 M; 0,005 M; dan
0,007 M berturut-turut sebesar 0,00163; 0,00030; 0,00023; dan 0,00010
mg/mL/menit pada suhu 37°C. Berdasarkan data tersebut, ion logam Ag+ dalam
senyawa AgNO3 bersifat inhibitor terhadap aktivitas enzim tripsin pada kondisi
optimum.
xv
THE EFFECT OF Ag+METAL ION ADDITION ON TRYPSIN’S ACTIVITY
By:
Titik Tri Wijayanti
Number of Student: 12307144032
Supervisor: Eddy Sulistyowati, Apt., MS.
ABSTRACT
This research aimed to determine the effect of Ag+ metal ion in AgNO3
compound against trypsin's activity. Determination of optimum condition of trypsin including the pH, temperature, incubation period and substrate's concentration had been undergone before the conduction.
Determination of trypsin's activity with casein substrate was undergone by
Anson's Method. Trypsin's actvity determined with and without adding the Ag+
metal ion in AgNO3 compound, were conducted in optimum condition which had
been collected. The variations of AgNO3 concentration which were added are 0.001
M; 0.003 M; 0.005 M; and 0.007 M. The data collected in this research is trypsin’s
activity. The data analysis used is Descriptive-Qualitative, comparing trypsin’s
activity with and without Ag+ metal ion addition in optimum condition that had
been collected.
The result shows the optimum condition of trypsin's activity is in pH 8; 37°C; 20 minutes of incubation period and 10 mg/mL as the concentration of
substrate. The trypsin’s activity in optimum condition is 0.00319 mg/mL/minute at
the 37°C temperature. On the other hand, the trypsin’s activity with addition of Ag+
metal ion presented in AgNO3 compound with 0.001M; 0.003M; 0.005M; and
0.007M in a row as the concentrations are 0.00163; 0.00030; 0.00023; and 0.00010
mg/mL/minute at the 37°C temperature. Based on the data, Ag+ ion metal in
AgNO3 compound has the quality as an inhibitor against trypsin’s activity in
optimum condition.
1 BAB I PENDAHULUAN
A. Latar Belakang
Kasus keracunan logam berat telah menjadi penyebab kematian yang tinggi
di dunia. Keracunan logam berat banyak terjadi karena adanya pencemaran logam
berat terhadap lingkungan melalui udara, air, maupun tanah. Pencemaran logam
berat biasanya berasal dari kegiatan industri. Sebagai contoh kasus keracunan
logam timbal di China pada tahun 2011. 139 warga China di sekitar pabrik baterai
di sekitar daerah Taizhou, Zhejiang, China mengalami keracunan logam berat
timbal. Tanah sekitar pabrik tersebut telah tercemar logam timbal yang melebihi
ambang batas limbah (Anonim, 2011).
Unsur kimia yang merupakan logam berat adalah unsur kimia yang
memiliki nomor atom 22 – 95. Beberapa jenis logam berat antara lain Ag, As, Cd,
Co, Cr, Cu, Hg, Mn, Mo, Ni, Pb, Sn, dan Ti. Logam memberikan manfaat yang
beragam bagi manusia. Logam banyak digunakan dalam bidang industri, pertanian,
ataupun kedokteran. Di sisi lain logam memiliki efek negatif bagi makhluk hidup
apabila terkontaminasi langsung melalui makanan, minuman maupun udara.
Beberapa jenis logam memiliki efek toksik yang berbeda, ada yang bersifat sangat
toksik, ada pula logam yang bersifat kurang toksik. Apabila logam masuk ke
organel sel makhluk hidup dapat mempengaruhi kinerja berbagai macam organel
sel. Sebagai contoh organel sel retikulum endoplasma yang mengandung banyak
enzim, kerja enzim akan dihambat oleh logam yang masuk ke dalam organel sel.
Kerja utama dari logam adalah menghambat enzim dengan cara berinteraksi
2
Penanganan pertama pada keracunan yang sering dilakukan adalah
pemberian susu. Susu dianggap dapat menetralkan racun yang masuk ke dalam
tubuh. Susu mempunyai zat antidotum yang memiliki kemampuan untuk mengikat
racun yang masuk ke dalam tubuh. Dalam kasus keracunan logam berat, zat
antidotum memiliki kemampuan untuk mengendapkan logam berat seperti perak,
timbal, merkuri dan lain-lain. Zat antidotum umumnya banyak ditemukan pada
bahan-bahan yang mengandung banyak protein.
Protein adalah senyawa organik komplek yang mengandung unsur C, H, O
dan N. Protein merupakan rantai asam amino yang memiliki banyak manfaat untuk
makhluk hidup. Fungsi protein antara lain sebagai antibodi dalam tubuh karena
protein memiliki zat antidotum. Selain karbohidrat, protein juga berfungsi sebagai
sumber energi. Fungsi lain dari protein adalah untuk mengatur pertumbuhan
sel-sel dalam tubuh dan sebagai biokatalis reaksi enzimatik. Protein dapat pula
berfungsi sebagai protein aktif, yaitu enzim.
Enzim adalah suatu biokatalis yang molekulnya berupa protein atau
beberapa juga berupa protein yang ditambah senyawa non-protein. Ada lebih dari
20 macam enzim yang memiliki fungsi spesifik. Diantara enzim tersebut terdapat
enzim yang berfungsi dalam proses menghidrolisis protein dalam tubuh, enzim
tersebut adalah enzim protease. Salah satu jenis enzim protease adalah enzim
tripsin. Enzim tripsin berfungsi memecah protein pada makanan dengan cara
memutuskan ikatan peptida dari gugus karboksil residu asam amino arginin atau
3
Enzim tripsin hanya dapat bekerja pada substrat kasein, benzoil-n-arginin etil ester
(BAEE), benzoil-n-argininamide (BAA), dan asetil-L-tirosin etil ester (ATEE)
Kemampuan enzim mengkatalis suatu reaksi dalam tubuh disebut sebagai
aktivitas enzim (Togu, 2011: 1). Aktivitas enzim dipengaruhi oleh beberapa faktor,
yaitu waktu inkubasi, suhu, pH, konsentrasi enzim, konsentrasi substrat, dan
kofaktor berupa kation yang dapat berfungsi sebagai aktivator atau inhibitor.
Aktivator adalah kation yang berfungsi untuk meningkatkan aktivitas enzim,
sedangkan inhibitor adalah kation yang berfungsi untuk menurunkan aktivitas
enzim. Kation Mn2+, Cd2+, Co2+, Mg2+, dan Ba2+ dapat meningkatkan aktivitas
enzim tripsin terhadap substrat BAEE. Namun, aktivitas enzim tripsin dapat
diturunkan dengan penambahan kation Hg2+, Cu2+, Ag+ dan Zn2+ dengan substrat
BAEE (Green, 1953: 379).
Pada penelitian ini menggunakan ion logam Ag+ dalam bentuk senyawa
AgNO3 yang akan ditambahkan pada enzim tripsin. Penambahan ion logam Ag+
digunakan untuk mengetahui apakah ion logam tersebut bertindak sebagai
aktivator atau inhibitor terhadap aktivitas enzim tripsin dengan substrat kasein.
B. Identifikasi Masalah
Berdasarkan latar belakang tersebut, pokok permasalahan yang dapat
diidentifikasi dalam penelitian ini adalah:
1. Ada berbagai enzim protease yang ada dalam perdagangan, antara lain enzim
pepsin dan enzim tripsin.
2. Ada berbagai jenis substrat protein komersil yang dapat digunakan dalam
4
3. Ada berbagai ion logam yang berfungsi sebagai aktivator atau inhibitor enzim,
antara lain Ag+, Cu2+, Hg2+, Ca2+, Cd2+, dan Mn2+.
4. Ada berbagai metode penentuan kadar protein antara lain metode Biuret, metode
Kjeldhal, dan metode Lowry.
5. Ada berbagai metode yang digunakan untuk menentukan aktivitas enzim tripsin,
antara lain metode Anson dan metode Kunitz.
6. Faktor-faktor yang mempengaruhi aktivitas enzim antara lain konsentrasi
enzim, konsentrasi substrat, pH, suhu, dan waktu inkubasi.
C. Pembatasan Masalah
Berdasarkan identifikasi masalah, maka perlu diberikan pembatasan
masalah, yaitu:
1. Enzim protease yang digunakan dalam penelitian ini adalah enzim tripsin
komersial merk dagang E-Merck.
2. Jenis substrat yang digunakan dalam penelitian ini adalah protein kasein.
3. Ion logam yang digunakan dalam penelitian ini adalah ion logam Ag+ dalam
bentuk senyawa AgNO3 dengan variasi konsentrasi 0,001 M; 0,003 M; 0,005
M; dan 0,007 M.
4. Penentuan kadar protein dilakukan dengan metode Lowry.
5. Penentuan aktivitas enzim tripsin dilakukan dengan metode Anson.
6. Faktor-faktor yang mempengaruhi aktivitas enzim tripsin yaitu pH, suhu,
waktu inkubasi, konsentrasi substrat dan ion logam Ag+ dalam bentuk senyawa
5 D. Rumusan Masalah
Berdasarkan latar belakang permasalahan, maka dapat dirumuskan
permasalahan sebagai berikut:
1. Berapa aktivitas enzim tripsin dengan substrat kasein pada kondisi optimum?
2.
Bagaimana pengaruh penambahan ion logam Ag+ dalam bentuk senyawaAgNO3 pada berbagai konsentrasi terhadap aktivitas enzim tripsin pada
kondisi optimum tersebut?
E. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui:
1. Aktivitas enzim tripsin pada kondisi optimum enzim tripsin dengan substrat
kasein.
2. Pengaruh penambahan ion logam Ag+ dalam bentuk senyawa AgNO3 pada
berbagai konsentrasi terhadap aktivitas enzim tripsin pada kondisi optimum
tersebut.
F. Manfaat Penelitian
Penelitian ini diharapkan memberikan manfaat sebagai berikut:
1. Bagi mahasiswa, memberikan informasi tentang besarnya aktivitas enzim
tripsin pada kondisi optimum dan pengaruh penambahan ion logam Ag+ dalam
bentuk senyawa AgNO3 konsentrasi 0,001 M; 0,003 M; 0,005 M; dan 0,007 M
6
2. Bagi masyarakat, memberikan informasi pada masyarakat mengenai dampak
yang terjadi apabila ion logam Ag+ masuk ke dalam tubuh, khususnya dampak
7 BAB II
KAJIAN PUSTAKA
A. Protein
Protein merupakan komponen utama dalam semua sel makhluk hidup.
Protein memiliki fungsi sebagai unsur pembentuk struktur sel seperti pada rambut,
wol, kolagen, jaringan penghubung, membran sel dan lain-lain. Selain itu, protein
juga dapat berfungsi sebagai protein aktif seperti enzim yang berfungsi sebagai
katalis segala proses biokimia dalam sel. Protein memiliki berat molekul besar
yang berkisar antara ribuan hingga jutaan, sehingga protein merupakan suatu
makromolekul. Struktur protein sangat tergantung pada keadaan lingkungannya.
Struktur protein cenderung tidak stabil pada pH, dan suhu yang tidak sesuai dengan
lingkungannya (Muhamad, 1977: 8-9).
Protein yang digunakan oleh makhluk hidup berasal dari tumbuhan dan
hewan. Protein yang berasal dari tumbuhan disebut protein nabati dan protein yang
berasal dari hewan disebut protein hewani. Beberapa contoh sumber protein nabati
adalah jagung, kacang, kedelai, gandum dan contoh sumber protein hewani adalah
daging, ikan dan susu. Protein yang masuk ke dalam tubuh selanjutnya akan
mengalami hidrolisis oleh enzim menghasilkan asam-asam amino (Anna, 2006:
81-82).
Protein dibangun dari 20 macam asam amino. Asam amino ini dihubungkan
satu dengan yang lain melalui ikatan kovalen dan ikatan peptida dengan urutan
yang khas. Semua asam amino pembentuk molekul protein mempunyai struktur
8
amino yang terikat pada satu atom karbon yang sama. Perbedaan struktur asam
amino banyak ditentukan oleh gugus rantai samping pada asam amino (Purwo,
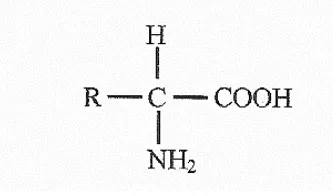
1997: 12-13). Berikut adalah gambar dari struktur asam amino:
Gambar 1. Struktur Asam Amino
B. Kasein
Protein susu sapi dapat digolongkan ke dalam dua golongan, yaitu kasein
dan golongan kedua berupa -laktoglobulin, α-lalktalbumin, globulin imun dan
albumin serum. Kasein merupakan golongan heterogen fosfoprotein yang
diendapkan dari susu skim pada pH 4,6 dan suhu 20°C. Hidrolisis kasein secara
khusus dan terbatas dengan enzim protease menghasilkan sejumlah polipeptida
besar yang tidak dapat dihidrolisis lebih lanjut (deMan, 1997: 136-140).
Kasein adalah fosfor protein yang terdiri dari asam amino yang terikat oleh
ikatan peptida. Kasein memiliki tiga jenis protein, yaitu α-kasein, -kasein dan
-kasein. Ketiga jenis protein yang ada dalam kasein mengandung sumber asam
amino yang dibutuhkan oleh tubuh. Kasein terdiri dari asam amino yang terhubung
oleh ikatan peptida. Struktur kasein dengan asam amino polipeptida dapat dilihat
9
Gambar 2. Struktur Kasein
Kasein adalah salah satu jenis substrat dalam reaksi yang dikatalis oleh
enzim tripsin. Substrat adalah suatu senyawa organik yang siap untuk diubah
menjadi produk. Kasein sebagai substrat dalam reaksi enzim tripsin, berarti kasein
merupakan protein yang akan diubah menjadi produk berupa asam amino dengan
bantuan enzim tripsin.
C. Enzim
Pada tahun 1926 James Sumner dari Cornell University berhasil
mengisolasi enzim urease dari ekstrak kacang dan kemudian mengkristalkannya.
Sumner menemukan bahwa kristal urease terdiri atas protein. Kemudian pada
tahun 1930 John Northrop mengkristalkan enzim tripsin dan enzim pepsin, dan
juga menemukan bahwa kedua enzim itu adalah suatu protein (Togu, 2011: 1).
Enzim merupakan suatu protein yang mempunyai kekhasan bekerja pada
satu reaksi saja. Selain itu, enzim hanya mampu mengubah substrat tertentu
menjadi produk. Hal ini dikarenakan reaksi antara substrat dan enzim terjadi pada
sisi aktif enzim. Sisi aktif enzim inilah yang memberikan ruang kepada substrat
untuk berikatan dengan enzim. Apabila jenis substrat yang digunakan tidak sesuai
10
dan substrat akan membentuk komplek enzim substrat yang sementara. Kompleks
ini dapat terurai kembali setelah reaksi yang diinginkan terjadi (Anna, 2006: 145).
Enzim dikelompokkan menjadi 6 kelompok berdasarkan tipe reaksi yang
dikatalisnya. Keenam kelompok tersebut adalah:
1. Oksidareduktase
Enzim yang berfungsi mengkatalis reaksi redoks. Dalam reaksi yang dikatalis
enzim ini, salah satu substrat tereduksi dan substrat lain teroksidasi. Contoh
enzim ini adalah enzim glutamat dehidrogenase.
2. Transferase
Enzim yang berfungsi mengkatalis reaksi pemindahan sebuah gugus dari satu
substrat ke substrat lainnya. Contoh dari enzim ini adalah enzim transammase.
3. Hidrolase
Enzim yang berfungsi mengkatalis reaksi hidrolisis substrat. Contoh enzim ini
adalah enzim tripsin.
4. Liase
Enzim yang berfungsi mengkatalis reaksi eliminasi sebuah gugus dari substrat
sehingga terbentuk ikatan peptida. Contoh dari enzim ini adalah enzim piruvat
dekarboksilase.
5. Isomerase
Enzim yang berfungsi mengkatalis reaksi isomerasi. Contoh dari enzim ini
adalah enzim glukosafosfat isomerase.
11
Enzim yang berfungsi mengkatalis reaksi penggabungan dua molekul dengan
bantuan ATP atau sumber energi lainnya. Contoh enzim ini adalah enzim
glutamin sintetase (Purwo, 1997: 115).
D. Enzim Tripsin
Enzim tripsin adalah salah satu enzim golongan hidrolase yang berfungsi
untuk memecah protein menjadi asam amino dengan bantuan air. Enzim tripsin
merupakan endopeptidase, dan bentuk in-aktifnya adalah tripsinogen yang
diproduksi oleh kelenjar pankreas yang dapat diaktifkan dengan asam (F.G.
Winarno, 1983: 79). Enzim tripsin memiliki kekhasan, yaitu hanya menyerang
ikatan peptida dalam molekul protein yang memiliki gugus karboksil dari residu
asam amino lisin atau arginin (Yayat, 2011: 9). Berikut ini adalah gambar dari
enzim tripsin dan reaksi hidrolisis oleh enzim tripsin pada residu asam amino lisin:
Gambar 3. Enzim tripsin
Gambar 4. Reaksi Hidrolisis oleh Enzim Tripsin
Fungsi utama dari enzim tripsin adalah mengubah protein menjadi senyawa
12
darah dan diedarkan pada seluruh sel yang membutuhkan. Asam amino hasil
hidrolisis enzim tripsin dapat dihitung dengan nilai absorbansi kompleks warna
biru hasil reaksi antara asam amino dan reagen Folin-Ciocalteau.
Setiap enzim bekerja pada kondisi optimal yang berbeda. Kondisi optimal
yang berupa pH dan suhu optimum ini berbeda – beda sesuai dengan jenis enzim.
Enzim tripsin memiliki kondisi optimum pada pH optimum 8,0 dan suhu optimum
35°C (Arie, 2011: 39-54).
E. Aktivitas Enzim
Aktivitas enzim didefinisikan sebagai kemampuan enzim dalam
mengkatalis reaksi biokimia tubuh, pengubahan substrat menjadi produk. Satuan
aktivitas enzim adalah satuan laju reaksi, yaitu mol/l/satuan. Dalam aktivitas enzim
kita mengenal adanya kofaktor (Togu, 2011: 1).
Satu unit aktivitas enzim adalah banyaknya enzim pada keadaan optimal
yang menyebabkan perubahan satu mikromol substrat dalam waktu satu menit pada
suhu 25°C. Sedangkan menurut International Commision on Enzymes pada tahun
1972, satu unit aktivitas enzim adalah banyaknya enzim yang mampu mengubah 1
mol substrat dalam waktu satu detik. Unit aktivitas enzim ini disebut katal (Kat).
Enzim mempunyai aktivitas spesifik, yakni banyaknya µ mol substrat yang berubah
per menit dalam miligram protein enzim. Sedangkan aktivitas total enzim adalah
banyak mol substrat yang diubah enzim per menit per gram protein (Mulyadi, 1986:
6-7).
Aktivitas katalitik dari enzim bergantung pada struktur proteinnya. Jika
13
berubah. Dengan demikian struktur primer, sekunder, tertier, ataupun kuartener
protein enzim sangat penting bagi aktivitas katalitik enzim yang bersangkutan.
Perubahan dari struktur protein enzim berhubungan dengan letak sisi aktif enzim
yang digunakan untuk mengkatalis reaksi.
Aktivitas katalitik enzim dipengaruhi oleh beberapa faktor, yakni:
1. Konsentrasi Enzim
Konsentrasi enzim menunjukkan banyaknya enzim yang ada dalam reaksi.
Kecepatan suatu reaksi yang dikatalis oleh enzim tergantung dari banyaknya enzim
yang mengkatalis reaksi. Pada suatu konsentrasi substrat yang konstan, kecepatan
reaksi bertambah dengan bertambahnya konsentrasi enzim (Anna, 2006: 158-159).
Grafik hubungan antara konsentrasi enzim dan aktivitas enzim dapat dilihat seperti
Gambar 5.
Gambar 5. Pengaruh Konsentrasi Enzim Terhadap Aktivitas Enzim
2. Konsentrasi Substrat
Konsentrasi substrat merupakan jumlah substrat yang ada dalam reaksi atau
jumlah substrat yang akan diubah menjadi produk dengan bantuan enzim yang
sesuai. Substrat akan bereaksi dengan enzim yang sesuai. Apabila jumlah enzim
14
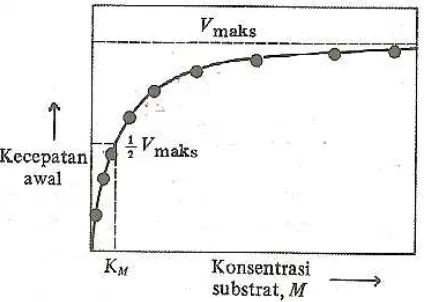
Kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi substrat.
Apabila konsentrasi substrat dinaikkan, besarnya tingkat kenaikan reaksi semakin
lama akan semakin kecil, sehingga pada akhirnya akan mencapai titik batas dimana
kecepatan reaksi hanya akan meningkat sangat sedikit dengan bertambahnya
konsentrasi substrat. Setelah titik ini tercapai, kecepatan reaksi hanya akan
mendekati, tetapi tidak akan pernah mencapai garis maksimum. Titik ini disebut
kecepatan maksimum, enzim menjadi jenuh dengan substratnya dan tidak dapat
berfungsi lebih cepat (Lehninger, 1982: 240-241). Grafik mengenai pengaruh
konsentrasi substrat pada reaksi enzim dapat dilihat pada Gambar 6.
Gambar 6. Pengaruh Konsentrasi Substrat Terhadap Kecepatan Reaksi
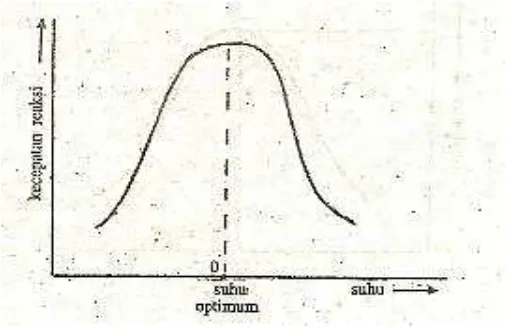
3. Suhu
Reaksi yang dikatalis oleh enzim dipengaruhi oleh suhu lingkungan.
Apabila suhu rendah, maka kecepatan reaksi juga rendah. Sebaliknya, semakin
tinggi suhu maka kecepatan reaksi juga akan meningkat. Disamping itu, enzim
merupakan suatu protein sehingga kenaikan suhu dapat menyebabkan denaturasi.
Bagian aktif enzim akan mengalami gangguan sehingga kemampuan mengkatalis
15
berlawanan, maka akan ada suhu optimum dimana enzim dapat bekerja secara
maksimal (Anna, 2006: 161). Berikut adalah grafik pengaruh suhu terhadap
kecepatan reaksi enzim:
Gambar 7. Pengaruh Suhu Terhadap Aktivitas Enzim
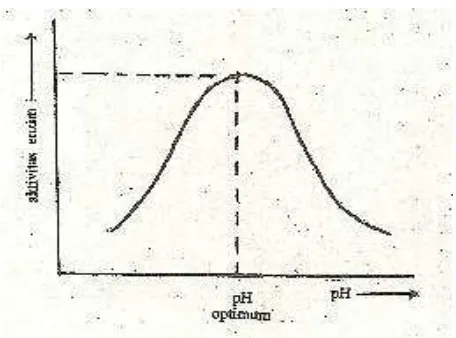
4. Derajat Keasaman (pH)
Suatu enzim sangat tergantung pada keadaan lingkungannya terutama
keadaan pH lingkungannya. Suatu enzim dapat berbentuk ion positif, ion negatif
maupun ion bermuatan ganda (zwitter ion). Perubahan pH yang berakibat pada
perubahan muatan dari enzim ini, akan mempengaruhi struktur dari enzim. Struktur
dari enzim inilah yang mempengaruhi daerah aktif enzim. Daerah aktif enzim
merupakan daerah dimana enzim dapat berikatan dengan substrat membentuk
kompleks Enzim-Substrat (ES) yang dapat menghasilkan produk. Selain itu, pH
yang terlalu rendah maupun terlalu tinggi dapat menyebabkan proses denaturasi
yang akan menurunkan kemampuan katalitik enzim. Maka dari itu, ada suatu
lingkungan pH yang disebut pH optimum. pH optimum adalah nilai pH lingkungan
yang menghasilkan aktivitas suatu enzim terbesar (Anna, 2006: 162). Gambar 8
16
Gambar 8. Pengaruh pH Terhadap Aktivitas Enzim
5. Aktivator dan Inhibitor
Aktivator dan inhibitor adalah senyawa yang ditambahkan ke dalam reaksi
enzimatik yang dapat berfungsi mempercepat atau memperlambat kerja enzim.
Aktivator merupakan katalis dari reaksi enzimatis yang berfungsi untuk
mempercepat reaksi. Sedangkan inhibitor adalah penganggu atau penghambat dari
reaksi enzimatis. Setiap enzim memiliki aktivator dan inhibitor yang spesifik,
berbeda dari enzim lain.
F. Inhibitor Enzim
Inhibitor adalah suatu zat yang cenderung menurunkan laju reaksi yang
dikatalis oleh enzim. Secara umum, inhibitor dapat menghambat kerja enzim
dengan dua jenis penghambatan, yaitu penghambat reversibel dan penghambat
irreversibel (Togu, 2011: 85).
1. Penghambat Reversibel
Penghambat reversibel adalah jenis penghambatan enzim yang dapat balik.
17
kembali dari enzim melalui dialisis maupun dengan pelarutan sederhana.
Pemisahan inhibitor reversibel dari enzim ini untuk mengembalikan aktivitas
katalitik enzim. Inhibitor reversibel berlangsung dengan cepat membentuk suatu
sistem kesetimbangan dengan enzim. Hal ini menunjukkan adanya suatu tingkat
penghambatan yang pasti, tergantung pada konsentrasi enzim, inhibitor, dan
substrat yang memiliki jumlah yang tetap konstan sepanjang reaksi jika laju awal
berlangsung dengan normal (Togu, 2011: 85).
Terdapat tiga jenis penghambatan yang terjadi pada aktivitas enzim yang
dihambat oleh inhibitor reversibel, yaitu:
a. Inhibitor kompetitif
Inhibitor kompetitif merupakan jenis inhibitor yang memiliki struktur mirip
substrat. Inhibitor bereaksi dengan enzim secara kompetitif terhadap substrat
mengikat sisi aktif enzim. Penghambatan ini kadang bersifat irreversibel apabila
substrat tidak bisa melepaskan ikatan inhibitor. Penghambatan kompetitif juga
ditemukan pada sisi dekat dengan pusat aktif enzim, sehingga mengurangi
kecenderungan enzim bereaksi dengan substrat (Maria, 2010: 63-64).
b. Inhibitor non-kompetitif
Penghambatan tidak bersaing ini tidak dipengaruhi oleh konsentrasi substrat
maupun konsentrasi inhibitor. Inhibitor dapat bergabung dengan enzim pada sisi di
luar pusat aktif enzim. Penggabungan ini dapat terjadi pada enzim bebas yang akan
membentuk kompleks Enzim-Inhibitor (EI). Selain itu, penggabungan inhibitor
juga dapat terjadi pada kompleks enzim substrat menghasilkan kompleks
18
yang diharapkan. Contoh inhibitor tidak bersaing adalah ion-ion logam seperti
Cu2+, Hg2+, dan Ag+ (Anna, 2006: 167-169).
c. Inhibitor unkompetitif
Inhibitor unkompetitif yaitu inhibitor yang berikatan pada kompleks enzim
substrat membentuk kompleks enzim substrat-inhibitor yang tidak aktif. Inhibitor
unkompetitif ini biasanya terjadi pada enzim multireaktan, enzim yang memiliki
lebih dari satu sisi aktif. Apabila sisi aktif pertama sudah diikat oleh substrat,
sehingga membentuk komples enzim-substrat, kemudian inhibitor akan mengikat
sisi aktif enzim yang lainnya, maka akan terjadi kompleks substrat-enzim-inhibitor
yang tidak aktif (Togu, 2011: 102).
2. Penghambat Irreversibel
Penghambat irreversibel merupakan jenis penghambatan oleh inhibitor
enzim yang tidak dapat balik. Penghambatan ini bersifat merusak suatu gugus
fungsioonal pada molekul enzim. Penghambatan oleh inhibitor irreversibel ini
dilakukan dengan cara inhibitor mengadakan ikatan kovalen dengan residu asam
amino sisi aktif enzim (Togu, 2011: 86). Reaksi antara inhibitor dengan sisi tertentu
dari enzim mengakibatkan perubahan bentuk enzim. Perubahan ini menyebabkan
pengurangan aktivitas katalitik enzim (Anna, 2006: 170).
G. Senyawa AgNO3
Dalam persenyawaan perak sederhana bukan kompleks, logam perak
memiliki tingkat oksidasi +1. Ion Ag+ merupakan ion perak yang paling stabil
dalam air. Senyawa perak yang banyak digunakan dalam kehidupan sehari-hari
19
mudah larut dalam air dan tidak berwarna. Perak nitrat banyak digunakan dalam
menguji adanya ion klorida, bromida dan iodida, sedangkan pada industri, perak
nitrat banyak digunakan sebagai bahan untuk membuat senyawa perak lain
(Kristian dkk., 2010: 311– 312).
Perak nitrat merupakan salah satu jenis perak yang dapat digunakan dalam
bidang kesehatan yaitu untuk pengobatan antiinfeksi topikal. Paparan yang
berlebihan dari senyawa perak dapat menimbulkan keracunan dengan tanda
timbulnya warna biru-keabu-abuan pada mata, sekat rongga hidung, tenggorokan
dan kulit, iritasi pada kulit, borok dan gangguan pencernaan. Sedangkan paparan
logam perak yang berkepanjangan dapat menimbulkan penyakit argyria, yaitu
timbulnya warna biru keabu-abuan pada kulit. Selain itu perak nitrat dapat
menyebabkan iritasi dan rasa seperti terbakar pada kulit dan mukosa membran, rasa
sakit di mulut, diare, muntah, koma dan kejang-kejang dan bahan dapat
menyebabkan gastroenteritis (Hari, dkk, 2003: 47).
Gambar 9. Struktur Perak Nitrat
Penggunaan ion logam Ag+ dibatasi karena dampak yang membahayakan
makhluk hidup. Selain itu, perak merupakan logam yang tidak bisa dihilangkan
hanya dengan dievaporasi. Logam perak terus ada, hanya saja dapat berpindah
karena lingkungan. Logam perak dapat mencemari lingkungan seperti pada tanah,
20
Amerika Serikat mengumumkan pembatasan kadar perak dalam air minum tidak
lebih dari 1,142 mg/L (U.S. Public Health Service, 1990). Selain itu berdasarkan
Peraturan Menteri Energi dan Sumber Daya Mineral Republik Indonesia No.45
tahun 2006, baku mutu perak terhadap uji konsentrasi parameter limbah lumpur
pencemar adalah 5 mg/L. Hal ini berarti logam perak tidak boleh mencemari
lingkungan melebihi 5 mg/L.
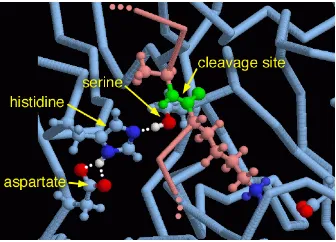
Senyawa AgNO3 mudah larut dalam air, sehingga ion-ion dalam senyawa
AgNO3 mudah menjadi ion Ag+ dan NO3-. Muatan positif yang ada pada kation
perak akan mengikat pusat aktif enzim tripsin yang berada antara gugus karboksil
Asp 10β dan δ-nitrogen dari His 57. Cincin imidazole dari His 57 berubah posisi
1,8Å ke dalam untuk menampung ion Ag+. Perubahan posisi ini mencegah interaksi
normal antara cincin imidazole His 57 dan gugus hidroksil dari Ser 195. Hal ini
berakibat His 57 tidak dapat membantu transfer proton secara langsung pada reaksi
katalis oleh enzim tripsin (Chambers, et al., 1974: 70).
H. Penentuan Kadar Protein
1. Metode Kjeldhal
Metode Kjeldhal digunakan untuk menganalisis protein kasar makanan
secara tidak langsung karena yang dianalisis adalah kadar nitrogennya. Kelemahan
cara ini adalah purin, pirimidin, vitamin-vitamin, keratin dan kreatina ikut
teranalisis dan terukur sebagai nitrogen protein (F.G. Winarno, 1988: 76-77).
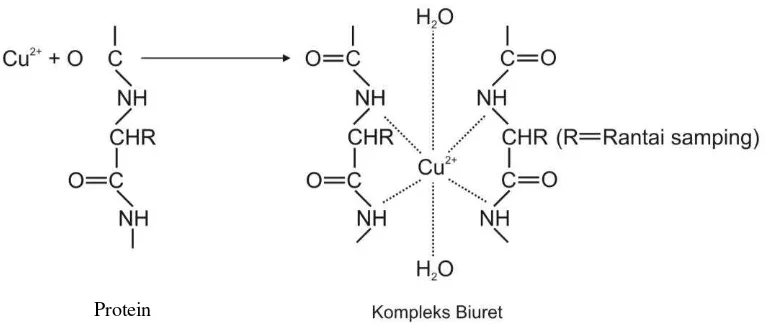
2. Metode Biuret
Metode Biuret adalah salah satu metode yang sensitif untuk menentukan
21
akan membentuk kompleks berwarna ungu dengan ikatan peptida pada protein.
Senyawa yang mampu menggangu reaksi ini adalah adanya urea dan gula
pereduksi yang akan bereaksi dengan ion Cu2+ (Yayat, 2011: 18).
3. Metode Lowry
Dalam metode Lowry, analisisnya menggunakan pereaksi Biuret yang
dikombinasikan dengan pereaksi lain yakni pereaksi Folin-Ciocalteau. Keuntungan
dari penggunaan metode Lowry adalah kemampuan metode Lowry untuk
penentuan kadar protein tinggi hingga kadar protein yang sangat rendah.
Pengukuran absorbansi metode Lowry sensitif terhadap panjang gelombang sekitar
500 nm (untuk kadar protein tinggi) hingga 750 nm (untuk kadar protein rendah)
(Yurika, 2014). Penentuan kadar protein dengan metode Lowry berdasarkan reaksi
antara Cu2+ dengan protein dan reaksi asam fosfomolibdat dan asam
fosfongtungstat oleh tirosin atau triptofan yang akan menghasilkan warna biru.
Intensitas warna biru yang dihasilkan tergantung pada kadar proteinnya (Suhardi
(1989) dalam Yayat, 2011: 18-19). Reaksi yang terjadi antara protein dan reagen
Folin-Ciocalteau sebagai berikut:
Gambar 10. Reaksi Protein dengan Cu2+
22
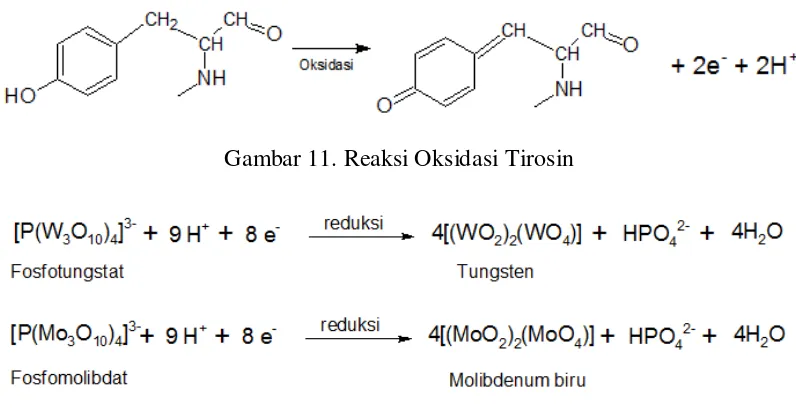
Gambar 11. Reaksi Oksidasi Tirosin
Gambar 12. Reaksi Reduksi Fosfotungstat Menjadi Tungsten dan Fosfomolibdat Menjadi Molibdenum Biru
I. Penentuan Aktivitas Enzim dengan Metode Anson
Penentuan aktivitas enzim tripsin dengan metode Anson dilakukan
berdasarkan pada produk larutan TCA-filtrat yang direaksikan dengan reagen
Foiln-Ciocalteau. Produk larutan TCA-filtrat adalah produk hasil hidrolisis protein
oleh tripsin. Pemecahan protein oleh tripsin spesifik terhadap gugus karboksil lisin
atau arginin yang akan menghasilkan asam amino yang lebih sederhana (Yayat,
2011: 20). Asam amino yang dihasilkan ini kemudian dihitung kadarnya dengan
metode Lowry.
Dalam penentuan aktivitas enzim tripsin dengan metode Anson ini,
menggunakan metode Anson yang telah dimodifikasi (Togu dkk., 2012: 42-43).
Metode Anson modifikasi menggunakan tiga tabung yang berbeda. Ketiga tabung
tersebut adalah tabung sampel, tabung kontrol dan tabung blanko. Ketiga tabung
tersebut diukur absorbansinya menggunakan spektronik-20 untuk mengetahui nilai
23
Absorbansi tabung kontrol dan tabung sampel dihitung dari terbentuknya
kompleks warna biru antara asam amino dan reagen Folin-Ciocalteau. Asam amino
membentuk kompleks Biuret dengan Cu2+ dalam reagen Folin-Ciocalteau.
Kompleks Cu(II)-asam amino ini akan mengalami reduksi menjadi Cu+ karena
berada pada lingkungan basa. Ion Cu+ dan gugus fenol asam amino (misalkan pada
tirosin) bereaksi dengan mereduksi asam fosfotungstat dan asam fosfomolibdat
menjadi tungsten dan molybdenum biru. Banyaknya kompleks warna yang
terbentuk sebanding dengan jumlah produk (asam amino) yang dihidrolisis oleh
enzim tripsin.
Nilai absorbansi yang diperoleh digunakan untuk menghitung aktivitas
enzim tripsin. Menurut Togu Gultom dan Eddy Sulistyowati (2011) aktivitas enzim
tripsin dapat diperoleh dari perhitungan menggunakan rumus berikut:
� = � − �� �
Keterangan:
V = aktivitas enzim tripsin
� = Absorbansi tabung sampel
� � = Absorbansi tabung kontrol (tabung yang enzimnya telah dinonaktifkan)
t = waktu inkubasi (menit)
J. Penelitian yang Relevan
Menurut Arie Sandie (2011) kondisi optimum enzim tripsin dengan substrat
umbi-umbian diperoleh pada pH optimum 8, suhu optimum 35oC serta waktu
24
(mg/mL.S)/(mg/mL.E)/gram/menit. Penelitian ini menggunakan metode Anson
untuk penentuan aktivitas enzim tripsin dan metode Lowry untuk menentukan
kadar protein.
Penelitian Chamber et al. (1974) mengenai kristalografi perak-tripsin
menunjukkan ion perak mampu menghambat protease serin. Ion perak mampu
mendesak nitrogen Histidin 57 tripsin yang berada di dekat sisi aktif dari enzim
tripsin. Konstanta inhibitor dari ion perak adalah 4x10-5 M.
Michael Green dan Hans Neurath (1953) melakukan penelitian efek
divalent kation terhadap enzim tripsin. Dalam penelitian ini, menggunakan ion
logam Ag+ dalam bentuk senyawa AgNO3 dengan konsentrasi 0,001 M dan 0,01
M dengan menggunakan metode titrasi potensiometri. Ion logam Ag+ menghambat
aktivitas enzim tripsin dengan substrat benzoil-n-arginin etil ester (BAEE),
benzoil-n-argininamide (BAA), dan asetil-L-tirosin etil ester (ATEE).
K. Kerangka Berfikir
Ion logam Ag+ merupakan ion logam berat yang apabila masuk dalam tubuh
dapat menyebabkan efek toksisitas terhadap tubuh. Ion logam tersebut dapat
menggangu kinerja enzim dalam tubuh. Enzim merupakan senyawa biokatalis dan
sangat berperan dalam reaksi tubuh manusia. Enzim tripsin merupakan enzim yang
dapat menghidrolisis semua jenis protein, namun demikian kerja enzim spesifik
pada pemecahan ikatan peptida pada posisi karboksil dari asam amino lisin atau
arginin. Aktivitas katalitik dari enzim dipengaruhi oleh beberapa faktor, seperti
waktu inkubasi, suhu, pH, konsentrasi enzim, konsentrasi substrat, pengaruh ion
25
enzim tripsin pada kondisi optimum dan pengaruh tambahan ion logam Ag+ dalam
26 BAB III
METODE PENELITIAN
A.Subjek dan Objek Penelitian
1. Subjek Penelitian
Subjek pada penelitian ini adalah enzim tripsin.
2. Objek Penelitian
Objek penelitian ini adalah aktivitas enzim tripsin dengan dan tanpa
penambahan ion logam Ag+ dalam bentuk senyawa AgNO3 konsentrasi 0,001 M;
0,003 M; 0,005 M; dan 0,007 M pada kondisi optimum.
B.Variabel Penelitian
1. Variabel Bebas
Variabel bebas dalam penelitian ini adalah konsentrasi senyawa AgNO3.
2. Variabel Terikat
Variabel terikat dalam penelitian ini adalah aktivitas enzim tripsin dengan
dan tanpa penambahan ion logam Ag+ dalam bentuk senyawa AgNO
3 konsentrasi
0,001 M; 0,003 M; 0,005 M; dan 0,007 M.
3. Variabel Terkendali
Variabel terkendali dari penelitian ini adalah kondisi optimum dari enzim
tripsin.
C.Alat dan Bahan Penelitian
1. Alat-Alat Penelitian
27
a. Seperangkat alat gelas
b. Seperangkat alat spektronik-20
c. Neraca analitik
d. Sentrifuge
e. Inkubator
2. Bahan-bahan Penelitian
Dalam penelitian ini, semua bahan kimia yang digunakan adalah bahan
kimia pro-analis (E-Merck) kecuali akuades. Bahan-bahan yang digunakan adalah
sebagai berikut:
a. Larutan Buffer Fosfat 0,1 M pH 7 sebanyak 50 mL
Larutan buffer fosfat 0,1 M pH 7 dibuat dengan melarutkan 0,6 gram NaH2PO4
ke dalam 25 mL akuades. Kemudian ditambahkan NaOH 0,5 M tetes demi
tetes hingga diperoleh pH 7. Setelah itu menambahkan akuades hingga volume
50 mL.
b. Larutan Buffer Fosfat 0,1 M pH 8 sebanyak 1000 mL
Larutan buffer fosfat 0,1 M pH 8 dibuat dengan melarutkan 12 gram NaH2PO4
ke dalam 500 mL akuades. Kemudian ditambahkan NaOH 0,5 M tetes demi
tetes hingga diperoleh pH 8. Setelah itu menambahkan akuades hingga volume
1000 mL.
c. Larutan Buffer Fosfat 0,1 M pH 9 sebanyak 50 mL
Larutan buffer fosfat 0,1 M pH 9 dibuat dengan melarutkan 0,6 gram NaH2PO4
28
tetes hingga diperoleh pH 9. Setelah itu menambahkan akuades hingga volume
50 mL.
d. Larutan 10% TCA (asam trikloroasetat) sebanyak 500 mL
Larutan 10% TCA dibuat dengan melarutkan 50 gram kristal TCA kedalam
500 mL akuades.
e. Larutan Enzim Tripsin pH 7 sebanyak 10 mL
Larutan enzim tripsin dibuat dengan melarutkan 4 mg padatan enzim tripsin
pada 10 mL buffer fosfat 0,1 M pH 7.
f. Larutan Enzim Tripsin pH 8 sebanyak 200 mL
Larutan enzim tripsin dibuat dengan melarutkan 80 mg padatan enzim tripsin
pada 200 mL buffer fosfat 0,1 M pH 8.
g. Larutan Enzim Tripsin pH 9 sebanyak 10 mL
Larutan enzim tripsin dibuat dengan melarutkan 4 mg padatan enzim tripsin
pada 10 mL buffer fosfat 0,1 M pH 9.
h. Reagen Folin-Ciocalteau 1 N sebanyak 200 mL
Reagen Folin-Ciocalteau 1 N dibuat dengan menambahkan akuades 100 mL
pada larutan induk Folin-Ciocalteau 100 mL (perbandingan 1:1).
Menghomogenkan larutan reagen Folin-Ciocalteau 1 N.
i. Larutan NaOH 0,5 M sebanyak 1000 mL
Larutan NaoH 0,5 M dibuat dengan melarutkan 20 gram kristal NaOH dengan
1000 mL akuades. Mengaduknya hingga kristal NaOH benar-benar larut.
29
Larutan induk kasein dengan menimbang 0,5 gram bubuk kasein. Kemudian
menambahkan NaOH 0,5 M tetes demi tetes hingga bubuk kasein berbentuk
gel. Menambahkan 10 mL akuades. Memanaskan larutan kasein sambil diaduk
hingga kasein benar benar larut. Menambahkan larutan buffer fosfat 0,1 M pH
7 hingga volume 50 mL.
k. Larutan Kasein 10 mg/mL pH 8 sebanyak 600 mL
Larutan induk kasein dengan menimbang 6 gram bubuk kasein. Kemudian
menambahkan NaOH 0,5 M tetes demi tetes hingga bubuk kasein berbentuk
gel. Menambahkan 100 mL akuades. Memanaskan larutan kasein sambil
diaduk hingga kasein benar benar larut. Menambahkan larutan buffer fosfat
0,1 M pH 8 hingga volume 600 mL.
l. Larutan Kasein 1% pH 9 sebanyak 50 mL
Larutan induk kasein dengan menimbang 0,5 gram bubuk kasein. Kemudian
menambahkan NaOH 0,5 M tetes demi tetes hingga bubuk kasein berbentuk
gel. Menambahkan 10 mL akuades. Memanaskan larutan kasein sambil diaduk
hingga kasein benar benar larut. Menambahkan larutan buffer fosfat 0,1 M pH
9 hingga volume 50 mL.
m. Pereaksi Lowry
1) Reagen A sebanyak 75 mL
Melarutkan 1,5 gram Na2CO3 dalam 75 mL NaOH 0,1 M. Mengaduknya
hingga larut sempurna.
30
Melarutkan 0,005 gram CuSO4.5H2O dalam 10 mL KaliumNatrium Tartrat
1% (melarutkan 0,1 gram KaliumNatrium Tartrat pada 10 mL akuades) .
Mengaduknya hingga larut sempurna.
3) Reagen C sebanyak 76,5 mL
Mencampurkan 75 mL reagen A dengan 1,5 mL reagen B.
4) Reagen E sebanyak 10 mL
Reagen E dibuat dengan menambahkan akuades 5 mL pada larutan induk
Folin-Ciocalteau 5 mL (perbandingan 1:1). Menghomogenkan larutan
reagen Folin-Ciocalteau 1N.
n. Larutan induk AgNO3 0,01 M sebanyak 100 mL
Melarutkan 0,172 gram kristal AgNO3 dengan akuades sebanyak 100 mL.
o. Akuades
D.Prosedur Penelitian
Penelitian ini menggunakan metode Lowry untuk menentukan konsentrasi
protein dan menggunakan metode Anson untuk menentukan aktivitas enzim
tripsin. Prosedur kerja dilakukan dengan langkah sebagai berikut:
1. Penentuan Kadar Protein dengan Metode Lowry (Lowry, 1951: 265-275)
Memasukkan 0,2 mL sampel ke dalam tabung reaksi. Kemudian
menambahkan 1 mL reagen C dan mengocoknya hingga tercampur sempurna.
Mendiamkan campuran tersebut selama 10 menit dalam temperatur ruangan.
Menambahkan 0,1 mL reagen E dengan cepat dan mengaduknya. Mendiamkannya
31
2. Penentuan Aktivitas Enzim dengan Metode Anson (Anson, 1938: 81-84)
a. Tabung Sampel (ts)
Menambahkan 1 mL larutan enzim tripsin ke dalam 5 mL larutan substrat
(pH 7,5). Kemudian mengocoknya hingga tercampur sempurna. Penyampuran
kedua larutan ini dilakukan dengan vortexmixer dan ditempatkan pada water bath
yang bersuhu 25°C. Mendiamkan larutan tersebut selama 10 menit. Kemudian
menambahkan 10 mL larutan TCA 3 N dan mengocoknya dengan kuat. Setelah itu
memisahkan endapan dari larutan dengan menyaringnya atau menyentrifugenya.
Mengambil 5 mL larutan filtrat dan memasukkannya ke dalam 50 mL labu
Erlenmeyer. Menambahkan 10 mL larutan NaOH 0,5 N dan mengaduknya. Setelah
itu menambahkan 3 mL reagen fenol dan mengaduknya. Mendiamkan larutan
tersebut selama 10 menit dari waktu penambahan reagen. Mengukur nilai warna
yang terbentuk.
b. Tabung Standar
0,0008 miliekuivalen tirosin (dalam 5 mL 0,2 N asam klorida dan 0,5%
formaldehid sebagai pengawet) ditambahkan dengan 10 mL NaOH 0,5 N dan 3 mL
reagen fenol. Mendiamkan larutan selama 5 menit dari waktu penambahan reagen.
Mengukur nilai warna yang terbentuk.
c. Tabung Blanko
10 mL larutan TCA 0,3 N ditambahkan ke dalam 5 mL larutan substrat dan
1 mL air. Kemudian mengambil 5 mL larutan TCA-filtrat tersebut dan
menambahkan 0,0008 miliekuivalen tirosin (dalam 5 mL 0,2 N asam klorida dan
32
N dan 3 mL reagen fenol. Kemudian mendiamkannya selama 5 menit dan
mengukur nilai warna yang terbentuk.
3. Penentuan Kadar Protein dengan Metode Lowry Modifikasi
a. Penentuan Panjang Gelombang Maksimum Kasein
Penentuan panjang gelombang kasein dilakukan dengan menggunakan
sampel larutan kasein 1 mg/mL yang dilarutkan dalam buffer fosfat pH 8.
Penentuan panjang gelombang maksimum dilakukan pada panjang gelombang
antara 650-750 nm. Penentuan ini dilakukan dengan mengacu pada metode Lowry
dengan sedikit perubahan. Pada penentuan panjang gelombang maksimum kasein,
menggunakan 1 mL larutan kasein 1 mg/mL kedalam tabung reaksi. Kemudian
menambahkan 5 mL reagen C dan mengaduknya hingga tercampur sempurna.
Mendiamkannya pada suhu kamar selama 10 menit. Kemudian menambahkan 0,5
mL reagen E dan mengocoknya dengan segera. Mendiamkan larutan tersebut
selama 30 menit pada suhu kamar. Setelah itu mengukur absorbansi pada panjang
gelombang 650-750 nm. Panjang gelombang maksimum adalah panjang
gelombang yang memberikan nilai absorbansi terbesar. Ringkasan cara kerja dalam
bentuk bagan dapat dilihat pada lampiran 1.
b. Penentuan Kurva Standar Protein Kasein
Konsentrasi larutan standar kasein yang digunakan adalah 0,1 mg/mL; 0,2
mg/mL; 0,3 mg/mL; 0,4 mg/mL; 0,5 mg/mL; 0,6 mg/mL; 0,7 mg/mL; 0,8 mg/mL;
0,9 mg/mL dan 1,0 mg/mL. Pengukuran absorbansi larutan standar dilakukan pada
33
mkasimum sebelumnya. Penentuan ini dilakukan sama dengan prosedur penentuan
panjang gelombang maksimum yaitu mengacu pada metode Lowry dengan sedikit
perubahan. Ringkasan cara kerja dalam bentuk bagan dapat dilihat pada lampiran
2.
c. Penentuan Kadar Protein Tripsin
Penentuan kadar protein dalam enzim tripsin dilakukan dengan
menggunakan larutan enzim tripsin 8 mg/20 mL. Penentuan ini dilakukan sama
dengan prosedur penentuan panjang gelombang maksimum yaitu mengacu pada
metode Lowry dengan sedikit perubahan. Pengukuran absorbansinya pada panjang
gelombang maksimum yang telah diketahui pada prosedur sebelumnya. Kadar
protein enzim tripsin dapat ditentukan dengan bantuan kurva standar protein kasein
yang diperoleh pada penentuan kadar protein larutan santadar kasein. Ringkasan
cara kerja dalam bentuk bagan dapat dilihat pada lampiran 3.
4. Penentuan Kondisi Optimum Enzim Tripsin dengan Metode Anson
Modifikasi
a. Penentuan pH Optimum
Variasi pH yang digunakan dalam penelitian ini adalah pH 7, pH 8 dan pH
9. Penentuan pH optimum enzim tripsin dilakukan dengan mengacu pada metode
Anson dengan sedikit perubahan. Perubahan pada penentuan pH optimum enzim
34
1) Tabung sampel (ts)
Ke dalam 3 tabung reaksi, memasukkan 5 mL larutan substrat kasein 1%
pH bervariasi dari pH 7; pH 8; dan pH 9. Kemudian melakukan prainkubasi selama
5 menit pada suhu 35°C. Menambahkan 1 mL larutan enzim tripsin pH bervariasi
(pH 7; pH 8; dan pH 9) dan 1 mL buffer fosfat 0,1 M pH bervariasi (pH 7; pH 8;
dan pH 9). Setelah itu, melakukan inkubasi selama 20 menit pada suhu 35°C yang
dihitung dari penambahan enzim tripsin. Menambahkan 3 mL larutan TCA 10%
kemudian mengaduknya dengan kuat untuk menghentikan reaksi. Selanjutnya,
mendiamkan selama 20 menit dalam air es agar endapan yang dihasilkan
benar-benar mengendap. Melakukan sentrifuge dengan kecepatan 3500 rpm selama 15
menit pada larutan dan endapan yang terbentuk. Mengambil 2 mL filtrat yang telah
disentrifuge dan menambahkan 4 mL NaOH 0,5 M. Lalu menambahkan 1 mL
reagen Folin-Ciocalteau. Mendiamkan selama 10 menit. Menentukan absorbansi
pada panjang gelombang 650 nm.
2) Tabung kontrol (tk)
Ke dalam 3 tabung reaksi, memasukkan 1 mL buffer fosfat 0,1 M pH 7, pH
8 dan pH 9. Setelah itu, menambahkan 1 mL larutan tripsin pH 7, pH 8 dan pH 9.
Kemudian menambahkan 3 mL larutan TCA 10 % dan mengaduknya hingga
tercampur. Menambahkan 5 mL larutan substrat kasein 1% pH bervariasi dari pH
7, pH 8, dan pH 9 dan mengocoknya. Melakukan inkubasi selama 5 menit pada
suhu 35°C. Selanjutnya, mendiamkan selama 20 menit dalam air es agar endapan
yang dihasilkan benar-benar mengendap. Melakukan sentrifuge dengan kecepatan
35
2 mL filtrat yang telah disentrifuge dan menambahkan 4 mL NaOH 0,5 M. Lalu
menambahkan 1 mL reagen Folin-Ciocalteau. Mendiamkan selama 10 menit.
Menentukan absorbansi pada panjang gelombang 650 nm.
3) Tabung blanko
Kedalam 3 tabung reaksi dimasukkan 2 mL larutan buffer fosfat 0,1 M pH
bervariasi dan 4 mL NaOH 0,5 M kemudian mengaduknya. Menambahkan 1 mL
reagen Folin-Ciocalteau dan mendiamkan selama 10 menit kemudian mengukur
absorbansinya pada panjang gelombang 650 nm.
Ringkasan cara kerja penentuan pH optimum enzim tripsin menggunakan
tabung sampel, tabung kontrol dan tabung blanko dalam bentuk bagan dapat dilihat
pada lampiran 4.
b. Penentuan Suhu Optimum
Penentuan suhu optimum enzim tripsin dilakukan dengan mengacu pada
metode Anson dengan sedikit perubahan. Prosedur penentuan ini dilakukan sama
dengan prosedur pada penentuan pH optimum. Hanya saja penentuan suhu
optimum dilakukan pada pH optimum yang diperoleh pada prosedur sebelumnya
dan pada variasi suhu 31°C; 33°C; 35°C; 37°C; dan 39°C. Ringkasan cara kerja
dalam bentuk bagan dapat dilihat pada lampiran 5.
c. Penentuan Waktu Inkubasi Optimum
Penentuan waktu inkubasi optimum enzim tripsin dilakukan dengan
mengacu pada metode Anson dengan sedikit perubahan. Prosedur penentuan ini
36
penentuan waktu inkubasi optimum dilakukan pada pH dan suhu optimum yang
diperoleh pada prosedur sebelumnya. Variasi waktu inkubasi yang digunakan yaitu
10 menit; 15 menit; 20 menit; 25 menit; dan 30 menit. Ringkasan cara kerja dalam
bentuk bagan dapat dilihat pada lampiran 6.
d. Penentuan Konsentrasi Substrat Optimum
Penentuan konsentrasi substrat optimum dilakukan dengan mengacu pada
metode Anson dengan sedikit perubahan. Prosedur penentuan ini dilakukan sama
dengan prosedur pada penentuan pH optimum. Hanya saja penentuan konsentrasi
substrat optimum dilakukan pada pH, suhu, dan waktu inkubasi optimum yang
diperoleh pada prosedur sebelumnya Variasi konsentrasi substrat yang digunakan
adalah 2 mg/mL; 4 mg/mL; 6 mg/mL; 8 mg/mL dan 10 mg/mL. Ringkasan cara
kerja dalam bentuk bagan dapat dilihat pada lampiran 7.
5. Penentuan Aktivitas Enzim Tripsin Pada Kondisi Optimum dengan
Metode Anson Modifikasi
Prosedur yang digunakan mengacu pada metode Anson dengan sedikit
perubahan. Prosedur penentuan ini dilakukan sama dengan prosedur pada
penentuan pH optimum. Penentuan aktivitas enzim tripsin ini dilakukan pada pH,
suhu, waktu inkubasi dan konsentrasi substrat optimum yang telah diketahui pada
prosedur sebelumnya. Ringkasan cara kerja dalam bentuk bagan dapat dilihat pada
37
6. Penentuan Aktivitas Enzim Tripsin Dengan Penambahan Ion Logam Ag+
dalam Bentuk Senyawa AgNO3 dengan Metode Anson Modifikasi
Penentuan aktivitas enzim tripsin dengan penambahan ion logam Ag+ dalam
bentuk senyawa AgNO3 dilakukan dengan mengacu pada metode Anson dengan
sedikit perubahan. Penentuan aktivitas enzim tripsin dengan penambahan ion
logam Ag+ dalam bentuk senyawa AgNO
3 dilakukan pada kondisi optimum enzim
tripsin yang telah diperoleh pada prosedur sebelumnya. Prosedur penentuan ini
dilakukan sama dengan prosedur pada penentuan pH optimum hanya saja pada
tabung kontrol dan tabung sampel penggunaan 1 mL buffer fosfat 0,1 M pH
optimum diganti dengan penambahan 1 mL larutan ion logam Ag+ dalam bentuk
senyawa AgNO3 berbagai konsentrasi. Variasi konsentrasi senyawa AgNO3 yang
ditambahkan adalah 0,001 M; 0,003 M; 0,005 M; dan 0,007 M. Ringkasan cara
kerja dalam bentuk bagan dapat dilihat pada lampiran 9
.
E.Teknik Analisa Data
Analisis deskriptif kualitatif dilakukan dengan membandingkan aktivitas
enzim tripsin dengan dan tanpa penambahan ion logam Ag+ dalam bentuk senyawa
AgNO3 pada kondisi optimum. Pada penentuan aktivitas enzim tripsin akan
diperoleh data berupa aktivitas enzim tripsin pada kondisi optimum maupun
aktivitas enzim tripsin dengan penambahan ion logam Ag+ dalam bentuk senyawa
AgNO3. Dari data tersebut dapat dibuat grafik hubungan antara aktivitas enzim dan
konsentrasi AgNO3 yang ditambahkan, sehingga dapat dilihat pengaruh dari
penambahan ion logam Ag+ dalam bentuk senyawa AgNO3 terhadap aktivitas
38 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Hasil Penelitian
Berdasarkan penelitian yang telah dilakukan di Laboratorium Biokimia
Jurusan Pendidikan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
UNY, diperoleh hasil sebagai berikut:
1. Penentuan Kadar Protein Kasein dengan Metode Lowry Modifikasi
a.
Penentuan Panjang Gelombang Maksimum KaseinPenentuan panjang gelombang maksimum kasein dilakukan pada panjang
gelombang antara 650 nm hingga 750 nm. Sampel yang digunakan untuk mencari
panjang gelombang maksimum adalah kasein 1 mg/mL. Panjang gelombang 720
nm memiliki absorbansi tertinggi yaitu 1,094, sehingga panjang gelombang
maksimumnya adalah 720 nm. Data hasil absorbansi penentuan panjang
gelombang maksimum dapat dilihat pada lampiran 10.
b.
Penentuan Kurva Standar ProteinPenentuan kurva standar protein dilakukan pada panjang gelombang
maksimum yaitu 720 nm. Protein yang digunakan dalam penentuan kurva standar
protein adalah kasein dengan konsentrasi 0,1 mg/mL; 0,2 mg/mL; 0,3 mg/mL; 0,4
mg/mL; 0,5 mg/mL; 0,6 mg/mL; 0,7 mg/mL0,8 mg/mL; 0,9 mg/mL dan 1,0
mg/mL. Kasein diperoleh dari larutan induk 1 mg/mL yang diencerkan
39
protein kasein dapat dilihat pada lampiran 11. Berdasarkan data tersebut dapat
diperoleh kurva standar protein seperti pada Gambar 13.
Gambar 13. Kurva Standar Protein
Berdasarkan Gambar 13 dapat ditentukan persamaan garis linier Y= aX+b.
Persamaan garis linier kurva standar protein adalah Y= 1,1025X+0,0092 dengan
nilai r = 0,9958.
c.
Penetuan Kadar Protein dalam TripsinPenentuan kadar protein dalam enzim tripsin dilakukan pada panjang
gelombang maksimum yang telah diperoleh pada prosedur sebelumnya, yaitu 720
nm. Enzim tripsin yang digunakan adalah larutan enzim tripsin yang berasal dari
padatan enzim tripsin yang dilarutkan dengan larutan buffer fosfat 0,1 M.
Absorbansi yang diperoleh dari larutan tripsin tersebut adalah 0,091. Apabila
absorbansi enzim tripsin dimasukkan dalam persamaan kurva standar protein, yaitu
Y= 1,1025X+0,0092 maka diperoleh kadar protein dalam enzim tripsin adalah
40
0,074 mg/mL. Perhitungan kadar protein enzim tripsin dapat dilihat pada lampiran
12.
2. Penentuan Kondisi Optimum Enzim Tripsin dengan Metode Anson
Modifikasi
a. Penentuan pH Optimum
Penentuan pH optimum enzim tripsin dilakukan pada suhu 35°C. waktu
inkubasi 20 menit dan konsentrasi substrat kasein 10 mg/mL. Enzim tripsin bekerja
pada pH basa, sehingga digunakan variasi pH pada pH 7, pH 8 dan pH 9. Penentuan
pH optimum enzim tripsin dilakukan sebanyak tiga kali dengan hasil rata-rata
aktivitas enzim tripsin ditunjukkan pada Tabel 1.
Tabel 1. Hasil Penentuan pH Optimum Enzim Tripsin
Variasi pH Aktivitas Enzim Tripsin
(mg/mL/menit pada 37°C)
pH 7 0.00238
pH 8 0.00563
pH 9 0.00325
Berdasarkan Tabel 1, diperoleh hasil aktivitas enzim tripsin tertinggi pada
pH 8. Dengan demikian diperoleh pH optimum enzim tripsin yaitu pada pH 8.
Perhitungan aktivitas enzim tripsin pada penentuan pH optimum dapat dilihat pada
lampiran 13.
b. Penentuan Suhu Optimum
Penentuan suhu optimum enzim tripsin dilakukan pada pH optimum enzim
tripsin yaitu pH 8, waktu inkubasi selama 20 menit dan konsentrasi substrat 10
41
tripsin yaitu pada suhu 31°C, 33°C, 35°C, 37°C, dan 39°C. Penentuan suhu
optimum enzim tripsin dilakukan sebanyak tiga kali dengan hasil rata-rata aktivitas
enzim tripsin ditunjukkan pada Tabel 2.
Tabel 2. Hasil Penentuan Suhu Optimum Enzim Tripsin
Variasi Suhu
Berdasarkan Tabel 2, diperoleh hasil aktivitas enzim tripsin tertinggi pada
suhu 37°C, sehingga suhu optimum enzim tripsin pada suhu 37°C. Perhitungan
aktivitas enzim tripsin pada penentuan suhu optimum dapat dilihat pada lampiran
14.
c. Penentuan Waktu Inkubasi Optimum
Penentuan waktu inkubasi optimum enzim tripsin dilakukan pada pH dan
suhu optimum enzim tripsin yang telah diperoleh pada prosedur sebelumnya dan
dengan konsentrasi substrat 10 mg/mL. pH dan suhu optimum enzim tripsin yang
telah diperoleh yaitu, pH 8 dan suhu 37°C. Variasi waktu inkubasi optimum yang
digunakan untuk penentuan waktu inkubasi optimum enzim tripsin yaitu 10 menit,
15 menit, 20 menit, 25 menit dan 30 menit. Waktu inkubasi enzim tripsin dihitung
dari penambahan larutan enzim tripsin pada larutan substrat kasein hingga
penambahan larutan TCA 10%. Penentuan waktu inkubasi optimum enzim tripsin
42
Tabel 3. Hasil Penentuan Waktu Inkubasi Optimum Enzim Tripsin
Variasi Waktu Inkubasi
Berdasarkan Tabel 3, diperoleh hasil aktivitas enzim tripsin tertinggi pada
waktu inkubasi selama 20 menit, sehingga waktu inkubasi optimum dari enzim
tripsin selama 20 menit. Perhitungan aktivitas enzim tripsin pada penentuan waktu
inkubasi optimum dapat dilihat pada lampiran 15.
d. Penentuan Konsentrasi Substrat Optimum
Penentuan konsentrasi substrat kasein optimum terhadap aktivitas enzim
tripsin dilakukan pada pH, suhu inkubasi dan waktu inkubasi optimum yang telah
diperoleh pada prosedur sebelumnya. pH, suhu inkubasi dan waktu inkubasi
optimum yang diperoleh pada prosedur sebelumnya yaitu, pH 8, suhu inkubasi
37°C dan waktu inkubasi selama 20 menit. Variasi konsentrasi substrat yang
digunakan adalah 2 mg/mL; 4 mg/mL; 6 mg/mL; 8 mg/mL dan 10 mg/mL. Variasi
konsentrasi yang digunakan ini berasal dari hasil pengenceran larutan induk kasein
10 mg/mL. Prosedur penentuan konsentrasi substrat optimum enzim tripsin
dilakukan sama dengan prosedur sebelumnya. Penentuan konsentrasi substrat
maksimum dilakukan sebanyak tiga kali dengan hasil terbaik dapat dilihat pada
43
Tabel 4. Hasil Penentuan Konsentrasi Substrat Optimum Enzim Tripsin
Variasi Konsentrasi Substrat
Berdasarkan Tabel 4, maka diperoleh hasil bahwa aktivitas enzim tripsin
telah konstan pada substrat kasein dengan konsentrasi 10 mg/mL, sehingga
konsentrasi substrat optimum pada konsentrasi 10 mg/mL. Perhitungan aktivitas
enzim tripsin pada penentuan konsentrasi substrat optimum dapat dilihat pada
lampiran 16.
.
3. Penentuan Aktivitas Enzim pada Kondisi Optimum dengan Metode
Anson Modifikasi
Aktivitas optimum dari enzim tripsin adalah kondisi dimana enzim tripsin
berada pada kondisi optimum untuk mengkatalis reaksi hidrolisis protein, sehingga
produk yang dihasilkan semakin besar. Kondisi optimum enzim tripsin yang
digunakan diperoleh dari penentuan pH optimum enzim tripsin, suhu inkubasi
optimum enzim tripsin, waktu inkubasi optimum enzim tripsin, dan konsentrasi
substrat kasein optimum pada prosedur sebelumnya. Kondisi optimum enzim
tripsin yang digunakan, yaitu pada pH 8, suhu inkubasi 37°C, waktu inkubasi
selama 20 menit dan konsentrasi substrat kasein sebesar 10 mg/mL. Penentuan
aktivitas enzim tripsin pada kondisi optimum dilakukan sebanyak lima kali dengan