BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Juli 2011. Pengambilan tanah dan akar tanaman dilakukan di lahan gambut Desa Telaga Suka Kecamatan Panai Tengah Kabupaten Labuhan Batu. Ekstrasi spora, identifikasi dan penghitungan persentase kolonisasi FMA pada akar tanaman dilakukan di Laboratorium Biologi Tanah, Program Studi Agroekoteknologi, Fakultas Pertanian. Kegiatan pemerangkapan dilaksanakan pada rumah kaca, dan dokumentasi sampel dilakukan di Laboratorium Bioteknologi Hutan, Program Studi Kehutanan Fakultas Pertanian Universitas Sumatera Utara.
Bahan dan Alat
Bahan yang digunakan dalam penelitiaan ini adalah contoh tanah dan akar anakan pada tegakan karet dan tegakan sawit di lahan gambut. Kudzu (Pueraria javanica) sebagai inang pada perlakuan pemeragkapan. Untuk ekstraksi dan identifikasi spora mikoriza digunakan bahan berupa larutan glukosa 60%, larutan Melzer’s sebagai bahan pewarna spora dan larutan polyvinyl lacto glycerol (PVLG) sebagai bahan pengawet spora. Larutan trypan blue untuk bahan proses pewarnaan akar (staining). Larutan KOH 10% untuk mengeluarkan cairan sitoplasma dalam akar, sehingga akar pucat dan sebagai pengawet. Larutan HCl 2% untuk mempermudah masuknya trypan blue pada saat pewarnaan.
Alat yang digunakan dalam penelitian ini untuk pengambilan contoh tanah dan akar tanaman adalah kompas, tali plastik, cangkul, kantong plastik, dan spidol serta kertas label. Alat untuk pengamatan di laboratorium adalah saringan 710 µm, 425 µm, dan 53 µm, tabung sentrifuse, cawan petri, pinset spora, mikroskop binokuler, mikroskop cahaya, kaca preparat, dan kaca penutup. Alat yang digunakan untuk pemerangkapan di rumah kaca berupa pot (aqua cup), dan sprayer.
Metode Penelitian 1. Pembuatan Petak
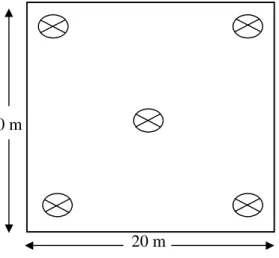
Petak penelitian dibuat sesuai metode ICRAF (Ervayenri et al., 1999). Adapun ukuran petak pengamatan yang digunakan adalah 20 m × 20 m. Penetapan petak pengamatan dilakukan secara acak dengan jumlah petak yang dibuat sebanyak lima petak.
20 m
20 m
Gambar 2. Ilustrasi petak contoh pengambilan sampel tanah Keterangan :
: tempat pengambilan sampel tanah
2. Pengambilan Sampel Tanah
Pengambilan sampel tanah dilakukan sebanyak lima titik dalam setiap petak dengan kedalaman 0-20 cm. Berat tanah yang diambil setiap titik sebanyak 500 gr, sehingga total sampel tanah yang diambil untuk tiap petak pengamatan sebanyak 2500 gr. Sampel tanah tiap titik dalam satu petak dicampur dalam satu tempat hingga homogen untuk mewakili satu petak. Setelah pencampuran dianggap homogen diambil 500 gr sampel tanah untuk tiap petak.
3. Pengambilan Sampel Akar
Akar tumbuhan yang diambil yaitu akar anakan karet dan sawit untuk setiap petak. Akar tumbuhan diambil sebanyak lima anakan setiap petak, dengan diameter yang diambil berukuran 0.5 -1.0 millileter.
4. Ekstraksi dan Identifikasi Spora FMA
Teknik yang digunakan dalam mengekstraksi spora FMA adalah teknik tuang – saring dari Pacioni (1992) dalam Brundet et al. (1996) dan akan dilanjutkan dengan teknik sentrifugasi dari Brundrett et al. (1996). Prosedur kerja teknik tuang – saring ini dimulai dengan mencampurkan tanah sampel sebanyak 50 g dengan 200–300 ml air dan diaduk sampai butiran-butiran tanah hancur. Selanjutnya disaring dalam satu set saringan dengan ukuran 710 µm, 425 µm dan 53 µm secara berurutan dari atas ke bawah. Dari saringan bagian atas disemprot dengan air kran untuk memudahkan bahan saringan lolos. Kemudian saringan paling atas dilepas dan saringan kedua kembali disemprot dengan air kran. Setelah saringan kedua dilepas sejumlah tanah sisa yang tertinggal pada saringan terbawah dipindahkan ke dalam tabung sentrifuse.
Ekstraksi spora teknik tuang – saring ini kemudian diikuti dengan teknik sentrifugasi dari Brundrett et al. (1996). Hasil saringan dalam tabung sentrifuse ditambahkan dengan glukosa 60% yang diletakkan pada bagian bawah dari larutan tanah dengan menggunakan pipet. Tabung sentrifuse ditutup rapat dan disentrifugasi dengan kecepatan 2500 rpm selama 3 menit. Selanjutnya larutan supernatan tersebut dituang ke dalam saringan 53 µm, dicuci dengan air mengalir (air kran) untuk menghilangkan glukosa. Endapan yang tersisa dalam saringan di atas dituangkan ke dalam cawan petri dan kemudian diamati di bawah mikroskop binokuler untuk penghitungan kepadatan spora dan pembuatan preparat guna identifikasi spora FMA yang ada.
Pembuatan preparat spora menggunakan bahan pewarna Melzer’s dan pengawet PVLG yang diletakkan secara terpisah pada satu kaca preparat. Spora-spora FMA yang diperoleh dari ekstraksi setelah dihitung jumlah diletakkan dalam larutan Melzer’s dan PVLG dan jenis spora FMA yang ada dikedua larutan ini sama Selanjutnya spora-spora tersebut dipecahkan secara hati-hati dengan cara menekan kaca penutup preparat menggunakan ujung lidi. Perubahan warna spora dalam larutan Melzer’s adalah salah satu indikator untuk menentukan tipe spora yang ada.
5. Kolonisasi FMA pada Akar Tanaman Sampel
Pengamatan kolonisasi FMA pada akar tanaman sampel dilakukan melalui teknik pewarnaan akar (staining). Metode yang digunakan untuk pembersihan dan pewarnaan akar sampel adalah metoda dari Kormanik dan Mc Graw (1982) dalam Brundet et al. (1996). Langkah pertama adalah memilih akar-akar halus dengan diameter ± 0,5 mm segar dan dicuci dengan air mengalir hingga bersih.
Akar sampel dimasukkan ke dalam larutan KOH 10% dan dibiarkan selama lebih kurang 24 jam sehingga akar akan berwarna putih atau pucat. Tuju-annya adalah untuk mengeluarkan semua isi sitoplasma dari sel akar sehingga akan memudahkan pengamatan struktur infeksi FMA. Larutan KOH kemudian dibuang dan akar sampel dicuci pada air mengalir selama 5-10 menit. Selanjutnya akar sampel direndam dalam larutan HCl 2% dan diinapkan selama satu malam. Larutan HCl 2% kemudian dibuang dengan mengalirkannya secara perlahan-lahan. Selanjutnya akar sampel direndam dalam larutan trypan blue 0,05%. Kemudian larutan trypan blue dibuang dan diganti dengan larutan lacto glycerol untuk proses pengurangan warna (destaining). Selanjutnya kegiatan pengamatan siap dilakukan.
Penghitungan persentase kolonisasi akar menggunakan metode panjang akar terkolonisasi Giovannetti dan Mosse (1980), dalam Brundet et al. (1996). Secara acak diambil potong-potongan akar yang telah diwarnai dengan panjang ± 1 cm sebanyak 10 potongan akar dan disusun pada kaca preparat, untuk setiap tanaman sampel dibuat dua preparat akar. Potongan-potongan akar pada kaca preparat diamati untuk setiap bidang pandang. Bidang pandang yang menunjukkan tanda-tanda kolonisasi (terdapat hifa dan atau arbuskula dan atau vesikula) diberi tanda positif (+), sedangkan yang tidak terdapat tanda-tanda kolonisasi diberi tanda negatif (-). Derajat/persentase kolonisasi akar dihitung dengan menggunakan rumus:
% kolonisasi akar =
n keseluruha pandang bidang da ber pandang bidang _ _ ) _( tan _ _ x 100%6. Pemerangkapan (Trapping Culture)
Teknik pemerangkapan (trapping culture) digunakan dengan mengikuti metode Brundret et al. (1996). Setiap contoh tanah dibuat 5 pot kultur sehingga terdapat 25 pot kultur. Media tanam pot kultur berupa campuran 50 g dan pasir sebanyak 150 g, selanjutnya bibit Kudzu (Pueraria javanica) ditaruh pada lubang tanam yang sudah diisi dengan pasir tanah kemudian ditutupi lagi dengan pasir.
Pemeliharaan kultur meliputi kegiatan penyiraman, pemberian hara dan pengendalian hama secara manual. Larutan hara yang digunakan adalah Hyponex merah (25-5-20) dengan konsentrasi 1 g/l. Pemberian larutan hara dilakuan setiap minggu sebanyak 20 ml tiap pot kultur.
Setelah kultur berumur 8 minggu kegiatan penyiraman dihentikan dengan tujuan menkondisikan kultur pada keadaan stress kekeringan. Proses pengeringan ini berlangsung secara perlahan sehingga dapat merangsang pembentukan spora lebih banyak. Periode pengeringan ini akan berlangsung selama lebih kurang 2 minggu. Setelah itu dapat dilakukan pemanenan spora dengan menggunakan teknik isolasi spora yang telah dijelaskan pada bagian ekstraksi dan identifikasi spora fungi mikoriza arbuskula.
7. Pengamatan
Hasil pengamatan yang dilakukan secara deskriptif dan menyajikan tabel hasil identifikasi tipe-tipe fungi mikoriza. Serta membandingkan identifikasi spora antara tegakan sawit dan tegakan karet.
Kondisi fisik dan kimia tanah
Hasil pengukuran sifat fisik tanah pada lahan gambut di lapangan didapat bahwa kedalaman gambut berkisar antara 1,8 m – 2,3 m. Tanah yang diteliti merupakan tanah gambut saprik, hal ini ditandai dengan tidak ditemukan lagi serat sisa pelapukan pada tanah tersebut. Menurut Agus dan Subiksa (2008), gambut saprik (matang) adalah gambut yang sudah melapuk lanjut dan bahan asalnya tidak dikenali, berwarna coklat tua sampai hitam, dan bila diremas kandungan seratnya < 15%. Hasil analisis sifat kimia tanah dapat dilihat pada Tabel 2 . Tabel 2. Hasil analisis tanah lokasi penelitian.
No. Jenis Analisis Nilai Kriteria*
1 C-Organik (%) 31, 02 Sangat tinggi
2 pH (H2O) 3,51 Sangat masam
3 P-Bray I (ppm) 57,81 Sangat tinggi
*Staf Pusat Penelitian Tanah-Bogor (1983) dan BPP-Medan (1982).
Berdasarkan analisis pH tanah yang dilakukan, tanah gambut yang terdapat pada areal penelitian tergolong sangat masam. Lahan gambut umumnya mempunyai tingkat kemasaman yang relatif tinggi dengan kisaran pH 3 – 5 (Agus dan Subiksa, 2008). Tingginya kemasaman tanah gambut disebabkan tingginya asam fenolat dan asam - asam organik lain hasil dekomposisi bahan organik yang banyak mengandung lignin. Bahan organik yang terdekomposisi menghasilkan asam-asam organik yang akan melepaskan ion H+yang mempengaruhi pH tanah. Nilai pH menunjukkan banyaknya konsentrasi ion hidrogen (H+) di dalam tanah. Semakin banyak H+yang dilepaskan maka pH tanah akan semakin masam. Tapak pertukaran tanah gambut didominasi ion hidrogen menyebabkan pH tanah rendah.
Kadar KTK yang tinggi membuat unsur hara pada gambut mudah terikat menjadi bentuk tidak tersedia (Barchia, 2006).
Hasil analisis menunjukkan bahwa ketersedian fosfat dalam tanah pada areal penelitian sebesar 57,81 ppm, yang tergolong sangat tinggi menurut Staf Pusat Penelitian Tanah-Bogor (1983) dan BPP-Medan (1982). Ketersediaan P ini bertentangan dengan ketersediaan P pada tanah gambut secara umum. Seperti pernyataan Poerwowidodo (2000), umumnya ketersediaan fosfat dalam tanah maksimum dijumpai pada kisaran pH 5,5–7,0. Ketersediaan fosfat akan menurun pada pH <5,5 atau >7,0. Pada kondisi masam aktivitas besi dan aluminium yang tinggi menjadi unsur pengikat P yang utama. Hasil yang kontradiktif ini diduga terjadi karena tanah yang diambil sebagai sampel telah dipupuk dengan pupuk P mengingat lokasi penelitian merupakan areal budidaya tanaman.
Tanah gambut areal penelitian memiliki kandungan karbon yang tergolong sangat tinggi yaitu 31,02 %, hasil ini berarti bahwa dalam tiap 100 gr sampel tanah gambut terdapat karbon organik sebesar 31,02 gr, hal ini didukung oleh pernyataan Agus dan Subiksa (2008), yang menyatakan bahwa lahan gambut menyimpan karbon (C) dalam jumlah besar. Kandungan karbon organik yang sangat tinggi ini, terjadi dengan penumpukan serasah dan bahan organik lain yang dalam jangka waktu yang cukup lama bahkan mencapai ribuan tahun, sehingga membentuk suatu ekosistem lahan gambut.
Kepadatan Spora Fungi Mikoriza Arbuskula
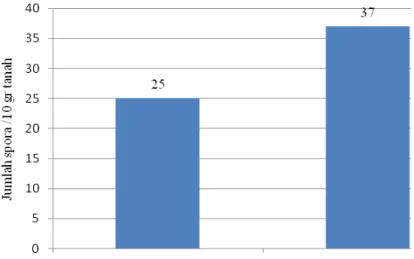
Kepadatan spora FMA hasil pengamatan di lapangan dalam 10 gr sampel tanah gambut, menunjukkan jumlah yang berbeda antara tegakan karet dengan tegakan sawit. Rata-rata kepadatan spora untuk tegakan karet sebesar 25 /10 gr
tanah, dan rataan kepadatan spora untuk tegakan sawit sebesar 37/10 gr tanah. Jumlah kepadatan spora ini lebih banyak dari laporan Lumban Gaol (2007), jumlah kepadatan spora FMA pada vegetasi tunggar (Vaccinium varingifolium) (112/50gr tanah), vegetasi nenas (127/50 gr tanah), maupun laporan Hasbi (2005), yang menyatakan bahwa kepadatan spora pada tanaman budidaya tergolong rendah yaitu 1-6/50 gr tanah. Kepadatan spora hasil pengamatan lapangan dapat dilihat pada Gambar 3.
Gambar 3. Rata-rata jumlah spora FMA hasil pengamatan lapangan.
Perbedaan jumlah kepadatan spora diduga akibat perbedaan kemampuan tanaman untuk berasosiasi dengan FMA, dengan kondisi lingkungan lahan gambut sebagai tempat tumbuh, seperti yang di laporkan oleh Hasbi (2005), yang menyatakan bahwa variasi jumlah spora yang diamati diduga akibat kondisi tanaman dan lingkungan tumbuh serta dapat pula disebabkan oleh faktor kemampuan infeksi dari FMA. Secara tidak langsung eksudat akar juga memiliki kontribusi terhadap jumlah kepadatan spora, dimana perbedaan eksudat akar yang dihasilkan antar tegakan karet dengan tegakan sawit, mempengaruhi rizosfir yang merangsang perbedaan perkecambahan spora, seperti laporan Bakhtiar (2002),
yang menyatakan bahwa komposisi eksudat inang berpengaruh terhadap lingkungan, dan mampu merangsang perkecambahan.
Fungi mikoriza arbuskula membutuhkan air untuk kegiatan metabolismenya. Ketersediaan air berpengaruh terhadap sporulasi FMA, akan tetapi melihat adanya indikasi perbedaan dalam kebutuhan air bagi setiap FMA, maka hasilnya tidak konklusif (Delvian, 2005). Adanya jumlah air yang berlebih karena lingkungan gambut yang tergenang menyebabkan spora cenderung dorman dan diam. Vestberg dan Kukkonen (2008), menyatakan percobaan lapangan menunjukkan bahwa sporulasi fungi mikoriza arbuskula tidak hanya dipengaruhi oleh tanaman panenan tetapi juga pengaruh gambut. Gambut mempunyai efek negatif terhadap aktivitas mikoiza dan kelimpahan jumlah spora FMA tapi tidak mempengaruhi frekuensi jenis.
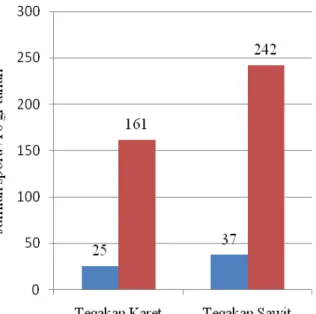
Kepadatan spora FMA hasil pemerangkapan menunjukkan bahwa rata-rata kepadatan spora pada tegakan karet sebesar 161/10 gr tanah dan rata-rata kepadatan pada tegakan sawit sebesar 242/10 gr tanah. Kepadatan spora yang sangat melimpah pada pemerangkapan ini didukung oleh faktor lingkungan yang baik bagi spora FMA untuk berkecambah dan berkembang biak. Seperti yang dilaporkan oleh Sancayaningsih (2005), pengaruh perlakuan tempat tumbuh tanaman inang dan lama waktu memberikan hasil berbeda nyata terhadap perbanyakan spora (jumlah spora). Faktor penentu di dalam perbanyakan spora adalah perkecambahan spora dan diikuti perkembangan sporulasi (terbentuknya spora). Namun, banyak faktor mempengaruhi proses sporulasi antara lain lingkungan, jenis inang, kemampuan infektif dan efektif spora, dan lama waktu inkubasi.
Kepadatan spora hasil isolasi dari langsung dari lapangan dan kepadatan hasil traping yang berasal dari masing-masing petak dan tegakan dapat dilihat pada Gambar 4.
Gambar 4. Perbandingan jumlah spora FMA hasil isolasi dari lapangan dan hasil pemerangkapan
Rata-rata kepadatan spora hasil pemerangkapan ini menunjukkan peningkatan hingga 600% dari rata-rata kepadatan spora hasil isolasi langsung dari lapangan. Peningkatan yang tajam ini terjadi karena perlakuan pengeringan selama 14 hari yang dilakukan pada tahap akhir pemerangkapan, sehingga menyebabkan tanaman kultur mengalami cekaman kekeringan dan merangsang perkecambahan spora. Seperti pernyataan Delvian (2005), yang menyatakan bahwa produksi spora beberapa FMA akan meningkat pada kondisi kering. Sylvia dan Schenck (1982) dalam Devian (2005), juga menyimpulkan bahwa Glomus mosseae dan Gigaspora margarita menghasilkan spora 40% lebih banyak setelah 18 minggu dalam pot yang kemudian diinkubasi selama 9 hari tanpa pemberian air.
Persentase Kolonisasi Akar
Hasil pengamatan akar anakan tanaman pada tegakan karet dan juga pada tegakan sawit menunjukkan asosiasi antara FMA dengan akar yang membentuk hifa di dalam sel akar. Persentase kolonisasi akar anakan pada tegakan karet didapat rata-rata sebesar 8.60%, dan pada tegakan sawit di dapat rata-rata sebesar 18.54%. Persentase kolonisasi akar pada masing-masing petak di kedua tegakan dapat dilihat pada Gambar 5.
Gambar 5. Persentase kolonisasi akar oleh FMA
Perbedaan persentase kolonisasi akar pada tegakan karet dan tegakan sawit ini diduga disebabkan oleh eksudat akar yang dikeluarkan pada rizosfir pada kedua tegakan berbeda juga. Seperti yang dilaporkan oleh Bakhtiar (2002), perkecambahan spora berperan penting di dalam infeksi akar, yang dipengaruhi oleh beberapa faktor diantaranya kompatibilitas inang, komposisi eksudat akar, jenis inokulum dan faktor lingkungan.
Diameter akar antara satu tanaman berbeda dengan tanaman lain, dimana diameter akar berpengaruh signifikan terhadap persentase kolonisasi akar. Akar
tanaman yang memiliki diameter berukuran lebih besar dan yang telah tua tidak begitu baik terinfeksi oleh hifa FMA, diduga hal ini disebabkan karena sel epidermis akar yang lebih besar telah mengeras dan mempersulit penetrasi hifa kedalam sel korteks akar. Pada penelitian ini diameter akar anakan yang diambil sebagai sampel tidak dapat dihomogenkan secara menyeluruh, dimana akar sampel dari tegakan karet cenderung memiliki diameter yang lebih besar jika dibandingkan dengan akar sampel dari tegakan sawit. Hal inilah yang diduga menyebabkan tingkat kolonisasi akar pada tegakan karet lebih rendah. Infeksi ini juga sangat ditentukan adanya kesesuaian FMA dengan inang dalam mekanisme transfer atau pertukaran nutrisi antara keduanya, dan juga kemampuan hidup FMA dan kepekaan inang (Hasbi, 2005).
Meningkatnya kesuburan tanah, terutama suplai unsur P menyebabkan daya infeksi yang lebih rendah. Sebaliknya jika unsur P rendah dan bahan organik tersedia maka daya infeksi akar akan tinggi. Smith dan Read (1997), menyatakan pada ketersediaan hara yang rendah, hifa dapat menyerap hara dari tanah yang tidak dapat diserap oleh akar sehingga pengaruh FMA terhadap serapan hara tinggi. Namun pada unsur P yang cukup, akar tanaman dapat berperan sebagai organ penyerap hara sehingga tanaman mengakumulasi P dalam jumlah yang tinggi. Pada keadaan ini FMA tetap mendapatkan senyawa C dari tanaman sehingga mempengaruhi metabolisme tanaman. Serapan hara oleh FMA tidak menyebabkan respons pertumbuhan yang positif karena faktor lain seperti akuisisi C menjadi pembatas pertumbuhan tanaman sehingga pada keadan P yang sangat tinggi bahkan dapat menyebabkan respons yang negatif terhadap kolonisasi FMA.
Hifa FMA
Hifa FMA Rata-rata kolonisasi akar anakan pada tegakan karet sebesar 8,60%, sedangkan rata-rata kolonisasi akar anakan pada tegakan sawit sebesar 18,54%. Tingkat kolonisasi akar ini tergolong rendah menurut Setiadi et al. (1992), hal ini kemungkinan diakibatkan oleh unsur P tersedia pada tanah di areal penelitian yang tergolong sangat tinggi. Tingginya P menghambat FMA secara langsung dengan menekan perkecambahan spora dan pertumbuhan hifa dari spora yang berkecambah (Miranda dan Harris, 1994).
Infeksi FMA pada akar anakan sampel di tegakan karet dan tegakan sawit yang ditemukan hanya berupa hifa, sedangkan untuk vesikula maupun arbuskula tidak ditemukan pada akar sampel. Infeksi FMA pada akar sampel untuk lebih jelas dapat dilihat pada Gambar 6, 7, dan 8.
Gambar 6. Akar sampel pada tegakan karet yang terinfeksi oleh hifa FMA
Gambar 8. Akar sampel yang tidak terinfeksi oleh hifa FMA
Proses infeksi dimulai dengan pembentukan apresorium pada permukaan akar oleh hifa eksternal, dan selanjutnya hifa akan menembus sel-sel korteks akar melalui rambut akar atau sel epidermis. Gambar 6 dan gambar 7 memperlihatkan bahwa infeksi akar yang terjadi baik pada tegakan karet maupun tegakan sawit hanya berupa hifa, dimana hifa yang ditemukan tidak bersekat, dan hifa tersebut terdapat diantara sel-sel korteks akar (Moose, 1981).
Arbuskula yang merupakan hifa bercabang halus yang dibentuk oleh percabangan dikotomi yang berulang-ulang sehingga menyerupai pohon dari dalam sel inang (Pattimahu, 2004). Dan berfungsi untuk membantu dalam mentrasfer unsur hara (terutama fosfat) dari tanah ke sistem perakaran (Rao, 2004), tidak ditemukan pada akar tanaman sampel. Hal ini disebabkan oleh kelangsungan hidup arbuskula yang sangat singkat.
Tipe dan karakteristik spora FMA hasil pengamatan
Pengamatan spora yang ditemukan di lapangan memiliki tipe dan karakteristik yang berbeda. Perbedaan karakteristik ditemukan pada bentuk spora,
permukaan spora, dinding spora, ukuran spora, warna dan corak spora hingga tangkai spora (hyfal attachment).
Hasil isolasi, pengamatan dan identifikasi yang dilakukan terdapat 2 genus spora FMA yaitu Acaulospora dan Glomus sementara genus lain tidak ditemukan. Genus Acaulospora didapat sebanyak 3 tipe spora, sedangkan untuk genus Glomus didapat sebanyak 38 tipe spora. Tipe dan karakteristik spora yang ditemukan dapat dilihat pada Tabel 3.
Tabel 3. Tipe dan karakteristik spora FMA
Tipe spora FMA Perbesaran Karakteristik
Spora berwarna merah bata kehitaman, dinding spora jelas dan tebal, berbentuk bulat, permukaan tidak begitu halus dengan corak seperti kulit jeruk.
Acaulospora sp.-1
Spora berwarna coklat dan berbentuk bulat. Permukaan spora halus, memiliki corak seperti kulit jeruk. Dinding spora jelas, dan tebal.
Acaulospora sp.-2
40 x
Spora berwarna coklat kemerahan, dan berbentuk bulat. Dinding spora jelas dengan permukaan halus, corak seperti kulit jeruk.
Acaulospora sp.-3
Spora berwarna coklat dan berbentuk bulat. Permukaan spora halus, terdapat bintik hitam pada bagian dalam spora. Dinding spora jelas.
Glomus sp.-1
Spora berwarna coklat kehitaman, dengan noda-noda hitam pada spora. Dinding spora tidak jelas.
Glomus sp.-2
Spora berwarna merah bata, dinding spora tidak jelas. Spora berbentuk bulat. Permukaan spora tidak halus. Memiliki tangkai spora (Hifal attachment). Glomus sp.-3 40 x 40 x 40 x 40 x
Spora berwarna merah bata, berbentuk bulat, dinding jelas. Permukaan halus dengan corak bintik bintik hitam.
Glomus sp.- 4
Spora berwarna kuning halus, permukaan halus, tidak bercorak, dinding spora tipis. Spora berbentuk elips (bulat telur).
Glomus sp.- 5
Spora berwarna merah bata dan berbentuk bulat, dinding spora tebal dan jelas. Permukaan spora halus, dengan corak berwarna yang lebih gelap.
Glomus sp.- 6
Spora berbentuk bulat, berwarna merah gelap. Dinding spora tebal dan jelas. Permukaan spora halus, dengan corak berupa guratan-guratan denga warna lebih gelap.
Glomus sp.-7
40 x
40 x
40 x
Spora berwarna hitam kekuning-kuningan dan berbentuk bulat. Permukaan spora halus, dengan dinding spora yang tipis.
Glomus sp.-8
Spora berwarna coklat dengan dinding yang tidak jelas. Berbentuk bulat, permukaan halus dengan corak berbentuk pipih berwarna lebih gelap.
Glomus sp.-9
Spora berwarna coklat gelap dan berbentuk bulat, memiliki tangkai spora (Hifal attachment). dinding spora tidak jelas. Permukaan spora halus.
Glomus sp.-10
Spora berwarna kuning kehitaman, dinding spora jelas. Spora berbentuk bulat permukaan spora halus, dengan corak bintik bintik hitam.
Glomus sp.-11
40 x
40 x
40 x
Spora berwarna coklat muda dan berbentuk bulat. Permukaan spora halus, memiliki corak menyerupai gelembung-gelembung yang bening seperti pasir dan dinding spora jelas.
Glomus sp.-12
Spora berwarna merah bata, berbentuk bulat, dinding tidak begitu jelas. Permukaan halus dengan corak lebih gelap dan kotor.
Glomus sp.-13
Spora berwarna kuning oranye dan berbentuk bulat, dinding spora jelas. Permukaan spora halus, dengan corak beberapa bintik-bintik bulat.
Glomus sp.-14
Spora berwarna coklat, dinding spora jelas. Spora berbentuk bulat permukaan spora halus, dengan corak kotor menyerupai hamparan pasir yang tersebar merata.
Glomus sp.-15
40 x
10 x
40 x
Spora berwarna coklat kehitaman dan berbentuk bulat. Permukaan spora halus, memiliki corak seperti sarang laba-laba. Dinding spora jelas.
Glomus sp.-16
Spora berwarna kuning dengan corak gelembung hitam, dinding spora kurang begitu jelas, berbentuk bulat, dinding tidak begitu jelas dan permukaan kasar.
Glomus sp.-17
Spora berwarna krem, berbentuk bulat telur, dinding jelas. Permukaan tidak begitu halus dan tidak bercorak.
Glomus sp.-18
Spora berwarna merah bata, berbentuk bulat, dinding tidak begitu jelas. Permukaan halus dengan corak lebih gelap. Glomus sp.-19 40 x 40 x 40 x 40 x
Spora berwarna coklat, dinding spora jelas, permukaan spora halus, berbentuk bulat, memiliki corak nintik-bintik halus yang bulat.
Glomus sp.-20
Spora berwarna coklat dan berbentuk bulat, dinding spora jelas. Permukaan spora halus, dengan corak bintik-bintik bulat.
Glomus sp.-21
Spora berwarna merah gelap, dinding spora tidak jelas. Spora berbentuk bulat permukaan spora tidak halus, dengan corak kotor gelap.
Glomus sp.-22
Spora berwarna coklat muda, berbentuk bulat. Dinding spora jelas dan permukaan spora halus. Tidak mempunyai corak. Glomus sp.-23 40 x 40 x 40 x 40 x
Spora berwarna coklat, dan berbentuk bulat. Dinding spora jelas dan permukaan halus dengan corak berlubang-lubang bulat.
Glomus sp.-24
Spora berwarna hitam dan berbentuk bulat, dinding spora tidak jelas. Permukaan spora kasar, memiliki tangkai spora (Hyfal attachment).
Glomus sp.-25
Spora berwarna coklat muda, dinding tebal dan jelas. Spora berbentuk bulat permukaan spora halus, dengan sedikit corak.
Glomus sp.-26
Spora berwarna coklat dan berbentuk bulat. Permukaan spora tidak halus, memiliki corak. Dinding spora tebal jelas. Glomus sp.-27 40 x 40 x 40 x 40 x
Spora berwarna krem dan berbentuk bulat, dinding spora jelas. Permukaan spora tidak halus, dengan corak kotor dan bintik merah.
Glomus sp.-28
Spora berwarna coklat kehitaman, dinding spora tidak jelas. Spora berbentuk bulat permukaan spora tidak halus, dengan corak seperti duri, memiliki tangkai spora (Hyfal attachment).
Glomus sp.-29
Spora berwarna kuning dan berbentuk bulat. Permukaan spora tidak halus, memiliki corak noda-noda hitam. Dinding spora jelas.
Glomus sp.-30
Spora berwarna merah gelap, berbentuk bulat, dinding jelas. Permukaan tidak halus dengan corak gelap. Memiliki tangkai spora (Hyfal attachment). Glomus sp.-31 40 x 40 x 40 x 40 x
Spora berwarna coklat muda dan berbentuk bulat, dinding spora jelas. Permukaan spora tidak halus, dengan corak berlubang-lubang.
Glomus sp.-32
Spora berwarna kuning oranye, dinding spora jelas. Spora berbentuk bulat permukaan spora halus, dengan corak seperti duri, memiliki tangkai spora (Hyfal attachment).
Glomus sp.-33
Spora berwarna coklat dan berbentuk bulat. Permukaan spora tidak halus, memiliki corak. Dinding spora tebal jelas.
Glomus sp.-34
Spora berwarna coklat dan berbentuk bulat. Permukaan spora tidak halus, memiliki corak yang lebih gelap. Dinding spora tebal jelas dan tidak rata. Glomus sp.-35 40 x 40 x 40 x 40 x
Spora berwarna coklat dan berbentuk bulat. Permukaan spora halus, tidak memiliki corak. Dinding spora tebal jelas dan rata.
Glomus sp.-36
Spora berwarna coklat dan berbentuk bulat. Permukaan spora halus, tidak memiliki corak. Dinding spora tebal jelas dan tidak rata. Memiliki (Hyfal attachment).
Glomus sp.-37
Spora berwarna hitam dan berbentuk bulat. Permukaan spora halus, tidak memiliki corak. Dinding spora tidak jelas dan tidak rata. Memiliki (Hyfal attachment).
Glomus sp.-38
Secara umum, tipe vegetasi mempengaruhi jumlah dan tipe spora. Tipe spora yang ditemukan pada tegakan sawit berbeda dengan tipe spora yang ditemukan pada tegakan karet. Tipe-tipe spora yang ditemukan berasosiasi dengan tegakan pada tanah gambut ditampilkan pada Tabel 4.
40 x
40 x
Tabel 4. Tipe-tipe spora dengan tegakan yang ada.
No Tipe Spora Tegakan
Karet Sawit 1 Acaulospora sp.-1 + 2 Acaulospora sp.-2 + + 3 Acaulospora sp.-3 + 4 Glomus sp.-1 + 5 Glomus sp.-2 + 6 Glomus sp.-3 + 7 Glomus sp.-4 + 8 Glomus sp.-5 + 9 Glomus sp.-6 + 10 Glomus sp.-7 + 11 Glomus sp.-8 + 12 Glomus sp.-9 + + 13 Glomus sp.-10 + 14 Glomus sp.-11 + 15 Glomus sp.-12 + 16 Glomus sp.-13 + 17 Glomus sp.-14 + 18 Glomus sp.-15 + 19 Glomus sp.-16 + 20 Glomus sp.-17 + 21 Glomus sp.-18 + 22 Glomus sp.-19 + 23 Glomus sp.-20 + 24 Glomus sp.-21 + 25 Glomus sp.-22 + 26 Glomus sp.-23 + 27 Glomus sp.-24 + 28 Glomus sp.-25 + 29 Glomus sp.-26 + 30 Glomus sp.-27 + 31 Glomus sp.-28 + 32 Glomus sp.-29 + 33 Glomus sp.-30 + 34 Glomus sp.-31 + 35 Glomus sp.-32 + 36 Glomus sp.-33 + 37 Glomus sp.-34 + 38 Glomus sp.-35 + 39 Glomus sp.-36 + 40 Glomus sp.-37 + + 41 Glomus sp.-38 + + Keterangan + : Ditemukan
Tipe spora FMA yang ditemukan pada lokasi penelitian adalah tipe Glomus dan tipe Acaulospora. Tipe spora ini sama dengan tipe spora yang ditemukan Lumban Gaol (2007), pada lahan gambut di Kecamatan Pollung, Kabupaten Humbang Hasundutan dan pada lahan gambut di Pontianak dengan berbagai tanaman inang (Hasbi, 2005). Namun pada lahan gambut Pollung jumlah tipe spora Glomus spp.yang ditemukan sebanyak 15 tipe spora dan tipe Acaulospora spp. sebanyak 4 tipe spora.
Sementara itu Suciatmih (2003), melaporkan bahwa isolat FMA yang ditemukan pada hutan lahan gambut Setia Alam Jaya, Sebangau, Kalimantan Tengah telah diidentifikasi ke dalam dua genera yaitu genera Glomus dan Gigaspora. Pada lahan gambut di Kalimantan Barat dengan ekosistem alami dan ekosistem yang terganggu atau diolah, spesies yang ditemukan adalah Glomus, Acaulospora, Scutellospora, Enthrospora (Ekamawanti, 1997).
Hasil pada tabel 4 menunjukkan bahwa tipe Glomus diketahui lebih mendominasi baik pada tegakan karet maupun pada tegakan sawit, hal ini seperti yang dilaporkan oleh Ekamawanti (1997), pada lahan gambut di Kalimantan Barat dengan ekosistem alami dan ekosistem terganggu, dan laporan Hasbi (2008), dalam penelitiannya pada lahan gambut di Pontianak, yang menyatakan bahwa genus Glomus dijumpai berbagai tanaman sampel yaitu nenas, sawi, pepaya, kangkung dan terong kecuali bayam. Mikoriza genus Acaulospora hanya ditemukan pada tanaman sawi, pepaya dan kangkung. Hal ini menunjukkan kemampuan simbiosis dan adaptasi Glomus terhadap kondisi setempat. Dengan kata lain genus Glomus mempunyai kemampuan adaptasi dengan jenis tanaman budidaya yang lebih luas jika dibandingkan dengan genus Acaulospora.
Kesimpulan
1. Rata-rata kepadatan spora FMA hasil isolasi dari lapangan pada tegakan karet 25/10 gr tanah, dan pada tegakan sawit sebesar 37/10 gr tanah. Rata-rata kepadatan spora FMA hasil pemerangkapan pada tegakan karet 161/10 gr tanah, dan pada tegakan sawit sebesar 242/10 gr tanah
2. Tipe FMA yang terdapat pada lokasi penelitian adalah tipe Glomus spp. sebanyak 38 tipe spora dan tipe Acaulospora spp. sebanyak 3 tipe spora. 3. Rata-rata kolonisasi akar pada kedua tegakan tergolong rendah, dimana rataan
kolonisasi akar pada tegakan karet sebesar 8,60% dan pada tegakan sawit sebesar 18,54%.
Saran
Diperlukan ketelitian dalam pengambilan akar anakan, dimana sebaiknya akar yang diambil merupakan akar-akar halus (rambut-rambut akar), karena akar yang tua sulit untuk diamati dan cenderung tidak dapat berasosiasi lagi dengan baik terhadap mikoriza, sehingga penghitungan kolonisasi akar dapat lebih mudah dan data yang diperoleh lebih akurat.