FORMULASI GEL HAND SANITIZER EKSTRAK TEH HIJAU (Camelia sinensis L.) DAN UJI AKTIVITAS ANTIBAKTERI PADA BAKTERI Escherichia coli DAN Staphylococcus aureus
SKRIPSI
OLEH:
BANGKIT A. SIPAYUNG NIM 151501064
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
ii
FORMULASI GEL HAND SANITIZER EKSTRAK TEH HIJAU (Camelia sinensis L.) DAN UJI AKTIVITAS ANTIBAKTERI PADA BAKTERI Escherichia coli DAN Staphylococcus aureus
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara OLEH:
BANGKIT A. SIPAYUNG NIM 151501064
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
iv
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Esa yang telah melimpahkan kasih karuniaNya, sehingga penulis dapat menyelesaikan penyususnan skripsi yang berjudul “Formulasi Gel Hand Sanitizer Ekstrak Teh Hijau (Camelia sinensis L.) dan Uji Aktivitas Antibakteri Pada Bakteri Escherichia coli dan Staphylococcus aureus”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Teh hijau adalah jenis teh yang tidak mengalami proses fermentasi, Teh hijau lebih populer karena kandungan katekinnya yang tinggi. Katekin penting dalam anti bakteri teh. Salah satu sediaan Farmasi yang sering digunakan sehari-hari adalah gel Hand Sanitizer. Gel Hand Sanitizer merupakan gel yang memiliki antibakteri dalam menghambat bakteri. Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri sediaan Hand Sanitizer ekstrak simplisia teh hijau. Hasil yang diperoleh adalah sediaan Hand Sanitizer ekstrak teh hijau memberikan aktivitas antibakteri yang baik terhadap Staphylococcus aureus dan Escherichia coli. Hasil penelitian ini diharapkan bisa menjadi sumber informasi bagi penelitian selanjutnya, khususnya untuk bidang Farmasi.
Penulis dengan rasa hormat dan segala ketulusan hati menyampaikan terima kasih kepada Ibu Dra. Nazliniwaty, M.Si., Apt. selaku pembimbing penulis yang telah memberikan bimbingan dan motivasi dengan penuh kesabaran dan tanggung jawab hingga selesainya penyusunan skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Prof. Dr. Anayanti Arianto, M.Si., Apt. selaku ketua penguji, Bapak Imam Bagus Sumantri S.Farm, M.Si., Apt. selaku dosen penguji yang telah
v
memberikan kritik, saran dan arahan kepada penulis dalam penyusunan skripsi ini serta Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik selama perkuliahan dan kepada Ibu Dr. Sumaiyah, M.Si., Apt.
selaku penasehat akademik yang selalu memberi bimbingan, perhatian dan motivasi kepada penulis selama masa perkuliahan. Penulis juga mengucapkan terima kasih kepada Ibu Khairunnisa, S.Si, M.Pharm., Ph.D., Apt. selaku Dekan Fakultas Farmasi yang telah memberikan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orangtua, Bapak Lamris Sipayung dan Mama Dumaria Simanjuntak yang telah menjadi kekuatan serta sandaran saat suka duka dan telah memberikan cinta, kasih sayang, doa, dorongan dan pengorbanan yang tak ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada seperdopingan Keteh, Teman belajar Grup Hmmm (Atika Sihombing, S. Farm, Mutia Zulfahira S. Farm, Budy Andyasa S. Farm, Devi Widya Sari S. Farm, Indah Khairani Panjaitan S.
Farm, Leni Arlina Nasution S, Farm), senior saya kakak Desfrianti Sinaga, dan Astri Sianipar atas kebersamaan, perhatian, dukungan dan doa hingga akhirnya penulis dapat menyelesaikan skripsi ini.
Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan di bidang farmasi.
Medan, Juni 2021 Penulis,
Bangkit A. Sipayung NIM 151501064
vi
FORMULASI GEL HAND SANITIZER EKSTRAK TEH HIJAU (Camelia sinensis L.) DAN UJI AKTIVITAS ANTIBAKTERI PADA BAKTERI Escherichia coli DAN Staphylococcus aureus
ABSTRAK
Latar Belakang: Teh hijau (Camelia sinensis L.) memiliki aktivitas antibakteri pada bakteri Escherichia coli dan Staphylococcus aureus. Hal tersebut disebabkan karena ekstrak teh hijau (Camelia sinensis L.) mengandung senyawa seperti tanin, flavonoid, steroid/glikosida, dan saponin. Katekin dalam kandungan Teh dapat menghambat pertumbuhan bakteri Escherichia coli dan Staphylococcus aureus menjadi alasan penggunaan Hand Sanitizer.
Tujuan: Formulasi dan uji aktivitas antibakteri dari sediaan gel Hand Sanitizer ekstrak teh hijau dan evaluasi mutu fisik sediaan Hand Sanitizer.
Metode: Ekstrak teh hijau dibuat dengan maserasi menggunakan pelarut etanol 96%. Ekstrak diuji karakterisasi dan skirining fitokimia. Sediaan gel Hand Sanitizer dibuat dalam formula : ekstrak teh hijau, CMC-Na, propilen glikol, nipagin, pewangi dan air suling. Kemudian dibuat dalam 4 formula yang dibedakan oleh konsentrasi ekstrak teh hijau masing-masing dengan konsentrasi 5 mg/ml (F1), 10 mg/ml (F2), 15 mg/ml (F3), dan tanpa ekstrak teh hijau (F0/ blanko). Evaluasi sediaan gel meliputi stabilitas sediaan (bau dan warna), homogenitas, pH dan uji viskositas. Pengujian aktivitas antibakteri ekstrak dilakukan dengan metode difusi agar menggunakan pencadang kertas terhadap bakteri Escherichia coli dan Staphylococcus aureus dengan mengukur diameter zona hambat pertumbuhan bakteri dan pengujiaan sediaan gel Hand Sanitizer terhadap bakteri Eschericia coli dan Staphylococcus aureus dilakukan dengan metode sumuran dan dilakukan pengukuran dengan menggunakan jangka sorong.
Hasil: Hasil penelitian menunjukkan simplisia memenuhi syarat uji karakteristik.
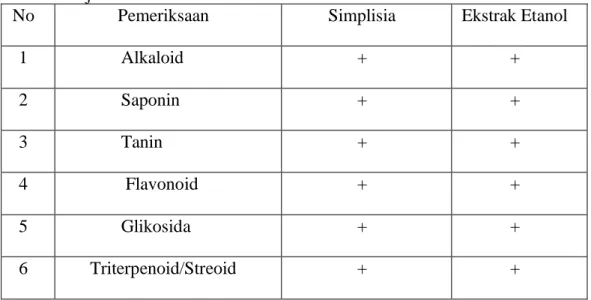
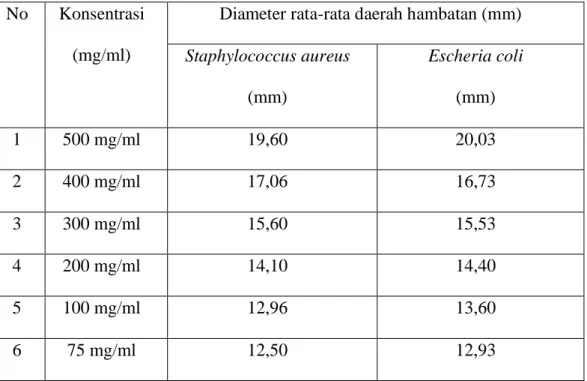
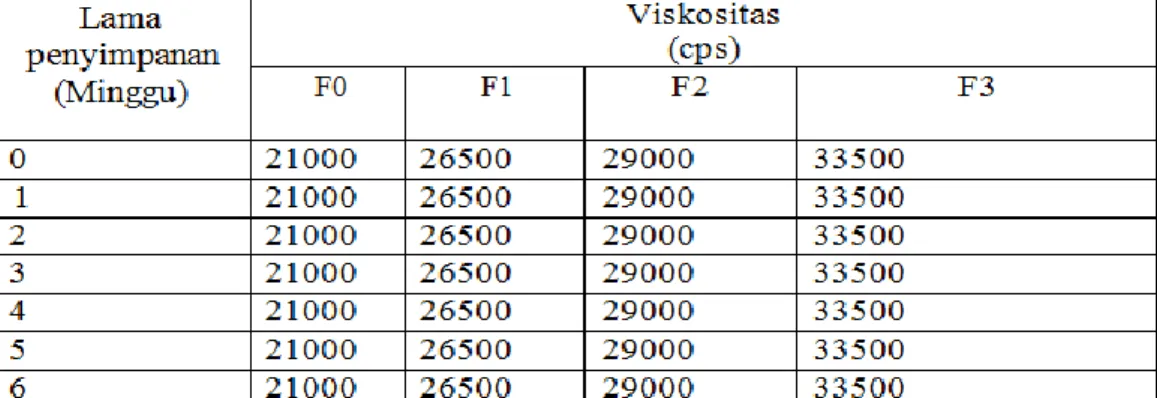
Ekstrak mengandung alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid /triterpenoid. Sediaan Hand Sanitizer ekstrak teh hijau yang dihasilkan homogen, pH 5,8-6,3, stabil dalam penyimpanan 12 minggu dan memiliki Viskositas yang semakin tinggi dikarenakan konsentrasi ekstrak sediaan gel Hand Sanitizer. Hasil uji aktivitas antibakteri ekstrak teh hijau terhadap bakteri Escherichia coli diperoleh kadar hambat pada konsentrasi 5 mg/ml dengan diameter hambat sebesar 10.70 mm dan pada bakteri Staphylococcus aureus pada konsentrasi 5 mg/ml dengan diameter hambat sebesar 10.80 mm. Sedangkan hasil uji aktivitas gel Hand Sanitizer diperoleh daya hambat pada bakteri Escherichia coli pada konsentrasi 1 mg/ml dengan diameter hambat 7.63 mm dan pada bakteri Staphylococcus aureus diperoleh daya hambat pada konsentrasi 1 mg/ml dengan diameter hambat 7.7 mm.
Kesimpulan: Sediaan gel Hand Sanitizer ekstrak teh hijau dapat menghambat pertumbuhan Escherichia coli dan Staphylococcus aureus.
Kata kunci : Ekstrak simlisia teh hijau, Escherichia coli dan Staphylococcus aureus, gel Hand Sanitizer.
vii
FORMULATON GEL HAND SANITIZER OF GREEN TEA (Camelia sinensi L.) EXTRACT. AND ANTIBACTERIAL ON
BACTERIA Escherichia coli and Staphylococcus aureus
ABSTRACT
Background : Green tea (Camelia sinensis L.) have antibacterial activity on Escherichia coli and Staphylococcus aureus bacteria. It is caused ekstrack of green tea (Camelia sinensis L.) contains compound such as tanin, flavonoids, steroids/glikosida, and saponins. The ability of Hand Sanitizer to inhibit the growth of Eschericia coli and Staphylococcus aureus bacteria is the reason for using Hand Sanitizer.
Purpose : formulation and test of antibacterial activity of gel preparation of Hand Sanitizer leaves star green tea extract and evaluation of physical quality of hand sanitizer.
Method : Extract of green tea was made by in a manner maceration using ethanol 96%. Simplicia performed characteristic and phyto chemical screening test. Hand Sanitizer gel preparation is made from extrackt green tea, CMC-Na, Propylen glycol, Nipagin, Fragrance and distiled water.Then made in 4 formulas distinguished by the concentration of green tea extract respetively with concentrations of 5 mg/ml (F1), 10 mg/ml (F2), 15 mg/ml (F3) and without green tea extract (F0 / blank) %. Evaluation of physical properties of Hand Sanitizer gel include of : organoleptic test, homogenety test, pH test, viscosity test. Antibacterial activity test as measured by difusion method using paper disk to measuring the diameter of the bacterial growh imhibition zone of Escherichia coli and Staphylococcus aureus. And testing of Hand Sanitizer gel preparations against Escherichia coli and Staphylococcus aureus bacteria was carried out using the well method and measured using a caliper.
Result : The results showed simplicia fulfilled the characteristics test requirements.
Simplicia containing alkaloid, flaconoid, glycosides, saponin, tanins, and steroids/triterpenoids. The resulting green tea extract Hand Sanitizer is homogeneous, pH 5,8-6,3, stable in 12 weeks of storage and has a higher viscosity due to the concentration of extracts and storage time for Hand sanitizer gel preparations. The resuls of the green tea extract antibacterial activity test against Eschericia coli bacteria obtained inhibitory level centration of 5 mg/ml with an inhibitory diameter of 10.70 mm and Staphylococcus aureus at a concentration of 5 mg/ml with a diameter of 10.80 mm. Meanwhile the resuts of the Hand Sanitizer gel activity test showed that the inhibition of Escherichia coli bacteria at concentration of 10 mg/ml with a diameter of 7.63 mm, and Staphylococcus aureus bacteria obtained minimal inhibitory power at a concentration of 10 mg/ml with a diameter of 7.7 mm.
viii
Conclution : Hand Sanitizer gel of green tea extract have less inhibited growth against Escherichia coli and staphylococcus aureus.
Key word : green tea extract, Eschericia coli and Staphylococcus aureus, Hand Sanitizer gel.
ix DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR...iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan penelitian ... 4
1.5 Manfaat penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.2 Klasifikasi Tumbuhan ... 6
2.3 Morfologi Tanaman ... 6
2.4 Kandungan Teh Hijau ... 7
2.5 Khasiat Tumbuhan Teh Hijau ... 7
2.6 Pembagian Teh ... 8
2.7 Gel ... 9
2.8 Hand Sanitizer ... 10
2.9 Gelling Agent ... 12
2.10 Humektan ... 12
2.11 Metil Paraben ... 12
2.12 Aquades ... 13
2.13 Kulit ... 13
2.14 Metode Ekstraksi ... 14
2.15 Bakteri ... 15
2.16 Staphylococcus aureus ... 15
2.17 Escherichia coli ... 18
2.18 Antimikroba ... 19
2.19 Cara pengukuran Aktivitas Antimikroba ... 19
BAB III METODE PENELITIAN ... 21
3.1 Alat dan bahan ... 21
3.1.1 Alat ... 21
3.1.2 Bahan ... 21
3.2 Penyiapan Sampel ... 22
3.2.1 Pengambilan Sampel ... ... 22
3.2.2 Identifikasi Sampel ... ... 22
x
3.2.3 Pengolahan Sampel ... ... 22
3.3 Pembuatan Larutan Pereaksi ... ... 22
3.3.1 Pereaksi Asam klorida 2 N ... ... 22
3.3.2 Pereaksi Asam Sulkfat 2 N ... ... 23
3.3.3 Pereaksi Besi (III) klorida 1 % ... ... 23
3.3.4 Pereaksi Bouchardat ... ... 23
3.3.5 Pereaksi Dragendorff ... ... 23
3.3.6 Pereaksi Kloralhidrat ... ... 23
3.3.7 Pereaksi Liebermann-Bouchard ... ... 23
3.3.8 Pereaksi Meyer ... ... 23
3.3.9 Pereaksi Molish ... ... 24
3.3.10 Pereksi Natrium Hidroksida 2 N ... ... 24
3.3.11 Pereaksi Timbal (II) Asetat 0.4 ... ... 24
3.4 Pemeriksaan Karakteristik Simplisia ... ... 24
3.4.1 Pemeriksaan Makroskopik ... ... 24
3.4.2 Penetapan Kadar Air ... ... 24
3.4.3 Penetapan Kadar Air ... ... 25
3.4.4 Penetapan Kadar Sari Larut Dalam Air ... ... 25
3.4.5 Penetapan Kadar Sari Larut Dalam Etanol ... ... 26
3.4.6 Penetapan Kadar Abu Total ... ... 26
3.4.7 Penetapan Kadar Abu Tidak Larut Dalam Asam ... ... 26
3.5 Skrinning Fitokimia ... ... 27
3.5.1 Pemeriksaan Flavonoid ... ... 27
3.5.2 Pemeriksaan Alkaloida ... ... 27
3.5.3 Pemeriksaan Glikosida ... ... 28
3.5.4 Pemeriksaan Steroida/Triterpenoida...28
3.5.5 Pemeriksaan Saponin ... ... 29
3.5.6 Pemeriksaan Tanin ... ... 29
3.6 Pembuatan Ekstrak Teh Hijau ... ... 29
3.7 Sterilisasi Alat dan Bahan ... ... 30
3.8 Pembuatan Media ... ... 30
3.8.1 Pembuatan media Nutrient Agar (NA) ... ... 30
3.8.2 Pembuatan media Nutrient Broth (NB) ... ... 31
3.8.3 Pembuatan media Muller Hinton Agar (MHA) ... ... 31
3.8.4 Pembuatan media Agar Miring ... ... 32
3.8.5 Suspensi standar Mc Farland 0.5 ... ... 32
3.9 Pembiakan Bakteri ... ... 32
3.9.1 Pembuatan Stok Kultur Bakteri ... ... 32
3.9.2 Peremajaan Bakteri ... ... 32
3.9.3 Pembuatan Inokulum Bakteri ... ... 33
3.10 Pembuatan Larutan Uji Ekstrak Teh Hijau (Camelia sinensis L.) dengan Berbagai Konsentrasi ... ... 33
3.11 Pengujian Aktivitas Antibakteri Ekstrak Simplisia Teh hijau (Camelia sinensis L) ... ... 33
3.12 Prosedur Pembuatan Gel Antiseptik tangan ... ... 34
3.12.1 Formula Dasar Gel ... ... 34
3.12.2 Formulasi Sediaan Gel Antiseptik Tangan ... ... 35
3.13 Evaluasi Terhadap Sediaan ... ... 36
xi
3.13.1 Pengamatan Stabilitas ... ... 36
3.13.2 Pemeriksaan Homogenitas Sediaan ... ... 36
3.13.3 Penentuan PH ... . ... 36
3.13.4 Uji Viskositas ... . ... 36
3.14 Pengujian Aktivitas Antibakteri Sediaan Gel Antiseptik ... ... 37
BAB IV HASIL DAN PEMBAHASAN ... ... 38
4.1 Hasil Identifikasi Tumbuhan...38
4.2 Hasil Pemeriksaan Karakterisasi...38
4.3 Hasil Ekstraksi ... ... .39
4.4 Hasil Skrinning Fitokimia ... . ... .40
4.5 Hasil Uji Aktivitas Ekstrak Etanol Daun Teh Hijau (EEDTH) ... ... 41
4.6 Pengamatan Stabilitas Sediaan ... ... 44
4.7 Hasil Pengamatan Homogenitas Sediaan ... ... 45
4.8 Hasil Penentuan pH Sediaan ... ... 45
4.9 Hasil Viskositas Sediaan Gel ... ... 45
BAB V KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 50
xii
DAFTAR TABEL
4.1 Hasil karakterisasi ekstrak teh hijau ... 38
4.2 Hasil skrining fitokimia ... 40
4.3 Pengujian aktivitas antibakteri ekstrak teh hijau ... 42
4.4 Hasil uji aktivitas antibakteri gel Hand Sanitizer ekstrak teh hijau terhadap bakteri Staphylococcus aureus dan Escherichia coli ... 43
4.5 Data pengamatan stabilitas gel Hand Sanitizer ... 44
4.6 Data pengamatan pH gediaan... 45
4.7 Data pengamatan viskositas sediaan ... 46
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia kaya akan aneka ragam jenis tanaman, baik sebagai sumber obat, tanaman pelindung atau bahan pangan. Informasi dan kajian ilmiah pada tanaman yang biasa digunakan sebagai bumbu atau bahan makanan masih jarang ditemukan, tanaman-tanaman tersebut potensial untuk dikembangkan sebagai obat dan nutraseutikal atau bahan makanan yang berkhasiat untuk mencegah atau mengobati penyakit (Fachraniah dan Novilasi, 2012).
Indonesia memiliki iklim tropis yang menyebabkan tanahnya subur sehingga banyak jenis tumbuhan yang dapat tumbuh, jenis tumbuhan berkhasiat sebagai obat adalah tumbuhan teh (Hariana, 2008)
Menurut (Juniaty, 2013), menyatakan bahwa kandungan kimia dalam daun teh digolongkan menjadi 4 kelompok besar yaitu : (1) golongan fenol, (2) golongan bukan fenol, (3) golongan aromatis dan (4) enzim. Keempat kelompok tersebut bersama-sama mendukung terjadinya sifat-sifat baik pada teh, apabila pengendaliannya selama pengolahan dapat dilakukan dengan tepat. Kandungan senyawa kimia pada daun teh serta perubahan-perubahan yang terjadi pada senyawa kimia tersebut selama pengolahan, sangat penting diketahui terutama bagi pelaku industri teh seperti pengusaha dan petani sehingga dapat menghasilkan produk teh yang becita rasa dan beraroma serta berkhasiat tinggi yang dapat bersaing dengan teh produksi luar negri. (Juniaty, 2013).
Mamfaat teh sebagai antibakteri telah diuji di berbagai penelitian. Sejumlah besar penelitian tersebut menyatakan bahwa teh dapat menunjukkan
2
penghambatan terhadap bakteri Bacillus careus, Campylobacter jejuni, CL.
Escherichia coli, Leginella pnuemaphila, Staphylococcus aureus (Friedman, 2010)
Kandungan katekin tertinggi terdapat pada teh hijau, disusul oleh teh oolong dan teh hitam. Perbedaan kadar katekin ini disebabkan karena perbedaan dalam tata cara proses pengolahan daun teh ( Alamsyah, 2006)
Katekin penting dalam proses daya antibakteri teh. Polifenol atau katekin dalam daun teh dilaporkan dapat mempengaruhi mikroflora, termasuk virus dan bakteri dalam saluran pencernaan. Polifenol teh dapat menekan pertumbuhan bakteri patogen tetapi tidak menekan pertumbuhan bakteri yang menguntugkan (Jain, 2006).
Escherichia coli dan Staphylococcus aureus adalah salah satu penyebab penyakit diare yang bersifat patogen. Escherichia coli adala bakteri gram negatif yang biasanya terdapat dalam saluran pencernaan, sehingga dapat mengakibatkan infeksi pada sistem saluran pencernaan. Staphylococcus aureus merupakan gram positif yang dapat menyebapkan infeksi kulit pada luka,bisul dan menyebapkan infeksi lain yaitu keracunan pada makanan (Jawetz, dkk., 2007).
Gel mempunyai beberapa keuntungan diantaranya tidak lengket, mempunyai aliran tiksotropik dan pseudoplastik yang berbentuk padat apabila disimpan dan akan segera mencair bila dikocok. Konsentrasi bahan untuk membentuk massa gel yang baik dibutuhkan hanya sedikit, disamping itu viskositas gel tidak mengalami perubahan yang berarti pada suhu penyimpanan (Sihombing dkk., 2009).
Berbagai produk gel yang mengandung zat antiseptik, khususnya gel
3
antiseptik tangan, yang pada saat ini telah banyak dikembangkan, produk-produk ini dinilai lebih efektif dan praktis dalam menghambat pertumbuhan bakteri yang ada pada tangan. Berdasarkan uraian diatas, maka peneliti melakukan penelitian mengenai formulasi sediaan gel Hand Sanitizer ekstrak simplisia teh hijau (Camelia sinensis L.) pada bakteri Escherichia coli dan Staphylococcus aureus.
Untuk dapat lebih memanfaatkan penggunaan teh hijau sebagai salah satu tumbuhan yang memiliki khasiat sebagai antibakteri.
Hand Sanitizer merupakan zat antiseptik. Menurut food and drug Administration (FDA), Hand Sanitizer dapat menghilangkan kuman kurang dari 30 detik. Hand Sanitizer memiliki kemampuan aktivitas bakteriosida yang baik terhadap bakteri Gram positif dan Gram negatif. Selain itu, Hand Sanitizer juga mengandung bahan antibakterial seperti triklosam atau agen antimikroba lain yang dapat menghambat pertumbuhan bakteri pada tangan seperti Escherichia coli dan Staphylococcus aureus (Radji, 2007).
Disaat pandemi begini mengembangkan produk sediaan gel Hand Sanitizer sangat dibutuhkan serta untuk meningkatkan pemanfaatan dari tanaman teh (Camelia sinensis L.) yang memiliki aktivitas antibakteri.
4 1.2 Perumusan Masalah
a. Apakah ekstrak teh hijau (Camelia sinensis L.) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus.
b. Apakah gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) memiliki Formula yang baik sebagai antibakteri.
c. Apakah sediaan gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus.
1.3 Hipotesis
a. Ekstrak teh hijau (Camelia sinensis L.) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus.
b. Gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) memiliki Formula baik sebagai antibakteri.
c. Sediaan gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus.
1.4 Tujuan Penelitian
a. Untuk mengetahui aktivitas antibakteri ekstrak teh hijau terhadap bakteri Escherichia coli dan Staphylococcus aureus.
5
b. Untuk mengetahui Formula gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) yang yang baik sebagai antibakteri.
c. Untuk mengetahui aktivitas antibakteri sediaan gel Hand Sanitizer ekstrak teh hijau (Camelia sinensis L.) terhadap bakteri Escherichia coli dan Staphylococcusaureus.
1.5 Manfaat Penelitian
Mengembangkan produk sediaan antiseptik tangan (Hand Sanitizer) dari bahan alam yaitu teh hijau (Camelia sinensis L.). Selain itu, untuk meningkatkan pemamfaatan dari tanaman teh hijau (Camelia sinensis L.) yang memiliki aktivitas antibakteri.
6 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Tanaman Teh merupakan tanaman yang termasuk dari keluarga Theaceae, Teh hijau berasal dari daratan Asia Selatan dan Tenggara, namun sekarang telah dibudidayakan diseluruh dunia, baik daerah tropis maupun sub tropis. Tumbuhan ini merupakan perdu atau pohon kecil yang biasanya dipangkas bila dibudidayakan untuk dipanen daunnya. Teh memiliki akar tunggang yang kuat. Bunganya kuning- putih berdiameter 2,5-4 cm dengan 7 hingga 8 petal (James, 1983).
2.2 Klasifikasi Tumbuhan
Klasifikasi tumbuhan teh yaitu:
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae
Kelas : Dicotyledoneae Ordo: Ericales Famili : Theaceae
Genus : Camellia
Spesies : Camelia sinensis (L.) (Depkes, 2001) 2.3 Morfologi Tanaman
Camellia sinensis (L.) suatu tanaman yang berasal dari famili Theaceae, merupakan pohon berdaun hijau yang memiliki tinggi 10 -15 meter di alam bebas dan tinggi 0,6 - 1,5 meter jika dibudayakan sendiri. Daun dari tanaman ini berwarna hijau muda dengan panjang 5-30 cm dan lebar sekitar 4 cm. Tanaman ini memiliki
7
bunga yang berwarna putih dengan diameter 2,5 - 4 cm dan biasanya berdiri sendiri atau saling berpasangan dua-dua (Ross, 2005). Buahnya berbentuk pipih, bulat, dan terdapat satu biji dalam masing-masing buah dengan ukuran sebesar kacang (Biswas, 2006).
2.4 Kandungan Teh Hijau
Teh hijau mengandung sejumlah zat gizi penting. Dalam setiap 100 g daun teh mengandung 7-80% air, polifenol 25-35% berat kering, kafein 2,5-4,5%, dan per gram berat kering daun teh mengandung mineral magnesium 1,90 mg, alumunium 400 µg, natrium 27 µg, kalium 21,50 mg, kalsium 3,70 µg, besi 89 µg, seng 34 µg, fosfor 3,30 mg, vitamin C, vitamin B2, vitamin D, vitamin K dan karotenoid (Rohdiana, 2009). Polifenol utama dalam teh hijau adalah katekin.
Kandungan katekin dalam teh hijau mencapai 25-35% bobot kering. Hasil penelitian menyebutkan bahwa, kandungan senyawa polifenol yang tinggi dalam teh hijau berperan sebagai pelindung terhadap serangan radikal bebas (Kumalaningsih, 2006).
2.5 Khasiat Tumbuhan Teh Hijau
Teh hijau memiliki berbagai manfaat, antara lain mengurangi resiko kanker (kanker perut, kanker payudara, kanker kandungan, kanker prostat, kanker rongga mulut), menurunkan kadar kolesterol darah, mencegah tekanan darah tinggi, membunuh bakteri, membunuh virus-virus influenza, mengurangi stress, menurunkan berat badan, meningkatkan kemampuan belajar, menurunkan kadar gula darah, mencegah pengeroposan gigi dimana flour merupakan komponen anorganik yang dapat memperkuat struktur gigi, sebagai antioksidan dan mencegah penuaan dini, mengatasi penyakit jantung koroner, menurunkan risiko terjadinya
8
penyakit kardiovaskuler, meningkatkan kekebalan tubuh, mencegah penyakit ginjal, mencegah penyakit parkinson, mencegah nafas tidak sedap, dan antiosteoporosis (Widyaningrum, 2013). Katekin yang terkandung dalam teh hijau dapat bersifat bakteriostatik atau bakterisid tergantung konsentrasinya sebagai senyawa fenol, katekin dapat bekerja dengan cara merusak dinding sel bakteri dan membran sitoplasmanya sehingga menyebabkan denaturasi protein. Di samping itu, teh hijau juga mempunyai efek terapeutik terhadap disentri (Handajani, 2002).
2.6 Pembagian Teh
Berdasarkan proses pengolahannya, teh di Indonesia dibagi menjadi 4 jenis, yaitu teh putih, teh hijau, teh oolong dan teh hitam. Teh putih merupakan jenis teh yang tidak mengalami proses fermentasi sama sekali, dimana proses pengeringan dan penguapan dilakukan dengan sangat singkat. Daun teh putih adalah daun teh yang paling sedikit mengalami pengolahan, sedangkan teh jenis yang lain umumnya mengalami empat sampai lima langkah pengolahan. Teh hijau diperoleh tanpa proses fermentasi (oksidasi enzimatis), yaitu dibuat dengan cara menginaktifkan enzim polifenol oksidase yang ada dalam pucuk daun teh segar, dengan cara pemanasan sehingga oksidasi terhadap katekin (zat antiok sidan) dapat dicegah. Teh oolong diproses secara semi fermentasi. Proses pembuatan dan pengolahan teh oolong berada diantara teh hijau dan teh hitam, dimana teh oolong dihasilkan melalui proses pemanasan yang dilakukan segera setelah proses penggulungan daun, dengan tujuan untuk menghentikan proses fermentasi oleh karena itu maa disebut Teh semi fermentasi. Teh hitam merupakan daun teh yang paling banyak mengalami fermentasi, sehingga dapat dikatakan pengolahan teh hitam dilakukan dengan fermentasi penuh (Santoso, 2008).
9 2.7 Gel
Gel merupakan sistem semi solid yang terdiri dari dispersi molekul-molekul kecil atau besar di dalam pembawa cairan berair yang membentuk seperti jeli dengan penambahan gelling agent. Gel merupakan sistem penghantaran obat yang sangat baik untuk cara pemberian yang beragam dan kompatibel dengan banyak bahan obat yang berbeda (Allen, 2002). Gel harus menunjukkan perubahan viskositas yang kecil pada berbagai temperatur, baik saat penyimpanan maupun penggunaan. Gel dengan tujuan penggunaan topikal tidak boleh lengket (Zath dan Kushla, 1996).
Adapun beberapa pengujian stabilitas fisik sediaan gel yaitu:
1. Viskositas
Pengujian viskositas ini dilakukan untuk mengetahui besarnya suatu viskositas dari sediaan, dimana viskositas tersebut menyatakan besarnya tahanan suatu cairan untuk mengalir. Makin tinggi viskositas maka makin besar tahanannya.
2. Pengukuran pH
Digunakan untuk mengetahui pH gel, apakah sesuai dengan pH kulit yaitu antara 4,5-6,5.
3. Homogenitas
Pengujian homogenitas dilakukan dengan cara sampel gel dioleskan pada sekeping kaca atau bahan transparan lain. Sediaan harus menunjukkan susunan yang homogen dan tidak terlihat adanya butiran kasar (Ditjen POM, 1985).
Sifat fisik dari sediaan gel dapat dilihat dari pH, stabilitas, dan nilai viskositas nya. Organoleptis merupakan pengamatan fisik yang meliputi bentuk, warna dan
10
bau. Daya sebar merupakan karakteristik penting dalam formulasi gel. Karena daya sebar mempengaruhi kemudahan saat sediaan diaplikasikan pada kulit. Daya sebar suatu sediaan biasanya berbanding terbalik dengan nilai viskositas. Semakin tinggi nilai viskositas, daya sebar akan semakin rendah (Garg et al, 2002).
Viskositas merupakan suatu tahanan dari suatu sediaan untuk mengalir semakin kental atau semakin besar nilai viskositas maka semakin besar tahanannya (Sinko, 2006).
2.8 Hand Sanitizer
Hand Sanitizer adalah gel dengan berbagai kandungan yang cepat menghambat pertumbuhan mikroorganisme yang ada di kulit tangan. Hand Sanitizer banyak digunakan karena alasan kepraktisan. Hand Sanitizer mudah dibawa dan bisa cepat digunakan tanpa perlu menggunakan air. Hand Sanitizer sering digunakan ketika dalam keadaan darurat contohnya ketika kita tidak bisa menemukan air untuk mencuci tangan. Menurut US FDA (United State Food and Drug Administration) penggunaan Hand Sanitizer dapat membunuh kuman dalam waktu yang relatif cepat (Benjamin, 2010).
Menurut Hapsari (2015), seiring perkembangan zaman, dikembangkan juga pembersih tangan non alkohol, tetapi apabila tangan benar-benar kotor, baik oleh tanah, udara, darah, ataupun lainnya, mencuci tangan dengan air dan sabun lebih disarankan karena gel Hand sanitizer tidak dapat efektif membunuh kuman dan membersihkan material organik lainnya.
Gel Hand sanitizer juga dikenal dengan detergen sintetik cair pembersih tangan yang merupakan sediaan pembersih yang dibuat dari bahan aktif detergen sintetik dengan atau tanpa penambahan zat lain yang tidak menimbulkan iritasi pada kulit
11
(BSN, 1992). Pemerintah menjamin keamanan dan mutu produk ini dengan membuat regulasi dalam Standart Nasional Indonesia. Syarat mutu detergen sintetik cair pembersih tangan di Indonesia diatur berdasarkan Badan Standar Nasional (1992) yang dilihat pada tabel berikut ini.
No Jenis Uji Persyaratan
1 Kadar bahan aktif Minimal 5 %
2 pH 4,5 – 8,0
3 Bentuk cairan Stabil
4 Zat tambahan Sesuai peraturan yang berlakuy
2.9 Gelling Agent
Gelling agent merupakan basis dari sediaan gel yang digunakan untuk membentuk gel dan idealnya harus tidak berinteraksi dengan komponen lain dari formulasi serta harus bebas dari kontaminasi mikroba. Gelling agent dapat diperoleh dari alam maupun sintetik dan memiliki bobot molekul yang tinggi.
Gelling agent dapat terdispersi dalam air dan bisa mengembang, serta meningkat kan viskositas. Gelling agent juga harus dapat stabil terhadap perubahan suhu dan pH selama pembuatan dan penggunaan preservative tidak boleh mengubah rheologinya, dapat membentuk gel yang tidak berwarna, menimbulkan sensasi dingin saat digunakan di tempat aplikasi (Rowe, et al., 2009).
Gelling agent yang sering digunakan adalah carboxy methyl cellulose, dikenal sebagai CMC. Carageenan, gum tragacanth, gum karaya, sodium alginate, carbomer resin, dan magnesium aluminium silicates juga digunakan sebagai gelling
12
agent (Lieberman, Rieger and banker, 1996). Carboxy methyl cellulose sodium (CMC-Na) berbentuk serbuk granul putih, tidak berbau, tidak berasa, dan bersifat higroskopis. Pada konsentrasi 3-6% dalam formula biasa digunakan sebagai basis gel, tidak dapat larut dalam aseton, etanol (95%), eter, dan toluene, tetapi mudah terdispersi dalam air pada segala temperatur (Rowe, et al., 2009).
2.10 Humektan
Humektan adalah bahan dalam produk kosmetik yang dimaksudkan untuk meningkatkan jumlah air (kelembaban) pada lapisan kulit terluar saat produk digunakan. Propilen glikol biasa digunakan sebagai antimicrobial preservative, disinfektan, humektan, plasticizer, pelarut, agen stabilitas, dan cosolvent.
Pemeriannya adalah jernih, tidak berwarna, kental, biasanya tidak berbau, dengan rasa manis, sedikit tajam seperti gliserol. Pada konsentrasi sekitar 15%
dari formula. Propilen glikol berfungsi sebagai humektan. Dapat bercampur deng an aseton, kloroform, etanol (95%), gliserin, dan air, kelarutannya adalah 1 bagian dalam 6 bagian eter. Tidak bercampur dengan minyak mineral, tetapi dapat terla rut dalam beberapa minyak esensial. Secara kimia stabil ketika dicampur dengan etanol (95%), gliserin, atau air, dan larutannya dapat disterilisasi dengan auto klaf (Rowe, et al., 2009).
2.11 Metil Paraben
Metil paraben berbentuk serbuk kristal, berwarna putih dan tidak berbau.
Rumus kimia C8H8O3, dimana range konsentrasi yang biasa digunakan yaitu 0,02%
- 0,3% (Rowe, et al., 2009).
2.12 Aquades
13
Aquades merupakan cairan jernih, tidak berbau, tidak berwarna, dan tidak berasa. Aquades dibuat dengan cara menyuling air yang dapat diminum. Rumus kimia dari aquades yaitu H2O dengan bobot molekul 18,02 (Departemen Kesehatan RI, 1979).
2.13 Kulit
Kulit adalah lapisan jaringan yang terdapat yang terdapat pada bagian luar yang menutupi dan melindungi permukaan tubuh. Kulit disebut juga integumen atau kutis, tumbuh dari dua macam jaringan yaitu jaringan epitel yang menumbuhkan lapisan epidermis dan jaringan pengikat (penunjang) yang menumbuhkan lapisan dermis (kulit dalam). Kulit merupakan organ yang paling luas sebagai pelindung tubuh terhadap bahaya bahan kimia, cahaya matahari, mikroorganisme dan menjaga keseimbangan tubuh dengan lingkungan (Syaifuddin, 2012).
Kulit berfungsi sebagai pembatas terhadap serangan fisika-kimia. Kulit berfungsi sebagai thermostat dalam mempertahankan suhu tubuh, melindungi tubuh dari serangan mikroorganisme, sianr ultraviolet, dan berperan pula dalam mengatur tekanan darah (Lachman, 1994). Kulit melindungi tubuh dari trauma dan merupakan benteng pertahanan terhadap infeksi bakteri, virus dan jamur (Price dan Wilson, 2005). Kulit berperan sebagai lapisan pelindung tubuh terhadap pengaruh luar, baik pengaruh fisik Maupun kimia. Kulit juga merupaknsawar (barrier) fisiologik yang penting karena mampu menahan penembusan bahan gas, cair, maupun padat, baik yang berasal dari lingkungan dari lingkungan luar tubuh maupun komponen yang dihasilkan oleh mikroorganisme. Struktur senyawa
penyusun sel- sel kulit sangat
14
penting dalam mempertimbangkan absorpsi perkutan dari senyawa yang terkandung dalam sediaan yang diaplikasikan pada permukaan kulit (Ismail,2013).
Kulit manusia tersusun atas 3 lapisan utama, dari luar kedalam yakni epidermis (non-viable epidermis dan viable epidermis), dermis, dan endodermis. Lapisan terluar merupakan turunan dari ektoderm yang disebut epidermis. Epidermis terhubung dengan dermis oleh taut dermo-epidermic (dermo-epidermic junction).
Dibawah dermis terdapat lapisan hypodermis (endodermis). Setiap lapisan dilalui oleh ujung-ujung syaraf dan pembuluh darah. Pembuluh darah perifer yang melintasi kulit mengalirkan darah sebanyak 0,3 mL/jam/cm3 (Ismail, 2013).
2.14 Metode Ekstraksi
Metode ekstraksi daun teh dilakukan dengan metode maserasi, yaitu suatu metode ekstraksi dengan perendaman bahan dengan pelarut yang sesuai dengan senyawa aktif yang akan diambil dengan pemanasan rendah atau tanpa adanya proses pemanasan. Metode ini memberikan keuntungan bahwa cairan ekstraksi yang dibutuhkan lebih sedikit dan memberikan hasil ekstrak yang lebih pekat.
Namun, kerugian dari metode ini adalah membutuhkan waktu yang cukup lama yaitu sampai beberapa hari (Voight, 1994).
Pada maserasi, ekstrak simplisia teh hijau direndam dengan menggunakan etanol 96%. Larutan kemudian akan berkumpul di dalam wadah gelas, setelah mencapai tinggi maksimalnya secara otomatis dipindahkan ke dalam labu (Putri, 2008). Cairan ekstrak tersebut kemudian dimasukkan dalam Rotaric evaporator untuk membuat cairan ekstraksi semakin pekat dan menguapkan pelarutnya.
Kemudian hasil ekstraksi disimpan dalam botol steril berwarna coklat dalam suhu kamar (25oC) dan untukmencegah terjadinya proses oksidasi oleh sinar matahari
15 (Rahayu, 2009).
2.15 Bakteri
Bakteri berasal dari bahasa Latin bacterium (jamak,bacteria) adalah mikro organisme yang kebanyakan uni seluler (bersel satu), dengan struktur yang lebih sederhana (Tamher, 2008). Bakteri dapat dibagi menjadi dua berdasarkan pewar naan gram yaitu bakteri gram positif dan bakteri gram negatif. Bakteri gram positif merupakan bakteri yang dapat mempertahankan zat warna primer yaitu kristal karbon ungu, sedangkan bakteri gram negatif adalah bakteri yang mampu melepas zat warna primer dan mengikat zat warna sekunder (safranin) (Kumala, 2006).
Contoh bakteri gram positif adalah Staphylococcus aureus, Streptococcus, Bacillus, Corynebacterium, Listeria, dan lain-lain. Bakteri gram negatif contohnya seperti Neisseriaceae, Escherichia coli, Shigella, Klabsiella, Salmonella, Vibrio, Pseudomonadace , Haemoplilus, Bordetella, Brucella (Lucky et al., 1994).
2.16 Staphylococcus aureus
Taksonomi dari bakteri Staphylococcus aureus adalah sebagai berikut : Kingdom : Bacteria
Phylum : Firmicutes Class : Bacili
Ordo : Eubacteriales Famili : Micrococcacea Genus : Staphylococcus
Spesies : Staphylococcus aureus (Soemarno, 2000).
Staphylococcus merupakan bakteri gram positif berbentuk kokus bulat, berdiameter sekitar 1 mikron tersusun dalam kelompok yang tidak teratur seperti kelompokbuah anggur. Bakteri ini dapat dibiakkan baik pada keadaan aerob maupun anaerob dan bersifat tidak bergerak, tidak berkapsul, dan tidak berspora.
16
Suhu optimal bagi bakteri Staphylococcus untuk berkembang adalah pada suhu 37oC, tetapi suhu optimal bagi bakteri ini untuk menghasilkan pigmen adalah pada suhu kamar (20-25oC). Pada media agar, bakteri tersebut memiliki karakteristik koloni berbentuk bulat, diameter 1-2 mm, cembung, buram, mengkilat dan konsistensinya lunak. Warna nya yang khas adalah kuning atau coklat keemasan.
(Jawetz, 2007). Staphylococcus ditemukan sebagai flora normal pada kulit, saluran pernapasan, dan saluran cerna manusia. Staphylococcus aureus merupakan penyebab infeksi piogenik kulit yang paling sering dan juga merupakan spesies yang paling patogen.
Bakteri tersebut mampu menimbulkan penyakit-penyakit yang berspektrum luas pada manusia dimulai dari penyakit yang disebabkan oleh toxin, seperti toxic shock syndrome, sampai dengan penyakit-penyakit yang mematikan seperti septicemia, endocarditis, pneumonia, dan osteomyelitis. (Nickerson et al., 2009).
Staphylococcus aureus dapat menyebabkan penyakit baik melalui kemampuannya untuk berkembang biak dan menyebar luas di jaringan serta dengan cara menghasilkan berbagai substansi ekstraseluler. Beberapa substansi tersebut adalah: (Jawetz, 2007).
a. Katalase
Staphylococcus menghasilkan katalase, yang mengubah hidrogen peroksida menjadi air dan oksigen.
b. Koagulase dan Faktor Pengumpal
Staphylococcus menghasilkan koagulase, suatu protein mirip enzim yang dapat menggumpalkan plasma yang mengandung oksalat atau sitrat. Koagulase dianggap sama dengan memiliki potensi menjadi patogen invasif. Faktor koagulasi
17
adalah kandungan permukaan Staphylococcus aureus yang berfungsi melekatkan organisme ke fibrin atau fibrinogen. Bila berada di dalam plasma, Staphylococcus aureus membentuk gumpalan.
c. Enzim lain
Enzim-enzim lain yang dihasilkan oleh Staphylococcus antara lain adalah hialuronidase, atau faktor penyebar.
d. Eksotoksin
Eksotoksin merupakan protein heterogen yang bekerja dengan spektrum luas pada membrane sel eukariot. Eksotoksin merupakan hemolisin yang kuat. Beta toksin dapat menguraikan sfingomielin sehingga toksin untuk berbagai sel, termasuk sel darah merah manusia. Delta toksin melisiskan sel darah merah manusia dan hewan. Lamda toksin bersifat heterogen dan terurai menjadi beberapa subunit pada deterjen non ionik. Toksin tersebut mengganggu membrane biologik dan dapat berperan pada penyakit diare akibat Staphylococcus aureus.
e. Toksin Eksfoliatif
Toksin ini menyebabkan pemisahan interseluler lapisan epidermis antara stratum spinosum dan stratum granulosum, mungkin melalui disrupsi tautan interseluler. Terdapat dua varian toksin eksoliatif, yaitu varian yang bersifat antigenik pada manusia dan varian yang bertindak sebagai antibodi yang memberi efek anti toksik terhadap toksin itu sendiri.
f. Enterotoksin
Enterotoksin merupakan penyebab penting dalam keracunan makanan;
enterotoksin dihasilkan bila Staphylococcus aureus tumbuh di makanan yang mengandung karbohidrat dan protein. Enterotoksin juga tahan terhadap panas dan
18 resisten terhadap kerja enzim usus
2.17 Escherichia coli Domain : Bacteria Kingdom : Eubacteria Filum : Proteobacteria
Kelas : Gammaproteobacteria Ordo : Eubacteriales
Famili : Enterobacteriaceace Genus : Eschericia
Spesies : Eschericia coli
Escherichia coli merupakan bakteri Gram negatif yang berbentuk batang pendek (kokobasil) dengan ukuran 0,4-0,7 μm, tidak berspora dan beberapa strain mempunyai kapsul. Eschericia coli tumbuh baik pada hampir semua media yang biasa di pakai di laboratorium Mikrobiologi; pada media yang digunakan untuk isolasi kuman enterik, sebagian besar strain Escherichia coli tumbuh sebagai koloni yang meragi laktosa. Escherichia coli bersifat fakultatif anaerob (Jawetz, 2007).
Beberapa strain bila ditanam pada agar darah menunjukkan hemolisis tipe beta (Lucky et al,1994). Escherichia coli secara khas menunjukkan hasil positif pada tes indol, lisin dekarboksilase, dan fermentasi manitol, serta menghasilkan gas dari glukosa (Soemarno, 2000). Escherichia coli mempunyai karakteristik berwarna merah atau merah jambu, bulat, dan tidak berlendir. Namun, pada Eosin methylene blue agar, Escherichia coli menghasilkan koloni yang berwarna metallic green. Escherichia coli merupakan penyebab infeksi saluran kemih yang paling sering pada sekitar 90% infeksi saluran kemih pertama pada wanita muda. Gejala dan tanda-tandanya antara lain sering berkemih, disuria hematuria, danpiuria.
19
(Jawetz, 2007). Adapun faktor-faktor patogenitas dari Eschericia coli sebagai berikut: Antigen permukaan pada Escherichia coli paling tidak terdapat 2 tipe fimbria, yaitu tipe sensitif manosa (pili) dan tipe resisten manosa (CFAS I & II).
Kedua tipe fimbriae ini penting sebagai colonization factor, yaitu untuk perlekatan sel bakteri pada sel/jaringan inang (Lucky etal, 1994).
2.18 Antimikroba
Antimikroba merupakan substansi yang dihasilkan oleh suatu mikroorganisme, yang mempunyai kemampuan untuk menghambat pertumbuhan ataupun membunuh mikroorganisme lain. Aktivitas antimikroba diukur in vitro untuk menentukan potensi agen antibakteri dalam larutan, konsentrasinya dalam cairan tubuh atau jaringan, dan kerentanan mikroorganisme tertentu terhadap obat dengan konsentrasi tertentu. Ada beberapa faktor yang mempengaruhi aktivitas antimikroba in vitro yaitu pH lingkungan, komponen medium, stabilitas obat, ukuran inokulum, lama inkubasi, dan aktivitas metabolik mikroorganisme (Warsa, 1994).
2.19 Cara Pengukuran Aktivitas Antimikroba
Penentuan kepekaan bakteri patogen terhadap antimikroba dapat dilakukan dengan salah satu metode utama yaitu metode dilusi ataupun metode difusi. Dalam Jawetz (2007), metode-metode utama yang dapat digunakan adalah: Metode Dilusi Cara kerja metode dilusi yaitu Sejumlah zat anti mikroba dimasukkan ke dalam medium bakteriologi padat atau cair. Biasanya digunakan pengenceran dua kali lipat zat anti mikroba. Medium akhirnya diinokulasi dengan bakteri yang diuji.
Tujuan akhirnya adalah mengetahui seberapa banyak jumlah zat anti mikroba yang diperlukan untuk menghambat pertumbuhan atau bakteri yang diuji.
20 BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan merupakan metode eksperimental (experimental research), yang meliputi pengumpulan dan identifikasi bahan tumbuhan, karakterisasi estrak simplisia, pembuatan ekstrak teh hijau, serta pengujian antibakteri ekstrak teh hijau (Camelia sinensis L.). Penelitian ini dilakukan di Laboratorium Fitokimia, Laboratorium Farmasi Fisik, Laboratorium Mikrobiologi, dan Laboratorium Kosmetologi, Fakultas Farmasi Universitas Sumatera Utara, Medan.
21 3.1 Alat dan Bahan
3.1.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah aluminium foil, autoklaf (Fisons), batang pengaduk, beaker glass (Iwaki pyrex), benang wol, Biological Safety Cabinet (Astec HLF 1200 L), bunsen, blender, cawan petri, cawan penguap, erlenmenyer (Iwaki pyrex), inkubator (Memmert), jangka sorong, jarum ose, kain kassa, kapas, kertas perkamen, kertas saring, kompor gas (Rinnai), kurs porselin, lumpang dan Alu porselen, lemari pendingin (Toshiba), mikro pipet (Eppendorf), mikroskop (Olympus), neraca analitik (Metler AE 200), oven (Memmert), object glass, penangas air, pH meter (Hanna), pinset, pipet tetes, rotary evaporator (Haake D), Spatula, tanur (Gallenkomp) vial, dan Viscometer Brookfield.
3.1.2 Bahan
Bahan yang digunakan adalah teh hijau (Camelia sinensis L.), CMC-Na, Muller Hinton Agar (Himedia), Nutrient Agar (Oxoid), Nutrient Broth (Oxoid), pencadang kertas berdiameter 6 mm dan bahan-bahan yang berkualitas proanalisa
@-naftol, amil alkohol, asam nitrat pekat, asam asetat anhidrat, asam klorida pekat, asam sulfat pekat, benzena, besi (III) klorida, bismuth nitrat, etanol 96%, etilasetat, iodium, isopropanol, kalium iodida, kloroform, metanol, natrium hidroksida, natrium klorida, n-heksana, raksa (II) klorida, serbuk magnesium, timbal (II) asetat dan toluene, suspensi standar CMC-Na. Bakteri yang digunakan adalah Escherichia coli ATCC dan Staphylococcus aureus AATC 1228.
3.2 Penyiapan sampel 3.2.1 Pengambilan sampel
22
Pengambilan sampel dilakukan dengan purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel digunakan adalah sediaan teh hijau (Camelia sinensis L.) merek Zuma Superco yang di ambil dari Sidamanik, kecamatan Sidamanik, kabupaten Simalungun.
3.2.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Medanense, Universitas Sumatera Utara, Medan.
3.2.3 Pengolahan sampel
Sampel yang sudah di ambil kemudian di blender hingga menjadi serbuk.
3.3 Pembuatan Larutan Pereaksi
3.3.1 Pereaksi Asam Klorida 2 N
Sebanyak 16,67 ml asam klorida pekat dilarutkan dalam akuades hingga volume 100 ml (Ditjen POM, 1979).
3.3.2 Pereaksi Asam Sulfat 2N
Sebanyak 5,4 ml asam sulfat pekat dilarutkan dalam akuades hingga volume 100 ml (Ditjen POM, 1979).
3.3.3 Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) Klorida dilarutkan dalam akuades hingga volume 100 ml lalu disaring (Ditjen POM, 1979).
3.3.4 Pereaksi Bouchardat
Sebanyak 4 g Kalium iodida dilarutkan dalam sedikit akuades kemudian ditambahkan 2 g iodium, setelah semuanya larut ditambahkan akuades hingga 100 ml (Depkes, 1995).
23 3.3.5 Pereaksi Dragendorff
Pereaksi dibuat dua larutan persediaan : (1) 0,6 gram bismuth nitrat dalam 2 ml HCl pekat dan 10 ml air; (2) 6 gram kalium iodida dalam 10 ml air. Larutan persediaan ini dicampur dengan 7 ml HCl pekat dan 15 ml air (Harborne, 1987).
3.3.6 Pereaksi Kloralhidrat
Larutan kloralhidrat dibuat dengan cara melarutkan kloralhidrat sebanyak 50 g dalam 20 ml air (Depkes, 1995).
3.3.7 Pereaksi Liebermann-Burchard
Sebanyak 5 ml asan asetat anhidrida dicampurkan dengan 5 ml asam sulfat pekat kemudian ditambahkan etanol hingga 50 ml (Depkes, 1995).
3.3.8 Pereaksi Meyer
Sebanyak 1,35 g raksa (II) klorida dilarutkan dalam 60 ml akuades. Kemudian pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10 ml akuades lalu dicampurkan keduanya dan ditambahkan akuades hingga 100 ml (Depkes, 1995).
3.3.9 Pereaksi Molish
Sebanyak 3 g alfa-naftol ditimbang kemudian dilarutkan dalam asam nitrat 0,5 N hingga volume 100 ml (Depkes, 1995).
3.3.10 Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam akuades hingga 100 ml (Depkes, 1995).
3.3.11 Pereaksi Timbal (II) Asetat 0,4M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas karbondioksida hingga 100 ml (Depkes, 1995).
3.4 Pemeriksaan Karakteristik Simplisia
24 3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk Teh hijau (Camelia sinensis L. ) dengan mengamati bentuk, bau, rasa, dan warna.
3.4.2 Penetapan kadar air a. Penjenuhan toluen
Sebanyak 200 ml toluen dimasukkan ke dalam labu alas bulat, lalu ditambahkan 2 ml air suling, kemudian alat dipasang dan dilakukan destilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama kurang lebih 30menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,1 ml.
b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 gram simpllisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kemudian toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik dan setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,1 ml.
Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998).
3.4.3 Penetapan kadar sari larut dalam air
Sebanyak 5 gram simplisia dimaserasi selama 24 jam dalam 100 ml air- kloroform (2,5 ml kloroform dalam akuades sampai 1 L) dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 ml filtrat diuapkan hingga
25
kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105 0C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.4 Penetapan kadar sari larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96 % dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 ml filtrat diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105 0C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.5 Penetapan kadar abu total
Sebanyak 2,5 gram serbuk simplisia yang telah digerus dan ditimbang seksama, dimasukkan ke dalam krus porselen yang telah dipijar dan ditara, kemudian diratakan. Krus porselen bersama isinya dipijarkan perlahan hingga arang habis, didinginkan, ditimbang sampai diperoleh bobot yang tetap.kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, 1995).
3.4.6 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total didihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring dengan kertas saring, lalu cuci dengan air panas. Residu dan kertas saring dipijarkan sampai diperoleh bobot yang tetap, didinginkan dan ditimbang beratnya.
Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di
26 udara (Depkes, 1995).
3.4.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total didihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring dengan kertas saring, lalu cuci dengan air panas. Residu dan kertas saring dipijarkan sampai diperoleh bobot yang tetap, didinginkan dan ditimbang beratnya.
Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di udara (Depkes, 1995).
3.5 Skrining Fitokimia
Skrining fitokimia dari serbuk simplisia dan ekstrak etanol meliputi pemeriksaan golongan senyawa alkaloida, flavonoida, saponin, tanin, glikosida dan steroida/triterpenoida (Depkes, RI, 1995; Farnsworth, 1966).
3.5.1 Pemeriksaan flavonoida
Sebanyak 0,5 gram serbuk simplisia ditambahkan 20 ml air panas, ddiidihkan selama 10 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 gram serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.2 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 gram kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit. Didinginkan dan disaring. Filtratnya dipakai untuk percobaan sebagai berikut :
27
• Filtrat sebanyak 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Mayer, akan terbentuk endapan menggumpal bewarna putih ataukuning.
• Filtrat sebanyak 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan bewarna coklat sampaihitam.
• Filtrat sebanyak 3 tetes ditambahkan dengan 2 tetes larutan pereaksi Dragendorff, akan terbentuk endapan merah atau jingga.
Serbuk mengandung alkoloida jika sekurang-kurangnya terbentuk endapan dengan menggunakan dua golongan larutan percobaan yang digunakan (Depkes, RI, 1995).
3.5.3 Pemeriksaan glikosida
Sebanyak 3 gram serbuk simplisia disari dengan 30 ml campuran etanol 95%
dengan air suling (7:3), ditambahkan asam sulfat pekat sehingga diperoleh pH 2, kemudian direfluks selama 10 menit, didinginkan dan disaring. Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali.Kumpulan sari air diuapkan dengan suhu tidak lebih dari 50 0C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa dipakai untuk percobaan berikut:
✓ Larutan sisa dimasukkan ke dalan tabung reaksi selanjutnya diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish.
Ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatangula.
✓ Larutan percobaan diuapkan di atas penangas air. Diarutkan sisa dalam 5 ml asam asetat anhidrat. Tambahkan 10 tetes asam sulfat pekat, akan terjadi warna
28
biru atau hijau, menunjukkan adanya glikosida (Depkes, RI,1995).
3.5.4 Pemeriksaan steroida/triterpenoida
1 gram sampel dimaserasi dengan n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.5.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel ditimbang dimasukkan kedalam tabung reaksi, kemudian ditambahkan 10 ml air panas, didinginkan kemudian dikocok selama 10 detik, jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan busa tersebut tidak hilang dengan penambahan 1 tetes asam klorida 2N, maka hasil tersebut menunjukkan terdapatnya saponin ( Depkes, 1995).
3.5.6 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling kemudian disaring, ekstraknya dieencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%, jika terjadi warna hijau,biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6 Pembuatan Ekstrak Etanol Teh Hijau
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut etanol 96%. Masukkan 10 bagian simplisia atau campuran simplisia dengan derajat
29
yang cocok kedalam sebuah bejana, tuangi dengan 75 bagian cairan penyari, tutup, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukup nya hingga diperoleh 100 bagian.
Pindahkan kedalam bejana tertutup, biarkan ditempat sejuk, terlindung dari cahaya selama 2 hari. Enap tuangkan atau saring (Ditjen POM, 1979).
3.7 Sterilisasi Alat dan Bahan
Alat dan bahan yang digunakan dalam suatu uji aktivitas aktivitas antibakeri disterilkan terlebih dahulu sebelum digunakan dalam percobaan. Media pertumbuhan di sterilkan di autoklaf pada suhu 121oC selama 15 menit dan alat- alat gelas yang digunakan disterilkan di oven pada suhu 160-170oC selama 1-2 jam.
Jarum ose dan pinset di sterilkan dengan cara dibakar dengan nyala bunsen (Lay, 1994).
3.8 Pembuatan media
3.8.1 Pembuatan media Nutrient Agar (NA) Komposisi :
Lab-lamcopowder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Agar 15,0 g
Air suling Ad 1 liter
30 Cara pembuatan :
Sebanyak 28 g nutrient agar dilarutkan dalam air suling steril ad 1000 ml, kemudian dipanaskan hingga semua larut, dalam keadaan panas larutam tersebut kemudian dimasukkan dalam erlenmenyer. Disterilkan di autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.8.2 Pembuatan Media Nutrient Broth (NB) Komposisi :
Lab-lamco powder 1.0 g Yeast extract 2.0 g Peptone 5.0 g Sodium chloride 5.0 g
Air suling ad 1 Liter a d Cara pembuatan :
Sebanyak 13 g nutrient broth dilarutkan dalam air suling steril ad 1000 ml, kemudian dipanaskan hingga semua larut, dalam keadaan panas larutan tersebut kemudian dimasukkan dalam erlenmenyer. Disterilkan di autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.8.3 Pembuatan Media Muller Hinton Agar (MHA) Komposisi :
Casein acid hydrolisate 17,50 g Starch 1,50 g
Agar 17,00 g
Air suling ad 1 liter Cara pembuatan :
31
Sebanyak 36 g Muller Hinton Agar (MHA) ditimbang. Kemudian disuspensikan kedalam air suling ad 1000 ml, lalu dipanaskan sampai bahan larut sempurna, lalu disterilkan di dalam autoklaf selama 15 menit pada suhu 121oC (Himedia, 2003).
3.8.4 Pembuatan Media Agar Miring
5 ml media media nutrient agar (NA) yang telah dimasak di masukkan kedalam tabung reaksi, ditutup dan dibungkus lalu disterilkan didalam autoklaf selama 15 menit pada suhu 121oC. Kemudian tabung yang berisi agar diletakkan pada kemiringan 30-45oC Diperhatikan bahwa agar tidak menyentuh tutup tabung Agar dibiarkan menjadi dingin dan keras.
3.8.5 Suspensi Standar Mc Farland 0,5 Komposisi :
Larutan BaCl2 1,175% b/v 0,5 ml Larutan H2SO4 1% v/v 99,5 ml Cara pembuatan :
Kedua larutan dicampurkan dalam tabung reaksi steril, dikocok sampai homogem dan ditutup. Apabila hasil suspensi bakteri sama dengan kekeruhan suspensi standar berarti konsentrasi bakteri 108 CFU/ml (Lay, 1994).
3.9 Pembiakan Bakteri
3.9.1 Pembuatan Stok kultur Bakteri
Dilakukan dalam Biological Safety Cabinet (BSC), satu koloni bakteri diambil dengan menggunakan jarum ose steril, koloni bakteri tersebut kemudian ditanamkan pada media nutrient agar miring dengan cara menggores, setelah itu
32
diinkubasi dalam inkubator pada suhu 37oC selama 18-24 jam (Ditjen POM RI, 1995).
3.9.2 Peremajaan Bakteri
Dilakukan dalam Biological Safety Cabinet (BSC), satu koloni bakteri diambil dengan menggunakan jarum ose steril, lalu ditanam pada media NA miring dengan cara menggores, kemudian diinkubasi dalam inkubator pada suhu 36-37oC selama 18-24 jam (Depkes RI,1995).
3.9.3 Pembuatan Inokulum Bakteri
Dilakukan dalam Biological Safety Cabinet (BSC), bakteri diambil dengan menggunakan jarum ose steril kemudian disuspensikan kedalam 10 ml Nutrient broth (NB), kemudian diinkubasi selama 1-2 jam hingga diperoleh kekeruhan yang sama dengan standar Mc Farland (Konsentrasi 108 CFU/ml, kemudian dilakukan pengenceran suspensi bakteri dengan memipet 0,1 ml biakan bakteri (108 CFU/ml), dimasukkan kedalam tabung steril yang berisi nutrient broth (NB) steril sebanyak 9,9 ml dan di vortex hingga homogen maka suspensi bakteri konsentrasinya sama dengan 106 CFU/ml.
3.10 Pembuatan Larutan Uji Ekstrak simplisia teh hijau (Camelia sinensis L.) dengan berbagai konsentrasi
Ekstrak teh hijau (Camelia sinensis L) ditimbang 5 g kemudian dilarutkan dengan pelarut etanol 96% hingga 10 ml maka konsentrasi ekstrak adalah 500 mg/ml. Larutan tersebut diencerkan kembali dengan pelarut etanol 96% sehingga didapat konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml, 50 mg/ml,40 mg/ml, 30 mg/ml.
33
3.11 Pengujian Aktivitas Antibakteri Ekstrak simplisia Teh Hijau (Camelia sinensis L.)
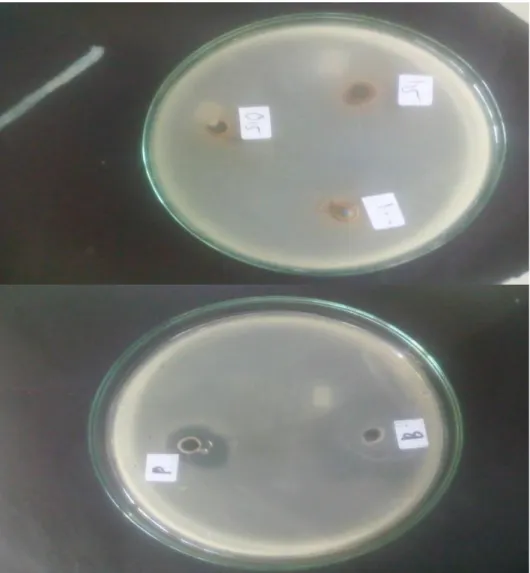
Dilakukan dalam Biological Safety Cabinet (BSC), sebanyak 0,1 ml suspensi inokulum bakteri Escherichia coli dimasukkan ke dalam cawan petri steril, kemudian tuangkan 15 ml MHA ke dalam cawan, lalu dihomogenkan dan didiamkan pada suhu kamar hingga media memadat. Cakram kertas yang telah dicelupkan dalam larutan uji dengan berbagai perbandingan diletakkan pada permukaan media sedangkan cakram yang dicelupkan kedalam etanol 96%
digunakan sebagai kontrol. Cawan didiamkan pada suhu kamar selama 10-15 menit, kemudian diinkubasi pada suhu 37oC selama 18-24 jam, kemudian diameter zona hambat di sekitar cakram diukur dengan menggunakan jangka sorong.
Pengujian dilakukan dengan tiga kali pengulangan (triplo). Perlakuan yang sama dilakukan terhadap inokulum bakteri Staphylococcus aureus (Ditjen POM, 1995).
3.12 Prosedur Pembuatan Gel Antiseptik Tangan 3.12.1 Formula Dasar gel
a. Formula dasar gel (Widaningsih dan Septi, 2016) R/ HPMC 5 g
Propilen glikol 5 ml
b. Formula dasar gel yang telah dimodifikasi R/ CMC – Na 3 g
Nipagin 0,02 g
Pewangi 15 tetes
Air suling ad 100 ml
34
Propilen glikol 15 ml
Nipagin 0,02 g
Pewangi 15 tetes Air suling ad 100 ml
Cara pembuatan:
Diawali dengan menaburkan CMC-Na di dalam lumpang yang berisi aquades selama 15-30 menit hingga mengembang digerus sampai terbentuk dasar gel (massa 1), kemudian nipagin dilarutkan dengan propilen glikol (massa II), lalu dicampur massa II ke massa I, tambahkan bahan pewangi teh kemudian diaduk secara homogen.
3.12.2 Formulasi Sediaan Gel Antiseptik Tangan
Sediaan gel dibuat kedalam 4 sediaan, yaitu satu sediaan blanko (dasar gel) dan sediaan yang mengandung ekstrak teh hijau. Konsentrasi ekstrak teh hijau yang digunakan dalam penelitian ini yaitu 5 mg/ml, 10 mg/ml, 15 mg/ml. Adapun formula yang digunakan dalam penelitian ini dapat dilihat pada tabel 2.1
Tabel 2.1 Rancangan formula Hand Sanitizer ekstrak teh hijau (Camelia sinensis.
L).
Komposisi Formula
F0 F1 F2 F3
Ekstrak Teh Hijau (mg/ml)
- 5 10 15
Dasar gel (gr) ad 100 100 100 100
Keterangan F = Formula
F0 = Basis gel (blanko)
F1 = Konsentrasi ekstrak teh hijau (5 mg/ml) F2 = Konsentrasi ekstrak teh hijau (10 mg/ml) F3 = Konsentrasi ekstrak teh hijau (15 mg/ml)
35 Cara pembuatan
Ekstrak teh hijau digerus didalam lumpang, lalu ditambahkan sedikit demi sedikit dasar gel kedalam lumpang sambil terus digerus sampai homogen.
3.13 Evaluasi Terhadap Sediaan 3.13.1 Pengamatan Stabilitas
Masing-masing formula sediaan dimasukkan kedalam pot plastik. Penga matan dilakukan pada saat sediaan telah selesai dimasukkan kedalam pot plastik dan diamati selama 12 minggu dengan interval pengamatan setiap minggunya.
Pengujian fisik Hand Sanitier yang telah dibuat meliputi pengamatan bau dan warna selama 12 minggu (Ditjen POM, 1985).
3.13.2 Pemeriksaan Homogenitas Sediaan
Sejumlah tertentu sediaan jika dioleskan pada sekeping kaca, sediaan harus menunjukkan susunan yang homogen dan tidak terlihat adanya butiran kasar (Ditjen POM, 1979).
3.13.3 Penentuan pH
Penentuan pH sediaan dilakukan dengan menggunakan alat pH meter
Cara : Alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar netral (pH 7,01) dan larutan dapar pH asam (pH 4,01) hingga alat menunjukkan harga pH tersebut. Kemudian elektroda dicuci dengan air suling, lalu dikeringkan dengan tissue. Sampel dibuat dalam konsentrasi 1% yaitu ditimbang 0,25 gram sediaan dan dilarutkan ad 25 ml air suling. Kemudian elektroda dicelupkan dalam larutan tersebut. Dibiarkan alat menunjukkan harga pH sampai konstan. Angka yang ditunjukkan pH meter merupakan pH sediaan (Rawlins, 2003).