MAKALAH
OKSIGEN
Diajukkan untuk memenuhi tugas mata kuliah Kimia Anorganik I Yang dibina oleh Ibu Dra. Ida Farida. M.Pd
Disusun Oleh :
Irma Rahmawati 208 204 117
Iskandar Nugraha 208 204 118
Rizky Maulana Akbar 208 204 135
Siti Fatmawati 208 204 143
Sri Rahayu 208 204 145
PENDIDIKAN KIMIA
FAKULTAS TARBIYAH DAN KEGURUAN
UIN SUNAN GUNUNG DJATI BANDUNG
| i
KATA PENGANTAR
Segala puji bagi Allah Yang Maha Adil dan Maha Bijaksana, yang telah memberikan segala nikmat dan hidayah-Nya kepada umat manusia supaya selalu dekat kepada-Nya. Shalawat beserta salam semoga tetap tercurah limpahkan kehadirat Rasulullah SAW baik kepada keluarga, sahabat maupun kepada kita selaku umatnya.
Makalah ini penulis sampaikan kepada pembina mata kuliah kimia anorganik I sebagai salah satu tugas mata kuliah tersebut. Tidak lupa kami ucapkan terima kasih kepada Ibu Dra.Ida Farida, M.Pd yang telah membimbing kami dan kepada semua pihak yang telah membantu kelancaran penulisan makalah ini.
Alhamdulillah makalah ini akhirnya dapat diselesaikan oleh kami walaupun masih banyak kekurangan baik dari segi penulisan maupun dari segi sub-materinya. Untuk itu kami memohon kritik dan saran yang bersifat membangun guna perbaikan makalah ini.
Akhirnya hanya kepada Allah jualah kita memohon perlindungan dan hanya kepada Allah-lah kita memohon ampun. Mudah-mudahan makalah ini bermanfaat bagi yang membacanya kelak. Amin.
Bandung, 10 November 2009
| ii
DAFTAR ISI
KATA PENGANTAR ...i
DAFTAR ISI ...ii
BAB I PENDAHULUAN ...1 1. Latar Belakang ...1 2. Rumusan Masalah ...2 3. Tujuan ...2 BAB II PEMBAHASAN ...3 1. Sejarah Oksigen ...3
2. Sifat dan Karakteristik Oksigen ...11
3. Pembuatan Oksigen ...19
4. Penggunaan Oksigen dalam Industri ...21
5. Senyawa-Senyawa Oksigen ...21
6. Ozon ...28
BAB III PENUTUP ...37
DAFTAR PUSTAKA ...40
| 1
BAB I PENDAHULUAN 1. LATAR BELAKANG
Oksigen adalah unsur yang sangat penting bagi kehidupan manusia. Unsur golongan VI A ini, sangat penting bagi proses pernafasan makhluk hidup. Oksigen lebih banyak berada dalam keadaan senyawanya daripada sebagai unsur bebas. Sebagai unsur bebas (O2) terdapat dalam udara, yaitu kira-kira 21%
volume udara kering.
Oksigen atau zat asam adalah unsur kimia dalam sistem tabel periodik yang mempunyai lambang O dan nomor atom 8. Ia merupakan unsur golongan kalkogen dan dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi oksida). Pada temperatur dan tekanan standar, dua atom unsur ini berikatan menjadi dioksigen, yaitu senyawa gas diatomik dengan rumus O2 yang tidak berwarna, tidak berasa, dan tidak berbau. Oksigen
merupakan unsur paling melimpah ketiga di alam semesta berdasarkan massa dan unsur paling melimpah di kerak Bumi. Gas oksigen diatomik mengisi 20,9% volume atmosfer bumi.
Semua kelompok molekul struktural yang terdapat pada organisme hidup, seperti protein, karbohidrat, dan lemak, mengandung oksigen. Demikian pula senyawa anorganik yang terdapat pada cangkang, gigi, dan tulang hewan. Oksigen dalam bentuk O2 dihasilkan dari air oleh sianobakteri, ganggang, dan
tumbuhan selama fotosintesis, dan digunakan pada respirasi sel oleh hampir semua makhluk hidup. Oksigen beracun bagi organisme anaerob, yang
| 2 merupakan bentuk kehidupan paling dominan pada masa-masa awal evolusi kehidupan. O2 kemudian mulai berakumulasi pada atomsfer sekitar 2,5 milyar
tahun yang lalu. Terdapat pula alotrop oksigen lainnya, yaitu ozon (O3). Lapisan
ozon pada atomsfer membantu melindungi biosfer dari radiasi ultraviolet, namun pada permukaan bumi ia adalah polutan yang merupakan produk samping dari asbut.
Oleh karena itu oksigen adalah salah satu unsur yang menarik untuk dibahas, karena oksigen ini dapat dengan mudah kita deskripsikan sesuai dengan kelimpahannya di alam dan mudah bereaksi dengan unsur lain.
2. RUMUSAN MASALAH
Adapun berbagai masalah yang muncul dari unsur oksigen yang akan dibahas dalam makalah ini diantaranya adalah sebagai berikut :
a. Bagaimana sejarah mengenai perkembangan oksigen? b. Bagaimana sifat-sifat dan karakteristik oksigen? c. Bagaimana cara pembuatan oksigen ?
d. Apa macam-macam senyawa oksida ? e. Apa yang dimaksud dengan ozon ?
3. TUJUAN MAKALAH
Dari rumusan masalah di atas maka dapat ditarik tujuan-tujuan pembahasan yang akan dicapai diantaranya adalah sebagai berikut :
a. Mengetahui sejarah dan perkembangan oksigen. b. Mengetahui sifat-sifat dan karaktristik oksigen c. Mengetahui berbagai cara pembuatan oksigen d. Mengetahui macam-macam senyawa oksida
| 3
BAB II PEMBAHASAN 1. SEJARAH OKSIGEN
Oksigen secara terpisah ditemukan oleh Carl Wilhelm Scheele di Uppsala pada tahun 1773 dan Joseph Priestley di Wiltshire pada tahun 1774. Temuan Priestley lebih terkenal oleh karena publikasinya merupakan yang pertama kali dicetak. Istilah oxygen diciptakan oleh Antoine Lavoisier pada tahun 1777, yang eksperimennya dengan oksigen berhasil meruntuhkan teori flogiston pembakaran dan korosi yang terkenal. Oksigen secara industri dihasilkan dengan distilasi bertingkat udara cair, dengan munggunakan zeolit untuk memisahkan karbon dioksida dan nitrogen dari udara, ataupun elektrolisis air, dll. Oksigen digunakan dalam produksi baja, plastik, dan tekstil, ia juga digunakan sebagai propelan roket, untuk terapi oksigen, dan sebagai penyokong kehidupan pada pesawat terbang, kapal selam, penerbangan luar angkasa, dan penyelaman.
a. Percobaan awal
Percobaan Philo yang menginspirasi para peneliti selanjutnya. Salah satu percobaan pertama yang menginvestigasi hubungan antara pembakaran dengan udara dilakukan oleh seorang penulis Yunani abad ke-2, Philo dari Bizantium. Dalam karyanya Pneumatica, Philo mengamati bahwa dengan membalikkan labu yang di dalamnnya terdapat lilin yang menyala dan kemudian
| 4 menutup leher labu dengan air akan mengakibatkan permukaan air yang terdapat dalam leher labu tersebut meningkat. Philo menyimpulkan bahwa sebagian udara dalam labu tersebut diubah menjadi unsur api, sehingga dapat melepaskan diri dari labu melalui pori-pori kaca. Beberapa abad kemudian, Leonardo da Vinci merancang eksperimen yang sama dan mengamati bahwa udara dikonsumsi selama pembakaran dan respirasi. Pada akhir abad ke-17, Robert Boyle membuktikan bahwa udara diperlukan dalam proses pembakaran.
Kimiawan Inggris, John Mayow, melengkapi hasil kerja Boyle dengan menunjukkan bahwa hanya sebagian komponen udara yang ia sebut sebagai spiritus nitroaereus atau nitroaereus yang diperlukan dalam pembakaran. Pada satu eksperimen, ia menemukan bahwa dengan memasukkan seekor tikus ataupun sebatang lilin ke dalam wadah penampung yang tertutup oleh permukaan air akan mengakibatkan permukaan air tersebut naik dan menggantikan seperempatbelas volume udara yang hilang. Dari percobaan ini, ia menyimpulkan bahwa nitroaereus digunakan dalam proses respirasi dan pembakaran.
Mayow mengamati bahwa berat antimon akan meningkat ketika dipanaskan. Ia menyimpulkan bahwa nitroaereus haruslah telah bergabung dengan antimon. Ia juga mengira bahwa paru-para memisahkan nitroaereus dari udara dan menghantarkannya ke dalam darah, dan panas tubuh hewan serta pergerakan otot akan mengakibatkan reaksi nitroaereus dengan zat-zat tertentu dalam tubuh. Laporan seperti ini dan pemikiran-pemikiran serta percobaan-percobaan lainnya dipublikasikan pada tahun 1668 dalam karyanya Tractatus duo pada bagian "De respiratione".
| 5
b. Teori flogiston
Stahl membantu mengembangkan dan mempopulerkan teori flogiston. Dalam percobaan Robert Hooke, Ole Borch, Mikhail Lomonosov, dan Pierre Bayen, percobaan mereka semuanya menghasilkan oksigen, namun tiada satupun dari mereka yang mengenalinya sebagai unsur. Hal ini kemungkinan besar disebabkan oleh prevalensi filosofi pembakaran dan korosi yang dikenal sebagai teori flogiston.
Teori flogiston dikemukakan oleh alkimiawan Jerman, J. J. Becher pada tahun 1667, dan dimodifikasi oleh kimiawan Georg Ernst Stahl pada tahun 1731. Teori flogiston menyatakan bahwa semua bahan yang dapat terbakar terbuat dari dua bagian komponen. Salah satunya adalah flogiston, yang dilepaskan ketika bahan tersebut dibakar, sedangkan bagian yang tersisa setelah terbakar merupakan bentuk asli materi tersebut.
Bahan-bahan yang terbakar dengan hebat dan meninggalkan sedikit residu (misalnya kayu dan batu bara), dianggap memiliki kadar flogiston yang sangat tinggi, sedangkan bahan-bahan yang tidak mudah terbakar dan berkorosi (misalnya besi), mengandung sangat sedikit flogiston. Udara tidak memiliki peranan dalam teori flogiston. Tiada eksperimen kuantitatif yang pernah dilakukan untuk menguji keabsahan teori flogiston ini, melainkan teori ini hanya didasarkan pada pengamatan bahwa
| 6 ketika sesuatu terbakar, kebanyakan objek tampaknya menjadi lebih ringan dan sepertinya kehilangan sesuatu selama proses pembakaran tersebut.
Fakta bahwa materi seperti kayu sebenarnya bertambah berat dalam proses pembakaran tertutup oleh gaya apung yang dimiliki oleh produk pembakaran yang berupa gas tersebut. Sebenarnya pun, fakta bahwa logam akan bertambah berat ketika berkarat menjadi petunjuk awal bahwa teori flogiston tidaklah benar (yang mana menurut teori flogiston, logam tersebut akan menjadi lebih ringan).
Carl Wilhelm Scheele mendahului Priestley dalam penemuan oksigen, namun publikasinya dilakukan setelah Priestley.
c. Penemuan
Oksigen pertama kali ditemukan oleh seorang ahli obat Carl Wilhelm Scheele. Ia menghasilkan gas oksigen dengan mamanaskan raksa oksida dan berbagai nitrat sekitar tahun 1772. Scheele menyebut gas ini 'udara api' karena ia murupakan satu-satunya gas yang diketahui mendukung pembakaran. Ia menuliskan pengamatannya ke dalam sebuah manuskrip yang berjudul Treatise on Air and Fire, yang kemudian ia kirimkan ke penerbitnya pada tahun 1775. Namun, dokumen ini tidak dipublikasikan sampai dengan tahun 1777. Joseph Priestley biasanya diberikan prioritas dalam penemuan oksigen
Pada saat yang sama, seorang pastor Britania, Joseph Priestley, melakukan percobaan yang memfokuskan cahaya matahari ke raksa oksida
| 7 (HgO) dalam tabung gelas pada tanggal 1 Augustus 1774. Percobaan ini menghasilkan gas yang ia namakan 'dephlogisticated air'. Ia mencatat bahwa lilin akan menyala lebih terang di dalam gas tersebut dan seekor tikus akan menjadi lebih aktif dan hidup lebih lama ketika menghirup udara tersebut.
Setelah mencoba menghirup gas itu sendiri, ia menulis: "The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards." Priestley mempublikasikan penemuannya pada tahun 1775 dalam sebuah laporan yang berjudul "An Account of Further Discoveries in Air". Laporan ini pula dimasukkan ke dalam jilid kedua bukunya yang berjudul Experiments and Observations on Different Kinds of Air. Oleh karena ia mempublikasikan penemuannya terlebih dahulu, Priestley biasanya diberikan prioritas terlebih dahulu dalam penemuan oksigen.
Seorang kimiawan Perancis, Antoine Laurent Lavoisier kemudian mengklaim bahwa ia telah menemukan zat baru secara independen. Namun, Priestley mengunjungi Lavoisier pada Oktober 1774 dan memberitahukan Lavoisier mengenai eksperimennya serta bagaimana ia menghasilkan gas baru tersebut. Scheele juga mengirimkan sebuah surat kepada Lavoisier pada 30 September 1774 yang menjelaskan penemuannya mengenai zat yang tak diketahui, tetapi Lavoisier tidak pernah mengakui menerima surat tersebut (sebuah kopian surat ini ditemukan dalam barang-barang pribadi Scheele setelah kematiannya).
| 8
d. Lavoisier
Apa yang Lavoisier tidak terbantahkan pernah lakukan (walaupun pada saat itu dipertentangkan) adalah percobaan kuantitatif pertama mengenai oksidasi yang mengantarkannya kepada penjelasan bagaimana proses pembakaran bekerja. Ia menggunakan percobaan ini beserta percobaan yang mirip lainnya untuk meruntuhkan teori flogiston dan membuktikan bahwa zat yang ditemukan oleh Priestley dan Scheele adalah unsur kimia.
Antoine Lavoisier mendiskreditkan teori flogiston. Pada satu eksperimen, Lavoisier mengamati bahwa tidak terdapat keseluruhan peningkatan berat ketika timah dan udara dipanaskan di dalam wadah tertutup. Ia mencatat bahwa udara segera masuk ke dalam wadah seketika ia membuka wadah tersebut. Hal ini mengindikasikan bahwa sebagian udara yang berada dalam wadah tersebut telah dikonsumsi. Ia juga mencatat bahwa berat timah tersebut juga telah meningkat dan jumlah peningkatan ini adalah sama beratnya dengan udara yang masuk ke dalam wadah tersebut. Percobaan ini beserta percobaan mengenai pembakaran lainnya didokumentasikan ke dalam bukunya Sur la combustion en général yang dipublikasikan pada tahun 1777.
Hasil kerjanya membuktikan bahwa udara merupakan campuran dua gas, 'udara vital', yang diperlukan dalam pembakaran dan respirasi, serta azote (Bahasa Yunani ἄζωτον "tak bernyawa"), yang tidak mendukung pembakaran maupun respirasi. Azote kemudian menjadi apa yang dinamakan sebagai
| 9 nitrogen, walaupun dalam Bahasa Perancis dan beberapa bahasa Eropa lainnya masih menggunakan nama Azote.
Lavoisier menamai ulang 'udara vital' tersebut menjadi oxygène pada tahun 1777. Nama tersebut berasal dari akar kata Yunani ὀξύς (oxys) (asam, secara harfiah "tajam") dan -γενής (-genēs) (penghasil, secara harfiah penghasil keturunan). Ia menamainya demikian karena ia percaya bahwa oksigen merupakan komponen dari semua asam. Ini tidaklah benar, namun pada saat para kimiawan menemukan kesalahan ini, nama oxygène telah digunakan secara luas dan sudah terlambat untuk menggantinya. Sebenarnya gas yang lebih tepat untuk disebut sebagai "penghasil asam" adalah hidrogen.
Oxygène kemudian diserap menjadi oxygen dalam bahasa Inggris walaupun terdapat penentangan dari ilmuwan-ilmuwan Inggris dikarenakan bahwa adalah seorang Inggris, Priestley, yang pertama kali mengisolasi serta menuliskan keterangan mengenai gas ini. Penyerapan ini secara sebagian didorong oleh sebuah puisi berjudul "Oxygen" yang memuji gas ini dalam sebuah buku populer The Botanic Garden (1791) oleh Erasmus Darwin, kakek Charles Darwin.
e. Sejarah selanjutnya
Robert H. Goddard dengan roket berbahan bakar campuran bensin dan oksigen cair rancangannya. Hipotesis atom awal John Dalton berasumsi bahwa semua unsur berupa monoatomik dan atom-atom dalam suatu senyawa akan memiliki rasio atom paling sederhana terhadap satu sama lainnya. Sebagai contoh, Dalton berasumsi bahwa rumus air adalah HO,
| 10 sehingga massa atom oksigen adalah 8 kali massa hidrogen (nilai yang sebenarnya adalah 16).
Pada tahun 1805, Joseph Louis Gay-Lussac dan Alexander von Humboldt menunjukkan bahwa air terbentuk dari dua volume hidrogen dengan satu volume oksigen; dan pada tahun 1811, berdasarkan apa yang sekarang disebut hukum Avogadro dan asumsi molekul unsur diatomik, Amedeo Avogadro memperkirakan komposisi air dengan benar.
Pada akhir abad ke-19, para ilmuwan menyadari bahwa udara dapat dicairkan dan komponen-komponennya dapat dipisahkan dengan mengkompres dan mendinginkannya. Kimiawan dan fisikawan Swiss, Raoul Pierre Pictet, menguapkan cairan sulfur dioksida untuk mencairkan karbon dioksida, yang mana pada akhirnya diuapkan untuk mendinginkan gas oksigen menjadi cairan. Ia mengirim sebuah telegram pada 22 Desember 1877 kepada Akademi Sains Prancis di Paris dan mengumumkan penemuan oksigen cairnya. Dua hari kemudian, fisikawan Perancis Louis Paul Cailletet mengumumkan metodenya untuk mencairkan oksigen molekuler.
Hanya beberapa tetes cairan yang dihasilkan sehingga tidak ada analisis berarti yang dapat dilaksanakan. Oksigen berhasil dicairkan ke dalam keadaan stabil untuk pertama kalinya pada 29 Maret 1877 oleh ilmuwan Polandia dari Universitas Jagiellonian, Zygmunt Wróblewski dan Karol Olszewski.
Pada tahun 1891, kimiawan Skotlandia James Dewar berhasil memproduksi oksigen cair dalam jumlah yang cukup banyak untuk dipelajari. Proses produksi oksigen cair secara komersial dikembangkan secara terpisah
| 11 pada tahun 1895 oleh insinyur Jerman Carl von Linde dan insinyur Britania William Hampson. Kedua insinyur tersebut menurunkan suhu udara sampai ia mencair dan kemudian mendistilasi udara cair tersebut. Pada tahun 1901, pengelasan oksiasetilena didemonstrasikan untuk pertama kalinya dengan membakar campuran asetilena dan O2 yang dimampatkan. Metode pengelasan
dan pemotongan logam ini pada akhirnya digunakan secara meluas.
Pada tahun 1923, ilmuwan Amerika Robert H. Goddard menjadi orang pertama yang mengembangkan mesin roket; mesin ini menggunakan bensin sebagai bahan bakar dan oksigen cair sebagai oksidator. Goddard berhasil menerbangkan roket kecil sejauh 56 m dengan kecepatan 97 km/jam pada 16 Maret 1926 di Auburn, Massachusetts, USA.
2. SIFAT DAN KARAKTERISTIK OKSIGEN a. Struktur
Pada temperatur dan tekanan standar, oksigen berupa gas tak berwarna dan tak berasa dengan rumus kimia O2, di mana dua atom oksigen
secara kimiawi berikatan dengan konfigurasi elektron triplet spin. Ikatan ini memiliki orde ikatan dua dan sering dijelaskan secara sederhana sebagai ikatan ganda ataupun sebagai kombinasi satu ikatan dua elektron dengan dua ikatan tiga elektron.
Oksigen triplet merupakan keadaan dasar molekul O2. Konfigurasi
elektron molekul ini memiliki dua elektron tak berpasangan yang menduduki dua orbital molekul yang berdegenerasi. Kedua orbital ini dikelompokkan sebagai
| 12 antiikat (melemahkan orde ikatan dari tiga menjadi dua), sehingga ikatan oksigen diatomik adalah lebih lemah daripada ikatan rangkap tiga nitrogen.
Dalam bentuk triplet yang normal, molekul O2 bersifat paramagnetik,
karena spin momen magnetik memiliki elektron tak berpasangan pada molekul tersebut, sehingga terjadi energi pertukaran negatif antara molekul O2 yang
bersebelahan. Oksigen cair akan tertarik kepada magnet, sedemikiannya pada percobaan laboratorium, jembatan oksigen cair akan terbentuk di antara dua kutub magnet kuat.
Oksigen singlet, adalah nama molekul oksigen O2 yang kesemuaan
spin elektronnya berpasangan. Ia lebih reaktif terhadap molekul organik pada umumnya. Konfigurasi electron dengan energy terendah dari molekul O2 yang
mengandung dua electron orbital , memberikan kenaikan ketiga keadaan, seperti diperlihatkan dibawah ini.
Keadaan Energi 1 + 155 kJ (~13.000 cm-1) 1 92 kJ (~8.000 cm-1) 3 -0 (keadaan dasar) Gambar Oksigen triplet
| 13 Molekul oksigen dalam keadaan tereksitasi singlet, khususnya keadaan 1 , yang mempunyai waktu hidup yang jauh lebih panjang daripada keadaan 1 +, bereaksi dengan berbagai substrat organic tidak jenuh menyebabkan oksidasi spesifik, terbatas, yaitu reaksi yang sangat khas berupa reaksi Diels-Alder seperti adisi 1,4- pada suatu 1,3-dien :
Secara alami, oksigen singlet umumnya dihasilkan dari air selama fotosintesis. Ia juga dihasilkan di troposfer melalui fotolisis ozon oleh sinar berpanjang gelombang pendek, dan oleh sistem kekebalan tubuh sebagai sumber oksigen aktif. Karotenoid pada organisme yang berfotosintesis (kemungkinan juga ada pada hewan) memainkan peran yang penting dalam menyerap oksigen singlet dan mengubahnya menjadi berkeadaan dasar tak tereksitasi sebelum ia menyebabkan kerusakan pada jaringan.
b. Alotrop
Alotrop oksigen elementer yang umumnya ditemukan di bumi adalah dioksigen O2. Ia memiliki panjang ikat 121 pm dan energi ikat 498 kJ·mol-1.
Alotrop oksigen ini digunakan oleh makhluk hidup dalam respirasi sel dan merupakan komponen utama atmosfer bumi.
Trioksigen (O3), dikenal sebagai ozon, merupakan alotrop oksigen
yang sangat reaktif dan dapat merusak jaringan paru-paru. Ozon diproduksi di atmosfer bumi ketika O2 bergabung dengan oksigen atomik yang dihasilkan dari
pemisahan O2 oleh radiasi ultraviolet (UV). Oleh karena ozon menyerap
| 14 gelombang UV dengan sangat kuat, lapisan ozon yang berada di atmosfer berfungsi sebagai perisai radiasi yang melindungi planet. Namun, dekat permukaan bumi, ozon merupakan polutan udara yang dibentuk dari produk sampingan pembakaran otomobil.
Molekul metastabil tetraoksigen (O4) ditemukan pada tahun 2001, dan
diasumsikan terdapat pada salah satu enam fase oksigen padat. Hal ini dibuktikan pada tahun 2006, dengan menekan O2 sampai dengan 20 GPa, dan ditemukan
struktur gerombol rombohedral O8. Gerombol ini berpotensi sebagai oksidator
yang lebih kuat daripada O2 maupun O3, dan dapat digunakan dalam bahan bakar
roket. Fase logam oksigen ditemukan pada tahun 1990 ketika oksigen padat ditekan sampai di atas 96 GPa. Ditemukan pula pada tahun 1998 bahwa pada suhu yang sangat rendah, fase ini menjadi superkonduktor.
c. Sifat Fisik
Oksigen adalah unsur ketiga terbanyak yang ditemukan berlimpah di matahari, dan memainkan peranan dalam siklus karbon-nitrogen, yakni proses yang diduga menjadi sumber energi di matahari dan bintang-bintang. Oksigen dalam kondisi tereksitasi memberikan warna merah terang dan kuning-hijau pada Aurora Borealis. Warna oksigen cair adalah biru seperti warna biru langit. Fenomena ini tidak berkaitan; warna biru langit disebabkan oleh penyebaran Rayleigh.
Oksigen lebih larut dalam air daripada nitrogen. Air mengandung sekitar satu molekul O2 untuk setiap dua molekul N2, bandingkan dengan rasio
Gambar oksigen cair
| 15 atmosferik yang sekitar 1:4. Kelarutan oksigen dalam air bergantung pada suhu. Pada suhu 0 °C, konsentrasi oksigen dalam air adalah 14,6 mg·L−1, manakala pada suhu 20 °C oksigen yang larut adalah sekitar 7,6 mg·L−1. Pada suhu 25 °C dan 1 atm udara, air tawar mengandung 6,04 mililiter (mL) oksigen per liter, manakala dalam air laut mengandung sekitar 4,95 mL per liter. Pada suhu 5 °C, kelarutannya bertambah menjadi 9,0 mL (50% lebih banyak daripada 25 °C) per liter untuk air murni dan 7,2 mL (45% lebih) per liter untuk air laut.
Oksigen mendidih pada 90,20 K (−182,95 °C, −297,31 °F), dan membeku pada 54.36 K (−218,79 °C, −361,82 °F). Baik oksigen cair dan oksigen padat berwarna biru langit. Hal ini dikarenakan oleh penyerapan panjang gelombang warna merah. Oksigen cair dengan kadar kemurnian yang tinggi biasanya didapatkan dengan distilasi bertingkat udara cair. Oksigen cair juga dapat dihasilkan dari pengembunan udara, menggunakan nitrogen cair dengan pendingin. Oksigen merupakan zat yang sangat reaktif dan harus dipisahkan dari bahan-bahan yang mudah terbakar. Pada suhu dan tekanan biasa, oksigen didapati sebagai dua atom oksigen dengan formula kimia O2.
Oksigen merupakan gas yang dibebaskan oleh tumbuhan ketika proses fotosintesis, dan diperlukan oleh hewan untuk pernafasan. Perkataan oksigen terdiri daripada dua perkataan Greek, oxus (asid) dan gennan (menghasilkan). Oksigen cair dan pepejal mempunyai warna biru lembut dan mempunyai sifat paramagnet (mudah menjadi magnet). Oksigen cair biasanya dihasilkan dengan proses perbedaan suhu dari udara cair (disejukkan sehingga menjadi cair).
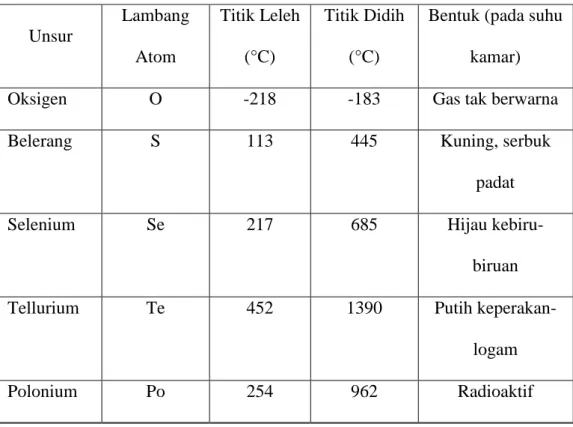
| 16 Berikut ini perbandingan sifat fisik oksigen dengan unsur-unsur segolongannya, yaitu Sulfur, Selenium, Tellurium dan Polonium.
Unsur Lambang Atom Titik Leleh (°C) Titik Didih (°C)
Bentuk (pada suhu kamar)
Oksigen O -218 -183 Gas tak berwarna
Belerang S 113 445 Kuning, serbuk
padat
Selenium Se 217 685 Hijau
kebiru-biruan
Tellurium Te 452 1390 Putih
keperakan-logam
Polonium Po 254 962 Radioaktif
d. Isotop
Oksigen yang dapat ditemukan secara alami adalah 16O, 17O, dan 18O, dengan 16O merupakan yang paling melimpah (99,762%). Isotop oksigen dapat berkisar dari yang bernomor massa 12 sampai dengan 28.
Kebanyakan 16O di disintesis pada akhir proses fusi helium pada bintang, namun ada juga beberapa yang dihasilkan pada proses pembakaran neon.
17
O utamanya dihasilkan dari pembakaran hidrogen menjadi helium semasa siklus CNO, membuatnya menjadi isotop yang paling umum pada zona pembakaran hidrogen bintang. Kebanyakan 18O diproduksi ketika 14N (berasal
| 17 dari pembakaran CNO) menangkap inti 4He, menjadikannya bentuk isotop yang paling umum di zona kaya helium bintang.
Empat belas radioisotop telah berhasil dikarakterisasi, yang paling stabil adalah 15O dengan umur paruh 122,24 detik dan 14O dengan umur paruh 70,606 detik. Isotop radioaktif sisanya memiliki umur paruh yang lebih pendek daripada 27 detik, dan mayoritas memiliki umur paruh kurang dari 83 milidetik. Modus peluruhan yang paling umum untuk isotop yang lebih ringan dari 16O adalah penangkapan elektron, menghasilkan nitrogen, sedangkan modus peluruhan yang paling umum untuk isotop yang lebih berat daripada 18O adalah peluruhan beta, menghasilkan fluorin.
e. Keberadaan
Menurut massanya, oksigen merupakan unsur kimia paling melimpah di biosfer, udara, laut, dan tanah bumi. Oksigen merupakan unsur kimia paling melimpah ketiga di alam semesta, setelah hidrogen dan helium. Sekitar 0,9% massa Matahari adalah oksigen. Oksigen mengisi sekitar 49,2% massa kerak bumi dan merupakan komponen utama dalam samudera (88,8% berdasarkan massa). Gas oksigen merupakan komponen paling umum kedua dalam atmosfer bumi, menduduki 21,0% volume dan 23,1% massa (sekitar 1015 ton) atmosfer.
Bumi memiliki ketidaklaziman pada atmosfernya dibandingkan planet-planet lainnya dalam sistem tata surya karena ia memiliki konsentrasi gas oksigen yang tinggi di atmosfernya. Bandingkan dengan Mars yang hanya memiliki 0,1% O2 berdasarkan volume dan Venus yang bahkan memiliki kadar
| 18 bumi hanya dihasilkan dari radiasi ultraviolet yang menimpa molekul-molekul beratom oksigen, misalnya karbon dioksida.
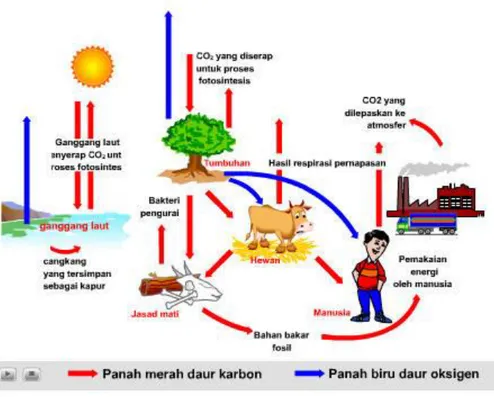
Konsentrasi gas oksigen di Bumi yang tidak lazim ini merupakan akibat dari siklus oksigen. Siklus biogeokimia ini menjelaskan pergerakan oksigen di dalam dan di antara tiga reservoir utama bumi: atmosfer, biosfer, dan litosfer. Faktor utama yang mendorong siklus oksigen ini adalah fotosintesis. Fotosintesis melepaskan oksigen ke atmosfer, manakala respirasi dan proses pembusukan menghilangkannya dari atmosfer. Dalam keadaan kesetimbangan, laju produksi dan konsumsi oksigen adalah sekitar 1/2000 keseluruhan oksigen yang ada di atmosfer setiap tahunnya.
Oksigen bebas juga terdapat dalam air sebagai larutan. Peningkatan kelarutan O2 pada temperatur yang rendah memiliki implikasi yang besar pada
| 19 Bagan Destilasi Bertingkat Udara Cair
kehidupan laut. Lautan di sekitar kutub bumi dapat menyokong kehidupan laut yang lebih banyak oleh karena kandungan oksigen yang lebih tinggi. Air yang terkena polusi dapat mengurangi jumlah O2 dalam air tersebut. Para ilmuwan
menaksir kualitas air dengan mengukur kebutuhan oksigen biologis atau jumlah O2 yang diperlukan untuk mengembalikan konsentrasi oksigen dalam air itu
seperti semula.
3. PEMBUATAN OKSIGEN
Secara komersial, oksigen diperoleh dari destilasi bertingkat udara yang dicairkan. Berikut bagan destilasi bertingkat udara cair :
Prosesnya sebagai berikut :
Mula-mula udara disaring untuk menghilangkan debu lalu dimasukkan ke dalam kompresor. Pada kompresi ini suhu udara akan naik, kenudian didinginkan dalam pendingin. Udara dingin mengembang melalui celah, dan hasilnya adalah udara yang suhunya lebih dingin, cukup untuk
| 20 Pembuatan gas oksigen dalam skala lab
menyebabkan mencair. Udara cair disaring untuk memisahkan CO2(s) dan air
yang telah membeku. Kemudian udara cair itu memasuki bagian puncak kolom dimana nitrogen, komponen yang paling mudah menguap, keluar sebagai gas. Pada pertengahan kolom, gas argon keluar dan selanjutnya oksigen cair. Komponen lain yang paling sulit menguap akan terkumpul didasar. Berturut-turut titik didih normal nitrogen, argon, dan oksigen adalah -195,8, -187,7, dan-183,0°C.
Untuk membuat gas oksigen dalam skala kecil (di laboratorium) dapat dilakukan dengan cara antara lain :
a. Memanaskan serbuk kalium kromat KClO3 dengan katalisator mangan
oksida (batu kawi), MnO2, sebagai katalis.
Reaksinya :
| 21 b. Menguraikan hydrogen peroksida H2O2 dengan MnO2 sebagai katalis :
H2O2(l) H2O(l) + O2(g)
c. Elektrolisis air yang diberi asam sulfat H2SO4
2H2O(l) H2(g) + O2(g)
d. Memanaskan barium peroksida BaO2
BaO2(s) 2BaO(s) + O2(g)
4. PENGGUNAAN OKSIGEN DALAM INDUSTRI
Sebagian besar dari produksi oksigen digunakan pada industry baja. Besi tuang yang diperoleh dari tanur tinggi (besi kasar) mengandung karbon sekitar 3 - 4 %. Kadar karbon yang terlalu tinggi itu menyebabkan besi tuang kurang kuat dan rapuh. Kadang karbon dalam besi tuang dikurangi dengan oksidasi yang terkendali.
Sebagian kecil oksigen digunakan bersama-sama dengan gas asetilen (etuna) untuk mengelas. Pembakaran gas asetilen bisa mencapai suhu 3000°C. Selain itu oksigen cair digunakan sebagai bahan bakar roket.
5. SENYAWA-SENYAWA OKSIGEN
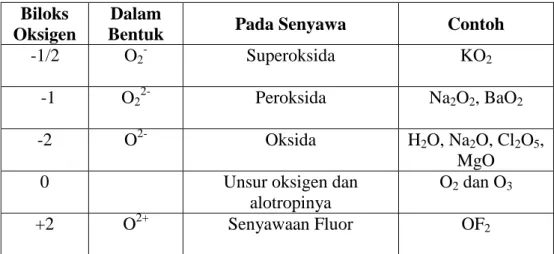
Oksigen dengan konfigurasi elektron [He] 2s2 2p4 adalah unsur yang sangat elektronegatif (skala paulling = 3,5), nomor dua terbesar seelah fluor (skala paulling = 4,1). Oleh karena itu, semua unsur bereaksi dengan oksigen membentuk senyawa oksida, kecuali gas mulia. Selain itu, juga membentuk senyawa peroksida dan superoksida. Ini dimungkinkan karena oksigen dapat mempunyai bebrapa bilangan oksidasi, dalam senyawanya, seperti pada tabel berikut ini :
| 22
Biloks Oksigen
Dalam
Bentuk Pada Senyawa Contoh
-1/2 O2- Superoksida KO2
-1 O22- Peroksida Na2O2, BaO2
-2 O2- Oksida H2O, Na2O, Cl2O5,
MgO
0 Unsur oksigen dan
alotropinya
O2 dan O3
+2 O2+ Senyawaan Fluor OF2
a. Senyawa Oksida
Oksida adalah senyawa biner suatu unsur dengan oksigen. Sebagain besar oksida diperoleh langsung dengan mereaksikan unsurnya langsung dengan oksigen.oksida biner dari unsurnya melengkapi ranah jenis ikatan mulia yang benmar-benar ionic sampai yang benar-benar kovalen. Oksida dapat diklasifikasikan ke dalam lima golongan,yaitu oksida logam, oksida nonlogam, oksida amfoter, oksida netral dan oksida campuran.
1) Oksida Logam
Oksida logam terbentuk antara unsur IA dan IIA dengan oksigen. Oksida logam alkali atau alkali tanah kurang lebih akan larut dalam air dan menunjukkan sifat basa. Natrium oksida Na2O adalah cntoh khas oksida basa.
Jadi,
Na2O(s) + H2O → 2Na+(aq) + 2OH¯(aq)
(aq) menunjukkan bahwa spesi ini ada dalam larutan dalam air. Bahkan bila oksida ini sedikit larut dalam air, oksida ini tetap basa bila bereaksi dengan air.
| 23 Semua oksida logam golongan IA bersifat mudah larut dalam air. Kelarutan ini disebabkan terjadinya reaksi hidrolisis ion oksida menjadi ion hidroksida. Sifat basa kuatnmya disebabkan oleh OH- contohnya:
K2O(S) + H2O 2KOH(aq)
Semua oksida logam IA maupun IIA bersifat sangat reaktif terhadap air, sehingga harus disimpan dalam udara kering.
Semua oksida logam IIA juga bersifat basa,kecuali BeO yang bersifat amfoter. Makin kebawah dalam satu golongan, sifat basa oksida logam IIA semakin kuat. Namun karena MgO tidak larut dalam air, sifat basanya ditunjukkan oleh kemampuannya bereaksi dengan H+ (karena bereaksi dengan asam) reaksinya:
MgO(s) + 2H+(aq) Mg2+(aq) +H2O
MgO(s) + H2O tidak larut
Semua oksida logam mempunyai titik leleh di atas 19000C yang menunjukkan sebagai senyawa ionik yang mengandung ion oksida, kecuali berilium oksida merupakan senyawa kovalen.
2) Oksida Non-Logam
Oksida ini terbentuk dari oksigen dengan unsur-unsur nonlogam seperti,nitrogen,sulfur,posfor,dan golongan ahalogen serta karbon dioksida. Sebagian besar oksida non logam bersifat asam. Kekuatan asamnya meningkat dari kiri ke kanan dalam satu periode dalam tabel periodik.
| 24 Dengan kata lain, keasaman menjadi lebih kuat dengan meningkatnya sifat non logamnya.
Contoh oksida nonlogam SO2,SO3,CO2,NO2,P2O5. Seperti pada
Sebagaimana unsur golongan 14, karbon memiliki dua oksida, CO dan CO2,
dan keasaman CO2 lemah (H2CO3 adalah asam lemah). Oksida karbon
berwujud gas tetapi oksida silikon dan unsur-unsur di bawahnya berwujud padat. SiO2 tidak larut dalam air, tetapi oksida ini bersifat asam karena
bereaksi dengan basa.
SiO2 + 2NaOH → Na2SiO3 + H2O
SO3 dan P4O10 adalah oksida asam karena oksida ini bereaksi dengan
air menghasilkan proton.
3) Oksida Amfoter
Oksida amfoter terbentuk antara oksigen dengan logam amfoter antara lain Al,Sn,Zn,Pb,Sb,Cr. Oksida ini berlaku sebagai basa terhadap asam kuat dan sebagai asam terhadap basa kuat.contoh:
ZnO + HCl ZnCl2 + H2O
ZnO + 2H+(aq) Zn2+ + H2O
4) Oksida netral (oksida inert)
Oksida netral atau inert adalah oksida yang tidak bereaksi dengan asam maupun basa. Disamping itu oksida netral juga bila dilarutkan dalam air tidak menghasilkan asam maupun basa.misalnya:N2O,CO dan MnO2. bila
| 25 adalah reaksi redoks, menhhasilkan Mn2+ dan Cl2 namun bukan reaksi asam
basa.
5) Oksida campuran
Oksida campuran terdiri dari dua macam oksida dari unsur sejenis,tapi berbeda tingkat oksidasinya,oksida ini merupakan oksida ion yang nonstoikiometri,contoh Fe3O4 merupakan campuran dari FeO dan Fe2O3. Bila
suatu unsur membentuk beberapa oksida yang biloksnya lebih tinggi bersifat asam,contohnya Cr membentuk oksida CrO bersifat basa, Cr2O3 Bersifat
amfoter dan CrO3 bersifat asam.
b. Senyawa Peroksida
Senyawa peroksida yang banyak digunakan adalah hydrogen peroksida H2O2, yaitu untuk pemutih pulp kertas, tekstil, kulit, lemak dan minyak rambut.
Dalam industry digunakan sebagai pereaksi kimia organic, polimer, obat-obatan, dan produksi makanan. Hydrogen peroksida encer digunakan dalam rumah tangga untuk antiseptic ringan dan pemutih kain.
Hidrogen peroksida murni merupakan cairan tak berwarna yang membeku pada -0,46oC dan mendidih 150,2oC. Cairannya lebih kental dari pada air dengan massa jenisnya 1,44225 g/mL (pada 25oC). molekulnya menunjukan ikatan O-O seperti yang ditunjukkan oleh struktur Lewis :
| 26 Namun strukturnya tidak planar, tetapi membentuk struktur yang disebut skew-chain. Seperti yang ditunjukan dalam gambar berikut ini :
Hidrogen peroksida mempunyai nilai pKa = 11,75, bersifat asam sangat lemah dan sebagai proton akseptor, seperti ditunjukan dalam reaksi berikut ini :
H2O2 (aq) + H3O+(aq) H2O(aq) + H3O+ (aq)
Namun demikian, hydrogen peroksida merupakan oksidator kuat dalam suasana asam maupun basa. Ini terlihat dari potensial reduksi standarnya :
H2O2 (aq) + 2H+(aq) + 2e- 2 H2O E0=+1,77 V (1)
O2(g) + 2H+(aq) + 2e- ↔ H2O2 (aq) E0=+0,69 V (2)
HO2-(aq) + H2O + 2e- ↔ 3OH-(aq) E0=+0,87 V (3)
Laju reaksi Hidrogen peroksida mudah terurai menjadi air dan oksigen setelah disimpan lama. Reaksinya, sebagai berikut:
2 H2O2 (l) → 2 H2O + O2(g) ∆H= -197 kJ/mol
Penguraian ini dipercepat oleh adanya, panas , ion logam berat, dan kotoran. Bahkan air dan oksigen yang menjadi produk penguraiannya juga mempercepat proses penguraian selanjutnya. Terbentuknya oksigen dari hasil penguraian itu dapat memicu terjadinya ledakan dan api. Oleh karena itu
| 27 hydrogen peroksida pekat harus disimpan dalam botol plastic khusus yang bagian dalamnya dilapisi lilin dan tidak boleh menggunakan botol gelas. Permukaan gelas umumnya mengandung alkali yang dapat mempercepat proses penguraian.
Peroksida yang dijual di toko obat konsentrasinya hanya 2-3%. Biasanya hidrogen peroksida yang dijual secara komersial adalah larutan encer yang berisi sedikit stabilizer, dalam botol kaca atau polietilena untuk menurunkan tingkat dekomposisi. 6% (w/v) hidrogen peroksida dapat merusak kulit, menimbulkan bisul-bisul putih yang disebabkan oleh gelembung oksigen.
Hydrogen peroksida dapat dibuat melalui berbagai metode. Untuk pembuatan di laboratorium dalam jumlah yang kecil, sering dilakukan melalui penambahan barium peroksida ke dalam larutan asam sulfat, encer dan dingin. Reaksinya sebagai berikut :
BaO2 (s) + H2SO4 (aq) → BaSO4 (s)+ H2O2 (aq)
c. Senyawa Superoksida
Senyawa superoksida Na, K, dan Rb dibuat dari peroksidanya. Contohnya sebagai berikut :
K2O2 + O2 2KO2
Dalam sistem tertutup seperti pada kapal selam, kalium superoksida digunakan untuk menghilangkan gas karbon dioksida hasil pernafasan para kru kapal selam.
Reaksinya sebagai berikut :
| 28 Reaksi diatas memungkinkan terjadinya regenerasi gas oksigen yang diperlukan untuk pernafasan.
Superoksida ionic, MO2, dibentuk oleh interaksi O2 dengan K, Rb,
atau Cs sebagai padatan Kristal kuning sampai jingga. NaO2 dapat diperoleh
hanya dengan reaksi Na2O2 dengan O2 pada 300 atm dan 500°C. LiO2 tidak dapat
diisolasi. Superoksida alkali tanah, Mg, Zn, dan Cd hanya terdapat dalam konsentrasi kecil sebagai larutan padat dalam peroksida. Ion O2- mempunyai satu
elektron tidak berpasangan. Superoksida adalah zat pengoksidasi yang sangat kuat. Mereka bereaksi kuat dengan air :
2 O2- + H2O → O2 + HO2- + OH
-2 HO2- → 2OH- + O2 (lambat)
Reaksi dengan CO2, yang melibatkan intermediet peroksokarbonat,
diguanakan untuk menghilangkan CO2 dan meregenerasi O2 dalam system
tertutup (misalnya kapal selam). Reaksi keseluruhan adalah 4MO2(s) + 2CO2(g) → 2M2CO3(s) + 3O2(g)
6. OZON
Ozon tertumpu di bawah stratosfer di antara 15 dan 30 km di atas permukaan bumi yang dikenal sebagai 'lapisan ozon'. Ozon terhasil dengan berbagai percampuran kimiawi, tetapi mekanisme utama penghasilan dan perpindahan dalam atmosfer adalah penyerapan tenaga sinar ultraviolet (UV) dari matahari.
| 29 Ozon adalah salah satu gas yang membentuk atmosfer. Molekul oksigen (O2) yang dengannya kita bernafas membentuk hampir 20% atmosfer.
Pembentukan ozon (O3), molekul triatom oksigen kurang banyak dalam atmosfer
di mana kandungannya hanya 1/3.000.000 gas atmosfer.
Ozon adalah salah satu bentuk alotropi dari oksigen. Ozon murni adalah gas berwarna biru muda dan berbau tajam ozon cair berwarna biru tua, sedangkan ozon paat berwarna ungu tua. Ozon cair mendidih pada -1800C. Ozon bersifat tidak stabil, baik daam bentuk gas, cair atau padat. Ozon cair mudah meledak.
Ozon adalah oksidator yang jauh lebih kuat daripada oksigen. Ozon mempnyai potensial redksi standar yang sangat tinggi baik dalam suasana asam maupun basa. Hal ini mennjukkan bahwa ozon merupakan oksidator yang sangat kuat.
O3 (g) + 2H+(aq) + 2e- ↔ O2(g) + H2O E0 = +2,08 V
O3 (g) + H2O + 2e- ↔ O2(g) + 2OH- E0 = +1,24 V
Dalam suasana asam, kekuatan oksidator ozon urutan kedua setelah flour, sehingga ozon seringkali digunakan sebagai oksidator untuk pembuatan senyawa. Sifat oksidator ozon ini juga dimanfaatkan untuk mensterilkan air minum, karena dapat membunuh mikroorganisme.
Reaksi utama yang menghasilkan O3(g) pada stratosfer adalah :
O2 + uv → O + O …(a)
| 30 Persamaan (a) menjelaskan penguraian ozon setelah menyerap radiasi uv. Reaksi atom dan molekul oksigen menghasilkan ozon seperti yang diuliskan pada persamaan (b). M adalah ‘spesi ketiga’ (misalnya N2 (g) ) yang diperlukan
untuk menangkap kelebihan energi tumbukkan. Adanya M sangat penting, karena ozon sangat energetic dan terurai spontan.
Ozon (O3) dihasilkan apabila O2 menyerap sinar UV pada jarak
gelombang 242 nanometer dan disingkirkan dengan fotosintesis dari sinar bagi jarak gelombang yang besar dari 290 nm. O3 juga merupakan penyerap utama
sinar UV antara 200 dan 330 nm. Penggabungan proses-proses ini efektif dalam meneruskan ketetapan bilangan ozon dalam lapisan dan penyerapan 90% sinar UV.
UV dikaitkan dengan pembentukan kanker kulit dan kerusakan genetik. Peningkatan tingkat UV juga mempunyai dampak kurang baik terhadap sistem imunisasi hewan, organisme akuatik dalam rantai makanan, tumbuhan dan tanaman. Penyerapan sinaran UV berbahaya oleh ozon stratosfer amat penting untuk semua hidupan di bumi.
a. Sifat ozon
Ozon amat mengkakis dan dipercayai sebagai bahan beracun dan bahan cemar biasa. Ozon mempunyai bau yang tajam, menusuk hidung. Ozon juga terbentuk pada kadar rendah dalam udara akibat arus listrik seperti kilat, dan oleh tenaga tinggi seperti radiasi eletromagnetik.
UV dikaitkan dengan pembentukan kanker kulit dan kerusakan genetik. Peningkatan tingkat uv juga mempunyai dampak kurang baik terhadap
| 31 sistem imunisasi hewan, organisme akuatik dalam rantai makanan, tumbuhan dan tanaman. Penyerapan sinar UV oleh ozon di stratosfer amat penting bagi kehidupan di bumi.
b. Ozon di muka bumi
Ozon di muka bumi terbentuk oleh sinar ultraviolet yang menguraikan molekul O3 membentuk unsur oksigen. Unsur oksigen ini bergabung dengan
molekul yang tidak terurai dan membentuk O3 (trioksigen). Kadangkala unsur
oksigen akan bergabung dengan N2 untuk membentuk nitrogen oksida; yang
apabila bercampur dengan cahaya mampu membentuk ozon.
c. Keseimbangan ozon
Jumlah ozon dalam atmosfer berubah menurut lokasi geografi dan musim. Ozon ditentukan dalam satuan Dobson (Du) di mana, sebagai contoh, 300 Du setara dengan 3 mm tebal lapisan ozon yang tulen jika dimampatkan ke tekanan permukaan laut. Sebagian besar ozon stratosfer dihasilkan di kawasan tropis dan diangkut ke ketinggian yang tinggi dengan skala-besar putaran atmosfer semasa musim salju hingga musim semi. Umumnya kawasan tropis memiliki ozon yang rendah.
d. Kegunaan ozon
Ozon digunakan dalam bidang pengobatan untuk mengobati pasien dengan cara terawasi dan mempunyai penggunaan yang meluas seperti di Jerman. Di antaranya ialah untuk perawatan kulit terbakar. Sedangkan dalam perindustrian, ozon digunakan untuk:
| 32 menghapuskan pencemaran dalam air (besi, arsen, hidrogen sulfida, nitrit, dan bahan organik kompleks yang dikenal sebagai warna),
membantu proses flokulasi (proses pengabungan molekul untuk membantu penapis menghilangkan besi dan arsenik),
mencuci, dan memutihkan kain (dipaten), membantu mewarnakan plastik,
menentukan ketahanan getah.
e. Ancaman dari klorofluorokarbon (CFC)
Ancaman yang diketahui terhadap keseimbangan ozon adalah kloroflorokarbon (CFC) buatan manusia yang meningkatkan kadar penipisan ozon menyebabkan kemerosotan berangsur-angsur dalam tingkat ozon global. CFC digunakan oleh masyarakat modern dengan cara yang tidak terkira banyaknya, dalam kulkas, bahan dorong dalam penyembur, pembuatan busa dan bahan pelarut terutama bagi kilang-kilang elektronik.
Masa hidup CFC berarti 1 molekul yang dibebaskan hari ini bisa ada 50 hingga 100 tahun dalam atmosfer sebelum dihapuskan. Dalam waktu kira-kira 5 tahun, CFC bergerak naik dengan perlahan ke dalam stratosfer (10 – 50 km). Di atas lapisan ozon utama, pertengahan julat ketinggian 20 – 25 km, kurang sinar UV diserap oleh ozon. Molekul CFC terurai setelah bercampur dengan UV, dan membebaskan atom klorin. Atom klorin ini juga berupaya untuk memusnahkan ozon dan menghasilkan lubang ozon. Setiap satu molekul CFC mampu menghancurkan hingga 100.000 molekul ozon. Oleh karena itu, penggunaan CFC dalam aerosol dilarang di Amerika Serikat dan negara-negara lain di dunia.
| 33 Bahan-bahan kimia lain seperti bromin halokarbon, dan juga nitrogen oksida dari pupuk, juga dapat menyerang lapisan ozon.
f. Dampak akibat penipisan ozon 1) Timbul beberapa penyakit
Menipisnya lapisan ozon dalam atmosfer bagian atas diperkirakan menjadi penyebab meningkatnya penyakit kanker kulit dan katarak pada manusia, merusak tanaman pangan tertentu, mempengaruhi plankton yang akan berakibat pada rantai makanan di laut, dan meningkatnya karbondioksida (lihat pemanasan global) akibat berkurangnya tanaman dan plankton. Sebaliknya, terlalu banyak ozon di bagian bawah atmosfer membantu terjadinya kabut campur asap, yang berkaitan dengan iritasi saluran pernapasan dan penyakit pernapasan akut bagi mereka yang menderita masalah kardiopulmoner.
2) Kemerosotan ozon global
Pengukuran latar dan satelit menunjukkan pengurangan signifikan terhadap jumlah kolom ozon pada musim dingin dan panas bagi kedua hemisfer utara dan selatan pada garis lintang tengah dan tinggi. Didapati aliran ke bawah ini pada tahun 1980 agak besar bila dibandingkan dengan tahun 1970. Tiada statistik aliran signifikan dapat ditentukan bagi kawasan tropika semasa tahun 1980. Dengan kemajuan komputer model bagi pemusnahan stratosfer ozon dapat menjelaskan pemerhatian aliran jumlah ozon di ketinggian pertengahan pada musim panas, tetapi hanya sebagian darinya pada
| 34 musin sejuk. Ini bermakna pada masa depan perubahan global ozon belum bisa diramalkan lagi.
3) Satelit
Penggunaan satelit mengelilingi kutub seperti Satelit NASA Nimbus7 yang membawa peralatan "Total Ozone Mapping Spectrometer" (TOMS) telah merevolusikan pemantauan ozon sejak 20 tahun yang lalu. Kedudukan yang baik di atas cakrawala dan kemampuan setiap satelit untuk perjalanan mendatar seluruh dunia, menyediakan liputan yang lebih baik dari stasiun darat. Ini sangat tinggi nilainya untuk menentukan aliran global. Ketepatan sensor satelit menggunakan prinsip yang sama dengan spektrofotometer Dobson.
4) Spektrofotometer Dobson
Spektrofotometer pertama diciptakan pada tahun 1920 oleh Gordon Dobson untuk mengukur jumlah ozon. Kini terdapat kurang lebih 80 jenis alat ini untuk digunakan di seluruh dunia dalam mengukur jumlah ozon. Spektrofotometer Dobson mengukur ozon dengan membandingkan jumlah penyinaran pada jarak dua UV. Satu jarak gelombang terlacak kuat dengan ozon manakala yang satu lagi tidak. Perbedaan antara jumlah dua sinar secara langsung berhubungan dengan jumlah ozon.
5) Ozon sonde
Ozon sonde adalah sel elektrokimia dan penghantar radio yang dilekatkan kepada balon yang berisi gas hidrogen yang dapat mencapai ketinggian kira-kira 35 km. Udara dimasukkan ke dalam sel kecil dengan pompa. Pelarut dalam sel bercampur dengan ozon, menghasilkan arus eletrik yang
| 35 berkadar sama dengan jumlah ozon. Isyarat dari sel diubah atas kode dan diantarkan melalui radio kepada penerima stasiun. Dari pelepasan balon hingga kegagalan, lazimnya kira-kira 35 km, sonde ini menyediakan taburan menegak ozon.
6) Tindakan dunia
Dalam tahun 1975, dikhawatirkan aktivitas manusia akan mengancam lapisan ozon. Oleh itu atas permintaan "United Nations Environment Programme" (UNEP), WMO memulai Penyelidikan Ozon Global dan Proyek Pemantauan untuk mengkoordinasi pemantauan dan penyelidikan ozon dalam jangka panjang. Semua data dari tapak pemantauan di seluruh dunia diantarkan ke Pusat Data Ozon Dunia di Toronto, Kanada, yang tersedia kepada masyarakat ilmiah internasional.
Pada tahun 1987, ditandatangani Protokol Montreal, suatu perjanjian untuk perlindungan terhadap lapisan ozon. Protokol ini kemudian diratifikasi oleh 36 negara termasuk Amerika Serikat. Pelarangan total terhadap penggunaan CFC sejak 1990 diusulkan oleh Komunitas Eropa (sekarang Uni Eropa) pada tahun 1989, yang juga disetujui oleh Presiden AS George Bush. Pada Desember 1995, lebih dari 100 negara setuju untuk secara bertahap menghentikan produksi pestisida metil bromida di negara-negara maju. Bahan ini diperkirakan dapat menyebabkan pengurangan lapisan ozon hingga 15 persen pada tahun 2000. CFC tidak diproduksi lagi di negara maju pada akhir tahun 1995 dan dihentikan secara bertahap di negara berkembang hingga tahun 2010.
| 36 Hidrofluorokarbon atau HCFC, yang lebih sedikit menyebabkan kerusakan lapisan ozon bila dibandingkan CFC, digunakan sementara sebagai pengganti CFC, hingga 2020 pada negara maju dan 2016 di negara berkembang. Untuk memonitor berkurangnya ozon secara global, pada tahun 1991, National Aeronautics and Space Administration (NASA) meluncurkan Satelit Peneliti Atmosfer. Satelit dengan berat 7 ton ini mengorbit pada ketinggian 600 km (372 mil) untuk mengukur variasi ozon pada berbagai ketinggian dan menyediakan gambaran jelas pertama tentang kimiawi atmosfer di atas.
Protokol ini memperkenalkan serangkaian kapasitas, termasuk jadwal tindakan, mengawasi produksi dan pembebasan CFC ke alam sekitar. Ini memungkinkan tingkat penggunaan dan produksi terkait CFC untuk turun ke tingkat semasa 1986 pada tahun 1989, dan pengurangan sebanyak 50% pada 1999.
| 37
BAB III PENUTUP 1. SIMPULAN
Oksigen merupakan salah satu unsur yang berada dalam keadaan bebas di alam yang berwujud gas diatomic (O2). Gas oksigen merupakan
komponen paling umum kedua dalam atmosfer bumi, menduduki 21,0% volume dan 23,1% massa (sekitar 1015 ton) atmosferOksigen dalam bentuk gas merupakan satu unsur yang sangat reaktif dan bahkan kereaktifannya melebihi hydrogen dalam bentuk gas.
Oksigen dalam system periodic menempati golongan VI bersama dengan Sulfur, Selenium, Tellurium dan Poloniu karena mempunyai electron valensi 6 pada kulit electron terluarnya. Untuk mencapai kaidah octet maka oksigen ini memerlukan pemasukan electron sebanyak 2elektron sehingga menjadi O2-. Oksigen ini gas yang tak berwarna, tetapi oksigen dalam bentuk padat dan cair berwarna biru terang. Oksigen dapat dibuat dengan memanaskan serbuk KClO3 dengan katalisator MnO2, lalu melalui penguraian
H2O2 dengan katalisator MnO2, Elektrolisis air yang diberi H2SO4,
Memanaskan BaO2. Sebagian besar oksigen digunakan pada industry baja, dan
sebagian kecil digunakan bersama gas asitilen untuk mengelas. Tetapi penggunaan terpenting dari oksigen adalah sebagai bahan pernafasan bagi manusia dan hewan.
Semua unsur dapat bereaksi dengan oksigen membentuk senyawa oksida kecuali dengan golongan gas mulia karena oksigen sendiri merupakan
| 38 unsur yang derajat keelektronegatifannya kedua terbesar setelah fluor. Selain itu juga oksigen dapat membentuk senyawa peroksida dan senyawa superoksida ini dikarenakan oksigen memiliki bilangan oksidasi yang bervariatif.
Ozon merupakan salah satu bentuk oksigen yang terdapat di atsmosfer. Ozon memiliki rumus kimia O3 dan ozon murni berwarna biru
muda. Ozon dalam bentuk pada,cair ataupun gas ini tidak stabil. Ozon merupakan oksidator yang lebih kuat daripada oksigen. Ozon digunakan dalam industry pensterilan air minum karena mampu membunuh mikroorganisme tertentu. Lapisan ozon dalam stratosfer berperan sebagai penyerap radiasi sinar ultraviolet.
2. SARAN
Telah kita ketahui bersama segala penjelasan konsep mengenai unsur oksigen baik dalam makalah ini maupun dari sumber lain dan bahkan dari pengetahuan kita. Kelimpahan oksien di bumi kita ini sangat melimpah, tentunya kelimpahan ini semakin lama akan semakin berkurang kuantitasnya. Apa yang terjadi ? ya bumi ini dari hari ke hari semakin panas contohnya saja di perkotaan yang padat penduduk dan terdapat berbagai pencemaran ini menandakan kadar oksigen yang menipis dan semakin banyaknya kadar gas CO2, orang-orang sering menyebutnya sebagai gejala pemanasan global.
Berbagai macam factor dan alasan penyebabnya bermunculan tetapi tak ada perubahan yang berarti. Dulu kita dapat merasakan pagi hari yang sangat dingin dan sejuk sekali,tetapi hanya karena ulah dari
| 39 tangan manusia yang tak berilmu dan berakhlak semuanya terjadi. Lapisan ozon semakin menipis, bumi semakin panas dan tidak dapat dibantah lagi kalau terjadi hal yang lebih parah lagi yaitu kehidupan akan mulai menyusut.
Tuhan telah memberi kita nikmat yang begitu luar biasa, kita dapat bernafas, oksigen melimpah dan dapat terlindung dari sinar UV matahari, dan sebagai manusia yang beriman dan berilmu mulai dari sekarang mari kita tanamkan gaya hidup alami yang segala sesuatunya menghormati ala mini, karena alam sewaktu-waktu adalah teman kita sekaligus musuh kita semuanya tergantung dari bagaimana kita berinterasi dengannya. STOP GLOBAL WARMING !
| 40
DAFTAR PUSTAKA
Achmad, Hiskia. 1992. KIMIA UNSUR DAN RADIOKIMIA. Bandung : PT. Citra Aditya Bakti.
Cotton, F.Albert dan Geoffrey Wilkinson. 2007. KIMIA ANORGANIK DASAR. Jakarta : Penerbit Universitas Indonesia.
Dra. Ida Farida. M.Pd. 2009. Modul Perkuliahan KIMIA ANORGANIK I. Bandung : Pendidikam Kimia Fakultas Tarbiyah dan Keguruan UIN Sunan Gunung Djati Bandung.
http://id.wikipedia.org/wiki/Oksigen
http://www.chem-is-try.org/tabel_periodik/oksigen/ http://www.e-smartschool.com
http://www.bawanacamp.co.cc/
| iii
LAMPIRAN
1. Bagaimana ion oksida jika bereaksi dengan logam magnesium? Apakah Mg(OH)2 ada atau tidak?
o Semua oksida logam IIA juga bersifat basa, kecuali BeO yang bersifat amfoter. Makin kebawah dalam satu golongan, sifat basa oksida logam IIA semakin kuat. Namun karena MgO tidak larut dalam air, sifat basanya ditunjukkan oleh kemampuannya bereaksi dengan H+ (karena bereaksi dengan asam) reaksinya:
MgO(s) + 2H+(aq) Mg2+(aq) +H2O o MgO(s) + H2O tidak larut
Karena itu Mg(OH)2 berasal dari Mg bukan MgO, jika magnesium yang kita lihat masih berwarna hitam,berarti itu adalah MgO artinya magnesium yang sudah bereaksi dengan oksigen.
Mg (s) + O2 (g) → MgO (S)
Oleh karena itu kita harus menghampelasnya terlebih dahulu. Mg(OH)2 berasal
dari reaksi antara Mg dan H2O, tetapi agar dapat bereaksi Mg harus
dibakar terlebih dahulu.
Mg (s) + H2O (l) → Mg(OH)2 (l)
2. Bagaimana unsur oksigen terbentuk di atmosfer?
o Konsentrasi gas oksigen di atmosfer ini merupakan akibat dari siklus oksigen. Siklus biogeokimia ini menjelaskan pergerakan oksigen di dalam dan di antara tiga reservoir utama bumi: atmosfer, biosfer, dan litosfer. Faktor utama yang mendorong siklus oksigen ini adalah fotosintesis. Fotosintesis melepaskan oksigen ke atmosfer, manakala respirasi dan proses pembusukan menghilangkannya dari atmosfer.
| iv 3. Jika di Laboratorium tangan kita terkena senyawa peroksida, bagaimana
reaksi yang terjadi ?
o Jika tangan kita terkena senyawa peroksida (yang sering kita gunakan adalah H2O2), tangan kita akan memerah, terasa perih dan infeksi. Hal ini
disebabkan karena laju reaksi hidrogen peroksida mudah terurai menjadi air dan oksigen setelah disimpan lama. Penguraian ini dipercepat oleh adanya, panas , ion logam berat, dan kotoran. Bahkan air dan oksigen yang menjadi produk penguraiannya juga mempercepat proses penguraian selanjutnya. Terbentuknya oksigen dari hasil penguraian itu dapat memicu terjadinya ledakan dan api. Oleh karena itu hydrogen peroksida pekat harus disimpan dalam botol plastic khusus yang bagian dalamnya dilapisi lilin dan tidak boleh menggunakan botol gelas.
4. Terbuat dari apakah tabung oksigen yang biasa ada di Rumah Sakit?
o Terbuat dari besi yang dilapisi dengan logam yang sukar bereaksi, yaitu dengan logam mulia, yang biasa dipakai adalah logam tembaga (Cu), karena oksigen sangat mudah bereaksi, sehingga dibutuhkan logam yang sukar bereaksi agar oksigen yang berada di dalam tabung tidak bereaksi dengan logam itu.